牡丹(Paeonia suffruticosa Andr.)是毛茛科(Paeoniaceae)芍药属(Paeonia)牡丹组(section Moutan DC)的多年生木本花卉,其种类繁多,花型颜色各异,有“花中之王”与“国花”美誉[1]。牡丹除可作为观赏植物之外,还具有很高的食用价值,可用于制酒、面点辅料、焙烤食品、泡茶,如牡丹花营养酒、牡丹花鲜花饼、牡丹花茶等[2-4]。研究表明,牡丹花除了含有丰富的碳水化合物、蛋白质、脂肪、矿物质元素和维生素外,还含有多种人体所需的游离氨基酸,且含量较高,是一种极具营养价值的食品资源[5]。
牡丹中含有丰富的黄酮、酚类物质等生物活性成分,具有抗氧化、降血脂、抗炎、抑菌等功能活性。陈庆敏等[6]以牡丹雄蕊为材料,研究发现70%(体积分数)的甲醇提取物具有良好DPPH自由基清除能力,其主要酚类成分为没食子酸、芦丁、槲皮素;关宁宁[7]研究表明,高含量的牡丹花蕊醇提物具有很强的还原力和·OH清除能力,且对糖尿病小鼠的血糖指数有显著改善作用;董振兴等[8]研究表明,牡丹籽油可显著降低高脂血症大鼠的血脂水平,同时具有降低糖尿病小鼠血糖、改善正常小鼠糖耐量的作用。随着社会的发展,人们的生活水平显著提高,抗氧化、降血脂等功能食品也越来越引起重视。牡丹在抗氧化、降血脂等方面有较好的作用,对其活性成分进行开发利用,可拓展功能性食品种类,具有良好的市场开发前景。
海黄(Paeonia suffruticosa ‘Hai Huang’)是观赏牡丹的一个品种,孙泽飞[9]研究表明,海黄牡丹花瓣含有丰富的多酚成分,其含量仅次于紫红色花系,且有较高的抗氧化活性。目前,关于海黄牡丹的研究大多集中在栽培育种[10]、品种间差异比较[11]、远缘杂交鉴定[12]等方面,而对于海黄牡丹的活性成分研究较少,且对海黄牡丹不同部位的活性研究未见报道。因此,本研究以海黄牡丹的4个部位(花瓣、花萼、雌蕊、雄蕊)为研究对象,对其功能活性和化学组成进行研究,从而为提高海黄牡丹的利用水平、拓展新型功能食品种类提供参考。
1 材料与方法
1.1 试验材料
海黄牡丹:于2021年4月8日采集自云南省玉溪市梁王山种植资源收集圃(东经102°53′55″,北纬24°45′38″,海拔2 733 m),并置于4 ℃冰箱中保存备用。
CH3OH、NaNO2、Al(NO3)3、FeCl3、CH3COOH、CH3COONa、Na2SO3、抗坏血酸(维生素C)、2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、对硝基苯基-β-D-吡喃半乳糖苷(p-nitrophenyl-β-D-galactopyranoside,pNPG)、DPPH、ABTS、阿卡波糖等均为分析纯,国药集团化学试剂有限公司;2, 4, 6-三(2-吡啶基)三嗪(2, 4, 6-tripyridin-2-yl-1, 3, 5-triazine,TPTZ),上海阿拉丁生化科技股份有限公司;芦丁(纯度≥98%)、没食子酸(纯度≥99%)、木犀草素(纯度≥98%)、异鼠李素(纯度≥98%)、芹菜素(纯度≥98%)、对香豆酸(纯度≥98%)、表儿茶素没食子酸酯(纯度≥98%),上海源叶生物科技有限公司;α-淀粉酶、α-葡萄糖苷酶,均为分析纯,北京索莱宝科技有限公司。
1.2 仪器与设备
GZX-9240MB电热鼓风干燥箱,上海博迅实业有限公司;200T高速多功能粉碎机,永康市铂欧五金制品有限公司;FVYANG超声波清洗机,深圳福洋科技集团有限公司;S1010E离心机,Hitachi Koki公司;N-1200B旋转蒸发仪,上海泉杰仪器有限公司;AX224ZH电子天平,奥豪斯仪器有限公司;FD304箱式真空冷冻干燥机,济南骏德仪器有限公司;1260 Infinity II高效液相色谱仪,Agilent Technologies;TECAN infinite 200 PRO多功能酶标仪,上海迪奥生物科技有限公司。
1.2 试验方法
1.2.1 样品的制备
将海黄牡丹的花瓣、花萼、雌蕊、雄蕊这4个部位分别剥离,置于50 ℃恒温箱中烘干至恒重。将其粉碎后过60目筛。准确称取4个部位的粉末各10 g,按料液比1∶25(g∶mL)的比例加入体积分数为70%的甲醇溶液(含体积分数为1%的甲酸),避光过夜,超声波提取1 h后,4 000 r/min离心15 min,收集滤液,滤渣再加入体积分数为70%的甲醇溶液(含体积分数为1%的甲酸)超声波提取,离心,重复提取2次,合并滤液,抽滤2次。用旋转蒸发仪50 ℃条件下真空旋干,样品冷冻干燥后置于4 ℃冰箱备用。
1.2.2 总酚含量的测定
参考THAVAMONEY等[13]的方法测定总酚含量。在室温下,取20 μL没食子酸或合适质量浓度的样品加入到96孔酶标板,加入20 μL 0.5 mol/L福林酚溶液,混合5 min后,加入160 μL 0.075 g/mL的Na2CO3溶液,对照组此时加入同体积的蒸馏水,避光反应25 min,然后在765 nm下测定吸光度Ai,在相同条件下测定10、20、30、40、50、60 μg/mL的没食子酸吸光度,以没食子酸质量浓度为横坐标,以吸光值Ai为纵坐标,绘制标准曲线,得到标准方程Y=0.006 6X-0.005 5(R2=0.994),其中X为质量浓度,Y为吸光值。所有试验重复3次,计算总酚含量,以没食子酸当量表示(mgGAE/g)。
1.2.3 总黄酮含量测定
参考HUANG等[14]的方法测定总黄酮含量。在室温条件下,取40 μL芦丁或稀释到合适质量浓度的样品加入96孔酶标板,然后加入20 μL 0.03 g/mL的NaNO2溶液,室温下放置6 min后加入20 μL 0.06 g/mL的Al(NO3)3溶液,室温下反应6 min后加入140 μL 0.04 g/mL的NaOH溶液和60 μL体积分数为70%甲醇溶液,放置15 min后在510 nm下测定吸光度。其中,对照组分别在上述步骤中加入同体积的70%(体积分数)甲醇溶液代替NaNO2溶液和Al(NO3)3溶液。在相同条件下测定0.1、0.2、0.4、0.5、0.6、0.8、1.0 mg/mL的芦丁吸光度,以芦丁质量浓度(X)为横坐标,以吸光值(Y)为纵坐标,绘制标准曲线,得到标准方程Y=0.000 8X+0.033 9(R2=0.991)。所有试验重复3次,计算总黄酮含量,以芦丁当量表示(mg RT/g)。
1.2.4 高效液相色谱分析
海黄牡丹4个部位的滤液各取2 mL通过针头过滤器(0.45 μm)过滤后进行HPLC分析。色谱柱:Eclipse plus C18 column(4.6 mm×150 mm,5 μm);洗脱剂:乙腈(C)和体积分数为0.1%的甲酸水溶液(D);检测波长280 nm;流速0.8 mL/min;柱温35 ℃;进样量10 μL;紫外吸收扫描波长范围为200~600 nm。其中,洗脱梯度为:0~5 min,5%~5% C;5~10 min,5%~10% C;10~20 min,10%~10% C;20~40 min,10%~20% C;40~80 min,20%~30% C。
标准品溶液制备和测定:精确称取木犀草素、异鼠李素、芹菜素、对香豆酸、表儿茶素没食子酸酯标准品,用色谱甲醇配制成0.1 mg/mL的混合标准品储备液。分别吸取上述标准品溶液1、5、10、15、20 μL,注入高效液相色谱仪中,以峰面积(Y)对其进样量(X)进行线性回归,并根据标准曲线方程进行该物质的定量定性分析。其各种标准品的回归方程分别为:异鼠李素Y=67.261X+13.301(R2=0.997);木犀草素Y=407.73X-26.306(R2=1.000);芹菜素Y=288.25X-20.415(R2=1.000);对香豆酸Y=551.57X-15.99(R2=1.000);表儿茶素没食子酸酯Y=143.7X+115.57(R2=0.984)。
1.2.5 DPPH自由基清除能力
参考陈蓬凤等[15]的方法,在室温条件下,取100 μL标准品和用体积分数为70%甲醇溶液稀释到合适质量浓度的样品加入96孔酶标板,加入100 μL 0.15 mmol/L DPPH溶液充分混合,在室温下避光反应30 min后在517 nm处测定其吸光度值(As),以体积分数为70%的甲醇溶液代替样品的反应为空白(Ac),以体积分数为70%的甲醇溶液代替DPPH溶液的反应为样品空白(Ab),采用两倍稀释法进行实验,以维生素C和BHT为阳性对照,所有试验重复3次,按公式(1)计算样品中DPPH自由基清除率。
清除率![]()
(1)
采用Origin 2018软件计算样品清除DPPH自由基的半抑制浓度(half maximal inhibitory concentration,IC50)/(μg/mL),结果用IC50值表示。
1.2.6 ABTS阳离子自由基清除能力
参考SAREGA等[16]的方法,称取38.4 mg ABTS和6.623 mg K2S2O8混合,蒸馏水溶解后并定容至10 mL配成ABTS母液。室温避光反应12~16 h后用PBS稀释ABTS母液至734 nm波长处吸光度为0.70±0.02左右。在室温条件下,取50 μL标准品和用体积分数70%甲醇稀释到合适浓度的样品加入96孔酶标板,加入200 μL ABTS溶液充分混合,在室温下避光反应6 min后在734 nm处测定其吸光值(As);以体积分数为70%的甲醇溶液代替样品的反应为空白(Ac);以体积分数为70%的甲醇溶液代替ABTS溶液的反应为样品空白(Ab),采用两倍稀释法,以维生素C和BHT为阳性对照,所有试验重复3次,按公式(1)计算样品 ABTS阳离子自由基清除率,结果用IC50值表示。
1.2.7 铁还原能力
参考龚宇等[17]的方法,并适当修改。按照体积比10∶1∶1的比例将30 mmol/L CH3COONa缓冲液(pH 3.6)、10 mmol/L TPTZ溶液和20 mmol/L FeCl3溶液混合配制铁离子还原力(ferric reducing ability of plasma,FRAP)溶液。在室温条件下,取30 μL标准品和用体积分数70%甲醇稀释到合适质量浓度的样品加入96孔酶标板,然后加入240 μL FRAP溶液,充分混合,在37 ℃避光反应10 min后在593 nm处测定吸光度值(As)。以体积分数为70%的甲醇溶液代替样品的反应为空白(Ac),以体积分数为70%的甲醇溶液代替FRAP溶液的反应为样品空白(Ab),以维生素C和BHT为阳性对照。以不同质量浓度(0~100 μg/mL)的FeSO4溶液作为标准品绘制标准曲线,得到标准方程Y=0.006 6X-0.005 5(R2=0.999),其中X为质量浓度,Y为吸光值。所有试验重复3次,以此计算样品的FeSO4水溶液的当量,表示样品的铁还原能力。
1.2.8 α-葡萄糖苷酶抑制能力的测定
参考WANG等[18]的方法,在室温条件下,取50 μL标准品和用体积分数70%甲醇稀释到合适质量浓度的样品加入96孔酶标板,加入25 μL α-葡萄糖苷酶溶液,将酶标板置于托盘内于水浴锅中进行37 ℃恒温反应10 min后,加入50 μL pNPG溶液充分混匀,继续反应15 min后加入100 μL Na2CO3溶液终止反应。立即在405 nm下测定吸光值(As),以体积分数70%的甲醇溶液代替样品的反应为空白(Ac),以体积分数为70%的甲醇溶液代替α-葡萄糖苷酶溶液的反应为样品空白(Ab),采用两倍稀释法进行实验,以阿卡波糖为阳性对照,所有试验重复3次,按公式(2)计算样品中α-葡萄糖苷酶抑制能力:
抑制率![]()
(2)
1.2.9 α-淀粉酶抑制能力
参考张兆远等[19]的方法,称取2.1 g NaOH和18.2 g酒石酸钾钠溶于蒸馏水中,然后加入0.63 g DNS于45 ℃加热溶解,冷却后加入0.5 g苯酚和0.5 g Na2SO3,完全溶解后用蒸馏水定容至100 mL,配制DNS溶液。用20 μmol/L,pH 6.9 PBS稀释α-淀粉酶至540 nm波长处吸光度为0.9~1.0。取20 μL用体积分数70%甲醇稀释到合适质量浓度的样品加入96孔酶标板,然后加入20 μL α-淀粉酶溶液,25 ℃反应10 min后,加入100 μL 2.5 mg/mL糊化后的淀粉溶液充分混匀,继续反应10 min,加入20 μL DNS溶液,将酶标板置于托盘内于水浴锅中进行沸水浴10 min,冷却至室温,最后加入110 μL蒸馏水,在540 nm下测定吸光度值,以阿卡波糖为对照,所有试验重复3次,结果用抑制率表示。按公式(2)计算样品α-淀粉酶抑制能力。
1.3 数据处理
所有实验均重复3次,结果以平均值±标准偏差表示。采用SPSS 26.0统计软件进行数据分析,采用Origin 2018 绘图软件绘图。P<0.05则认为样品间具有显著性差异。
2 结果与分析
2.1 海黄牡丹不同部位的成分分析
2.1.1 总酚、总黄酮分析
研究表明,海黄牡丹中含有丰富的总酚、黄酮类等活性物质,具有抗氧化、抗菌等多种生物活性作用[20]。由表1可知,海黄牡丹中的总酚、总黄酮含量以及提取物得率在4个不同部位间存在显著性差异(P<0.05)。4个不同部位提取物的总酚含量依次为雌蕊>花萼>花瓣>雄蕊,总黄酮含量依次为雌蕊>花萼>花瓣>雄蕊。结果显示,两者含量在不同部位的变化趋势相同,且总酚含量明显高于总黄酮含量,这与苗永美等[21]研究石豆兰中总酚、总黄酮含量的结果相一致。
表1 海黄牡丹不同部位提取物中总酚和总黄酮含量
Table 1 Contents of total phenols and flavonoids in extracts from different parts of peony Hai Huang
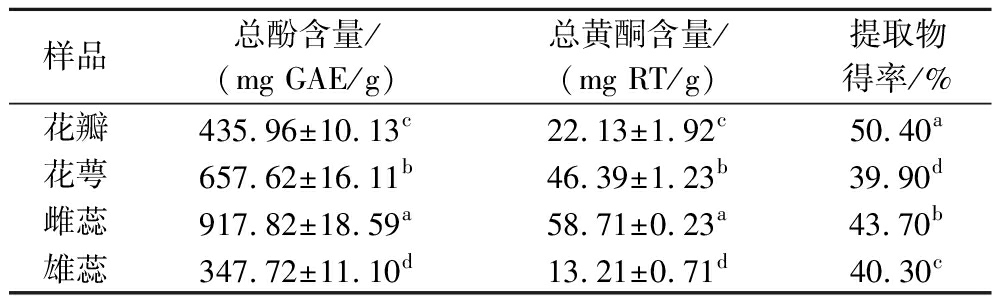
样品总酚含量/(mg GAE/g)总黄酮含量/(mg RT/g)提取物得率/%花瓣435.96±10.13c22.13±1.92c50.40a花萼657.62±16.11b46.39±1.23b39.90d雌蕊917.82±18.59a58.71±0.23a43.70b雄蕊347.72±11.10d13.21±0.71d40.30c
注:同列不同小写字母表示差异显著(P<0.05)(下同)。
2.1.2 HPLC分析
牡丹花作为新食品原料,营养丰富,富含多酚黄酮类活性物质,具有显著的生理活性,广泛应用于食品、饮料及化工行业[22]。研究表明,牡丹花中主要含有木犀草素、异鼠李素、芹菜素、对香豆酸和表儿茶素没食子酸酯等活性成分[23-24],故以其为代表性物质对海黄牡丹不同部位的活性成分分布进行检测。标准物质和海黄牡丹的HPLC图如图1所示。混合标准对照物被完全分开,无重叠现象,可用于海黄牡丹不同部位提取物中的化合物检测。

a-对照品;b-花瓣;c-花萼;d-雌蕊;e-雄蕊
图1 海黄牡丹4个部位HPLC图(280 nm)
Fig.1 HPLC chromatogram of four parts of peony Hai Huang (280 nm)
如表2所示,同一化合物含量在不同部位的差异显著(P<0.05);在定量的5个多酚化合物中,花瓣部位检测到全部5种多酚,种类最多,雄蕊部位芹菜素和异鼠李素含量最高(P<0.05)。在海黄牡丹检测出的这些化合物中,木犀草素、芹菜素属于黄酮类,异鼠李素属于黄酮醇类,表儿茶素没食子酸酯属于黄烷醇,对香豆酸属于简单酚类,这些物质均具有一定的抗氧化、抗炎、降血脂、保护心血管等生物活性[25-26]。
表2 海黄牡丹4个部位提取物中5种多酚成分含量
Table 2 Contents of five polyphenols in extracts from four parts of peony Hai Huang
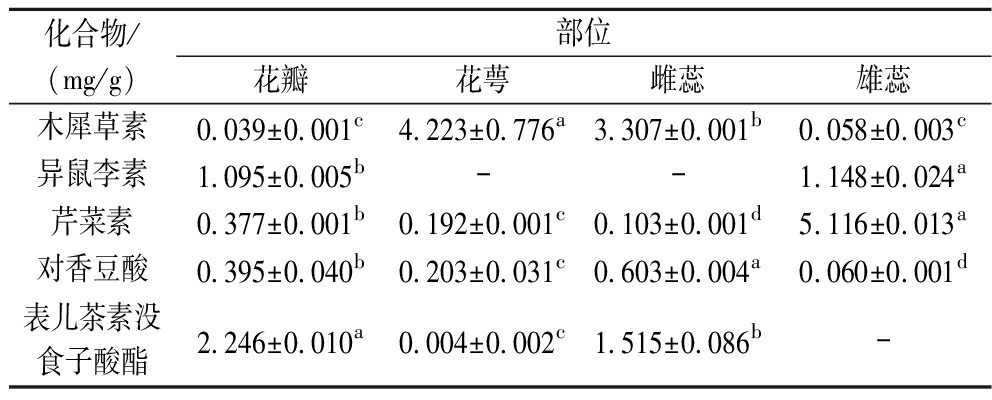
化合物/(mg/g) 部位 花瓣花萼雌蕊雄蕊木犀草素0.039±0.001c4.223±0.776a3.307±0.001b0.058±0.003c异鼠李素1.095±0.005b--1.148±0.024a芹菜素0.377±0.001b0.192±0.001c0.103±0.001d5.116±0.013a对香豆酸0.395±0.040b0.203±0.031c0.603±0.004a0.060±0.001d表儿茶素没食子酸酯2.246±0.010a0.004±0.002c1.515±0.086b-
注:— 表示未检测到。
2.2 海黄牡丹不同部位的抗氧化活性
2.2.1 DPPH自由基清除能力
DPPH自由基是一种很稳定以氮为中心的自由基,可用于反映样品抗氧化能力强弱[27]。如图2-a所示,样品质量浓度为0~500 μg/mL时,不同部位的提取物均具有一定的DPPH自由基清除能力,且DPPH自由基清除能力均随样品质量浓度的递增而增加。由图2-b可知,各部位清除DPPH自由基的IC50值依次为维生素C(16.38 μg/mL)>花萼(27.87 μg/mL)>BHT(32.96 μg/mL)>花瓣(44.97 μg/mL)>雌蕊(74.83 μg/mL)>雄蕊(152.92 μg/mL),说明海黄牡丹的花萼部位具有最强的DPPH自由基清除能力,与维生素C较为接近,高于BHT,且强于其他部位。这可能与表2中花萼含有高含量的木犀草素有关,郑必胜等[28]研究表明,金银花中的绿原酸、木犀草苷、木犀草素3种活性成分中,木犀草素的抗氧化能力最强。单恬恬等[29]的研究也发现,香辛料提取物中黄酮、多酚含量与其抗氧化活性具有一定的相关性,而DPPH自由基清除能力与黄酮含量最为相关。
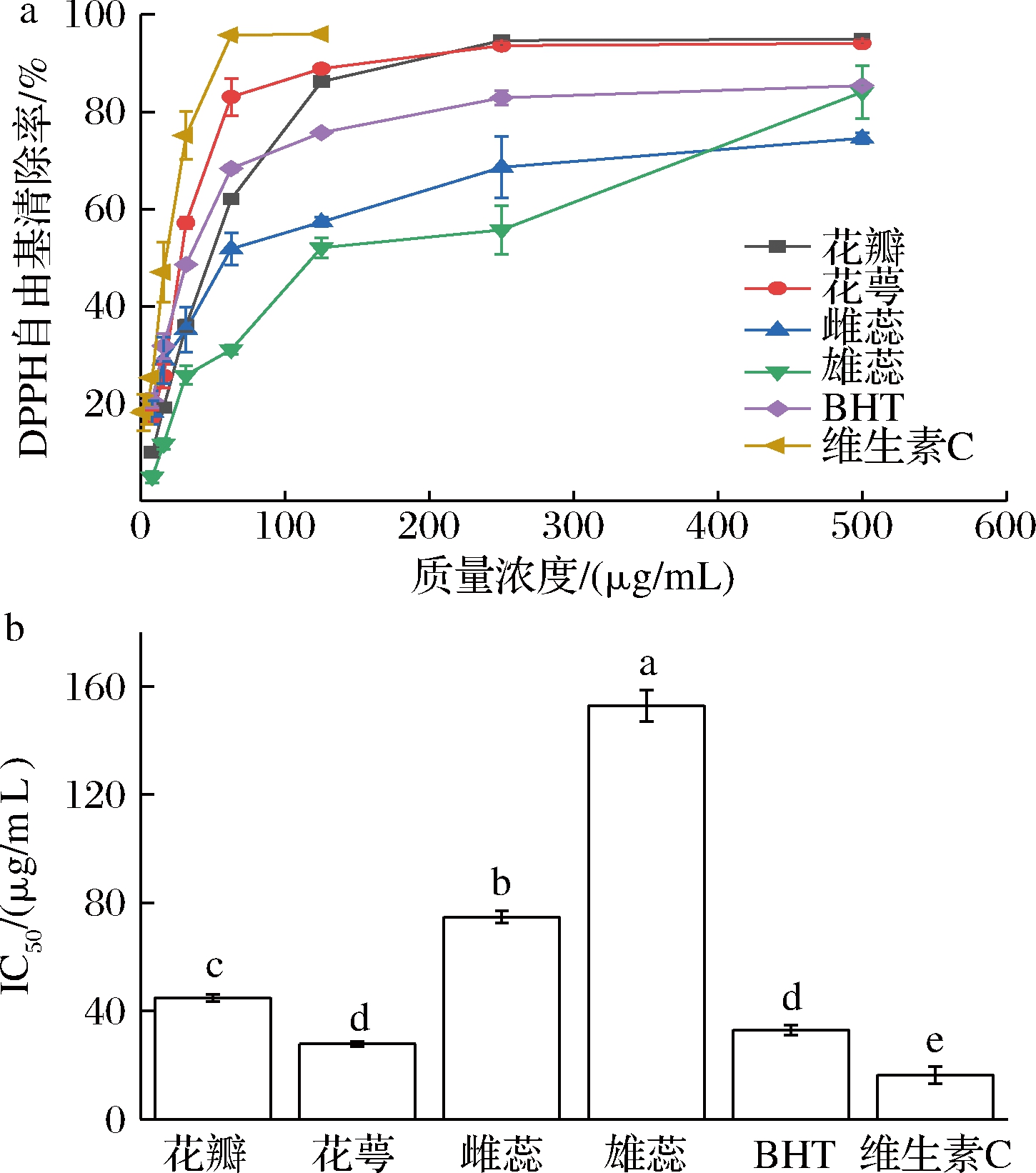
a-DPPH自由基清除率;b-IC50值
图2 海黄牡丹4个部位对DPPH自由基清除率
Fig.2 DPPH radical scavenging rate of four parts of peony Hai Huang
2.2.2 ABTS阳离子自由基清除能力
由图3-a可知,在样品质量浓度范围(0~500 μg/mL)内,海黄牡丹的4个部位对ABTS阳离子自由基的清除率随样品质量浓度的增大而增大,且当清除能力低于80%时,样品的ABTS阳离子自由基清除能力表现出明显的量效关系。由图3-b可知,各组分清除ABTS阳离子自由基能力的IC50值依次为维生素C(21.40 μg/mL)>BHT(36.37 μg/mL)>花萼(74.44 μg/mL)>雄蕊(82.42 μg/mL)>雌蕊(102.48 μg/mL)>花瓣(152.35 μg/mL)。结果显示,各醇提取物均具有一定的ABTS阳离子自由基清除能力,其中花萼部位提取物能力最强,但与阳性对照维生素C和BHT比较仍有一定差距。因此可考虑将其开发为一种安全的天然可食用抗氧化剂。
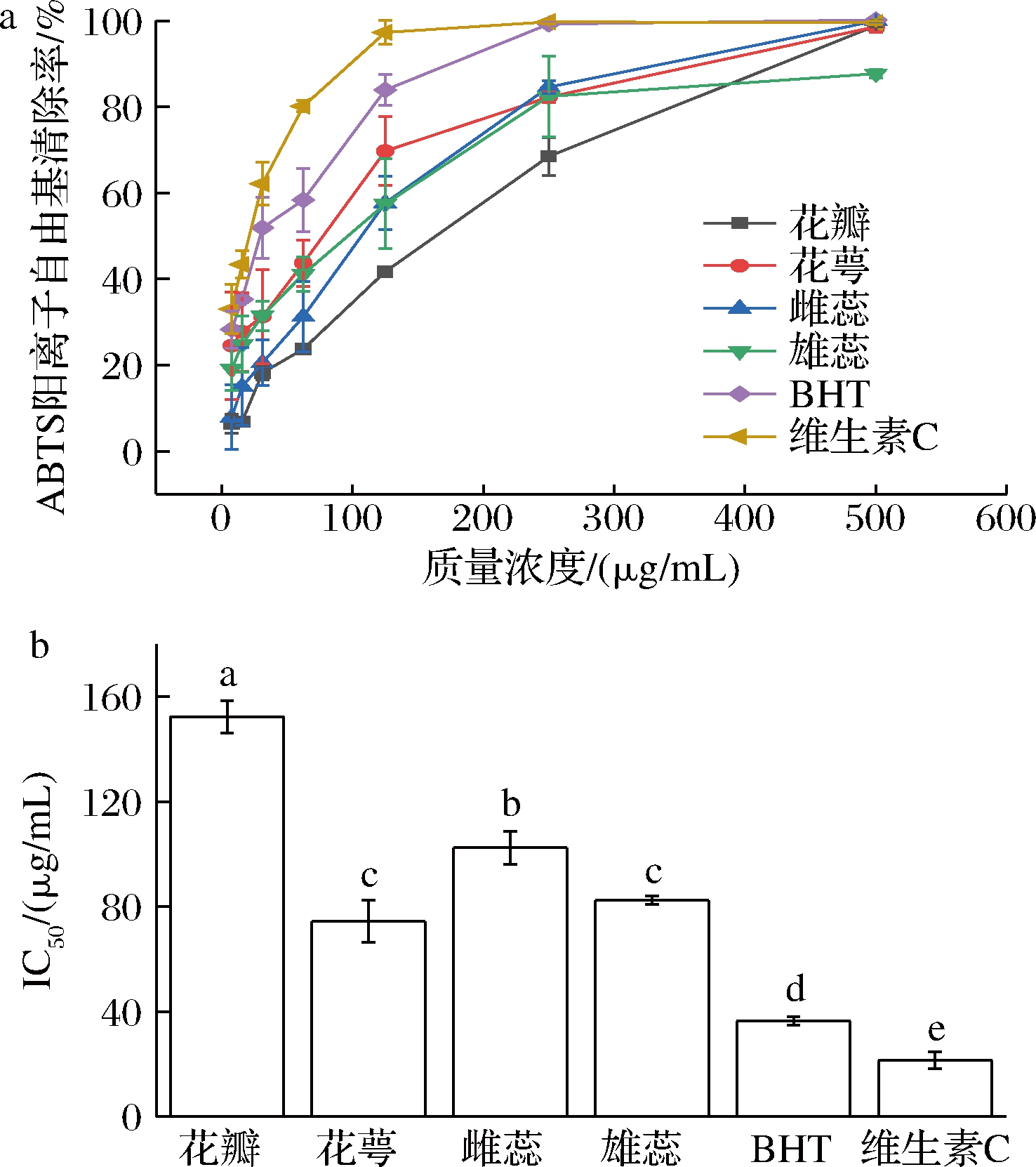
a-ABTS阳离子自由基清除率;b-IC50值
图3 海黄牡丹4个部位对ABTS阳离子自由基清除率
Fig.3 ABTS cation radical scavenging rate of four parts of peony Hai Huang
2.2.3 铁还原能力
样品溶液中的还原剂在酸性环境下,会将TPTZ与Fe3+的复合物还原成Fe2+而呈明显的蓝色,在波长593 nm处有最大吸收,其值越大,则表示样品的铁还原能力越强。由图4可知,海黄牡丹不同部位提取物的铁还原能力依次为雌蕊(691.46 mg FeSO4/g)>花萼(504.41 mg FeSO4/g)>雄蕊(321.41 mg FeSO4/g)>花瓣(318.53 mg FeSO4/g)。4个部位均表现出一定的铁还原能力,但均弱于维生素C和BHT。其中,雌蕊部位醇提取物的铁还原力最强(P<0.05),花萼部位的醇提取物次之,这与DPPH自由基、ABTS阳离子自由基清除能力的结果不同的原因是,雌蕊含有高含量的木犀草素、表儿茶素没食子酸酯,使其还原能力增加。
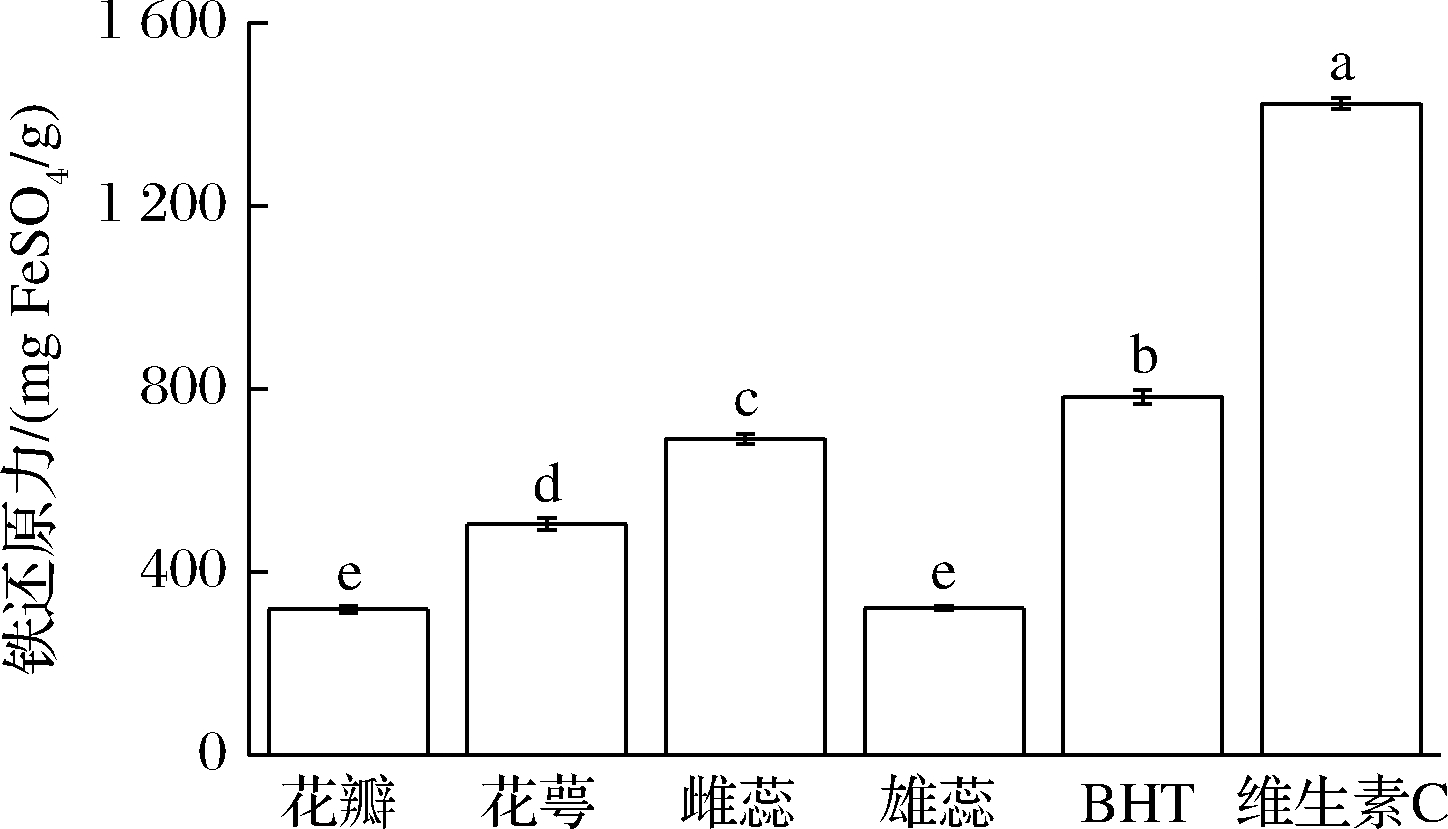
图4 海黄牡丹4个部位的总还原能力
Fig.4 Total reduction capacity of four parts of peony Hai Huang
2.3 海黄牡丹不同部位的酶抑制能力分析
2.3.1 α-葡萄糖苷酶抑制活性
α-葡萄糖苷酶将低聚糖或二糖水解为可吸收的单糖,从而促进人体对碳水化合物的吸收。当其活性被抑制时,能有效降低人体对碳水化合物的消化速率,从而达到降低人体餐后、空腹血糖的目的[30],因此寻找天然高效、无毒副作用的α-葡萄糖苷酶抑制剂一直是糖尿病学上的研究课题。由图5可知,海黄牡丹4个部位的醇提取物均具有α-葡萄糖苷酶抑制活性,且在一定质量浓度范围(0~500 μg/mL)内,α-葡萄糖苷酶抑制率随样品质量浓度的增大而增强,呈现一定的量效关系。当样品质量浓度达到500 μg/mL时,花瓣对α-葡萄糖苷酶的抑制活性最强,但低于阳性对照阿卡波糖,而花萼、雌蕊和雄蕊3个部位差别不明显。花瓣部位的醇提取物对α-淀粉酶的抑制效果虽弱于阿卡波糖,但强于其他药用部位,其原因可能是花瓣含有较丰富的表儿茶素没食子酸酯,具有较好的降血糖能力[31]。同时,SONG等[32]的研究也表明,黄色牡丹花瓣提取物具有最强的α-葡萄糖苷酶的抑制能力。该结果为海黄花瓣作为α-葡萄糖苷酶抑制剂资源和降血糖功能食品的开发提供了科学依据,但具体成分和作用机制需要进一步研究。
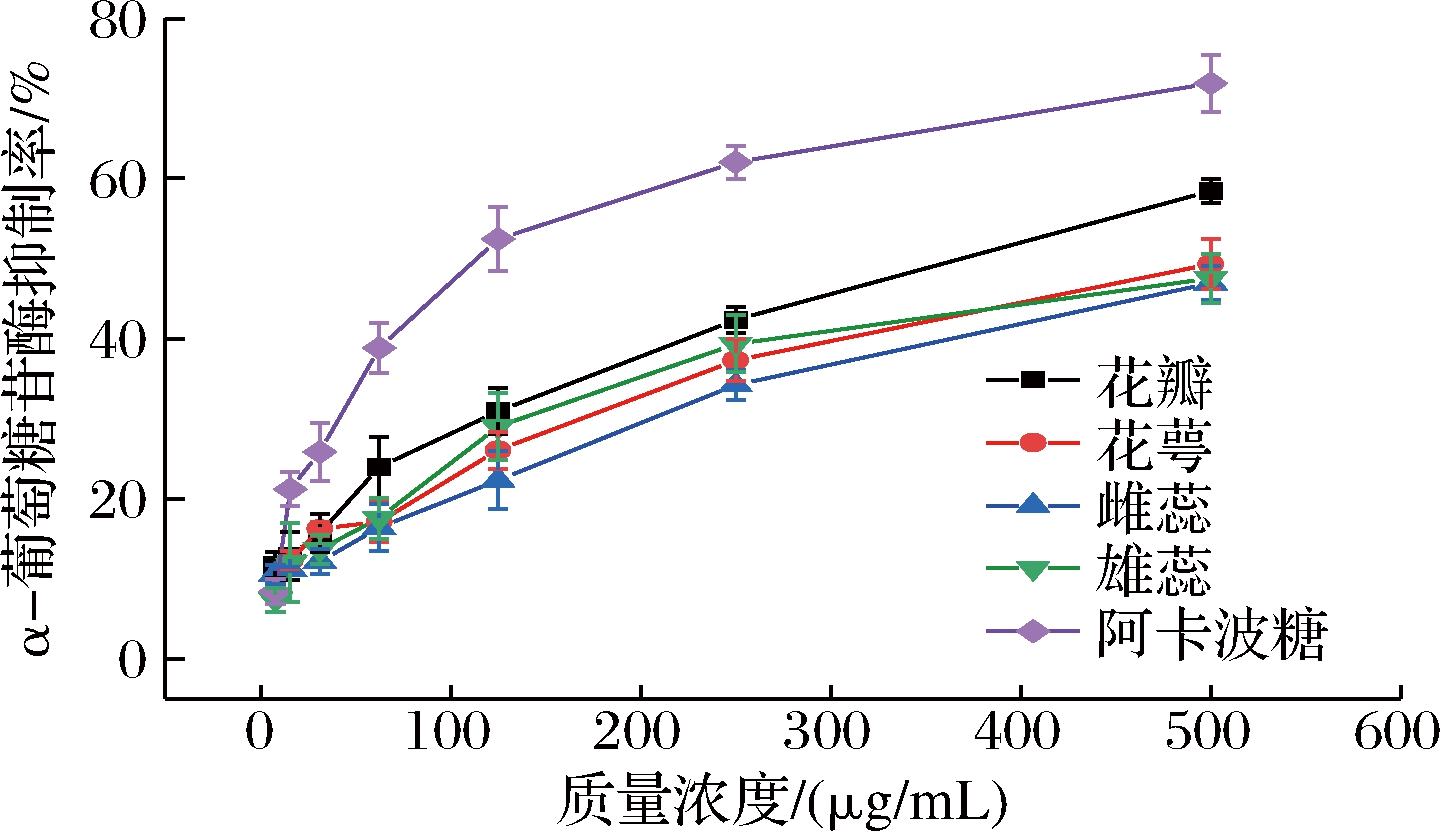
图5 海黄牡丹4个部位对α-葡萄糖苷酶的抑制效果
Fig.5 α-Glucosidase inhibition ability of four parts of peony Hai Huang
2.3.2 α-淀粉酶抑制活性
抑制α-淀粉酶的活性能有效阻止食物中碳水化合物在机体内的消化和水解,从而减少糖分的摄入,控制血糖升高。王俊朋等[33]研究表明,牡丹花黄酮对α-淀粉酶活性具有显著抑制作用,在开发降血糖药物或功能性食品方面具有很大的潜力。由图6可知,海黄牡丹4个部位的醇提取物具有较好的α-淀粉酶抑制活性,花萼、雌蕊、雄蕊对α-淀粉酶的抑制作用强于阳性对照阿卡波糖,且在实验质量浓度范围(15.62~156.25 μg/mL)内,雄蕊对于α-淀粉酶的抑制作用较好,花瓣的抑制作用最差。雄蕊的醇提取物对α-淀粉酶的抑制效果强于其他药用部位,其原因可能与表2中雄蕊含有较高的芹菜素(黄酮类)有关。LI等[34]研究表明芹菜素可通过调节PI3K/Akt信号通路来降低细胞黏附分子的表达, 从而缓解内皮细胞中由免疫细胞渗透增强及炎症级联反应引发的心血管疾病,具有降血糖作用。WANG等[35]的研究结果表明,芹菜素可以减轻链脲佐菌素诱导的胰岛β细胞的氧化损伤,并可能成为治疗糖尿病的新药物。
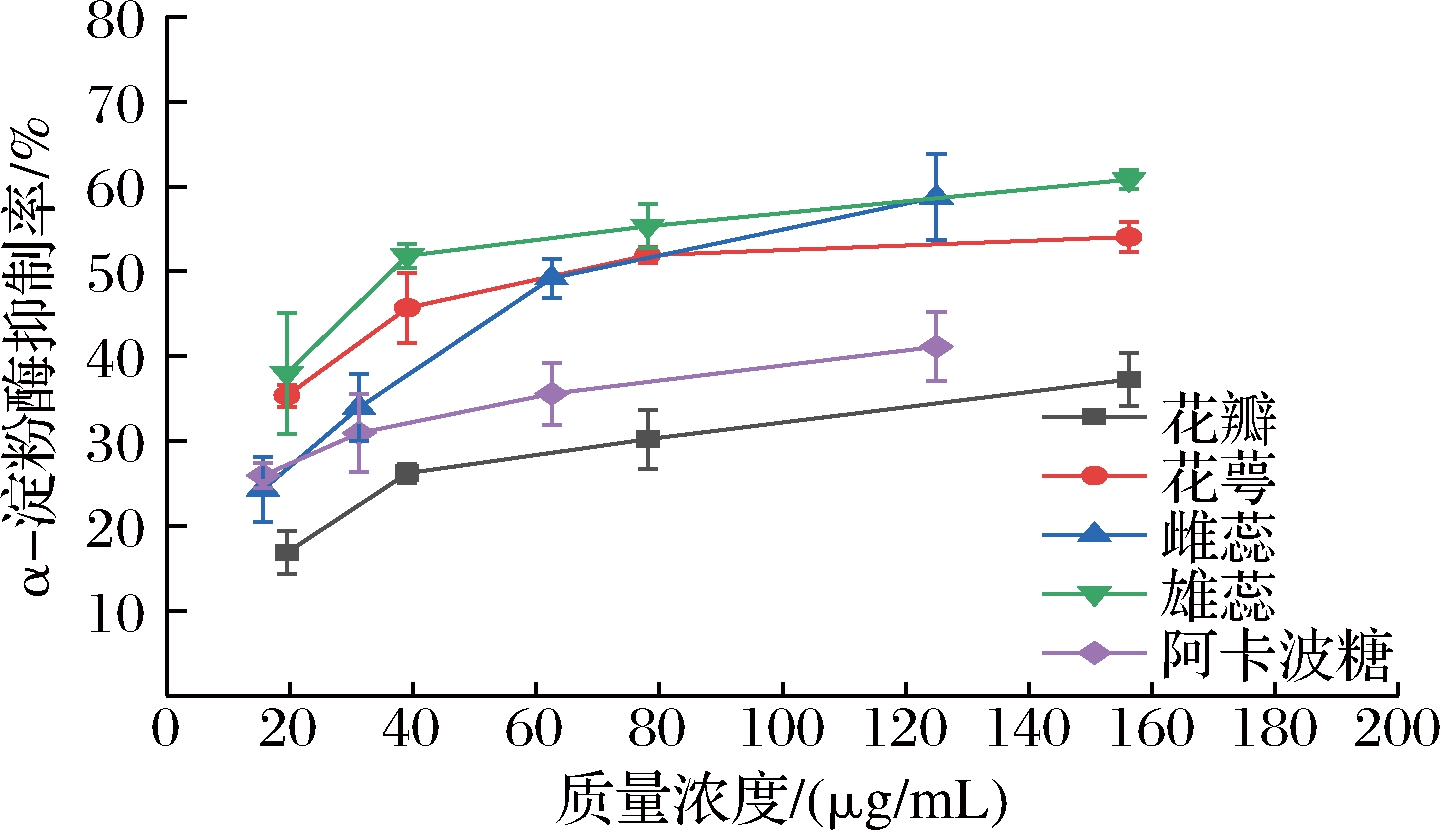
图6 海黄牡丹4个部位对α-淀粉酶的抑制效果
Fig.6 α-Amylase inhibition ability of four parts of peony Hai Huang
3 结论
本研究对海黄牡丹花瓣、花萼、雌蕊、雄蕊部位提取物中的总酚、总黄酮含量及其活性物质分布情况进行了检测,并比较了其抗氧化活性以及对α-葡萄糖苷酶和α-淀粉酶的抑制能力。结果表明,雌蕊、花萼提取物中的总酚和总黄酮含量显著高于其他2个部位,花萼部位有较强的DPPH和ABTS阳离子自由基清除能力,其IC50值分别为44.97和74.44 μg/mL,雌蕊部位的铁还原能力最强,其值为691.46 mg FeSO4/g。HPLC结果显示,同一化合物成分含量在不同部位差异显著,花瓣部位检测到的多酚种类最多,雄蕊部位芹菜素和异鼠李素含量最高(P<0.05)。花瓣对α-葡萄糖苷酶有较好的抑制作用,而雄蕊则对α-淀粉酶的抑制能力最强,强于阳性对照阿卡波糖。研究表明,花萼、雌蕊部位可作为天然抗氧化剂资源进行开发利用,同时花瓣与雄蕊对治疗糖尿病具有一定的潜力。后续可进一步进行有效活性成分与药用价值之间的关系分析,为海黄牡丹资源的综合利用提供新思路。
[1] 徐开蒙, 叶倩, 胡谦, 等.两种牡丹果荚化学组成与冷热水抽提物GC/MS对比研究[J].林产工业, 2021, 58(1):43-47.
XU K M, YE Q, HU Q, et al.Comparison of chemical composition for two kinds of pod biomass and their cold and hot water extractives by GC/MS[J].China Forest Products Industry, 2021, 58(1):43-47.
[2] 李霞. 牡丹的食用价值[J].现代园艺, 2013(15):107.
LI X.Edible value of peony[J].Contemporary Horticulture, 2013(15):107.
[3] 揭晓, 成仿云.牡丹花茶制作工艺研究[J].食品工业科技, 2017, 38(12):239-242.
JIE X, CHENG F Y.Study on processing technology of tree peony tea[J].Science and Technology of Food Industry, 2017, 38(12):239-242.
[4] 孙静, 姜宇, 陶俊.牡丹与芍药的食用研究进展[J].江苏农业科学, 2018, 46(11):10-14.
SUN J, JIANG Y, TAO J.Research progress on edible peony and peony[J].Jiangsu Agricultural Sciences, 2018, 46(11):10-14.
[5] 李雨欣, 李捷, 谢艳华, 等.牡丹花瓣冻干粉极细粉细胞破壁率的测定及营养成分分析[J].西北大学学报(自然科学版), 2022, 52(1):84-89.
LI Y X, LI J, XIE Y H, et al.Determination of wall breaking rate of very fine powder cells of freeze-dried peony petals and analysis of nutritional components[J].Journal of Northwest University (Natural Science Edition), 2022, 52(1):84-89.
[6] 陈庆敏, 闫琰, 程媛媛, 等.牡丹雄蕊的抗氧化活性及酚类成分分析[J].食品科技, 2017, 42(4):198-200.
CHEN Q M, YAN Y, CHENG Y Y, et al.Antioxidant activity and phenolic compounds of peony stamens[J].Food Science and Technology, 2017, 42(4):198-200.
[7] 关宁宁. 牡丹花蕊醇提物的生物活性研究[D].洛阳:河南科技大学, 2019.
GUAN N N.Study on biological activity of alcohol extract from peony stamens[D].Luoyang:Henan University of Science and Technology, 2019.
[8] 董振兴, 彭代银, 宣自华, 等.牡丹籽油降血脂、降血糖作用的实验研究[J].安徽医药, 2013, 17(8):1286-1289.
DONG Z X, PENG D Y, XUAN Z H, et al.Experimental study on hypolipidemic and hypoglycemic effects of peony seed oil[J].Anhui Medical and Pharmaceutical Journal, 2013, 17(8):1286-1289.
[9] 孙泽飞. 牡丹花类黄酮成分及抗氧化能力分析[D].杨凌:西北农林科技大学, 2015.
SUN Z F.Analysis of flavonoids and antioxidant capacity of peony flowers[D].Yangling:Northwest A &F University, 2015.
[10] 王占营, 冀含乐, 王晓晖, 等.容器胁迫下洛阳牡丹开花习性及生长规律研究[J].安徽农业科学, 2019, 47(12):51-53.
WANG Z Y, JI H L, WANG X H, et al.Study on flowering habits and growth rules of Luoyang peony under container stress[J].Journal of Anhui Agricultural Sciences, 2019, 47(12):51-53.
[11] 苏宝来, 孙泽飞, 张延龙, 等.11种牡丹花瓣多酚成分及抗氧化能力分析[C].中国观赏园艺研究进展.成都:中国林业出版社, 2017:42-48.
SU B L, SUN Z F, ZHANG Y L, et al.Analysis of polyphenol composition and antioxidant activity in petals of 11 tree peony cultivars[C].Research progress of ornamental horticulture in China.Chengdu:China Forestry Press, 2017:42-48.
[12] 律春燕. 黄牡丹野生种与牡丹、芍药栽培品种远缘杂交研究[D].北京:中国林业科学研究院, 2010.
LYU C Y.Study on distant hybridization between wild species of Paeonia suffruticosa and cultivated varieties of Paeonia suffruticosa[D].Beijing:Chinese Academy of Forestry, 2010.
[13] THAVAMONEY N, SIVANADIAN L, TEE L, et al.Extraction and recovery of phytochemical components and antioxidative properties in fruit parts of Dacryodes rostrata influenced by different solvents[J].Journal of Food Science and Technology, 2018, 55(7):2523-2532.
[14] HUANG R, WU W Y, SHEN S Y, et al.Evaluation of colorimetric methods for quantification of citrus flavonoids to avoid misuse[J].Analytical Methods, 2018, 10(22):2575-2587.
[15] 陈蓬凤, 梅新, 黄师荣, 等.不同品种薯尖的总酚、总黄酮含量及抗氧化活性比较[J].现代食品科技, 2021, 37(3):132-138;15.
CHEN P F, MEI X, HUANG S R, et al.Comparison of the total phenolics, total flavonoids and antioxidant activities in potato tips of different varieties[J].Modern Food Science and Technology, 2021, 37(3):132-138;15.
[16] SAREGA N, IMAM M U, OOI D J, et al.Phenolic rich extract from Clinacanthus nutans attenuates hyperlipidemia-associated oxidative stress in rats[J].Oxidative Medicine and Cellular Longevity, 2016, 2016:1-16.
[17] 龚宇, 罗伟, 周蕙祯, 等.大叶锣的酚性成分及其体外抗氧化活性研究[J].天然产物研究与开发, 2020, 32(3):420-426.
GONG Y, LUO W, ZHOU H Z, et al.Study on phenolic constituents and antioxidant activity of Didissandra sesquifolia C.B.Clarke[J].Natural Product Research and Development, 2020, 32(3):420-426.
[18] WANG Z X, TU Z C, XIE X, et al.Perilla frutescens leaf extract and fractions:Polyphenol composition, antioxidant, enzymes (α-glucosidase, acetylcholinesterase, and tyrosinase) inhibitory, anticancer, and antidiabetic activities[J].Foods, 2021, 10(2):315.
[19] 张兆远, 阮洪生.金荞麦根茎乙醇提取物抗氧化和对α-葡萄糖苷酶、α-淀粉酶的抑制作用[J].中药药理与临床, 2017, 33(2):102-106.
ZHANG Z Y, RUAN H S.Study the in vitro antioxidant and α-glucosidase, α-amylase inhibitory activities of extracts of Fagopyri dibotryis rhizoma[J].Pharmacology and Clinics of Chinese Materia Medica, 2017, 33(2):102-106.
[20] 王洪新, 吴颖, 寇兴然, 等.牡丹中黄酮类化合物的研究进展[J].食品与机械, 2017, 33(7):194-199.
WANG H X, WU Y, KOU X R, et al.Research progress of peony(Paeonia suffruticosa Andr.)flavonoids[J].Food &Machinery, 2017, 33(7):194-199.
[21] 苗永美, 简兴, 汪雁, 等.广东石豆兰不同溶剂提取物抗氧化及与总黄酮、总酚含量的关系[J].核农学报, 2020, 34(5):1038-1046.
MIAO Y M, JIAN X, WANG Y, et al.Antioxidant activities and their relationship with contents of total flavonoids and total phenols of various solvent extracts from Bublophyllum kwangtungense[J].Journal of Nuclear Agricultural Sciences, 2020, 34(5):1038-1046.
[22] 狄飞达, 张勃龙, 刘一静, 等.牡丹花食药成分及加工研究进展[J].农产品加工, 2020(12):88-89;92.
DI F D, ZHANG B L, LIU Y J, et al.Research progress on food and drug composition and processing of peony flowers[J].Farm Products Processing, 2020(12):88-89;92.
[23] 史倩倩. 基于转录组测序滇牡丹花色形成分子调控机理研究[D].北京:中国林业科学研究院, 2015.
SHI Q Q.Study on molecular regulation mechanism of flower color formation of Paeonia suffruticosa based on transcriptome sequencing[D].Beijing:Chinese Academy of Forestry, 2015.
[24] 周琳, 王雁, 律春燕, 等.云南野生黄牡丹花色素成分的鉴定[J].东北林业大学学报, 2011, 39(8):52-54.
ZHOU L, WANG Y, LYU C Y, et al.Identification of components of flower pigments in petals of Paeonia lutea wild population in Yunnan[J].Journal of Northeast Forestry University, 2011, 39(8):52-54.
[25] 张燕, 熊波, 易娜, 等.黄烷醇类化合物的药理活性研究进展[J].食品安全质量检测学报, 2015, 6(3):1055-1060.
ZHANG Y, XIONG B, YI N, et al.Advances in research on pharmacological activities of flavanol compounds[J].Journal of Food Safety &Quality, 2015, 6(3):1055-1060.
[26] 曹纬国, 刘志勤, 邵云, 等.黄酮类化合物药理作用的研究进展[J].西北植物学报, 2003, 23(12):2241-2247.
CAO W G, LIU Z Q, SHAO Y, et al.A progress in pharmacological research of flavonoids[J].Acta Botanica Boreali-Occidentalia Sinica, 2003, 23(12):2241-2247.
[27] 丁林玲, 谢颖欣, 高伟, 等.三叶木通果肉提取物的体外抗氧化及抑制α-葡萄糖苷酶和乙酰胆碱酯酶能力[J].南方农业学报, 2021, 52(4):1058-1065.
DING L L, XIE Y X, GAO W, et al.In vitro antioxidant activities, α-glucosidase and acetylcholinesterase inhibition ability of Akebia trifoliata pulp extracts[J].Journal of Southern Agriculture, 2021, 52(4):1058-1065.
[28] 郑必胜, 李会娜.金银花叶有效成分的抗氧化活性研究[J].现代食品科技, 2013, 29(12):2870-2876.
ZHENG B S, LI H N.Antioxidant activity constituents of Lonicera japonica leaves[J].Modern Food Science and Technology, 2013, 29(12):2870-2876.
[29] 单恬恬, 代钰, 徐筱莹, 等.14种香辛料提取物的多酚、黄酮含量及抗氧化活性比较研究[J].中国调味品, 2019, 44(4):80-83;88.
SHAN T T, DAI Y, XU X Y, et al.Comparative study on polyphenols, flavonoids and antioxidant activities of 14 spices’ extracts[J].China Condiment, 2019, 44(4):80-83;88.
[30] 张露, 刘鹏飞, 涂宗财, 等.香榧不同部位提取物的抗氧化和酶抑制活性比较分析[J].食品科学, 2018, 39(10):78-83.
ZHANG L, LIU P F, TU Z C, et al.Comparison of antioxidant activity and enzyme inhibitory activity of different plant parts of Torreya grandis cv.Merrillii[J].Food Science, 2018, 39(10):78-83.
[31] 苏建辉, 张玉, 刘成祥, 等.牡丹籽油及植物提取物的降血糖降血脂活性[J].食品与生物技术学报, 2018, 37(7):739-746.
SU J H, ZHANG Y, LIU C X, et al.Antidiabetic and hypolipidemic activity of plant extracts including peony seed oil[J].Journal of Food Science and Biotechnology, 2018, 37(7):739-746.
[32] SONG J, ZHANG H B, WANG Z X, et al.The antioxidant activity, α-glucosidase and acetylcholinesterase inhibition activity, and chemical composition of Paeonia delavayi petal[J].Food Quality and Safety, 2022, 6:1-12.
[33] 王俊朋, 张立攀, 胡桂芳, 等.牡丹花黄酮的提取及对α-淀粉酶的抑制作用[J].食品科技, 2022, 47(1):196-202.
WANG J P, ZHANG L P, HU G F, et al.Extraction and effect on inhibition of α-amylase of flavonoids from peony flower[J].Food Science and Technology, 2022, 47(1):196-202.
[34] LI C K, LEI Y P, YAO H T, et al.Chrysanthemum morifolium Ramat.reduces the oxidized LDL-induced expression of intercellular adhesion molecule-1 and E-selectin in human umbilical vein endothelial cells[J].Journal of Ethnopharmacology, 2010, 128(1):213-220.
[35] WANG N, YI W J, TAN L, et al.Apigenin attenuates streptozotocin-induced pancreatic β cell damage by its protective effects on cellular antioxidant defense[J].In Vitro Cellular &Developmental Biology - Animal, 2017, 53(6):554-563.