鲢鱼作为一种被广泛养殖的淡水鱼类,2021年产量已达到381.29万t[1],而鲢鱼由于肉薄刺多、土腥味重等特点,通常被加工成鱼糜制品[2]。在鱼糜加工中,会产生大量的鱼皮、鱼骨等副产物,其中含有丰富的胶原蛋白,含量约占粗蛋白的80%左右[3]。目前,对鲢鱼副产物的高值化利用主要是在提取胶原蛋白(明胶)的基础上采用酶解法制备各种胶原活性肽。胶原蛋白经不同的蛋白酶水解后会得到具有抗氧化[2]、促钙吸收[4]、抗皮肤老化、抗血小板聚集[5]等多种活性的胶原肽,从而开发成不同用途的功能性食品。但是在实际生产中发现胶原酶解物往往带有感官难以接受的腥味,主要是来源于原料中脂质氧化产生的挥发性醛类、酮类、酯类等物质[6];同时在酶解过程中会产生大量肽、氨基酸及呈味核苷酸等[7],其中疏水性氨基酸和低分子苦味肽[8]也会使胶原肽溶液带有一定的苦味。这些不良气味和滋味限制了胶原肽在食品工业中的应用。
目前研究人员尝试了活性炭吸附[9]、β-环糊精包埋[10]、有机溶剂提取[11]、大孔树脂吸附[12]等许多方法用于脱除多肽产品的不良风味。然而,一些活性肽可能会因此产生损失从而造成生物活性的下降。陈轩[13]发现活性炭对鲢鱼抗氧化肽有较好的脱腥效果,但脱腥后抗氧化活性下降25.38%;胡凌豪[14]采用大孔树脂吸附法对凤尾鱼蛋白肽脱腥,脱腥前后促嗜热链球菌增殖活性无显著性差异,同时发现也有一定的脱色效果。总的来说,针对不同的活性肽应该选择不同的脱腥方式以期减少活性的损失。本文前期研究发现鲢鱼皮胶原肽(silver carp skin collagen peptides, SCP)具有良好的抗血小板活性,但是带有难以接受的腥味和一定程度的苦味,限制了其在功能食品中的应用。因此本文对SCP脱腥和脱苦的品质提升技术,以及对抗血小板活性的影响进行重点研究。
1 材料与方法
1.1 材料与试剂
鲢鱼皮明胶(食品级),上海即景生物科技有限公司;复合蛋白酶(1.5 AU/g,食品级),丹麦诺维信公司;SD大鼠(雄性,8周龄,280~300 g),北京维通利华实验动物技术有限公司;二磷酸腺苷(adenosine diphosphate,ADP)、福林酚试剂,北京索莱宝公司;戊巴比妥钠、色谱级乙腈、异硫氰酸苯酯(phenyl isothiocyanate,PITC)、三乙胺,美国Sigma公司;活性炭、硅藻土,食品级,河南博旭环保科技有限公司;β-环糊精,食品级,河南万邦化工科技有限公司;大孔树脂XAD-1600、大孔树脂XAD-7HP,北京慧德易科技有限公司;大孔树脂AB-8,山东东鸿化工有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
FA1004万分之一电子天平,HANGPING公司;HZS-HA恒温水浴振荡器,哈尔滨东联电子技术开发有限公司;FiveEasy pH计,梅特勒托利多仪器(上海)有限公司;UV-5100紫外可见分光光度计,上海精密科学仪器有限公司;TGL-185高速离心机,长沙平凡仪器仪表有限公司;LBY-NJ4血小板聚集仪,北京普利生有限公司;LGJ-18冷冻干燥机,北京四环科学仪器厂;LC-15C高效液相色谱系统,日本岛津公司。
1.3 实验方法
1.3.1 鲢鱼皮胶原肽的制备
参考文献[5]的方法,将鲢鱼皮明胶与蒸馏水按1∶10(g∶mL)混合均匀,沸水浴加热40 min进行明胶的溶解,冷却至室温后,用1 mol/L的NaOH和HCl溶液调节pH至7.0。将明胶溶液置于60 ℃恒温水浴振荡器内预温15 min后,按照2.0%酶与底物比(质量分数)的添加量向明胶溶液中加入复合蛋白酶启动酶解反应,酶解6.0 h后沸水加热10 min进行灭酶和简单的杀菌,于25 ℃下4 000 r/min离心15 min取上清液,即为SCP,于4 ℃贮藏备用。
1.3.2 活性炭吸附
将活性炭置于烧杯中,倒入l%(体积比)盐酸浸泡12.0 h后,用热去离子水清洗,然后滤干,置于120 ℃下干燥8.0 h,完成活性炭清洗活化过程[15],冷却至室温备用。参考ZHANG等[16]的实验方法,称取0.1 g活性炭加入到10 mL SCP溶液中,40 ℃水浴振荡30 min,结束后立即在4 000 r/min离心15 min去除活性炭,上清液于4 ℃贮藏备用。
1.3.3 β-环糊精包埋
参考ZHANG等[16]的实验方法。称取0.1 g β-环糊精加入到10 mL SCP溶液中,50 ℃下水浴振荡30 min,得到脱苦脱腥鲢鱼皮胶原肽(silver carp skin collagen peptides after deodorization and debittering,d-SCP)溶液,降低至室温后于4 ℃贮藏备用。
1.3.4 硅藻土吸附
参考ZHANG等[16]的实验方法。称取0.1 g硅藻土加入到10 mL SCP溶液中,50 ℃水浴振荡30 min后立即使用滤纸过滤,收集d-SCP滤液,于4 ℃贮藏备用。
1.3.5 大孔树脂吸附
使用无水乙醇浸泡大孔树脂24.0 h,抽滤除去乙醇,蒸馏水反复洗涤至没有醇味。用1 mol/L NaOH溶液浸泡5.0 h,抽滤后用蒸馏水反复洗涤至pH 7.0,再用1 mol/L HCl溶液浸泡5.0 h,抽滤后用蒸馏水反复洗涤至pH 7.0,完成对大孔树脂的预处理[17]。最后抽滤得到湿润状态的树脂,自封袋密封,常温贮藏备用。参考陈增鑫等[18]的实验方法,称取0.5 g预处理后的XAD-1600、AB-8、XAD-7HP三种型号的大孔树脂,加入到10 mL SCP溶液中在30 ℃水浴振荡1.5 h。结束后立即使用滤纸过滤,收集d-SCP滤液,于4 ℃贮藏备用。
1.3.6 大孔树脂AB-8静态吸附单因素试验
根据初筛实验结果,以d-SCP溶液腥味值、苦味值及肽损失率为指标对大孔树脂AB-8吸附条件进行单因素试验,步骤同1.3.5节。固定每10 mL SCP溶液添加量0.7 g树脂,吸附温度30 ℃,吸附时间1.5 h,胶原肽溶液pH 6.0,通过改变单一条件考察树脂添加量(0.3、0.5、0.7、0.9、1.1 g)、吸附温度(20、30、40、50、60 ℃)、吸附时间(0.5、1.0、1.5、2.0、2.5 h)、胶原肽溶液pH(4.0、5.0、6.0、7.0、8.0)对脱腥脱苦效果影响。
1.3.7 大孔树脂AB-8静态吸附正交优化实验
根据静态吸附单因素试验结果,每个因素确定3个水平进行正交试验,各因素水平见表1。通过感官评价腥味值、苦味值,检测肽损失率,确定大孔树脂脱腥脱苦的最佳工艺条件。
表1 正交试验因素水平表
Table 1 Factor and level of the orthogonal test
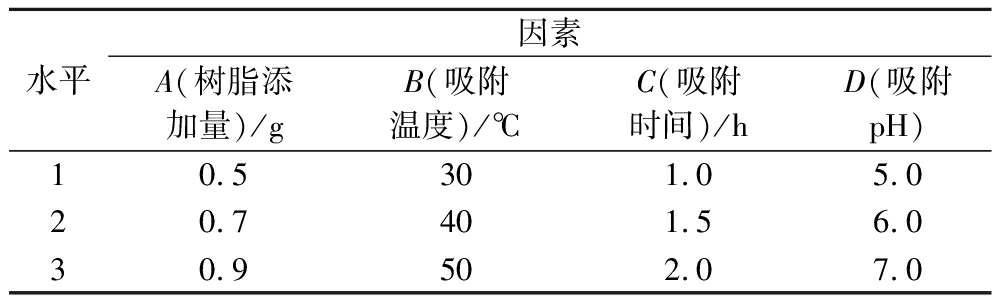
水平因素A(树脂添加量)/gB(吸附温度)/℃C(吸附时间)/hD(吸附pH)10.5301.05.020.7401.56.030.9502.07.0
1.3.8 胶原肽感官评价
将胶原肽溶液(10%,10 mL)置于一次性样品杯中,于25 ℃室温下放置10 min后,由7名经过训练的感官评价员进行感官评定,采用5分制,分值越高,腥味和苦味越重。同时对胶原肽溶液进行风味、气味、色泽的综合感官评价,评分标准见表2。感官得分为7人感官评分的平均值。
表2 感官值评价标准
Table 2 Sensory evaluation criteria
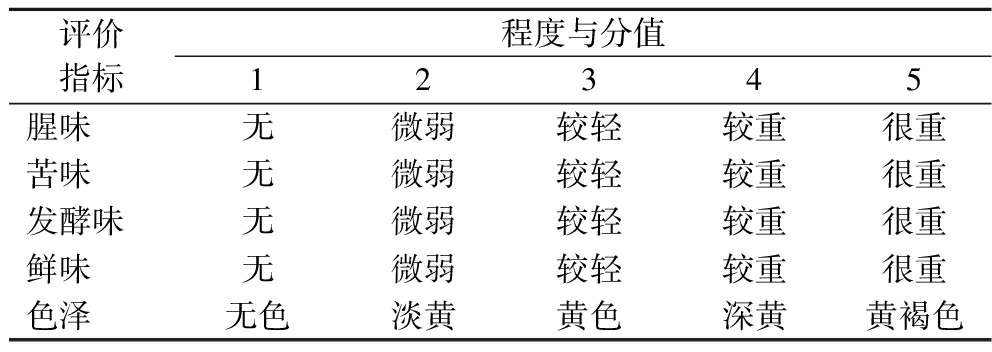
评价指标程度与分值12345腥味无微弱较轻较重很重苦味无微弱较轻较重很重发酵味无微弱较轻较重很重鲜味无微弱较轻较重很重色泽无色淡黄黄色深黄黄褐色
1.3.9 肽含量检测
采用福林酚法[19]检测肽含量。将胶原肽溶液或冻干粉配制成约含200 μg/mL蛋白的溶液,取1 mL加入5 mL福林酚试剂甲混匀,25 ℃放置10 min,再加0.5 mL福林酚试剂乙,立即摇匀,25 ℃保温30 min,在750 nm下比色,以1 mL水代替样品做空白对照。以牛血清白蛋白绘制出标准曲线:y=0.001 9x+0.035 9,R2=0.99,x为蛋白质量浓度(μg/mL),y为光密度值。
1.3.10 产品得率
准确量取一定量的d-SCP溶液,于-50 ℃,20 Pa以下进行冷冻干燥,并对干燥后的冻干粉进行准确称重,按公式(1)计算得率:
产品得率![]()
(1)
1.3.11 氨基酸组成测定
将胶原肽粉末按照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》进行前处理后,采用HPLC-异硫氰酸苯酯柱前衍生法[20]检测胶原肽氨基酸组成。
1.3.12 脂肪氧化物含量的测定
参照SIDDAIAH等[21]的方法。取0.1 g胶原肽冻干粉溶于1 mL去离子水置于具塞比色管中,加入2 mL 50 mmol/L的磷酸缓冲液(pH 7.0,加入质量浓度0.1% EDTA及质量浓度0.1%没食子酸丙酯),再加入2 mL质量浓度0.375%的硫代巴比妥酸(用质量浓度15%的三氯乙酸与0.25 mol/L的盐酸配制),沸水浴20 min冷却后加入5 mL的三氯甲烷,4 500 r/min离心10 min,取上清液于532 nm处比色。以丙二醛乙缩醛制作标准曲线:y=0.487 8x+0.007 5,R2=0.99,x为丙二醛乙缩醛质量浓度(μg/mL),y为光密度值。
1.3.13 抗血小板聚集活性测定
大鼠血小板的制备参照MAHESWARAIAH等[22]的方法进行制备,血小板聚集抑制率的测定参考YU等[23]的方法并稍作修改:称取一定量的胶原肽粉末溶于蒸馏水中配成终质量浓度(加到测试杯中的样品浓度)为3.0 mg/mL,以ADP(0.1 mol/L)为激活剂诱导血小板发生活化聚集,以贫血小板血浆为空白对照,利用比浊法测定血小板在5 min时的聚集率。血小板聚集抑制率按公式(2)计算:
抑制率![]()
(2)
1.4 数据处理
全文试验数据通过Excel预处理后,用统计分析软件:GraphPad prism 8.3.0进行显著性分析,SPSS Statistics 26软件进行正交试验结果分析。实验数据以平均值±标准差的形式表示。
2 结果与分析
2.1 不同吸附或包埋方法对胶原肽脱腥、脱苦的作用效果
活性炭和硅藻土[24]作为食品工业中常用的吸附剂,其较大的比表面积及多孔结构不仅对腥味物质和苦味肽有吸附消除作用,也具有一定的脱色效果[25];β-环糊精因具有内部疏水外部亲水的环状结构,能够包埋疏水氨基酸[26],从而降低胶原肽的苦味,也有研究发现其在脱腥方面也有一定的作用[10]。大孔树脂在功能成分分离纯化方面有广泛应用,近年来,在不良风味脱除方面的应用也逐渐兴起[12-14],不仅可以通过其发达孔穴结构大量吸附腥味物质,还可以对苦味氨基酸产生特异性吸附。因此,本文参照文献报道的实验方法处理样品,比较4种方式对SCP的脱腥、脱苦的作用效果以及d-SCP得率、肽含量和抗血小板活性的影响,从而确定适合于SCP脱腥的方式,结果如图1所示。在几种脱腥方式中,对SCP腥味脱除较好的为大孔树脂AB-8,其次为β-环糊精、活性炭和大孔树脂XAD-1600,对SCP苦味脱除较好的有大孔树脂AB-8、β-环糊精和大孔树脂XAD-1600(图1-a);3种大孔树脂吸附后d-SCP冻干粉得率均低于活性炭、β-环糊精和硅藻土,但从d-SCP的肽含量和抗血小板活性来看,大孔树脂AB-8吸附得到的d-SCP肽含量仅次于β-环糊精和活性炭,抗血小板活性和β-环糊精包埋产物的活性无显著差异(P>0.05)(图1-b),经大孔树脂AB-8吸附脱腥得到的d-SCP仍保持了较高的肽含量和血小板聚集抑制活性,说明大孔树脂AB-8虽然吸附能力较强,但由于其吸附具有选择性,并未对SCP中发挥抗血小板活性的肽产生大量吸附。常钰菲等[12]在对鳕鱼蛋白酶解液进行脱腥处理时,也发现AB-8型大孔树脂可吸附较多的腥味物质但又不至于损失大量多肽,整体脱腥效果较好。因此,选择大孔树脂AB-8进行下一步吸附条件的优化实验。

a-腥味值/苦味值;b-产物得率、肽含量、血小板聚集抑制率
图1 不同方式脱腥脱苦作用效果比较
Fig.1 Comparison of effects of different methods on deodorization and debittering
注:对于同一参数,图中不同字母表示差异显著性(P<0.05)(下同)。
2.2 大孔树脂AB-8静态吸附单因素试验
2.2.1 大孔树脂添加量对大孔树脂脱腥脱苦效果的影响
检测大孔树脂AB-8添加量为0.3~1.1 g时d-SCP溶液腥味值、苦味值及肽损失,以探究大孔树脂添加量对脱苦脱腥效果的影响,结果如图2所示。随着大孔树脂添加量的升高,d-SCP腥味值逐渐下降,在0.7 g时下降速度最快,0.9 g后未见显著变化(P>0.05),说明大孔树脂对SCP中的腥味物质吸附逐渐达到饱和。同时发现苦味值也呈现出下降的趋势,但0.7 g后下降不明显(图2-a)。肽损失率逐渐升高,升高速率也呈现先快速后平缓的趋势(图2-b),肽含量作为预估活性的指标,尽可能避免较高的损失。因此,本实验选取0.5、0.7及0.9 g,作为后续正交试验中大孔树脂添加量的3个水平。

a-腥味值和苦味值;b-肽损失率
图2 树脂添加量对大孔树脂脱腥脱苦效果影响
Fig.2 Effect of resin addition on macroporous resin deodorization and debittering
2.2.2 吸附温度对大孔树脂脱腥脱苦效果的影响
检测大孔树脂AB-8吸附温度为20~60 ℃时d-SCP腥味值、苦味值及肽损失,以探究大孔树脂吸附温度对脱苦脱腥效果的影响。由图3结果可以看出,随着温度的升高,d-SCP腥味值先降低后升高,在30 ℃达到最低值,可能存在的原因是在30 ℃左右有利于大孔树脂AB-8对胶原肽中腥味物质的吸附,但温度过高时d-SCP产生了轻微劣变,从而导致风味变差。苦味值先不变后升高,在20~40 ℃保持较低的水平(图3-a)。肽损失率先上升后降低,这可能是由于低温不利于大孔树脂的吸附,而大孔树脂的吸附过程是放热过程,所以温度过高也会导致吸附量的下降(图3-b),但在该温度范围内肽损失率基本在10%以内,未出现大量损失。因此,本实验选取30、40、50 ℃,作为后续正交试验中大孔树脂吸附温度的3个水平。
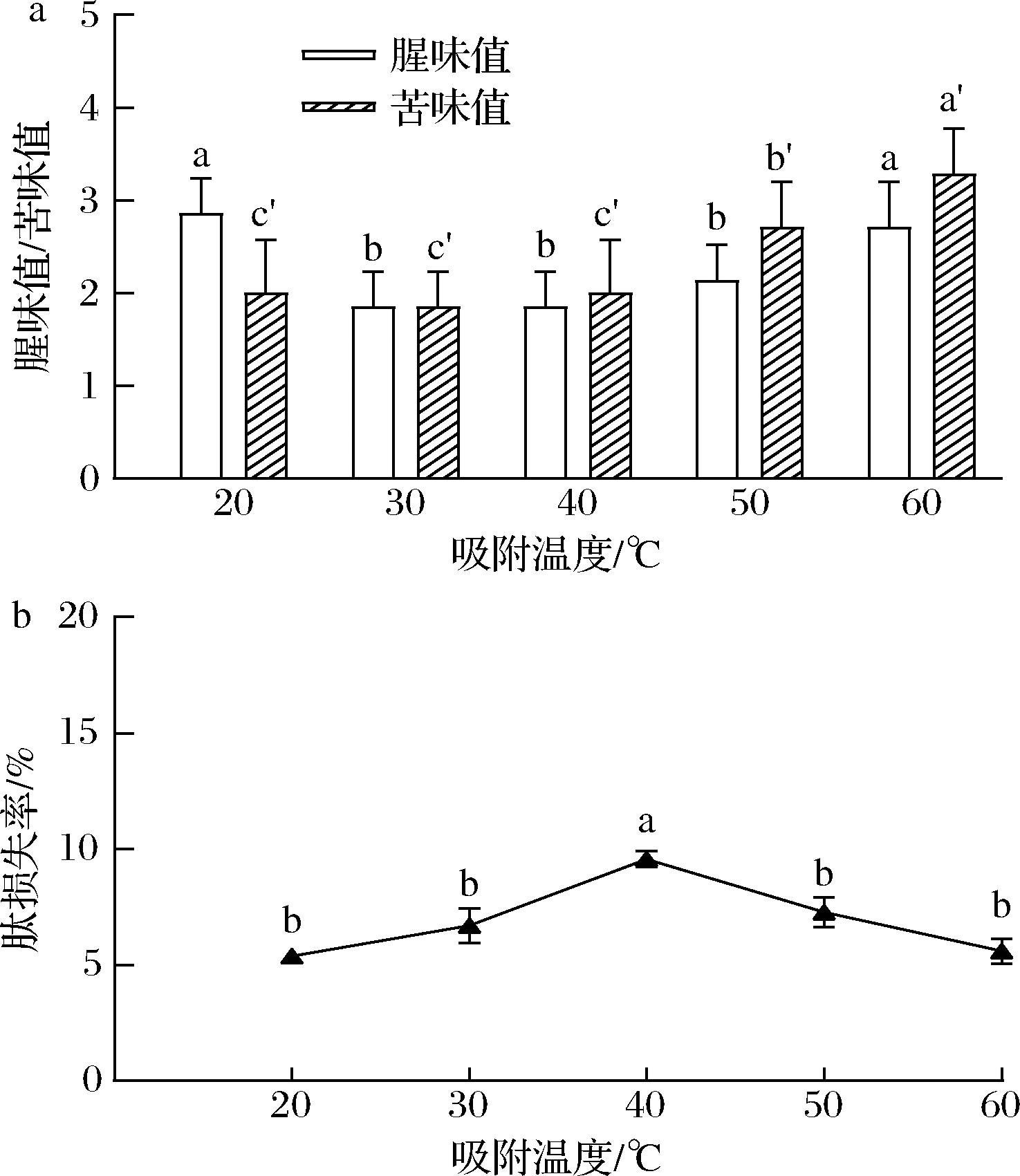
a-腥味值和苦味值;b-肽损失率
图3 吸附温度对大孔树脂脱腥脱苦效果影响
Fig.3 Effect of adsorption temperature on macroporous resin deodorization and debittering
2.2.3 吸附时间对大孔树脂脱腥脱苦效果的影响
检测大孔树脂AB-8吸附时间为0.5~2.5 h时d-SCP腥味值、苦味值及肽损失,以探究大孔树脂吸附时间对脱苦脱腥效果的影响。由图4可知,随着吸附时间的延长,腥味值和苦味值均先下降后趋于平缓,在1.5 h后未见显著变化(P>0.05),说明大孔树脂AB-8在0.5~1.5 h内对腥味物质和苦味物质大量吸附,在1.5 h基本达到饱和(图4-a)。肽的损失率随时间延长先快后慢,在2.0 h后基本不变,对肽的吸附也达到饱和(图4-b)。同时考虑到时间过长可能会造成肽溶液中微生物的繁殖和时间成本的增加,因此,本实验选取1.0、1.5、2.0 h,作为后续正交试验中吸附时间的3个水平。
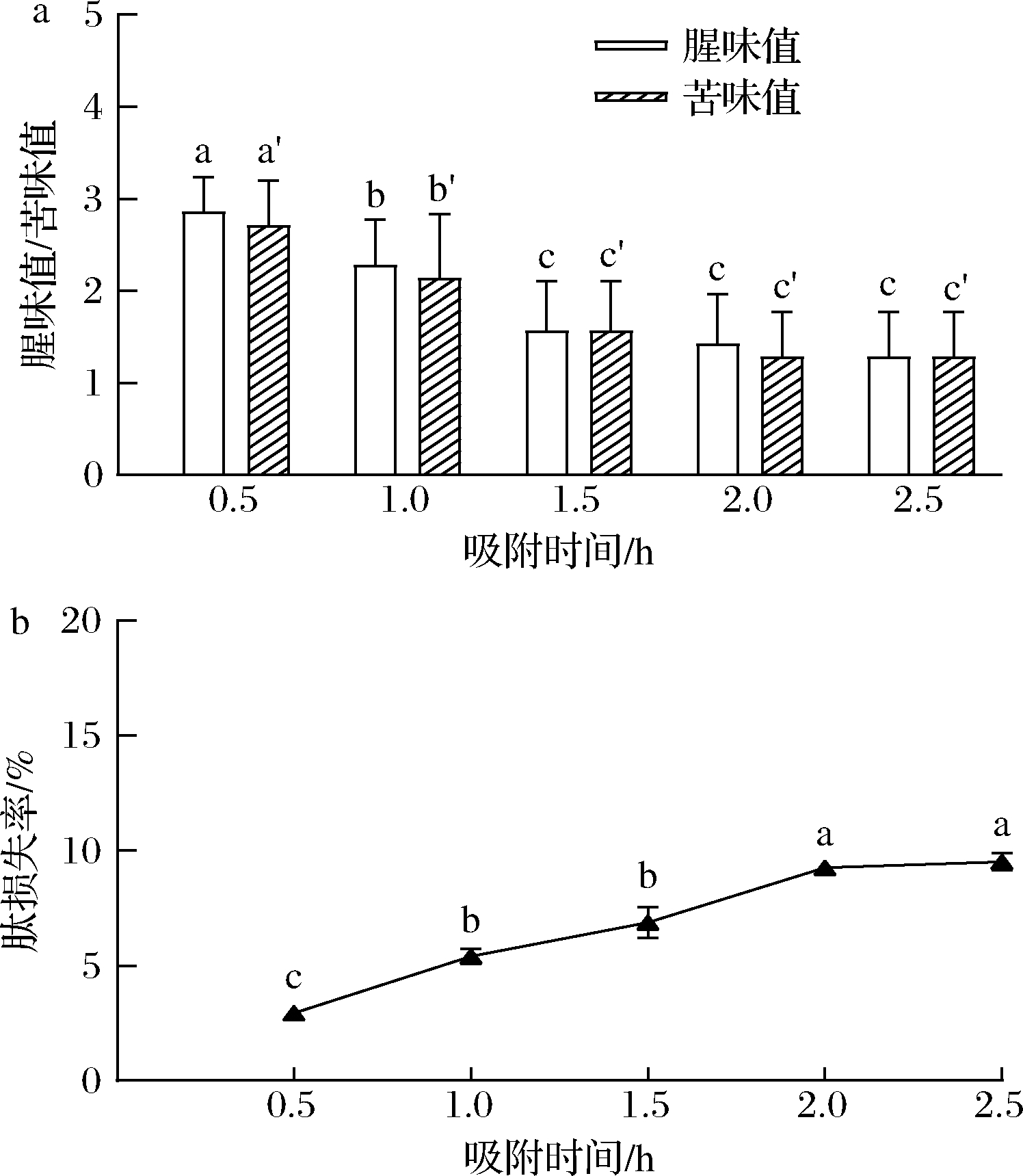
a-腥味值和苦味值;b-肽损失率
图4 吸附时间对大孔树脂脱腥脱苦效果影响
Fig.4 Effect of adsorption time on macroporous resin deodorization and debittering
2.2.4 胶原肽溶液pH对大孔树脂脱腥脱苦效果的影响
胶原肽溶液中pH的改变会使其中腥苦味物质和肽的极性发生变化,从而影响吸附效果[27]。探究溶液pH对大孔树脂AB-8脱腥脱苦效果的影响,检测d-SCP在pH 4.0~8.0时脱腥脱苦效果及肽损失。由图5-a可以看出,随着pH的升高,腥味值急剧下降后缓慢升高,在pH 6.0时达到最低值,说明中性或偏碱性环境有利于大孔树脂AB-8对腥味物质的吸附,这与常钰菲等[12]的研究结果一致。苦味值随pH升高而升高,说明酸性条件有利于大孔树脂AB-8对苦味氨基酸的吸附,同时发现酸的存在也能够对苦涩味有一定的掩盖作用,2种作用可共同导致苦味值的降低。肽的损失率随着pH的升高呈现先下降后上升的趋势,在中性附近损失率较低,过酸的吸附环境会造成肽的大量损失(图5-b)。综合考虑,本实验选取pH分别为5.0、6.0及7.0,作为后续正交试验中吸附pH的3个水平。
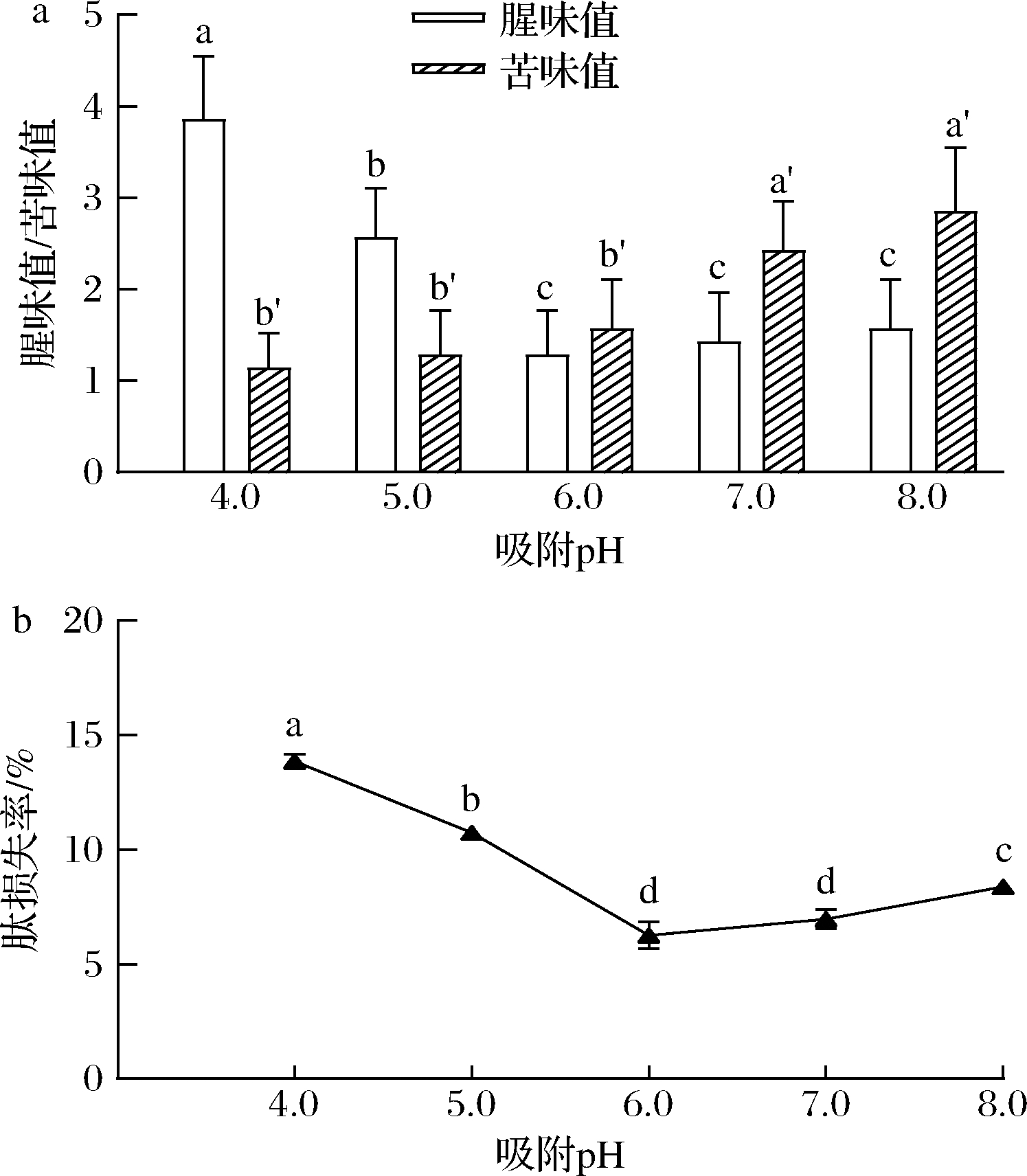
a-腥味值和苦味值;b-肽损失率
图5 胶原肽溶液pH对大孔树脂脱腥脱苦效果影响
Fig.5 Effect of pH of collagen peptide solution on macroporous resin deodorization and debittering
2.3 大孔树脂AB-8静态吸附正交试验
在单因素试验的基础上,以腥味值、苦味值和肽损失率为指标,按照表1进行正交试验。表3为正交试验结果,表4为正交试验方差分析结果。可以看出,在A(树脂添加量)、B(吸附温度)、C(吸附时间)、D(溶液pH)4个因素中,以腥味值为指标,显著影响因素为A和C,影响程度大小为A>C>D>B,得到的最优组合为A3B1C3D3,在该条件下d-SCP理论腥味值最低。但若以苦味值为指标,显著影响因素为A和B,得到的最优组合为A3B1C3D1;以肽损失率为指标,显著影响因素为A、B、C和D,得到的最优组合为A1B1C1D2。对于不同的评价指标,不同因素的影响程度是不一样的,对应的优化方案也各不相同,因此,采用综合平衡法[10]根据各项指标重要性及各项指标中因素主次、水平优劣等进行综合平衡。由于A为影响腥味值和苦味值的最主要因素,C为影响腥味值的主要因素,D为影响肽损失率的最主要因素,综合平衡后大孔树脂添加量的最佳水平为A3,吸附温度的最佳水平是B1,吸附时间的最佳水平是C3,吸附pH的最佳水平为D2,因此A3B1C3D2为最优组合,即正交试验表中的方案7,在该吸附条件下得到的d-SCP腥味值1.00,苦味值1.43,肽损失率7.72%。
表3 正交试验结果
Table 3 The results of orthogonal test
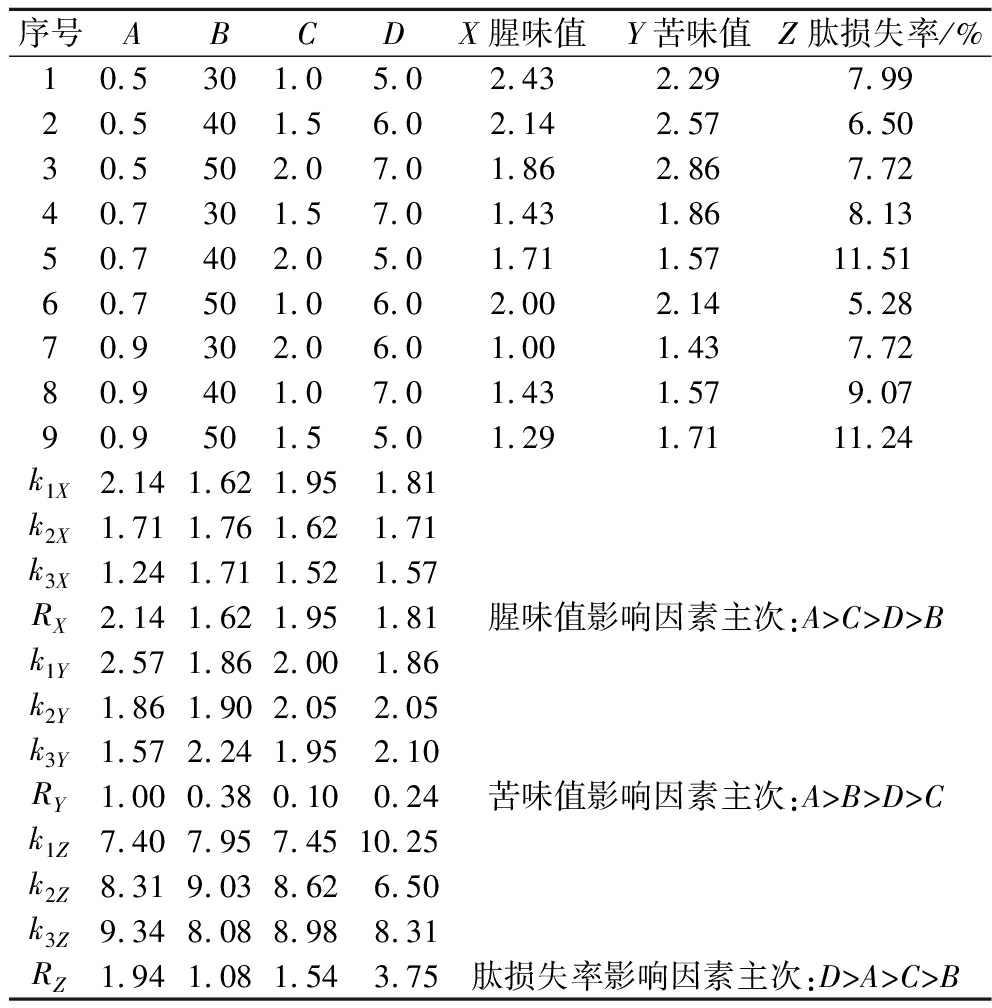
序号ABCDX腥味值Y苦味值Z肽损失率/%10.5301.05.02.43 2.29 7.9920.5401.56.02.14 2.57 6.5030.5502.07.01.86 2.86 7.7240.7301.57.01.43 1.86 8.1350.7402.05.01.71 1.57 11.5160.7501.06.02.00 2.14 5.2870.9302.06.01.00 1.43 7.7280.9401.07.01.43 1.57 9.0790.9501.55.01.29 1.71 11.24k1X2.14 1.62 1.95 1.81 k2X1.71 1.76 1.62 1.71 k3X1.24 1.71 1.52 1.57 RX2.14 1.62 1.95 1.81腥味值影响因素主次:A>C>D>Bk1Y2.57 1.86 2.00 1.86 k2Y1.86 1.90 2.05 2.05 k3Y1.57 2.24 1.95 2.10 RY1.00 0.38 0.10 0.24 苦味值影响因素主次:A>B>D>Ck1Z7.407.957.4510.25k2Z8.319.038.626.50k3Z9.348.088.988.31RZ1.941.081.543.75肽损失率影响因素主次:D>A>C>B
表4 正交试验方差分析表
Table 4 Variance analysis of orthogonal test
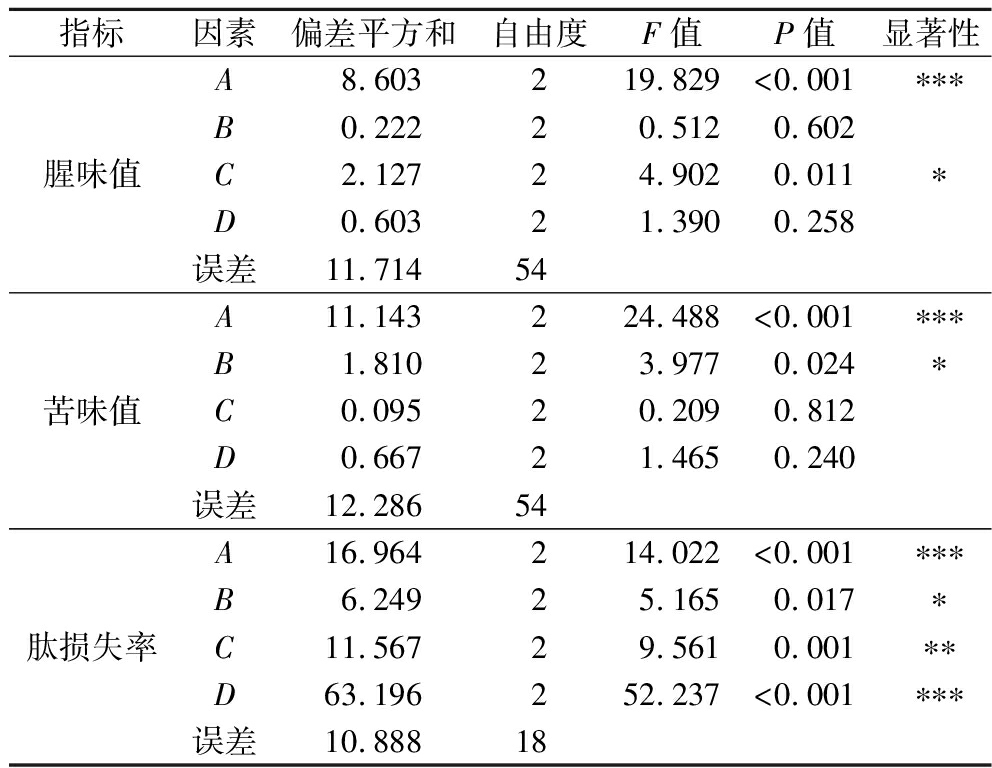
指标因素偏差平方和自由度F值P值显著性腥味值A8.603219.829<0.001∗∗∗B0.22220.5120.602C2.12724.9020.011∗D0.60321.3900.258误差11.71454苦味值A11.143224.488<0.001∗∗∗B1.81023.9770.024∗C0.09520.2090.812D0.66721.4650.240误差12.28654肽损失率A16.964214.022<0.001∗∗∗B6.24925.1650.017∗C11.56729.5610.001∗∗D63.196252.237<0.001∗∗∗误差10.88818
2.4 大孔树脂吸附前后胶原肽感官特征变化
对SCP和d-SCP溶液进行感官评价,从鱼腥味、发酵味、苦味、鲜味和色泽外观上对大孔树脂AB-8的脱腥脱苦效果进行综合评价,结果如图6所示。经过大孔树脂AB-8脱腥脱苦后的d-SCP溶液基本无鱼腥味,苦味也降低至感官可以接受的水平(P<0.05),外观上由原来的黄色变为澄清透明的微黄色,接近于无色,同时发现SCP溶液带有发酵味,经脱腥脱苦后,发酵味几乎无法被感知出,吸附后的d-SCP溶液也呈现出了一定的鲜味,整体风味得到显著改善。
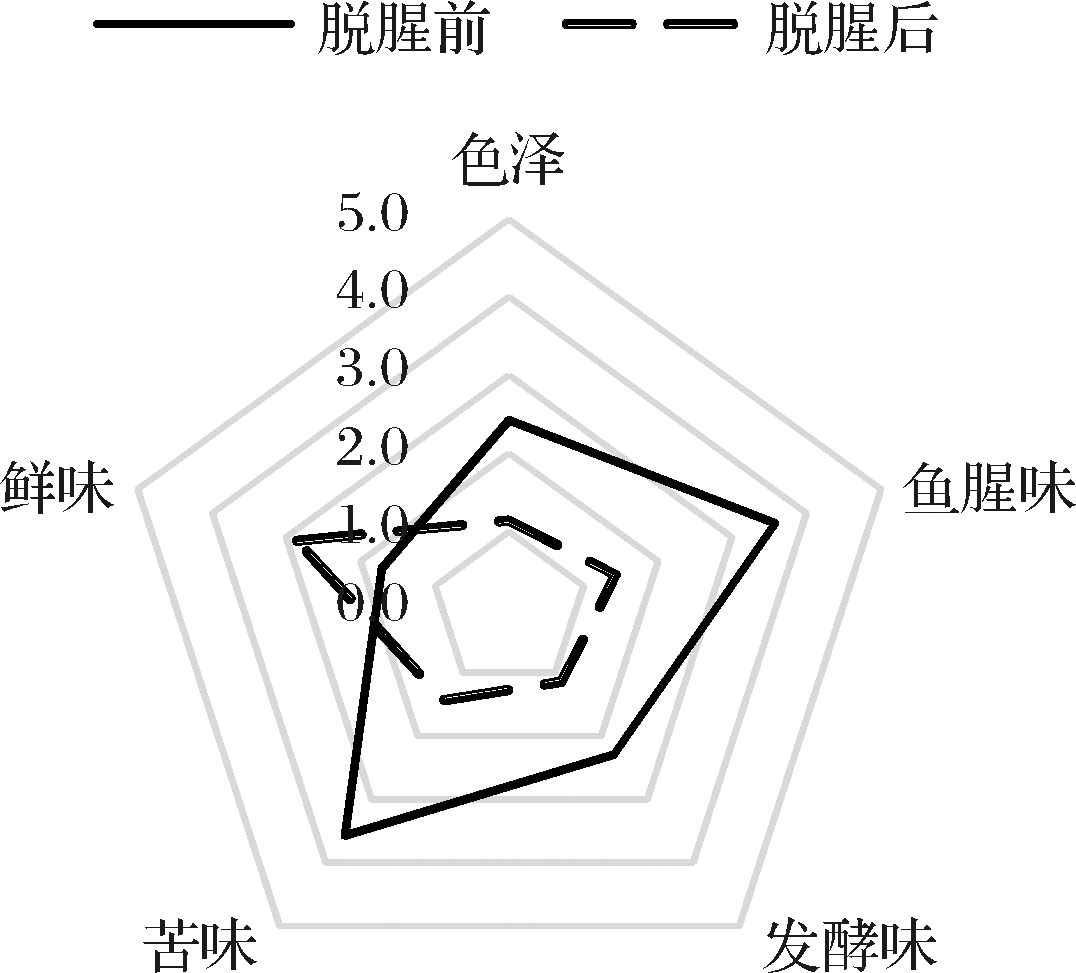
图6 SCP和d-SCP感官特征
Fig.6 The SCP and d-SCP sensory characteristics
2.5 大孔树脂吸附前后胶原肽氨基酸组成变化
在1.3.1节中酶解条件下制备SCP溶液,在正交优化得到的最优吸附条件下进行脱腥脱苦处理得到d-SCP,经冷冻干燥后计算得率为70.0%(以干基计)。
对SCP和d-SCP粉末进行总氨基酸分析,结果如表5所示。
表5 SCP和d-SCP氨基酸组成
Table 5 SCP and d-SCP amino acid composition
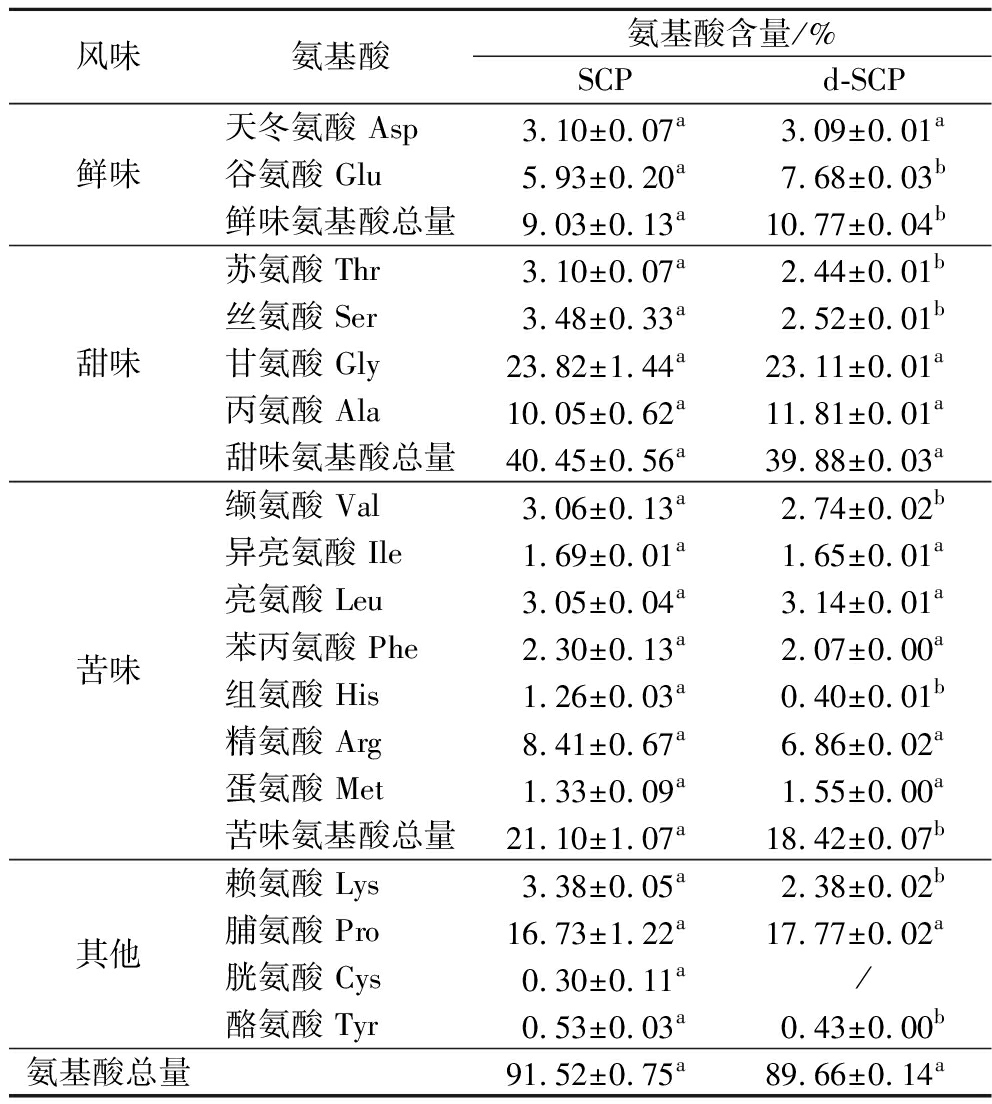
风味氨基酸氨基酸含量/%SCPd-SCP鲜味天冬氨酸 Asp3.10±0.07a3.09±0.01a谷氨酸 Glu5.93±0.20a7.68±0.03b鲜味氨基酸总量9.03±0.13a10.77±0.04b甜味苏氨酸 Thr3.10±0.07a2.44±0.01b丝氨酸 Ser3.48±0.33a2.52±0.01b甘氨酸 Gly23.82±1.44a23.11±0.01a丙氨酸 Ala10.05±0.62a11.81±0.01a甜味氨基酸总量40.45±0.56a39.88±0.03a苦味缬氨酸 Val3.06±0.13a2.74±0.02b异亮氨酸 Ile1.69±0.01a1.65±0.01a亮氨酸 Leu3.05±0.04a3.14±0.01a苯丙氨酸 Phe2.30±0.13a2.07±0.00a组氨酸 His1.26±0.03a0.40±0.01b精氨酸 Arg8.41±0.67a6.86±0.02a蛋氨酸 Met1.33±0.09a1.55±0.00a苦味氨基酸总量21.10±1.07a 18.42±0.07b其他赖氨酸 Lys3.38±0.05a2.38±0.02b脯氨酸 Pro16.73±1.22a17.77±0.02a胱氨酸 Cys0.30±0.11a/酪氨酸 Tyr0.53±0.03a0.43±0.00b氨基酸总量91.52±0.75a 89.66±0.14a
SCP和d-SCP中氨基酸总量分别为91.52%和89.66%,未出现显著差异(P>0.05)。从各种氨基酸种类的变化情况来看,SCP和d-SCP中对肽鲜味起重要作用的Asp和Glu[7]总量分别为9.03%和10.77%,增加了19.27%,从而使吸附处理后的d-SCP鲜味提升。Thr、Ser、Gly和Ala为甜味氨基酸,4种氨基酸总量未出现显著变化。Val、Ile、Leu、Phe、His、Arg、Met均属于苦味氨基酸,带有明显苦味[17],吸附前后总量分别为21.10%和18.42%,降低了12.70%,分析原因可能是由于以上几种氨基酸大部分为疏水性氨基酸,大孔树脂AB-8为聚苯乙烯型弱极性吸附树脂,其吸附机理为疏水性吸附,因此,苦味氨基酸得到一定吸附,从而使d-SCP相较于SCP苦味得到良好改善,这与蒋雄武等[28]的研究结果一致。另外,组成抗血小板肽的主要氨基酸Gly和Pro[29]吸附前后总量分别为40.55%和40.88%,未出现显著下降(P>0.05)。
2.6 大孔树脂吸附前后胶原肽中脂肪氧化物含量的变化
鱼类脂肪氧化产生的醛酮类物质是胶原肽溶液腥味的重要来源,SIDDAIAH等[21]发现,脂肪氧化产物指标TBARS与鱼类风味感官评分呈正相关,因此通过测定硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值来验证大孔树脂AB-8静态吸附对SCP中腥味物质的影响,结果见表6。SCP和d-SCP冻干粉中脂肪氧化产物含分别为3.71 μg/g和2.34 μg/g,降低了36.93%,说明大孔树脂AB-8的静态吸附能够对SCP中的腥味物质有较好的脱除,这和感官评价的结果是一致的。
表6 SCP和d-SCP脂肪氧化物含量、肽含量及抗血小板活性变化
Table 6 Changes in TBARS, peptide content, and antiplatelet activity of SCP and d-SCP

指标SCPd-SCP脂肪氧化物/(μg/g)3.71±0.14a2.34±0.08b肽含量/%85.49±0.45a88.10±0.44b血小板聚集抑制率IC50/(mg/mL)1.9692.069
2.7 大孔树脂吸附前后胶原肽中肽含量和抗血小板活性的变化
经检测,SCP和d-SCP冻干粉中肽含量分别为85.48%和88.10%,结合2.5节中实验结果,吸附后的d-SCP氨基酸总量略微下降,而肽含量提高了3.07%,说明大孔树脂AB-8在SCP溶液中对游离氨基酸的吸附能力大于对肽的吸收,大孔树脂AB-8在脱苦脱腥的同时,也对其中的肽起到了一定的纯化效果。SCP和d-SCP的血小板聚集抑制IC50值分别为1.969和2.069 mg/mL,活性下降5.08%,吸附后的d-SCP仍具有较高的抗血小板活性,说明采用大孔树脂AB-8对SCP脱腥脱苦是可行的。
3 结论
本研究比较了活性炭、β-环糊精、硅藻土、大孔树脂XAD-1600、AB-8和XAD-7HP等6种方式处理对SCP脱腥脱苦的作用效果,筛选出大孔树脂AB-8,经过单因素和正交优化,确定最佳脱腥条件为每10 mL SCP溶液添加0.9 g树脂,在pH 6.0和温度30 ℃条件下水浴振荡吸附2.0 h。经大孔树脂吸附处理后的d-SCP基本无腥味,苦味降低至感官可以接受的水平,鲜味得到提升;肽含量为88.10%,较吸附前提高了3.07%,血小板聚集抑制IC50值为2.069 mg/mL,较吸附前下降5.08%。大孔树脂AB-8处理后SCP肽损失率和抗血小板活性损失率较低,风味得到显著改善,为鲢鱼皮胶原活性肽的品质提升提供了技术解决方案。
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会.中国渔业统计年鉴—2021[M].北京:中国农业出版社, 2021.
Bureau of Fisheries of MARA, National Fisheries Technology Extension Center, China Society of Fisheries.China Fishery Statistical Yearbook 2021[M].Beijing:China Agriculture Press, 2021.
[2] 武润琳, 刘建伟, 熊善柏, 等.混酶水解法制备的鲢鱼皮多肽的抗氧化活性[J].华中农业大学学报, 2020, 39(4):114-120.
WU R L, LIU J W, XIONG S B, et al.Antioxidant activity of polypeptides from silver carp skin prepared by mixed enzymatic hydrolysis[J].Journal of Huazhong Agricultural University, 2020, 39(4):114-120.
[3] 茅宇虹, 杨文鸽.鱼皮胶原蛋白及胶原活性肽的研究[J].食品工业科技, 2013, 34(15):375-379.
MAO Y H, YANG W G.Advances in the study of collagen and its active peptide of fish skin[J].Science and Technology of Food Industry, 2013, 34(15):375-379.
[4] 杨璇. 基于超声酸酶法和模拟肠消化制备鱼皮胶原蛋白肽及肽钙螯合物研究[D].镇江:江苏大学, 2020.
YANG X.Study on preparation of fish skin collagen peptide and peptide-calcium chelate based on ultrasonic acid enzyme method and simulated intestinal digestion[D].Zhenjiang:Jiangsu University, 2020.
[5] 李雨奇, 李博, 王成涛.鱼皮抗血小板胶原肽的功效评价及酶法制备工艺优化[J].食品工业科技, 2019, 40(18):185-193.
LI Y Q, LI B, WANG C T.Efficacy evaluation and optimization of enzymatic preparation process of anti-platelet collagen peptides from fish skin[J].Science and Technology of Food Industry, 2019, 40(18):185-193.
[6] SAE-LEAW T, BENJAKUL S, O’BRIEN N M.Effect of pretreatments and drying methods on the properties and fishy odor/flavor of gelatin from seabass (Lates calcarifer) skin[J].Drying Technology, 2016, 34(1):53-65.
[7] TEMUSSI P A.The good taste of peptides[J].Journal of Peptide Science, 2012, 18(2):73-82.
[8] IDOWU A T, BENJAKUL S.Bitterness of fish protein hydrolysate and its debittering prospects[J].Journal of Food Biochemistry, 2019, 43(9):e12978.
[9] LI X, WANG J, ZHANG X J, et al.Powdered activated carbon adsorption of two fishy odorants in water:Trans, trans-2, 4-heptadienal and trans, trans-2, 4-decadienal[J].Journal of Environmental Sciences, 2015, 32:15-25.
[10] 鉏晓艳, 熊光权, 李新, 等.草鱼鱼鳞酶溶性胶原蛋白肽脱腥脱苦工艺研究[J].食品工业科技, 2014, 35(15):232-235.
ZU X Y, XIONG G Q, LI X, et al.Study on debittering of papain soluble collagen peptide from grass carp scale[J].Science and Technology of Food Industry, 2014, 35(15):232-235.
[11] DAUKSAS E, SLIZYTE R, RUSTAD T, et al.Bitterness in fish protein hydrolysates and methods for removal[J].Journal of Aquatic Food Product Technology, 2004, 13(2):101-114.
[12] 常钰菲, 侯虎, 李八方.大孔树脂处理对鳕鱼蛋白酶解液中腥味物质的影响[J].食品与发酵工业, 2015, 41(6):52-58.
CHANG Y F, HOU H, LI B F.Effects of macroporous resins on odor-removal process of codfish protein hydrolysate[J].Food and Fermentation Industries, 2015, 41(6):52-58.
[13] 陈轩. 鲢鱼抗氧化肽的制备、精制工艺及其功能特性研究[D].武汉:武汉工业学院, 2012.
CHEN X.Study on the preparation and refining processing and functional quality of the silver carp antioxidant peptide[D].Wuhan:Wuhan Polytechnic University, 2012.
[14] 胡凌豪. 凤尾鱼酶解产物对嗜热链球菌增殖作用及其生物活性研究[D].上海:上海海洋大学, 2019.
HU L H.Anchovy hydrolysates:Proliferation effect on Streptococcus thermophiles and evaluation of physiological activity[D].Shanghai:Shanghai Ocean University, 2019.
[15] 白兰莉, 李士雨, 杨瑞丽, 等.低聚木糖液脱色的工艺研究[J].安徽农业科学, 2009, 37(20):9338-9339;9354.
BAI L L, LI S Y, YANG R L, et al.Study on decolorizing of xylooligosaccharides[J].Journal of Anhui Agricultural Sciences, 2009, 37(20):9338-9339;9354.
[16] ZHANG Z P, NIU L H, SUN L, et al.Effects of powdered activated carbon, diatomaceous earth and β-cyclodextrin treatments on the clarity and volatile compounds of tilapia (Oreochromis niloticus) skin gelatin[J].Journal of Food Measurement and Characterization, 2017, 11(2):894-901.
[17] ZHUANG M Z, ZHAO M M, LIN L Z, et al.Macroporous resin purification of peptides with umami taste from soy sauce[J].Food Chemistry, 2016, 190:338-344.
[18] 陈增鑫, 刘咏霖, 潘芸芸, 等.不同脱腥方法对海参肠卵酶解液脱腥效果的比较[J].食品与发酵工业, 2022, 48(5):187-194.
CHEN Z X, LIU Y L, PAN Y Y, et al.Effect of different deodorization methods on enzymatic hydrolysate of sea cucumber (Stichopus japonicas) intestines and gonads[J].Food and Fermentation Industries, 2022, 48(5):187-194.
[19] 余瑞元, 袁明秀, 陈丽蓉, 等.生物化学试验原理和方法[M].北京:北京大学出版社, 1994.
YU R Y, YUAN M X, CHEN L R, et al.Principles and Methods of Biochemical Experiment[M].Beijing:Peking University Press, 1994.
[20] BIDLINGMEYER B A, COHEN S A, TARVIN T L.Rapid analysis of amino acids using pre-column derivatization[J].Journal of Chromatography B:Biomedical Sciences and Applications, 1984, 336(1):93-104.
[21] SIDDAIAH D, SAGAR REDDY G V, RAJU C V, et al.Changes in lipids, proteins and kamaboko forming ability of silver carp (Hypophthalmichthys molitrix) mince during frozen storage[J].Food Research International, 2001, 34(1):47-53.
[22] MAHESWARAIAH A, RAO L J, NAIDU K A.Anti-platelet activity of water dispersible curcuminoids in rat platelets[J].Phytotherapy Research:PTR, 2015, 29(3):450-458.
[23] YU G Y, WANG F, ZHANG B L, et al.In vitro inhibition of platelet aggregation by peptides derived from oat (Avena sativa L.), highland barley (Hordeum vulgare Linn.var.nudum Hook.f.), and buckwheat (Fagopyrum esculentum Moench) proteins[J].Food Chemistry, 2016, 194:577-586.
[24] 张瑞瑞, 杨萍, 李利敏, 等.微滤膜、硅藻土和珍珠岩对罗非鱼肉酶解液脱腥脱苦效果的比较研究[J].食品工业科技, 2014, 35(5):83-86;90.
ZHANG R R, YANG P, LI L M, et al.Comparative study of deodorization of tilapia fish protein enzymatic hydrolysis by microfiltration, diatomite and perlite process[J].Science and Technology of Food Industry, 2014, 35(5):83-86;90.
[25] 卢祺, 刘津延, 刘方芳, 等.鱼类腥味物质及脱腥技术研究进展[J].食品工业科技, 2019, 40(8):285-291.
LU Q, LIU J Y, LIU F F, et al.Research progress on fishy smell and technology of removing off-odor[J].Science and Technology of Food Industry, 2019, 40(8):285-291.
[26] LINDE G A, JUNIOR A L, DE FARIA E V, et al.The use of 2D NMR to study β-cyclodextrin complexation and debittering of amino acids and peptides[J].Food Research International, 2010, 43(1):187-192.
[27] 米恒振. 鳀鱼酶解液中不良风味成分的吸附脱除[D].青岛:中国海洋大学, 2010.
MI H Z.Adsorptive removal of bad flavor compounds in anchovy enzymatic hydrolysates[D].Qingdao:Ocean University of China, 2010.
[28] 蒋雄武, 杨萍, 张瑞瑞, 等.大孔树脂动态吸附前后罗非鱼下脚料蛋白酶解液的理化特性比较[J].食品工业科技, 2015, 36(20):102-106.
JIANG X W, YANG P, ZHANG R R, et al.Comparative of physicochemical properties of tilapia scraps enzymatic hydrolyzate treated by dynamic adsorption of macroporous resin[J].Science and Technology of Food Industry, 2015, 36(20):102-106.
[29] 田淇. 含Hyp-Gly序列抗血小板肽的分子对接及定量构效关系研究[D].北京:中国农业大学, 2020.
TIAN Q.Molecular docking and quantitative structure-activity relationship of antiplatelet peptides containing Hyp-Gly[D].Beijing:China Agriculture University, 2020.