鱼类的活体销售是我国鱼类销售方式之一,较之冷冻或者冰鲜的鱼产品,活鱼销售的价格一般相对较高,其中一些经济价值较高的鱼类,其价格是冷冻或者冰鲜鱼产品的2~5倍[1]。目前,无水保活运输是国际上鱼类保活运输的一种重要的运输方式,利用低温诱导使鱼类处于休眠状态,降低机体的新陈代谢及耗氧量,提高抗应激能力,提高活鱼的运输量和存活率[2-3]。然而,鱼类作为一种变温动物,极易受到温度的影响,鱼类所处的环境温度一旦发生变化便容易引发机体产生应激反应、免疫系统受损等[4]。因此,研究减缓降温过程中应激反应的处理方法对提高鱼类抵御能力具有重要意义。
维生素E,又称生育酚、生殖维生素及抗不孕维生素等,是目前最主要的抗氧化剂之一,具有抗氧化、抗不育的作用,以及影响免疫功能、防治疾病等作用[5]。维生素E作为饲料添加物应用于水产养殖的研究表明,饲料中添加维生素E能有效提高罗非鱼、黄花鱼、鲴鱼、大西洋白姑鱼等抗氧化、抗应激能力,增强免疫力和代谢能力[6-8]。迄今为止,尚未见到水体中添加维生素E用以缓解鱼类胁迫这方面的应用研究报道。本研究以鲫鱼为试验对象,在降温胁迫下,研究不同浓度维生素E水溶液处理对鱼体生理代谢及应激指标的变化情况,分析维生素E处理下鱼体面对胁迫时的应激水平变化,为水体中添加维生素E应用于缓解鱼类应激提供研究参考。
1 材料与方法
1.1 材料
鲫鱼购自济南市海鲜大市场,并运至国家农产品现代物流工程技术研究中心。挑选个体初始体重(0.42±0.10) kg、体长(18.15±1.56) cm、体质健康、体表无损伤、鳞片完整、大小均匀的成鱼,暂养于国家农产品现代物流工程技术研究中心水产品控温循环水过滤系统待用。暂养条件:水温(20±1)℃,溶氧量≥6 mg/L;暂养时间为1 d。
1.2 仪器与设备
BK-280 全自动生化分析仪,山东博科生物产业有限公司;F6/10-104-S组织破碎机,上海弗鲁克流体机械制造有限公司;T9S 紫外分光光度计,北京普析通用仪器有限责任公司;Multiscan MK3 酶标仪,赛默飞世尔(上海)仪器有限公司;鲜活水产品智能冷驯化/唤醒箱,山东省农产品贮运保鲜技术重点实验室自主研发(专利号ZL201310447777.8);人工气候箱QHX-300BSH-Ⅲ,上海新苗医疗器械制造有限公司;水产养殖及循环水处理系统,青岛中科海水处理设备工程有限公司;笔式 pH 检测计,希玛仪表集团有限公司;JPB-607A 型便携式溶解氧分析仪,上海雷磁仪电科学仪器股份有限公司。
1.3 试验方法
1.3.1 维生素E处理
试验组按维生素E∶无水乙醇=1∶5将维生素E溶入无水乙醇制成原液,并将原液加水调配成质量浓度分别为50、100、200 mg/L的维生素E水溶液,以不添加维生素E(0 mg/L)处理的鲫鱼作为对照组,每组21尾鲫鱼。设置阴性对照组M1、M2、M3,M1、M2、M3分别为50、100、200 mg/L维生素E水溶液时所需乙醇量而调配成的乙醇水溶液,每组3尾鲫鱼。将暂养后的鲫鱼分别转入不同浓度维生素E水溶液以及阴性对照组M1、M2、M3水溶液的冷驯化智能降温装置中进行药浴,时间为2 h。
1.3.2 冷驯化处理
通过自主设计的冷驯化智能降温装置完成对鲫鱼的冷驯化[9],装置先按照10 ℃/h的降温速率将水温从20 ℃降至10 ℃,然后再以5 ℃/h的降温速率将水温从10 ℃降至5 ℃;分别在20、10、5 ℃的3个温度点随机取出6尾鲫鱼进行取样。
1.3.3 指标测定
鲫鱼从冷驯化智能降温装置中取出后,从尾端静脉处,用规格为5 mL的一次性注射器取血5 mL以上,取后的血液于4 ℃冰箱中静置2 h后,4 ℃下4 000 r/min离心20 min,取其上清液于-80 ℃冰箱中保存待用,将取完血的鲫鱼放置在盛有冰块的托盘上进行解剖,取其肝脏和肌肉,放入-80 ℃冰箱中保存待用。
1.3.3.1 存活率的测定
冷驯化结束后的鲫鱼装入自封袋内,将空气排尽后充入O2,将自封袋封口后,放进人工气候箱进行无水保活,保活温度根据前期的预实验结果设定为5 ℃。试验组分为7组,分别为M1、M2、M3、0、50、100、200 mg/L,每组3尾,每2 h统计1次存活率。
1.3.3.2 血清生化指标测定
采用全自动生化分析仪测定谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、乳酸脱氢酶(lactate dehydrogenase,LDH)、血糖 (blood glucose,GLU)、乳酸(lactic acid,LAC);采用南京建成生物工程研究所的试剂盒测定丙二醛(malondialdehyde,MDA)、皮质醇(cortisol)、肾上腺素(epinephrine,EPI)及糖原。每个样品重复3次。
1.3.3.3 肌肉指标测定
质构指标测定:参照蒋乐霞等[10]的方法,将鱼的肌肉组织剪切成1 cm×1 cm×1 cm的大小,采用质构剖面法测定。探头为P45/R,测试速度为1 mm/s,循环次数为2次,测定其硬度、黏附性、胶黏性、弹性以及咀嚼性,每个样品重复3次。
pH值的测定:将鱼的肌肉组织搅碎后,用分析天平准确称量5.00 g鱼肉放于烧杯中,加入煮沸后冷却的蒸馏水,搅拌均匀定容至50 mL,静置30 min后过滤到烧杯中,用pH计测定其pH值,每个样品重复3次。
电子鼻的测定:电子鼻取样参照陈东杰等[11]的研究方法,准确称取对照组及不同浓度维生素E处理组各2.0 g鲫鱼背部肌肉,采用组织搅碎机将其进行搅碎后分别装入10 mL样品瓶中,加盖密封,每个样品重复4次。测试前,需对电子鼻测定参数进行调整优化。根据传感器的响应信号,进而确定电子鼻的测定参数如下:载气流速150 mL/min,顶空产生温度40 ℃,进样体积2 000 μL/s,顶空产生时间设置为600 s,数据采集时间设置为120 s,延滞时间设置为400 s。采用雷达图和线性判别分析(linear discriminant analysis,LDA)对样品进行分析,将样品中差异较大的个体除去。18个传感器对应的敏感物质类型如表1所示。
表1 传感器对应的敏感物质类型
Table 1 Types of sensitive substances corresponding to sensors

序号传感器名称敏感物质类型序号传感器名称敏感物质类型1LY2/LG氯、氟、氮氧化合物、硫化物10P40/1氟、氯2LY2/G氨、胺类化合物、氮氧化合物11T70/2甲苯、二甲苯、一氧化碳3LY2/AA乙醇、丙酮、氨12PA/2乙醇、氨水、胺类化合物4LY2/GH氨、胺类化合物13P30/1碳氢化合物、氨、乙醇5LY2/gCTL硫化物14T40/2氯、硫化氢、氟化物6LY2/gCT丙烷、丁烷15P30/2硫化氢、酮7T30/1极性化合物、氯化氢16T40/2氯8P10/1非极性;碳氢化合物、氨、氯17T40/1氟9P10/2非极性;甲烷、乙烷18TA/2乙醇
1.4 数据统计
应用SPSS 22软件进行方差分析,显著性分析应用Duncan法进行组间多重比较,显著性水平设P<0.05表示显著,P>0.05表示显著;P<0.01表示极显著,P>0.01表示极不显著,结果由Origin 2019软件绘制图表。
2 结果与分析
2.1 不同浓度维生素E处理对鲫鱼无水保活过程中存活率的影响
鲫鱼经不同浓度维生素E处理下不同保活时间的存活率如表2所示。本试验中,随着保活时间的延长,各组存活率整体呈下降趋势。对照组和阴性对照组M1、M2、M3的存活率下降幅度差别不大;而与对照组、阴性对照组相比,各浓度维生素E处理组存活率下降幅度较小,其中,100 mg/L处理组的鲫鱼存活率最高。无水保活50 h时,阴性对照组M1、M3的存活率降至66.7%,M2和0、50、100、200 mg/L处理组的存活率为100%;无水保活52 h时,0 mg/L处理组的存活率降低至66.7%,M2和50、100、200 mg/L处理组的存活率为100%;无水保活54 h时,M2的存活率降低至66.7%,50、100、200 mg/L处理组的存活率为100%;无水保活58 h时,200 mg/L处理组的存活率降低至66.7%,50、100 mg/L处理组的存活率为100%;无水保活72 h时,50 mg/L处理组的存活率降低至66.7%,100 mg/L处理组的存活率为100%,且100 mg/L处理组的鲫鱼休眠状态良好,体色无异且体表无出血等状况。由此初步认为,在无水保活过程中,无水乙醇的存在因剂量小的缘故对鲫鱼的作用影响不大,而经过维生素E处理可提升鲫鱼的存活率,其中100 mg/L维生素E的保活效果最佳。
表2 不同维生素E浓度处理下鲫鱼无水保活不同时间的存活率
Table 2 Survival rate of crucian carp without water preservation for different time under different vitamin E concentration treatment
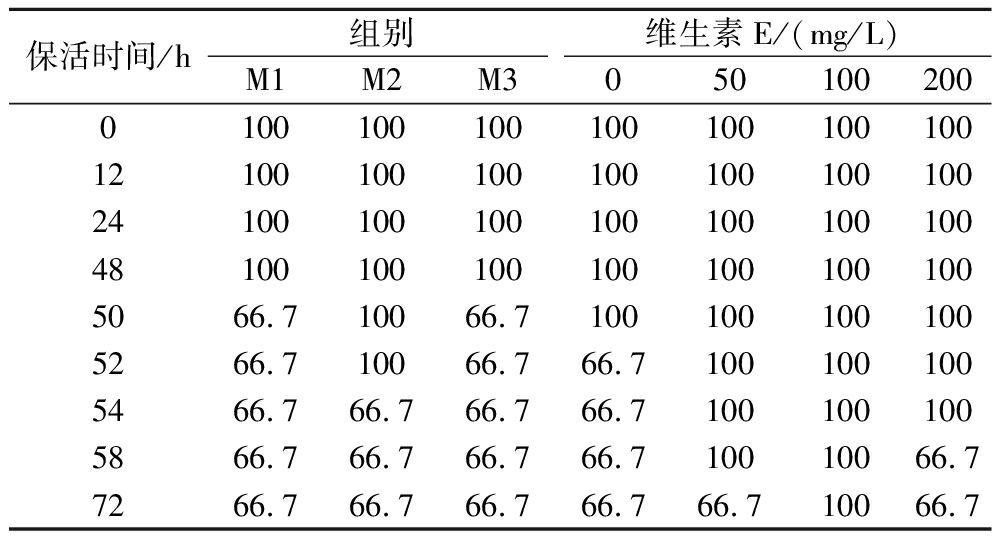
保活时间/h组别维生素E/(mg/L)M1M2M305010020001001001001001001001001210010010010010010010024100100100100100100100481001001001001001001005066.710066.71001001001005266.710066.766.71001001005466.766.766.766.71001001005866.766.766.766.710010066.77266.766.766.766.766.710066.7
2.2 维生素E对降温胁迫下鲫鱼血清皮质醇和肾上腺素的影响
由表3可知,除100 mg/L处理组外,0、50、200 mg/L处理组的皮质醇质量浓度随温度下降呈先升高后下降的趋势,在降温至10 ℃时皮质醇浓度达到最大值,分别为2.51、1.75、1.35、2.05 ng/mL;除20 ℃外,其余温度点100 mg/L处理组的皮质醇浓度显著低于0、50、200 mg/L处理组(P<0.05)。0、50、100、200 mg/L处理组的肾上腺素质量浓度随温度下降呈先升高后下降的趋势,在降温至10 ℃时肾上腺素浓度达到最大值,分别为0.39、0.21、0.20、0.31 ng/mL;除20 ℃外,其余温度点100 mg/L处理组的肾上腺素浓度显著低于0、50、200 mg/L处理组(P<0.05)。
表3 维生素E对降温胁迫下鲫鱼血清皮质醇和肾上腺素的影响 单位:ng/mL
Table 3 Effect of vitamin E on serum cortisol and adrenaline in crucian carp under cooling stress
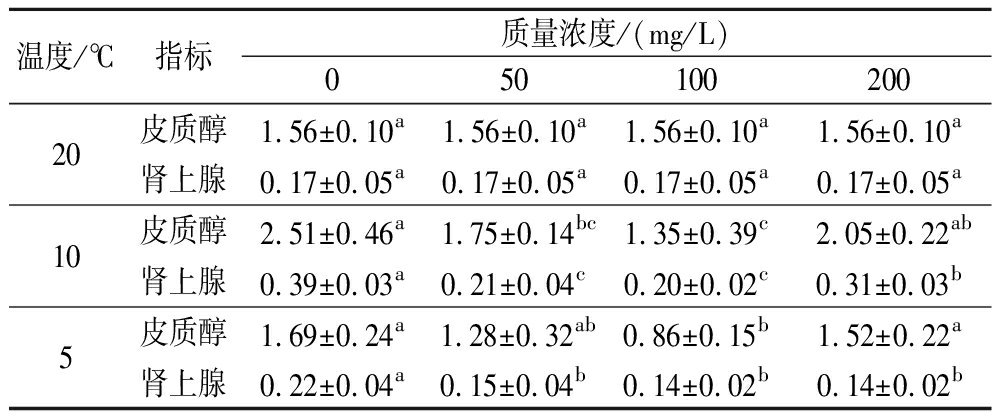
温度/℃指标质量浓度/(mg/L)05010020020皮质醇1.56±0.10a1.56±0.10a1.56±0.10a1.56±0.10a肾上腺0.17±0.05a0.17±0.05a0.17±0.05a0.17±0.05a10皮质醇2.51±0.46a1.75±0.14bc1.35±0.39c2.05±0.22ab肾上腺0.39±0.03a0.21±0.04c0.20±0.02c0.31±0.03b5皮质醇1.69±0.24a1.28±0.32ab0.86±0.15b1.52±0.22a肾上腺0.22±0.04a0.15±0.04b0.14±0.02b0.14±0.02b
注:同列中不同小写字母标记的值表示差异显著(下同)。
2.3 维生素E对降温胁迫下鲫鱼血清AST、ALT、LDH、MDA的影响
在降温胁迫下,鲫鱼经不同浓度维生素E水溶液处理下血清谷草转氨酶、谷丙转氨酶、乳酸脱氢酶及丙二醛的指标变化如表4所示,随着温度的下降,0、50、200 mg/L处理组的血清谷草转氨酶活性呈先上升后下降的趋势,但100 mg/L处理组的血清谷草转氨酶活性却呈先下降后上升的趋势,在降温至10 ℃时谷草转氨酶浓度达到最大值,分别为1 192.90、792.13、458.27、700.67 U/L;除20 ℃外,其余温度点100 mg/L处理组的谷草转氨酶浓度极显著低于0、50、200 mg/L处理组(P<0.01)。0 mg/L处理组的血清谷丙转氨酶活性随着温度的下降而升高,而50、100、200 mg/L处理组的血清谷丙转氨酶则呈先下降后上升的趋势,在降温至5 ℃时谷丙转氨酶浓度达到最大值,分别为25.67、19.77、11.83、14.03 U/L;除20 ℃外,其余温度点100 mg/L处理组的谷丙转氨酶浓度极显著低于0、50、200 mg/L处理组(P<0.01)。0、200 mg/L处理组乳酸脱氢酶活性随温度下降呈升高的趋势,50 mg/L处理组鲫鱼呈先升高后降低的趋势,而100 mg/L处理组鲫鱼则呈先下降后升高的趋势,在降温至5 ℃时乳酸脱氢酶浓度达到最大值,分别为1 247、479.33、352.67、530 U/L;除20 ℃外,其余温度点100 mg/L处理组的乳酸脱氢酶浓度极显著低于0、50、200 mg/L处理组(P<0.01)。0、50、100、200 mg/L处理组鲫鱼血清丙二醛随温度的下降呈先上升后下降的趋势,在降温至10 ℃时丙二醛浓度达到最大值,分别为4.69、4.54、3.09、4.15 nmol/mL;除20 ℃外,其余温度点100 mg/L处理组的丙二醛浓度极显著低于0、50、200 mg/L处理组(P<0.01)。
表4 维生素E对降温胁迫下鲫鱼血清AST、ALT、LDH、MDA的影响
Table 4 Effect of vitamin E on serum AST, ALT, LDH and MDA of crucian carp under cooling stress
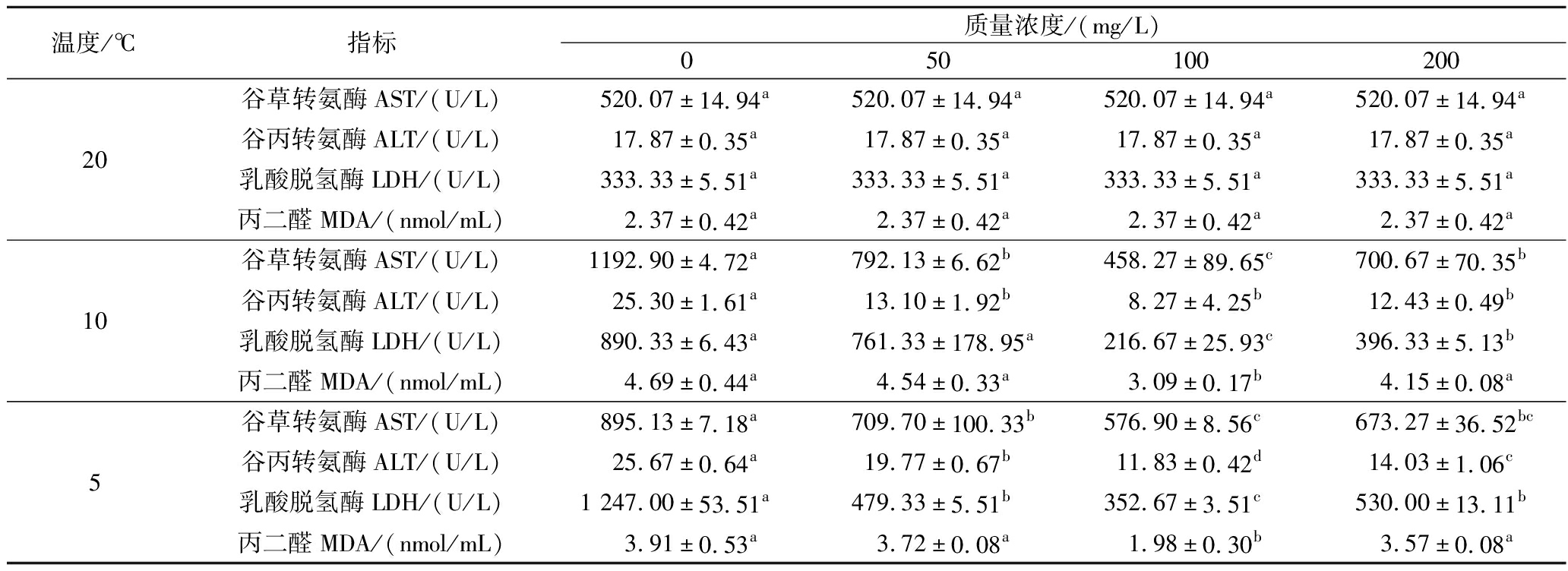
温度/℃指标质量浓度/(mg/L)05010020020谷草转氨酶AST/(U/L)520.07±14.94a520.07±14.94a520.07±14.94a520.07±14.94a谷丙转氨酶ALT/(U/L)17.87±0.35a17.87±0.35a17.87±0.35a17.87±0.35a乳酸脱氢酶LDH/(U/L)333.33±5.51a333.33±5.51a333.33±5.51a333.33±5.51a丙二醛MDA/(nmol/mL)2.37±0.42a2.37±0.42a2.37±0.42a2.37±0.42a10谷草转氨酶AST/(U/L)1192.90±4.72a792.13±6.62b458.27±89.65c700.67±70.35b谷丙转氨酶ALT/(U/L)25.30±1.61a13.10±1.92b8.27±4.25b12.43±0.49b乳酸脱氢酶LDH/(U/L)890.33±6.43a761.33±178.95a216.67±25.93c396.33±5.13b丙二醛MDA/(nmol/mL)4.69±0.44a4.54±0.33a3.09±0.17b4.15±0.08a5谷草转氨酶AST/(U/L)895.13±7.18a709.70±100.33b576.90±8.56c673.27±36.52bc谷丙转氨酶ALT/(U/L)25.67±0.64a19.77±0.67b11.83±0.42d14.03±1.06c乳酸脱氢酶LDH/(U/L)1 247.00±53.51a479.33±5.51b352.67±3.51c530.00±13.11b丙二醛MDA/(nmol/mL)3.91±0.53a3.72±0.08a1.98±0.30b3.57±0.08a
2.4 维生素E对降温胁迫下鲫鱼LAC、血清GLU、肝糖原的影响
由表5可知不同浓度维生素E水溶液处理对降温胁迫下鲫鱼血清乳酸、血清葡萄糖及肝糖原的指标影响。50 mg/L处理组鲫鱼的血清乳酸浓度随温度下降而下降,而0、100、200 mg/L处理组的血清乳酸则呈先下降后上升的趋势;除20 ℃外,其余温度点100 mg/L处理组的乳酸浓度显著低于0、50、200 mg/L处理组(P<0.05)。0 mg/L处理组鲫鱼血清葡萄糖浓度随温度的下降而下降,其他浓度维生素E处理组鲫鱼血清葡萄糖浓度呈先降低后升高的趋势,但100 mg/L处理组的鲫鱼血清葡萄糖浓度随温度的降低呈上升的趋势;除20 ℃外,其余温度点100 mg/L处理组的血清葡萄糖浓度显著高于0、50、200 mg/L处理组(P<0.05)。这可能是在较低温情况下其代谢水平和能量消耗较低,从而导致血清葡萄糖处于较高的水平,这与王琪等[12]对海鲈鱼的代谢研究结果一致。0、50 mg/L处理组肝糖原含量随温度的降低呈先下降后上升的趋势,200 mg/L处理组肝糖原含量随温度的降低而降低,但100 mg/L处理组的肝糖原含量却随温度的降低呈先升后降的趋势;除20 ℃外,其余温度点100 mg/L处理组的肝糖原浓度极显著高于0、50、200 mg/L处理组(P<0.01)。
表5 维生素E对降温胁迫下鲫鱼血清LAC、GLU、肝糖原的影响
Table 5 Effect of vitamin E on serum GLU, liver glycogen and LAC of crucian carp under cooling stress
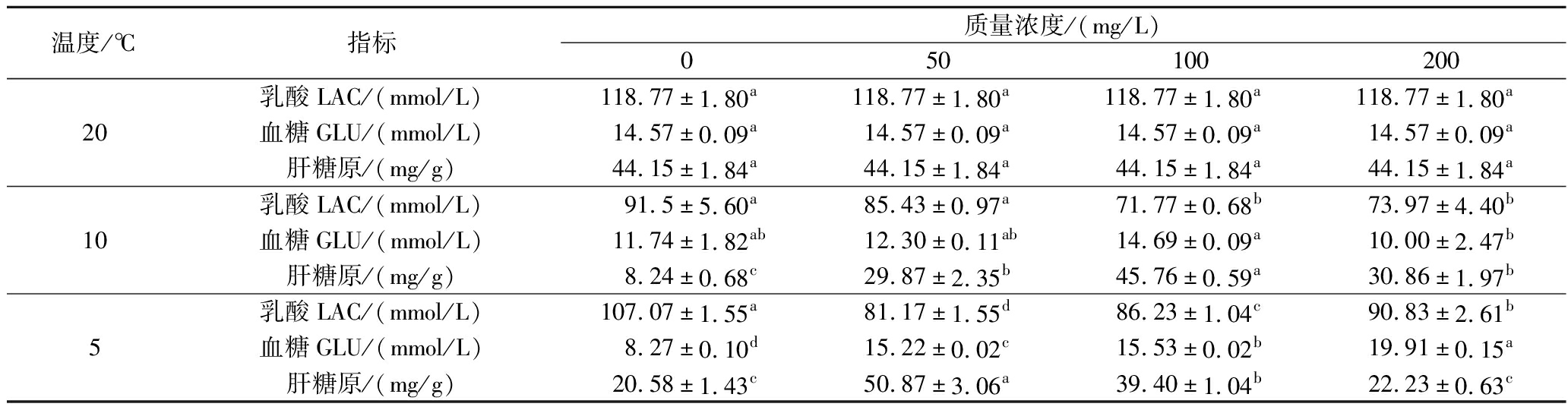
温度/℃指标质量浓度/(mg/L)05010020020乳酸LAC/(mmol/L)118.77±1.80a118.77±1.80a118.77±1.80a118.77±1.80a血糖GLU/(mmol/L)14.57±0.09a14.57±0.09a14.57±0.09a14.57±0.09a肝糖原/(mg/g)44.15±1.84a44.15±1.84a44.15±1.84a44.15±1.84a10乳酸LAC/(mmol/L)91.5±5.60a85.43±0.97a71.77±0.68b73.97±4.40b血糖GLU/(mmol/L)11.74±1.82ab12.30±0.11ab14.69±0.09a10.00±2.47b肝糖原/(mg/g)8.24±0.68c29.87±2.35b45.76±0.59a30.86±1.97b5乳酸LAC/(mmol/L)107.07±1.55a81.17±1.55d86.23±1.04c90.83±2.61b血糖GLU/(mmol/L)8.27±0.10d15.22±0.02c15.53±0.02b19.91±0.15a肝糖原/(mg/g)20.58±1.43c50.87±3.06a39.40±1.04b22.23±0.63c
2.5 维生素E对降温胁迫下鲫鱼肌肉质构及pH的影响
如表6所示,0 mg/L处理组的肌肉硬度、弹性及咀嚼性随温度的降低而升高,50 mg/L处理组的硬度随温度的下降呈先下降后上升的趋势,50 mg/L处理组的弹性、咀嚼性则随温度的下降而上升,而100、200 mg/L处理组的硬度、弹性及咀嚼性则随温度的下降呈先升后降的趋势;降至5 ℃时,0 mg/L处理组的硬度、弹性及咀嚼性均显著高于50、100、200 mg/L处理组(P<0.05),这可能是降温胁迫下并未引起鲫鱼肌肉蛋白质变性,从而令其应激反应较对照组的小,这与李卢等[9]对鲫鱼的质构研究结果一致。50 mg/L处理组的黏附性、胶黏性随温度的降低呈先降后升的趋势,而0、100、200 mg/L处理组的黏附性、胶黏性随温度的降低而降低,对照组(0 mg/L处理组)和50、100、200 mg/L处理组无显著差异(P>0.05)。0 mg/L处理组的pH值随温度的下降而上升,50、100、200 mg/L处理组的pH值则随温度的降低呈先升后降的趋势;在降温至10 ℃时,0、50、200 mg/L处理组的pH值均显著低于100 mg/L处理组(P<0.05),在降温至5 ℃时,0、50、100、200 mg/L处理组之间无显著差异(P>0.05)。
表6 维生素E对降温胁迫下鲫鱼肌肉质构及pH的影响
Table 6 Effect of vitamin E on muscle texture and pH of crucian carp under cooling stress

温度/℃指标质量浓度/(mg/L)05010020020硬度/N20.13±5.56a20.13±5.56a20.13±5.56a20.13±5.56a黏附性/N·mm1.47±0.52a1.47±0.52a1.47±0.52a1.47±0.52a胶黏性/N0.40±0a0.40±0a0.40±0a0.40±0a弹性/mm4.34±1.16a4.34±1.16a4.34±1.16a4.34±1.16a咀嚼性/mj3.4±1.33a3.4±1.33a3.4±1.33a3.4±1.33apH值6.62±0.03a6.62±0.03a6.62±0.03a6.62±0.03a10硬度/N26.42±7.01a19.51±11.97a27.72±10.28a25.60±7.47a黏附性/N·mm1.25±0.29a0.05±0.01b0.04±0.01b0.05±0.01b胶黏性/N0.40±0a0.43±0.05a0.52±0.25a0.43±0.05a弹性/mm5.68±1.61a4.61±3.24a7.96±4.09a6.21±2.14a咀嚼性/mj5.32±2.22a6.37±7.38a11.50±7.33a7.40±3.91apH值6.66±0.01c6.67±0.05c6.84±0.04a6.75±0b5硬度/N45.54±21.65a22.98±6.60b20.38±11.27b15.45±5.92b黏附性/N·mm0.75±0.39a0.05±0.01b0.04±0.02b0.06±0.02b胶黏性/N0.42±0.04a0.52±0.24a0.38±0.08a0.38±0.08a弹性/mm10.68±4.83a6.36±2.39b4.54±3.08b3.45±1.68b咀嚼性/mj14.47±10.28a9.18±5.11ab4.73±3.93b3.23±2.05bpH值6.68±0.02a6.54±0.01b6.68±0.03a6.69±0.03a
2.6 电子鼻对维生素E处理下鲫鱼肌肉的气味分析
通过电子鼻分析维生素E处理下降温至10 ℃、5 ℃时鲫鱼背部肌肉的气味指纹图谱,又称为气味雷达图。结果见图1、图2。图1为维生素E处理下降温至10 ℃时鲫鱼肌肉对电子鼻18个传感器相应信号强度的大小,除LY2/LG、LY2/G、LY2/AA、LY2/GH、LY2/gCTL和LY2/gCT传感器的信号强度不明显外,其余12个传感器的信号强度则较为明显,分别为T30/1、P10/1、P10/2、P40/1、T70/2、PA/2、P30/1、P40/2、P30/2、T40/2、T40/1、TA/2。图2为维生素E处理下降温至5 ℃时鲫鱼肌肉对电子鼻18个传感器相应信号强度的大小,除LY2/LG、LY2/G、LY2/AA、LY2/GH、LY2/gCTL和LY2/gCT传感器的信号强度不明显外,其余12个传感器的信号强度则较为明显,分别为T30/1、P10/1、P10/2、P40/1、T70/2、PA/2、P30/1、P40/2、P30/2、T40/2、T40/1、TA/2。表1列出了18个传感器对应的敏感物质类型,结合图1、2可知,LY2/LG、LY2/G、LY2/AA、LY2/GH、LY2/gCTL和LY2/gCT传感器对应的敏感物质类型如氯、氟、氮氧化合物、硫化物、丙烷和丁烷等,表明传感器对样品中上述类型的气味物质识别能力弱,而其余的传感器对碳氢化合物类、氨、氯、甲苯和胺类化合物等敏感,表明传感器对样品中上述类型的气味物质识别能力较强。
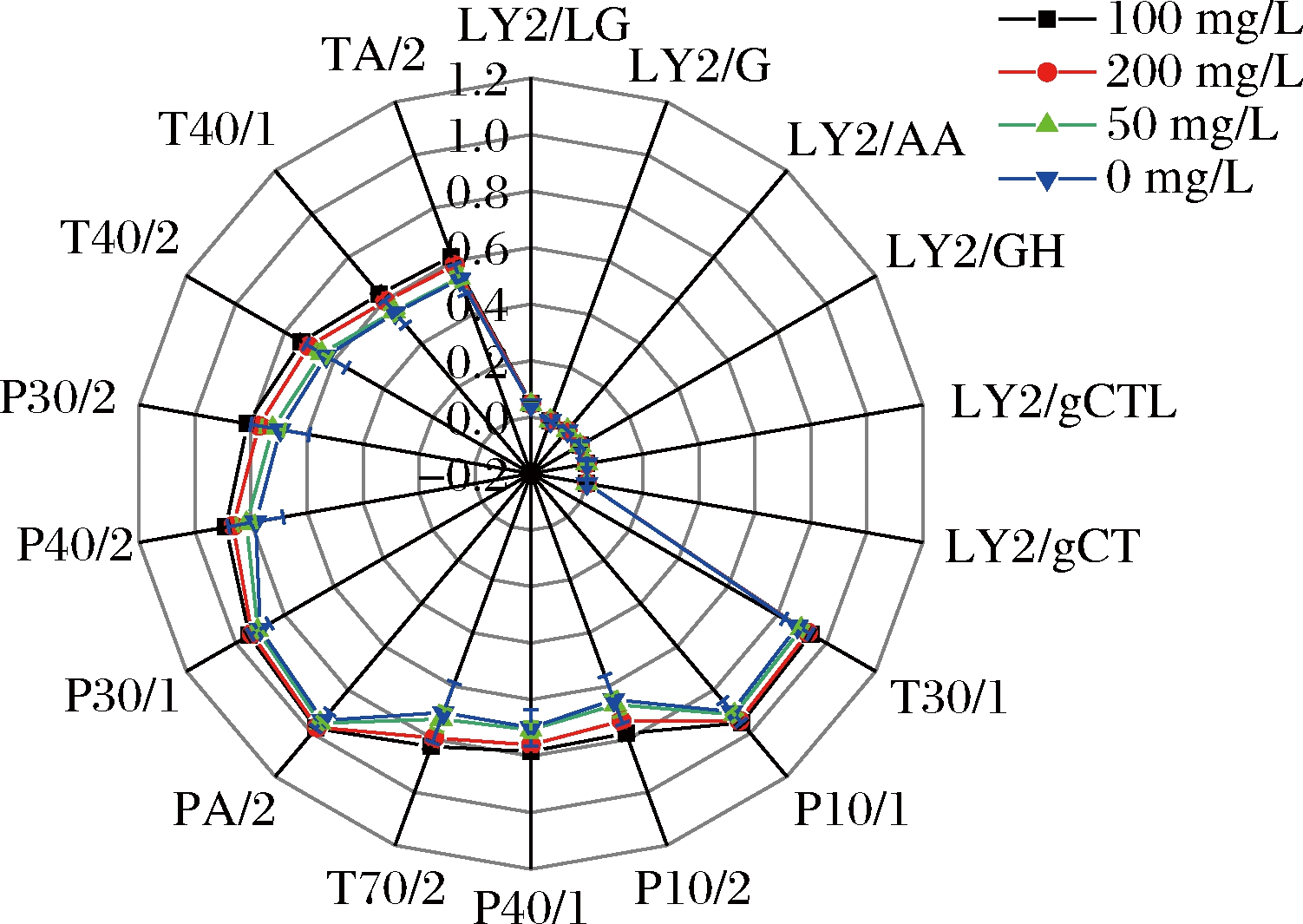
图1 维生素E处理下降温至10 ℃时鲫鱼肌肉的电子鼻雷达图
Fig.1 Electronic nose radar map of carp muscle when cooled to 10 ℃ under vitamin E treatment

图2 维生素E处理下降温至5 ℃时鲫鱼肌肉的电子鼻雷达图
Fig.2 Electronic nose radar map of carp muscle when cooled to 5 ℃ under vitamin E treatment
2.7 维生素E处理下鲫鱼肌肉的线性判别分析(linear discriminant analysis,LDA)
LDA是通过数学运算法则将高纬度的原始数据转化成低纬度方向,并对其数据进行压缩,在对样品组间点分布状态、组类间分布距离进行分析[13]。由图3可知,LDA1的贡献率为26.84%,LDA2的贡献率为65.47%,二者累积的贡献率为92.31%。由图4可知,LDA1的贡献率为33.32%,LDA2的贡献率为64.14%,二者累积的贡献率为97.46%。图3、图4中各组样品均无重叠,区分明显,表明电子鼻可以区分不同浓度维生素E水溶液处理对鲫鱼的肌肉风味的影响。
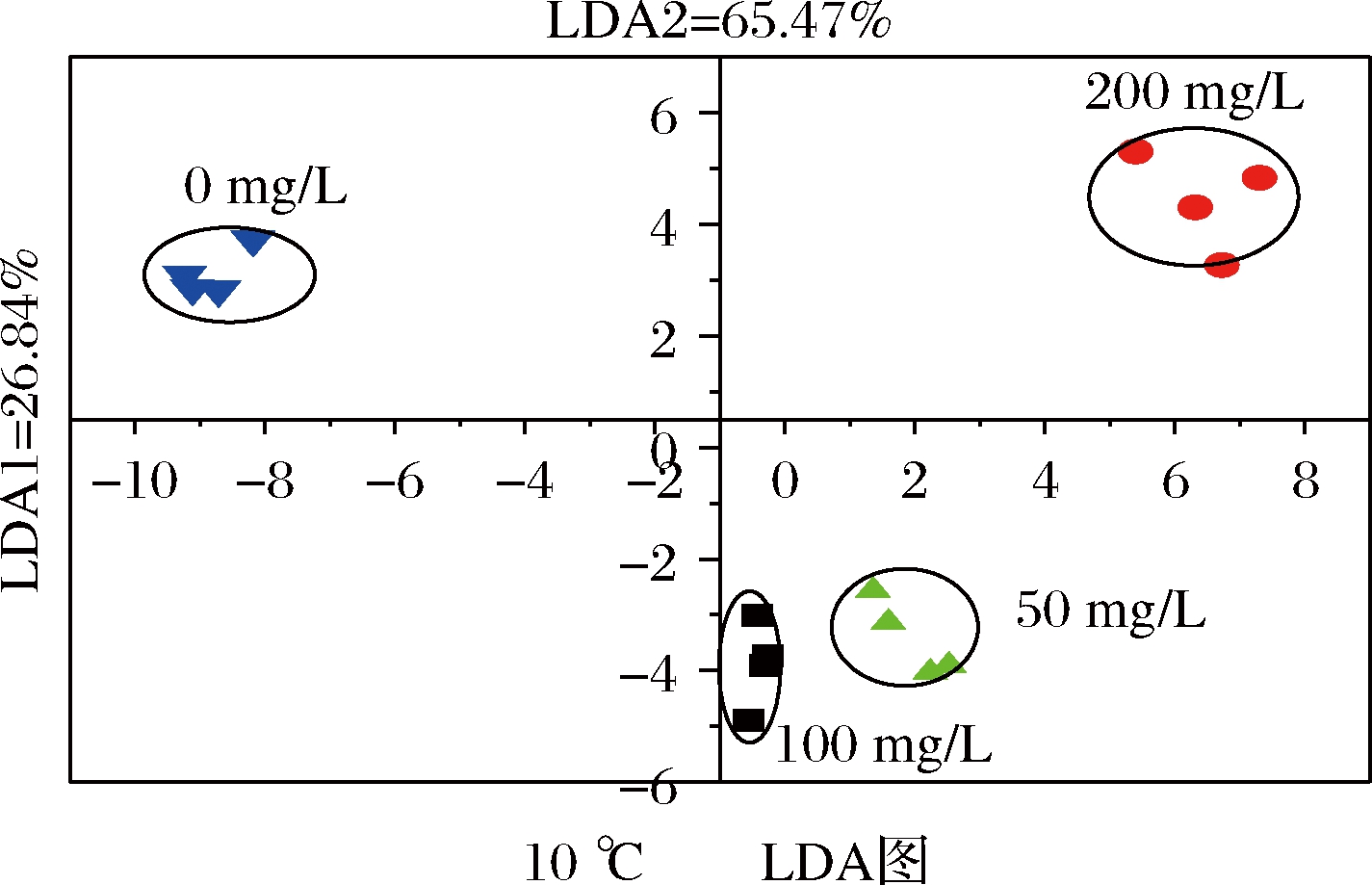
图3 维生素E处理下降温至10 ℃时鲫鱼肌肉的LDA图
Fig.3 LDA diagram of crucian carp muscle when cooled to 10 ℃ under vitamin E treatment
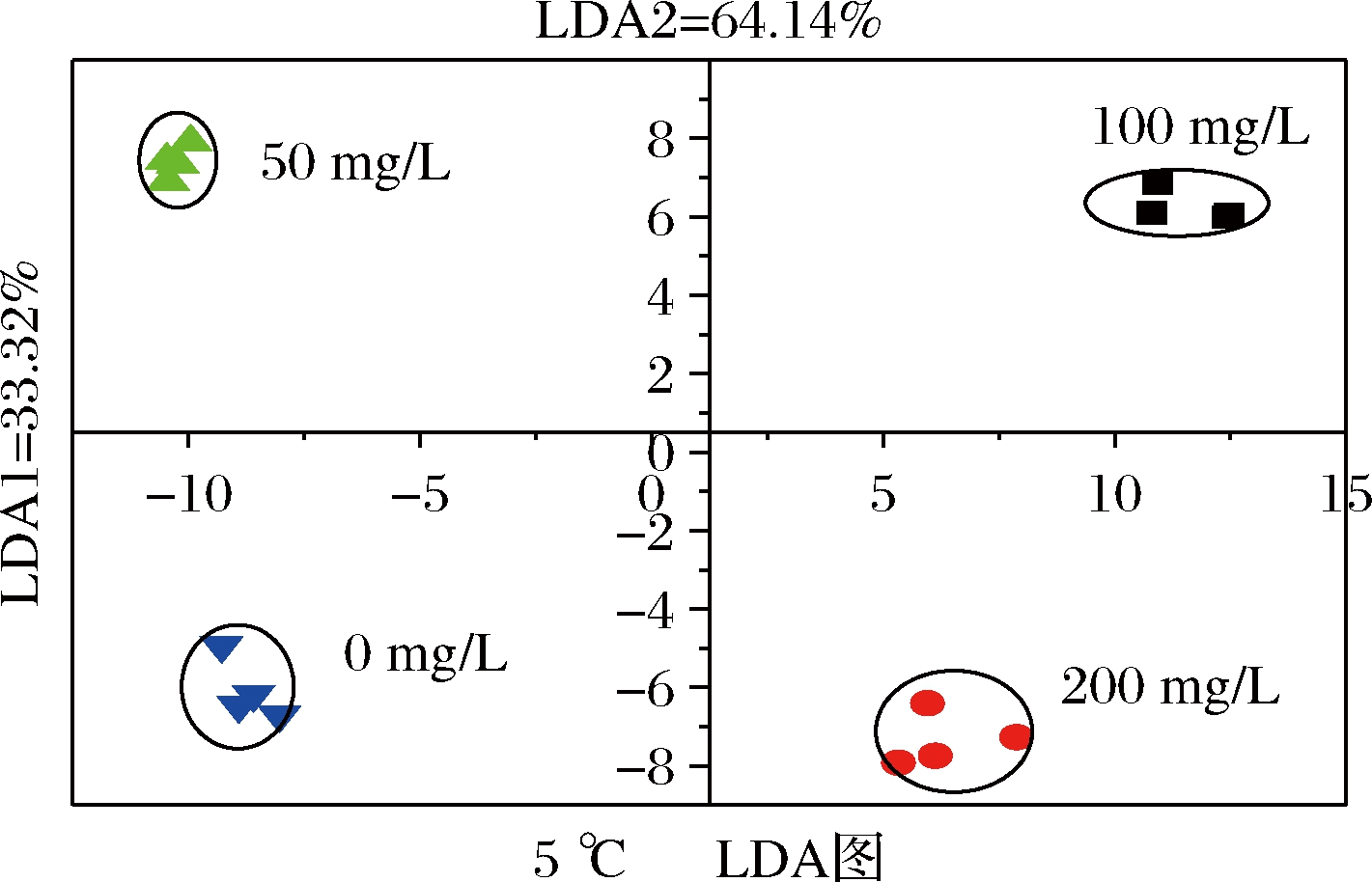
图4 维生素E处理下降温至5 ℃时鲫鱼肌肉的LDA图
Fig.4 LDA diagram of crucian carp muscle when cooled to 5 ℃ under vitamin E treatment
3 讨论
3.1 维生素E对降温胁迫下鲫鱼血清生化指标的影响
皮质醇和肾上腺素是鱼体主要的应激激素,是直接判断机体是否发生应激反应以及机体应激反应程度的重要指标[14-15]。本研究中,在降温胁迫下,0、50、100、200 mg/L处理组的皮质醇和肾上腺素均显著升高。有研究表明,皮质醇的含量与降温的幅度呈正相关,随温度的降低而含量上升[16]。CURRIE等[17]研究发现,鳟鱼在受到刺激后,其机体肾上腺素含量会显著上升。降温过程中,100 mg/L处理组中鲫鱼的血清皮质醇、肾上腺素含量均显著低于0、50、200 mg/L处理组(P<0.05),表明经过浓度为100 mg/L的维生素E处理的鲫鱼,其机体的抗应激能力得到显著增强。
AST和ALT是指示肝功能的重要指标,在正常情况下,这2个酶主要存在于机体的肝细胞中,但在机体组织细胞受损时,酶会从细胞流进血液中,使血清中谷草转氨酶和谷丙转氨酶的含量高于正常值[18-20]。本研究中,随着温度的下降,各组鲫鱼血清中的谷草转氨酶、谷丙转氨酶均高于正常值,表明低温胁迫下,机体的肝功能均受到了损伤。而在降温过程中,100 mg/L处理组的谷草转氨酶、谷丙转氨酶活性均极显著低于0、50、200 mg/L处理组(P<0.01),表明浓度为100 mg/L的维生素E处理能够保护鲫鱼的肝组织细胞,使其在低温胁迫下减少损伤。LDH是糖代谢中将丙酮酸催化成乳酸的一类酶,当鱼受到外界胁迫时,会引起乳酸脱氢酶的活性显著升高[21]。本实验结果显示,100 mg/L处理组的乳酸脱氢酶活性极显著低于0、50、200 mg/L处理组(P<0.01),表明通过质量浓度为100 mg/L的维生素E处理能够在很大程度上减轻鱼体因胁迫所带来的的损伤。MDA是一种脂质过氧化物,能够反映出机体的氧化损伤程度[22]。当鱼类在降温过程中,机体一直处于不利环境时,机体的抗氧化防御能力会被破坏,使脂质过氧化程度加深,血清中的MDA含量则表现为显著高于正常值[23]。本研究中,100 mg/L处理组的MDA含量极显著低于0、50、200 mg/L处理组(P<0.01),表明100 mg/L的维生素E处理提高了降温胁迫下鲫鱼的抗氧化防御能力。
本研究中,在降温过程中,100 mg/L处理组的糖原含量极显著高于0、50、200 mg/L处理组(P<0.01),而100 mg/L处理组的乳酸含量显著低于0、50、200 mg/L处理组(P<0.05),这与珍珠龙胆石斑鱼的研究一致[4],表明鲫鱼经100 mg/L的维生素E处理后提高了机体对降温胁迫的耐力。本试验中,在降温过程中,100 mg/L处理组的血糖含量显著高于0、50、200 mg/L处理组(P<0.05),表明在低温胁迫下,鲫鱼通过血糖代谢增加机体抵御寒冷的能量,而维生素E的处理提高了机体面对胁迫的耐力,故含量高于0、50、200 mg/L处理组,这与大菱鲆的研究一致[10]。
3.2 维生素E对降温胁迫下鲫鱼肌肉品质指标的影响
质构指标是指食物中视觉与触觉的效应,常用于评价食物的营养价值。研究表明,在氧化应激条件下,鱼类肌肉组织的改变会影响肌肉质构特性,从而影响鱼肉品质[24]。本研究中,降温过程中,0 mg/L处理组的硬度、弹性、咀嚼性显著高于50、100、200 mg/L处理组(P<0.05),而黏附性、胶黏性和对照组差异不显著(P>0.05),表明经维生素E处理的鲫鱼肌肉品质在一定程度上要优于对照组(0 mg/L处理组),其结果与鲫鱼一致[9]。鱼肉的pH值是一个反映肉质参数的重要指标,在无水保活过程中,乳酸在肌肉中累积,造成鱼肉的pH值下降[25]。本研究中,在降温至10 ℃时,0、50、200 mg/L处理组的pH值均显著低于100 mg/L处理组(P<0.05),同时结合表5中乳酸的数据进行分析,初步认为在降温胁迫下,鲫鱼因体内酶作用产生大量乳酸,从而导致pH下降,而经100 mg/L维生素E处理的鲫鱼能够缓解胁迫所带来的影响,减少乳酸的产生,从而减缓pH的下降幅度。
3.3 维生素E对降温胁迫下鲫鱼肌肉风味的影响
电子鼻可对样品无损的情况下快速识别出样品的风味[26]。本研究中,采用电子鼻收集了经不同浓度维生素E水溶液处理的鲫鱼在降温至10 ℃时及降温至5 ℃时的鱼肉气味指纹图。由降温至10 ℃时鲫鱼肌肉的LDA图可知,50 mg/L处理组与100 mg/L处理组距离相近,说明在降温至10 ℃时,50 mg/L与100 mg/L的维生素E水溶液处理对鲫鱼肌肉风味的影响变化不大;后由降温至5 ℃时鲫鱼肌肉的LDA图可知,50 mg/L处理组处于第三象限,而100 mg/L处于第一象限,两组距离相距远,这可能是随着温度的降低,鲫鱼受到的应激程度增大,50 mg/L与100 mg/L的维生素E水溶液处理对鲫鱼的作用增大,因维生素E水溶液的浓度不一样,其对鲫鱼处理的效果也就不一样,进而导致对鲫鱼肌肉风味的影响不同,但并不能说明维生素E水溶液处理对鱼肉风味的好坏。若要辨别维生素E水溶液处理对鱼肉风味是否是有利的影响,还需继续进行下一步的实验分析。
4 结论
通过研究水体中添加维生素E对鲫鱼降温胁迫下生理生化、肌肉质构指标变化及肌肉风味影响,得出质量浓度为100 mg/L维生素E处理后的鲫鱼保活效果最佳,无水保活72 h,存活率达100%;肝功能受损及应激反应得到缓解,能量代谢及肌肉品质更为稳定,鱼肉风味也具有一定的影响,通过维生素E处理的方式能够使鲫鱼诱导休眠产生的胁迫得到缓解。下一步可以借助蛋白质组学技术,研究维生素E缓解鱼类应激的作用机理。
[1] 张坤, 刘书成, 范秀萍, 等.鱼类保活运输策略与关键技术研究进展[J].广东海洋大学学报, 2021, 41(5):137-144.
ZHANG K, LIU S C, FAN X P, et al.Review on strategies and key technologies of live fish transportation[J].Journal of Guangdong Ocean University, 2021, 41(5):137-144.
[2] ZHANG Y J, WANG W S, YAN L, et al.Development and evaluation of an intelligent traceability system for waterless live fish transportation[J].Food Control, 2019, 95:283-297.
[3] 刘骁, 谢晶, 黄硕琳.鱼类保活运输的研究进展[J].食品与发酵工业, 2015, 41(8):255-260.
LIU X, XIE J, HUANG S L.Advances research of transportation to keep fish alive[J].Food and Fermentation Industries, 2015, 41(8):255-260.
[4] 范秀萍. 珍珠龙胆石斑鱼低温休眠无水保活的胁迫响应与机制研究[D].湛江:广东海洋大学, 2019.
FAN X P.Stress Response and mechanism of waterless preservation after low-temperature induced dormancy on pearl gentian grouper(♀Epinephelus fuscoguttatus×♂Epinephelus lanceolatus)[D].Zhanjiang:Guangdong Ocean University, 2019.
[5] 王磊. 维生素E的功能[J].当代畜禽养殖业, 2021(6):28-29.
WANG L.Functions of vitamin E [J].Modern Animal Husbandry, 2021(6):28-29.
[6] WANG L G, MA B H, CHEN D X, et al.Effect of dietary level of vitamin E on growth performance, antioxidant ability, and resistance to Vibrio alginolyticus challenge in yellow drum Nibea albiflora[J].Aquaculture, 2019, 507:119-125.
[7] QIANG J, WASIPE A, HE J, et al.Dietary vitamin E deficiency inhibits fat metabolism, antioxidant capacity, and immune regulation of inflammatory response in genetically improved farmed tilapia (GIFT, Oreochromis niloticus) fingerlings following Streptococcus iniae infection[J].Fish &Shellfish Immunology, 2019, 92:395-404.
[8] PAN J H, FENG L, JIANG W D, et al.Vitamin E deficiency depressed fish growth, disease resistance, and the immunity and structural integrity of immune organs in grass carp (Ctenopharyngodon idella):Referring to NF-κB, TOR and Nrf2 signaling[J].Fish &Shellfish Immunology, 2017, 60:219-236.
[9] 李卢, 张长峰, 吴佳静, 等.高压对鲫鱼无水保活的影响[J].食品工业科技, 2020, 41(20):261-265.
LI L, ZHANG C F, WU J J, et al.Effect of high pressure on the water-free survival of crucian carp[J].Science and Technology of Food Industry, 2020, 41(20):261-265.
[10] 蒋乐霞, 华茂圳, 张长峰, 等.维生素C对降温胁迫下大菱鲆生理生化指标及其肉质的影响[J].福建农业学报, 2022, 37(10):1256-1265.
JIANG L X, HUA M Z, ZHANG C F, et al.Effects of vitamin C pretreatment on physiology, biochemistry, and meat quality of Scophthalmus maximus under cold stress[J].Fujian Journal of Agricultural Sciences, 2022, 37(10):1256-1265.
[11] 陈东杰, 姜沛宏, 张长峰, 等.基于电子鼻与统计学方法的海鲈鱼新鲜度品质预测[J].食品工业科技, 2018, 39(17):235-239.
CHEN D J, JIANG P H, ZHANG C F, et al.Freshness quality prediction of Latelabrax japonicas based on electronic nose and statistic analysis[J].Science and Technology of Food Industry, 2018, 39(17):235-239.
[12] 王琪, 梅俊, 谢晶.低温保活运输对海鲈鱼应激及品质的影响[J].中国食品学报, 2022, 22(7):203-213.
WANG Q, MEI J, XIE J.Effects of low temperature and alive transportation on stress and meat quality of sea bass(Lateolabrax maculatus)[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(7):203-213.
[13] 沈秋霞, 王晓君, 卢朝婷, 等.基于电子鼻技术对真空包装三文鱼片的新鲜度评价[J].食品与发酵工业, 2018, 44(10):241-247.
SHEN Q X, WANG X J, LU C T, et al.Evaluation of freshness of vacuum packaged salmon fillets by electronic nose technique[J].Food and Fermentation Industries, 2018, 44(10):241-247.
[14] 刘佳, 卢玉婷, 王楠, 等.饲料中添加维生素C对鱼类生长、免疫及抗应激能力影响的研究进展[J].水产科技情报, 2020, 47(5):289-291;300.
LIU J, LU Y T, WANG N, et al.Effects of dietary vitamin C on growth, immunity and antistress capability of fish:A review[J].Fisheries Science &Technology Information, 2020, 47(5):289-291;300.
[15] GEORGE N, PETER V S, SUBHASH PETER M C.Physiologic implications of inter-hormonal interference in fish:Lessons from the interaction of adrenaline with cortisol and thyroid hormones in climbing perch (Anabas testudineus Bloch)[J].General and Comparative Endocrinology, 2013, 181:122-129.
[16] 龙勇, 葛国栋, 李西西, 等.鱼类低温应激反应的调控机制[J].水生生物学报, 2021, 45(6):1405-1414.
LONG Y, GE G D, LI X X, et al.Regulation mechanisms for cold stress responses of fish[J].Acta Hydrobiologica Sinica, 2021, 45(6):1405-1414.
[17] CURRIE S, REDDIN K, MCGINN P, et al.β-Adrenergic stimulation enhances the heat-shock response in fish[J].Physiological and Biochemical Zoology, 2008, 81(4):414-425.
[18] 张曦文, 吴垠, 贺茹靖, 等.循环水养殖模式下养殖密度对青石斑鱼生长及生理指标的影响[J].大连海洋大学学报, 2012, 27(6):518-522.
ZHANG X W, WU Y, HE R J, et al.The effects of stocking density on growth and physiological indices of grouper Epinephelus awoara in recirculating aquaculture[J].Journal of Dalian Ocean University, 2012, 27(6):518-522.
[19] 陈晨, 黄峰, 舒秋艳, 等.共轭亚油酸对草鱼生长、肌肉成分、谷草转氨酶及谷丙转氨酶活性的影响[J].水生生物学报, 2010, 34(3):647-651.
CHEN C, HUANG F, SHU Q Y, et al.Effects of dietary conjugated linoleic acids on growth performance, muscle composition, ast and alt activities in serum in juveniles grass carp (Ctenopharyngodon idellus)[J].Acta Hydrobiologica Sinica, 2010, 34(3):647-651.
[20] 程佳佳, 李吉方, 温海深, 等.养殖密度对杂交鲟幼鱼生长、肌肉组分和血液生理生化指标的影响[J].中国水产科学, 2015, 22(3):433-441.
CHENG J J, LI J F, WEN H S, et al.Effect of stocking density on growth, muscle composition and blood parameters of hybrid sturgeon juveniles[J].Journal of Fishery Sciences of China, 2015, 22(3):433-441.
[21] 张坤, 周结倩, 范秀萍, 等.海水温度对金鲳鱼保活过程中应激和代谢的影响[J].包装工程, 2022, 43(9):92-99.
ZHANG K, ZHOU J Q, FAN X P, et al.Effect of temperature on stress and metabolism of golden pompano during keep-alive transportation[J].Packaging Engineering, 2022, 43(9):92-99.
[22] 陆泽峰, 黄和, 黄湘湄, 等.低氧胁迫对珍珠龙胆石斑鱼氧化应激及能量代谢的影响[J].广东海洋大学学报, 2022, 42(1):13-19.
LU Z F, HUANG H, HUANG X M, et al.Effects of hypoxic stress on antioxidant and energy metabolism of hybrid grouper(Epinephelus fuscoguttatus♀ × Epinephelus lanceolatus♂)[J].Journal of Guangdong Ocean University, 2022, 42(1):13-19.
[23] 李豫, 黄建盛, 陈有铭, 等.低温胁迫对军曹鱼幼鱼血清生化指标、肝脏抗氧化酶活性及凋亡相关基因表达量的影响[J].广东海洋大学学报, 2022, 42(5):18-26.
LI Y, HUANG J S, CHEN Y M, et al.Effects of low-temperature stress on serum biochemical, antioxidant enzymes activities and apoptosis-related gene expression in liver of juvenile cobia(Rachycentron canadum)[J].Journal of Guangdong Ocean University, 2022, 42(5):18-26.
[24] 李艳青, 孔保华, 夏秀芳, 等.羟自由基氧化对鲤鱼肌原纤维蛋白乳化性及凝胶性的影响[J].食品科学, 2012, 33(9):31-35.
LI Y Q, KONG B H, XIA X F, et al.Effect of hydroxyl radical oxidation on emulsifying and gel properties of common carp(Cyprinus carpio) myofibrillar protein[J].Food Science, 2012, 33(9):31-35.
[25] 曹杰, 王琪, 梅俊, 等.有水与无水保活运输对大菱鲆生理应激及鱼肉品质的影响[J].水产学报, 2021, 45(7):1034-1042.
CAO J, WANG Q, MEI J, et al.Effects of transport in water and waterless transport on physiological stress and flesh quality of turbot(Scophthalmus maximus)[J].Journal of Fisheries of China, 2021, 45(7):1034-1042.
[26] 孙灵霞, 李苗云, 靳春杰, 等.基于电子鼻和气质联用技术分析不同品牌道口烧鸡的香气差异性[J].食品与发酵工业, 2020, 46(6):238-243.
SUN L X, LI M Y, JIN C J, et al.Analysis of the aroma of different brands Daokou stewed chicken by electronic nose and GC-MS[J].Food and Fermentation Industries, 2020, 46(6):238-243.