牦牛肉营养价值丰富,属于高蛋白、低脂肪类食品,富含人体必需的氨基酸和多不饱和脂肪酸,是肉类中具有高生物学价值的良好蛋白质来源。但是牦牛肉存在肉色深、嫩度较差[1]并且肌红蛋白消化率较低的问题。
肌红蛋白是肉类蛋白的重要组成部分,其化学状态决定了肉类的颜色[2]。以往的研究主要关注肌红蛋白状态与脂质氧化和肉色的关系。然而,基于不同目的的研究表明,肌红蛋白的低消化率是由于它的“刚性”结构[3]和较低的胃蛋白酶消化敏感性。目前研究者大多采用辅助消化法改善肌红蛋白的消化率,发现离心辅助常规胰蛋白消化[4]以及植物酚衍生化的肌红蛋白[5]其消化率均受到不利影响,盐(NaCl)[6]处理后的肌红蛋白与胃蛋白酶/胰蛋白酶的结合方式也发生了改变。这些传统工艺通过改变肌红蛋白的血红素结构和疏水腔,进而影响肌红蛋白的消化率,但是对于肉类食用品质中色度、嫩度、脂肪氧化的改善效果并不明显。KIM等[7]发现乳酸盐在提高肉的亮度、红度、抗菌性能以及质地方面发挥着关键作用。张玉斌等[8]经过筛选不同乳酸钙浓度,发现注射0.06 g/mL(占肉样5%)的乳酸钙,在4~7 d的贮藏期内显著提高了肉色红度值。然而,乳酸钙对于其他肉品质是否产生影响,未作出评价。
超高压(high pressure, HP),也称高静水压,是一种食品保鲜的非热技术[9],可最大程度保留食品的营养成分,同时降低食品加工中的有害物质。目前,超高压技术在肉品工业中的应用主要目的是为了抑制肉品中李斯特菌[10]和大多数腐败微生物的生长,从而延长货架期。然而,近几年大多数研究关注经超高压处理蛋白在消化过程中结构的变化以及相应酶促反应速率大小,发现在超高压处理过程中,食品中的低能键(离子键、氢键)发生较大波动[11],导致肌红蛋白比天然蛋白向更小体积变化的同时影响肌红蛋白的酶促反应以及结合构象。这种变化可能有助于提高蛋白质在胃部的消化率[12],但是,关于超高压联合乳酸钙处理对肌红蛋白消化特性以及对牛肉食用品质的影响研究较少。
本研究旨在通过测定不同压力联合乳酸钙处理下牦牛肉食用品质以及肌红蛋白消化率的变化,应用分子对接和动力学模拟评估在食用品质较优压力下的肌红蛋白与胃蛋白酶结合模式以及氢键强弱变化,结合稳定性等。这些结果可能有助于了解肌红蛋白的消化行为,并开发提高牦牛肉食用品质以及肌红蛋白消化率和营养价值的技术。
1 材料与方法
1.1 材料与试剂
本试验从武威天润白牦牛绿色食品开发有限公司购买原料肉,所屠宰的牦牛皆为36~48月龄大小,检验检疫合格、鉴定生长发育良好、健康无病的牦牛,挑选10头体重在300~400 kg的公牛胴体,以背最长肌为样本,牛肉被顺着肌纤维切成1 cm薄片状,分割成100 g左右的肉块,保持相对低温,泡沫箱运回实验室。
EDTA、KH2PO4、H4KO4P、BCA蛋白浓度测定试剂盒、乳酸钙,北京索莱宝科技有限公司;肌红蛋白(CAS No.100684-32-0)、胃蛋白酶来自猪胃黏膜,活性为2 500 U/mg(CAS No.9001-75-6),合肥博美生物公司。
1.2 主要仪器
HC 3204电子天平,德国花潮高科控股集团限公司;TA.XT Express质构仪;BBS-DDC超净工作台,济南鑫贝西生物技术有限公司;testo205 pH计,德国仪器国际贸易(上海)有限公司;TG20G台式高速冷冻离心机,无锡首象科技有限公司;CR-410色差计,日本柯尼卡美能达公司;HH-420水浴锅,上海力辰科技有限公司;752紫外可见分光光度计,上海菁华光谱仪器有限公司;CQC2L-600 超高压设备,北京速原中天股份有限公司;MZ-420真空包装机,泉州茂合机械有限公司;FJ200-SH均质机,上海沪析实业有限公司。
1.3 试验方法
1.3.1 试验设计
肉样随机分为5组,均匀切分100 g,注射0.06 g/mL乳酸钙或生理盐水(空白对照),肉样与注射液按20∶1(g∶mL)处理后放入聚乙烯袋中真空密封,经过0.1(对照)、100、200、300、400 MPa 4个梯度的压力,常温,保压15 min处理。
1.3.2 pH
测定pH值,首先一手持pH计,一手固定肉样,探针垂直插入后,观察pH计的电极与肌肉组织完全、充分地接触,待闪动的pH读数稳定后,记录数据,每个肉样重复测定3~6次后取其平均值。
1.3.3 色泽的测定
色泽参照罗辉等[13]的方法进行测定。
1.3.4 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值
参考郑娅等[14]的方法进行测定,最后按照公式(1)计算TBARS:
TBARS=A532×9.48
(1)
式中:TBARS,硫代巴比妥酸反应物含量,mg MDA/kg;A532,溶液的吸光值,9.48,常数。
1.3.5 蒸煮损失
参考吴强等[15]方法,将肉样切割成10.0 cm×10.0 cm×5.0 cm大小,约100 g的肉块,第一次称重m1,然后放入蒸煮袋中,用夹子夹住,使其完全浸入85 ℃水温的水浴锅中,煮至中心温度达到70 ℃,冷却30 min, 吸水纸吸干肉面水分,第二次称重m2。按公式(2)计算蒸煮损失:
蒸煮损失![]()
(2)
1.3.6 剪切力
参照杨玉莹等[16]的方法测定剪切力。
1.3.7 肌红蛋白含量
使用分光光度计在503、525、557、575、582 nm处获得肌红蛋白样品的吸光度[17]然后按照公式(3)~(5)计算DeoMb、OxyMb、和MetMb各自的百分含量:
DeoMb/%=-0.543R1+1.594R2+0.522R3-1.329
(3)
OxyMb/%=0.722R1-1.432R2-1.659R3+2.599
(4)
MetMb/%=-0.159R1-0.085R2+1.262R3-0.520
(5)
式中:R1=A582/A525,R2=A557/A525,R3=A503/A525。
1.3.8 消化性能测量
根据消化前后样品中的粗蛋白含量,计算胃、肠道肌红蛋白样品的消化率[18]如公式(6)、公式(7)所示:
胃蛋白消化率![]()
(6)
肠道蛋白质消化率![]()
(7)
式中:ρ0、ρ1,胃消化前后样品的蛋白浓度,ρ2、ρ3,肠消化前后样品的蛋白浓度。肌红蛋白溶液消化过程中的初始蛋白质量浓度为4 mg/mL。由于加入了SGF和SIF,它被稀释至2和1 mg/mL,分别称为ρ0和ρ2,ρ1和ρ3采用BCA试剂盒测定法测定。
1.3.9 分子对接和分子动力学模拟
1.3.9.1 同源建模与分子对接
牛肌红蛋白氨基酸序列(NP_776306.1)获自NCBI并作为模板,使用SWISS-MODEL服务器进行同源建模并评估建模结构的质[19]。随后选择最佳模型进行进一步分析。分子对接由ZDOCK(https://zdock.umassmed.edu/)完成。牛肌红蛋白结构来自同源建模,并经不同压力下100 ns MD处理,获得处理后结构。胃蛋白酶(PDB ID:3UTL)来自RSCB 数据库 (http://www.rscb.org/pdb)。对接结果通过Pymol和LigPlot+进行可视化。
1.3.9.2 分子动力学模拟
分子动力学模拟基于Gromacs 2020.6程序包[20]。水模型为TIP4P,力场选择Charmm 36。创建十二面体周期性盒子,在三个空间维度上设置边界条件。蛋白距离盒子最小距离为1.2 nm。简单来说,蛋白配体复合物在经过能量最小化-模拟生理环境-能量最小化过程后,蛋白的骨架原子被限制在确定位置而溶剂自由扩散。设置耦合温度为300 K,通过EnerPres校正色散,Parrinello-Rahman作为压力控制器。使用LINCS方法约束所有键,长程静电作用方法为PME(particle mesh ewald),静电作用截断值为1.0 nm。在预平衡模拟后进行100 ns模拟。单独模拟牛肌红蛋白的参考压力分别为0.1和300 MPa。对接复合物的模拟采用0.1 MPa。计算结束收集了409 G数据。
1.4 数据统计分析
每个试验至少做3次重复。采用SPSS 19.0软件比较数据间的显著性差异,其中P<0.05表示差异显著。通过Gromacs 2020.6程序统计蛋白的均方根偏差(root-mean-square deviation,RMSD),相互作用氢键数量。通过Pymol进行可视化。采用Origin 8.0软件进行图形绘制。
2 结果与分析
2.1 pH
牛肉的pH变化曲线如图1所示,整体上pH呈现先上升后下降的趋势,在6.28~6.74,随着压力增加,在300 MPa处达到最高值,随后下降。在同一压力下,注射乳酸钙组的pH值显著高于空白组(P<0.05)。综上表明,在300 MPa联合乳酸钙处理的条件下,有利于牛肉pH值的增加,维持在胃部消化的中性条件附近。
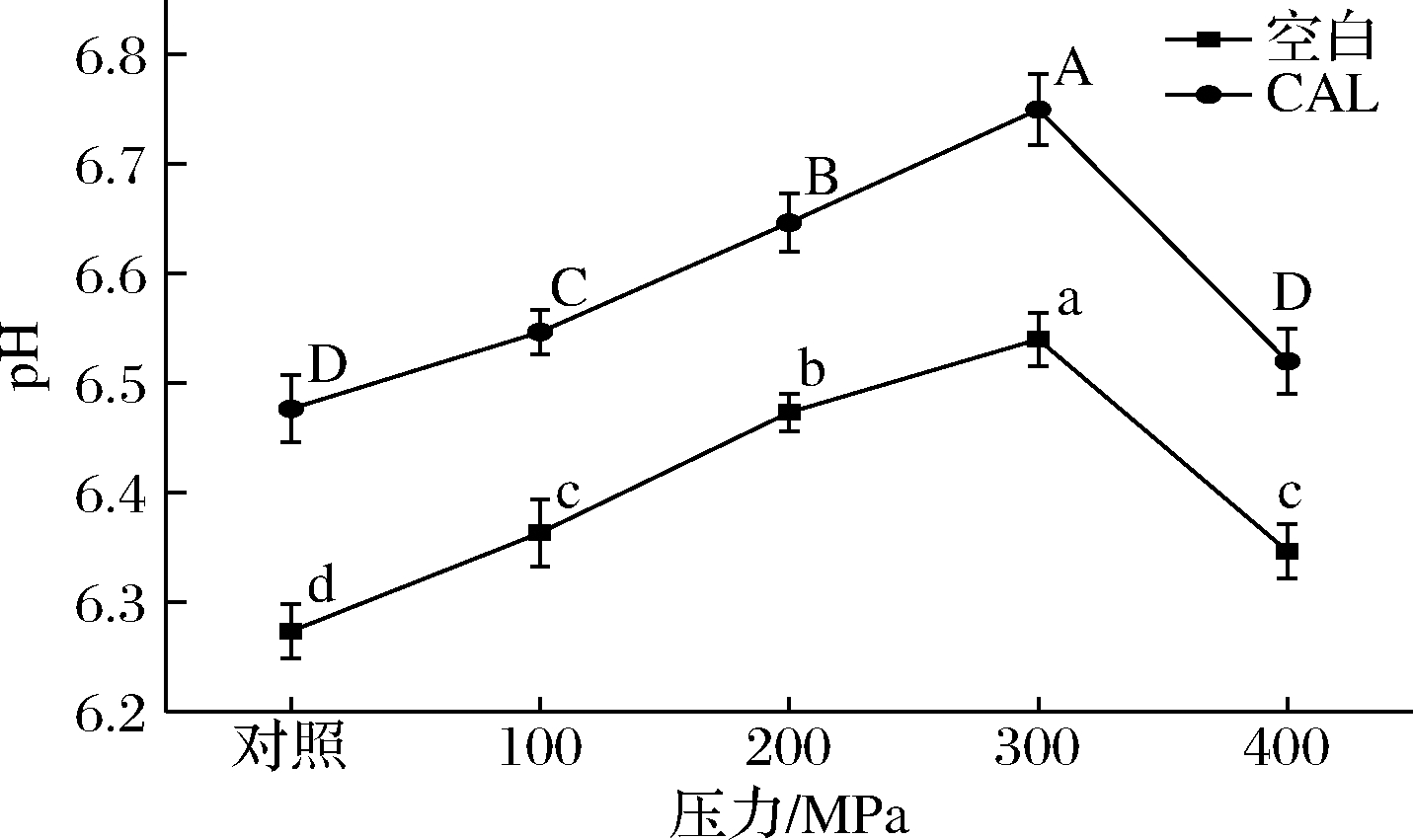
图1 超高压和乳酸钙处理对牛肉pH的影响
Fig.1 Effect of ultra-high pressure and calcium lactate treatment on beef pH
注:A~D乳酸钙组在不同压力下的差异性显著(P<0.05);a~d空白组在不同压力下的差异性显著(P<0.05);CAL-乳酸钙组,空白-生理盐水组,对照-0.1 MPa(下同)。
牦牛宰后肌肉内进行无氧糖酵解反应,产生并积累乳酸[21],从而使得pH下降。pH下降的速率和程度与牛肉的质量和新鲜度相关。在图1结果中,超高压联合乳酸钙处理后,在0.1~300 MPa,pH值较空白处理组仍保持较高值且有上升,这可能是由于解折叠引起的蛋白质酸性基团减少所致[22]。此外,随着压力增高可能导致细胞内缓冲溶液渗出到细胞外空间或改变蛋白质结构并释放碱性基团,这些因素会使得pH值升高。同时,高压处理增加pH值,会使牛肉中蛋白质偏离等电点[23]。
2.2 色度
牦牛屠宰充分放血后,主要呈色物质是肌红蛋白,其形态有3种,分别是脱氧肌红蛋白、氧合肌红蛋白和高铁肌红蛋白[24],由图2可知,随着压力的增大,空白组和CAL组的L*值、a*值均匀增长,b*值降低。对于2个处理组来说,乳酸钙处理的效果变化趋势更显著。在300 MPa压力下出现拐点,说明300 MPa的压力联合乳酸钙处理,提高了牦牛肉的亮度和红度,降低了黄度值。表明乳酸钙协同超高压有利于红度值的保持而且提高肌肉的亮度。进一步可以解释为乳酸钙的加入使得乳酸+LDH+NAD体系进一步强化运转[25],通过NADH再生从而提高了高铁肌红蛋白还原能力,进而使得红度值提高。牛肉亮度的改善可以解释为300 MPa压力处理牛肉后,导致珠蛋白变性或血红素基团的移位,同时肌肉纤维直径减小使得光散射特性发生变化[26]。整体上来说,300 MPa超高压联合乳酸钙处理赋予牛肉良好的色泽感官。
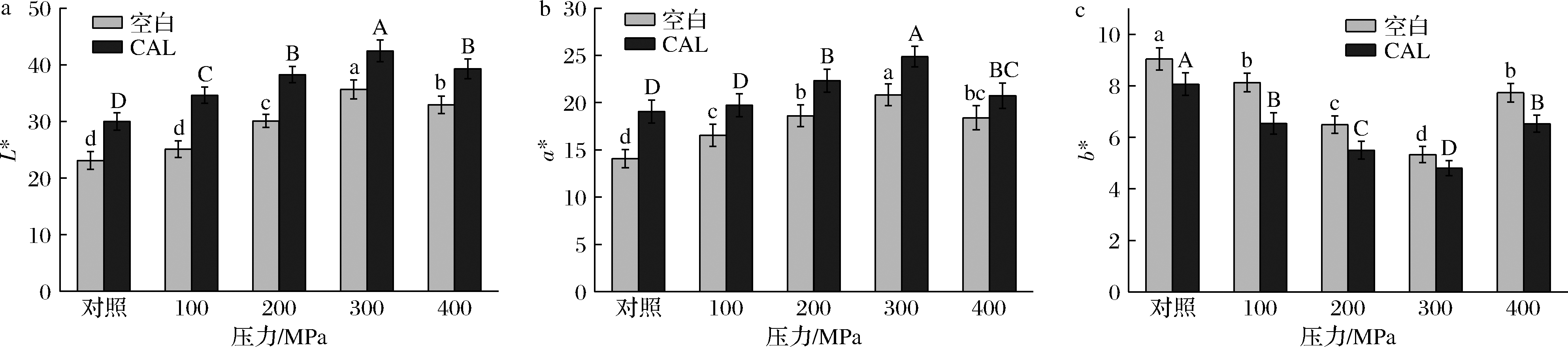
a-L*;b-a*;c-b*
图2 超高压和乳酸钙处理对牛肉色度的影响
Fig.2 Effect of ultra-high pressure and calcium lactate treatment on beef color
2.3 TBARS
如图3所示,随着压力的增大,脂质氧化程度呈先降低后增加的趋势,在0.1~300 MPa,氧化程度逐渐降低,相较于对照组,300 MPa压力下联合乳酸钙处理组降低了58%,而后400 MPa下氧化程度升高。
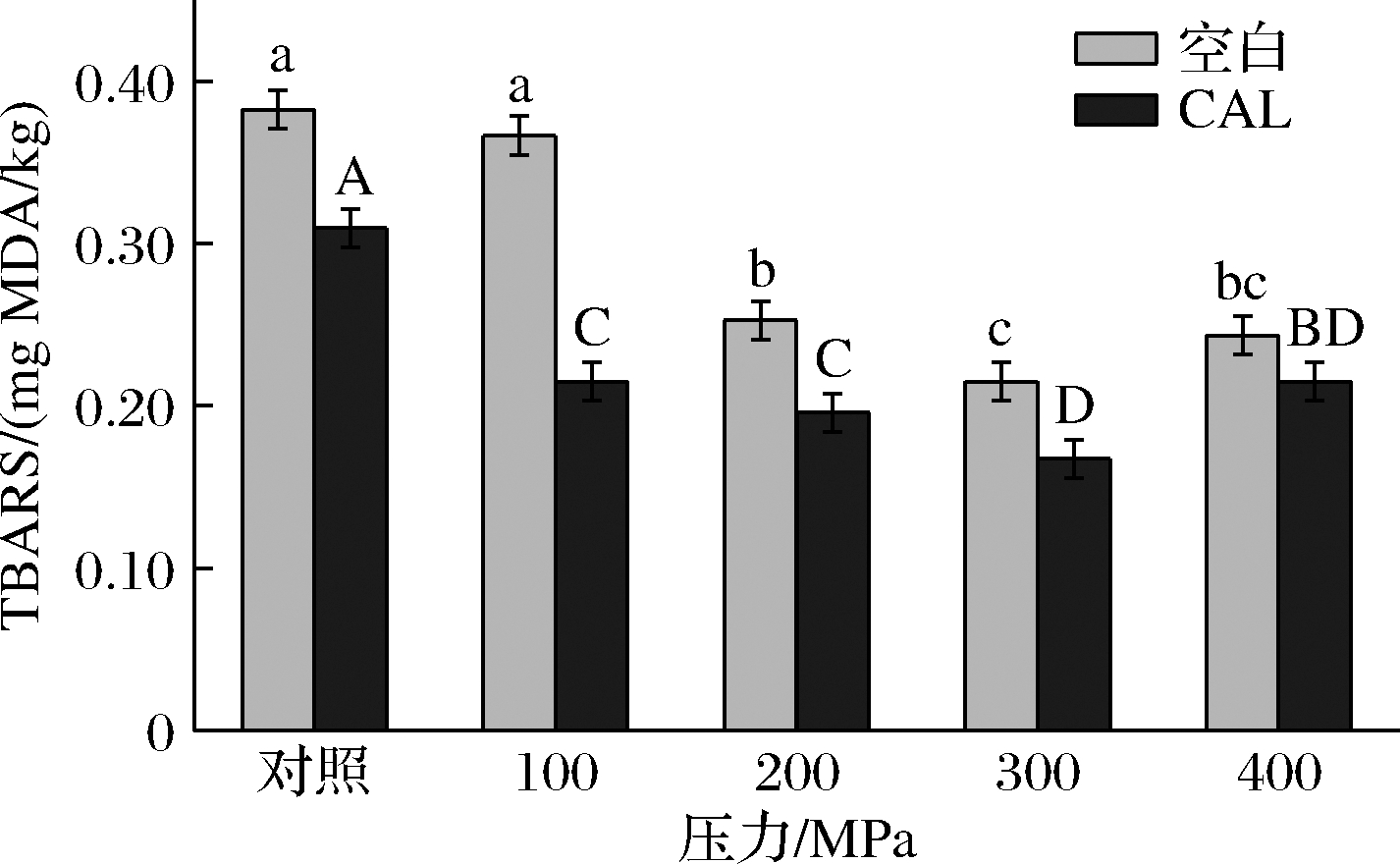
图3 超高压和乳酸钙处理对牛肉脂质氧化的影响
Fig.3 Effects of ultra-high pressure and calcium lactate treatment on lipid oxidation of beef
说明300 MPa压力有效降低牦牛宰后的脂质氧化现象。这一结果也印证了色度结果,牦牛肉相对稳定的色泽得益于脂质氧化速率低、内源抗氧化能力强[27]的特性。并且在贮藏期内,较低的脂质氧化有利于牦牛肉品质的保持,这对于后期牛肉贮藏保鲜有很大的意义。
2.4 蒸煮损失
蒸煮损失反应肌肉的持水能力,蒸煮损失越低,表明牛肉的颜色、嫩度、风味和营养价值及香气等食用品质越好[28]。如图4所示,在同一压力下,CAL组的蒸煮损失显著低于空白组,随着压力增加蒸煮损失呈现减小的趋势,300 MPa压力下,蒸煮损失最小。
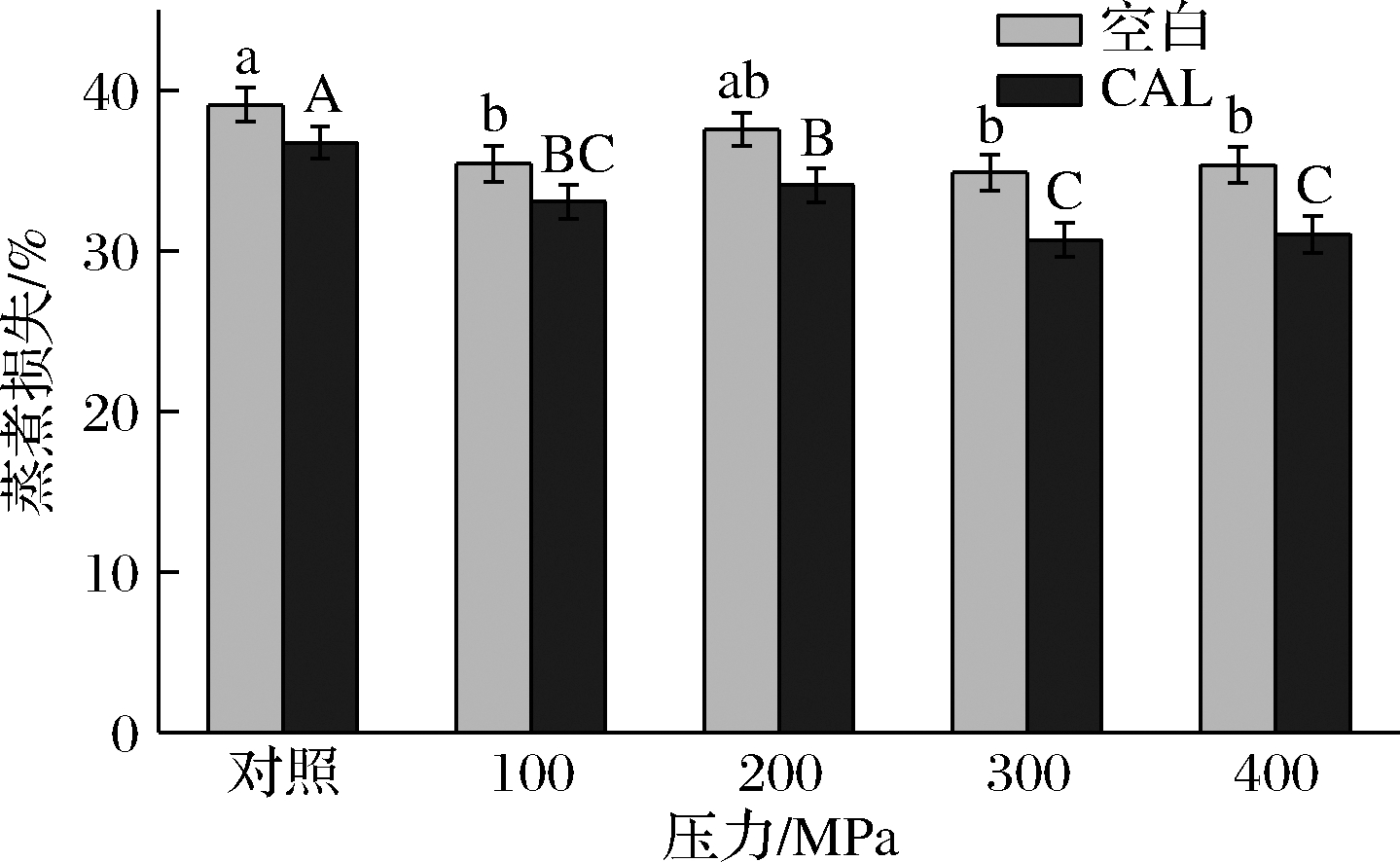
图4 超高压和乳酸钙处理对牛肉蒸煮损失的影响
Fig.4 Effects of ultra-high pressure and calcium lactate treatment on beef cooking loss
该结果说明超高压联合乳酸钙处理增加了肌纤维间的空隙,使得储水面积增大[29],能使牦牛肉保持较高的水分含量,从而损失达到较低值。
2.5 剪切力
剪切力值反应肌肉的嫩度,如图5所示,随着压力增加,剪切力逐渐减小,CAL组的下降趋势更加明显,显著低于空白组,400 MPa压力下的剪切力值在0.1~400 MPa达到最低值。由此可见,超高压或者联合乳酸钙处理后,可能使得肌原纤维蛋白生化特性以及肌原纤维蛋白凝胶性能发生改变[30],从而对肉嫩度改善具有促进作用。
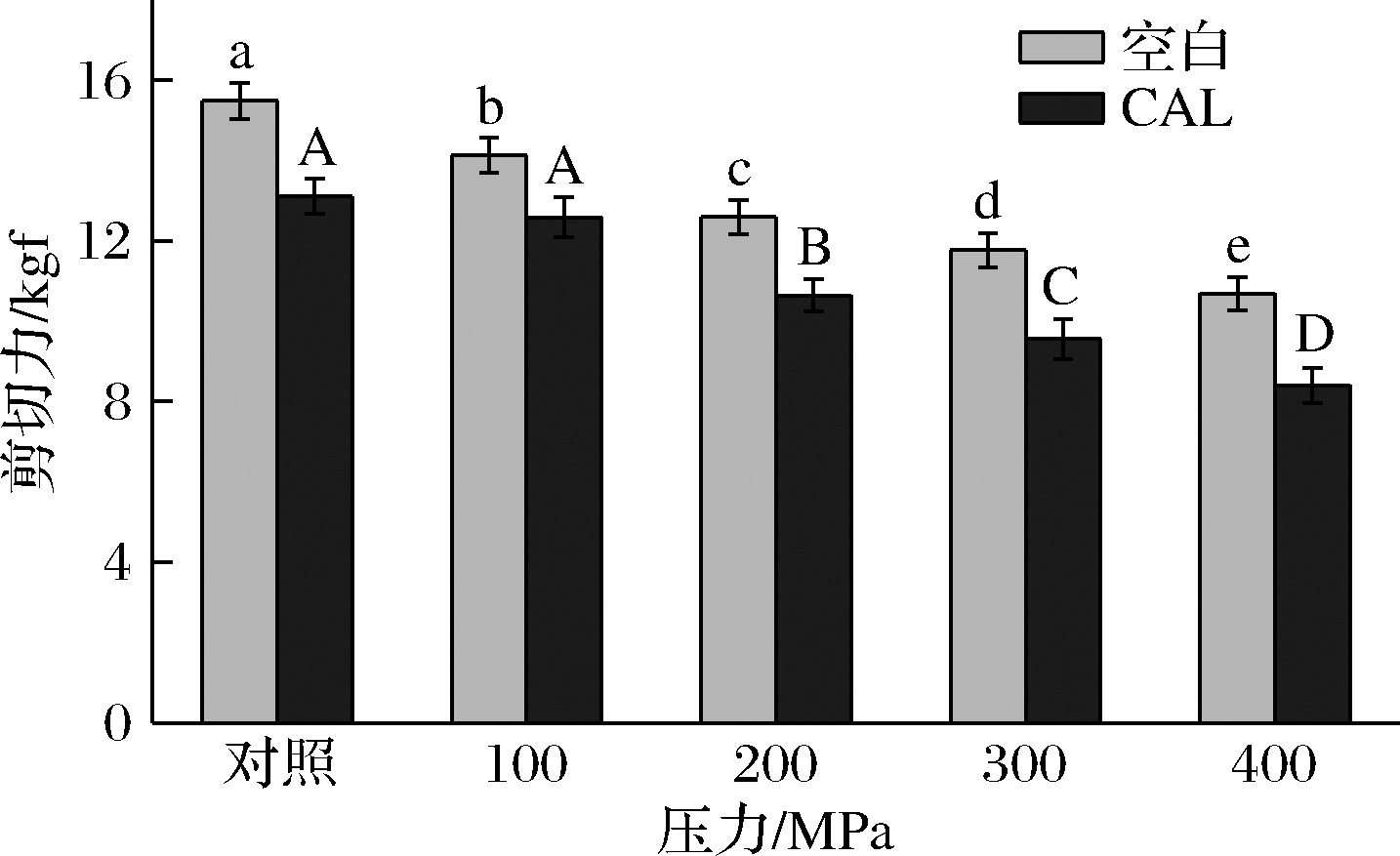
图5 超高压和乳酸钙处理对牛肉剪切力的影响
Fig.5 Effect of ultra-high pressure and calcium lactate treatment on beef shear force
2.6 肌红蛋白含量
由图6所示,描述了肌红蛋白中2种重要的不同氧化状态蛋白的相对含量,在0.1~400 MPa,2个处理组中,乳酸钙处理组中氧合肌红蛋白含量显著高于空白组,在300 MPa压力下的值最高,表明此种处理下牦牛肉具有良好的红色色泽。经过高压联合乳酸钙处理后,高铁肌红蛋白的相对含量显著降低,300 MPa处理后样品的值达到最低(P<0.05)。该现象和XIA等[31]研究结果一致,可以解释为300 MPa高压抑制了肌红蛋白的氧化,但也可能是高压促进了抗氧化肽的产生[32],但这并不完全是超高压单一作用的结果,联合处理下乳酸钙也发挥了其抗氧化的特性。

a-氧合肌红蛋白;b-高铁肌红蛋白
图6 超高压和乳酸钙处理对牛肉肌红蛋白氧化状态的影响
Fig.6 Effects of ultra-high pressure and calcium lactate treatment on the oxidative status of beef myoglobin
2.7 消化特性
胃期和肠期肌红蛋白消化率结果如图7所示。随着压力增加,胃消化率整体呈逐渐升高的趋势,在300 MPa时维持平稳。但差异不显著(P>0.05),然而,在空白和乳酸钙2个处理组内,胃消化率和肠道消化率差异显著(P<0.05)。进入肠道后消化率整体变化趋势跟胃期的趋势相同,在乳酸钙组,随着压力水平从100 MPa处理的45.97%急剧上升到300 MPa处理的52.28%,而空白组从44.05%增加了3.98%(P<0.05)。此结果说明无论压力水平如何,高压处理都能提高肌红蛋白的肠道消化率。这跟CAMPUS[33]的研究结果相一致。

a-胃蛋白消化率;b-肠道蛋白消化率
图7 超高压和乳酸钙处理对肌红蛋白消化特性的影响
Fig.7 Effects of ultra-high pressure and calcium lactate treatment on myoglobin digestion characteristics
2.8 肌红蛋白与胃蛋白酶相互作用
蛋白质的消化率依赖于其与消化酶之间的结合构像,本研究依据消化以及肉品质相关结果,将300 MPa压力联合0.06 g/mL乳酸钙处理和0.01 MPa压力空白处理的肌红蛋白进行动力学结构模拟,其与胃蛋白酶结合的结构变化如图8-a和图8-b所示,未经压力处理的肌红蛋白(图8-a)在与胃蛋白酶结合时“刚性”的扁平球状结构保持完整,未发生显著性的变化,而在300 MPa压力下(图8-b)。可以明显看到肌红蛋白结构发生改变,其螺旋结构有序排列,表明超高压处理导致肌红蛋白易态性提高,影响其与胃蛋白酶结合。猜测此时肌红蛋白亲水性表面以及 “疏水的口袋”结构[34]发生改变,可能影响其刚性结构从而提高其消化率。

a、b分别为肌红蛋白常压处理后与蛋白酶对接代表性图像和肌红蛋白高压处理后与蛋白酶对接代表性图像;c、d分别为肌红蛋白常压处理后与蛋白酶对接复合物氨基酸相互作用和肌红蛋白高压处理后与蛋白酶对接复合物氨基酸相互作用图像
图8 超高压和乳酸钙处理对肌红蛋白与胃蛋白酶结合的影响
Fig.8 Effects of ultra-high pressure and calcium lactate treatment on myoglobin binding to pepsin
此外,二维蛋白-蛋白相互作用图显示肌红蛋白和胃蛋白酶之间在常压条件下有3个氢键(图8-c),其距离分别为1.77、2.28、2.61 Å,而在高压条件下有6个氢键(图8-d),键长分别为3.00、3.22、2.11、1.94、2.83、2.89 Å。供体和受体之间的距离在1.8~2.3 Å时,氢键被认为是强的,而当距离在2.5~3.2 Å时,氢键被认为是弱的[35]。此外,常压条件下结合位点周围存在胃蛋白酶的疏水氨基酸残基(Leu 10、Pro 116、Ala 115、Phe 111、Tyr 114、Tyr 113)和肌红蛋白的疏水氨基酸残基(Pro 101、Phe 152、Ile 100、Val 102)。300 MPa高压条件下结合位点周围存在胃蛋白酶的疏水氨基酸残基(Leu 220、Phe 216、Leu 10、Leu 48、Phe 111)和肌红蛋白的疏水氨基酸残基(Ile 100、Tyr 104、Pro 101、Phe 152、Val 149、Leu 150、Val 37)。因此,说明氢键和疏水相互作用促进肌红蛋白与胃蛋白酶的结合。
2.9 肌红蛋白与胃蛋白酶结合的稳定性
如图9所示,蛋白的RMSD值被用来评估肌红蛋白在高压下的稳定性,胃蛋白酶以及肌红蛋白-胃蛋白酶复合物在高压下10 000 ps时间中的稳定性。

a-肌红蛋白和胃蛋白酶RMSD图;b-肌红蛋白-胃蛋白酶复合物RMSD图
图9 超高压和乳酸钙处理对肌红蛋白-胃蛋白酶复合物的RMSD值的影响
Fig.9 Effect of ultra-high pressure and calcium lactate treatment on the RMSD value of the myoglobin-pepsin complex
RMSD值在前2 000 ps急剧增加,随后保持稳定,表明肌红蛋白-胃蛋白酶系统在2 000 ps后达到平衡状态,联合处理下的胃蛋白酶和肌红蛋白复合物RMSD值均高于对照组,表明蛋白稳定性提高,有利于酶促反应。而在肌红蛋白与胃蛋白酶结合后的结果中可以看出,对照组RMSD值逐渐升高,而联合处理组的值保持稳定,说明300 MPa处理能使得肌红蛋白和胃蛋白酶稳定结合,这与ZOU等[36]的研究结果相一致,而本试验结果进一步说明超高压对于肌红蛋白消化率的提高具有辅助作用。
3 结论
300 MPa高压联合乳酸钙处理能显著改善牦牛肉的食用品质,同时改变了肌红蛋白与胃蛋白酶的结合构象,提高了肌红蛋白的消化率。高压处理使肌红蛋白的三级结构展开,增加了酶促反应面积。此外,在高强度高压条件下,肌红蛋白的氧化率显著降低。总之,高压联合乳酸钙处理可以作为一种强大的技术,提高难以消化的蛋白质的营养价值,改善牦牛肉嫩度和色度问题。
[1] 刘晓畅, 张寿, 孙宝忠, 等.牦牛肉品质特性研究进展[J].肉类研究, 2020, 34(11):78-83.
LIU X C, ZHANG S, SUN B Z, et al.Progress in understanding quality characteristics of yak meat[J].Meat Research, 2020, 34(11):78-83.
[2] 张杏亚, 杨波, 李亚蕾, 等.基于蛋白质组学技术研究秦川牛肉宰后贮藏过程中肌红蛋白含量及其衍生物转化[J].食品科学, 2021, 42(7):226-231.
ZHANG X Y, YANG B, LI Y L, et al.Proteomics studies on myoglobin content and its transformation into derivatives in muscle of Qinchuan cattle during postmortem storage[J].Food Science, 2021, 42(7):226-231.
[3] LI Q, ZHAO D, LIU H, et al.“Rigid” structure is a key determinant for the low digestibility of myoglobin[J].Food Chemistry:X, 2020, 7:100094.
[4] KIM S, KIM Y, LEE D B, et al.Effect of centrifugation on tryptic protein digestion[J].Analytical Science and Technology, 2017, 30(2):96-101.
[5] KROLL J, RAWEL H M, SEIDELMANN N.Physicochemical properties and susceptibility to proteolytic digestion of myoglobin-phenol derivatives[J].Journal of Agricultural and Food Chemistry, 2000, 48(5):1580-1587.
[6] LIU H, LI Q, JIANG S, et al.Exploring the underlying mechanisms on NaCl-induced reduction in digestibility of myoglobin[J].Food Chemistry, 2022, 380:132183.
[7] KIM Y H, HUNT M C, MANCINI R A, et al.Mechanism for lactate-color stabilization in injection-enhanced beef[J].Journal of Agricultural and Food Chemistry, 2006, 54(20):7856-7862.
[8] 张玉斌, 李丙子, 雷芸, 等.基于乳酸-LDH的牦牛肉NADH线粒体介导再生研究[J].农业机械学报, 2020, 51(6):353-359.
ZHANG Y B, LI B Z, LEI Y, et al.Effects of lactate-LDH system on NADH regeneration and metmyoglobin reduction in yak beef of mitochondria-mediated in vitro[J].Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(6):353-359
[9] 才琳. 超高压处理对镜鲤鱼肠凝胶特性及冷藏过程中品质变化的影响[J].中国食品添加剂, 2022, 33(7):112-116.
CAI L.Effect of ultra-high pressure on Cyprinus carpio sausages gel property and quality changes during refrigerated storage[J].China Food Additives, 2022, 33(7):112-116.
[10] PANEL E B, KOUTSOUMANIS K, ALLENDE A, et al.Pathogenicity assessment of Shiga toxin-producing Escherichia coli (STEC) and the public health risk posed by contamination of food with STEC[J].EFSA Journal, 2020, 18(1):e05967.
[11] LI Q, LIU H, JIANG S, et al.The effects of high pressure treatment on the structural and digestive properties of myoglobin[J].Food Research International, 2022, 156:111193.
[12] HATA H, NISHIYAMA M, KITAO A.Molecular dynamics simulation of proteins under high pressure:Structure, function and thermodynamics[J].Biochimica et Biophysica Acta (BBA) - General Subjects, 2020, 1864(2):129395.
[13] 罗辉, 何雨薇, 张杏亚, 等.秦川牛肉冷藏期间能量代谢变化及其对肉品质的影响[J].食品科学, 2021, 42(17):201-209.
LUO H, HE Y W, ZHANG X Y, et al.Changes in postmortem energy metabolism of Qinchuan cattle meat during chilled storage and its effects on meat quality[J].Food Science, 2021, 42(17):201-209.
[14] 郑娅, 胡生海, 何元翔, 等.牛肉肌红蛋白提纯及其协同脂质氧化效应分析[J].食品科技, 2019, 44(12):111-116.
ZHENG Y, HU S H, HE Y X, et al.Extractation and purification of myoglobin in beef and its synergistic oxidation effect with lipid[J].Food Science and Technology, 2019, 44(12):111-116.
[15] 吴强, 戴四发.超声波结合氯化钙处理对牛肉品质的影响[J].食品科学, 2010, 31(19):141-145.
WU Q, DAI S F.Influence of ultrasonic-assisted calcium chloride treatment on beef quality[J].Food Science, 2010, 31(19):141-145.
[16] 杨玉莹, 张一敏, 毛衍伟, 等.不同部位牦牛肉肌纤维特性与肉品质差异[J].食品科学, 2019, 40(21):72-77.
YANG Y Y, ZHANG Y M, MAO Y W, et al.Differences in myofiber characteristics and meat quality of different yak muscles[J].Food Science, 2019, 40(21):72-77.
[17] 朱宏星, 高田毅, 黄杨, 等.肌红蛋白血红素辅基氧化修饰对肌球蛋白功能特性及凝胶特性的影响[J].食品科学, 2022, 43(8):1-8.
ZHU H X, GAO T Y, HUANG Y, et al.Effect of oxidative modification of myoglobin hemin prosthetic group on the functional properties and gel properties of myosin[J].Food Science, 2022, 43(8):1-8.
[18] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[19] BIENERT S, WATERHOUSE A, DE BEER T A P, et al.The SWISS-MODEL Repository:New features and functionality[J].Nucleic Acids Research, 2017, 45(D1):D313-D319.
[20] WATERHOUSE A, BERTONI M, BIENERT S, et al.SWISS-MODEL:Homology modelling of protein structures and complexes[J].Nucleic Acids Research, 2018, 46(W1):W296-W303.
[21] SIKES A L, TOBIN A B, TUME R K.Use of high pressure to reduce cook loss and improve texture of low-salt beef sausage batters[J].Innovative Food Science &Emerging Technologies, 2009, 10(4):405-412.
[22] MARCOS B, KERRY J P, MULLEN A M.High pressure induced changes on sarcoplasmic protein fraction and quality indicators[J].Meat Science, 2010, 85(1):115-120.
[23] MASANA M O, BARRIO Y X, PALLADINO P M, et al.High pressure treatments combined with sodium lactate to inactivate Escherichia coli O157:H7 and spoilage microbiota in cured beef carpaccio[J].Food Microbiology, 2015, 46:610-617.
[24] 王璐, 韩衍青, 杨伯冰, 等.超高压处理对冷却牛肉色泽稳定性的影响[J].食品工业科技, 2015, 36(2):138-142;148.
WANG L, HAN Y Q, YANG B B, et al.Effect of high pressure processing treatment on beef color stability[J].Science and Technology of Food Industry, 2015, 36(2):138-142;148.
[25] KIM Y H, KEETON J T, SMITH S B, et al.Evaluation of antioxidant capacity and colour stability of calcium lactate enhancement on fresh beef under highly oxidising conditions[J].Food Chemistry, 2009, 115(1):272-278.
[26] KIM Y H, KEETON J T, YANG H S, et al.Color stability and biochemical characteristics of bovine muscles when enhanced with L- or D-potassium lactate in high-oxygen modified atmospheres[J].Meat Science, 2009, 82(2):234-240.
[27] 陈骋, 余群力, 韩玲, 等.丙二醛对牛肉线粒体高铁肌红蛋白还原能力的影响[J].农业机械学报, 2015, 46(12):253-259.
CHEN C, YU Q L, HAN L, et al.Effects of malondialdehyde on metmyoglobin reduction ability of bovine muscle mitochondria[J].Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(12):253-259.
[28] 邓绍林. 高压和氯化钙结合处理对牛肉品质的影响[D].南京:南京农业大学, 2012.
DENG S L.Effect of high pressure combined with calcium chloride on beef quality[D].Nanjing:Nanjing Agricultural University, 2012.
[29] HUGHES J M, OISETH S K, PURSLOW P P, et al.A structural approach to understanding the interactions between colour, water-holding capacity and tenderness[J].Meat Science, 2014, 98(3):520-532.
[30] 李钊, 李宁宁, 刘玉, 等.超高压对肌原纤维蛋白结构及其凝胶特性影响的研究进展[J].食品与发酵工业, 2020, 46(21):304-309.
LI Z, LI N N, LIU Y, et al.Advances on the effects of ultra-high pressure on myofibrillar protein structure and its gel properties[J].Food and Fermentation Industries, 2020, 46(21):304-309.
[31] XIA M Q, CHEN Y X, MA J, et al.Effects of low frequency magnetic field on myoglobin oxidation stability[J].Food Chemistry, 2020, 309:125651.
[32] 牛淑萍,艾麦提·巴热提.超高压技术在蛋白质食品加工中的应用分析[J].现代食品, 2021(20):125-127.
NIU S P, AI MAI TI·B R T.Application analysis of ultra-high pressure technology in protein food processing[J].Modern Food, 2021(20):125-127.
[33] CAMPUS M.High pressure processing of meat, meat products and seafood[J].Food Engineering Reviews, 2010, 2(4):256-273.
[34] LI Q, LIU H, JIANG S, et al.High pressure treatment modifies rigid structure of myoglobin and improves its digestibility[J].Current Developments in Nutrition, 2021, 5(2):592.
[35] 杨忠志,崔宝秋.血红素近轴侧基氢键的ABEEM/MM分子动力学模拟[J].物理化学学报,2007(9):1332-1336.
YANG Z Z,CUI B Q.Molecular dynamics simulation of ABEEM/MM hydrogen bond of heme nearaxial lateral group[J].Chinese Journal of Chemical Physics, 2007(9):1332-1336.
[36] ZOU H, XU Z Z, ZHAO L, et al.Effects of high pressure processing on the interaction of α-lactalbumin and pelargonidin-3-glucoside[J].Food Chemistry, 2019, 285:22-30.