枣果实富含维生素C、矿物质、氨基酸和碳水化合物等营养成分,被广泛作为传统功能性食品食用[1]。然而,枣果实贮藏期间易遭受病原菌入侵,导致病害发生[2]。由链格孢菌(Alternaria alternata)引起的黑斑病是冬枣采后常发生的病害之一。A.alternata可以产生细交链孢菌酮酸等霉菌毒素对人类健康造成严重威胁[3]。目前,代森猛锌、异菌脲和戊唑醇等化学杀菌剂已被广泛应用于A.alternata的控制[4-5]。然而,化学杀菌剂的耐药性以及对消费者健康带来的潜在危害,使得其不能广泛应用于实际生产[3]。因而,寻找能够有效防治冬枣黑斑病的绿色、安全环保的方法显得尤为重要。
拮抗酵母因对环境耐受性高,且为有益抗菌物质而被广泛应用于果蔬采后生物防治[6]。已有研究报道,尼泊尔德巴利酵母(Debaryomyces nepalensis)可以通过产生挥发性抗菌物质、诱导果实抗病性以及形成生物膜来有效地控制芒果采后炭疽病的发生[7]。经本实验室前期研究发现,D.nepalensis能够在冬枣果实表面形成生物膜,通过和病原菌竞争营养空间,从而控制冬枣采后黑斑病[8]。但单一的拮抗酵母对果蔬采后病害的防治效果远不如化学杀菌剂,这也导致了拮抗酵母商品化程度较低[9]。
低剂量的化学物质(植物激素类、金属盐类)复合拮抗酵母处理,是一种有望将拮抗酵母生防效力显著提升的方法[10]。已有研究表明,用0.2 mmol/L水杨酸复合胶红酵母(Rhodotorula mucilaginosa)使用,能显著控制柑橘青霉病的发生[11]。同样,用20 g/L NaHCO3复合海洋生防酵母(Rhodosporidium paludigenum)处理,也能够显著降低柑橘绿霉病的发生[12]。CaCl2已被证实为一种安全有效的化学杀菌剂,能够通过增强橄榄假丝酵母(Candida oleophila)对苹果果实的诱导抗性控制苹果采后青霉病的发生[13-14]。除此之外,外援Ca2+处理,还能够通过增强酵母抗氧化活性,减少活性氧的积累提高其抗病能力[15]。目前,CaCl2是否能够增强D.nepalensis对冬枣采后黑斑病的控制效果还有待研究。
本文用不同浓度CaCl2与D.nepalensis复合处理,筛选出控病最佳复合比例,并探究其作用机制,以期为冬枣采后黑斑病防控提供理论依据和应用参考。
1 材料与方法
1.1 材料与主要试剂
材料:实验所用冬枣购自北碚区开心水果店。选取成熟度一致,大小均匀且无机械伤的冬枣果实作为实验备用材料。经预冷后,放入冻库暂存。
菌种:Debaryomyces nepalensis和Alternaria alternata为本实验室自行分离、鉴定和保存的菌种。经活化后备用。
主要试剂:亮抑酶肽、乙酰溴、冰醋酸、甲醇、4-香豆酸辅酶A连接酶(4CL)提取试剂、正己烷、硼酸、D-葡萄糖-6-磷酸二钠盐、叔丁醇,重庆跃翔化工有限公司;辅酶A,北碚区玛顿实验设备经营部;p-香豆酸,重庆择物生物科技有限公司;酵母浸粉(分析纯),重庆兴光化玻公司;琼脂粉(分析纯)、ATP,重庆阿米达生物科技有限公司;福林酚,重庆千重山生物科技有限公司;H2O2,重庆兴光化玻公司。
1.2 仪器与设备
SW-CJ-2F洁净工作台,苏州安泰空气技术有限公司;BXM30R立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;ZWF-211摇床,重庆迈新科技发展有限公司;B203生物显微镜,重庆奥特光学仪器有限公司;DHG-9140A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;S-3400 NII扫描电镜,日本HITACHI公司;SYNERGYH1MG全自动酶标仪,美国BioTek公司。
1.3 试验方法
1.3.1 离体条件下CaCl2对D.nepalensis和A.alternata生长状况的影响
1.3.1.1 CaCl2在YEPD培养基中对D.nepalensis生长状况的影响
将10 mL不同质量浓度的CaCl2溶液加入到含有90 mL YEPD液体培养基的锥形瓶中,使CaCl2的终质量浓度达到0、5、10、20、40 g/L。之后,接入1 mL 1×108CFU/mL的D.nepalensis细胞悬浮液,并于28 ℃、200 r/min的摇床中培养24 h后计数。每个处理组重复3次。
1.3.1.2 CaCl2在PDA培养基中对A.alternate生长状况的影响
在含有质量浓度为0、5、10、20、40 g/L CaCl2的PDA培养基中央接入10 μL 1×106 CFU/mL A.alternate孢子悬浮液,用封口膜封住平板并放置在25 ℃恒温培养箱中培养7 d后记录病斑直径并拍照。每个处理组重复3次。
1.3.2 CaCl2与D.nepalensis复合处理对冬枣果实采后黑斑病的抑制效果
将冬枣果实浸入2%(体积分数)NaClO溶液中浸泡,2 min后用清水冲净,将其随机分为5组,放置于工作台上自然晾干。用无菌枪头在冬枣果实的赤道部位等距打孔(直径3 mm,深度3 mm),每个处理组果实的伤口处分别加入20 μL下列液体:(1)1×108 CFU/mL D.nepalensis悬浮液;(2)5 g/L CaCl2与1×108 CFU/mL D.nepalensis混合悬浮液;(3)10 g/L CaCl2与1×108CFU/mL D.nepalensis混合悬浮液;(4)20 g/L CaCl2与1×108 CFU/mL D.nepalensis混合悬浮液;(5)40 g/L CaCl2与1×108 CFU/mL D.nepalensis混合悬浮液;4 h后,再在枣果实伤口处接入10 μL 1×106CFU/mL A.alternate孢子悬浮液,待菌液完全吸收后,单果包装置于25 ℃、相对湿度为90%~95%条件下贮藏。每2 d测定冬枣果实的发病率和病斑直径。每个处理组10个果实,重复3次。
1.3.3 CaCl2处理后对D.nepalensis在冬枣果实伤口处定殖能力的影响
1.3.3.1 CaCl2处理后对D.nepalensis在冬枣果实伤口处生长动态的影响
冬枣处理:果实处理同1.3.2节,每个孔分别加入20 μL 1×108 CFU/mL D.nepalensis悬浮液、5 g/L CaCl2与1×108 CFU/mL D.nepalensis混合悬浮液,置于25 ℃、相对湿度为90%~95%条件下贮藏。以第0天(接种后2 h)测定的酵母数为起始值,每天取样,连续测定7 d。取样时,用无菌打孔器挖取伤口处直径为1 cm的果肉组织,放入装有10 mL PBS(50 mmol/L,pH 6.8)的消毒研钵中研磨成匀浆,之后进行梯度稀释,并吸取100 μL稀释液涂布在YEPD平板上,将其置于28 ℃下培养,48 h后计数。每个处理重复3次,每个重复3个果实。结果用每个伤口的酵母活菌数量表示,单位为lg CFU/wound。
1.3.3.2 扫描电镜观察D.nepalensis与A.alternate在果实伤口处的生长动态
将冬枣果实随机分为8组,果实处理同1.3.2节。每个孔分别接入(1)20 μL无菌水;(2)20 μL 5 g/L CaCl2;(3)20 μL无菌水,4 h后再在每个孔接种10 μL 1×106CFU/mL A.alternate悬浮液;(4)20 μL 5 g/L CaCl2,4 h后再在每个孔接种10 μL 1×106 CFU/mL A.alternate悬浮液;(5)20 μL 1×108 CFU/mL D.nepalensis悬浮液;(6)5 g/L CaCl2与1×108CFU/mL D.nepalensis混合悬浮液;(7)20 μL 1×108 CFU/mL D.nepalensis悬浮液,4 h后再在每个孔接种10 μL 1×106 CFU/mL A.alternate悬浮液;(8)5 g/L CaCl2与1×108CFU/mL D.nepalensis混合悬浮液,4 h后再在每个孔接种10 μL 1×106 CFU/mL A.alternate悬浮液。贮藏方法同1.3.2节。2 d后,采用扫描电镜观察。电镜样品制作参照LEI等[8]的方法。
1.3.3.3 CaCl2处理后对D.nepalensis生物膜生成能力的影响
实验参照LEI等[8]的方法,并稍作修改。D.nepalensis在YNB(含葡萄糖100 mmol/L)培养基中28 ℃过夜培养后,收集菌体,用PBS(50 mmol/L,pH 7.2)洗涤2次,然后分别用YNB培养基和含有5 g/L CaCl2的YNB培养基调整酵母细胞浓度为1×107 CFU/mL。分别吸取100 μL加入到96孔聚苯乙烯板的8个孔内。无酵母悬浮液的YNB培养基为对照。在28 ℃恒温摇床中以75 r/min的转速培养。在培养的3、24、48、72 h后,用150 μL PBS洗涤2次,随后加入100 μL 40 g/L的结晶紫溶液染色45 min,染色结束后用无菌水洗涤4次,并立即加入200 μL 95%(体积分数)的乙醇进行脱色。脱色45 min后,移取100 μL脱色液到另一块96孔聚苯乙烯板孔内,在590 nm处测定吸光值。吸光值的大小用来表示生物膜生成量的多少。以不接种酵母的YNB(含葡萄糖100 mmol/L)培养基校正空白,每个处理3个重复,每个重复8个复孔。
1.3.4 CaCl2与D.nepalensis复合处理诱导冬枣果实抗病性机制
1.3.4.1 样品处理及取样
冬枣处理:果实处理同1.3.3.1节。在贮藏的第0、1、2、3、4、5天对冬枣果实取样,取样时,用无菌打孔器在果实伤口周围取直径为3 mm的果实组织。每个处理3次重复,每个重复15个果实。
1.3.4.2 酶活力测定
苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)、肉桂酸-4-羟基化酶( cinnamate-4-hydroxylase,C4H) 、4-香豆酸辅酶 A 连接酶( 4-coumaric acid coenzyme-A-ligase,4CL)活性测定参照张静茹[16]的方法。
过氧化物酶(peroxidase,POD)活力的测定参考曹建康等[17]的方法,以每克鲜重(fresh weight,FW)枣果实样品每分钟吸光度变化值增加1时为1个过氧化物酶活性单位(U)。
1.3.4.3 总酚、类黄酮、木质素含量的测定
总酚、类黄酮的提取方法参照DENG等[18]的实验方法;总酚、类黄酮和木质素的测定方法参照张静茹[16]的方法。
2 结果与分析
2.1 离体条件下CaCl2对D.nepalensis和A.alternata生长状况的影响
2.1.1 CaCl2在YEPD培养基中对D.nepalensis生长状况的影响
如图1所示,将D.nepalensis与不同浓度的CaCl2混合培养24 h后,当CaCl2的质量浓度为5、10、20 g/L时,能显著促进D.nepalensis的生长(P<0.05),然而,当CaCl2的质量浓度达到40 g/L时,D.nepalensis的数量与未加CaCl2时无显著差别(P>0.05)。这与蔡孟轩等[14]的研究结果类似,高浓度Ca2+会抑制酵母生长,低浓度Ca2+却促进酵母生长。这可能与高浓度Ca2+增加酵母胞外渗透压,造成细胞胞内物外泄,细胞破裂而死亡有关。而低浓度Ca2+可以提供酵母所需要的营养物质,促进酵母生长。
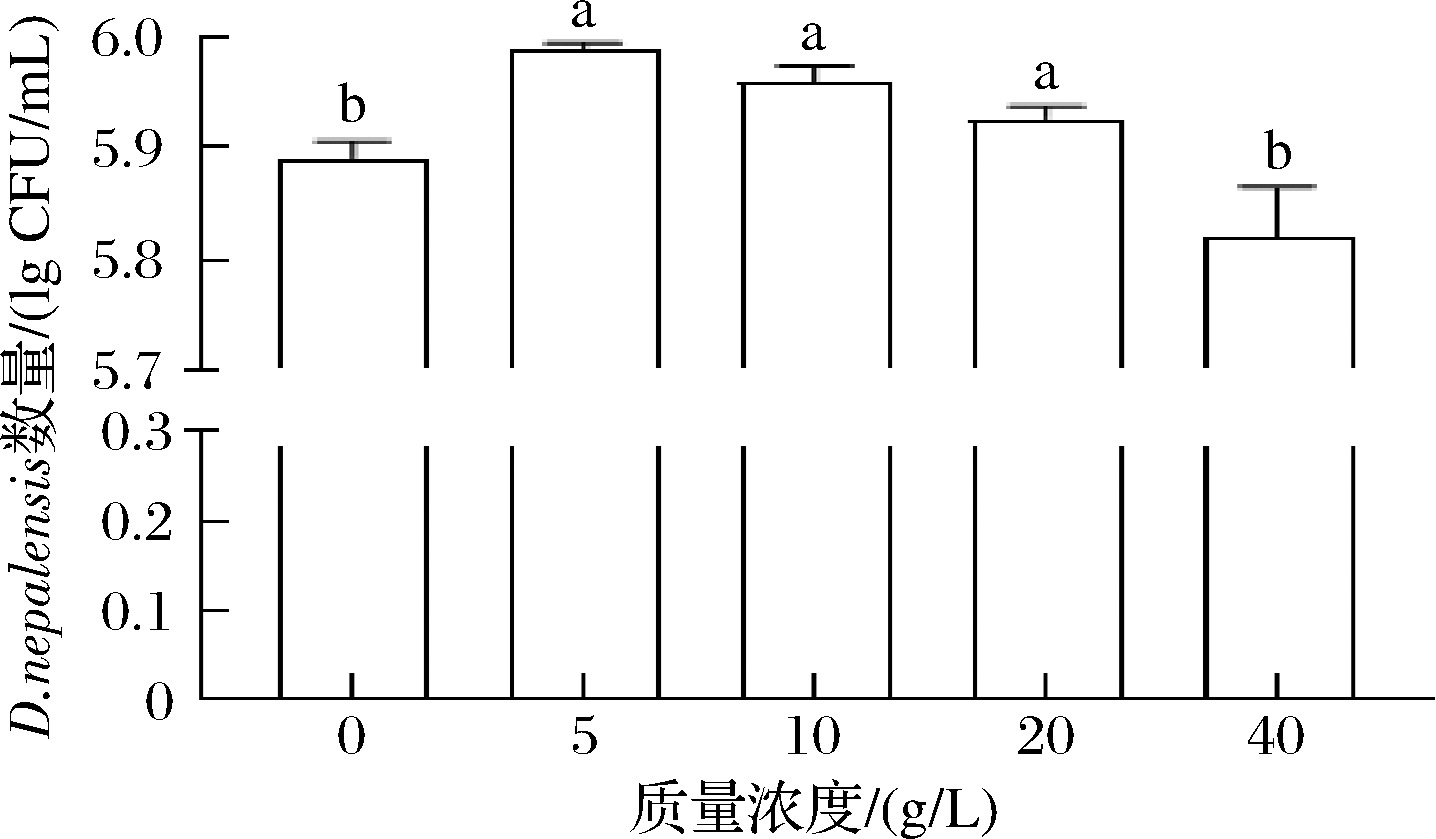
图1 不同浓度CaCl2对D.nepalensis生长动态的影响
Fig.1 Effects of different concentrations of CaCl2 on the growth dynamics of D.nepalensis
注:小写字母不同表示差异显著(P<0.05),下同。
2.1.2 CaCl2在PDA培养基中对A.alternate生长状况的影响
如图2所示,A.alternate在添加了5、10、40 g/L CaCl2的PDA培养基中培养7 d后,病斑直径显著高于未加CaCl2的对照组(P<0.05);而在添加了20 g/L CaCl2的PDA培养基中培养7 d后,病斑直径与对照组无显著区别(P>0.05)。这说明所选浓度的CaCl2对A.alternate均无直接抑菌作用,且一定浓度范围的CaCl2还可以提供A.alternate生长所需的营养元素促进其生长。
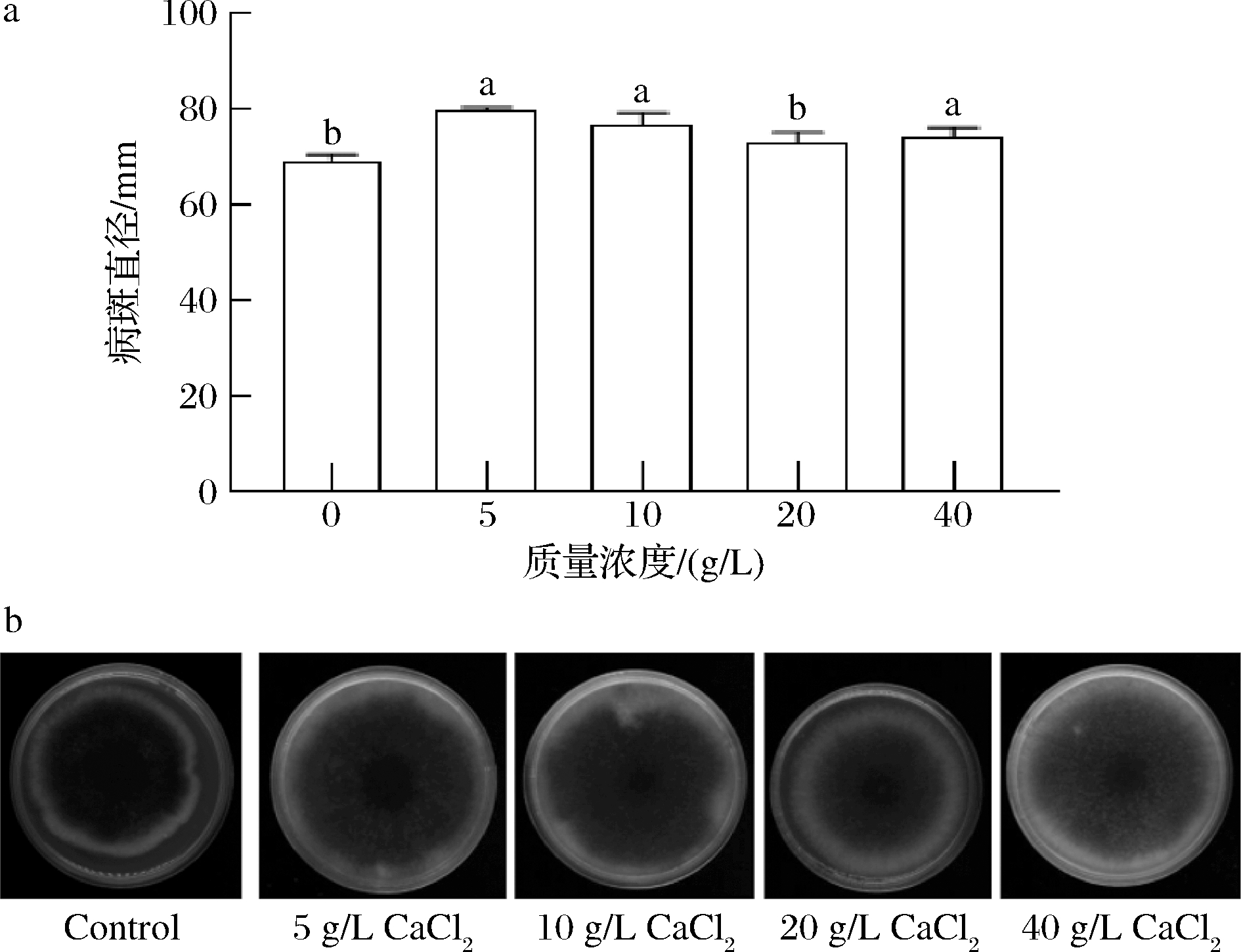
a-病斑直径;b-A.alternate生长图片
图2 不同浓度CaCl2对A.alternate生长状况的影响
Fig.2 Effects of different concentrations of CaCl2 on the growth of A.alternate
2.2 CaCl2与D.nepalensis复合处理对冬枣果实采后黑斑病的抑制效果
如图3所示,在贮藏期间,5 g/L CaCl2与D.nepalensis复合处理后,能降低枣果实黑斑病的发病率和病斑直径,且控制效果显著强于D.nepalensis单独处理(P<0.05)。10 g/L CaCl2与D.nepalensis复合处理后,发病率仅在第2天时,显著低于D.nepalensis单独处理(P<0.05)。20 g/L CaCl2与D.nepalensis复合处理后,在贮藏的第2、4、6天时,枣果实发病率与D.nepalensis单独处理组无显著差别(P>0.05),而在第8、10天时反而促进枣果实的发病。40 g/L CaCl2与D.nepalensis复合处理后,在贮藏期间,发病率和病斑直径都显著高于D.nepalensis单独处理组(P<0.05)。同样的结果在SUN等[19]的研究中也有发现。高浓度的化学添加剂复合拮抗酵母处理后,促进病害发生,这可能是因为化学添加剂本身对果实伤害较大,降低了果实的抵抗力,利于病原菌入侵。综上,后续实验选用对枣果实黑斑病控制效果最好的复合比例(5 g/L CaCl2与D.nepalensis复合)进行研究。

a-发病率;b-病斑直径;c-枣果实接种A.alternate 10 d时的图片
图3 不同浓度CaCl2与D.nepalensis复合处理对冬枣采后黑斑病控制效果
Fig.3 The control effect of different concentrations of CaCl2 with D.nepalensis on postharvest black spot disease of jujube
注:相同贮藏时间、不同处理组小写字母不同表示差异显著(P<0.05)。
2.3 CaCl2处理后对D.nepalensis在冬枣果实伤口处定殖能力的影响
2.3.1 CaCl2处理后对D.nepalensis在冬枣果实伤口处生长动态的影响
如图4所示,D.nepalensis能够在枣果实伤口处迅速定殖、扩增。且经过5 g/L CaCl2与D.nepalensis复合处理后,能够明显促进D.nepalensis的生长(P<0.05)。在贮藏第1天时,5 g/L CaCl2与D.nepalensis复合处理后,D.nepalensis的数量比刚开始接种时增加16.17%,且比D.nepalensis单独处理组的数量增加4.13%。AHIMA等[11]用水杨酸复合R. mucilaginosa处理后,发现R.mucilaginosa在柑橘果实伤口处的数量增加。
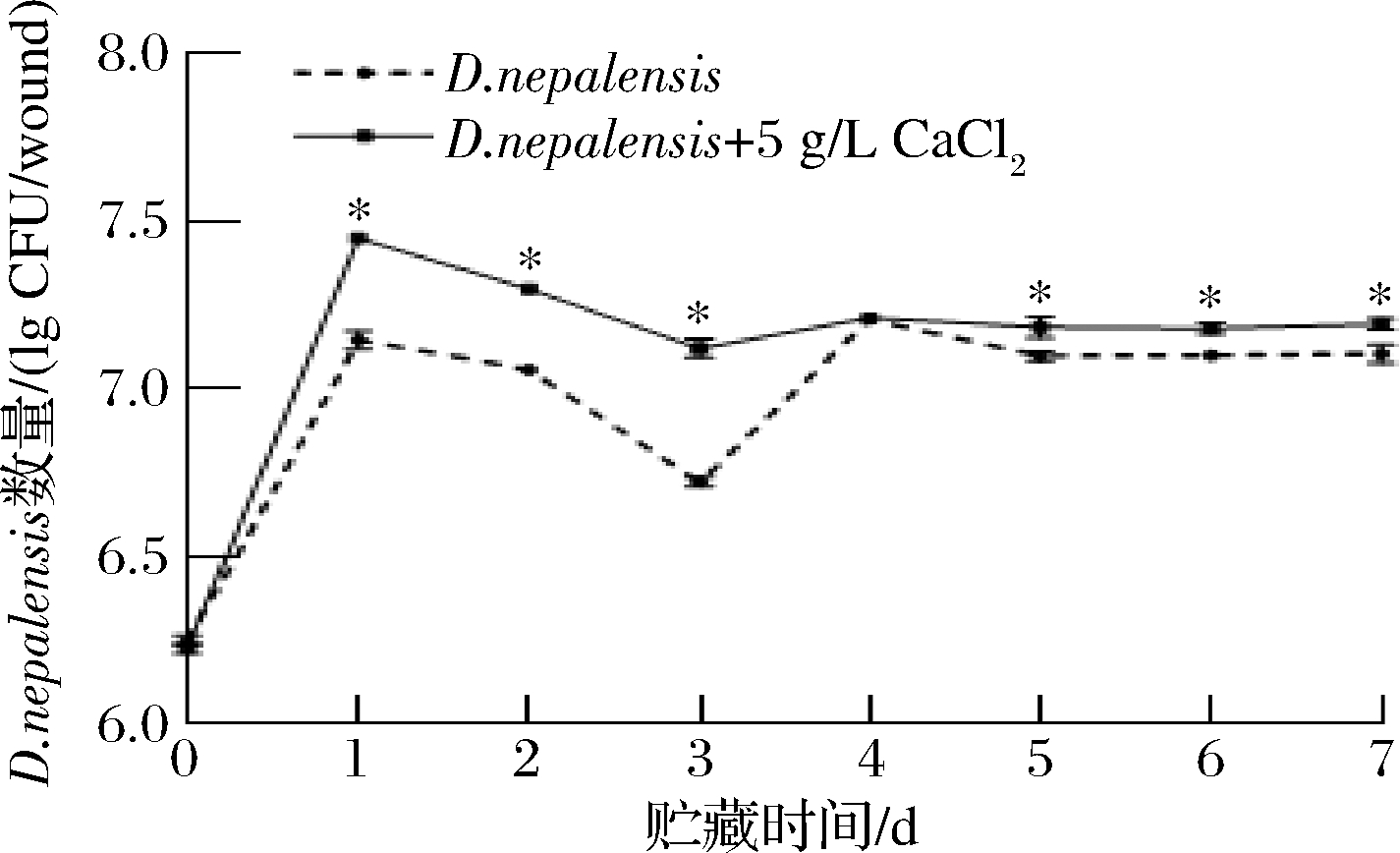
图4 CaCl2对D.nepalensis在冬枣果实伤口处生长动态的影响
Fig.4 Effects of CaCl2on the growth dynamics ofD.nepalensis in the wound of jujube
2.3.2 SEM观察D.nepalensis与A.alternate在果实伤口处的生长动态
如图5-a1、图5-a2、图5-b1、图5-b2所示,经过5 g/L CaCl2处理后,对枣果实伤口处组织以及A.alternate的菌丝无显著影响。如图5-c1、图5-c2所示,D.nepalensis经多次冲洗,依然能够稳定地附着在枣果实伤口处,形成密集壁垒,且经5 g/L CaCl2处理后,在D.nepalensis表面有一层膜状物生成,更加紧密地将D.nepalensis结合。LEI等[8]研究发现,苯乙醇作为D.nepalensis的群体感应分子能够促进D.nepalensis生物膜的形成,进而提高D.nepalensis生防效力。本研究发现CaCl2处理后可以增强D.nepalensis生物膜生成能力,这是否与CaCl2能够增加酵母苯乙醇生成量有关,还有待后续研究。如图5-d1、图5-d2所示,D.nepalensis能够紧紧附着在A.alternate菌丝周围,使其不能够有效接触到冬枣果实表面,且经5 g/L CaCl2和D.nepalensis复合处理后,A.alternate菌丝发生了变形和皱缩的现象。
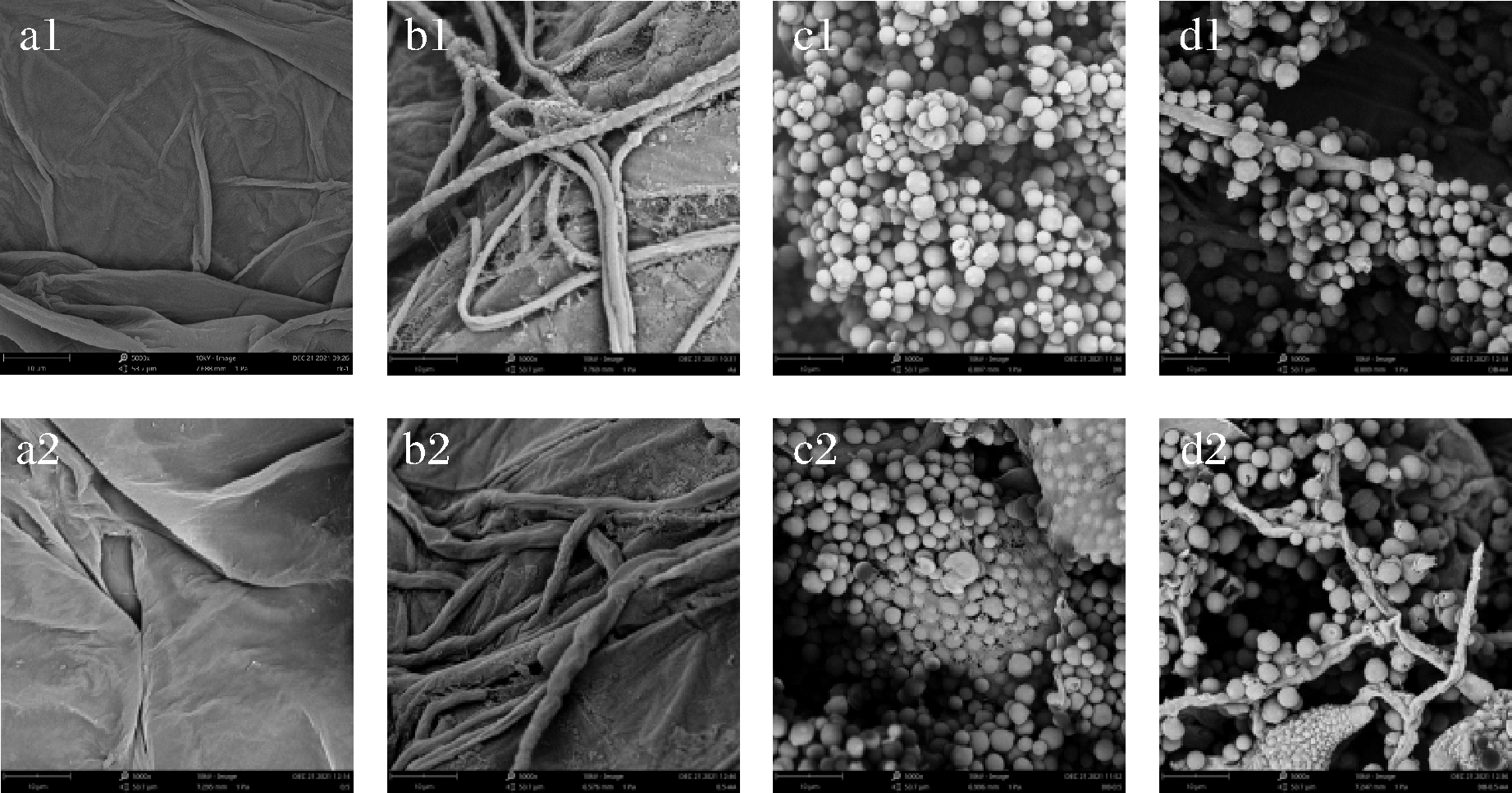
a-冬枣果皮伤口处组织;b-A. alternate在冬枣果实的生长动态;c-D. nepalensis在冬枣果皮伤口处的生长动态;d-A. alternate和D. nepalensis在冬枣果实的生长动态
图5 扫描电镜下D.nepalensis与A.alternate在果实伤口处的生长状态
Fig.5 Growth status of D.nepalensis and A.alternatein fruit wounds under scanning electron microscope
注:a1~d1:无CaCl2;a2~d2:加CaCl2;图为放大5 000倍的图。
2.3.3 CaCl2处理后对D.nepalensis生物膜生成能力的影响
如图6所示,在培养的3、24、48、72 h,经PBS和无菌水多次冲洗后,D.nepalensis依然能够稳定附着于96孔板上。且在3、48、72 h时,经5 g/L CaCl2处理后的OD590值显著大于D.nepalensis单独培养组。这进一步说明5 g/L CaCl2处理后,能够增强D.nepalensis的生物膜形成能力。
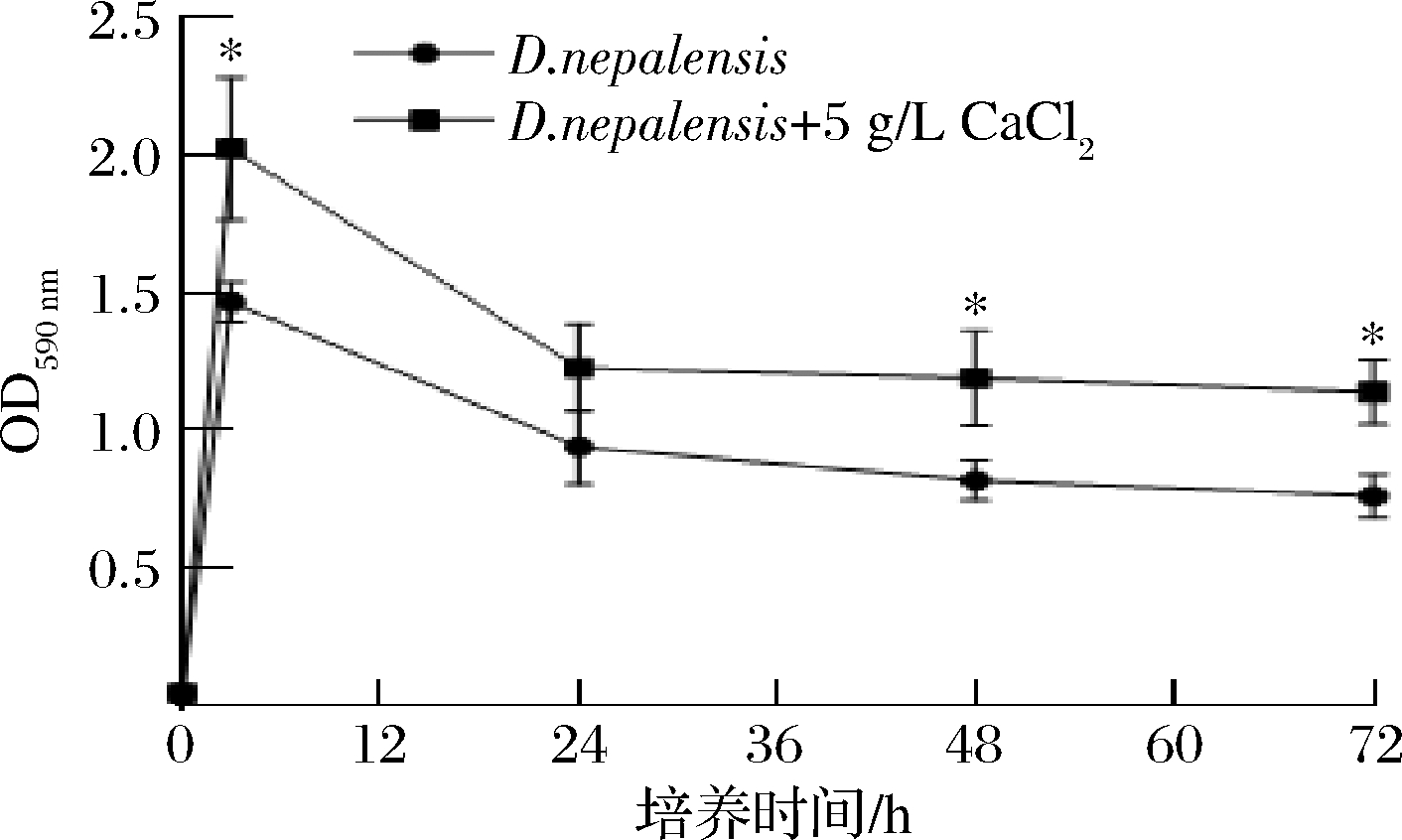
图6 CaCl2对D.nepalensis生物膜形成能力的影响
Fig.6 Effects of CaCl2 on the biofilm formation ability of D.nepalensis
2.4 CaCl2与D.nepalensis复合处理诱导冬枣果实抗病性机制
2.4.1 对冬枣果实PAL、C4H、4CL、POD活力的影响
苯丙烷代谢途径与酚类等化合物的生成有关,可以诱导其产生化学或者物理屏障来加强植物细胞壁的结构,从而阻止病原菌的浸染[3]。PAL是苯丙烷代谢途径当中的关键限速酶[20],与酚类、木质素等植物防御及抗病相关物质的合成关联。当PAL活力增强时,果实能够提高自身防御能力抵御外来侵害。如图7-a所示,经5 g/L CaCl2处理后,在贮藏的第1天~第4天,冬枣果实PAL的活性显著高于D.nepalensis单独处理组(P<0.05),且在第3天时达到最高,在贮藏的第4天,5 g/L CaCl2复合D.nepalensis处理组PAL活性是D.nepalensis单独处理组的1.44倍。在贮藏期间PAL活力呈现先上升后下降再上升后下降的趋势,这样的现象与张静茹[16]结果表现出一致性,这可能是因为在PAL使L-苯丙氨酸生成肉桂酸的过程中,给PAL自身的活性造成了负反馈调节[21]。
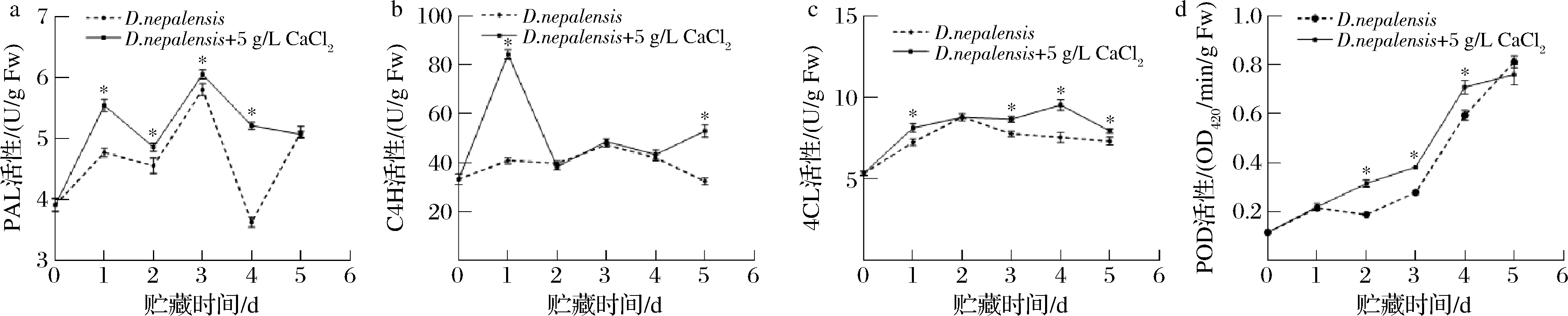
a-PAL活性;b-C4H活性;c-4CL活性;d-POD活性
图7 CaCl2与D.nepalensis复合处理对冬枣PAL、C4H、4CL、POD活力的影响
Fig.7 Effects of combined treatment with CaCl2 and D.nepalensis on PAL, C4H, 4CL, and POD activities of jujube
C4H与果实中p-香豆酸的合成密切相关,调节着咖啡酸及阿魏酸等酚酸物质的合成,这些物质的生成,可以对病原微生物起到直接杀菌作用[20]。如图7-b所示,在贮藏的第1天、第5天,5 g/L CaCl2复合D.nepalensis处理组C4H活力显著高于D.nepalensis单独处理组(P<0.05),且在第1天时,达到最高,相比D.nepalensis单独处理组的C4H活性高了51.53%。这样的结果与ZHANG等[22]用紫外处理防治油桃采后褐腐病结果类似,通过外界刺激,激活了苯丙烷代谢途径中C4H活性,从而达到抑菌目的。
4CL在苯丙烷代谢途径当中是生成不同产物的转折点,参与调节植物与病原微生物的相互作用,与辅酶A酯的合成有关[23]。如图7-c所示,在贮藏的1、3、4、5 d,5 g/L CaCl2复合D.nepalensis处理组的4CL活性显著高于D.nepalensis单独处理组(P<0.05),且都呈现先上升后下降的趋势。贮藏的第4天时,处理组4CL活性为对照组的1.26倍。类似的结果在ZHANG等[22]的研究中也有发现。
当植物处于逆境时,会刺激活性氧(reactive oxygen species,ROS)爆发,从而使病原菌更易侵染,而POD作为消除活性氧的主要保护酶,与维持活性氧平衡及植物抗性密切相关[24]。除此之外,POD增加后还能自发耦合成单酚自由基并合成木质素聚合体,加固细胞壁。如图7-d所示,在贮藏的第2、3、4天,5 g/L CaCl2复合D.nepalensis处理组的POD活性显著高于D.nepalensis单独处理组(P<0.05),且都呈现逐渐增加的趋势。类似的结果在蒋超男等[25]的研究中也有报道。
2.4.2 对冬枣果实总酚、类黄酮、木质素含量的影响
作为苯丙烷代谢途径终产物的总酚、类黄酮、木质素,与植物抗性息息相关。酚类具有强抗氧化性和抗病性且为木质素合成的前体物。类黄酮能够控制病原微生物在未被侵染的细胞中繁殖扩增,类黄酮含量的多少、产生的速度,通常与植物抗病性呈正相关。而木质素作为细胞壁的主要成分,是植物抵御病原菌入侵的重要保护壁垒。如图8-a所示,经5 g/L CaCl2与D.nepalensis复合处理后,在贮藏的第4天,总酚的含量显著高于D.nepalensis单独处理组(P<0.05),且为D.nepalensis单独处理组的1.05倍。如图8-b所示,在贮藏的第1、2、4天,5 g/L CaCl2与D.nepalensis复合处理组冬枣果实类黄酮含量显著高于D.nepalensis单独处理组(P<0.05)。如图8-c所示,在贮藏的第1、3、4天,5 g/L CaCl2与D.nepalensis复合处理组冬枣果实木质素含量显著高于D.nepalensis单独处理组(P<0.05),在第4天时达到最高,且木质素含量是D.nepalensis单独处理组的1.27倍。在处理的整个贮藏期内,总酚、类黄酮及木质素含量的变化趋势表现出一致性,都为先增加,后下降,再增加后下降的趋势。这可能是由于终产物的积累,导致上游反应途径出现负反馈调节造成的。同样的结果在蔡孟轩等[14]和蒋超男等[25]的研究中也有发现。

a-总酚含量;b-类黄酮含量;c-木质素含量
图8 CaCl2与D.nepalensis复合处理对冬枣木质素、总酚、类黄酮含量的影响
Fig.8 Effects of combined treatment with CaCl2 and D.nepalensis on the contents of lignin, total phenol, and flavonoid of jujube
3 结论
本文用5 g/L CaCl2与D.nepalensis复合处理后发现,CaCl2能够通过增强D.nepalensis的生物膜生成能力以及增强D.nepalensis诱导果实抗性,激活苯丙烷代谢途径,提高POD、PAL、C4H、4CL活力以及提升总酚、类黄酮和木质素等物质含量从而提升D.nepalensis对冬枣果实采后黑斑病的控制效果。因此, CaCl2与D.nepalensis的复合使用,可以提升D.nepalensis的生防效力,为D.nepalensis的商业化应用提供新的增效方法和思路。
[1] LI W S, YUAN S Z, LI Q Q, et al.Methyl p-coumarate inhibits black spot rot on jujube fruit through membrane damage and oxidative stress against Alternaria alternata[J].Postharvest Biology and Technology, 2018, 145:230-238.
[2] 雷兴梦, 易兰花, 邓丽莉, 等.拮抗微生物对枣果实采后病害生物防治的研究进展[J].食品与发酵工业, 2022, 48(2):287-292.
LEI X M, YI L H, DENG L L, et al.Advances in biological control of postharvest diseases of jujube by antagonistic microorganisms[J].Food and Fermentation Industries, 2022, 48(2):287-292.
[3] YUAN S Z, LI W S, LI Q Q, et al.Defense responses, induced by p-coumaric acid and methyl p-coumarate, of jujube (Ziziphus jujuba Mill.) fruit against black spot rot caused by Alternaria alternata[J].Journal of Agricultural and Food Chemistry, 2019, 67(10):2801-2810.
[4] NALLATHAMBI P, UMAMAHESWARI C, THAKORE B B L, et al.Post-harvest management of ber (Ziziphus mauritiana Lamk) fruit rot (Alternaria alternata Fr.Keissler) using Trichoderma species, fungicides and their combinations[J].Crop Protection, 2009, 28(6):525-532.
[5] THOMIDIS T, MICHAILIDES T, EXADAKTYLOU E.Contribution of pathogens to peach fruit rot in northern Greece and their sensitivity to iprodione, carbendazim, thiophanate-methyl and tebuconazole fungicides[J].Journal of Phytopathology, 2009, 157(3):194-200.
[6] ZHANG Z H, LI S H, SUN D D, et al.Cultivation of Rhodosporidium paludigenum in gluconic acid enhances effectiveness against Penicillium digitatum in citrus fruit[J].Postharvest Biology and Technology, 2021, 172:111374.
[7] ZHOU Y, LI W, ZENG J K, et al.Mechanisms of action of the yeast Debaryomyces nepalensis for control of the pathogen Colletotrichum gloeosporioides in mango fruit[J].Biological Control, 2018, 123:111-119.
[8] LEI X M, DENG B, RUAN C Q, et al.Phenylethanol as a quorum sensing molecule to promote biofilm formation of the antagonistic yeast Debaryomyces nepalensis for the control of black spot rot on jujube[J].Postharvest Biology and Technology, 2022, 185:111788.
[9] 曾丽珍. β-葡聚糖提高拮抗酵母生防效力及相关机理研究[D].杭州:浙江大学, 2015.
ZENG L Z.Study on β-glucan improving biocontrol efficacy of antagonistic yeast and its related mechanism[D].Hangzhou:Zhejiang University, 2015.
[10] 郭东起, 侯旭杰.生防酵母菌结合钼酸铵对冬枣采后主要病害防治的研究[J].保鲜与加工, 2012, 12(2):36-39;54.
GUO D Q, HOU X J.Research on the control of postharvest diseases of winter jujubes using antagonistic yeast in combination with ammonium molybdate[J].Storage &Process, 2012, 12(2):36-39;54.
[11] AHIMA J, ZHANG X Y, YANG Q Y, et al.Biocontrol activity of Rhodotorula mucilaginosa combined with salicylic acid against Penicillium digitatum infection in oranges[J].Biological Control, 2019, 135:23-32.
[12] ZHU R Y, LU L F, GUO J, et al.Postharvest control of green mold decay of Citrus fruit using combined treatment with sodium bicarbonate and Rhodosporidium paludigenum[J].Food and Bioprocess Technology, 2013, 6(10):2925-2930.
[13] SHAO Y Z, ZENG J K, TANG H, et al.The chemical treatments combined with antagonistic yeast control anthracnose and maintain the quality of postharvest mango fruit[J].Journal of Integrative Agriculture, 2019, 18(5):1159-1169.
[14] 蔡孟轩, 邓丽莉, 姚世响, 等.CaCl2增强橄榄假丝酵母对苹果果实采后青霉病的生防效力[J].食品科学, 2019, 40(11):220-226.
CAI M X, DENG L L, YAO S X, et al.CaCl2 enhances the biocontrol efficacy of Candida oleophila against inoculated Penicillium expansum on postharvest apples[J].Food Science, 2019, 40(11):220-226.
[15] AN B, LI B Q, QIN G Z, et al.Exogenous calcium improves viability of biocontrol yeasts under heat stress by reducing ROS accumulation and oxidative damage of cellular protein[J].Current Microbiology, 2012, 65(2):122-127.
[16] 张静茹. 壳聚糖复合硅酸钠处理对冬枣抗病性诱导机制的研究[D].临汾:山西师范大学, 2020.
ZHANG J R.Study on the mechanism of inducing disease resistance of Dongzao jujube by chitosan combined with sodium silicate treatment[D].Linfen:Shanxi Normal University, 2020.
[17] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG Y B, ZHAO Y M.Postharvest Physiological and Biochemical Experiment Guidance for Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007.
[18] DENG L L, ZENG K F, ZHOU Y H, et al.Effects of postharvest oligochitosan treatment on anthracnose disease in citrus (Citrus sinensis L.Osbeck) fruit[J].European Food Research and Technology, 2015, 240(4):795-804.
[19] SUN K Y, WANG Z, ZHANG X Q, et al.Enhancement of biocontrol efficacy of Pichia kudriavzevii induced by Ca ascorbate against Botrytis cinerea in cherry tomato fruit and the possible mechanisms of action[J].Microbiology Spectrum, 2021, 9(3):e0150721.
[20] 赵亚婷, 朱璇, 马玄, 等.采前水杨酸处理对杏果实抗病性及苯丙烷代谢的诱导[J].食品科学, 2015, 36(2):216-220.
ZHAO Y T, ZHU X, MA X, et al.Induction of disease resistance and phenylpropanoid metabolism in apricot fruits by pre-harvest salicylic acid treatment[J].Food Science, 2015, 36(2):216-220.
[21] ZHANG X B, LIU C J.Multifaceted regulations of gateway enzyme phenylalanine ammonia-lyase in the biosynthesis of phenylpropanoids[J].Molecular Plant, 2015, 8(1):17-27.
[22] ZHANG W L, JIANG H T, CAO J K, et al.UV-C treatment controls brown rot in postharvest nectarine by regulating ROS metabolism and anthocyanin synthesis[J].Postharvest Biology and Technology, 2021, 180:111613.
[23] 陈力维, 令阳, 邓丽莉, 等.L-半胱氨酸处理对采后青脆李果实苯丙烷代谢的影响[J].农业工程学报, 2020, 36(13):257-263.
CHEN L W, LING Y, DENG L L, et al.Effects of L-cysteine treatment on phenylpropanoid metabolism of postharvest “Qingcui” plum fruit[J].Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(13):257-263.
[24] GODANA E A, YANG Q Y, ZHAO L N, et al.Pichia anomala induced with chitosan triggers defense response of table grapes against post-harvest blue mold disease[J].Frontiers in Microbiology, 2021, 12:704519.
[25] 蒋超男, 李灿婴, 李伊涵, 等.采后核黄素处理对苹果青霉病及活性氧和苯丙烷代谢的影响[J].保鲜与加工, 2021, 21(3):1-7.
JIANG C N, LI C Y, LI Y H, et al.Effects of riboflavin treatment on blue mould and reactive oxygen species and phenylpropanoid metabolisms in postharvest apples[J].Storage and Process, 2021, 21(3):1-7.