中国十二大香型白酒之一的酱香型白酒,具有酿造周期最长,工艺最复杂,参与微生物最多,风味物质最丰富等特点[1],其生产工艺为每年1个生产大周期,2次投粮,9次蒸馏,8次发酵,7次取酒,简称“12987”[2-4]。其中7次取酒依次为一至七轮次基酒,因生产风格不同,具有明显不同的轮次风格特征,而综合基酒由7个单轮次基酒以不同比例组合勾调而成,酒体更为丰富和独特。查阅近十年文献,关于白酒成品酒风味物质的研究很多,尤其是研究挥发性风味物质的文献较多[5-11],先前关于酱香型白酒不同轮次基酒中挥发性风味物质的差异研究也有报道,而关于轮次基酒中非挥发性成分的系统研究却鲜有报道。
超高效液相色谱(ultra performance liquid chromatography, UPLC)[12-15]及UPLC-MS[16-18]已经被广泛应用于分析白酒中的非挥发性风味物质,相较于GC及MS/MS需要衍生化处理,LC具有无需衍生化,且灵敏度高、分离度好等优势,而GC-MS甚至对低含量的化合物也具有很高的检测灵敏度。近年来,色谱技术结合主成分分析(principal component analysis,PCA)[3,19-20]、正交偏最小二乘法判别分析(orthogonal partial least squares-discrimination analysis, OPLS-DA)[21]、聚类分析、人工神经网络分析等方法也逐渐被应用到了酒类风味物质的分析研究中[22]。PCA能够将多个数据信息浓缩,并能够保留大量数据信息[23],基于色谱分析的代谢组学在酒类分析研究中应用具有非常大的潜力。VACLAVIK等[24]采用高效液相色谱串联四极杆飞行时间质谱检测了3种不同地理来源的葡萄酒品种,采用PCA和PLS-DA探索数据结构并构建分类模型,能对96%的样本进行正确分类;唐维川等[3]通过GC分析酱香型白酒轮次基酒中的挥发性风味物质,利用PCA基本能够实现不同轮次酒的特征香味物质的差异性评价。
课题组前期在白酒风味物质研究基础上,采用UPLC及UPLC-MS/MS分析不同生产企业酱香型白酒一至七轮次及综合基酒中的非挥发性有机酸及酚酸类物质,乳酸由于含量很高采用LC法单独测定。非挥发性有机酸是酱香型白酒风味物质中非常重要的一类组分,主要承担增强酒体浓厚感及呈味的作用[25];非挥发性酚类化合物是白酒中的滋味物质和健康成分,不仅影响白酒的风格和口感,增加白酒风味层次感,同时还具有抗氧化的作用[26-27]。本试验利用化学计量学的方法对不同轮次及综合基酒中非挥发性有机酸及酚酸类物质进行分析,旨在找出不同轮次基酒及综合基酒中的共性与差异,为酱香型白酒酒体设计及生产工艺提供理论依据和数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
甲醇、乙腈,均为色谱纯,默克公司;甲酸、磷酸,天津市科密欧化学试剂有限公司;标准物质:乳酸、富马酸、马来酸、琥珀酸、酒石酸、苹果酸、月桂酸、肉豆蔻酸、棕榈酸、亚麻酸、硬脂酸、亚油酸、油酸、阿魏酸、原儿茶酸、丁香酸、香草酸、咖啡酸、绿原酸、p-香豆酸、没食子酸、苯甲酸,阿尔塔科技有限公司。
1.1.2 酒样
依据《仁怀产区大曲酱香酒技术标准体系》中感官品评标准术语,经专业感官品评后筛选出符合大曲酱香一至七轮次基酒风格酒样共3组共21个,来自贵州仁怀产区3个酱香型白酒生产企业(A、B、C),同一组样品为同一厂家、同一年份一至七轮次基酒,综合基酒以同一组一至七轮次基酒以不同比例组合勾调而成,具体组合见表1,共计24个酒样,均常温下密封避光贮存。
表1 不同轮次基酒酒精度及其在综合基酒中的含量
Table 1 Alcohol content of different round base liquor and percentage of each base liquor in comprehensive base liquor
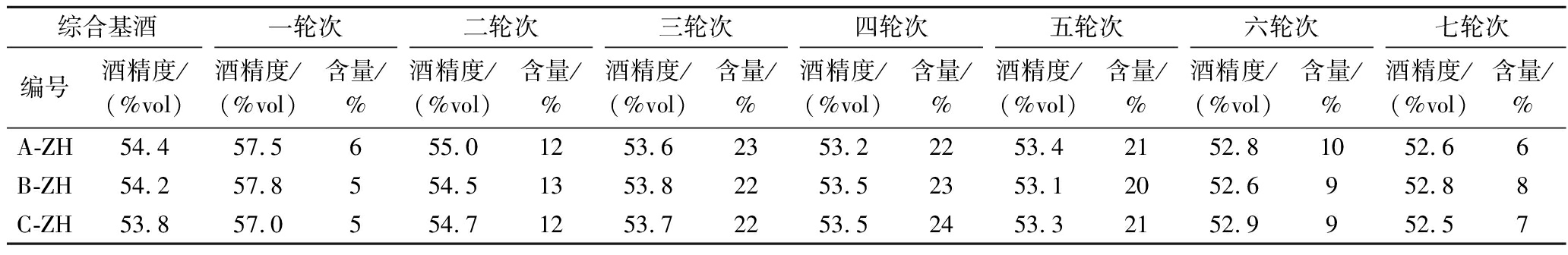
综合基酒一轮次二轮次三轮次四轮次五轮次六轮次七轮次编号酒精度/(%vol)酒精度/(%vol)含量/%酒精度/(%vol)含量/%酒精度/(%vol)含量/%酒精度/(%vol)含量/%酒精度/(%vol)含量/%酒精度/(%vol)含量/%酒精度/(%vol)含量/%A-ZH54.457.5655.01253.62353.22253.42152.81052.66B-ZH54.257.8554.51353.82253.52353.12052.6952.88C-ZH53.857.0554.71253.72253.52453.32152.9952.57
1.2 仪器与设备
1200系列液相色谱仪,安捷伦科技;Ultimate 3000-TSQ QUANTUM ULTRA三重四极杆液质联用仪,赛默飞科技;PHS-3C型pH计,上海仪电科学仪器;Milli-QAA10超纯水系统,倍捷科技。
1.3 方法
1.3.1 UPLC测定乳酸
样品的制备:准确吸取酒样2 mL于10 mL容量瓶中,用超纯水定容至刻度,摇匀。过0.22 μm水相滤膜,待UPLC测定乳酸含量。
仪器条件:色谱柱C18柱(4.6 mm×250 mm, 5 μm);流动相A相为0.1%磷酸溶液,B相为甲醇,0~10 min:5%B,10.50~15.00 min:100%B,15.10~20.00 min:5%B;流速1.00 mL/min;柱温40 ℃;进样量20 μL;检测器DAD;检测波长210 nm。乳酸出峰时间为4.241 min。
1.3.2 UPLC-MS/MS测定酒样中7种高级脂肪酸
样品的制备:准确吸取酒样2 mL于10 mL容量瓶中,用甲醇定容至刻度,摇匀。过0.22 μm有机相微孔滤膜,待UPLC-MS/MS测定高级脂肪酸类物质。
UPLC仪器条件:色谱柱XDB-C18柱(4.6 mm×50 mm,1.8 μm);流动相A相为0.1%甲酸溶液,B相为甲醇,0~4 min:70%~100%B,4.01~7.50 min:100%B,7.51~13.00 min:70%B;柱温30 ℃;进样量10 μL;流速0.20 mL/min。
MS仪器条件:电喷雾离子源(ESI),负离子模式;一级MS扫描;毛细管温度:350 ℃;雾化气温度:300 ℃;鞘气压力:25 Arb;喷雾电压:4 000 V。
7种高级脂肪酸质谱参数及保留时间见表2。
表2 7种高级脂肪酸的质谱分析参数
Table 2 MS parameters of 7 higher fatty acids
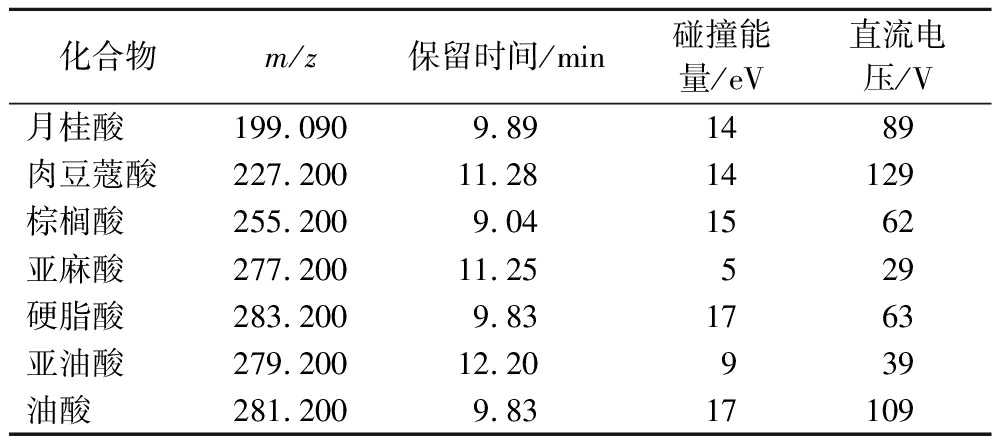
化合物m/z保留时间/min碰撞能量/eV直流电压/V月桂酸199.0909.891489肉豆蔻酸227.20011.2814129棕榈酸255.2009.041562亚麻酸277.20011.25529硬脂酸283.2009.831763亚油酸279.20012.20939油酸281.2009.8317109
1.3.3 LC-MS/MS测定酒样中8种酚酸及6种其他非挥发性有机酸
样品的制备:准确吸取酒样10 mL于蒸发皿中,60 ℃水浴1 h, 过经甲醇活化后的HLB小柱后,用甲醇洗脱,甲醇定容至5 mL比色管中。过0.22 μm有机相微孔滤膜,待LC-MS/MS测定酚酸类物质。
LC仪器条件:色谱柱为XDB-C18柱(4.6 mm×50 mm,1.8 μm);流动相A相为0.1%甲酸溶液,B相为甲醇,0~15.00 min:5%~100%B,15.10~17.00 min:100%B,17.10~20.00 min:5%B;柱温30 ℃;进样量10 μL;流速0.25 mL/min。
MS仪器条件:电喷雾离子源(ESI),负离子模式;选择反应监测(SRM);毛细管温度:300 ℃;雾化气温度:320 ℃;鞘气压力:25 Arb;喷雾电压:3 500 V。
8种酚酸及6种其他非挥发性有机酸质谱参数及保留时间见表3。
表3 酚酸及其他非挥发性有机酸的质谱分析参数
Table 3 The MS analysis parameters of phenolic acids and other non-volatile organic acids
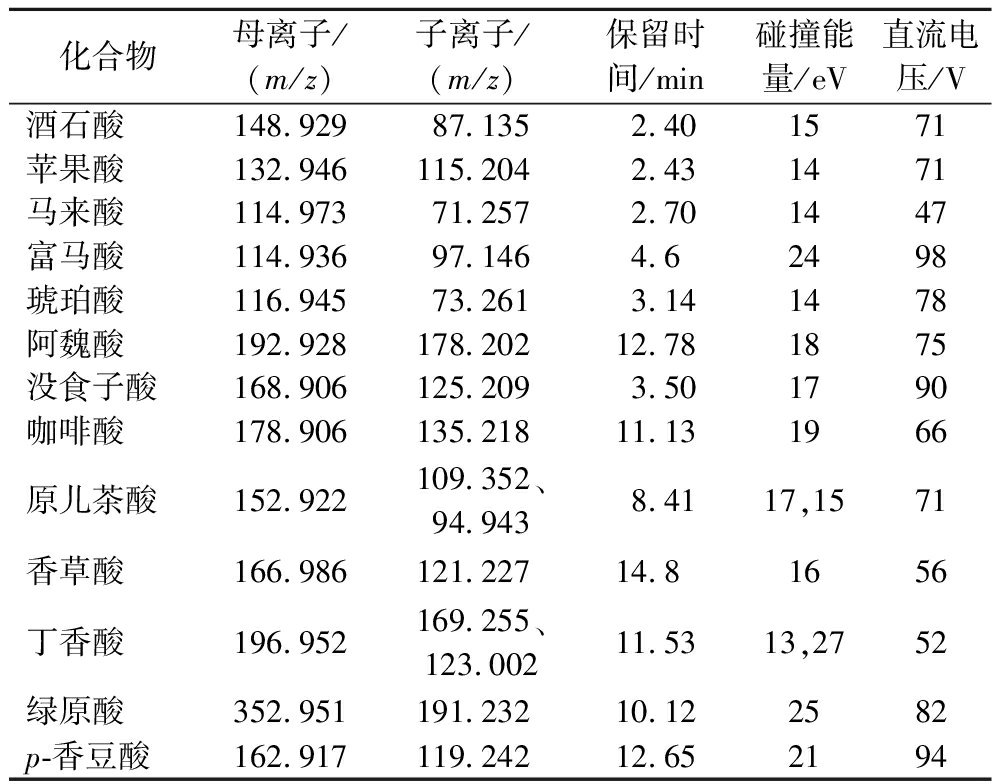
化合物母离子/(m/z)子离子/(m/z)保留时间/min碰撞能量/eV直流电压/V酒石酸148.92987.1352.401571苹果酸132.946115.2042.431471马来酸114.97371.2572.701447富马酸114.93697.1464.62498琥珀酸116.94573.2613.141478阿魏酸192.928178.20212.781875没食子酸168.906125.2093.501790咖啡酸178.906135.21811.131966原儿茶酸152.922109.352、94.9438.4117,1571香草酸166.986121.22714.81656丁香酸196.952169.255、123.00211.5313,2752绿原酸352.951191.23210.122582p-香豆酸162.917119.24212.652194
1.3.4 定性定量方法
定性条件:在相同试验条件下,样品检出的色谱峰保留时间和离子丰度比与标准样品相一致,则可判定为该成分。
定量条件:采用外标-标准曲线法定量测定。所有酒样均平行测定3次。
1.3.5 数据处理
采用SIMCA 13.0 软件进行PCA、OPLS-DA鉴别模型构建及变量权重重要性排序分析,根据变量投影重要性(variable importance in projection,VIP)值的发现判断各非挥发性化合物对大曲酱香一至七轮次及综合基酒差异的贡献,筛选出关键差异化合物。采用SPSS软件对数据进行显著性分析,Origin软件绘制潜在差异化合物在不同酒样中的变化趋势。
2 结果与讨论
2.1 22种非挥发性化合物的定性定量分析
通过外标法建立绘制5~6点标准曲线,准确构建了22种非挥发性化合物标准样品的检测方法。22种化合物包括乳酸、7种高级脂肪酸、8种酚酸以及6种其他有机酸(22种非挥发性化合物的定性定量详见增强出版附表1,https://doi.org/10.13995/j.cnki.11-1802/ts.035939)。标准曲线R2>0.99,线性关系良好;RSD<6,精密度良好。
在酒样中共检出18种化合物,其中包括乳酸、马来酸、富马酸、酒石酸、苹果酸、琥珀酸、苯甲酸、月桂酸、肉豆蔻酸、棕榈酸、亚麻酸、硬脂酸、油酸及亚油酸共14种非挥发性有机酸,以及阿魏酸、原儿茶酸、丁香酸、香草酸共4种酚酸,另外4种酚酸(咖啡酸、绿原酸、p-香豆酸、没食子酸)在酒样中均未检出。
2.2 不同的酱香型白酒样品中非挥发性物质分析
2.2.1 不同轮次酱香型基酒非挥发性物质分析
由表4可以看出,同一个酒样中乳酸含量最高(529.940~2 731.865 mg/L),远高于其他17种非挥发性风味物质,不同的化合物在一至七轮次及综合基酒中的含量变化有所不同。乳酸含量先增后降,在第二轮次基酒中最高,第七轮次基酒中最低,这是因为不同轮次酒醅中的乳酸具有不易挥发、多轮次积累的特点,因此前期轮次增高,而伴随酿造原料中淀粉含量的降低,乳酸菌合成乳酸的速度又会减缓,因此在后几个轮次会有降低趋势[28]。高级脂肪酸类物质含量在第一轮次最高,在第二、三、四轮次无明显差异,第五、六、七轮次缓慢下降,在第七轮次中最低,这是因为酒体中的高级脂肪酸可由芽胞杆菌属代谢产生,脂肪酸的β氧化可以生成酮类化合物,是乙偶姻这一风味物质的重要来源,同时,脂肪酸可以在发酵过程中和乙酸反应转化为脂肪酸酯,棕榈酸乙酯、油酸乙酯、亚油酸乙酯作为为白酒中的三大高级脂肪酸酯,其含量对酒体透明度和质量有重要影响。阿魏酸、酒石酸、马来酸、富马酸含量随轮次先增后降,在五轮次中含量最高,在一轮次中含量最低。乳酸、棕榈酸、油酸、亚油酸在酒样中检出浓度较高,初步猜测这几种含量较高的物质对区分不同轮次酱香型白酒有较大的贡献,且乳酸的贡献明显大于其他物质,这一结论是否合理需结合化学计量学进一步验证。
表4 酒样中18种目标化合物的质量浓度 单位:mg/L
Table 4 Mass concentrations of the 18 target compounds in the liquor samples
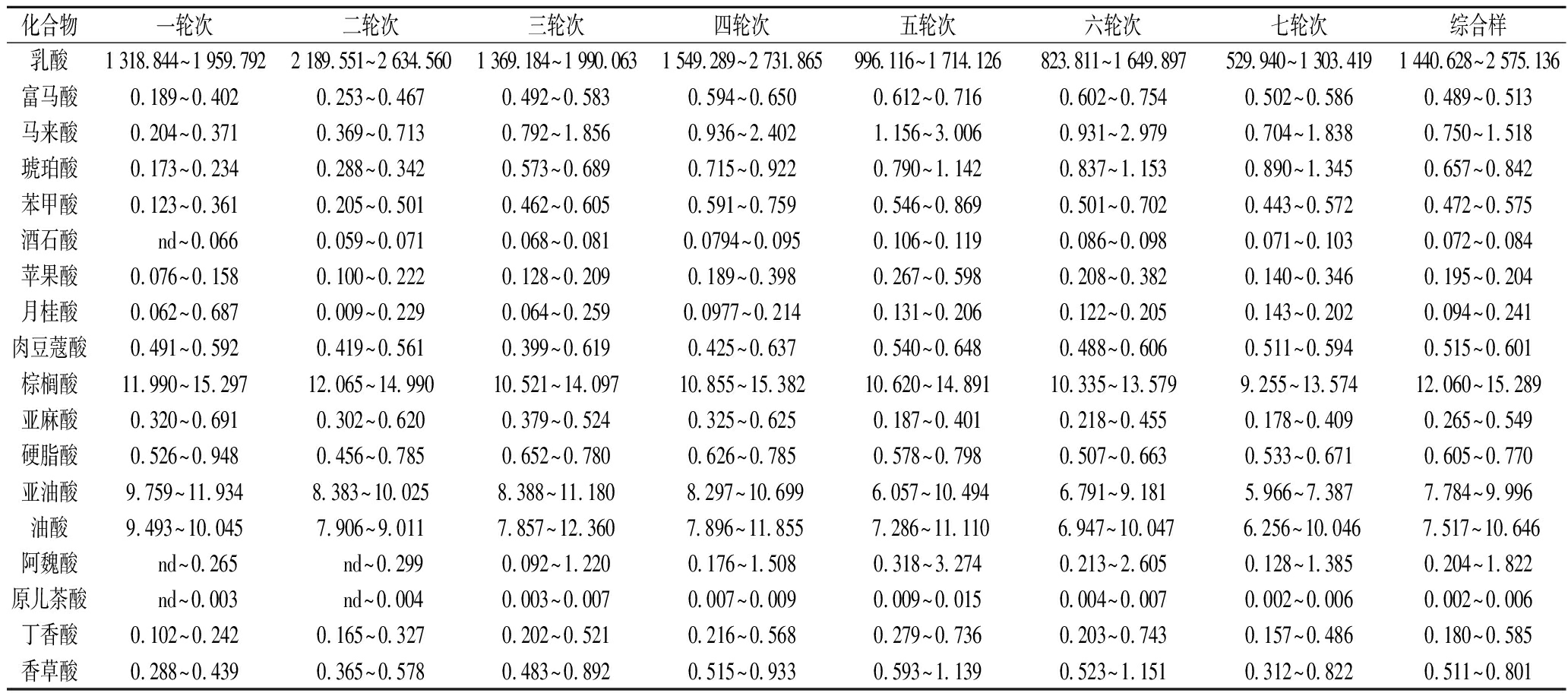
化合物一轮次二轮次三轮次四轮次五轮次六轮次七轮次综合样乳酸1 318.844~1 959.7922 189.551~2 634.5601 369.184~1 990.0631 549.289~2 731.865996.116~1 714.126823.811~1 649.897529.940~1 303.4191 440.628~2 575.136富马酸0.189~0.4020.253~0.4670.492~0.5830.594~0.6500.612~0.7160.602~0.7540.502~0.5860.489~0.513马来酸0.204~0.3710.369~0.7130.792~1.8560.936~2.4021.156~3.0060.931~2.9790.704~1.8380.750~1.518琥珀酸0.173~0.2340.288~0.3420.573~0.6890.715~0.9220.790~1.1420.837~1.1530.890~1.3450.657~0.842苯甲酸0.123~0.3610.205~0.5010.462~0.6050.591~0.7590.546~0.8690.501~0.7020.443~0.5720.472~0.575酒石酸 nd~0.0660.059~0.0710.068~0.0810.0794~0.0950.106~0.1190.086~0.0980.071~0.1030.072~0.084苹果酸0.076~0.1580.100~0.2220.128~0.2090.189~0.3980.267~0.5980.208~0.3820.140~0.3460.195~0.204月桂酸0.062~0.6870.009~0.2290.064~0.2590.0977~0.2140.131~0.2060.122~0.2050.143~0.2020.094~0.241肉豆蔻酸0.491~0.5920.419~0.5610.399~0.6190.425~0.6370.540~0.6480.488~0.6060.511~0.5940.515~0.601棕榈酸11.990~15.29712.065~14.99010.521~14.09710.855~15.38210.620~14.89110.335~13.5799.255~13.57412.060~15.289亚麻酸0.320~0.6910.302~0.6200.379~0.5240.325~0.6250.187~0.4010.218~0.4550.178~0.4090.265~0.549硬脂酸0.526~0.9480.456~0.7850.652~0.7800.626~0.7850.578~0.7980.507~0.6630.533~0.6710.605~0.770亚油酸9.759~11.9348.383~10.0258.388~11.1808.297~10.6996.057~10.4946.791~9.1815.966~7.3877.784~9.996油酸9.493~10.0457.906~9.0117.857~12.3607.896~11.8557.286~11.1106.947~10.0476.256~10.0467.517~10.646阿魏酸 nd~0.265 nd~0.2990.092~1.2200.176~1.5080.318~3.2740.213~2.6050.128~1.3850.204~1.822原儿茶酸 nd~0.003 nd~0.0040.003~0.0070.007~0.0090.009~0.0150.004~0.0070.002~0.0060.002~0.006丁香酸0.102~0.2420.165~0.3270.202~0.5210.216~0.5680.279~0.7360.203~0.7430.157~0.4860.180~0.585香草酸0.288~0.4390.365~0.5780.483~0.8920.515~0.9330.593~1.1390.523~1.1510.312~0.8220.511~0.801
注:“nd”表示未检出。
2.2.2 不同轮次及综合基酒 OPLS-DA模型建立及模型预测与验证
仪器分析3组不同厂家一至七轮次基酒及综合基酒共24个样,获得72个样本值。对所有样本值进行PCA,通过排查异常值,采用 Hotelling’s T2法和 DModX 法未发现有可疑和异常数据,72个值均用于建立辨识模型训练和预测并查找差异化合物。从OPLS-DA散点得分图可以看出不同轮次基酒及综合基酒分布情况(图1),五、六、七轮次完全分布在t1轴左侧,二、四轮次及综合基酒完全分布在t1轴右侧,一、二、七轮次基酒可分别与其他轮次基酒完全分开,且组内差异较小;三、四轮次及综合基酒样本值无法完全分开,这是因为综合基酒中三、四轮次用酒比例比较大,各占约25%,化合物含量及种类比较接近。表明风味特征相似的酒体散点相对聚合(如三、

图1 一至七轮次及综合基酒OPLS-DA得分图
Fig.1 OPLS-DA score plot for rounds one to seven and combined base liquors
四、五轮次及综合基酒),不同风味的酒体散点分布离散(如一、二、七轮次),这一结论与唐维川等[3]报道的不同轮次酱香型白酒中挥发性风味物质的评价结论相一致,是在挥发性风味研究基础上的数据补充,对酱香型白酒不同轮次基酒的精准识别更为科学有益。
通过置换检验(n=200),结果如图2所示,图中左侧点均低于右侧的点,Q2截距为-0.147(<-0.05),验证模型有效[29]。
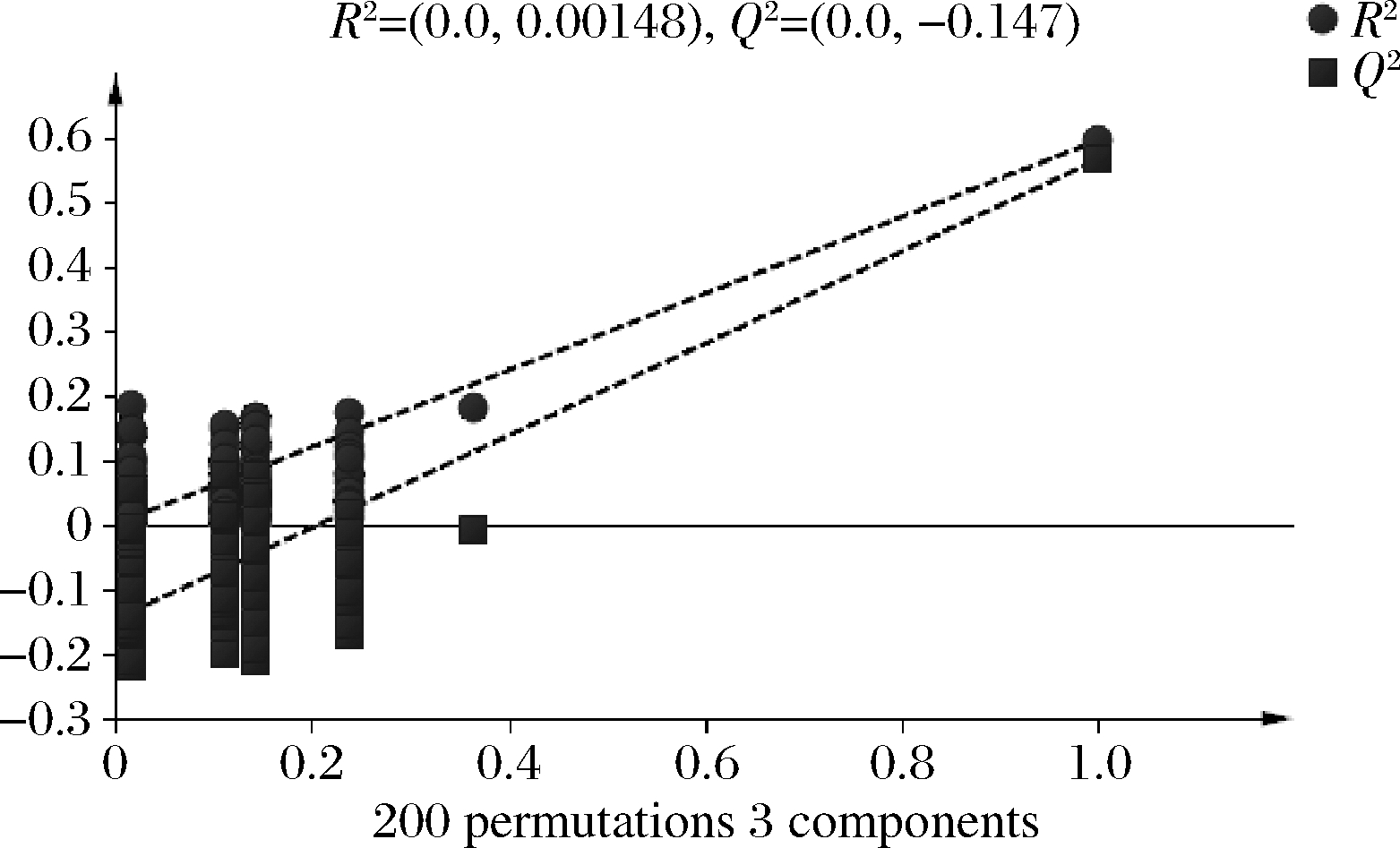
图2 不同轮次基酒置换检验结果
Fig.2 Results of different rounds of base wine replacement tests
2.2.3 潜在差异性物质的确认
通过查看该模型VIP值排序(图3)可知,VIP>1的化合物包括:乳酸、亚油酸、油酸、马来酸及阿魏酸,确认上述5种化合物为区分不同轮次基酒的潜在差异性化合物,其中乳酸的VIP值最高(2.628 6)。进一步验证了2.2.1节的猜测中乳酸、油酸、亚油酸这几种含量较高的化合物对区分不同轮次酒样有重要贡献,但不能仅以含量较高作为区分不同轮次基酒贡献的唯一评价标准,如棕榈酸较高,但其VIP<1。
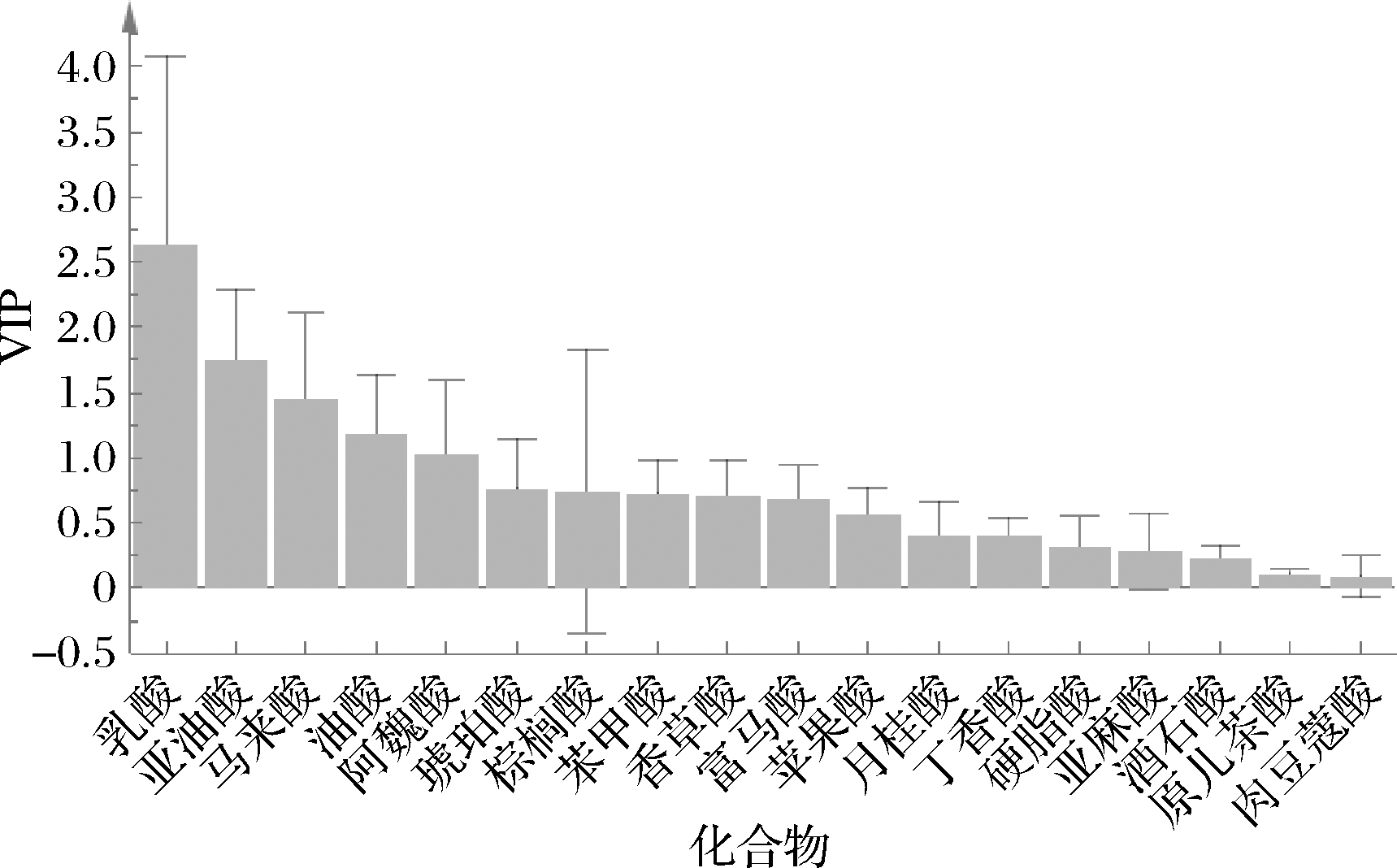
图3 不同轮次基酒中18种非挥发性化合物的VIP值
Fig.3 VIP values of 18 target compounds in different rounds of base liquor
如图4所示,5种潜在差异化合物平均值含量有不同的变化趋势:乳酸含量呈先上升后下降,在第二轮次基酒中最高,这与蒙德俊等[1]报道的利用离子色谱检测酱香型不同轮次基酒中乳酸变化趋势的结论相一致,在第七轮次基酒中最低的趋势,二轮次中与其他轮次存在显著差异(P<0.05),在第一、三、四轮次及综合基酒中比较接近,无显著差异(P>0.05)。亚油酸含量在一轮次基酒中最高,七轮次基酒中最低,且第一轮次和第七轮次基酒分别与其他轮次及综合基酒存在显著差异(P<0.05),在第二、三、四、五、六轮次及综合基酒中相邻轮次间存在差异,但不显著(P>0.05),在第二、三、四轮次基酒中与第六轮次基酒中差异显著(P<0.05)。油酸含量总体变化趋势与亚油酸类似,在第一轮次基酒中最高,第七轮次基酒中最低,在第一、七轮次基酒存在显著性差异(P<0.05),相邻轮次及综合基酒中存在差异但不显著(P>0.05),在综合基酒中与第二、五轮次基酒中的含量接近,三、四轮次中含量很接近。阿魏酸含量总体呈先上升后下降,在第五轮次基酒中最高,在第一轮次基酒中最低的趋势,在第五轮次基酒中与第一、二、三、四、七轮次及综合基酒存在显著差异(P<0.05),第一、二、三轮次基酒差异不显著(P>0.05),但与第五、六轮次酒存在显著差异(P<0.05),在综合基酒中与其他(除第五轮次外)轮次存在差异但均不显著(P>0.05)。马来酸含量总体呈先上升后下降,在第五轮次基酒中最高,在第一轮次基酒中最低的趋势,其在第一、二轮次基酒中差异较小,但在这2个轮次基酒中与在其他轮次及综合基酒中的含量有显著差异(P<0.05),其在第五、六轮次基酒中差异较小,但在这2个轮次基酒中与第一、二、三、七轮次及综合基酒中含量存在显著差异(P<0.05),在综合基酒中含量与第三、七轮次基酒接近,与其他轮次基酒存在显著差异(P<0.05)。进一步验证了构建模型筛选出的差异化合物基本在大曲酱香一至七轮次及综合基酒中存在不同的差异变化。

a-乳酸;b-亚油酸;c-油酸;d-阿魏酸;e-马来酸
图4 五种潜在差异物质在不同轮次基酒中的变化趋势
Fig.4 Variation tendency of 5 potential differential substances in different rounds of base liquor
注:不同字母表示组间差异显著(P<0.05)。
3 结论
本研究建立了一种基于UPLC及UPLC-MS/MS法测定22种非挥发性风味物质的检测方法,具有简单、可靠、灵敏度高、重现性较好等特点,可用于批量样品的检测与分析。通过运用该方法在酱香型白酒轮次基酒及综合基酒中检出18种非挥发性风味物质(包括14种非挥发性有机酸和4种酚酸),并总结了其在不同轮次的变化规律。还通过PCA及OPLS-DA法构建了酱香型白酒一至七轮次基酒及综合基酒的鉴别模型,VIP分析表明乳酸、油酸、亚油酸、马来酸及阿魏酸共5种潜在差异物质具有区分不同轮次及综合基酒的潜力,对区分不同轮次酱香型白酒贡献较大的差异化合物可以为酱香型白酒分型定级工作提供参考依据,且它们的含量变化趋势也可作为生产过程中轮次风格是否存在偏离的监控和指导依据。这为进一步全面解析酱香型白酒中的风味物质,更加科学精准地评价酱香型白酒轮次基酒质量做出重要贡献。后续的研究中将在此基础上结合挥发性风味物质对酱香型白酒轮次基酒中不同香型及不同等级的差异分析进行深入探索。
[1] 蒙德俊, 张娇娇, 郭炳豪, 等.酱香型白酒轮次基酒酸类风味物质与酒醅微生物的相关性分析[J].食品科技, 2022, 47(10):77-83.
MENG D J, ZHANG J J, GUO B H, et al.Correlation analysis of acid flavor substances and microorganisms in fermented grains of Maotai flavor Baijiu[J].Food Science and Technology, 2022, 47(10):77-83.
[2] 王川南. 酱香型白酒品质表达的基础性因素研究[D].贵阳:贵州大学.
WANG C N.Study on basic factors of quality expression of sauce-flavor liquor[D].Guiyang:Guizhou University.
[3] 唐维川, 孔祥凯, 王婷, 等.基于主成分分析法评价酱香型白酒的不同轮次基酒[J].现代食品科技, 2021, 37(7):269-277;268.
TANG W C, KONG X K, WANG T, et al.Evaluation of different rounds of Moutai-flavor Baijiu based on principal component analysis[J].Modern Food Science and Technology, 2021, 37(7):269-277;268.
[4] 沈毅, 许忠, 王西, 等.论酱香型郎酒酿造时令的科学性[J].酿酒科技, 2013(9):43-48.
SHEN Y, XU Z, WANG X, et al.On the scientific nature of the producing seasons of Jiang-flavor Langjiu[J].Liquor-Making Science &Technology, 2013(9):43-48.
[5] CHEN W T, KARANGWA E, YU J Y, et al.Characterizing red radish pigment off-odor and aroma-active compounds by sensory evaluation, gas chromatography-mass spectrometry/olfactometry and partial least square regression[J].Food and Bioprocess Technology, 2017, 10(7):1337-1353.
[6] WANG L L, FAN S S, YAN Y, et al.Characterization of potent odorants causing a pickle-like off-odor in Moutai-aroma type Baijiu by comparative aroma extract dilution analysis, quantitative measurements, aroma addition, and omission studies[J].Journal of Agricultural and Food Chemistry, 2020, 68(6):1666-1677.
[7] XU M L, YU Y, RAMASWAMY H S, et al.Characterization of Chinese liquor aroma components during aging process and liquor age discrimination using gas chromatography combined with multivariable statistics[J].Scientific Reports, 2017, 7:39671.
[8] FAN W L, XU Y, QIAN M C.Identification of aroma compounds in Chinese “Moutai” and “Langjiu” liquors by normal phase liquid chromatography fractionation followed by gas chromatography/olfactometry[M]//ACS Symposium Series.Washington, DC:American Chemical Society, 2012:303-338.
[9] ZHAO T F, CHEN S, LI H Z, et al.Identification of 2-hydroxymethyl-3, 6-diethyl-5-methylpyrazine as a key retronasal burnt flavor compound in soy sauce aroma type Baijiu using sensory-guided isolation assisted by multivariate data analysis[J].Journal of Agricultural and Food Chemistry, 2018, 66(40):10496-10505.
[10] FAN W L, SHEN H Y, XU Y.Quantification of volatile compounds in Chinese soy sauce aroma type liquor by stir bar sorptive extraction and gas chromatography-mass spectrometry[J].Journal of the Science of Food and Agriculture, 2011, 91(7):1187-1198.
[11] WANG L, HU G Y, LEI L B, et al.Identification and aroma impact of volatile terpenes in Moutai liquor[J].International Journal of Food Properties, 2016, 19(6):1335-1352.
[12] 刘露, 刘国英, 马雷, 等.超高效液相色谱法测定白酒中的琥珀酸的含量[J].酿酒, 2018, 45(3):99-101.
LIU L, LIU G Y, MA L, et al.Determination of succinic acid in liquor by UPLC[J].Liquor Making, 2018, 45(3):99-101.
[13] 吴子阳, 何菲, 李贺贺, 等.采用固相萃取结合高效液相色谱测定清香型白酒中酚类活性化合物[J].分析化学, 2020, 48(10):1400-1408.
WU Z Y, HE F, LI H H, et al.Determination of phenolic active compounds in light-aroma Baijiu by solid phase extraction-high performance liquid chromatography[J].Chinese Journal of Analytical Chemistry, 2020, 48(10):1400-1408.
[14] 庄俊钰, 方毅斐, 侯真真, 等.豉香型白酒中乳酸分析的前处理方法和测定技术研究[J].食品工业, 2017, 38(7):291-294.
ZHUANG J Y, FANG Y F, HOU Z Z, et al.Study on the pretreatment and determination methods of lactic acid in Chi-flavor Chinese spirits[J].The Food Industry, 2017, 38(7):291-294.
[15] 张瑞景, 王浩, 蔡凤娇, 等.高效液相色谱法检测白酒中四种有机酸的方法研究[J].中国酿造, 2022, 41(3):238-242.
ZHANG R J, WANG H, CAI F J, et al.Determination of four organic acids in Baijiu by HPLC[J].China Brewing, 2022, 41(3):238-242.
[16] 王戎, 廖勤俭, 安明哲, 等.白酒中酚酸及酚酸酯检测方法的研究[J].酿酒科技, 2019(7):110-113.
WANG R, LIAO Q J, AN M Z, et al.Detection methods of phenolic acids and phenolic acid esters in Baijiu[J].Liquor-Making Science &Technology, 2019(7):110-113.
[17] 刘露, 吴文睿, 方颂平, 等.UPLC-QTOF-MS法检测白酒中9种有机酸[J].安徽科技学院学报, 2021, 35(2):81-85.
LIU L, WU W R, FANG S P, et al.Developed UPLC-QTOF-MS method to detect 9 organic acids in liquor[J].Journal of Anhui Science and Technology University, 2021, 35(2):81-85.
[18] 廖勤俭, 练顺才, 李杨华, 等.高效液相色谱四级杆飞行时间质谱联用技术检测白酒中高级脂肪酸[J].酿酒科技, 2013(10):97-99.
LIAO Q J, LIAN S C, LI Y H, et al.Determination of higher fatty acids in liquor by LC-QTOF[J].Liquor-Making Science &Technology, 2013(10):97-99.
[19] 孙细珍, 张帆, 杜佳炜, 等.基于毛细管气相色谱法和主成分分析的白酒真假酒判别分析[J].酿酒, 2021, 48(1):42-50.
SUN X Z, ZHANG F, DU J W, et al.Discriminant analysis for Chinese spirits authenticity based on capillary gas chromatography and principal component analysis[J].Liquor Making, 2021, 48(1):42-50.
[20] 吴奇霄, 余松柏, 马龙, 等.基于LC-MS和GC-MS结合多元统计的白酒酚类成分分析[J].中国酿造, 2022, 41(12):223-229.
WU Q X, YU S B, MA L, et al.Component analysis of phenols in Baijiu based on LC-MS and GC-MS combined with multivariate statistics[J].China Brewing, 2022, 41(12):223-229.
[21] ZHANG J A, TIAN Z Q, MA Y Q, et al.Origin identification of the sauce-flavor Chinese Baijiu by organic acids, trace elements, and the stable carbon isotope ratio[J].Journal of Food Quality, 2019, 2019:1-7.
[22] 胡雪, 李锦松, 唐永清, 等.基于GC-MS结合化学计量学的浓香型白酒分类方法[J].食品与发酵工业, 2021, 47(8):212-217.
HU X, LI J S, TANG Y Q, et al.Classification of strong-flavor Baijiu based on GC-MS combined with chemometric method[J].Food and Fermentation Industries, 2021, 47(8):212-217.
[23] 纪南, 廖永红, 丁芳, 等.市售5种酱香型白酒挥发性风味物质的主成分分析[J].酿酒科技, 2016(9):17-22;30.
JI N, LIAO Y H, DING F, et al.Principal component analysis of volatile flavoring compounds in five kinds of Jiangxiang Baijiu[J].Liquor-Making Science &Technology, 2016(9):17-22;30.
[24] VACLAVIK L, LACINA O, HAJSLOVA J, et al.The use of high performance liquid chromatography-quadrupole time-of-flight mass spectrometry coupled to advanced data mining and chemometric tools for discrimination and classification of red wines according to their variety[J].Analytica Chimica Acta, 2011, 685(1):45-51.
[25] 杨会. 白酒中不挥发呈味有机酸和多羟基化合物研究[D].无锡:江南大学, 2017.
YANG H.Characterization of non-volatile gustatory organic acids and polyhydroxy compounds in Chinese liquors[D].Wuxi:Jiangnan University, 2017.
[26] 陈建业, 温鹏飞, 战吉成, 等.葡萄酒中11种酚酸的反相高效液相色谱测定方法研究[J].中国食品学报, 2006, 6(6):133-138.
CHEN J Y, WEN P F, ZHAN J C, et al.Studies on the determination of 11 phenolic acids in wines by reverse phase high performance liquid chromatography[J].Journal of Chinese Institute of Food Science and Technology, 2006, 6(6):133-138.
[27] XU J W, WANG W Q, ZHAO Y.Phenolic compounds in whole grain sorghum and their health benefits[J].Foods, 2021, 10(8):1921.
[28] 杨帆. 酱香型白酒中乳酸代谢机理及调控策略的研究[D].无锡:江南大学, 2020.
YANG F.Lactic acid metabolic mechanism investigation and control strategy development during Chinese Jiang-flavor liquor making[D].Wuxi:Jiangnan University, 2020.
[29] ZHU M, SUN J, ZHAO H A, et al.Volatile compounds of five types of unifloral honey in Northwest China:Correlation with aroma and floral origin based on HS-SPME/GC-MS combined with chemometrics[J].Food Chemistry, 2022, 384:132461.