蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物结合后,经充分酿造而成的天然甜物质(GB 14963—2011《食品安全国家标准 蜂蜜》)。蜂蜜被人们用作食品和保健品已经有悠久的历史[1]。随着科学研究的不断深入,蜂蜜的活性成分和营养价值也不断被挖掘。在当前全球大健康产业(营养食品和保健用品是重要的领域和环节)快速发展的背景下,蜂蜜的促健康功能越来越受到关注和重视。蜂蜜的主要成分是果糖和葡萄糖(占约70%),同时亦含有蛋白质、氨基酸、脂类、黄酮类、酚酸类、有机酸、维生素、矿物质和挥发性化合物等成分,虽然这些物质总体含量较少,但分子种类很多(200种左右)[2],是蜂蜜中关键的风味和活性决定因子。不同蜂种、蜜源和产地生产的蜂蜜在成分、口感和生物学功能方面存在差异,因此形成了具有不同地域特色的蜂蜜。近年来,我国进口蜂蜜量价齐升。据《2022—2028年中国蜂蜜行业市场竞争状况及发展趋向分析报告》的数据显示,2021年我国进口蜂蜜突破1亿美元,价格为21 879美元/t,是我国出口蜂蜜价格(1 783美元/t)的12.3倍。新西兰蜂蜜年进口量一直位列第一[3],其中麦卢卡(Manuka)蜂蜜是最具代表性的产品,其蜜源来自新西兰本土植物麦卢卡树(Leptospermum scoparium)[4]。麦卢卡蜂蜜根据质量等级分类,每250 g售价可从几百元到数千元人民币。为此人们基于这款新西兰特色蜂蜜进行了大量的成分特征和促健康功能研究。本文对麦卢卡蜂蜜的抗病原微生物机理、调节炎症模式、抗损伤效应、抗肿瘤机制,以及对神经系统功能的影响进行了综述,以期对其科学利用提供依据。
1 麦卢卡蜂蜜的成分特征
1.1 碳水化合物
每100 g麦卢卡蜂蜜中果糖和葡萄糖的含量分别为39.2和30.7 g,果糖/葡萄糖比值较低,约为1.3。而产自澳大利亚的玛里红桉蜂蜜(Marri honey)和凯瑞蜂蜜(Karri honey)果糖/葡萄糖比值分别达到1.6和1.5[5]。果糖/葡萄糖比值决定了蜂蜜的结晶程度(该值越高,越不容易结晶),结晶蜂蜜具有独特的质地和口感,因而受到不少人喜爱。碳水化合物中维持较为平均的果糖/葡萄糖比值更容易被人体吸收[6],较高的果糖/葡萄糖比值则促进肝细胞产生属于血脂成分的甘油三酯和胆固醇[7]。
总二糖和寡糖在麦卢卡蜂蜜中所占比例可达10.73 g/100 g,其中蔗糖1.43 g/100 g、麦芽糖2.35 g/100 g、黑曲霉糖2.43 g/100 g、曲二糖1.57 g/100 g、潘糖1.66 g/100 g[8]。在冻干处理的麦卢卡蜂蜜寡糖粉末中,还检测到了吡喃葡糖基蔗糖和麦芽三糖,并且研究发现,这些寡糖有助于抑制细菌与宿主细胞之间的黏附作用[9],可降低病原菌感染几率;而另一方面,蜂蜜中的寡糖成分可参与调节肠道功能和肠道菌群[10]。
1.2 黄酮类和酚酸类化合物
黄酮类和酚酸类化合物是蜂蜜中的关键活性成分,属于植物的次级代谢产物,在蜜蜂采蜜过程中由植物带入蜂蜜。黄酮类和酚酸类化合物具有显著的抗炎、抗肿瘤和抗衰老等药理学功效[11-13],两者在麦卢卡蜂蜜中均具有较高含量。
麦卢卡蜂蜜中总黄酮类化合物含量可达3.764 mg/100 g(以儿茶素为内参物),而澳大利亚的藿香蜂蜜和茶树蜂蜜,总黄酮类化合物含量分别为2.667和2.008 mg/100 g[14],低于麦卢卡蜂蜜。麦卢卡蜂蜜中主要黄酮类分子是槲皮素(0.43 mg/100 g)、异鼠李素(0.40 mg/100 g)、白杨素(0.38 mg/100 g)和木犀草素(0.38 mg/100 g)[另包括一种未知黄酮类分子(0.39 mg/100 g)],这5种分子含量占总黄酮类化合物的64.6%,其它被检测到的微量黄酮类分子有杨梅素、山奈酚和乔松素等[15]。也有研究表明麦卢卡蜂蜜的主要黄酮类分子是短叶松素(0.27 mg/100 g)、乔松素(0.17 mg/100 g)、木犀草素(0.14 mg/100 g)和白杨素(0.13 mg/100 g),占总黄酮类物质的61%[16]。两研究中木犀草素和白杨素均检测到较高含量,说明二者是麦卢卡蜂蜜中重要的黄酮类分子。
麦卢卡蜂蜜中总酚酸类化合物含量一般介于100 mg/100 g~300 mg/100 g(通常以Folin-Ciocalteu法测定、没食子酸为内参物)[14,17-18],属于较高水平,高于澳大利亚藿香蜂蜜(85.36 mg/100 g)和茶树蜂蜜(126.35 mg/100 g)[14]。早期有研究(非Folin-Ciocalteu法)表明麦卢卡蜂蜜中总酚酸类化合物含量为14.0 mg/100 g(高于澳大利亚澳洲茶蜂蜜的5.14 mg/100 g),其中主要的酚酸类分子是没食子酸(7.05 mg/100 g),占总酚酸类化合物含量的50%左右。其它含量较高的酚酸类分子包括鞣花酸(1.50 mg/100 g)、咖啡酸(1.43 mg/100 g)和一种未知酚酸类分子(1.62 mg/100 g),绿原酸和阿魏酸含量较低[15]。随后4-羟基苯甲酸、丁香酸、异阿魏酸和对香豆酸也被证实存在于麦卢卡蜂蜜中[16,19]。麦卢卡蜂蜜还含有部分酚酸类分子的衍生物。例如,丁香酸甲酯及其糖苷花含线叶金鸡菊甙,后者仅存在于产自大洋洲的蜂蜜中,可作为麦卢卡蜂蜜的检测标志物[20]。
麦卢卡蜂蜜中亦含有其它含苯环有机酸,含量较高的有苯乙酸(72.7 mg/100 g)、苯乳酸(66.1 mg/100 g)和4-甲氧基苯乳酸(41.7 mg/100 g)[19]。含苯环的有机酸(例如苯乳酸、2-甲氧基苯甲酸和4-羟苯基乳酸)通常用于麦卢卡蜂蜜真伪的鉴定[21];含有杂环的有机酸,含量较高的是脱落酸(32.8 mg/100 g)[15],也含有一定量的曲酸(1.7 mg/100 g)[19]。这些有机酸可直接影响麦卢卡蜂蜜的pH值,而较低的pH值是其抑制细菌生长的因素之一。
1.3 甲基乙二醛(methylglyoxal,MGO)
麦卢卡蜂蜜含有高浓度的MGO。MGO是重要的抗菌活性物质之一,也是麦卢卡蜂蜜质量等级标准的划分依据,通常以外包装上标注的“MGO数字+”表示质量等级。“数字+”表示该瓶蜂蜜中MGO含量大于“数字”(mg/kg),例如“MGO 100+”表示MGO含量大于100 mg/kg。数字越大,质量等级越高,价格也越昂贵[21]。麦卢卡蜂蜜中MGO含量高的原因是麦卢卡树花蜜具有高水平的二羟基丙酮,经过脱水即形成MGO。MGO在麦卢卡蜂蜜中可达800 mg/kg[22]。麦卢卡蜂蜜质量等级评价还具有另一套体系,即unique manuka factor(UMF)。UMF并非是一种具体分子,而是包含MGO作用在内的抗菌效应总称。UMF值以具有同样抗菌效果的苯酚水溶液浓度表示[23],例如“UMF5+”意味着该瓶麦卢卡蜂蜜与5%苯酚水溶液的抗菌能力相当。由于2种体系均以抗菌活性为质量等级评价依据,因此它们之间存在一定的对应和换算关系。通过铁离子还原/抗氧化能力法(ferric reducing antioxidant power,FRAP)对不同UMF等级的麦卢卡蜂蜜进行检测,发现其FRAP值与UMF值呈强正相关(R2=0.977)[24],表明UMF值在一定程度上亦可反映麦卢卡蜂蜜的抗氧化能力。
1.4 香气成分
麦卢卡蜂蜜属于颜色较深的单花蜜,具有特殊香味,目前已从中鉴定出多种挥发性成分,包括芳香类、烷烃类、酯类、醇类、萜烯类、酸类、酮类、醛类和醚类分子,挥发性成分与蜂蜜香气密切相关。在不同检测体系中,这些成分的种类和含量具有差异。总体来说,含有苯环的丁香酸甲酯、邻甲氧基苯乙酮、甲基苯并呋喃、2′-羟基苯乙酮和2′-甲氧基苯乙酮是主要挥发性物质[25-28],因此它们可能是麦卢卡蜂蜜风味的重要决定因素。
1.5 矿物质
麦卢卡蜂蜜中含量最高的矿物质是钙(123.1 mg/100 g)、钾(122.8 mg/100 g)、钠(34.7 mg/100 g)和镁(27.5 mg/100 g),这4种元素也是很多蜂蜜中含有的主要矿物质。在荞麦蜂蜜(buckwheat honey)中,钙、钠和镁含量分别为153.5、38.5和31.6 mg/100 g,均略高于麦卢卡蜂蜜;但钾含量(39.1 mg/100 g)比麦卢卡蜂蜜低3倍多[29]。因此,麦卢卡蜂蜜具有较高的钾含量,而钾是维持机体健康不可或缺的元素[30]。
1.6 蛋白质成分
麦卢卡蜂蜜中的蛋白质成分主要包括蜂王浆主蛋白家族、糖苷酶类、氧化还原酶类、酯酶类和肽酶类等[31]。麦卢卡蜂蜜总蛋白含量并不高,为90.3 mg/100 g,低于澳大利亚藿香蜂蜜(142.8 mg/100 g)和茶树蜂蜜(131.9 mg/100 g)[14];也有研究表明,麦卢卡蜂蜜总蛋白检测值为63 mg/100 g,低于荞麦蜂蜜(183 mg/100 g)[29]。就单独蛋白质分子而言,蜂王浆主蛋白6含量低于新西兰三叶草蜂蜜[31];阿拉伯半乳聚糖蛋白含量低于新西兰卡努卡蜂蜜[32],这意味着蛋白质可能并非麦卢卡蜂蜜的关键活性成分。事实上,麦卢卡蜂蜜中高浓度的MGO能够破坏一些酶的结构[33],这可能是其蛋白质含量较低的原因。此外,高含量的MGO导致麦卢卡蜂蜜中的美拉德反应产物与其它蜂蜜不同,典型特征是麦卢卡蜂蜜中羧乙基赖氨酸(carboxyethyllysine,CEL)和MGO衍生的氢化咪唑酮1(methylglyoxal-derived hydroimidazolone 1,MG-H1)含量很高,麦卢卡蜂蜜蛋白质中31%的赖氨酸和8%的精氨酸残基参与了CEL和MG-H1的形成,且麦卢卡蜂蜜中MGO浓度越高,赖氨酸浓度则越低[34]。部分蛋白质参与形成美拉德反应产物,可能是导致麦卢卡蜂蜜中蛋白质含量较低的另一因素。较为特殊的美拉德反应产物,是麦卢卡蜂蜜色泽较深的原因之一,也可作为其真伪辨别的检测指标。
综上所述,在成分特征方面,麦卢卡蜂蜜具有较低的果糖/葡萄糖比值和蛋白质水平,以及较高含量的MGO和黄酮类/酚酸类化合物,这些特点与麦卢卡蜂蜜的促健康功能密不可分。
2 麦卢卡蜂蜜抗病原微生物机理
2.1 抗菌作用途径
2.1.1 过氧化物途径
蜂蜜均具有一定的抗菌活性,根据其作用机理不同,可分为过氧化物途径和非过氧化物途径。过氧化物途径是蜂蜜中的葡萄糖在葡萄糖氧化酶(来源于蜜蜂自身分泌物)的催化作用下,生成葡萄糖酸和H2O2,H2O2发挥抗菌功能的过程[35]。该途径是大多数蜂蜜主要的抗菌机制,然而,对于麦卢卡蜂蜜则相反。麦卢卡蜂蜜中的MGO可破坏葡萄糖氧化酶结构,导致其活性降低,从而抑制H2O2的产生[33]。因此,过氧化物途径可能是麦卢卡蜂蜜的次要抗菌途径。
2.1.2 非过氧化物途径
非过氧化物途径可分为2类,一类是依赖于蜂蜜中的抗菌因子;另一类是基于蜂蜜自身的物理和化学性质(低pH值和高渗透压)。麦卢卡蜂蜜中富含MGO,使其非过氧化物途径加强,是抗菌的主要作用模式。麦卢卡蜂蜜含有高水平的酚酸类/黄酮类物质,亦有助于增强非过氧化物途径。此外,由于麦卢卡蜂蜜中有机酸水平较高,使其具有较低的pH值(4.10)[36],低于微生物生长的最适pH值(7左右)。这些因素有利于提高麦卢卡蜂蜜抗菌效果。
2.2 抗菌作用方式
2.2.1 直接抗菌方式
通过上述2条途径,麦卢卡蜂蜜具备改变细菌的细胞形态、抑制细胞分裂的能力。100 g/L的麦卢卡蜂蜜可干扰金黄色葡萄球菌细胞周期、影响细菌增殖,增加具有完整隔膜的细菌数量[37]。80 g/L的麦卢卡蜂蜜可完全抑制浮游态金黄色葡萄球菌生长,并且降低生物被膜形成(约95%)[38]。该现象在大肠杆菌中亦得到验证,100和200 g/L麦卢卡蜂蜜显著抑制其浮游态生长、降低生物被膜形成和生物被膜态细胞活力(>70%)[39]。在绿脓杆菌中,麦卢卡蜂蜜的最小抑制浓度(minimum inhibitory conentration,MIC)低至95 g/L,加入麦卢卡蜂蜜可破坏细胞结构完整性[40]。
麦卢卡蜂蜜的直接抗菌作用与其阻断菌体分子表达有关。使用MIC(300 g/L)1/2或1/4的麦卢卡蜂蜜,即可降低病原菌关键致毒因子嗜铁素的水平(下调1.3~2.2倍)[41]。120 g/L的麦卢卡蜂蜜通过调控菌落形成相关基因algD和oprF的表达水平(升高algD16倍、降低oprF10倍),阻止菌落形成,促进菌体裂解[42],亦通过抑制主要鞭毛蛋白FliC,以及与鞭毛蛋白合成相关基因(fliA、flhF、fleN、fleQ 和fleR)的表达,减弱细菌运动能力[43]。此外,细菌中的脲酶可将尿素转化为氨,有利于细菌在酸性环境生存。麦卢卡蜂蜜通过MGO抑制脲酶活性,也是其直接抗菌方式的机理之一[22]。
2.2.2 间接抗菌方式
麦卢卡蜂蜜还通过调控免疫细胞活性,发挥间接抗菌作用。MGO有助于5-A-RU转化为5-OP-RU,后者作为抗原可快速从黏膜表面进入胸腺,被胸腺细胞捕获,通过MHC Ib分子MR1呈递给黏膜相关恒定T细胞(mucosal-associated invariant T cell,MAIT细胞),激活并驱动其增殖。MAIT细胞具有抗菌和维持黏膜完整性的功能[44-45]。通过激活免疫细胞,实现抗菌功能,也是麦卢卡蜂蜜抗菌功能的重要特点。
综上所述,麦卢卡蜂蜜显著的抗菌特性是多方面因素协同作用的结果,其通过多层次的抗菌机理发挥抗菌作用(图1)。

图1 麦卢卡蜂蜜主要抗菌机理
Fig.1 The major mechanisms of anti-bacterial activity of Manuka honey
2.3 强化抗生素活性
2.3.1 协同或累加效应
抗生素残留是影响食品安全和导致环境污染的重要因素之一。麦卢卡蜂蜜不仅在单独使用时抗菌效果良好,与抗生素联合使用时亦表现出协同或累加抗菌效应。与万古霉素联合使用对抗金黄色葡萄球菌,∑FBEC值(该值表示生物膜消除浓度分数,≤0.5具有协同效应;0.5~1具有累加效应)为0.34;与庆大霉素联合使用对抗绿脓杆菌,∑FBEC值为0.78~0.82[46],表明麦卢卡蜂蜜作为天然、绿色食品,可部分替代和减少抗生素的使用。
2.3.2 降低耐药性
当前抗生素的普遍使用促使细菌产生耐药性,继而在抗菌过程中效果不佳。值得注意的是,麦卢卡蜂蜜能够抑制耐药菌,例如在抗甲氧西林的金黄色葡萄球菌株MRSA中加入麦卢卡蜂蜜,可使普遍胁迫蛋白A的表达水平下调16倍,从而降低细菌耐药性,达到抑菌目的[47],这一发现为利用天然产物解决细菌耐药性问题提供了新思路。
2.4 增益肠道菌群
肠道菌群是人体消化道内细菌总和,其数量多于人体细胞,并且与机体健康密切相关[48]。麦卢卡蜂蜜的抗菌功能具有选择性,用麦卢卡蜂蜜连续饲喂小鼠[2.2 g/(kg·d)]28 d,并不影响肠道内拟杆菌和双歧杆菌等益生菌的生长,仅略微影响有机酸代谢产物(甲酸升高、琥珀酸降低)[49]。在利用罗伊氏乳杆菌生产的酸奶中添加麦卢卡蜂蜜(50 g/L)会产生更优的发酵产物,尤其是乳酸和丙酸,并且显著增加益生菌数量,改善口感、表观黏度和持水力。因此,麦卢卡蜂蜜可应用于合生素制剂,维持肠道菌群健康[50]。
2.5 抗病毒机理
2.5.1 抑制病毒复制
病毒依赖宿主细胞进行自我复制,可导致宿主细胞形态、功能改变,甚至死亡。不少抗病毒药物作用机理就是靶向抑制病毒复制。根据基因组性质不同,病毒可分为RNA病毒和DNA病毒。麦卢卡蜂蜜可有效抑制2类病毒的复制。例如,正粘病毒科的流感病毒属于RNA病毒,加入麦卢卡蜂蜜后,其在肾细胞中的复制能力显著降低(半数最大抑制浓度half-maximal inhibitory concentration,IC50=3.6 g/L)。对比发现,麦卢卡蜂蜜抑制流感病毒复制能力优于其他蜂蜜(荞麦蜂蜜、刺槐蜂蜜和紫云英蜂蜜等)。抗流感病毒药物扎那米韦和奥司他韦与麦卢卡蜂蜜联合使用,两者IC50值可降低至1/1 000左右[51],亦表明麦卢卡蜂蜜可作为抗流感药物辅助成分。疱疹病毒科的水痘带状疱疹病毒是DNA病毒,在黑色素瘤细胞中的复制亦可被麦卢卡蜂蜜抑制,半数最大效应浓度EC50约为45 g/L,略低于三叶草蜂蜜[52],体现了麦卢卡蜂蜜抗病毒复制的潜力。
2.5.2 抑制逆转录酶活性
病毒中有一大类属于逆转录病毒(例如艾滋病病毒),其基因组RNA经过逆转录酶合成双链DNA,再整合到宿主细胞染色体DNA,随宿主细胞分裂而复制。麦卢卡蜂蜜显著抑制艾滋病病毒HIV-1逆转录酶活性,IC50为14.8 g/L,抑制效果强于刺槐蜂蜜、迷迭香蜂蜜和紫云英蜂蜜。麦卢卡蜂蜜中的MGO和2-甲氧基苯甲酸被认为是主要作用分子,HIV-1逆转录酶活性随这2种分子浓度升高而降低,呈浓度依赖性[53],未来可通过分子模拟等手段进一步证实它们之间存在互作关系。
2.6 抗真菌和寄生虫
除抗菌和抗病毒外,麦卢卡蜂蜜具有一定的抗真菌和抗寄生虫活性,40%、60%和80%(体积分数)的麦卢卡蜂蜜均可完全抑制外瓶霉(12 h)和镰刀霉(6 h)生长[54]。另有研究显示,二星瓢虫感染微孢子虫后发育时间从13.0 d延长至16.3 d,而补饲麦卢卡蜂蜜(5%,10%,15%)后, 发育时间缩短至15.0、15.2、15.6 d,孢子数量也从19.4/120 μm2降至19.0/120、19.1/120、14.3/120 μm2[55]。麦卢卡蜂蜜抗蓝氏贾第虫和阴道毛滴虫的IC50分别为5.6%和1.5%(体积分数)[56]。目前关于麦卢卡蜂蜜抗真菌和抗寄生虫研究不多,但可能和抗菌、抗病毒存在相似机制。
3 麦卢卡蜂蜜调节炎症模式
3.1 调控炎性细胞活性
3.1.1 调控炎症因子水平
麦卢卡蜂蜜具有调控炎症因子分泌的作用。在没有刺激物的情况下,10 g/L的麦卢卡蜂蜜促进巨噬细胞(RAW 264.7)肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的基因表达升高26倍,分泌量升高27倍;其他促炎因子,包括白细胞介素-1β(interleukin-1β,IL-1β)、IL-6和诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)亦呈升高趋势[57],麦卢卡蜂蜜表现促炎效应;而在模拟炎性条件下,即巨噬细胞受到脂多糖(1 mg/L)刺激时,TNF-α、IL-1β、IL-6和iNOS表达水平升高的趋势被麦卢卡蜂蜜(8 g/L)抑制[58],麦卢卡蜂蜜表现抗炎效应。
在中性粒细胞(dHL-60)中,加入脂多糖、脂多糖+趋化肽fMLP,或脂多糖+fMLP+干扰素-γ+粒细胞-巨噬细胞集落刺激因子模拟炎性条件,加入低浓度麦卢卡蜂蜜(0.5%,体积分数),可下调TNF-α、IL-1β、巨噬细胞炎性蛋白-1α(macrophage inflammatory protein-1α,MIP-1α)、MIP-1β、IL-12 p70、基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)、MMP-1、成纤维细胞生长因子-13、IL-1ra和IL-4水平,上调MIP-3α、蛋白酶3、血管内皮生长因子和IL-8水平;但加入高浓度麦卢卡蜂蜜(3%,体积分数),则上调TNF-α,而下调其他分子水平[59],表现出浓度差异性。中性粒细胞内部含有大量颗粒物。以脂多糖+fMLP刺激中性粒细胞,使其释放过氧化物能力增强,当加入麦卢卡蜂蜜(1%,体积分数),则抑制过氧化物的释放[60],表现出抗炎效应。
3.1.2 调控趋化
趋化因子参与炎性细胞募集,是调节炎症反应的重要分子。在巨噬细胞中,10 g/L的麦卢卡蜂蜜可提升趋化因子CXCL2和CCL2水平[57]。将抗炎因子(转化生长因子-β、IL-4或IL-4+IL-13)加入中性粒细胞模拟抗炎条件,0.5%(体积分数)麦卢卡蜂蜜提高CXCL8/IL-8、CCL2/单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、CCL4/MIP-1β和CCL20/MIP-3α的水平;而在3%(体积分数)时,仅提高CXCL8/IL-8的水平[61],同样体现麦卢卡蜂蜜作用的浓度差异性。另外,0.5%和3%(体积分数)麦卢卡蜂蜜可降低fMLP对中性粒细胞的趋化作用[60],表明麦卢卡蜂蜜对趋化功能的调控具有细胞特异性。
3.1.3 调控炎症相关通路
麦卢卡蜂蜜主要通过核因子κB(nuclear factor κB,NF-κB)通路和Toll样受体(Toll like receptors,TLRs)通路参与调控炎症。在脂多糖+fMLP刺激下,0.5%和3%(体积分数)的麦卢卡蜂蜜可降低中性粒细胞中NF-κB抑制蛋白IκBα的磷酸化(其磷酸化可解除对NF-κB的抑制),从而负向调控NF-κB通路,抑制中性粒细胞聚集和炎性反应[60]。细胞损伤或应激时,释放到细胞外的损伤相关模式分子可识别TLRs,激活慢性炎症。麦卢卡蜂蜜可调控人胚胎肾细胞中的TLR1/TLR2信号通路,参与调控的分子可能是其中的多酚类物质(多酚类含量越高,作用越明显)[62]。有研究者从麦卢卡蜂蜜中分离出一种5.8 kDa化合物,可在单核细胞中通过TLR4激活TNF-α[63]。脂多糖刺激巨噬细胞时,NF-κB/TLR4升高的趋势亦可被麦卢卡蜂蜜抑制[58]。
综上,麦卢卡蜂蜜对炎性细胞活性的调控具有浓度依赖性和双向性。麦卢卡蜂蜜对炎症反应以精细的网络形式进行调控,这可能与其中含有的活性物质种类较多有关,并且在参与炎症反应的不同细胞和炎症反应的不同阶段,麦卢卡蜂蜜发挥的调控作用存在差异。
3.2 调控氧化应激
3.2.1 清除自由基
细胞在内源性和外源性因素刺激下产生氧化应激,改变炎症相关通路基因表达,这也是诱导慢性炎症发生的关键因素[64]。自由基是一类带有不成对电子的原子或基团,具有很强的氧化性,是造成细胞和组织氧化应激/损伤、导致多种疾病的“元凶”。麦卢卡蜂蜜具有直接清除自由基(·OH、DPPH自由基等)的能力。在清除DPPH自由基的对比试验中,麦卢卡蜂蜜清除能力最强,其IC50=4.71 g/L,明显低于马来西亚土朗蜂蜜(IC50=8.60 g/L)和婆罗洲热带蜂蜜(IC50=17.51 g/L)[65]等其他类型蜂蜜。
3.2.2 调控抗氧化酶活性
抗氧化酶是体内清除自由基的一类重要分子。麦卢卡蜂蜜通过选择性提高抗氧化酶活性抵御氧化应激。中年大鼠灌服麦卢卡蜂蜜(2.5 g/kg /d)30 d,体内氧化应激水平降低,红细胞谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)活性增强,而过氧化氢酶(catalase,CAT)活性减弱[66],提示麦卢卡蜂蜜选择性地调控抗氧化酶活性。
3和8 g/L的麦卢卡蜂蜜可显著增强巨噬细胞谷胱甘肽转移酶(glutathione transferase,GST)的活性;8 g/L可显著增强CAT活性。在病理条件下,麦卢卡蜂蜜还可以激活部分正常状态下无法激活的抗氧化酶活性。例如在巨噬细胞中,仅加入麦卢卡蜂蜜(3和8 g/L)不影响谷胱甘肽还原酶(glutathione reductase,GR)的活性,但在脂多糖诱导的氧化应激状态下,麦卢卡蜂蜜可使GR活性显著提高[58]。
3.2.3 调控氧化应激相关信号通路
Kelch样环氧氯丙烷相关蛋白-1-核因子E2相关因子2(KEAP1-NRF2)通路是机体内主要的抗氧化信号通路之一。8 g/L浓度的麦卢卡蜂蜜可显著提高KEAP1和NRF2的表达水平[58],从而激活KEAP1-NRF2通路,参与细胞抗氧化过程。
麦卢卡蜂蜜通过以上机制调控氧化应激,从而达到明显的抗炎效果。巨噬细胞中加入脂多糖,可诱导活性氧簇(含氧原子的自由基)增多,造成脂类、蛋白质和DNA损伤,而麦卢卡蜂蜜可在一定程度上改善此类状况[58]。在三硝基苯磺酸诱导的大鼠结肠炎模型中,口服麦卢卡蜂蜜(5和10 g/kg),显著减少氧化应激和脂质过氧化(脂质过氧化即氧化应激导致的脂类成分破坏),减轻结肠炎症状[67]。
由于具备调控炎性细胞活性和氧化应激能力(如图2所示),麦卢卡蜂蜜的抗炎功能在临床数据中得到证实。它可缓解与囊性纤维化相关的慢性鼻窦炎,与生理盐水相比,滴注10%(体积分数)浓度的麦卢卡蜂蜜显著改善症状[68]。在对牙周炎进行非手术牙周治疗过程中,使用麦卢卡蜂蜜可显著改善牙周探诊深度和临床附连度指标,说明麦卢卡蜂蜜可辅助治疗牙周炎[69]。

图2 麦卢卡蜂蜜调节炎症模式
Fig.2 The modes of inflammatory regulation of Manuka honey
在肿瘤细胞中,麦卢卡蜂蜜反而激活氧化应激以对抗肿瘤细胞活性(在第5部分有详细描述),具有细胞特异性和选择性是麦卢卡蜂蜜生物学活性特点之一。
4 麦卢卡蜂蜜抗损伤效应
4.1 促伤口愈合
伤口愈合过程与细菌和炎症关系密切。在组织受损、出现伤口时,往往伴随细菌感染,细菌能以生物被膜态存在,生长较慢,躲避抗生素作用几率较大,使伤口愈合延迟[70]。由于麦卢卡蜂蜜具有抑制细菌生物被膜态和耐药性的作用,以及调节炎症反应的能力,因此可有效促进伤口愈合。在马机械性皮肤损伤模型中,66%麦卢卡蜂蜜可减轻伤口炎症,增强血管生成、纤维化、胶原蛋白合成和上皮细胞增生[71]。在兔烧伤模型中,未经药物处理的伤口愈合时间为36 d,使用1%呋喃西林(常用烧伤药)软膏缩短至32 d,使用1%麦卢卡蜂蜜软膏缩短至31.33 d,而呋喃西林+麦卢卡蜂蜜联合使用,愈合时间缩短至27 d,说明麦卢卡蜂蜜可有效促进烧伤伤口愈合[72]。临床数据表明,麦卢卡蜂蜜联合抗生素作为敷料,可使平均深度为5.72 mm的伤口在4周后降至0.88 mm,提示麦卢卡蜂蜜能够促进组织修复、抑制炎症反应,加快自溶清创[73]。
4.2 抑制溃疡
溃疡指黏膜或皮肤出现溃烂或缺失,是一种特殊形式的慢性创伤。在乙醇诱导的胃溃疡大鼠模型中,摄入麦卢卡蜂蜜(2.5 g/kg)可显著升高胃黏膜NO、GSH、SOD和CAT等抗氧化应激分子水平,降低血浆TNF-α,IL-1β和IL-6等促炎因子水平[74]。在乙酸诱导的大鼠胃溃疡模型中,给予麦卢卡蜂蜜(2.5 g/kg)具有相似效果。麦卢卡蜂蜜能够降低黏膜髓过氧化物酶活性、脂质过氧化水平和促炎性细胞因子(TNF-α,IL-1β和 IL-6)水平,同时升高抗氧化物质(SOD、GPx和GSH)和抗炎性细胞因子(IL-10)水平[75]。
糖尿病足是一种严重的糖尿病慢性并发症,其临床症状包括溃疡、感染和疼痛[76]。使用麦卢卡蜂蜜敷料,溃疡平均愈合时间为31 d, 而使用普通敷料的平均愈合时间为43 d,并且使用麦卢卡蜂蜜敷料患者未感染比例也高于使用普通敷料患者(在使用第1周,两组比例分别为78.13%和35.5%,随后几周同样趋势)[77]。麦卢卡蜂蜜对阴茎溃烂症状也具有显著的改善作用[78]。以上数据表明,麦卢卡蜂蜜可作为加速伤口愈合(包括溃疡在内)的敷料。
4.3 抗血管冻伤与痉挛
与一般组织损伤不同,冻伤是低温导致的局部缺血性血管损伤,并且普通抗损伤药物对其很难有效,血栓引起的缺血是造成与其相关组织坏死的主要原因。在大鼠冻伤模型中,使用麦卢卡蜂蜜可使伤口在18 d内恢复,其机制可能是其中的leptosin及其他植物性成分具有的抗血栓性质[79]。
血管痉挛是动脉血管异常收缩,影响机体血液流量和流速[80],因此可能导致机体缺氧。在股动脉痉挛大鼠模型中,使用0.1 mL麦卢卡蜂蜜可显著降低血管壁厚度、增大管腔直径,缓解痉挛,这可能与麦卢卡蜂蜜抗氧化和抗炎功能密切相关[81]。
5 麦卢卡蜂蜜抗肿瘤机制
5.1 激活凋亡因子
抗肿瘤的关键是促进肿瘤细胞凋亡、抑制肿瘤细胞增殖。目前研究证实,麦卢卡蜂蜜可促进多种肿瘤细胞凋亡。麦卢卡蜂蜜(体积分数为5%)可激活黑色素瘤细胞(B16.F1)的促凋亡蛋白含半胱氨酸的天冬氨酸蛋白水解酶-3、-9(Caspase-3、-9),抑制抗凋亡蛋白B淋巴细胞瘤-2(Bcl-2);通过静脉注射麦卢卡蜂蜜(500 g/L,100 μL)可抑制33%的小鼠黑色素瘤[82]。
麦卢卡蜂蜜(20和50 g/L)可分别激活结肠癌细胞HCT-116和LoVo中Caspase-3、-8、-9,以及cleaved-聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase,PARP]和p53,抑制细胞增殖,引发细胞周期阻滞,促进细胞凋亡,这可能与麦卢卡蜂蜜在肿瘤细胞中激活氧化损伤、改变线粒体呼吸和糖异生,以及减弱转移能力直接相关[83-84]。麦卢卡蜂蜜(或者与5-氟脲嘧啶联合使用)可减少结肠腺癌细胞来源的结肠球体(含有大量癌干细胞样细胞)质量、直径和密度,阻碍癌干细胞样细胞生存能力[85]。麦卢卡蜂蜜与5-氟脲嘧啶能够发挥协同抗肿瘤效应,提高化疗效果。该作用机制主要体现在上调促凋亡因子Bax、Caspase-3、-8、-9和cleaved-PARP,抑制结肠癌细胞增殖和迁移(下调表皮生长因子受体、磷酸化蛋白激酶p-Akt和磷酸化雷帕霉素靶蛋白p-mTOR等促增殖蛋白表达;下调MMP-2、-9并升高N、E-钙粘蛋白表达),并且通过下调SOD、CAT、GPx和GR等抗氧化酶水平,增强氧化损伤[86]。
麦卢卡蜂蜜同样抑制肝癌细胞HepG2(p53非突变型)和HepB3(p53突变型)的增殖,IC50浓度分别为6.92%和18.62%。尤其对于HepG2细胞株,麦卢卡蜂蜜处理48 h即可观察到明显的凋亡形态;与阿霉素联合使用,通过提高Bax、降低Bcl-2和促增殖蛋白[磷酸化细胞外调节蛋白激酶1/2(p-ERK1/2)、细胞周期蛋白Cyclin D1和mTOR],以及原癌蛋白(β-连环蛋白)水平,增强其诱导凋亡能力[87], 进一步证明了麦卢卡蜂蜜可激活肿瘤细胞凋亡因子,促进肿瘤细胞凋亡。
5.2 抑制IL-6/STAT3信号通路
IL-6是一种促肿瘤细胞因子,与IL-6受体IL-6R结合后,启动IL-6R作为信号转导的β链糖蛋白130(glycoprotein 130,gp130),激活Janus激酶(Janus kinases,JAKs),活化后的JAKs靠近信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3),使其第705位酪氨酸发生磷酸化(pY-STAT3),在细胞核与相应的靶基因启动子结合,调控靶基因的表达[88],从而参与肿瘤的生长和转移。p-STAT3作为原癌性转录因子,参与约50%乳腺癌和肺癌的发生。麦卢卡蜂蜜(10 g/L)能够迅速减弱乳腺癌细胞(MDA-MB-231和MCF-7)中pY-STAT3(>80%)和IL-6的水平,抑制细胞增殖、促进细胞凋亡,提示IL-6/STAT3信号通路可能是麦卢卡蜂蜜抗乳腺癌的早期作用靶点[89]。在肺癌细胞中,麦卢卡蜂蜜亦可显著抑制p-STAT3,以及gp130和p-JAK2水平,后两者正是IL-6R信号通路的上游分子。麦卢卡蜂蜜可特异性地与IL-6Rα结合(而不与IL-11Rα和 IL-8R结合),导致IL-6Rα与IL-6结合的几率降低约60%。在此过程中起关键作用的是黄酮类物质,包括木犀草素、槲皮素、高良姜素和白杨素。它们均可与IL-6Rα产生互作,从而影响IL-6功能,抑制癌症[90]。
由此可见,麦卢卡蜂蜜抗肿瘤的作用机制主要包括:激活促凋亡因子、抑制抗凋亡因子、增强肿瘤细胞氧化损伤、阻滞肿瘤细胞周期,降低肿瘤细胞增殖和迁移(图3)。此类机制只发生在肿瘤细胞中,对非肿瘤细胞无影响[83-84]。事实上,许多抗癌药物(尤其是天然产物)也有此特点。这可能与肿瘤细胞和非肿瘤细胞的表面标志以及信号转导通路存在差异有关。然而,麦卢卡蜂蜜为何具有明显的细胞特异性和选择性仍不清楚,有待进一步研究。
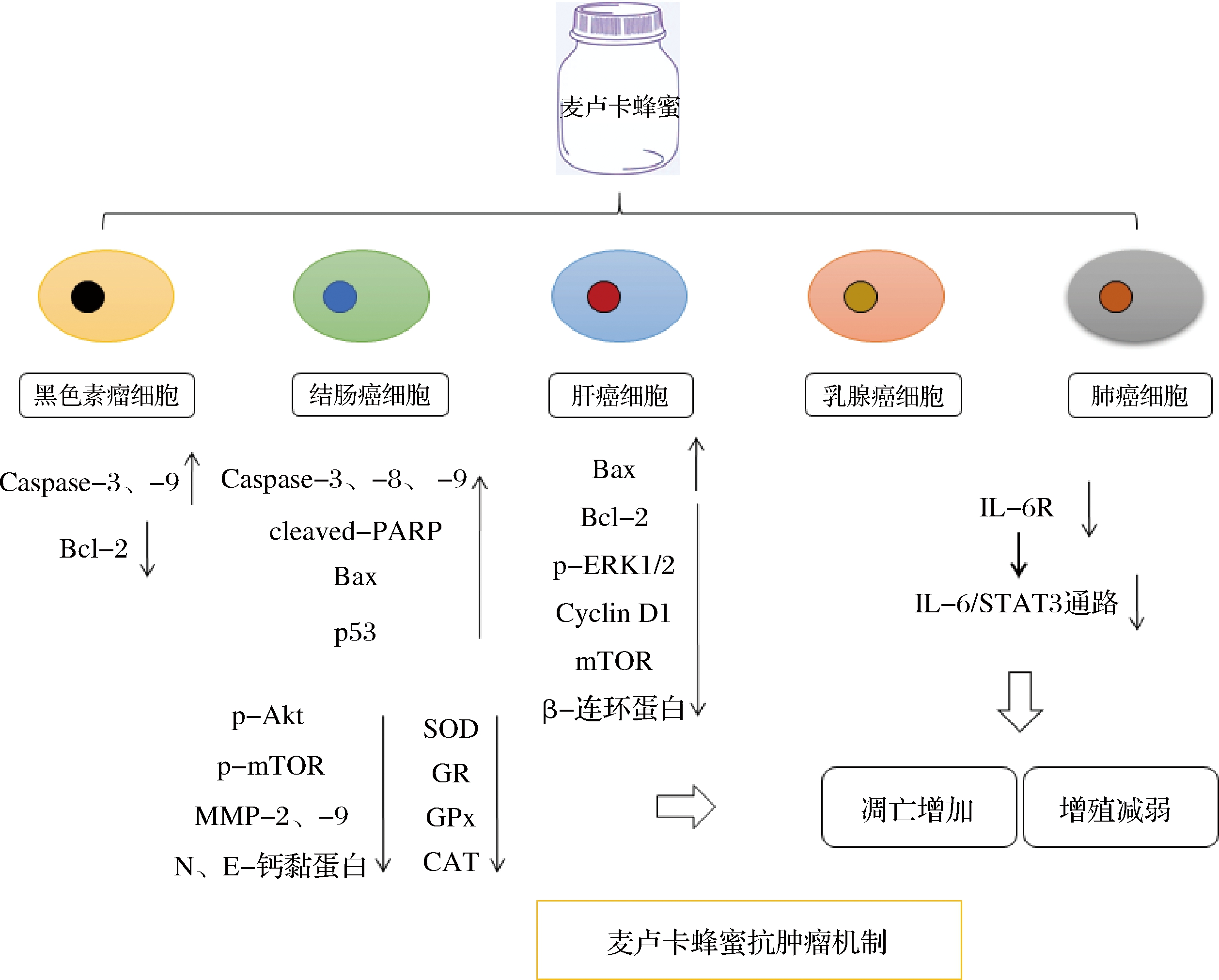
图3 麦卢卡蜂蜜抗肿瘤机制
Fig.3 The anti-tumor mechanisms of Manuka honey
6 影响神经系统功能
6.1 抗神经退行性疾病
阿尔茨海默症是一种以记忆、认知和行动能力下降为特征的神经退行性疾病,一般认为是脑内β-淀粉样蛋白聚集形成老年斑,以及微管相关蛋白Tau高度磷酸化形成神经原纤维缠结[91]。在基于秀丽隐杆线虫(CL4176)的阿尔茨海默症模型中,麦卢卡蜂蜜可通过调控热休克蛋白HSP-16.2和转录因子SKN-1/NRF2通路,减少氧化应激,延缓β-淀粉样蛋白诱导的行动麻痹,从而具有抗阿尔茨海默症的潜力[92]。
6.2 减轻疼痛
“痛”是炎症的主要临床症状之一。癌症化疗易引起口腔黏膜炎,发病率约40%~80%,并伴随疼痛。麦卢卡蜂蜜能够显著降低接受白血病化疗儿童的炎症程度;通过面部视觉模拟评分法(visual analogue scale,VAS)评估疼痛程度,VAS评分显著下降,表明麦卢卡蜂蜜可有效缓解化疗引发的、与口腔黏膜炎相关的疼痛[93]。
除了缓解炎症引起的疼痛,麦卢卡蜂蜜还可减轻机械性原因导致的疼痛。人类第三磨牙是最晚萌出的牙齿,但由于此时没有足够空间供其生长,故而容易形成“智齿”阻生或错位萌出,往往需要人工拔除,伤及下牙槽神经或舌神经,造成疼痛[94]。在拔除第三磨牙手术后随即灌注麦卢卡蜂蜜,术后第1、2 天VAS评分显著低于未经麦卢卡蜂蜜处理患者[95]。
7 小结与展望
通过细胞、动物和临床试验,阐明了麦卢卡蜂蜜具有一系列促健康功能。这不仅为人们合理消费和利用麦卢卡蜂蜜提供了理论依据,而且也为我国蜂蜜产业的科学发展提供了很好的思路。据美国国家生物技术信息中心PubMed数据库显示,关于麦卢卡蜂蜜的研究从1991年就已开始,目前仍在进行,不断有新的研究成果,并且数量逐年上升。我国不少具有地方特色、获得国家地理标志的蜂蜜,其促健康功能的研究数量还较少,由于缺乏科技支撑,限制了我国蜂蜜高附加值的开发和利用。因此,我国蜂蜜产业亟需加强科研投入,对其特性和功能进行深入阐释,为人类健康提供更科学的依据,同时也推动蜂业的健康发展。
致谢:感谢中国农业科学院蜜蜂研究所李建科教授为本文润色语言。
[1] HASSOUN A, HARASTANI R, JAGTAP S, et al.Truths and myths about superfoods in the era of the COVID-19 pandemic[J].Critical Reviews in Food Science and Nutrition, 2022:1-8.
[2] TERZO S, MUL F, AMATO A.Honey and obesity-related dysfunctions:A summary on health benefits[J].The Journal of Nutritional Biochemistry, 2020, 82:108401.
F, AMATO A.Honey and obesity-related dysfunctions:A summary on health benefits[J].The Journal of Nutritional Biochemistry, 2020, 82:108401.
[3] 高芸, 赵芝俊.进口蜂蜜对我国蜂产品市场的影响[J].浙江农业学报, 2020, 32(11):2088-2093.
GAO Y, ZHAO Z J.Influence of imported honey on market of bee products of China[J].Acta Agriculturae Zhejiangensis, 2020, 32(11):2088-2093.
[4] 杨艳歌, 王迎春, 刘鸣畅, 等.麦卢卡蜂蜜植物源性成分鉴别方法的建立[J].食品科学,2023,44(14):352-359.
YANG Y G, WANG Y C, LIU M C, et al.Establishment of identification method for plant-derived ingredients of mānuka honey[J].Food Science,2023,44(14):352-359.
[5] ISLAM M K, SOSTARIC T, LIM L Y, et al.Sugar profiling of honeys for authentication and detection of adulterants using high-performance thin layer chromatography[J].Molecules, 2020, 25(22):5289.
[6] FERN NDEZ-BA
NDEZ-BA ARES F.Carbohydrate maldigestion and intolerance[J].Nutrients, 2022, 14(9):1923.
ARES F.Carbohydrate maldigestion and intolerance[J].Nutrients, 2022, 14(9):1923.
[7] WINDEMULLER F, XU J L, RABINOWITZ S S, et al.Lipogenesis in Huh7 cells is promoted by increasing the fructose:Glucose molar ratio[J].World Journal of Hepatology, 2016, 8(20):838-843.
[8] MOHAN A, GUTIERREZ-MADDOX N, MENG T, et al.Manuka honey with varying levels of active Manuka factor (AMF) ratings as an anaerobic fermentation substrate for Limosilactobacillus reuteri DPC16[J].Fermentation, 2021, 7(3):128.
[9] LANE J A, CALONNE J, SLATTERY H, et al.Oligosaccharides isolated from MGOTM Manuka honey inhibit the adhesion of Pseudomonas aeruginosa, Escherichia coli O157:H7 and Staphylococcus aureus to human HT-29 cells[J].Foods, 2019, 8(10):446.
[10] EREJUWA O O, SULAIMAN S A, WAHAB M S A.Oligosaccharides might contribute to the antidiabetic effect of honey:A review of the literature[J].Molecules, 2011, 17(1):248-266.
[11] CALIS Z, MOGULKOC R, BALTACI A K.The roles of flavonols/flavonoids in neurodegeneration and neuroinflammation[J].Mini-Reviews in Medicinal Chemistry, 2020, 20(15):1475-1488.
[12] OR OLI
OLI N, KUN
N, KUN TI
TI M, KUKOLJ M, et al.Natural phenolic acid, product of the honey bee, for the control of oxidative stress, peritoneal angiogenesis, and tumor growth in mice[J].Molecules, 2020, 25(23):5583.
M, KUKOLJ M, et al.Natural phenolic acid, product of the honey bee, for the control of oxidative stress, peritoneal angiogenesis, and tumor growth in mice[J].Molecules, 2020, 25(23):5583.
[13] DILBERGER B, WEPPLER S, ECKERT G P.Phenolic acid metabolites of polyphenols act as inductors for hormesis in C.elegans[J].Mechanisms of Ageing and Development, 2021, 198:111518.
[14] ANAND S, PANG E, LIVANOS G, et al.Characterization of physico-chemical properties and antioxidant capacities of bioactive honey produced from Australian grown Agastache rugosa and its correlation with colour and poly-phenol content[J].Molecules, 2018, 23(1):108.
[15] YAO L H, DATTA N, TOM S-BARBER
S-BARBER N F A, et al.Flavonoids, phenolic acids and abscisic acid in Australian and New Zealand Leptospermum honeys[J].Food Chemistry, 2003, 81(2):159-168.
N F A, et al.Flavonoids, phenolic acids and abscisic acid in Australian and New Zealand Leptospermum honeys[J].Food Chemistry, 2003, 81(2):159-168.
[16] CHAN C W, DEADMAN B J, MANLEY-HARRIS M, et al.Analysis of the flavonoid component of bioactive New Zealand mānuka (Leptospermum scoparium) honey and the isolation, characterisation and synthesis of an unusual pyrrole[J].Food Chemistry, 2013, 141(3):1772-1781.
[17] VENUGOPAL S, DEVARAJAN S.Estimation of total flavonoids, phenols and antioxidant activity of local and New Zealand manuka honey[J].Journal of Pharmacy Research, 2011, 4(2):464-466.
[18] GO LI
LI SKI M, NOWAK D, SZWENGIEL A.Multidimensional comparative analysis of bioactive phenolic compounds of honeys of various origin[J].Antioxidants, 2021, 10(4):530.
SKI M, NOWAK D, SZWENGIEL A.Multidimensional comparative analysis of bioactive phenolic compounds of honeys of various origin[J].Antioxidants, 2021, 10(4):530.
[19] OELSCHLAEGEL S, GRUNER M, WANG P N, et al.Classification and characterization of manuka honeys based on phenolic compounds and methylglyoxal[J].Journal of Agricultural and Food Chemistry, 2012, 60(29):7229-7237.
[20] KATO Y, UMEDA N, MAEDA A, et al.Identification of a novel glycoside, leptosin, as a chemical marker of manuka honey[J].Journal of Agricultural and Food Chemistry, 2012, 60(13):3418-3423.
[21] 康海宁, 陈波, 蓝芳, 等.麦卢卡蜂蜜特征标志物及其分析方法研究进展[J].现代食品科技, 2019, 35(12):322-328;336.
KANG H N, CHEN B, LAN F, et al.Research progress in defining marker substances characteristic for manuka honey and developing their analytical methods[J].Modern Food Science and Technology, 2019, 35(12):322-328;336.
[22] RÜCKRIEMEN J, KLEMM O, HENLE T.Manuka honey (Leptospermum scoparium) inhibits jack bean urease activity due to methylglyoxal and dihydroxyacetone[J].Food Chemistry, 2017, 230:540-546.
[23] GIRMA A, SEO W, SHE R C.Antibacterial activity of varying UMF-graded Manuka honeys[J].PLoS One, 2019, 14(10):e0224495.
[24] BOLANOS DE LA TORRE A A S, HENDERSON T, NIGAM P S, et al.A universally calibrated microplate ferric reducing antioxidant power (FRAP) assay for foods and applications to Manuka honey[J].Food Chemistry, 2015, 174:119-123.
[25] DAHER S, GÜLAÇAR F O.Identification of new aromatic compounds in the New Zealand Manuka honey by gas chromatography-mass spectrometry[J].E-Journal of Chemistry, 2010, 7(s1):S7-S14.
[26] BEITLICH N, KOELLING-SPEER I, OELSCHLAEGEL S, et al.Differentiation of manuka honey from Kanuka honey and from jelly bush honey using HS-SPME-GC/MS and UHPLC-PDA-MS/MS[J].Journal of Agricultural and Food Chemistry, 2014, 62(27):6435-6444.
[27] 张鹏云, 李蓉, 龙春霞, 等.HS-SPME-GC-MS技术分析麦卢卡蜂蜜中的挥发性成分[J].食品工业, 2019, 40(9):255-260.
ZHANG P Y, LI R, LONG C X, et al.Analysis of the volatile compounds from manuka honey by HS-SPME-GC-MS combing with retention index[J].The Food Industry, 2019, 40(9):255-260.
[28] 王桃红, 崔宗岩, 徐立英, 等.麦卢卡蜂蜜挥发性成分的测定及与抗菌性相关性分析[J].食品与发酵工业, 2020, 46(19):228-236.
WANG T H, CUI Z Y, XU L Y, et al.Determination of volatile compounds in Manuka honey and its antibacterial properties[J].Food and Fermentation Industries, 2020, 46(19):228-236.
[29] DENG J L, LIU R, LU Q, et al.Biochemical properties, antibacterial and cellular antioxidant activities of buckwheat honey in comparison to manuka honey[J].Food Chemistry, 2018, 252:243-249.
[30] 穆妮热·阿塔吾拉, 郭艳英.低钾血症病因与发病机制的研究进展[J].中国医药科学, 2022, 12(18):39-43.
MUNIRE A, GUO Y Y.Research progress on the etiology and pathogenesis of hypokalemia[J].China Medicine and Pharmacy, 2022, 12(18):39-43.
[31] PAGET B W, KLEFFMANN T, WHITEMAN K E, et al.Quantitative comparison of manuka and clover honey proteomes with royal jelly[J].PLoS One, 2023, 18(2):e0272898.
[32] GANNABATHULA S, KRISSANSEN G W, SKINNER M, et al.Honeybee apisimin and plant Arabinogalactans in honey costimulate monocytes[J].Food Chemistry, 2015, 168:34-40.
[33] MAJTAN J, BOHOVA J, PROCHAZKA E, et al.Methylglyoxal may affect hydrogen peroxide accumulation in Manuka honey through the inhibition of glucose oxidase[J].Journal of Medicinal Food, 2014, 17(2):290-293.
[34] HELLWIG M, RÜCKRIEMEN J, SANDNER D, et al.Unique pattern of protein-bound Maillard reaction products in manuka (Leptospermum scoparium) honey[J].Journal of Agricultural and Food Chemistry, 2017, 65(17):3532-3540.
[35] MANDAL M D, MANDAL S.Honey:Its medicinal property and antibacterial activity[J].Asian Pacific Journal of Tropical Biomedicine, 2011, 1(2):154-160.
[36] STAVROPOULOU E, VOIDAROU C C, ROZOS G, et al.Antimicrobial evaluation of various honey types against carbapenemase-producing Gram-negative clinical isolates[J].Antibiotics, 2022, 11(3):422.
[37] HENRIQUES A F, JENKINS R E, BURTON N F, et al.The intracellular effects of Manuka honey on Staphylococcus aureus[J].European Journal of Clinical Microbiology &Infectious Diseases, 2010, 29(1):45-50.
[38] LU J, TURNBULL L, BURKE C M, et al.Manuka-type honeys can eradicate biofilms produced by Staphylococcus aureus strains with different biofilm-forming abilities[J].PeerJ, 2014, 2:e326.
[39] KIM S Y, KANG S S.Anti-biofilm activities of manuka honey against Escherichia coli O157:H7[J].Food Science of Animal Resources, 2020, 40(4):668-674.
[40] HENRIQUES A F, JENKINS R E, BURTON N F, et al.The effect of Manuka honey on the structure of Pseudomonas aeruginosa[J].European Journal of Clinical Microbiology &Infectious Diseases, 2011, 30(2):167-171.
[41] KRONDA J M, COOPER R A, MADDOCKS S E.Manuka honey inhibits siderophore production in Pseudomonas aeruginosa[J].Journal of Applied Microbiology, 2013, 115(1):86-90.
[42] ROBERTS A E L, MADDOCKS S E, COOPER R A.Manuka honey is bactericidal against Pseudomonas aeruginosa and results in differential expression of oprF and algD[J].Microbiology, 2012, 158(12):3005-3013.
[43] ROBERTS A E L, MADDOCKS S E, COOPER R A.Manuka honey reduces the motility of Pseudomonas aeruginosa by suppression of flagella-associated genes[J].Journal of Antimicrobial Chemotherapy, 2015, 70(3):716-725.
[44] TANG J S, COMPTON B J, MARSHALL A, et al.Mānuka honey-derived methylglyoxal enhances microbial sensing by mucosal-associated invariant T cells[J].Food &Function, 2020, 11(7):5782-5787.
[45] FRANÇOIS L, DÉBORAH B, CELINE D, et al.Microbial metabolites control the thymic development of mucosal-associated invariant T cells[J].Science (New York, N.Y.), 2019, 366(6464):494-499.
[46] CAMPEAU M E M, PATEL R.Antibiofilm activity of manuka honey in combination with antibiotics[J].International Journal of Bacteriology, 2014, 2014:1-7.
[47] JENKINS R, BURTON N, COOPER R.Effect of manuka honey on the expression of universal stress protein A in meticillin-resistant Staphylococcus aureus[J].International Journal of Antimicrobial Agents, 2011, 37(4):373-376.
[48] 江志峰, 郑培奋.肠道菌群与机体衰老关系的研究进展[J].中国慢性病预防与控制, 2023, 31(1):76-80.
JIANG Z F, ZHENG P F.Research progress on the relationship between intestinal flora and aging[J].Chinese Journal of Prevention and Control of Chronic Diseases, 2023, 31(1):76-80.
[49] ROSENDALE D, BUTTS C A, DE GUZMAN C E, et al.Consumption of antimicrobial manuka honey does not significantly perturb the microbiota in the hind gut of mice[J].PeerJ, 2016, 4:e2787.
[50] MOHAN A, HADI J, GUTIERREZ-MADDOX N, et al.Sensory, microbiological and physicochemical characterisation of functional manuka honey yogurts containing probiotic Lactobacillus reuteri DPC16[J].Foods, 2020, 9(1):106.
[51] WATANABE K, RAHMASARI R, MATSUNAGA A, et al.Anti-influenza viral effects of honey in vitro:Potent high activity of manuka honey[J].Archives of Medical Research, 2014, 45(5):359-365.
[52] SHAHZAD A, COHRS R J.In vitro antiviral activity of honey against varicella zoster virus (VZV):A translational medicine study for potential remedy for shingles[J].Translational Biomedicine, 2012, 3(2):2.
[53] OBOSSOU E K, SHIKAMOTO Y, HOSHINO Y, et al.Effect of manuka honey on human immunodeficiency virus type 1 reverse transcriptase activity[J].Natural Product Research, 2022, 36(6):1552-1557.
[54] YABES J M, WHITE B K, MURRAY C K, et al.In Vitro activity of Manuka Honey and polyhexamethylene biguanide on filamentous fungi and toxicity to human cell lines[J].Medical Mycology, 2017, 55(3):334-343.
[55] BJØRNSON S, JAMES K, STEELE T.Evaluation of Manuka honey on the microsporidian pathogen Vairimorpha (Nosema) adaliae and its host, the two-spotted lady beetle, Adalia Bipunctata L.(Coleoptera:Coccinellidae)[J].Journal of Invertebrate Pathology, 2023, 196:107855.
[56] MEDHI B, SINHA S, PRAKASH A, et al.Comparative effect of manuka honey on anaerobic parasitic protozoans with standard drug therapy under in vitro conditions:A preliminary study[J].Indian Journal of Pharmacology, 2018, 50(4):197.
[57] MASAD R J, NASSER R A, BASHIR G, et al.Characterization of immunomodulatory responses induced by Manuka honey[J].Frontiers in Immunology, 2022, 13:1020574.
[58] GASPARRINI M, AFRIN S, FORBES-HERN NDEZ T Y, et al.Protective effects of Manuka honey on LPS-treated RAW 264.7 macrophages.Part 2:Control of oxidative stress induced damage, increase of antioxidant enzyme activities and attenuation of inflammation[J].Food and Chemical Toxicology, 2018, 120:578-587.
NDEZ T Y, et al.Protective effects of Manuka honey on LPS-treated RAW 264.7 macrophages.Part 2:Control of oxidative stress induced damage, increase of antioxidant enzyme activities and attenuation of inflammation[J].Food and Chemical Toxicology, 2018, 120:578-587.
[59] MINDEN-BIRKENMAIER B A, MEADOWS M B, CHERUKURI K, et al.The effect of manuka honey on dHL-60 cytokine, chemokine, and matrix-degrading enzyme release under inflammatory conditions[J].Med One, 2019, 4(2):e190005.
[60] MINDEN-BIRKENMAIER B A, CHERUKURI K, SMITH R A, et al.Manuka honey modulates the inflammatory behavior of a dHL-60 neutrophil model under the cytotoxic limit[J].International Journal of Biomaterials, 2019, 2019:6132581.
[61] MINDEN-BIRKENMAIER B A, MEADOWS M B, CHERUKURI K, et al.Manuka honey modulates the release profile of a dHL-60 neutrophil model under anti-inflammatory stimulation[J].Journal of Tissue Viability, 2020, 29(2):91-99.
[62] TOMBLIN V, FERGUSON L R, HAN D Y, et al.Potential pathway of anti-inflammatory effect by New Zealand honeys[J].International Journal of General Medicine, 2014, 7:149-158.
[63] TONKS A J, DUDLEY E, PORTER N G, et al.A 5.8-kDa component of manuka honey stimulates immune cells via TLR4[J].Journal of Leukocyte Biology, 2007, 82(5):1147-1155.
[64] HUSSAIN T, TAN B, YIN Y L, et al.Oxidative stress and inflammation:What polyphenols can do for us?[J].Oxidative Medicine and Cellular Longevity, 2016, 2016:7432797.
[65] KHALIL M I, ALAM N, MONIRUZZAMAN M, et al.Phenolic acid composition and antioxidant properties of Malaysian honeys[J].Journal of Food Science, 2011, 76(6):C921-C928.
[66] JUBRI Z, RAHIM N B A, AAN G J.Manuka honey protects middle-aged rats from oxidative damage[J].Clinics, 2013, 68(11):1446-1454.
[67] PRAKASH A, MEDHI B, AVTI P K, et al.Effect of different doses of Manuka honey in experimentally induced inflammatory bowel disease in rats[J].Phytotherapy Research, 2008, 22(11):1511-1519.
[68] LEE V S, HUMPHREYS I M, PURCELL P L, et al.Manuka honey versus saline sinus irrigation in the treatment of cystic fibrosis-associated chronic rhinosinusitis:A randomised pilot trial[J].Clinical Otolaryngology, 2021, 46(1):168-174.
[69] OP IVA
IVA D, MUSI
D, MUSI L, BADOVINAC A, et al.Therapeutic manuka honey as an adjunct to non-surgical periodontal therapy:A 12-month follow-up, split-mouth pilot study[J].Materials, 2023, 16(3):1248.
L, BADOVINAC A, et al.Therapeutic manuka honey as an adjunct to non-surgical periodontal therapy:A 12-month follow-up, split-mouth pilot study[J].Materials, 2023, 16(3):1248.
[70] RAHIM K, SALEHA S, ZHU X D, et al.Bacterial contribution in chronicity of wounds[J].Microbial Ecology, 2017, 73(3):710-721.
[71] BISCHOFBERGER A S, DART C M, HORADAGODA N, et al.Effect of Manuka honey gel on the transforming growth factor β1 and β3 concentrations, bacterial counts and histomorphology of contaminated full-thickness skin wounds in equine distal limbs[J].Australian Veterinary Journal, 2016, 94(1-2):27-34.
[72] KULYAR M F E A, ASHFAQ K, AQIB A I, et al.Enhanced healing activity of Manuka honey and nitrofurazone composite in full-thickness burn wounds in the rabbit model[J].Frontiers in Veterinary Science, 2022, 9:875629.
[73] KAPOOR N, YADAV R.Manuka honey:A promising wound dressing material for the chronic nonhealing discharging wounds:A retrospective study[J].National Journal of Maxillofacial Surgery, 2021, 12(2):233-237.
[74] ALMASAUDI S B, EL-SHITANY N A, ABBAS A T, et al.Antioxidant, anti-inflammatory, and antiulcer potential of manuka honey against gastric ulcer in rats[J].Oxidative Medicine and Cellular Longevity, 2016, 2016:3643824.
[75] ALMASAUDI S B, ABBAS A T, AL-HINDI R R, et al.Manuka honey exerts antioxidant and anti-inflammatory activities that promote healing of acetic acid-induced gastric ulcer in rats[J].Evidence-Based Complementary and Alternative Medicine, 2017, 2017:1-12.
[76] 毛水红, 张家鹏, 张勇超.影响糖尿病足创面愈合的危险因素分析[J].中国烧伤创疡杂志, 2022, 34(6):404-407.
MAO S H, ZHANG J P, ZHANG Y C.Analysis of risk factors affecting wound healing of diabetic foot[J].The Chinese Journal of Burns Wounds &Surface Ulcers, 2022, 34(6):404-407.
[77] KAMARATOS A V, TZIROGIANNIS K N, IRAKLIANOU S A, et al.Manuka honey-impregnated dressings in the treatment of neuropathic diabetic foot ulcers[J].International Wound Journal, 2014, 11(3):259-263.
[78] SYLVESTER-HVID A, AVNSTORP M B, FJELD T, et al.Benign tumours leading to total penile denudation treated with Manuka honey dressings:A case report and review of literature[J].International Journal of Surgery Case Reports, 2019, 61:191-194.
[79] JOSHI K, MAZUMDER B, CHATTOPADHYAY P, et al.Exploring the frostbite healing potential of hyaluronic acid based hydrogel of Manuka honey through in-silico antithrombotic and anti-platelet studies of major phytoconstituents and in-vivo evaluation in Wistar rat model[J].Drug Development and Industrial Pharmacy, 2021, 47(8):1326-1334.
[80] 李琦. 综合干预在显微外科手术中防治血管痉挛的效果观察[J].中国卫生标准管理, 2016, 7(17):239-240.
LI Q.The effect of comprehensive intervention on the prevention and treatment of vasospasm in microsurgery[J].China Health Standard Management, 2016, 7(17):239-240.
[81] TANRIVERDI O.Morphometric analysis of the effects of manuka honey on vasospastic femoral arteries in rats:An experimental study[J].The Medical Bulletin of Sisli Hospital, 2018, 52(4):268-273.
[82] FERNANDEZ-CABEZUDO M J, EL-KHARRAG R, TORAB F, et al.Intravenous administration of Manuka honey inhibits tumor growth and improves host survival when used in combination with chemotherapy in a melanoma mouse model[J].PLoS One, 2013, 8(2):e55993.
[83] AFRIN S, GIAMPIERI F, GASPARRINI M, et al.The inhibitory effect of Manuka honey on human colon cancer HCT-116 and LoVo cell growth.Part 1:The suppression of cell proliferation, promotion of apoptosis and arrest of the cell cycle[J].Food &Function, 2018, 9(4):2145-2157.
[84] AFRIN S, GIAMPIERI F, GASPARRINI M, et al.The inhibitory effect of Manuka honey on human colon cancer HCT-116 and LoVo cell growth.Part 2:Induction of oxidative stress, alteration of mitochondrial respiration and glycolysis, and suppression of metastatic ability[J].Food &Function, 2018, 9(4):2158-2170.
[85] CIANCIOSI D, FORBES-HERN NDEZ T Y, REGOLO L, et al.Manuka honey in combination with 5-fluorouracil decreases physical parameters of colonspheres enriched with cancer stem-like cells and reduces their resistance to apoptosis[J].Food Chemistry, 2022, 374:131753.
NDEZ T Y, REGOLO L, et al.Manuka honey in combination with 5-fluorouracil decreases physical parameters of colonspheres enriched with cancer stem-like cells and reduces their resistance to apoptosis[J].Food Chemistry, 2022, 374:131753.
[86] AFRIN S, GIAMPIERI F, FORBES-HERN NDEZ T Y, et al.Manuka honey synergistically enhances the chemopreventive effect of 5-fluorouracil on human colon cancer cells by inducing oxidative stress and apoptosis, altering metabolic phenotypes and suppressing metastasis ability[J].Free Radical Biology and Medicine, 2018, 126:41-54.
NDEZ T Y, et al.Manuka honey synergistically enhances the chemopreventive effect of 5-fluorouracil on human colon cancer cells by inducing oxidative stress and apoptosis, altering metabolic phenotypes and suppressing metastasis ability[J].Free Radical Biology and Medicine, 2018, 126:41-54.
[87] AL REFAEY HEBA R, NEWAIRY ALSAYEDA A, WAHBY MAYSSAA M, et al.Manuka honey enhanced sensitivity of HepG2, hepatocellular carcinoma cells, for Doxorubicin and induced apoptosis through inhibition of Wnt/β-catenin and ERK1/2[J].Biological Research, 2021, 54(1):16.
[88] 韩超, 王丽娟, 王鹏源, 等.IL-6/JAK/STAT3信号通路在纤维化疾病中作用的研究进展[J].中国病理生理杂志, 2022, 38(12):2285-2290.
HAN C, WANG L J, WANG P Y, et al.Progress in role of IL-6/JAK/STAT3 signaling pathway in fibrotic diseases[J].Chinese Journal of Pathophysiology, 2022, 38(12):2285-2290.
[89] ARYAPPALLI P, AL-QUBAISI S S, ATTOUB S, et al.The IL-6/STAT3 signaling pathway is an early target of manuka honey-induced suppression of human breast cancer cells[J].Frontiers in Oncology, 2017, 7:167.
[90] ARYAPPALLI P, SHABBIRI K, MASAD R J, et al.Inhibition of tyrosine-phosphorylated STAT3 in human breast and lung cancer cells by manuka honey is mediated by selective antagonism of the IL-6 receptor[J].International Journal of Molecular Sciences, 2019, 20(18):4340.
[91] 李光美, 王朝群, 唐超, 等.天麻多糖对阿尔茨海默症小鼠焦虑行为及记忆功能的影响[J].遵义医科大学学报, 2023, 46(3):227-233;285.
LI G M, WANG C Q, TANG C, et al.Effect of Gastrodia elata polysaccharide on anxiety-like and learning/memory behaviors in AD mouse models[J].Journal of Zunyi Medical University, 2023, 46(3):227-233;285.
[92] NAVARRO-HORTAL M D, ROMERO-M RQUEZ J M, MU
RQUEZ J M, MU OZ-OLLERO P, et al.Amyloid β-but not Tau-induced neurotoxicity is suppressed by Manuka honey via HSP-16.2 and SKN-1/Nrf2 pathways in an in vivo model of Alzheimer’s disease[J].Food &Function, 2022, 13(21):11185-11199.
OZ-OLLERO P, et al.Amyloid β-but not Tau-induced neurotoxicity is suppressed by Manuka honey via HSP-16.2 and SKN-1/Nrf2 pathways in an in vivo model of Alzheimer’s disease[J].Food &Function, 2022, 13(21):11185-11199.
[93] BADR L K, EL ASMAR R, HAKIM S, et al.The efficacy of honey or olive oil on the severity of oral mucositis and pain compared to placebo (standard care) in children with leukemia receiving intensive chemotherapy:A randomized controlled trial (RCT)[J].Journal of Pediatric Nursing, 2023, 70:e48-e53.
[94] 徐微, 陈奕汝, 简艳艳, 等.446名大学生下颌第三磨牙阻生情况的CBCT研究[J].齐齐哈尔医学院学报, 2022, 43(7):627-632.
XU W, CHEN Y R, JIAN Y Y, et al.A CBCT study of the impacted mandibular third molars among 446 college students[J].Journal of Qiqihar Medical University, 2022, 43(7):627-632.
[95] AL-KHANATI N M, AL-MOUDALLAL Y.Effect of intrasocket application of manuka honey on postsurgical pain of impacted mandibular third molars surgery:Split-mouth randomized controlled trial[J].Journal of Maxillofacial and Oral Surgery, 2019, 18(1):147-152.