手性化合物特别是非天然氨基酸及其衍生物是现代药物、化学品和农药等的重要中间产物[1],现阶段手性化合物通常可以通过化学法、生物催化法合成[2-3]。但近些年来随着药物分子结构的日益复杂,化学法合成手性药物越来越复杂[4],生物催化法具有高效一步合成多个手性位点、绿色安全的特点而被广泛关注[5]。转氨酶(transaminase, TA)由于其已经成功高效合成手性胺,且其有着严格的立体选择性、高效一步合成、环境友好、不需要辅因子再生等优点而被广泛关注[6]。转氨酶是磷酸吡哆醛(pyridoxal phosphate, PLP)作为辅酶,通过将氨基转移至特定的受体来获得高对映体产物的一类酶[7],转氨酶现已经广泛应用于多种手性化合物的生产[8]。L-天冬氨酸转氨酶作为最先研究的一类转氨酶,其可以在氨基酸和酮酸之间发生转氨反应,从而生成酮酸对应的手性氨基酸[9-10],且其催化反应彻底、催化产物手性单一有着很高的实用价值[6]。
在自然界中,氨基酸转氨酶和脱羧酶都属于PLP依赖性的酶,研究证明天冬氨酸转氨酶和脱羧酶都属于同一种折叠方式,且都只在PLP辅因子与活性位点共价结合时才具有活性[6],PLP和酶形成的复合物在酶催化反应过程中都起着至关重要的作用[11]。对于L-天冬氨酸转氨酶催化的转氨反应来说,是典型的乒乓机制动力学机制,即酶和底物无需形成三元络合物,而是氨基供体通过将氨基转移至PLP和酶复合物上生成酮酸副产物,离开催化中心;剩下的磷酸吡哆胺(pyridoxamine phosphate,PMP)以及被修饰的酶紧接着和氨基受体结合,接受氨基供体留下的氨基生成转氨产物,同时PMP以及被修饰的酶回到原始形态,继续下一轮的催化反应[6]。同时脱羧酶也是一种PLP依赖性酶,不同的是脱羧酶将脱羧底物中的靠近官能团的羧基非氧化型脱羧,形成中间体的同时释放CO2,接着发生质子化等反应,脱羧产物释放的同时,内部的PLP和酶的复合物重新被建立[12]。该酶催化的2种反应有着诸多相似的地方,例如PLP在催化过程中的重要作用,推测该酶两种催化活性共用一个结合PLP的活性中心,具体的底物结合中心有所不同,导致其具有不同的催化活性[13]。
双功能酶是指酶蛋白一条肽链上同时具有两种不同的催化活性,来催化2种不同反应[14]的一类酶。双功能酶不同于由多个不同的单功能酶组成的酶系,由于其不同结构间的灵活转化机制使之有着比传统的多酶反应体系有着更高的反应速率。L-天冬氨酸转氨酶作为一种双功能酶不仅具有氨基酸和酮酸之间的转氨能力[15],同时也具有对二羧酸底物的非氧化脱羧能力,是一种研究较少的双功能酶,对其进行系统研究显得格外重要[16]。
本研究将L-天冬氨酸转氨酶基因克隆表达,并培养纯化出该酶,通过对该酶催化反应进行功能鉴定,结果表明该酶是一种具有催化氨基酸转氨和二羧酸底物的非氧化脱羧两种催化能力的双功能酶,对酶催化机理进行了探讨,并对该酶催化的2种反应进行研究,探究其具体反应方向,旨在为后续的研究和开发奠定基础。
1 材料和方法
1.1 材料和仪器
菌株细胞:克隆感受态菌株E.coli DH5α以及表达宿主菌株E.coli BL21(DE3),南京擎科生物有限公司;野生大肠杆菌菌株(菌株编号Bio-67405)以及表达载体pET-28a空载菌株均由本课题组保藏。
试剂及耗材:全基因组质粒提取试剂盒、质粒小提试剂盒、DNA凝胶回收试剂盒、PCR试剂盒、无缝克隆试剂盒,北京全式金生物有限公司;内切酶BamH I、Xho I、DNA Marker、DNA Ladder、蛋白Marker、蛋白Ladder,南京擎科生物有限公司;谷氨酸、苯甲酰甲酸、酮戊二酸、PLP,阿拉丁试剂。H2SO4、高氯酸、各类无机盐,国药集团。如果没有特殊说明,以上试剂均为化学纯。
LB(Luria-Bertani)培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10。
仪器:ETC821型PCR仪,东胜兴业科学仪器;Tanon 1600凝胶成像系统,上海天能科技;1350L高压蒸汽灭菌锅,上海博讯医疗公司;D-37520高速冷冻离心机,美国Beckman公司;SCIENT2-IID细胞超声破碎仪,宁波新芝生物技术有限公司;Model 201型Lab Alliance高效液相色谱系统,美国科学仪器公司。
1.2 实验方法
1.2.1 重组L-天冬氨酸转氨酶质粒的构建
根据NCBI中大肠杆菌来源的天冬氨酸转氨酶基因序列(CP026935.2),结合pET-28a的基因序列设计出带有BamH I、Xho I 两个酶切位点的如表1所示的2组引物。
表1 本研究所用引物
Table 1 Primers used in this study

引物名称引物序列(5′→3′)大小/bpAspAT-FGTGCTCGAGCAGCACTGCCACAATCGCTT29AspAT-RCGCGGATCCATGTTTGAGAACATTACCGCCGC32Vector-RATTGTGGCAGTGCTGCTCGAGCACCACCACCACCACCAC39Vector-FCTCAAACATGGATCCGCGACCCATTTGC28
以大肠杆菌的基因组质粒为模板,AspAT-F/AspAT-R为引物,进行PCR扩增,得到L-天冬氨酸转氨酶基因片段。同样以pET-28a空载质粒为模板,Vector-R/Vector-F为引物,进行PCR扩增,得到和已获得的基因片段有同源臂的pET-28a线性载体质粒。将纯化后的扩增产物使用无缝克隆试剂盒进行连接。
热激法将连接产物转化至DH5α克隆感受态细胞中,涂至含卡那霉素(50 mg/L)的固体LB平板上,37 ℃过夜培养并挑取单菌落。对单菌落进行酶切及测序验证重组质粒正确构建。验证成功的菌株质粒将转至BL21(DE3)表达感受态中,构建pET-28a(+)/L-AspAT菌株。
1.2.2 重组L-天冬氨酸转氨酶的诱导表达
将构建成功的产L-天冬氨酸转氨酶菌株在LB培养基37 ℃,220 r/min过夜培养。按照接种量2%(体积分数)将过夜菌液转接至LB培养基中37 ℃,220 r/min培养6~8 h至其OD600为1.8~2.0时,添加异丙基β-D-硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)至终浓度为0.25 mmol/L,25 ℃,220 r/min培养6 h。
4 ℃低温离心收集菌体沉淀,并重溶于Tris-HCl(0.1 mol/L pH 8)的缓冲液中,冰浴超声破碎,离心收集上清液,即为粗酶液。
1.2.3 重组L-天冬氨酸转氨酶的纯化
使用亲和层析(Proteinlso Ni-NTA Resin)对L-天冬氨酸转氨酶蛋白进行纯化。粗酶液经0.22 μm的微孔滤头过滤,上样于NI-NTA重力预装柱上。首先使用10倍柱体积的平衡缓冲液(300 mmol/L NaCl,50 mmol/L NaH2PO4,10 mmol/L咪唑,10 mmol/L Tris调pH 8.0)进行平衡,再分别依次使用含40~300 mmol/L咪唑的洗脱液进行洗脱,最后使用10 kDa的超滤管进行浓缩脱盐。SDS-PAGE蛋白电泳进行分析纯化结果,使用Bradford法,牛血清白蛋白作为标准曲线测定蛋白浓度,纯化后的蛋白进行酶学性质等后续实验。
1.2.4 重组L-天冬氨酸转氨酶酶活力测定
转氨酶活力测定:谷氨酸40 mmol/L,苯甲酰甲酸20 mmol/L,PLP 5 mmol/L溶解于5 mL的pH 8的Tris-HCl缓冲液中,加入蛋白质量浓度为0.1 mg/mL的纯酶液500 μL,35 ℃反应1 h,煮沸停止反应,检测反应液中苯甲酰甲酸的减少量。
一个酶活力单位(U)定义为:每小时催化消耗1 μmol苯甲酰甲酸所需的酶量。
脱羧酶活力测定:20 mmol/L酮戊二酸溶解于5 mL的pH 8的Tris-HCl缓冲液中,加入蛋白质量浓度为0.1 mg/mL的纯酶液500 μL,35 ℃反应1 h,煮沸停止反应,检测反应液中酮戊二酸的减少量。
一个酶活力单位(U)定义为:每小时催化消耗1 μmol酮戊二酸所需的酶量。
苯甲酰甲酸、苯甘氨酸、酮戊二酸均使用高效液相色谱检测,苯甲酰甲酸、酮戊二酸高效液相色谱检测条件为:色谱柱为Bio-RAD生产的Organic Acid Analysis Column(300 mm×7.8 mm),流动相为5 mmol/L H2SO4水溶液,在214 nm下检测,流速为0.6 mL/min,上样量20 μL,柱温25 ℃。苯甘氨酸液相检测条件:色谱柱为Daicel corporation生产的Crownpak CR-I(+)(150 mm×3.9 mm),流动相为V(高氯酸水溶液)∶V(乙腈)=80∶20,200 nm下检测,流速0.35 mL/min,上样量2 μL,柱温25 ℃。
质谱检测条件:美国Waters公司,ACQUITY UPLC LCT Premier XE仪器。
1.2.5 重组L-天冬氨酸转氨酶两种反应的表征
转氨反应:分别取谷氨酸、苯甲酰甲酸,PLP溶解于pH 8的Tris-HCl缓冲液中,使其终浓度为40、20和5 mmol/L,加入酶液,35 ℃反应,灭活利用高效液相色谱检测,观察反应前后反应液中苯甲酰甲酸以及产物苯甘氨酸浓度的变化。
脱羧反应:取酮戊二酸溶解于 pH 8的Tris-HCl缓冲液中使其终浓度为20 mmol/L,加入酶液,35 ℃反应,煮沸停止反应,高效液相色谱检测,观察反应前后反应液中酮戊二酸浓度的变化以及反应后反应液的质谱检测。
1.2.6 反应过程中转氨和脱羧反应关系
分别取谷氨酸、苯甲酰甲酸、PLP浓度溶解于 pH 8的Tris-HCl缓冲液中,使其终浓度为20 mmol/L、20 mmol/L、5 mmol/L,加入酶液,每隔1 h取样,煮沸检测反应液中的苯甲酰甲酸、酮戊二酸、苯甘氨酸、1,4-丁二酸浓度变化,并计算酮戊二酸以及苯甲酰甲酸转化率。
1.2.7 L-天冬氨酸转氨酶的分子对接
L-天冬氨酸转氨酶的蛋白结构来自PDB(编号1AHG),对接所用酮戊二酸(SID:404770395)与L-苯甘氨酸(SID:198962634)的分子结构均来自NCBI,分子对接由Discovery Studio Client完成,所有绘图分析由PyMOL完成。
1.2.8 重组L-天冬氨酸转氨酶酶学性质测定
1.2.8.1 温度、pH对重组酶酶活力的影响
最适温度:在pH为8.0的Tris-HCl缓冲液中,分别在25、30、35、37、40 ℃下,测定L-天冬氨酸转氨酶的转氨和脱羧酶活力,以最高酶活力为100%,计算相对酶活力。
最适pH:在pH 7、8、9、10的Tris-HCl缓冲液以及pH 5、6、7、8、9下的磷酸氢二钠-柠檬酸缓冲液中,分别测定L-天冬氨酸转氨酶的转氨和脱羧酶活力,以最高酶活力为100%,计算相对酶活力。
1.2.8.2 金属离子对重组L-天冬氨酸转氨酶活性影响
分别在反应液中加入终浓度为5 mmol/L MnCl2、MgCl2、NiCl2、Al2SO4、KCl、FeCl3、ZnCl2、NaCl、BaCl2、CaCl2、CuSO4、EDTA,观察金属离子对酶活力的影响,以不加离子的反应液的酶活力定义为100%,计算相对酶活力。
1.2.8.3 重组L-天冬氨酸转氨酶的酶动力学参数
转氨反应的酶动力参数:苯甲酰甲酸20 mmol/L,PLP 5 mmol/L。谷氨酸分别以10~160 mmol/L溶解于5 mL的pH 8的Tris-HCl缓冲液中,加入500 μL的0.1 mg/mL的纯酶液。35 ℃纯酶催化反应10 min,高效液相色谱检测不同反应组中苯甲酰甲酸的减少量从而计算酶动力学参数。
脱羧反应的酶动力学参数:PLP 5 mmol/L以及酮戊二酸分别以10~160 mmol/L溶解于5 mL的pH 8的Tris-HCl缓冲液中,加入500 μL的0.1 mg/mL的纯酶液。35 ℃,纯酶催化反应10 min,高效液相色谱检测不同反应液中酮戊二酸的减少量从而计算酶动力学参数。
2 结果和分析
2.1 重组酶蛋白表达及其纯化结果
通过前期的基因克隆,对其质粒进行双酶切验证、菌落PCR鉴定、测序等操作,认为pET-28a/L-AspAT重组质粒构建成功。将质粒转化、产酶,并对粗酶液进行蛋白纯化操作。SDS-PAGE结果图如增强出版附件图1所示,L-AspAT的预测蛋白大小为43.5 kDa,对比Marker可知,蛋白表达正确,且纯化效果较好,收集洗脱液,进行超滤脱盐浓缩,得到的纯化酶做接下来的酶催化反应。
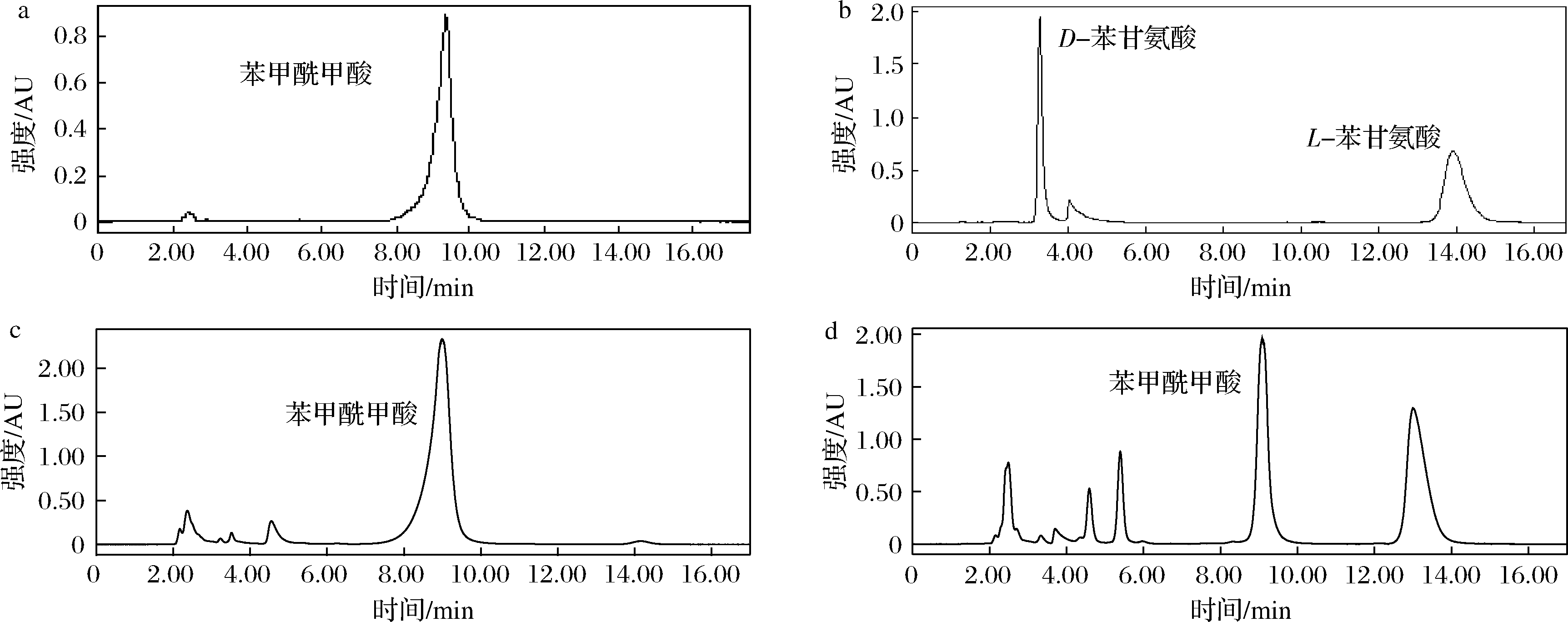
a-苯甲酰甲酸标品;b-D型、L型苯甘氨酸标品;c-转氨反应前;d-转氨反应后
图1 转氨功能验证HPLC图
Fig.1 HPLC chromatograph of ammonia transfer function validation
2.2 重组酶催化功能鉴定
对L-AspAT催化的转氨脱羧反应进行功能鉴定,并分析底物的减少以及不同反应的产物生成情况。图1-a为苯甲酰甲酸标品的HPLC图,其特征峰出峰时间为9.1 min,图1-b为D型、L型苯甘氨酸标品的HPLC图,3.5 min为D-苯甘氨酸的特征峰,13.1 min为L-苯甘氨酸特征峰。图1-c和图1-d为转氨反应前后反应液的HPLC对比图,从图中可以看到,反应前后苯甲酰甲酸的峰面积减少,反应生成L-苯甘氨酸,同时在3.5 min并没有D-苯甘氨酸的特征峰的产生,计算其ee值>98%,说明该酶催化转氨反应的产物手性单一。
由图2可知,图2-a为酮戊二酸的标品,酮戊二酸在8.5 min左右有特征峰,结合脱羧反应前后的反应液的HPLC对比图中(图2-b及图2-c)。当L-AspAT单独催化酮戊二酸反应时,酮戊二酸有消耗的现象,通过检测反应体系中生成的CO2以及特异性的还原端反应。脱羧反应后反应液的质谱图见增强出版附件图2,在质谱图中可以看到117.01和101.02的特征峰,分别对应着1,4-丁二酸和4-氧代丁酸。结合液相和质谱图得到酮戊二酸在酶的催化作用下,发生了非氧化脱羧。生成了4-氧代丁酸,4-氧代丁酸不稳定进而生成1,4-丁二酸,由于CO2在反应体系中不能积累的缘故,脱羧反应一般进行的比较彻底。
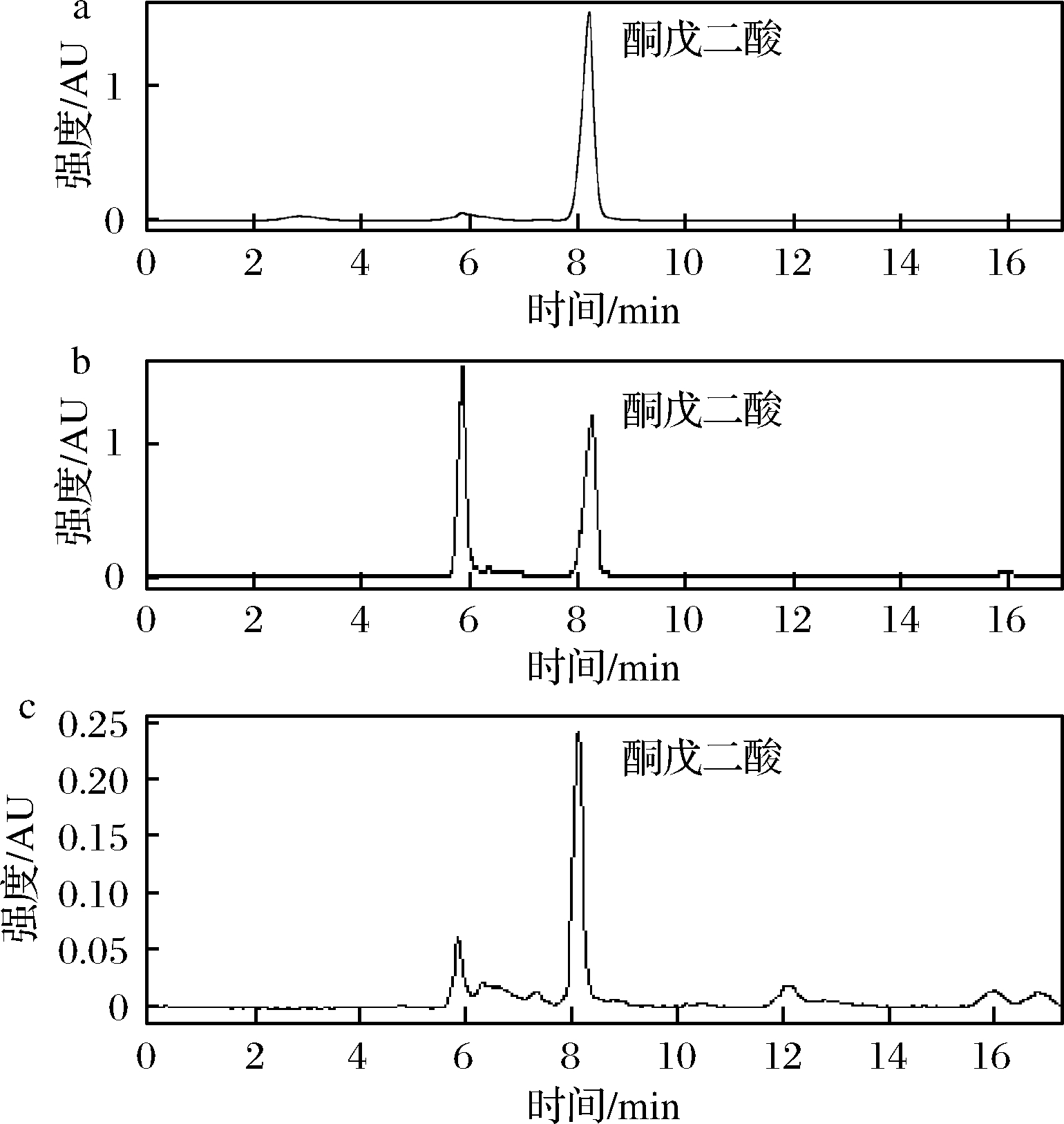
a-酮戊二酸标品;b-脱羧反应前;c-脱羧反应后
图2 脱羧功能HPLC验证图
Fig.2 HPLC chromatograph of decarboxylation function validation
通过对该酶催化反应进行功能鉴定,实验结果表明该酶是一种具有催化氨基酸转氨和二羧酸底物的非氧化脱羧2种催化能力的双功能酶。
2.3 反应过程底物产物随时间变化
检测反应液中不同成分在不同时间的浓度以及转化率,结果如图3所示。从图3-a可以看出在反应前期即反应0~5 h,苯甲酰甲酸和酮戊二酸的转化率基本持平,即反应前期以转氨反应为主,酮戊二酸在反应液中并没有积累较多,其浓度不高,体系中基本上不进行脱羧反应,反应体系中酮戊二酸的浓度增高。
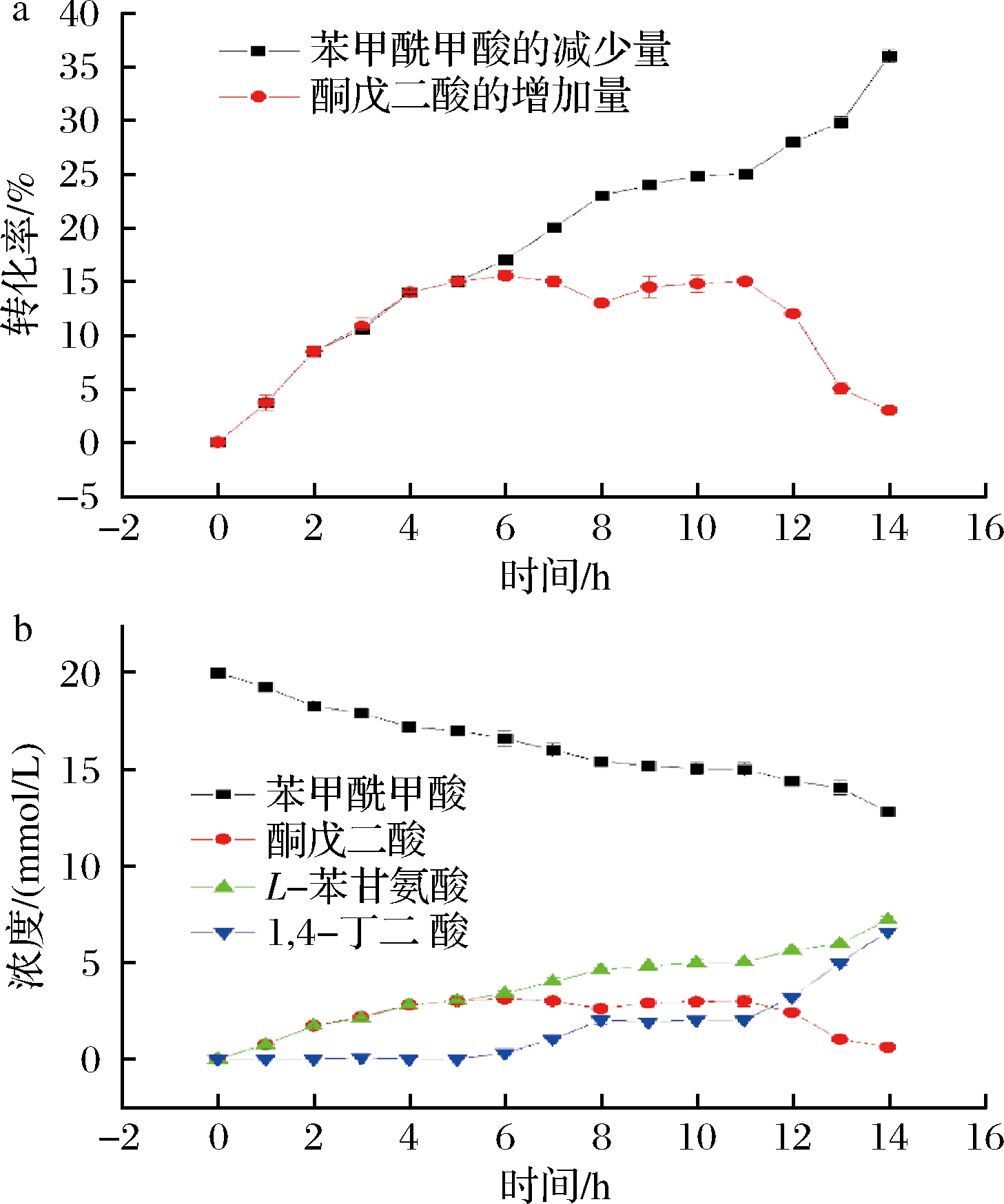
a-L-AspAT催化反应转化率;b-L-AspAT催化反应成分浓度
图3 溶液成分随时间变化图
Fig.3 Change diagram of solution composition with time
随着反应进行,在反应进程中期时(即反应5~11 h时),酮戊二酸的增加量和苯甲酰甲酸的减少量开始不对等。推测随着酮戊二酸浓度进一步增高,脱羧反应开始进行,但此时转氨反应生成酮戊二酸的速率大于脱羧反应消耗酮戊二酸的速率,所以反应体系中酮戊二酸的浓度进一步增加,同时可以发现转氨反应速率相对于反应初期来说有所增加。
在反应后期,酮戊二酸的量基本达到最高值后,脱羧反应速率进一步增加,转氨反应生成的酮戊二酸开始小于脱羧反应消耗的量,反应体系中酮戊二酸的浓度减少。随着脱羧反应速率增高,反应体系中的转氨反应速率进一步增加。
进一步检测催化体系中不同物质的浓度随时间变化如图3-b所示,可以看到,随着时间的增加苯甲酰甲酸的量是持续下降的,同时作为转氨反应的产物L-苯甘氨酸和酮戊二酸在反应前期均有一定程度的浓度上升,但随着脱羧反应的进行,酮戊二酸的浓度开始下降,同时由于L-苯甘氨酸不进行脱羧反应其浓度一直随着反应的进行而上升。在脱羧反应开始的同时,开始检测到1,4-丁二酸的生成,使整个催化反应快速且使转氨反应催化完全,目标产物L-苯甘氨酸的产量达到预期。
酮戊二酸作为转氨反应的产物,被非氧化脱羧反应消耗后,能进一步促进转氨反应的进行,转氨反应速率的增加导致酮戊二酸生成更加迅速。反应中后期转氨和脱羧反应的相互促进作用,不仅解除了转氨反应的产物抑制作用,使其生成更多的所需非天然氨基酸L-苯甘氨酸,而且使转氨和脱羧反应速率大大增加。
2.4 双功能酶的反应机制探讨
结合实验现象和L-天冬氨酸转氨酶催化原理以及LI等[17]关于PLP依赖型酶的综述报道中对转氨和脱羧的阐述,认为在底物为L-谷氨酸和苯甲酰甲酸的反应体系中,发生了图4所示的反应,首先在反应前期,发生的转氨反应,生成了转氨反应产物L-苯甘氨酸和酮戊二酸,随着产物酮戊二酸的积累,体系中开始发生脱羧反应,生成4-氧代丁酸进而生成1,4-丁二酸,同时产生副产物CO2。L-天冬氨酸转氨酶催化的脱羧反应在一定程度上消耗了转氨反应的产物,降低了转氨反应的产物抑制程度,促进转氨反应的进行,这有可能是双功能酶在进化过程中发生了基因融合从而导致该酶有利于反应进行的生物学特性。
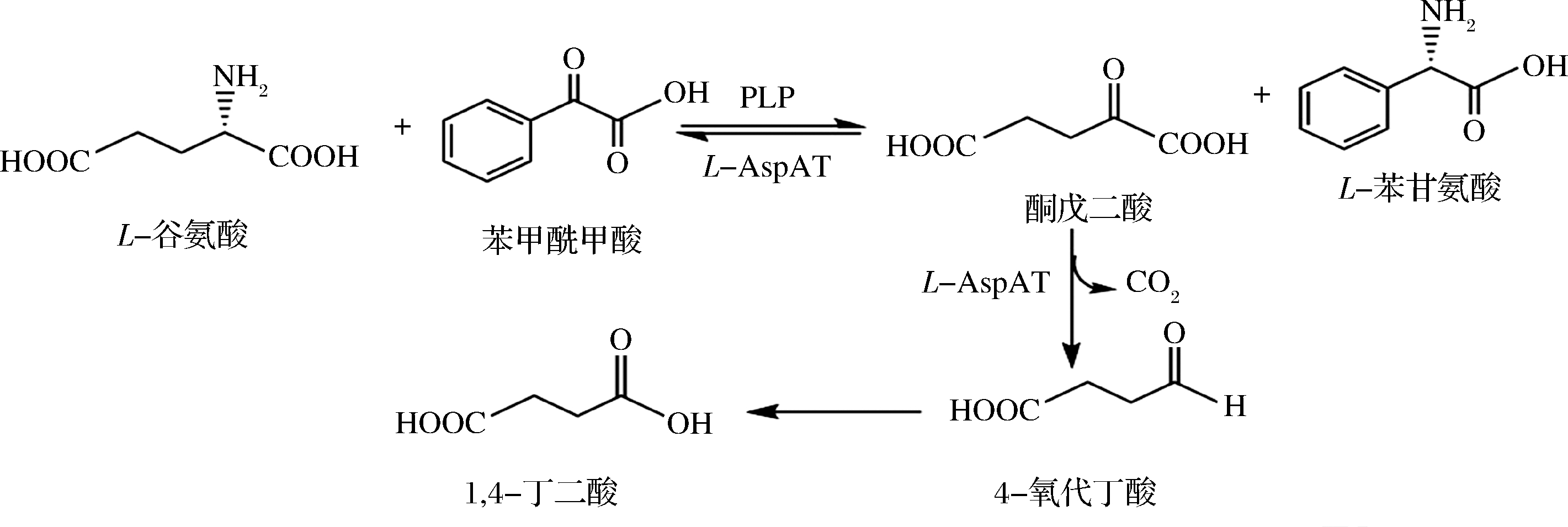
图4 转氨脱羧反应进程图
Fig.4 Progression diagram of transamination decarboxylation reaction
利用DS对L-天冬氨酸转氨酶和小分子进行刚性对接,对接结果如图5所示。可以明显地看到对于L-天冬氨酸转氨酶来说,转氨和脱羧不同反应底物结合位点是不同的,2个反应有不同的催化中心。在整个反应体系中,转氨反应生成的酮戊二酸可能经过蛋白内部通道到达脱羧反应的催化中心,使该反应能够更好更彻底的进行。
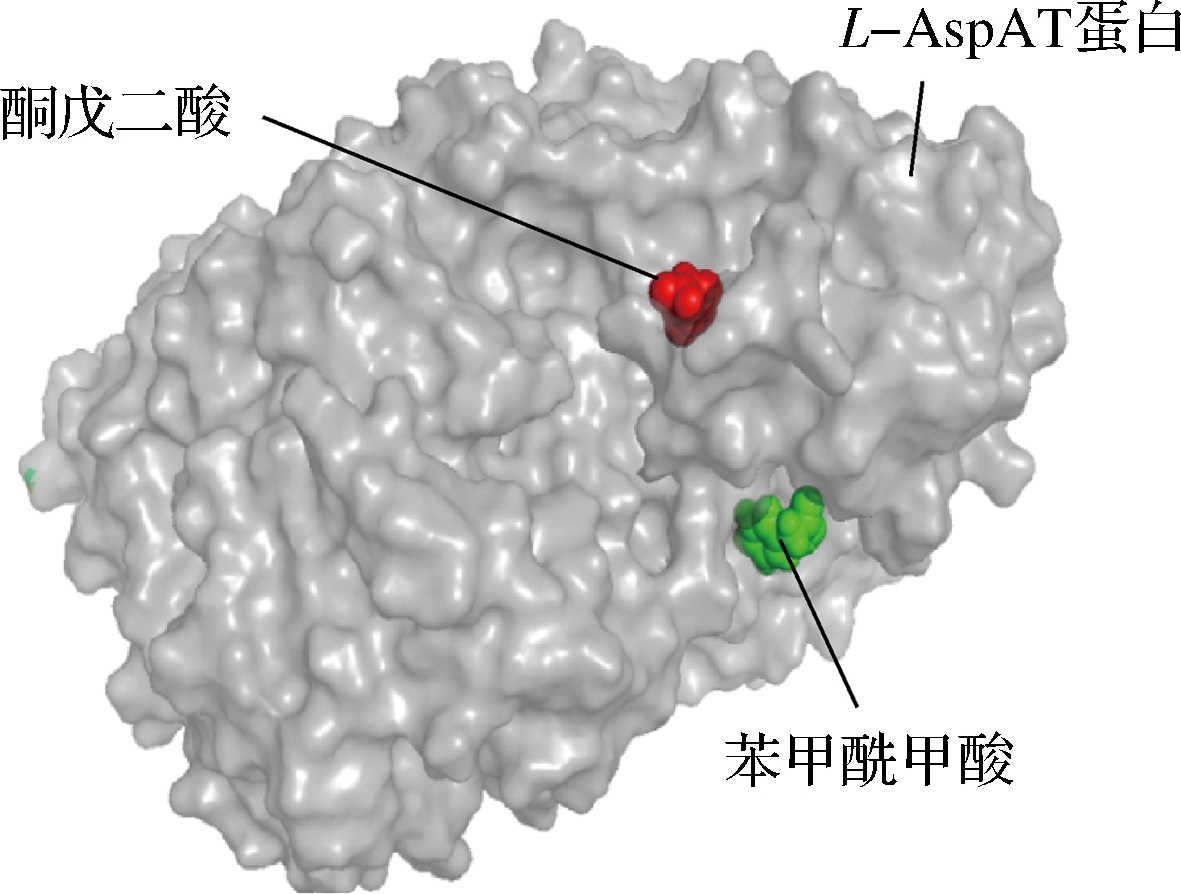
图5 分子对接结果图
Fig.5 Molecular docking result diagram
对蛋白和小分子相互作用进行进一步的模拟分析,如增强出版附件图3所示,苯甲酰甲酸分别和L-天冬氨酸转氨酶的128位脯氨酸,133位组氨酸,146位谷氨酸形成了氢键。同样的是,如增强出版附件图4所示,酮戊二酸分别和L-天冬氨酸转氨酶蛋白的37位色氨酸,33位亮氨酸,30位天冬酰胺分别形成了氢键。可以得到苯甲酰甲酸和酮戊二酸在酶表面的不同位置进行结合,不同的催化中心催化2种反应,2种反应独立又相互促进,符合双功能酶的催化现象。
2.5 重组酶酶学性质
2.5.1 温度、pH对酶活力的影响
不同温度下测量L-天冬氨酸转氨酶的催化转氨脱羧活性,结果如图6所示,转氨反应的最适温度为35 ℃,同时脱羧反应的最适温度为37 ℃,2种反应的最适温度有所不同,但相差不多。对比不同来源的L-天冬氨酸转氨酶的最适温度基本和该酶相似,但来源于嗜热菌Thermus thermophilus HB8的酶最适温度为75 ℃,其较强的温度耐受性可能和其来源有关[10]。
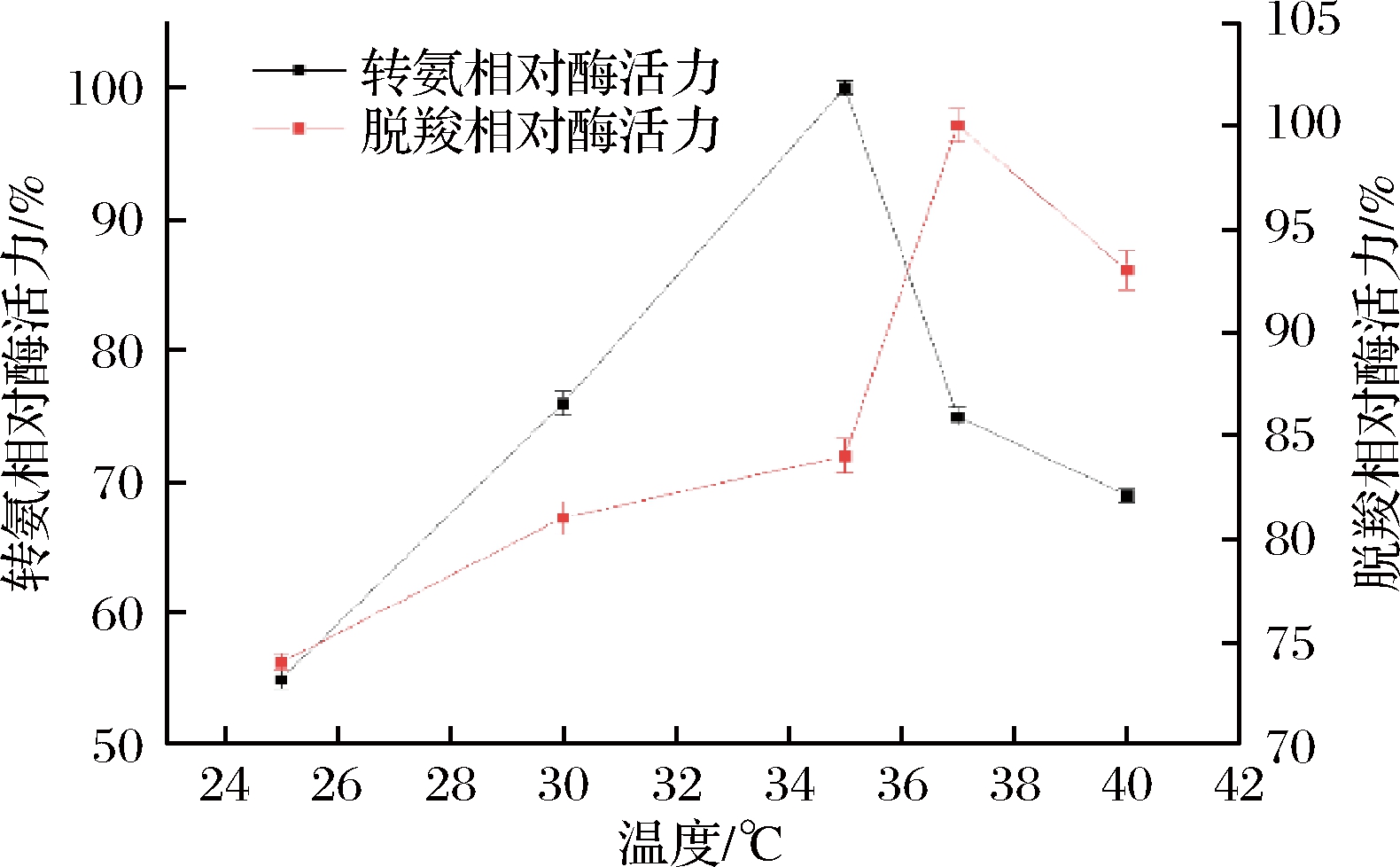
图6 温度对酶活力的影响
Fig.6 Effects of temperature on the enzyme activity
在不同pH下测量L-天冬氨酸转氨酶的催化转氨脱羧活性,结果如图7所示,在不同的缓冲体系中,当反应体系中pH为8时,转氨和脱羧2种反应的相对酶活力都为最高,可以得到该酶2种酶活力的最适pH相同都为8。偏酸和偏碱情况下酶活力都有所损失,偏酸情况下损失的更加明显。对比不同来源的L-天冬氨酸转氨酶的最适pH基本相似都为8左右[10],这可能和转氨反应所需的碱性环境有关。

图7 pH对酶活力的影响
Fig.7 Effects of pH on the enzyme activity
2.5.2 金属离子对酶活力的影响
由图8可知,不同离子对转氨和脱羧反应的影响不同,对于转氨反应来说,EDTA、Mg2+、Cu2+能显著增加转氨酶活力,而Na+、Ba2+存在的情况下,转氨酶活力损失较为严重,其他离子存在的情况下,对转氨酶活力没有显著影响。对于脱羧反应来说,EDTA、Ni+能显著增加脱羧酶活力,而Al3+、K+、Ba2+、Cu2+存在的情况下,脱羧酶活力损失较为严重,其他离子存在的情况下,对脱羧酶活力没有显著影响。
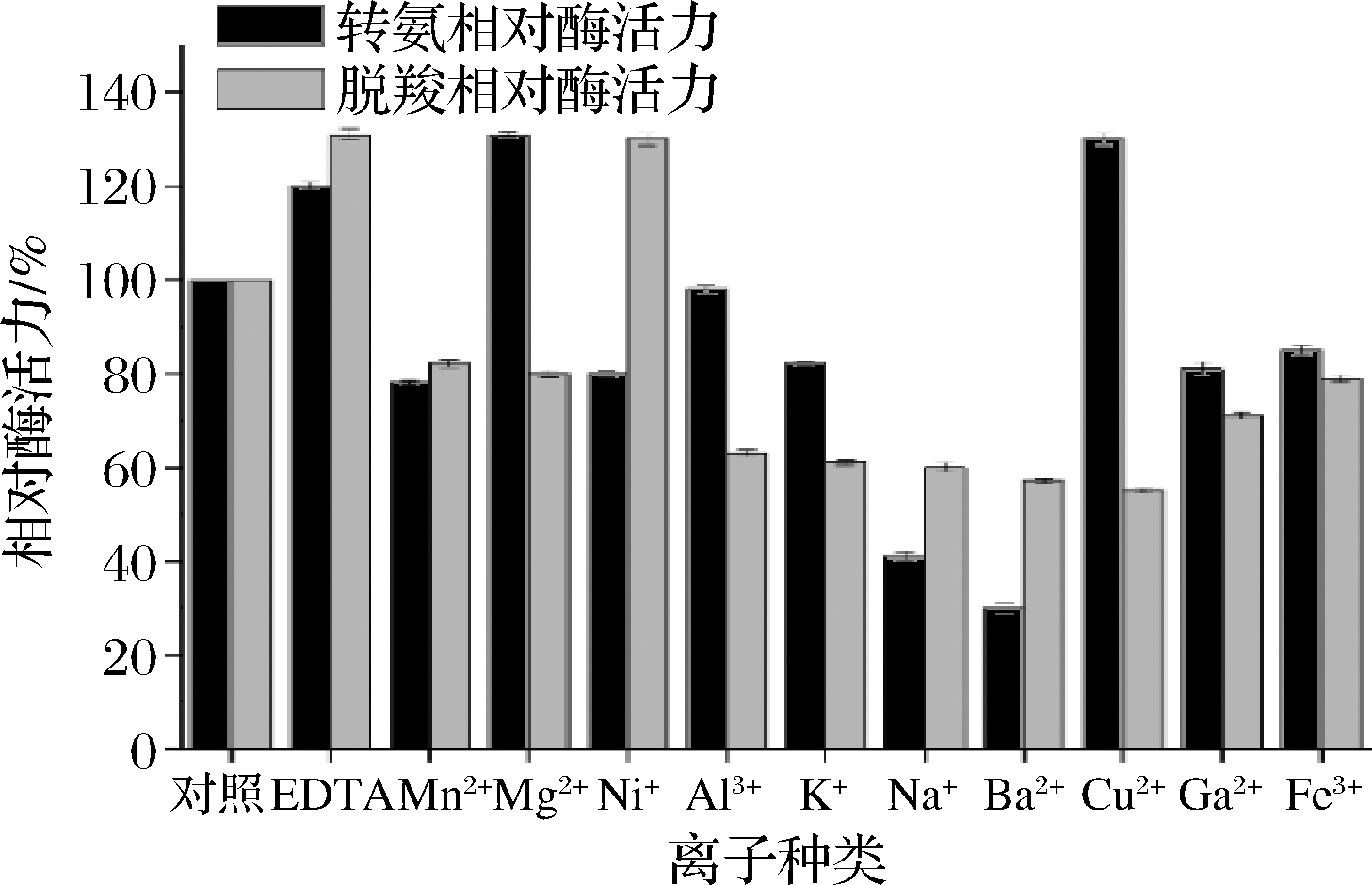
图8 金属离子对酶活力的影响
Fig.8 Effect of metal ion on the enzyme activity
同时Mg2+、Cu2+对转氨反应酶活力有促进作用,同时对脱羧反应酶活力没有影响甚至降低了脱羧反应的酶活力。Ni+对脱羧反应酶活力有着促进作用,同时对转氨反应酶活力没有太大影响,可能是和2种活力催化活性中心不同,导致不同的离子对脱羧和转氨反应酶活力的影响不同。
2.5.3 酶动力参数
对L-天冬氨酸转氨酶催化的2种反应,分别测酶动力学参数,结果如表2所示,其中转氨反应的Km值为138 mmol/L,kcat/Km值为0.015 s-1·(mmol/L)-1。脱羧反应的Km值为12.09 mmol/L,kcat/Km值为0.006 s-1·(mmol/L)-1,可以看出对于L-天冬氨酸转氨酶来说,是以转氨反应作为其主反应,脱羧反应为其副反应而进行的,对于该酶来说,转氨反应速率是要大于脱羧反应的,转氨反应相对而言是有较高的催化效率。
表2 转氨脱羧反应的酶动力参数
Table 2 Kinetic parameters of transammonia and decarboxylation reaction

反应类型Km/(mmol/L)kcat/(s-1)kcat/Km/[s-1·(mmol/L)-1]转氨反应138.72±4.012.08±0.40 0.015±0.10脱羧反应12.09±0.500.072±0.007 00.006±0.010
3 结论
本文以大肠杆菌来源的L-天冬氨酸转氨酶基因序列作为研究对象,成功克隆表达出了高产L-天冬氨酸转氨酶的菌株,并通过亲和层析得到纯化酶。通过对该酶催化反应进行功能鉴定,验证该酶是一种具有催化氨基酸转氨和二羧酸底物的非氧化脱羧2种催化能力的双功能酶。对该酶催化的2种反应进行了机理研究,进一步研究了L-天冬氨酸转氨酶的转氨反应和脱羧反应分别的酶学性质得到了2种反应的最适温度、最适pH和不同的离子对2种反应的影响,2种反应相类似的最适条件使该酶能够更好地发生级联反应,对该酶催化的主反应(转氨反应)有着很好的促进作用。对反应过程中底物产物的转化率进行检测研究,并对该酶催化的2种不同的反应底物和酶蛋白进行分子对接操作,发现该酶有2个不同的结构域来催化不同的反应,并得到了2种酶催化反应之间的关系,进一步验证了该双功能酶具体的催化进程,为后续研究提供了理论基础。
L-天冬氨酸转氨酶有着转氨能力,同时也有着对二羧酸底物的非氧化脱羧作用。通过对反应进行研究认为转氨反应是该酶催化的主要反应。同时对于双功能酶来说,转氨反应的产物酮戊二酸是脱羧反应的底物,酮戊二酸可能不需要通过溶液进入脱羧反应的催化中心,而是通过酶蛋白内部之间进入催化中心。从而该双功能酶比多个单功能酶组成的酶系更加快速有效,同时转氨反应的速率也影响着脱羧反应[10]的进行,脱羧反应的进行也使转氨反应解除产物抑制,打破反应平衡更加有利于整体反应的进行。对转氨酶和脱羧酶的反应机理相关的验证讨论,认为该酶催化的2种反应都为PLP依赖型的酶,同时脱羧反应有利于转氨反应的正向进行,可能在生物进化的过程中发生了2种酶的融合导致了该酶具有的双功酶催化特性[18-19],利用Discovery Studio Client,结合生物信息学工具发现对于L-AspAT来说,其结合转氨和脱羧反应底物的催化中心位于酶的不同位置,该双功能酶催化2种反应时相互独立,但同时其独特的PLP依赖型的结构也促使在反应液中同时有2种反应时,两者相互促进,互相影响。
后续可以利用分子生物学以及生物信息学作为工具,对基因序列以及结构进行研究,深入探讨具体的协同机制,以及转氨反应和脱羧反应催化中心的关系以及二羧酸底物可能的底物通道,更加深入了解该酶。
[1] JIA D X, PENG C, LI J L, et al.Redesign of (R)-omega-transaminase and its application for synthesizing amino acids with bulky side chain[J].Applied Biochemistry and Biotechnology, 2021, 193(11):3624-3640.
[2] ZHAI L X, YANG S L, LAI Y J, et al.Effect of residue substitution via site-directed mutagenesis on activity and steroselectivity of transaminase BpTA from Bacillus pumilus W3 for sitafloxacin hydrate intermediate[J].International Journal of Biological Macromolecules, 2019, 137:732-740.
[3] KOPER K, HAN S W, PASTOR D C, et al.Evolutionary origin and functional diversification of aminotransferases[J].Journal of Biological Chemistry, 2022, 298(8):102122.
[4] MORENO C J, HERN NDEZ K, CHARNOK S J, et al.Synthesis of γ-hydroxy-α-amino acid derivatives by enzymatic tandem aldol addition-transamination reactions[J].ACS Catalysis, 2021, 11(8):4660-4669.
NDEZ K, CHARNOK S J, et al.Synthesis of γ-hydroxy-α-amino acid derivatives by enzymatic tandem aldol addition-transamination reactions[J].ACS Catalysis, 2021, 11(8):4660-4669.
[5] ROSSIGNOLI G, PHILLIPS R S, ASTEGNO A, et al.Phosphorylation of pyridoxal 5′-phosphate enzymes:An intriguing and neglected topic[J].Amino Acids, 2018, 50(2):205-215.
[6] 黄宗庆, 路建光, 张喜全, 等.催化合成西格列汀的转氨酶基因的克隆表达[J].中国医药工业杂志, 2015, 46(12):1296-1300.
HUANG Z Q, LU J G, ZHANG X Q, et al.Gene cloning and expression of transaminase for the catalytic synthesis of sitagliptin[J].Chinese Journal of Pharmaceuticals, 2015, 46(12):1296-1300.
[7] C RDENAS-FERN
RDENAS-FERN NDEZ M, KHALIKOVA E, KORPELA T, et al.Co-immobilised aspartase and transaminase for high-yield synthesis of L[J].Biochemical Engineering Journal, 2015, 93:173-178.
NDEZ M, KHALIKOVA E, KORPELA T, et al.Co-immobilised aspartase and transaminase for high-yield synthesis of L[J].Biochemical Engineering Journal, 2015, 93:173-178.
[8] YU J H, LI J, CAO S Y, et al.Chemoenzymatic synthesis of L-3, 4-dimethoxyphenyl-alanine and its analogues using aspartate aminotransferase as a key catalyst[J].Catalysis Communications, 2019, 120:28-32.
[9] BEZSUDNOVA E Y, POPOV V O, BOYKO K M.Structural insight into the substrate specificity of PLP fold type IV transaminases[J].Applied Microbiology and Biotechnology, 2020, 104(6):2343-2357.
[10] 邵楠, 王虹, 李荣贵.荧光假单胞菌天冬氨酸转氨酶的基因克隆及其在大肠杆菌中的表达[J].中国生物工程杂志, 2009, 29(4):88-92.
SHAO N, WANG H, LI R G.Cloning and expression of aspartate aminotransferase from Pseudomonas fluorescens in Escherichia coli[J].China Biotechnology, 2009, 29(4):88-92.
[11] GRISWOLD W R, CASTRO J N, FISHER A J, et al.Ground-state electronic destabilization via hyperconjugation in aspartate aminotransferase[J].Journal of the American Chemical Society, 2012, 134(20):8436-8438.
[12] OSTERMAN A L, BROOKS H B, RIZO J, et al.Role of arg-277 in the binding of pyridoxal 5′- phosphate to Trypanosoma brucei ornithine decarboxylase[J].Biochemistry, 1997, 36(15):4558-4567.
[13] ROCHA J F, PINA A F, SOUSA S F, et al.PLP-dependent enzymes as important biocatalysts for the pharmaceutical, chemical and food industries:A structural and mechanistic perspective[J].Catalysis Science &Technology, 2019, 9(18):4864-4876.
[14] 刘欣, 石鹏君, 杨培龙, 等.双功能木聚糖酶研究进展[J].中国农业科技导报, 2010, 12(2):50-56.
LIU X, SHI P J, YANG P L, et al.Research progress on bifunctional xylanases[J].Journal of Agricultural Science and Technology, 2010, 12(2):50-56.
[15] MCKENNA M C, RAE C D.A new role for α-ketoglutarate dehydrogenase complex:Regulating metabolism through post-translational modification of other enzymes[J].Journal of Neurochemistry, 2015, 134(1):3-6.
[16] GRABER R, KASPER P, MALASHKEVICH V N, et al.Conversion of aspartate aminotransferase into anl-aspartate β-decarboxylase by a triple active-site mutation[J].Journal of Biological Chemistry, 1999, 274(44):31203-31208.
[17] LI T F, HUO L, PULLEY C, et al.Decarboxylation mechanisms in biological system[J].Bioorganic Chemistry, 2012, 43:2-14.
[18] TAYLOR P P, PANTALEONE D P, SENKPEIL R F, et al.Novel biosynthetic approaches to the production of unnatural amino acids using transaminases[J].Trends in Biotechnology, 1998, 16(10):412-418.
[19] KAMITORI S, HIROTSU K, HIGUCHI T, et al.Three-dimensional structure of aspartate aminotransferase from Escherichia coli at 2.8 Å resolution[J].The Journal of Biochemistry, 1988, 104(3):317-318.