胃动力障碍是由胃肌肉收缩的频率、力量过低或过高、胃分泌功能紊乱引起的胃调节、胃排空异常[1-2],是引起功能性消化不良和胃轻瘫的主要原因之一[3-4]。环境、遗传、饮食、情绪都有可能导致胃动力障碍[5],促动力剂是目前一线的胃动力障碍治疗药物[6]。然而这些药物有一定副作用,在许多地区、国家禁售[7-8]。在临床治疗当中也常采用调整患者饮食结构或使用消化酶膳食补充剂等非药物治疗方法[9-10],但只有当患者的症状频次满足了相应的诊断标准才会被纳入相应治疗体系,这忽略了许多症状较为轻微但依然为此所扰的人群[11]。因此,基于实际的人群需求找到效果较好、安全无毒且起效机制较为明确的促胃动力药替代品不可或缺。
我国许多消食导滞的药食同源食物具有促消化、促胃动力的作用,如陈皮、山楂、鸡内金等。山楂具有促消化液分泌、促胃排空等作用调节胃肠运动[12-13];陈皮水提物具有促进离体胃体平滑肌收缩的作用[14],其成分橘皮素等具有促胃液、胃蛋白酶排出的作用[15];鸡内金具有促进功能性消化不良大鼠胃排空、提高胃泌素(gastrin,GAS)和胃动素(motilin,MTL)表达的作用,并能提高小鼠胃游离酸、总酸度和胃蛋白酶活力[16]。但这些食物的研究主要针对整体消化作用,对胃动力的影响尚不完全清楚。另外,通过调研发现菊苣可能具有促进食欲、增加胃液分泌的功能[17],余甘子水提物具有改善胃肠激素的作用[18]。尽管这两者极具潜力,却几乎未被传统药方用于配伍促胃动力配方。
综上,5种食物皆有改善胃动力的作用,但发挥作用的机制可能不同。然而,目前没有相关研究甄别其促胃动力机制和作用靶点的重叠性,也没有统一模型下的效果比较。目前,以这些食品为原料开发的产品较多,包括各类山楂、陈皮、余甘子饮品,鸡内金和菊苣软糖,以及近年来深受追捧的晒干药食同源食物复配后的茶包、粉包等。但这些市售产品宣称的功效往往缺乏依据,大多只是简单加和,容易误导消费者。因此,对这些食物的促胃动力机制和效果研究十分迫切。
本研究旨在通过左旋精氨酸(L-arginine,L-arg)造模致胃动力障碍,基于该模型验证、筛选有效的促胃动力药食同源食物,通过对胃排空指标的研究评价其是否具有促胃动力作用,通过对胃液相关指标、兴奋型血清胃肠激素GAS、MTL和饥饿素(ghrelin)、胃窦HE染色切片和间质细胞(interstitial cell of Cajal,ICC)指示基因酪氨基酶受体基因(c-kit)和干细胞因子(stem cell factor,SCF)相对表达水平来观察起效的可能途径,从而比较这些药食同源食物的促胃动力效果,明确其起效机制,进而为开发新型促胃动力膳食补充剂的原材料选用提供参考。
1 材料与方法
1.1 材料
1.1.1 动物
雄性SPF级SD大鼠64只,10周左右,体重(400±20)g,北京维通利华实验动物技术有限公司。
1.1.2 试剂
山楂、陈皮、鸡内金、菊苣、余甘子,北京同仁堂大药房;多潘立酮,西安杨森制药有限公司生产,市售药店;异氟烷,深圳市瑞沃德生命科技有限公司;NaCl、左旋精氨酸盐酸盐、多聚甲醛,国药集团化学试剂有限公司;大鼠胃动素、胃泌素、饥饿素酶联免疫吸附测定(ELISA)试剂盒,上海酶联生物技术有限公司;Trizol裂解液,逆转录试剂盒,南京诺唯赞生物技术公司;PCR引物,生工生物工程(上海)股份有限公司。
1.1.3 仪器与设备
EL3002型精密电子天平,梅特勒托利多科技(中国)有限公司;TG16A台式离心机和TGL-16M冷冻离心机,上海卢湘仪离心机仪器有限公司;5424R高速离心机,德国Eppendorf公司;Thermo-994式-80 ℃冰箱、Multiscan Go多功能酶标仪,美国赛默飞世尔科技公司;高通量组织研磨仪,宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 动物分组、模型建立
64只大鼠饲养于江南大学实验动物中心SPF级屏障中[SYXK(苏)2021-0056],温度为(25±2)℃,相对湿度40%~60%,严格遵循光照12 h/黑夜12 h循环,所有动物均喂食标准饲料和无菌水,并可自由饮食。适应1周后开始实验。动物实验设计方法经江南大学伦理委员会批准(NO20211015S0961120),符合欧盟保护动物条例(2010/63/EU)。具体动物实验设计方案见表1。
表1 动物实验设计方案
Table 1 Animal experimental design scheme

分组造模、干预操作数量第1天第2~5天第6~12天8空白组腹腔注射等量生理盐水灌胃与各实验组等量水8模型组多潘立酮组菊苣组陈皮组鸡内金组山楂组余甘子组腹腔注射左旋精氨酸5.2 g/kg腹腔注射左旋精氨酸2.6 g/kg灌胃与各实验组等量水8灌胃3.1 mg/kg多潘立酮混悬液8灌胃0.93 g/kg菊苣粉末混悬液8灌胃0.31 g/kg陈皮粉末混悬液8灌胃0.31 g/kg鸡内金粉末混悬液8灌胃1.03 g/kg山楂粉末混悬液8灌胃0.31 g/kg余甘子粉末混悬液8
采用腹腔注射左旋精氨法诱导大鼠胃动力障碍模型[19],阳性参照多潘立酮组和各实验组的灌胃剂量根据药典推荐范围选取,分别为成人每天多潘立酮30 mg,菊苣9 g,陈皮3 g,鸡内金3 g,山楂10 g[17],并根据人与大鼠的体表面积进行剂量转换后[13]即为表1中最终灌胃剂量[20]。
1.2.2 大鼠体重、摄食量记录
实验期间,每日记录饲料用量、大鼠体重和摄食量变化。
1.2.3 胃排空率测定
每组一半的大鼠用半固体营养米糊法[21]测定胃排空率。灌胃半固体营养米糊(羧甲基纤维素钠10 g、全脂奶粉16 g、淀粉8 g、炭粉2 g、蒸馏水200 g)3 mL/kg,30 min后处死动物,结扎贲门和幽门,取完整胃,称胃全重,将胃组织沿胃大弯剪开,冲洗净胃内容物后,称量胃净重。按公式(1)计算胃排空率:
胃排空率/%=[固体糊状物重-(胃全重-胃净重)/固体糊状物重]×100
(1)
1.2.4 胃液游离酸、总酸及蛋白酶测定
每组一半大鼠在处死前4 h用异氟烷麻醉,打开腹腔,结扎幽门部,再逐层缝合关闭腹腔,处死时结扎贲门后取完整胃,沿胃大弯处剪开,收集胃内容物,3 000 r/min离心10 min后得到澄清液,记录胃液量。
取0.5 mL胃液加入甲基橙和酚酞试剂,用20 mmol/L NaOH溶液滴定,红色消失、橙色开始出现时,消耗的NaOH溶液量为游离酸终点量,橙色消失、微红色出现时,消耗的NaOH的量为总酸终点量[22]。
取0.5 mL胃液加入具塞量筒中,加入7.5 mL 0.05 mol/L HCl溶液摇匀,放入2根自制的蛋白管,塞好瓶口于37 ℃恒温箱中孵育24 h后取出,游标卡尺测量蛋白管两端透明长度,胃蛋白酶活力/(U/mL)=长度平均值2×16[22]。
1.2.5 血清胃肠激素检测
各胃肠激素(GAS、MTL、ghrelin)的表达水平,均参照对应的ELISA试剂盒说明书进行测定。
1.2.6 胃窦组织c-kit和SCF mRNA表达的检测
取适量胃窦组织,加入Trizol裂解液,冰上匀浆,提取组织中总RNA;引物参考IWASAKI等[23]的实验,按逆转录试剂盒要求合成cDNA,混入荧光Mix后,进行荧光定量PCR分析(表2)。
表2 PCR引物
Table 2 PCR Primers
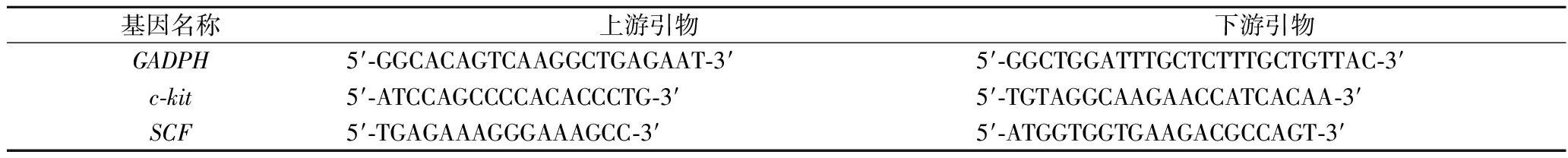
基因名称上游引物下游引物GADPH5′-GGCACAGTCAAGGCTGAGAAT-3′5′-GGCTGGATTTGCTCTTTGCTGTTAC-3′c-kit5′-ATCCAGCCCCACACCCTG-3′5′-TGTAGGCAAGAACCATCACAA-3′SCF5′-TGAGAAAGGGAAAGCC-3′5′-ATGGTGGTGAAGACGCCAGT-3′
1.2.7 胃窦组织HE染色观察
将胃窦组织在质量分数4%多聚甲醛固定液中固定48 h,然后脱水、石蜡包埋、切片,苏木精-伊红染色,数字切片扫描仪对切片进行扫描,使用CaseViewer 2.3软件对组织病理损伤进行观察。
1.2.8 数据统计与分析
所有数据均以平均值±标准差表示,使用Graphpad Prism 8.0进行可视化绘图,使用SPSS 22.0软件进行统计分析,单因素方差分析采用最小显著差别(least significant difference,LSD)事后分析。
2 实验结果
2.1 药食同源食物对大鼠每日摄食量、饮水量和体重变化的影响
如图1所示,由造模后大鼠每日摄食量、饮水量和体重变化可知,与正常组相比,模型组大鼠每日摄食量显著下降,饮水量无显著性差异,体重增长速度明显下降。与模型组相比较,菊苣组和余甘子组大鼠每日摄食量显著提高(P<0.05);各组每日饮水量无明显差异;多潘立酮使大鼠体重增加,菊苣和余甘子能使其体重下降,但都不显著。

a-每日摄食量;b-每日饮水量;c-体重
图1 造模后大鼠每日摄食量、饮水量和体重变化
Fig.1 Changes of body weight, food intake and water intake of rats
注:*表示和模型组比较,*表示P<0.05, **表示P<0.01,***表示P<0.001(下同)。
2.2 药食同源食物对大鼠胃排空率的影响
胃排空率是衡量胃动力大小的直接指标,如图2所示,与空白组比较,模型组胃排空速率显著降低(P<0.001),该造模方法可致使大鼠胃动力障碍。与模型组比较,多潘立酮组效果最好(P<0.001),几乎恢复到了和空白组相同的水平。在药食同源食物组当中,菊苣、山楂和余甘子(P<0.05)对胃排空均有显著的提升作用,陈皮和鸡内金也具有提升趋势,但无显著性差异。山楂具有促胃排空作用,这与陈青莲等[24]的实验结果一致,余甘子能够促进胃排空,这与LI等[18]的报道相似,而菊苣的促胃排空作用未见相关报道。

图2 大鼠胃排空率
Fig.2 Gastric emptying rate in rats
2.3 药食同源食物对大鼠胃液、胃酸和胃蛋白酶的影响
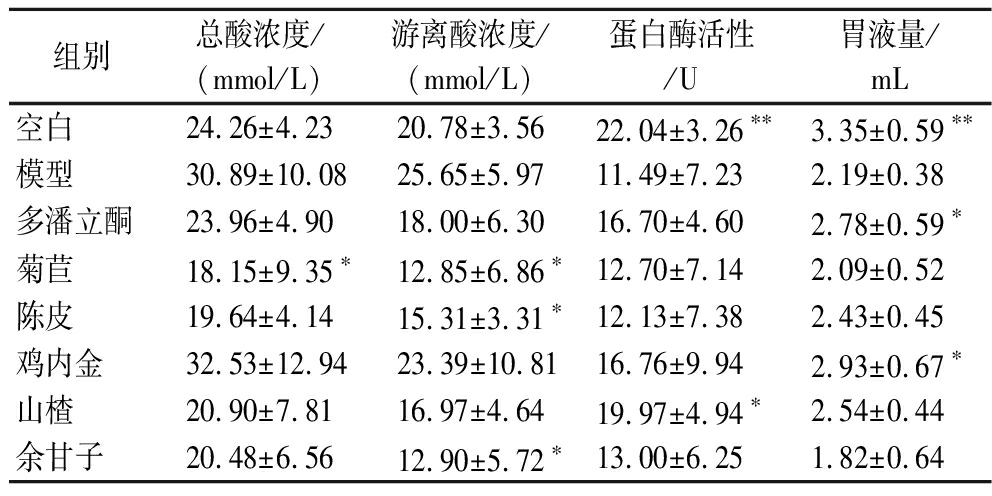
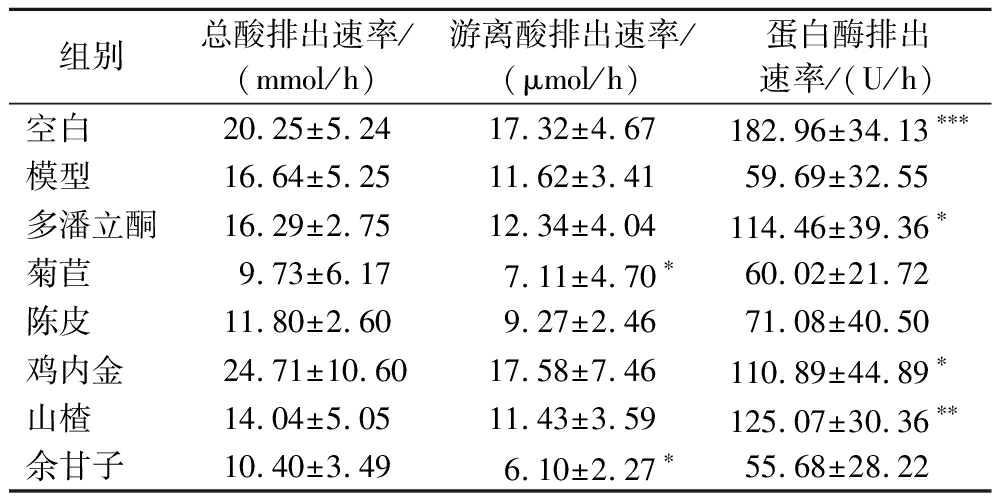
大鼠胃液量、胃酸浓度和排出速率、胃蛋白酶活性和排出速率如表3和表4所示。相较于空白组,模型组胃液量显著性下降(P<0.01),游离酸浓度和总酸浓度上升但没有显著性差异,蛋白酶活性显著性下降(P<0.01),游离酸排出速率显著下降(P<0.05),蛋白酶排出速率显著性下降(P<0.001),表明胃动力障碍大鼠总体的胃液、游离酸和胃蛋白酶排出量相较于正常鼠总体呈现下降趋势。与模型组相比,菊苣使总酸浓度呈显著降低(P<0.05);菊苣和余甘子使游离酸浓度显著降低(P<0.05);山楂使蛋白酶活性显著性提升(P<0.05);鸡内金组总酸排出速率和游离酸排出速率提高但无显著性,菊苣组、余甘子组游离酸排出速率显著下降(P<0.05);多潘立酮组、山楂组和鸡内金组蛋白酶排出速率显著提高(P<0.05)。
表3 总酸、游离酸、蛋白酶和胃液量测定
Table 3 Content of total acid, free acid, pepsin, and gastric fluid
组别总酸浓度/(mmol/L)游离酸浓度/(mmol/L)蛋白酶活性/U胃液量/mL空白24.26±4.2320.78±3.5622.04±3.26∗∗3.35±0.59∗∗模型30.89±10.0825.65±5.9711.49±7.23 2.19±0.38多潘立酮23.96±4.9018.00±6.3016.70±4.60 2.78±0.59∗菊苣18.15±9.35∗12.85±6.86∗12.70±7.142.09±0.52陈皮19.64±4.1415.31±3.31∗12.13±7.382.43±0.45鸡内金32.53±12.9423.39±10.8116.76±9.942.93±0.67∗山楂20.90±7.8116.97±4.6419.97±4.94∗2.54±0.44余甘子20.48±6.5612.90±5.72∗13.00±6.251.82±0.64
表4 总酸、游离酸和蛋白酶的排出速率测定
Table 4 Discharge rate of total acid, free acid, and protease
组别总酸排出速率/(mmol/h)游离酸排出速率/(μmol/h)蛋白酶排出速率/(U/h)空白20.25±5.2417.32±4.67182.96±34.13∗∗∗模型16.64±5.2511.62±3.4159.69±32.55多潘立酮16.29±2.7512.34±4.04114.46±39.36∗菊苣9.73±6.177.11±4.70∗60.02±21.72陈皮11.80±2.609.27±2.4671.08±40.50鸡内金24.71±10.6017.58±7.46110.89±44.89∗山楂14.04±5.0511.43±3.59125.07±30.36∗∗余甘子10.40±3.496.10±2.27∗55.68±28.22
胃液是消化道重要的消化液,高浓度氢离子和有机酸抑制胃排空[25]。胃蛋白酶输出和胃酸存在并行控制机制,目前的研究普遍认为胃运动和胃酸分泌存在联系,但机制尚不清楚。本研究中胃动力障碍大鼠胃黏膜细胞泌酸功能紊乱,胃液量和胃蛋白酶排放量下降,但胃酸浓度反而增加。菊苣、陈皮和余甘子菊苣降低胃游离酸浓度及其排出速率,山楂提高胃蛋白酶活性和排放速率,它们对胃酸和胃蛋白酶的影响趋势并不一致,其中的原因有待研究。
2.4 药食同源食物对大鼠血清胃肠激素的影响
大鼠血清胃肠激素含量如图3所示。相较于空白组,模型组血清GAS含量和ghrelin含量显著降低(P<0.05),血清MTL含量下降但无显著性差异,胃动力障碍大鼠兴奋型胃肠激素整体分泌不足。相较于模型组,多潘立酮组血清MTL含量显著上升,菊苣、陈皮、山楂组血清MTL含量上升但无显著性差异;余甘子组血清GAS含量显著上升(P<0.05);多潘立酮、菊苣和山楂组血清ghrelin含量显著上升(P<0.05),陈皮和鸡内金组也呈上升趋势但无显著性差异。
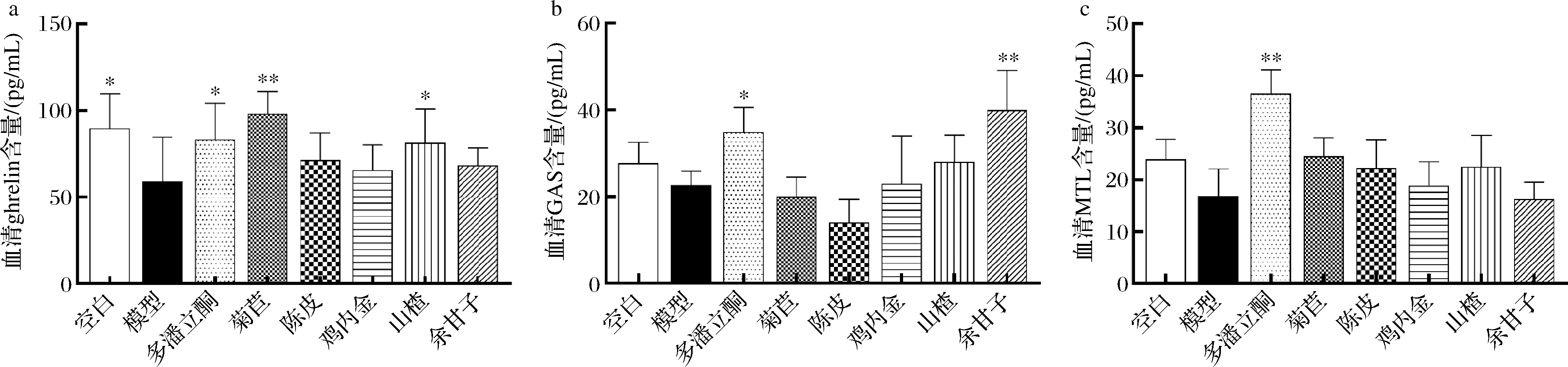
a-血清ghrelin含量;b-血清GAS含量;c-血清MTL含量
图3 大鼠血清胃肠激素含量
Fig.3 Content of serum gastrointestinal hormone in rats
MTL、GAS和ghrelin同属兴奋型胃肠激素,研究表明ghrelin可能是啮齿类动物的MTL替代物,具有促食欲、促胃排空的效果[26];GAS与胃酸分泌、黏膜生长和胃运动有关[27];十二指肠和近端空肠黏膜M细胞产生的MTL是最经典的促胃动力激素[28]。余甘子能够促进胃泌素分泌,并可能通过该途径促进胃动力,这与LI等[18]的研究结果一致;山楂能够促进ghrelin分泌,在WANG等[29]的研究中也有类似报道;而菊苣能促进ghrelin的分泌,则是本研究的新发现。
2.5 药食同源食物对大鼠胃窦组织c-kit和SCF mRNA表达的影响
ICC是胃肠道的起搏细胞,c-kit和SCF是ICC增殖分化的关键基因。研究表明胃动力障碍大鼠c-kit、SCF mRNA与蛋白水平表达降低,ICC的正常功能受损[30]。胃窦组织中c-kit和SCF的表达量由表5可知,相较于空白组,模型组大鼠c-kit mRNA(P<0.01)和SCF mRNA(P<0.001)表达量显著下降,表明胃动力障碍大鼠ICC数量可能下降,胃起搏能力下降。相较于模型组,多潘立酮组和菊苣组c-kit相对表达量显著提高(P<0.05),其他实验组没有明显变化;多潘立酮组SCF相对表达量显著提高,菊苣组、陈皮组和山楂组SCF相对表达量提高但无显著性。
表5 大鼠胃窦组织c-kit、SCF mRNA表达![]()
Table 5 Expression of c-kit and SCF mRNA in rat antrum

组别c-kit mRNASCF mRNA空白1.01±0.18∗∗1.04±0.29∗∗∗模型0.28±0.090.19±0.06多潘立酮0.53±0.10∗0.54±0.13∗菊苣0.58±0.11∗0.25±0.07陈皮0.25±0.080.26±0.12鸡内金0.23±0.030.13±0.04山楂0.24±0.060.27±0.08余甘子0.25±0.090.14±0.06
本研究结果显示,菊苣使c-kit基因表达量上升,其他食物均无该效果,提示菊苣可能通过c-kit/SCF信号通路促进了胃动力提升,尚未有相关报道菊苣对c-kit/SCF通路的影响。
2.6 大鼠胃窦组织HE染色结果
如空白组(图4-a)所示,正常大鼠胃底腺层约占黏膜厚度的1/2左右,模型组大鼠(图4-b)胃窦组织结构全面,未见明显损伤,但是其胃窦黏膜层腺体仅占全黏膜厚度1/4左右,表明胃动力障碍大鼠胃底腺层功能受到影响。相较于模型组胃底腺体数量,多潘立酮组(图4-c)和菊苣组(图4-d)的胃底腺厚度增加,其余组没有明显的差异。

a-空白组;b-模型组;c-多潘立酮组;d-菊苣组;e-陈皮组;f-鸡内金组;g-山楂组;h-余甘子组
图4 胃窦组织HE染色(100×)
Fig.4 Hematoxylin-eosin staining of gastric antrum (100×)
胃黏膜细胞受损不仅引起泌酸功能异常,也可能引起其他的激素水平下降,影响胃动力,切片观察发现胃底分泌腺层厚度减少可能是胃动力异常的原因,而菊苣和余甘子体现出了一定的修复胃黏膜层的作用,这也可能是菊苣促激素释放,进而促胃排空的机制之一。
3 结论
本文通过12 d大鼠动物实验,测定指标对5种药食同源食物的促胃动力作用进行评价和机制解析。研究发现,菊苣、山楂和余甘子组与模型组相比能显著提升胃排空速率(P<0.05),具有直接的促胃动力效果。陈皮和鸡内金虽具有促胃排空的趋势,无显著性差异,2种食物实验组的其他几个指标测定结果也类似。这两者的效果不佳可能是由于陈皮、鸡内金的起效物质多为醇溶性的黄酮类、挥发油或本身的酶,因此直接用常温水混悬粉末灌胃,其功效物质难以被吸收利用所致。对影响胃动力的指标研究发现,相较于模型组,菊苣组显著降低总酸浓度、游离酸浓度和游离酸排出速率(P<0.05),余甘子组显著降低游离酸浓度和排出速率(P<0.05),山楂组显著提高胃蛋白酶活性(P<0.05)和排出速率(P<0.01);菊苣组显著提高血清饥饿素水平(P<0.01),山楂组也显著提高血清ghrelin水平(P<0.05),余甘子组显著提高血清GAS水平;菊苣组具有修复胃底腺层的作用;菊苣能显著提高c-kit mRNA的相对表达量(P<0.05)。研究证明菊苣、山楂和余甘子具促胃动力作用,且其起效的机制和途径并不相同,可以制成单体或配方促胃动力产品,大力促进食疗领域新产品的开发。菊苣、余甘子的促胃动力量效关系及其促胃动力具体成分的解析,仍需进一步的研究。
[1] JEAN A H, ROBERT J W.Diagnosis and treatment of gastric motility disorders[J].Veterinary Clinics of North America:Small Animal Practice, 1999, 29(2):377-395.
[2] VAN DEN HOUTE K, CARBONE F, TACK J.Postprandial distress syndrome:Stratification and management[J].Expert Review of Gastroenterology &Hepatology, 2019, 13(1):37-46.
[3] FORD A C, MAHADEVA S, CARBONE M F, et al.Functional dyspepsia[J].The Lancet, 2020, 396(10263):1689-1702.
[4] TSENG P H, WU Y W, LEE Y C, et al.Normal values and symptom correlation of a simplified oatmeal-based gastric emptying study in the Chinese population[J].Journal of Gastroenterology and Hepatology, 2014, 29(11):1873-1882.
[5] ENCK P, AZPIROZ F, BOECKXSTAENS G, et al.Functional dyspepsia[J].Nature Reviews.Disease Primers, 2017, 3:17081.
[6] SAYUK G S, GYAWALI C P.Functional dyspepsia:Diagnostic and therapeutic approaches[J].Drugs, 2020, 80(13):1319-1336.
[7] TONINI M, CIPOLLINA L, POLUZZI E, et al.Review article:Clinical implications of enteric and central D2 receptor blockade by antidopaminergic gastrointestinal prokinetics[J].Alimentary Pharmacology &Therapeutics, 2004, 19(4):379-390.
[8] MOUNSEY A, BARZIN A, RIETZ A.Functional dyspepsia:Evaluation and management[J].American Family Physician, 2020, 101(2):84-88.
[9] LEVINE M E, KOCH S Y, KOCH K L.Lipase supplementation before a high-fat meal reduces perceptions of fullness in healthy subjects[J].Gut and Liver, 2015, 9(4):464-469.
[10] SUAREZ F L, LEVITT M D, ADSHEAD J.Pancreatic supplements reduce the symptomatic response of healthy subjects to a high fat meal[J].Gastroenterology, 1998, 114:A420.
[11] ALONSO-BERMEJO C, BARRIO J, FERN NDEZ B, et al.Functional gastrointestinal disorders frequency by Rome IV criteria[J].Anales De Pediatria, 2022, 96(5):441-447.
NDEZ B, et al.Functional gastrointestinal disorders frequency by Rome IV criteria[J].Anales De Pediatria, 2022, 96(5):441-447.
[12] EDWARDS J E, BROWN P N, TALENT N, et al.A review of the chemistry of the genus Crataegus[J].Phytochemistry, 2012, 79:5-26.
[13] WEI Z Q, AI L, CHEN X, et al.Comparative studies on the regulatory effects of raw and charred hawthorn on functional dyspepsia and intestinal flora[J].Tropical Journal of Pharmaceutical Research, 2019, 18(2):333.
[14] 何占坤, 张国梁, 唐方, 等.陈皮、藿香不同提取物对胃肠动力障碍大鼠胃肠平滑肌收缩活动及胃肠激素的影响[J].天津医药, 2017, 45(11):1175-1179.
HE Z K, ZHANG G L, TANG F, et al.Effects of extracts of pericarpium citri reticulatae and Pogostemon cablin on the contraction of gastrointestinal smooth muscle and gastrointestinal hormones in rats with gastrointestinal motility disorder[J].Tianjin Medical Journal, 2017, 45(11):1175-1179.
[15] 傅曼琴, 肖更生, 吴继军, 等.广陈皮促消化功能物质基础的研究[J].中国食品学报, 2018, 18(1):56-64.
FU M Q, XIAO G S, WU J J, et al.Studies on chemical basis of digestion promoting function of pericarpium citri reticulatae(Citrus reticulate ‘Chachi’)[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(1):56-64.
[16] 王楠, 顾笑妍, 吴怡, 等.鸡内金的临床应用及药理作用研究概况[J].江苏中医药, 2021, 53(1):77-81.
WANG N, GU X Y, WU Y, et al.Clinical application and pharmacological action of Endothelium Corneum Gigeriae Galli[J].Jiangsu Journal of Traditional Chinese Medicine, 2021, 53(1):77-81.
[17] 国家药典委员会. 中华人民共和国药典-一部:2015年版[M].北京:中国医药科技出版社, 2015.
China Pharmacopoeia Committee. The Pharmacopoeia of the People’s Republic of China[M]. Beijing: China Medical Science Press, 2015.
[18] LI X Q, LIN Y L, JIANG Y Q, et al.Aqueous extract of Phyllanthus emblica L.alleviates functional dyspepsia through regulating gastrointestinal hormones and gut microbiome in vivo[J].Foods, 2022, 11(10):1491.
[19] WANG X A, ZHANG C, ZHENG M Y, et al.Metabolomics analysis of L-arginine induced gastrointestinal motility disorder in rats using UPLC-MS after magnolol treatment[J].Frontiers in Pharmacology, 2019, 10:183.
[20] NAIR A, MORSY M A, JACOB S.Dose translation between laboratory animals and human in preclinical and clinical phases of drug development[J].Drug Development Research, 2018, 79(8):373-382.
[21] 黄爱华, 迟玉广, 曾元儿, 等.枳实黄酮对功能性消化不良大鼠胃肠动力的影响[J].中药新药与临床药理, 2012, 23(6):612-615.
HUANG A H, CHI Y G, ZENG Y E, et al.Influence of fructus aurantii immaturus flavonoids on gastrointestinal motility in rats with functional dyspepsia[J].Traditional Chinese Drug Research and Clinical Pharmacology, 2012, 23(6):612-615.
[22] 林飞, 梁怿, 吕廉, 等.富硒大蒜对实验动物上消化道的刺激作用及对胃液成分的影响[J].癌变·畸变·突变, 2008, 20(4):275-278.
LIN F, LIANG Y, LYU L, et al.Selenium-enriched garlic on the gastric juice components and upper gastrointestinal tract stimulation in experimental animal[J].Carcinogenesis, Teratogenesis &Mutagenesis, 2008, 20(4):275-278.
[23] IWASAKI E, SUZUKI H, MASAOKA T, et al.Enhanced gastric ghrelin production and secretion in rats with gastric outlet obstruction[J].Digestive Diseases and Sciences, 2012, 57(4):858-864.
[24] 陈青莲, 江雪平.山楂不同炮制品对小鼠胃排空作用的影响[J].中药材, 2001, 24(12):887-888.
CHEN Q L, JIANG X P.Effects of different processed hawthorn products on gastric emptying in mice[J].Journal of Chinese Medicinal Materials, 2001, 24(12):887-888.
[25] BLUM A L, HEGGLIN J, KREJS G J, et al.Gastric emptying of organic acids in the dog[J].The Journal of Physiology, 1976, 261(2):285-299.
[26] DORNONVILLE DE LA COUR C, LINDSTRÖM E, NORLÉN P, et al.Ghrelin stimulates gastric emptying but is without effect on acid secretion and gastric endocrine cells[J].Regulatory Peptides, 2004, 120(1-3):23-32.
[27] O’CONNOR A, O’MOR IN C.Digestive function of the stomach[J].Digestive Diseases, 2014, 32(3):186-191.
IN C.Digestive function of the stomach[J].Digestive Diseases, 2014, 32(3):186-191.
[28] DELOOSE E, VERBEURE W, DEPOORTERE I, et al.Motilin:From gastric motility stimulation to hunger signalling[J].Nature Reviews Endocrinology, 2019, 15(4):238-250.
[29] WANG Y, LYU M, WANG T, et al.Research on mechanism of charred hawthorn on digestive through modulating “brain-gut” axis and gut flora[J].Journal of Ethnopharmacology, 2019, 245:112166.
[30] ZHANG L M, ZENG L J, DENG J, et al.Investigation of autophagy and differentiation of myenteric interstitial cells of Cajal in the pathogenesis of gastric motility disorders in rats with functional dyspepsia[J].Biotechnology and Applied Biochemistry, 2018, 65(4):533-539.