溃疡性结肠炎(ulcerative colitis, UC)是一种主要发生在结肠的慢性非特异性炎症性肠病,其发病率在全球范围内逐年上升[1]。UC患者的临床症状主要表现为体重下降、腹痛及血性腹泻,其发病与地理、年龄、性别、遗传和环境因素有关[2],但确切的发病机制尚未完全确定。近年研究发现肠黏膜机械屏障在UC的发病机制中起重要作用,例如抗氧化能力及免疫炎症因子失衡造成结肠黏膜屏障不同程度受损,肠上皮细胞大面积凋亡,导致局部肠道环境发生病变,加快UC进程[3]。基于UC的无法治愈性,UC患者通常需终身服用美沙拉嗪等药物,但其仍具有一定的毒副作用,因此,探索可预防UC健康无副作用的益生菌制剂成为新的研究热点[4]。
凝结芽孢杆菌(Bacillus coagulans)是益生菌中一类兼具乳酸菌和芽孢杆菌特征、革兰氏阳性的杆状细菌,已先后在多种动物肠道及粪便[5]中分离获得。当凝结芽孢杆菌的生长条件恶化时,会从营养细胞转化为具有良好抗逆性的芽孢,其芽孢耐酸、耐胆盐,可在胃肠道中存活及定植[6],从而降低肠道pH,抑制有害菌滋生,起到调节人体肠道健康、提高消化能力及免疫力等益生作用[7]。此前,已有多项研究证实凝结芽孢杆菌对结肠炎有缓解效果,FITZPATRICK等[8]发现凝结芽孢杆菌BC30改善了艰难梭菌诱导的小鼠结肠炎,减轻了小鼠腹泻症状;SASAKI等[9]采用模型培养系统构建体外人结肠微生物群,发现凝结芽孢杆菌SANK 70258增加了毛螺菌科相关细菌,使受试者的微生物群模型中产生了更多具有健康益处的丁酸盐;SHINDE等[10]利用绿色香蕉抗性淀粉与凝结芽孢杆菌MTCC 5856作为合生元,发现其对葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的小鼠结肠炎有明显缓解作用。据研究[11],包括凝结芽孢杆菌在内的乳酸菌可能通过消除肠道自由基、产生多种有机酸修复肠道损伤。但目前对于凝结芽孢杆菌干预UC患者肠道氧化应激反应及肠道机械屏障的系统性研究甚少。
前期研究发现,凝结芽孢杆菌CGMCC 9951具有良好的益生性能[5]。因此,本研究以DSS诱导的小鼠结肠炎为模型,系统性探讨凝结芽孢杆菌CGMCC 9951对结肠炎小鼠肠道氧化应激、免疫炎症及肠道机械屏障等保护效果,为凝结芽孢杆菌CGMCC 9951干预结肠炎提供科学依据,从而促进凝结芽孢杆菌CGMCC 9951在食品、医药等不同领域的应用。
1 材料与方法
1.1 菌株
凝结芽孢杆菌CGMCC 9951,由河南科技大学食品与生物工程学院微生物育种与代谢调控研究室前期分离保藏。经活化后制备种子液,于5 L发酵罐中37 ℃发酵96 h,取发酵液混入质量分数5%的玉米淀粉,于160 ℃喷雾干燥制为菌粉。
1.2 试剂与仪器
DSS,上海翌圣生物科技股份有限公司;总超氧化物歧化酶(total superoxide dismutase, T-SOD)、谷胱甘肽(glutathione, GSH)、丙二醛(malondialdehyde, MDA)、乳酸、总蛋白检测试剂盒,南京建成生物工程研究所;白细胞介素(interleukin, IL)-1β、IL-10测试盒、肿瘤坏死因子(tumor necrosis factor, TNF)-α、脂多糖(lipopolysaccharide, LPS)检测试剂盒,上海科艾博生物技术有限公司;二胺氧化酶(diamine oxidase, DAO)检测试剂盒,江苏连云港伊势久生物科技有限责任公司;多聚甲醛固定液,北京兰杰柯科技有限公司。
Multiskan FC酶标仪,美国Thermo Fisher(赛默飞世尔)公司;D3024R台式高速冷冻离心机,美国Scilogex(赛洛捷克)公司;L5S型紫外可见分光光度计,上海仪电分析仪器有限公司。
1.3 实验方法
1.3.1 菌悬液的制备
准确称取凝结芽孢杆菌CGMCC 9951菌粉1 g于10 mL 0.85%无菌生理盐水中,得到3×108 CFU/mL菌悬液,之后用无菌生理盐水逐级稀释得到3×107、3×106 CFU/mL菌悬液。配制完成后,4 ℃冷藏备用。
1.3.2 动物实验设计
健康昆明雄性小鼠30只(n=6只/组),鼠龄12周,体质量(30±2) g,饲养于12 h光照12 h黑夜交替循环,温度(24±2) ℃,湿度(50±10)%的环境中。
实验小鼠自由饮食适应性喂养7 d后,随机分为对照组、模型组、CGMCC 9951低、中、高剂量组。随后,对各组小鼠进行实验:对照组与模型组每日灌胃0.85%无菌生理盐水0.3 mL,低、中、高剂量组每日分别灌胃3×106、3×107、3×108 CFU/mL CGMCC 9951菌悬液0.3 mL,灌胃2周。在第3周,除对照组外,其他各组小鼠均自由饮用5%DSS水溶液诱发急性结肠炎。实验结束后,小鼠禁食12 h后处死小鼠,采集血清、结肠组织等样品,用于后续相关指标的测定与分析。动物实验设计方案如表1所示。该研究内容和过程遵循国际及国家颁布的有关生物医学研究所制订的伦理学标准[SYXK-(豫)2018—0010]。
表1 动物实验设计方案
Table 1 Animal experiment design
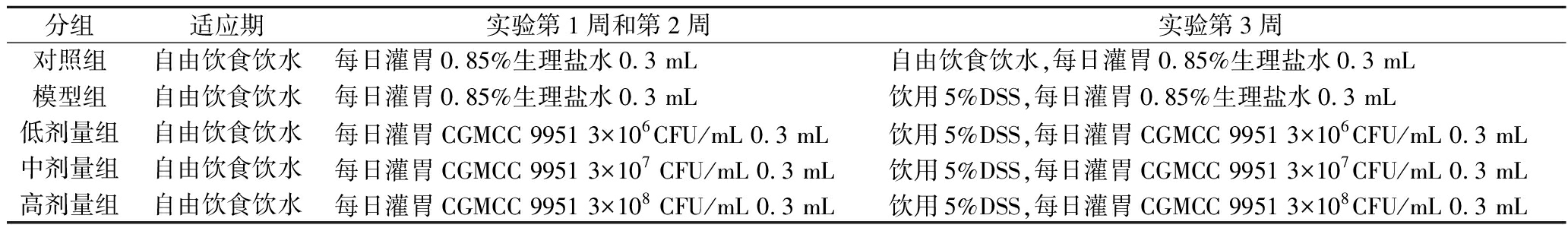
分组适应期实验第1周和第2周实验第3周对照组自由饮食饮水每日灌胃0.85%生理盐水0.3 mL自由饮食饮水,每日灌胃0.85%生理盐水0.3 mL模型组自由饮食饮水每日灌胃0.85%生理盐水0.3 mL饮用5%DSS,每日灌胃0.85%生理盐水0.3 mL低剂量组自由饮食饮水每日灌胃CGMCC 9951 3×106CFU/mL 0.3 mL饮用5%DSS,每日灌胃CGMCC 9951 3×106CFU/mL 0.3 mL中剂量组自由饮食饮水每日灌胃CGMCC 9951 3×107 CFU/mL 0.3 mL饮用5%DSS,每日灌胃CGMCC 9951 3×107CFU/mL 0.3 mL高剂量组自由饮食饮水每日灌胃CGMCC 9951 3×108 CFU/mL 0.3 mL饮用5%DSS,每日灌胃CGMCC 9951 3×108CFU/mL 0.3 mL
1.3.3 疾病活动指数(disease activity index, DAI)的测定
实验期间,每日观察小鼠精神及活动状况,并于固定时间点称量小鼠体重及饲料,计算小鼠体重下降比与日均摄食量。另外,从实验第3周开始每日注意观察小鼠的粪便性状,根据SHICHIJO等[12]的评分方法,计算得出小鼠DAI评分,具体评分项目如表2所示。
表2 疾病活动指数评分
Table 2 Disease activity index score

评分体重下降比/%粪便稠度粪便隐血0011~5正常正常轻度26~10311~15稀便中度严重416~20腹泻直肠出血
1.3.4 结肠长度的测定
处死小鼠后,从小鼠回盲瓣至肛门取得整段结直肠组织,测量其长度,做好记录。
1.3.5 病理组织H&E染色
剪取小鼠结肠0.5 cm放入4%多聚甲醛中固定,采用95%乙醇脱水,之后使用二甲苯洗脱结肠组织中的乙醇,将组织包埋于石蜡中,冷却后切片,采用H&E染色法染色,于光学显微镜下观察结肠组织上皮细胞病变、隐窝损伤、炎症浸润等病理情况,并参照WALLACE等[13]的方法进行组织学评分,评分标准见表3。
表3 小鼠结肠病理组织学评分
Table 3 Mouse colon histopathological scoring
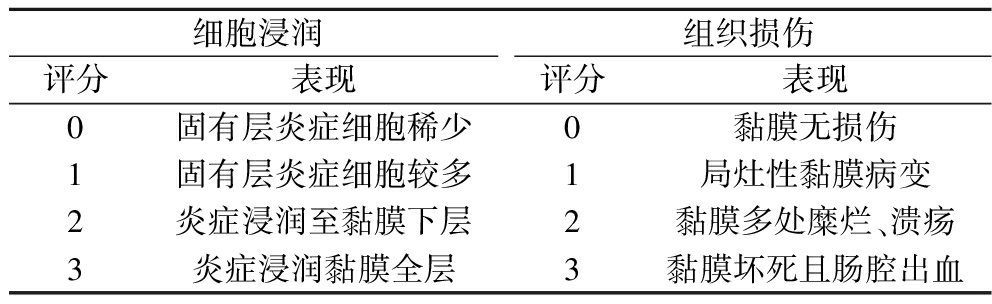
细胞浸润组织损伤评分表现评分表现0固有层炎症细胞稀少0黏膜无损伤1固有层炎症细胞较多1局灶性黏膜病变2炎症浸润至黏膜下层2黏膜多处糜烂、溃疡3炎症浸润黏膜全层3黏膜坏死且肠腔出血
1.3.6 结肠组织氧化应激程度的测定
准确称取结肠组织样本0.1 g于0.9 mL生理盐水中,冰水浴条件下机械匀浆充分后,在4 ℃、3 000 r/min离心10 min,取上清至1.5 mL离心管中,获得结肠组织匀浆,放于-80 ℃保存。随后根据试剂盒说明书对组织匀浆样本中的T-SOD、GSH及MDA的含量进行测定。
1.3.7 血清炎症反应的测定
将血液样本在4 ℃、4 000 r/min离心15 min,获得血清,放于-80 ℃保存。严格按照酶联免疫吸附试剂盒说明分析血清中IL-10、TNF-α、IL-1β含量。
1.3.8 结肠肠道通透性的测定
小鼠血清中LPS含量及结肠组织匀浆中DAO含量可作为评判结肠肠道通透性的指标。依照相关试剂盒操作指示取血清测定LPS含量;根据DAO试剂盒说明书制备结肠组织粗酶液,测定DAO含量。
1.4 数据统计及分析
使用Origin 2021软件绘图;实验数据以平均值±标准误表示,采用SPSS 17.0软件进行单因素方差分析或克鲁斯卡尔-沃利斯统计分析,其中P<0.05认为具有统计学差异,P<0.01认为差异具有显著性,P<0.001认为差异具有极显著性。
2 结果与分析
2.1 CGMCC 9951对结肠炎小鼠症状的影响
以DSS诱导的UC小鼠模型在建模后表现为精神萎靡、毛发暗淡、摄食减少、血性腹泻以及结肠损伤,进而影响小鼠体重、摄食、结肠长度和DAI评分的变化。由图1所示,在本实验第1、2周内,CGMCC 9951的低、中、高干预组、模型组与对照组小鼠的日均摄食量和体重减轻比不存在显著差异;在第3周,除对照组外,各组经5%DSS处理后,小鼠日均摄食量及体重呈不同程度下降,其中模型组体重下降最为显著。实验结束时,相比对照组,模型组小鼠体重显著下降(P<0.05),达24.25%。而与模型组相比,中剂量组和高剂量组缓解了结肠炎小鼠的体重下降(P<0.05),使小鼠体重增加了9.15%及8.59%。
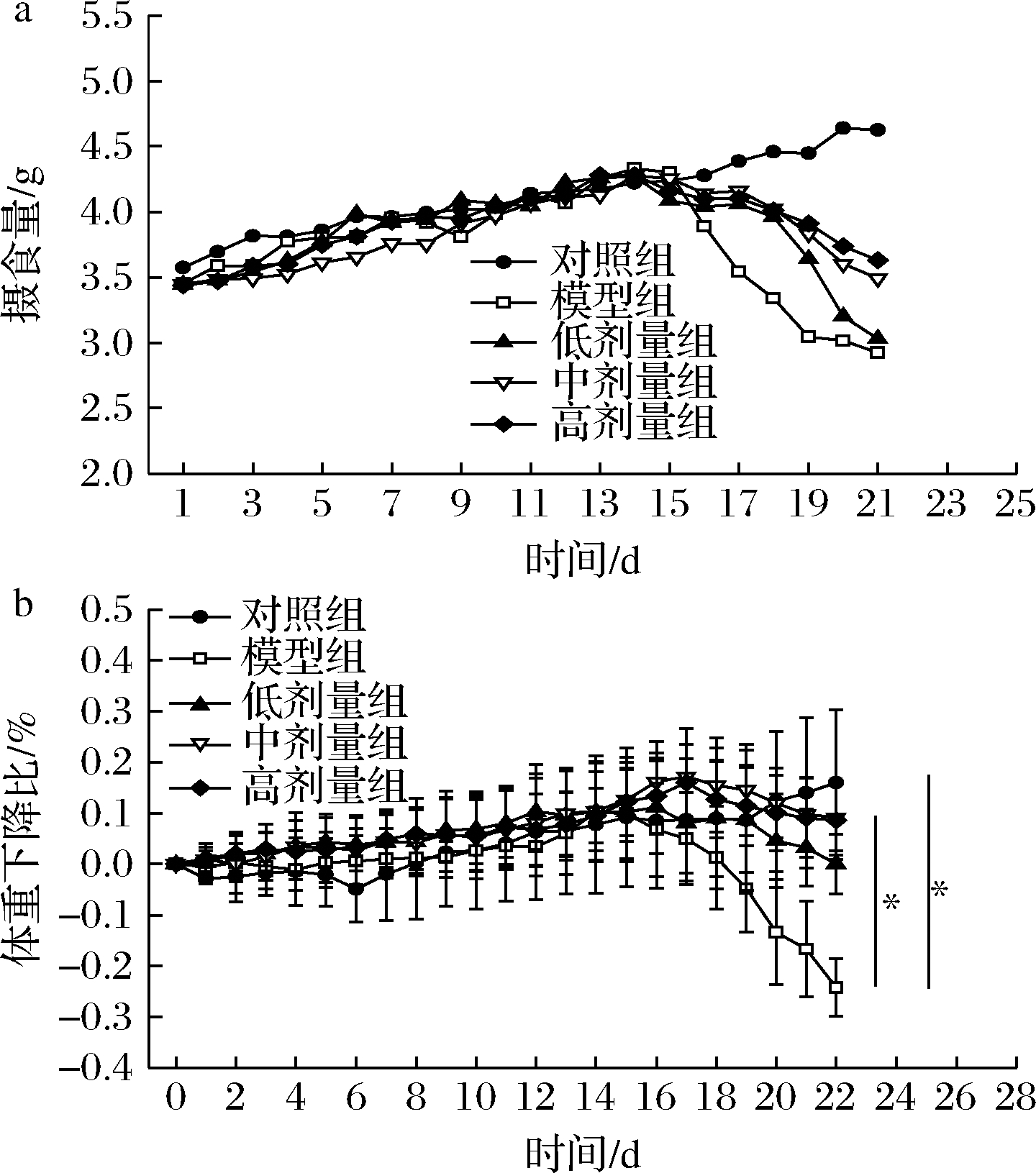
a-摄食量;b-体重下降比
图1 各处理组小鼠摄食量及体重的变化
Fig.1 Changes of food intake and body weight of mice in each treatment group
注:*表示P<0.05,**表示P<0.01,***表示P<0.001(下同)。
由图2可知,与对照组相比,模型组小鼠DAI评分在造模期内极显著升高(P<0.001),表明结肠炎模型建立成功;与模型组相比,高剂量组DAI评分降低53.33%(P<0.05),说明高剂量CGMCC 9951能明显减轻由DSS引起的便血、粪便松散等症状。
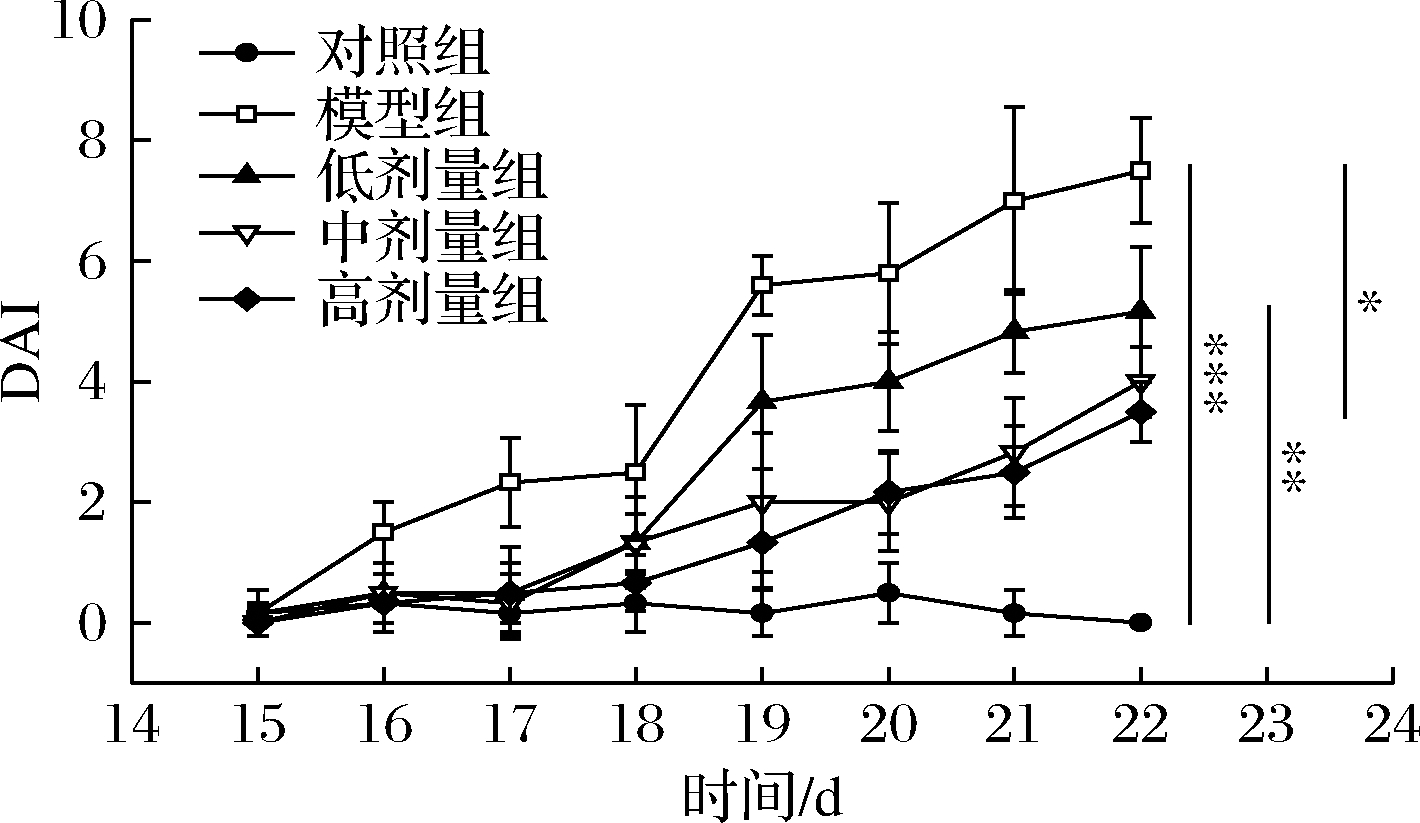
图2 各处理组小鼠DAI评分
Fig.2 DAI score of mice in each treatment group
如图3-a所示,与对照组相比,模型组结肠长度呈显著下降趋势(P<0.001),表明小鼠结肠受到损伤而缩短;而与模型组相比,中剂量、高剂量组结肠长度分别增加了27.12%(P<0.05)和38.55%(P<0.01)。表明中剂量及高剂量的CGMCC 9951干预可改善UC造成的结肠缩短症状,从而减缓UC进程。脾脏作为机体最大的淋巴器官,不断参与到免疫应答反应中。当机体发生炎症反应时,脾脏由于更多免疫调节的发生而肿胀,造成其质量的增加。由图3-b可知,模型组与对照组相比脾脏指数显著增加(P<0.05),而经CGMCC 9951保护的中剂量、高剂量组小鼠脾脏指数相比模型组显著降低(P<0.01)。以上实验结果表明中剂量及高剂量CGMCC 9951可显著改善UC症状。

a-结肠长度;b-脾脏指数
图3 各处理组小鼠结肠长度及脾脏指数
Fig.3 Colon length and spleen index of mice in each treatment group
2.2 CGMCC 9951对结肠炎小鼠病理组织的影响
通过对小鼠结肠组织进行H&E染色和组织学损伤评分,以评估CGMCC 9951对DSS诱导的UC小鼠结肠结构和形态的影响。如图4-a和4-b所示,对照组小鼠的结肠完整,上皮细胞正常,隐窝结构清晰,杯状细胞明显;而经DSS诱导后,模型组小鼠的结肠肠上皮细胞损伤明显,隐窝结构部分缺失,炎症浸润程度较高,病变范围高(P<0.001)。高剂量组小鼠结肠黏膜上皮结构十分完整,炎症细胞浸润程度低,病变深度主要在黏膜下层,隐窝病灶范围较小,与模型组组织学评分相比下降了46.43%(P<0.05)。结果表明高剂量CGMCC 9951显著减少了DSS诱导的小鼠结肠组织损伤,在一定程度上保护肠道上皮细胞,减轻小鼠UC炎症程度,维持肠黏膜完整性。

a-结肠病理组织切片;b-组织学评分
图4 CGMCC 9951对结肠炎小鼠病理组织的影响
Fig.4 Effects of CGMCC 9951 on the pathological tissue of colitis mice
2.3 CGMCC 9951对结肠炎小鼠结肠氧化应激程度的影响
DSS诱导的UC通常伴有结肠环境大量活性氧的产生,导致小鼠体内氧化还原系统失调,即引发了氧化应激反应,对结肠组织造成不同程度的炎症损伤[14-15]。GSH是机体重要的自由基清除剂,组织内GSH浓度较高,使细胞损伤减少,同时使机体各种免疫细胞得到充分的活化与分化,增强免疫力[16]。如图5-a所示,与对照组相比,模型组GSH含量极显著下降(P<0.001),证实DSS诱导会导致小鼠抗氧化防御系统功能异常。经低、中、高剂量CGMCC 9951干预后的小鼠GSH含量均极显著升高(P<0.001),其中高剂量组升高最显著,达181.89%,说明小鼠肠道氧化应激程度得到有效缓解。T-SOD是参与保护组织免受氧化损伤的重要抗氧化酶之一,可将活性氧分解为O2和H2O2,抑制结肠组织中的脂质过氧化反应[17]。如图5-b所示,其含量变化与GSH趋势一致,中、高剂量组相比模型组酶活性显著升高22.80%及48.73%(P<0.01)。MDA是脂质过氧化的产物,可反映机体内脂质过氧化的程度,通常与T-SOD的测定相配合,间接反映组织细胞受损伤程度。如图5-c所示,实验结果表明,与模型组相比中剂量组和高剂量组MDA含量差异性降低53.35%及55.41%(P<0.05)。该实验结果表明CGMCC 9951可减少小鼠结肠的氧化损伤程度。
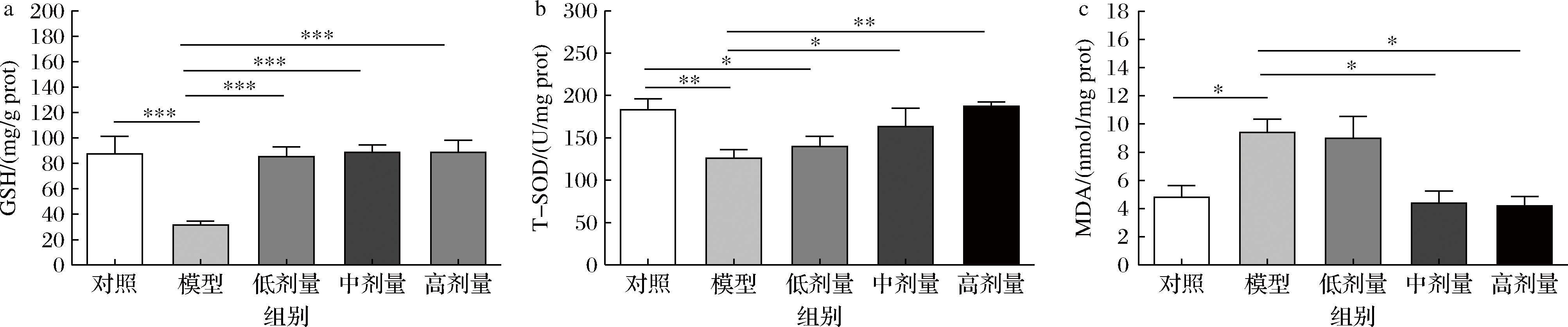
a-GSH含量;b-T-SOD含量;c-MDA含量
图5 CGMCC 9951对结肠炎小鼠结肠氧化应激程度的影响
Fig.5 Effects of CGMCC 9951 on colon tissue damage in colitis mice
2.4 CGMCC 9951对结肠炎小鼠炎症因子的影响
当发生UC时,机体会处于应激状态,诱发多种炎症因子参与到免疫反应中,从而促进炎症反应的进程。机体的免疫细胞通过TLR4/NF-κB等信号通路[18]的激活,释放促炎因子(TNF-α、IL-1β)[19-20],从而促进UC。如图6所示,模型组相比对照组TNF-α及IL-1β含量上升(P<0.05),表示DSS诱导后加剧了小鼠体内的炎症反应。而与模型组相比,中、高剂量组小鼠TNF-α下降20.91%(P<0.05)及24.87%(P<0.01),表明中、高剂量CGMCC 9951能够有效抑制小鼠体内促炎因子的升高。抗炎因子IL-10含量在实验中与促炎因子呈相反趋势,中、高剂量组IL-10浓度的显著上升36.46%及46.81%说明小鼠体内的炎症扩散得到有效控制(P<0.05)。该实验结果表明CGMCC 9951可通过调节免疫炎症因子控制炎症反应的加剧。
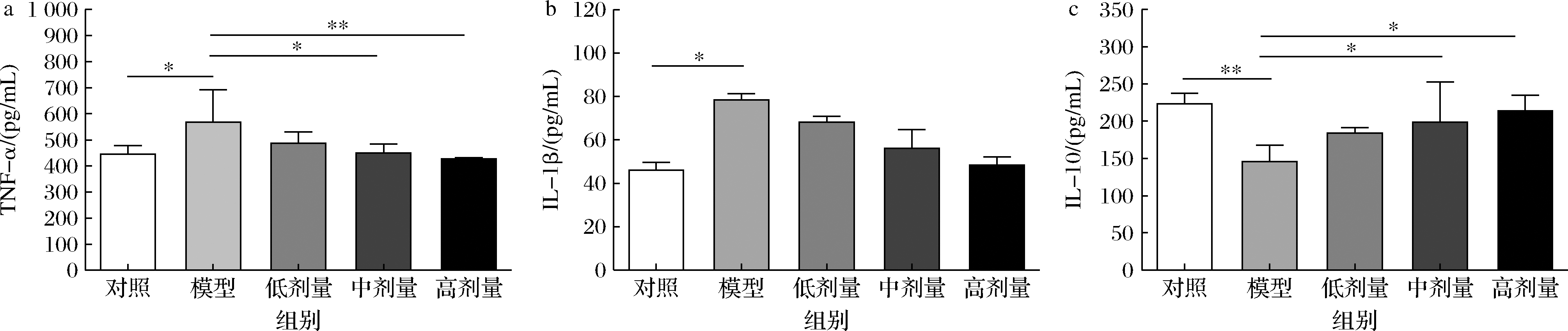
a-TNF-α含量;b-IL-1β含量;c-IL-10含量
图6 CGMCC 9951对结肠炎小鼠炎症因子的影响
Fig.6 Effects of CGMCC 9951 on inflammatory cytokines in mice with colitis
2.5 CGMCC 9951对结肠炎小鼠肠道通透性的影响
肠道通透性的增加是结肠炎发生的重要标志,表明肠道机械屏障的完整性遭到破坏。研究表明,肠黏膜通透性会随着肠道炎症的增加而显著增加[21]。当肠黏膜受到损伤,导致肠道内外多种炎症性疾病的发生及肠道通透性增加,进而影响肠道机械屏障。因此,改善肠道通透性是缓解UC的有效途径之一。本实验中,利用LPS浓度和DAO活力来评估小鼠结肠机械屏障的完整性。肠黏膜受损导致肠道通透性增加,致使肠道内革兰氏阴性菌产生的LPS通过肠上皮进入血液,进而引发全身炎症。如图7-a所示,模型组相较对照组血清LPS升高(P<0.05),说明DSS诱导的结肠炎小鼠肠道通透性增加,肠道机械屏障遭到破坏。模型组相比,高剂量组LPS含量下降16.57%(P<0.05),证明经高剂量CGMCC 9951干预保护的小鼠肠黏膜损伤减轻,肠道通透性未受明显影响。DAO可催化多胺氧化为醛,与核酸和蛋白质的合成密切相关,常被临床上用来反映肠道机械屏障的受损程度。如图7-b所示,模型组DAO活力较对照组显著下降(P<0.05),而高剂量组DAO活力较模型组显著上升74.49%(P<0.05),表明高剂量组小鼠肠道机械屏障受到CGMCC 9951保护,较为完整。该实验结果证实CGMCC 9951通过维持小鼠肠道机械屏障的完整性预防结肠炎。
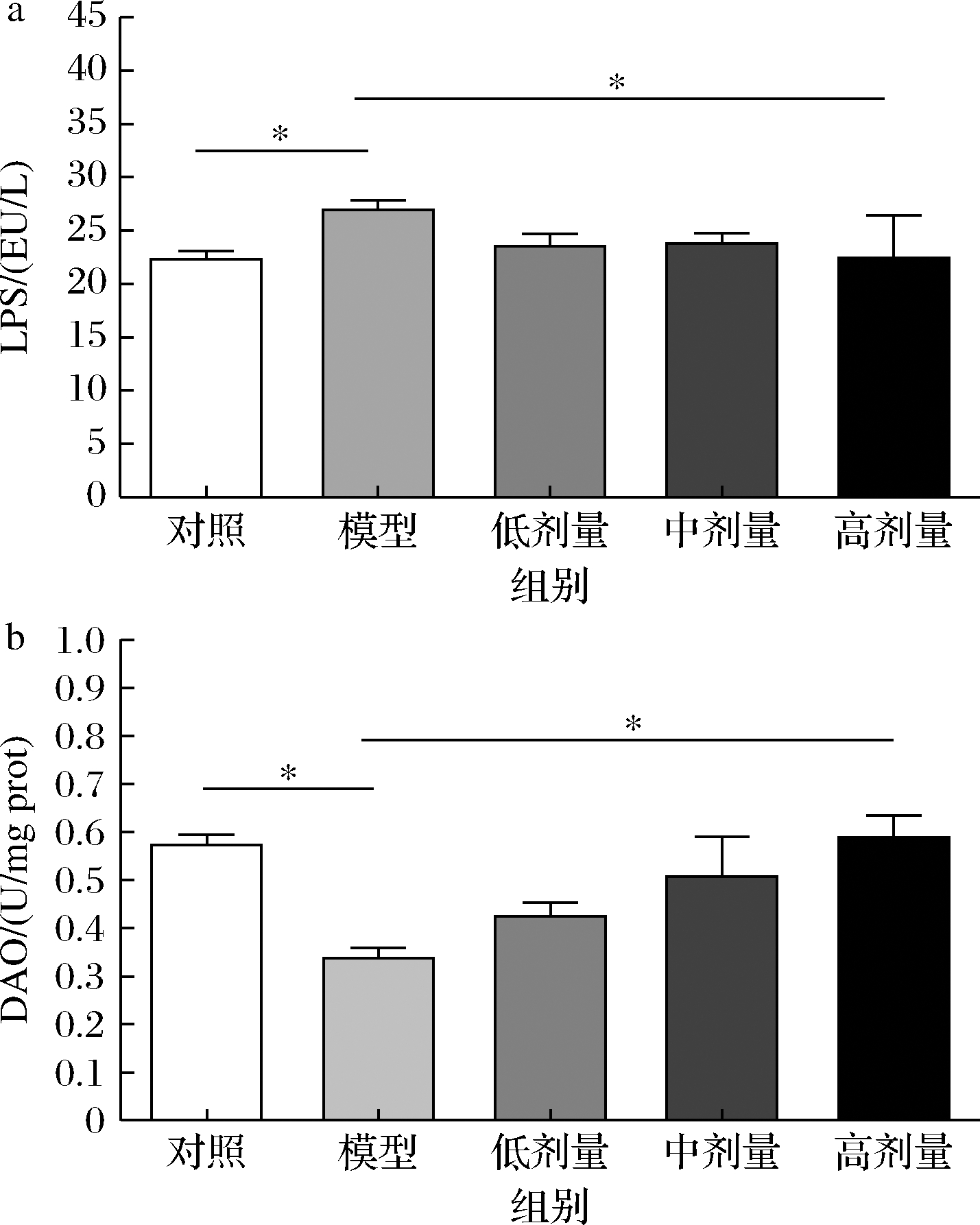
a-LPS浓度;b-DAO活力
图7 CGMCC 9951对结肠炎小鼠结肠肠道通透性的影响
Fig.7 Effects of CGMCC 9951 on colonic intestinal permeability in colitis mice
3 结论与讨论
UC是一类慢性、易反复发作的炎症性肠病,可能与肠道通透性增加、肠道菌群失调、免疫功能下降及炎症因子失衡等因素有关。本研究以不同剂量的凝结芽孢杆菌CGMCC 9951对小鼠进行灌胃,之后采用5% DSS诱导结肠炎,探讨CGMCC 9951对结肠炎小鼠病症的干预作用,主要表现为:(1)CGMCC 9951能显著改善结肠炎小鼠的摄食量及体重下降、结肠长度缩短、DAI评分和结肠组织损伤等;(2)CGMCC 9951通过调节结肠炎小鼠体内氧化与抗氧化作用失衡、影响炎症因子水平,改善小鼠的炎症反应;(3)CGMCC 9951还可通过控制小鼠肠道通透性的增加,从而维护结肠炎小鼠肠道机械屏障的完整性。
UC患者通常存在肠道菌群失调,外源性益生菌通过调节内源性菌群和免疫系统来改善局部微生物环境,从而减轻相关疾病。MAYER等[22]指出,益生菌可通过产生抗菌物质以控制肠道中有害菌的数量;BERMUDEZ-BRITO等[23]发现益生菌常常通过抑制TLR4/NF-κB信号通路和PI3K/AKT/NF-κB信号通路,调节免疫细胞因子IL-1β、IL-4、IL-6、IL-8、IL-10、IL-12、TNF-α、IFN-γ等释放,以降低炎症程度,并指出益生菌可影响肠道上皮黏膜的紧密连接蛋白来调节肠道通透性,从而保护肠道屏障的完整性。JOYCE等[24]研究得出益生菌通过调节肠道菌群,降低致病微生物丰度,进而影响胆汁酸代谢,缓解UC。多项临床研究表明,凝结芽孢杆菌作为益生菌对UC具有良好的保护作用。李飞[25]研究发现,凝结芽孢杆菌TBC-169是凝结芽孢杆菌活菌片的有效成分,进入肠道后分泌大量乳酸、乙酸等有机酸的同时产生多种细菌素以修复肠道损伤;激活免疫细胞调节炎症因子的释放以改善免疫系统失衡,从而达到防治UC的作用。此前关于凝结芽孢杆菌干预UC的研究大多围绕炎症因子调节、肠道菌群变化等,对凝结芽孢杆菌干预机体氧化应激反应及维护肠道机械屏障研究较少。基于此,本研究重点探讨了凝结芽孢杆菌CGMCC 9951对UC小鼠炎症反应、结肠氧化应激反应及肠道机械屏障的干预效果,结果表明CGMCC 9951不但具有与凝结芽孢杆菌TBC-169调节机体炎症反应作用的相似功能,还表现出有效改善结肠氧化与抗氧化失调、维系肠道机械屏障完整的能力。
综上所述,凝结芽孢杆菌CGMCC 9951具有改善DSS诱导的功效,可缓和UC导致的体重降低、结肠长度缩短、DAI增加等表现,减轻UC相关症状与小鼠结肠组织的病理变化。此外,CGMCC 9951可减弱DSS诱导的结肠氧化应激损伤,调节UC小鼠血清炎症因子水平,且对肠道机械屏障损伤及结肠通透性降低具有缓解作用。因此,本研究为凝结芽孢杆菌CGMCC 9951作为高效干预UC的益生菌制剂相关营养食品开发和使用提供了基础支持。
[1] HE D, ZENG W, WANG Y, et al.Isolation and characterization of novel peptides from fermented products of Lactobacillus for ulcerative colitis prevention and treatment[J].Food Science and Human Wellness, 2022, 11(6):1464-1474.
[2] ROSSEN N G, MACDONALD J K, DE VRIES E M, et al.Fecal microbiota transplantation as novel therapy in gastroenterology:A systematic review[J].World Journal of Gastroenterology, 2015, 21(17):5359-5371.
[3] GANJI-ARJENAKI M, RAFIEIAN-KOPAEI M.Probiotics are a good choice in remission of inflammatory bowel diseases:A meta analysis and systematic review[J].Journal of Cellular Physiology, 2018, 233(3):2091-2103.
[4] OPHEIM R, HOIVIK M L, SOLBERG I C, et al.Complementary and alternative medicine in patients with inflammatory bowel disease:The results of a population-based inception cohort study (IBSEN)[J].Journal of Crohn’s and Colitis, 2012, 6(3):345-353.
[5] GU S B, ZHAO L N, WU Y, et al.Potential probiotic attributes of a new strain of Bacillus coagulans CGMCC 9951 isolated from healthy piglet feces[J].World Journal of Microbiology and Biotechnology, 2015, 31(6):851-863.
[6] LOPETUSO L R, SCALDAFERRI F, FRANCESCHI F, et al.Bacillus clausii and gut homeostasis:State of the art and future perspectives[J].Expert Review of Gastroenterology &Hepatology, 2016, 10(8):943-948.
[7] BOMKO T V, NOSALSKAYA T N, KABLUCHKO T V, et al.Immunotropic aspect of the Bacillus coagulans probiotic action[J].The Journal of Pharmacy and Pharmacology, 2017, 69(8):1033-1040.
[8] FITZPATRICK L R, SMALL J S, GREENE W H, et al.Bacillus coagulans GBI-30 (BC30) improves indices of Clostridium difficile-induced colitis in mice[J].Gut Pathogens, 2011, 3(1):16.
[9] SASAKI K, SASAKI D, INOUE J, et al.Bacillus coagulans SANK 70258 suppresses Enterobacteriaceae in the microbiota of ulcerative colitis in vitro and enhances butyrogenesis in healthy microbiota[J].Applied Microbiology and Biotechnology, 2020, 104(9):3859-3867.
[10] SHINDE T, PERERA A P, VEMURI R, et al.Synbiotic supplementation with prebiotic green banana resistant starch and probiotic Bacillus coagulans spores ameliorates gut inflammation in mouse model of inflammatory bowel diseases[J].European Journal of Nutrition, 2020, 59(8):3669-3689.
[11] STROBER W, FUSS I J, BLUMBERG R S.The immunology of mucosal models of inflammation[J].Annual Review of Immunology, 2002, 20:495-549.
[12] SHICHIJO K, MATUU M, IKEDA Y, et al.Clinicopathologic study of dextran sulfate sodium experimental acute colitis[J].Japanese Journal of Pharmacology, 1998, 76:297.
[13] WALLACE B D, WANG H W, LANE K T, et al.Alleviating cancer drug toxicity by inhibiting a bacterial enzyme[J].Science, 2010, 330(6005):831-835.
[14] 麦尔旦·吐尔逊麦麦提, 刘涛, 李晨阳, 等.睡莲花isostrictiniin对CCl4致小鼠急性肝损伤防护作用及其体外抗氧化活性研究[J].新疆医科大学学报, 2018, 41(3):321-325.
MAIERDAN T, LIU T, LI C Y, et al.Preventive effect of isostrictiniin from Nymphaea candida on acute liver injury induced by CCl4 in mice and its antioxidant activities in vitro[J].Journal of Xinjiang Medical University, 2018, 41(3):321-325.
[15] PAN Y N, WANG H, TAN F, et al.Lactobacillus plantarum KFY02 enhances the prevention of CCl4-induced liver injury by transforming geniposide into genipin to increase the antioxidant capacity of mice[J].Journal of Functional Foods, 2020, 73:104128.
[16] 吴娜, 万治平, 曾娟, 等.黄芩汤对溃疡性结肠炎小鼠氧化应激及铁死亡相关指标GSH-Px4, P53, SLC7A11的影响[J].中国实验方剂学杂志, 2021, 27(8):17-24.
WU N, WAN Z P, ZENG J, et al.Effect of Huangqintang on oxidative stress and ferroptosis-related indexes GSH-Px4, P53, SLC7A11 in ulcerative colitis mice[J].Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(8):17-24.
[17] KOC M, TAYSI S, BUYUKOKUROGLU M E, et al.Melatonin protects rat liver against irradiation-induced oxidative injury[J].Journal of Radiation Research, 2003, 44(3):211-215.
[18] GUI J S, JALIL J, JUBRI Z, et al.Parkia speciosa empty pod extract exerts anti-inflammatory properties by modulating NFκB and MAPK pathways in cardiomyocytes exposed to tumor necrosis factor-α[J].Cytotechnology, 2019, 71(1):79-89.
[19] SHEN Z H, ZHU C X, QUAN Y S, et al.Relationship between intestinal microbiota and ulcerative colitis:Mechanisms and clinical application of probiotics and fecal microbiota transplantation[J].World Journal of Gastroenterology, 2018, 24(1):5-14.
[20] 杨秀芳, 简伟华, 丁俊彩, 等.肠道微生态-LPS-TLR4通路与新生儿坏死性小肠结肠炎炎症损伤的研究[J].广州医药, 2022, 53(3):49-52.
YANG X F, JIAN W H, DING J C, et al.The study on intestinal flora-LPS-TLR4 pathway and inflammatory injury of neonatal necrotizing enterocolitis[J].Guangzhou Medical Journal, 2022, 53(3):49-52.
[21] WANG L, ZHANG R, CHEN J, et al.Baicalin protects against TNF-α-induced injury by down-regulating miR-191a that targets the tight junction protein ZO-1 in IEC-6 cells[J].Biological &Pharmaceutical Bulletin, 2017, 40(4):435-443.
[22] MAYER E A, SAVIDGE T, SHULMAN R J.Brain-gut microbiome interactions and functional bowel disorders[J].Gastroenterology, 2014, 146(6):1500-1512.
[23] BERMUDEZ-BRITO M, PLAZA-D AZ J, MU
AZ J, MU OZ-QUEZADA S, et al.Probiotic mechanisms of action[J].Annals of Nutrition &Metabolism, 2012, 61(2):160-174.
OZ-QUEZADA S, et al.Probiotic mechanisms of action[J].Annals of Nutrition &Metabolism, 2012, 61(2):160-174.
[24] JOYCE S A, MACSHARRY J, CASEY P G, et al.Regulation of host weight gain and lipid metabolism by bacterial bile acid modification in the gut[J].Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(20):7421-7426.
[25] 李飞. 凝结芽孢杆菌对噁唑酮诱导的大鼠溃疡性结肠炎的治疗作用研究[D].青岛:青岛科技大学, 2011.
LI F.The research of rapeutic effects of Bacillus coaguans on oxazolone-induced ulcerative colitis in rats[D].Qingdao:Qingdao University of Science &Technology, 2011.