二十二碳六烯酸(docosahexenoic acid,DHA)是人体中的一种功能性脂肪酸,能预防心血管疾病[1],影响婴幼儿及儿童时期神经系统和认知功能的发育,尤其对儿童脑细胞和视网膜细胞的发育及功能有重要作用[2]。目前用于食品营养补充剂的DHA主要来源于鱼油和藻油[3]。与鱼油相比,藻油属于植物性油脂,具有易获取、对环境污染小的特点,因此藻油常被作为DHA的主要来源和载体应用于食品[3]。然而,将DHA藻油直接添加到食品体系中,会不可避免地改变食品的风味和稳定性,且富含多不饱和脂肪酸的DHA藻油也极易被氧化,引起油脂某些品质指标的改变[4]。研究表明,乳液体系可以提高藻油的物理稳定性[5]。乳液是一种液体,以小液滴的形式均匀分散在另一种不相容液体中的体系[6],蛋白质-DHA藻油乳液可以增强DHA的稳定性和生物利用率[7]。CHANG等[8]比较了乳清浓缩蛋白、Tween80和Tween 80+Span80对DHA藻油乳液贮藏稳定性和氧化稳定性的影响,发现乳清浓缩蛋白稳定DHA藻油的能力弱于小分子表面活性剂。因此,需要对天然蛋白质进行适度处理以提高其乳化能力。
研究表明,动植物蛋白混合经物理和化学方法制备的共沉淀蛋白,具有比单一蛋白质无法比拟的加工性质[9-10]。与单一蛋白质相比,采用共沉淀法制备的大豆-乳清和棉籽-乳清共沉淀蛋白,具有强的亲水性和吸脂性,且其溶解度和乳化能力明显提高[9];KRISTENSEN等[10]研究发现,共沉淀法可以改善豌豆蛋白的功能特性。与单一大豆球蛋白相比,混合酪蛋白和大豆蛋白制备的乳液具有更强的热稳定性,且其稳定性随酪蛋白含量的增加而增强。此外,在乳清-豌豆共沉淀蛋白中,蛋白质-蛋白质相互作用主要是二硫键和静电相互作用[11],也包括变性亚基之间的非共价相互作用。与单一蛋白相比,大多数共沉淀可溶性聚集体显示出更高的分子质量和更小的直径,同时共沉淀蛋白的热稳定性[11]和凝胶性能[12]也会明显增强。实际上,共沉淀蛋白的溶解度、发泡能力和凝胶性能都明显优于单一蛋白,植物蛋白和动物蛋白共混体系具有比单一蛋白更独特的功能,同时也可以满足不同年龄段消费群体的营养需求[2]。
近年来,有关鱼蛋白潜在的抗氧化应用被广泛报道,可作为一种潜在的乳化剂[13]。鱼蛋白具有独特的氨基酸组成,能有效阻止蛋白结构被氧自由基攻击,缓解乳液中油脂的氧化[14]。罗非鱼是我国养殖的主要经济鱼类,2019年我国罗非鱼产量164万t,占全球罗非鱼总产量的26%,生产潜力和加工潜力巨大[15]。然而,鱼蛋白本身的溶解性和热稳定性较差,在加工贮藏过程中,鱼蛋白乳液易发生凝聚和沉淀的现象,限制了其在食品工业中的应用。大豆分离蛋白具有良好的加工特性,是当前应用最广泛的植物蛋白。因此,本研究以罗非鱼和豆粕为原料,按比例混合经碱溶酸沉法提取罗非鱼-大豆共沉淀蛋白(tilapia-soy protein co-precipitates,TSPC),高压均质制备DHA藻油乳液,研究TSPC稳定的DHA藻油乳液的物理稳定性和氧化稳定性,为共沉淀蛋白乳液的制备及其对DHA藻油的稳定化提供依据。
1 材料与方法
1.1 材料与试剂
罗非鱼,广东湛江当地水产加工市场,取背部白肉搅碎,保存于-20 ℃下备用;大豆豆粕,山东万德福生物技术有限公司,搅碎后过80目筛,室温贮藏备用;40% DHA藻油,陕西承乾生物科技有限公司;尼罗红,上海麦克林生化科技有限公司;尼罗蓝,SIGMA试剂公司;其余试剂均为国产分析纯,广州化学试剂厂。
1.2 仪器与设备
Avanti J-26 sxp落地高速冷冻离心机,美国Beckman公司;ALPHA1-2LD plus冷冻干燥机,德国Martin Christ Gefriertrocknungsanlagen公司;高压纳米均质机,加拿大ATS仪器公司;DF-101S恒温水浴锅,河南省予华仪器有限公司;Nano Brook Omni激光粒度及Zeta电位仪,美国布鲁克海文仪器公司;Cintra1010紫外分光光度计,澳大利亚GBC仪器公司;FV3000激光扫描共聚焦显微镜,奥林巴斯仪器公司。
1.3 实验方法
1.3.1 分离蛋白的制备
采用碱溶酸沉法[16]制备罗非鱼分离蛋白(tilapia protein isolate,TPI)、TSPC和大豆分离蛋白(soy protein isolate,SPI)。其中TPI制备过程中采用的溶解pH值为11.0,沉淀pH值为5.5;将罗非鱼肉和大豆按质量比2∶1、1∶1和1∶2混合制备TSPC2∶1、TSPC1∶1和TSPC1∶2,采用的溶解pH值为11.0,沉淀pH值为4.5;SPI制备过程中采用的溶解pH值为8.0和沉淀pH值为4.5。蛋白溶液经冷冻干燥后密封干燥,-20 ℃冰箱中保存备用。
1.3.2 蛋白乳液的制备
取上述TPI、TSPC2∶1、TSPC1∶1、TSPC1∶2和SPI 5种蛋白粉末分别分散于去离子水,冰浴条件下磁力搅拌2 h,制备蛋白质量浓度10 mg/mL的蛋白溶液,利用高压均质机在60 MPa条件下均质循环5次,得到预处理后的5种蛋白溶液。取上述预处理后的蛋白溶液,按照油水比为1∶9(g∶mL)的比例添加DHA藻油,经10 000 r/min匀浆2 min,并高压均质(60 MPa)循环5次,得到5种蛋白稳定的DHA藻油乳液。将新鲜制备的乳液分别分装,密封于容量为50 mL的玻璃瓶中,4 ℃贮藏28 d,用于物理稳定性和氧化稳定性的检测。
1.3.3 粒径和Zeta电位的测定
为避免多次散射的影响,利用去离子水将乳液稀释至0.5%(体积分数),在室温条件下测定乳液的平均粒径、多分散性指数(polydispersity,PDI)和Zeta电位。每个样品至少测定3次,并取平均值。
1.3.4 浊度的测定
参考孙亚欣等[17]的方法并略作改动。利用去离子水将新鲜制备的蛋白乳液稀释1 000倍,以去离子水作空白对照,在波长为600 nm处测定其吸光度,浊度T的计算如公式(1)所示:
(1)
式中:A,稀释乳液在600 nm处的吸光度;V,稀释倍数;I,光程差,取1 cm。
1.3.5 乳析指数的测定
参考ZHANG等[18]的方法测定乳液的乳析指数。4 ℃贮藏28 d期间,每天记录乳液的乳析情况并拍照,乳析指数(creaming index,CI)的计算如公式(2)所示:
(2)
式中:HC,乳液底部析出清液层的高度;HE,乳液的总高度。
1.3.6 氧化稳定性的测定
参考SHAO等[19]的方法并稍加修改,测定乳液的氢过氧化值。将异辛烷和异丙醇按照3∶1的体积混合,作为溶液A;将甲醇和正丁醇按照2∶1的体积比混合,作为溶液B;将0.132 mol/L的氯化钡和0.144 mol/L的硫酸亚铁等体积混合,在室温下5 000 r/min离心2 min,所得上清液为溶液C。取200 μL蛋白乳液与1.5 mL溶液A混合,涡旋10 s并静置10 s,重复3次后在室温下5 000 r/min离心3 min。吸取200 μL上层有机相与2.8 mL溶液B混合,依次加入0.3 g/mL硫氰酸铵和溶液C各15 μL,充分混合后孵育20 min,在波长510 nm处测量溶液的吸光度,同时采用过氧化氢标准曲线计算样品中的氢过氧化物值。
参考陈旭辉[20]的方法并作略微修改测定乳液的硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值。取0.5 mL乳液与1 mL的硫代巴比妥酸(thiobarbituric acid,TBA)试剂混合,90 ℃水浴加热15 min。冷却至室温后,用注射器小心吸取底部清液过0.45 μm滤膜,于波长532 nm处测定其吸光值。同时利用0.1 mmol/L的1,1,3,3-四乙氧基丙烷作标准标曲,以水作为对照组。其中TBA试剂的配制:称取三氯乙酸15 g和2-硫代巴比妥酸0.375 g,加入到100 mL的0.5 mol/L HCl溶液中,并超声至溶质完全溶解。
1.3.7 乳液的微观结构观察
乳液形貌学的观察参考陈艾霖等[21]的方法并稍加修改。将10 mg尼罗红分散于5 mL甲醇溶液中制备尼罗红溶液,将5 mg尼罗蓝分散于5 mL去离子水中制备尼罗蓝溶液。取新鲜制备的乳液,用去离子水稀释10倍,按照V(样品)∶V(尼罗红)∶V(尼罗蓝)=1∶1∶2混合,并将混合液滴在载玻片上,利用激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)放大60倍观察乳液的微观结构。
1.4 数据统计与分析
所有实验从乳液样品制备开始重复3次以上。图形绘制均采用Origin 9.0软件。数据分析采用SPSS 24.0软件,并利用Duncan多重检验分析显著性差异(P<0.05表示差异显著),且结果以![]() 的形式表示。
的形式表示。
2 结果与分析
2.1 乳液的平均粒径、Zeta电位和浊度分析
经高压均质预处理后的蛋白溶液,添加10%的DHA藻油,再经高压均质制备O/W蛋白乳液,检测其平均粒径、PDI、电位和浊度,结果如图1所示。TPI乳液的平均粒径和PDI值最大,随着原料中大豆比例的增加,TSPC乳液的平均粒径不断减小(P<0.05),电位绝对值增大(P<0.05),电负性增强。TSPC2∶1乳液的平均粒径和电位分别为603.10 nm和31.44 mV,而TSPC1∶2乳液的平均粒径减小到277.16 nm,电位绝对值增大到41.17 mV,乳液的PDI值更小。共沉淀蛋白表现出的物理稳定性与2种原料蛋白本身性质有关。与罗非鱼蛋白相比,大豆蛋白具有更好的分散性和界面活性,在均质处理过程中,表面暴露的带电基团增多,蛋白质分子间的排斥作用更大[22],罗非鱼-大豆复合共沉淀蛋白乳液的电负性增强(图1-b)。因此,与TPI稳定的DHA藻油乳液相比,大豆蛋白组分的存在明显降低了TSPC-DHA藻油乳液的平均粒径,增强了乳液的电负性,乳液的物理稳定性增强。
乳液的浊度能够反映乳液的平均粒径和稳定性[17]。随着原料中罗非鱼比例的减少,共沉淀蛋白乳液的浊度明显降低,TSPC2∶1乳液的浊度值为5 577.99 cm-1,TSPC1∶2乳液的浊度值减小为3 220.28 cm-1(图1-d),表明乳液中小粒径组分的比例增加。此外,在TPI和TSPC2∶1乳液的粒度分布图中,能明显观察到“双峰”,说明其粒度分布不均匀,发生了奥氏熟化现象[18]。而TSPC1∶1和TSPC1∶2乳液的粒度分布图呈现单峰分布(图1-c),且与SPI乳液的粒度分布图接近,平均粒径更小,进一步说明了大豆蛋白组分的存在能明显提高TSPC-DHA藻油乳液的物理稳定性。
2.2 乳液的乳析指数分析
乳液在4 ℃贮藏28 d,观察实物图并测定其乳析指数,结果如图2所示。由图2可知,TPI乳液贮藏第7天即开始出现了明显的分层,乳析指数高达28.57%;贮藏28 d后,TSPC2∶1乳液也出现了明显的分层,其乳析指数为8.00%,乳液的稳定性较差;而TSPC1∶1和TSPC1∶2乳液的外观与SPI乳液接近,4 ℃贮藏28 d没有明显的分层现象,乳析指数接近于零,乳液的宏观稳定性好,与乳液的平均粒径结果(图1-a)一致,也反映了乳液贮藏稳定性受粒径大小的影响。在重力的作用下,大颗粒的罗非鱼蛋白聚集体扩散速度慢、易沉降,在溶液中难以覆盖油水界面[23]。比较而言,大豆蛋白分子含有更多的亲水基团和表面电荷,更容易附着在油水的界面处[8]。当罗非鱼和大豆的混合比例为1∶1和1∶2时,TSPC中大豆蛋白组分的存在导致共沉淀蛋白的表面性质足够覆盖油水界面,减缓了油滴的絮凝,且乳液组分之间强烈的布朗运动和静电斥力抑制了离心聚集[23],进而增强TSPC1∶1和TSPC1∶2乳液的物理稳定性。
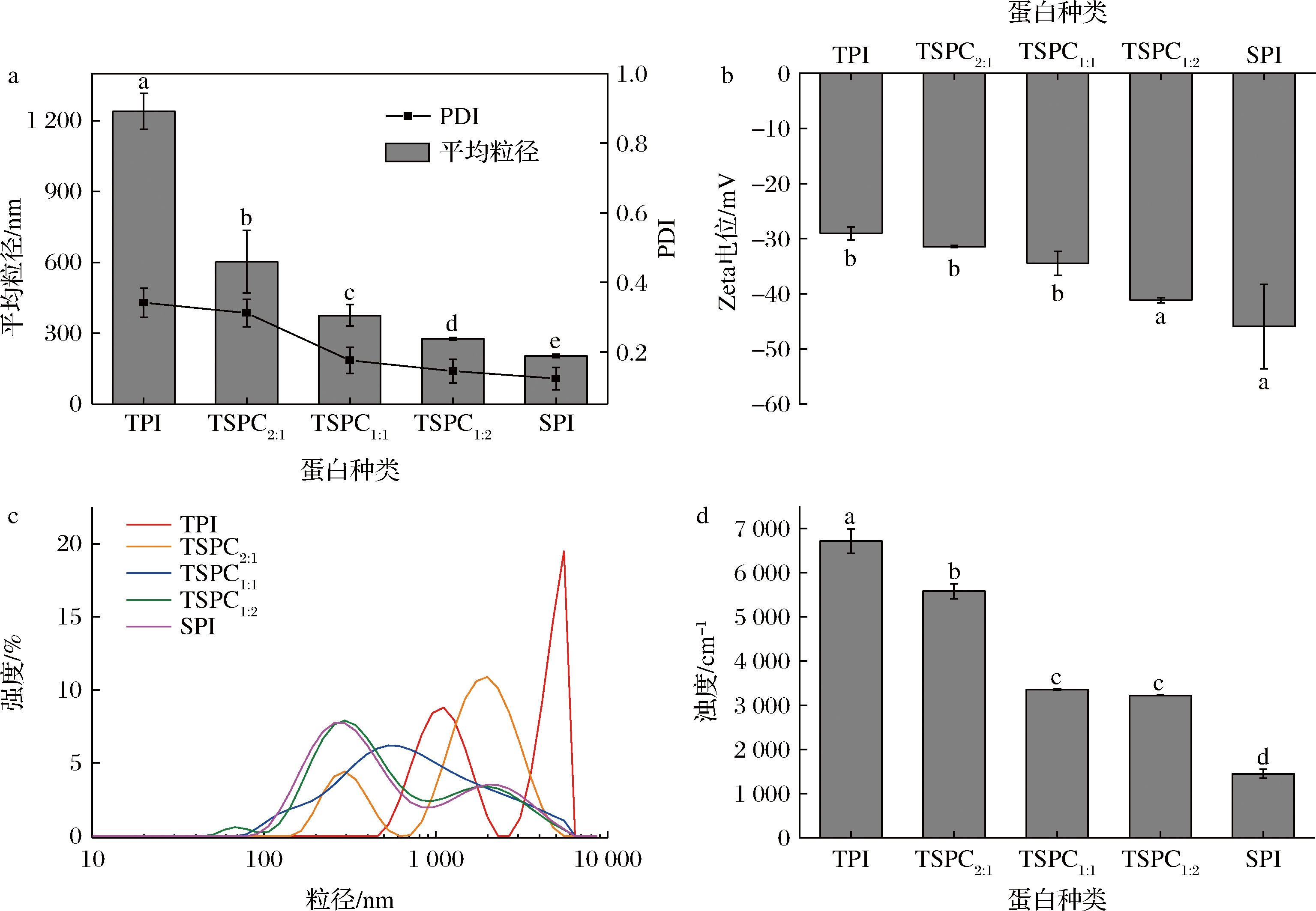
a-平均粒径与PDI;b-电位;c-粒度分布;d-浊度
图1 TSPC-DHA藻油乳液的分析
Fig.1 The analysis of TSPC-DHA algal oil emulsion 注:不同小写字母表示差异显著(P<0.05)

a-乳析指数;b-实物图
图2 TSPC-DHA藻油乳液贮藏过程中乳析指数和实物图的变化
Fig.2 Creaming index of TSPC-DHA algal oil emulsion and visual appearance during storage
2.3 乳液的氧化稳定性分析
DHA藻油富含多不饱和脂肪酸,极易被氧化,可能导致乳液风味的劣化和功能活性的丧失[4]。TPI、TSPC和SPI乳液在4 ℃贮藏28 d,产生的初级和次级氧化产物含量如图3所示。由图3可知,4 ℃贮藏过程中,TPI乳液和TSPC乳液的氧化产物含量较低,而SPI乳液的氧化产物含量随贮藏时间的延长明显增加,表明TPI和TSPC能减缓DHA藻油的氧化。4 ℃贮藏28 d后,TSPC2∶1、TSPC1∶1和TSPC1∶2乳液的过氧化值分别为9.65、13.95、15.91 mmol/L,与TPI乳液接近(12.89 mmol/L),并且产生的TBARS值在TPI乳液和SPI乳液之间。初步分析,一方面,鱼蛋白质自身含有与抗氧化活性有关疏水性组分,如自由巯基和色氨酸[13-14],在预防油脂氧化方面具有天然的缓解效果,乳液均质处理过程中,蛋白质内部的自由巯基和色氨酸暴露出来,并通过螯合金属离子的方式促使自由基失活,进而减缓油脂的氧化[14]。另一方面,TSPC中的鱼蛋白组分的存在可以在油水界面形成厚的粘弹性膜,作为物理屏障减少脂质和水相中氧化剂的相互作用[24]。因此,TSPC中鱼蛋白组分的存在有利于保护DHA藻油,提高其氧化稳定性。鱼类蛋白质含量高,氨基酸组成丰富,近年来,由各种鱼蛋白制备抗氧化活性成分及应用的研究被广泛报道[13]。
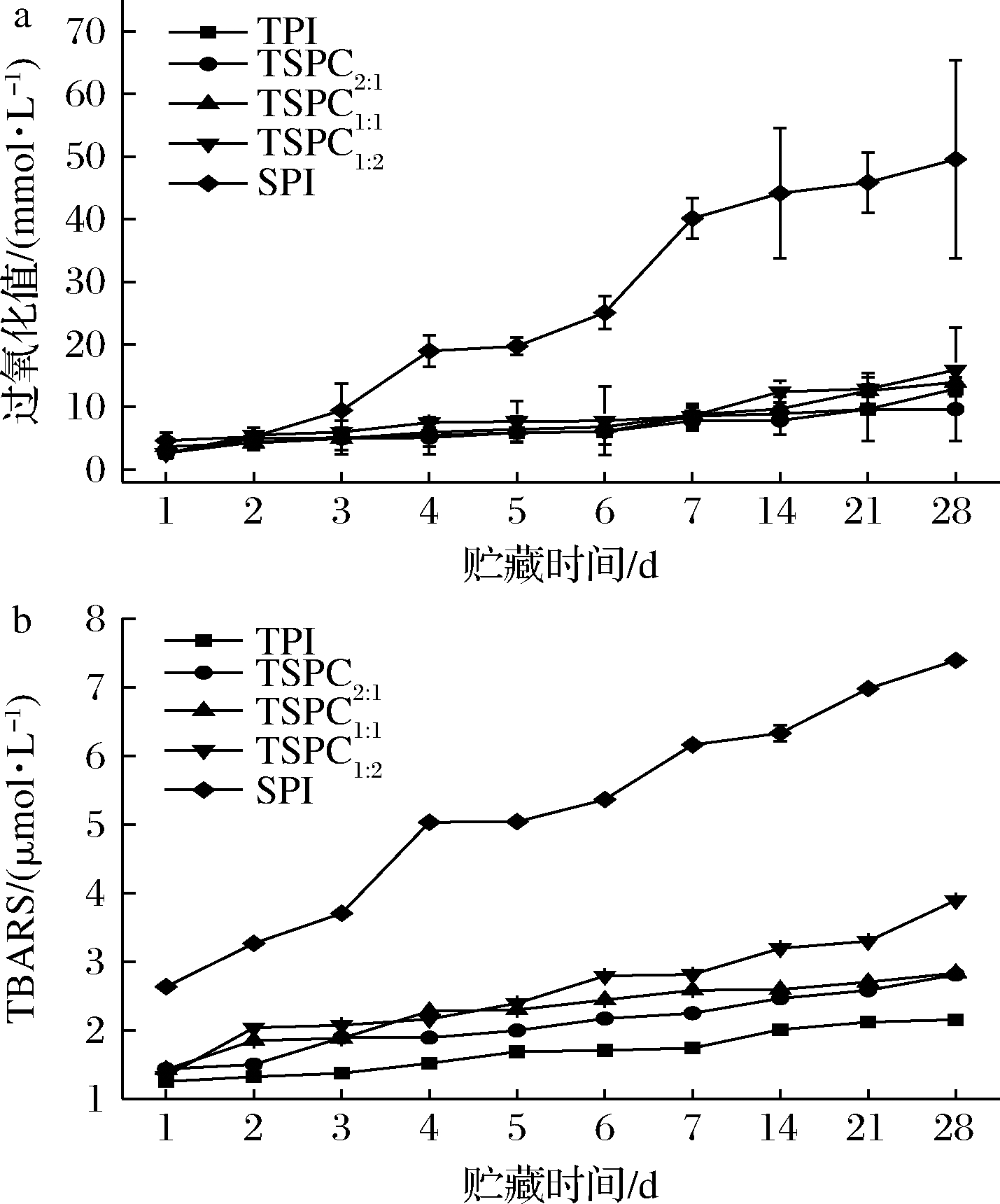
a-过氧化值;b-TBARS值
图3 TSPC-DHA藻油乳液贮藏过程中的变化
Fig.3 Changes of TSPC-DHA algal oil emulsion during storage
2.4 乳液的微观结构分析
乳液的形成和稳定直接受到油滴分布和颗粒大小的影响。将乳液的蛋白和油相分别用尼罗红和尼罗蓝染色,通过CLSM观察乳液的微观结构并拍照,如图4所示。由图4可知,TPI乳液和TSPC2∶1乳液微观图中明显存在不均匀的颗粒分布,蛋白分子间相互结合形成聚集体,且油滴周围包裹了较厚的蛋白吸附层。结果与乳析指数和实物图的变化趋势一致,说明TPI乳液和TSPC2∶1乳液内部的蛋白聚集体是引起乳液分层的主要原因。由于较大的蛋白聚集体不容易移动到油-水界面,引起蛋白质的界面活性下降[8],油滴间更容易相互聚集,导致乳液的物理稳定性变差。同时,由于油滴周围包裹了较厚的蛋白吸附层,可以作为天然的物理屏障减少DHA藻油和促氧化剂的相互作用[24],进而减缓了DHA藻油的氧化。随着原料中大豆比例的增加,TSPC乳液的平均粒径逐渐减小,蛋白聚集体和油滴逐渐分散。其中,TSPC1∶1和TSPC1∶2乳液油滴的分散程度接近SPI乳液,颗粒小且分布均匀,蛋白分子更容易扩散到油水界面,可以有效阻止油滴之间的聚集,乳液的物理稳定性更好,并且油滴周围的蛋白吸附层较厚,减少了DHA藻油和环境中促氧化剂的相互作用。因此,TSPC乳液具有优于TPI乳液的物理稳定性和优于SPI乳液的氧化稳定性,其中TSPC1∶1和TSPC1∶2乳液的物理稳定性和氧化稳定性更好。

图4 TSPC-DHA藻油乳液的激光共聚焦显微镜图
Fig.4 CLSM pictures of the TSPC-DHA algal oil emulsion
3 结论
为了探究罗非鱼-大豆复合共沉淀蛋白乳化稳定DHA藻油的可行性,比较了TPI、3种TSPC和SPI-DHA藻油乳液的物理稳定性和氧化稳定性。结果表明,TSPC稳定的DHA藻油乳液具有优于TPI乳液的物理稳定性和优于SPI乳液的氧化稳定性,且不同比例的共沉淀蛋白稳定DHA藻油的效果不同。大豆蛋白组分的存在能增强TSPC乳液体系的分散性和电负性,乳液的平均粒径减小,提高乳液的物理稳定性;而鱼蛋白组分的存在能够减缓TSPC乳液体系中油脂的氧化速率,提高乳液的氧化稳定性。当罗非鱼肉和大豆原料混合的比例为1∶1和1∶2时,TSPC1∶1和TSPC1∶2乳液平均粒径小,体系分散均匀,4 ℃贮藏28 d无明显分层,且贮藏期间体系的过氧化值接近TPI乳液,乳液的物理稳定性和氧化稳定性较好。因此,罗非鱼-大豆复合共沉淀蛋白具有优于单一蛋白的特性,可用作良好的乳化剂稳定DHA藻油,研究结果为共沉淀蛋白功能乳液的开发提供新的可能。
[1] 汪志明, 余超, 陆姝欢, 等.DHA/EPA在心血管疾病防治中的重要作用[J].中国食品添加剂, 2014(9):164-170.
WANG Z M, YU C, LU S H, et al.Protective effect of docosahexaenoic acid and eicosapntemacnioc acid on cardiovascular disease[J].China Food Additives, 2014(9):164-170.
[2] 王美辰, 石羽杰, 刘彪, 等.二十二碳六烯酸与认知功能发育研究进展[J].中国儿童保健杂志, 2020, 28(11):1 227-1 230.
WANG M C, SHI Y J, LIU B, et al.Research advances on docosahexaenoic acid and cognition function development[J].Chinese Journal of Child Health Care, 2020, 28(11):1 227-1 230.
[3] 陈琼, 郑奕锐, 汤新, 等.基于胃肠动态消化系统分析两种不同藻油剂型的消化特性和生物可及性[J].现代食品科技, 2021, 37(8):127-134.
CHEN Q, ZHENG Y R, TANG X, et al.Digestive characteristics and bioaccessibility of two different types of algal oil based on an in vitro dynamic digestive system[J].Modern Food Science and Technology, 2021, 37(8):127-134.
[4] 邓斌, 尚刚.ω-3型脂肪酸-DHA在食品中的应用[J].食品研究与开发, 2009, 30(10):157-159.
DENG B, SHANG G.Research on application of ω-3 fatty acid-DHA in the food[J].Food Research and Development, 2009, 30(10):157-159.
[5] 孙勤, 王丽娟.酪蛋白酸钠稳定的海藻油纳米乳液制备及表征[J].现代食品科技, 2016, 32(6):183-187.
SUN Q, WANG L J.Preparation and characterization of algal oil nanoemulsions stabilized by casein sodium[J].Modern Food Science and Technology, 2016, 32(6):183-187.
[6] 纪雪花, 杜启伟, 苏琪皓, 等.基于油-水界面行为解析蛋白质乳液絮凝机制及其控制方法研究进展[J].食品科学, 2021, 42(13):281-288.
JI X H, DU Q W, SU Q H, et al.Mechanisms for and control strategies against the flocculation of protein-stabilized emulsion based on oil-water interface behavior:A review[J].Food Science, 2021, 42(13):281-288.
[7] GAYOSO L, ANSORENA D, ASTIASAR N I.DHA rich algae oil delivered by O/W or gelled emulsions:Strategies to increase its bioaccessibility[J].Journal of the Science of Food and Agriculture, 2019, 99(5):2 251-2 258.
N I.DHA rich algae oil delivered by O/W or gelled emulsions:Strategies to increase its bioaccessibility[J].Journal of the Science of Food and Agriculture, 2019, 99(5):2 251-2 258.
[8] CHANG H J, LEE J H.Emulsification and oxidation stabilities of DAG rich algae oil-in-water emulsions prepared with the selected emulsifiers[J].Journal of the Science of Food and Agriculture, 2020, 100(1):287-294.
[9] THOMPSON L U.Coprecipitation of cheese whey with soybean and cottonseed proteins using acid and heat treatment[J].Journal of Food Science, 1978, 43(3):790-792.
[10] KRISTENSEN H T, DENON Q, TAVERNIER I, et al.Improved food functional properties of pea protein isolate in blends and co-precipitates with whey protein isolate[J].Food Hydrocolloids, 2021, 113:106556.
[11] KRISTENSEN H T, CHRISTENSEN M, HANSEN M S, et al.Protein-protein interactions of a whey-pea protein co-recipitate[J].International Journal of Food Science & Technology, 2021, 56(11):5 777-5 790.
[12] CHIHI M L, MESSION J L, SOK N, et al.Heat-induced soluble protein aggregates from mixed pea globulins and β-lactoglobulin[J].Journal of Agricultural and Food Chemistry, 2016, 64(13):2 780-2 791.
[13] CHALAMAIAH M, HEMALATHA R, JYOTHIRMAYI T.Fish protein hydrolysates:Proximate composition, amino acid composition, antioxidant activities and applications:A review[J].Food chemistry, 2012, 135(4):3 020-3 038.
[14] ZHANG X G, NOISA P, YONGSAWATDIGUL J.Chemical and cellular antioxidant activities of in vitro digesta of tilapia protein and its hydrolysates[J].Foods (Basel,Switzerland), 2020, 9(6):833.
[15] 张震, 郝强, 周小秋, 等.近年我国淡水鱼营养与饲料科学研究进展[J].动物营养学报, 2020, 32(10):4 743-4 764.
ZHANG Z, HAO Q, ZHOU X Q, et al.Recent research progresses of nutrition and feed science of freshwater fish in China[J].Chinese Journal of Animal Nutrition, 2020, 32(10):4 743-4 764.
[16] 代振清, 张梦霞, 郑惠娜, 等.罗非鱼蛋白-大豆蛋白共沉淀物的乳化性[J].食品与发酵工业, 2015, 41(2):63-69.
DAI Z Q, ZHANG M X, ZHENG H N, et al.Emulsifying properties of tilapia-soybean protein co-precipitates[J].Food and Fermentation Industries, 2015, 41(2):63-69.
[17] 孙亚欣, 郑晓燕, 郑丽丽, 等.大豆分离蛋白-茶皂素复合乳化剂制备山茶油纳米乳液及其性质研究[J].食品工业科技, 2020, 41(22):27-34;42.
SUN Y X, ZHENG X Y, ZHENG L L, et al.Preparation of camellia oil nanoemulsion by soy protein isolate-tea saponin compound emulsifier and properties of nanoemulsion[J].Science and Technology of Food Industry, 2020, 41(22):27-34;42.
[18] ZHANG X Y, QI B K, XIE F Y, et al.Emulsion stability and dilatational rheological properties of soy/whey protein isolate complexes at the oil-water interface:Influence of pH[J].Food Hydrocolloids, 2021, 113:106391.
[19] SHAO Y, TANG C H.Characteristics and oxidative stability of soy protein-stabilized oil-in-water emulsions:Influence of ionic strength and heat pretreatment[J].Food Hydrocolloids, 2014, 37:149-158.
[20] 陈旭辉. pH对藻蓝蛋白乳化性质的影响[J].现代食品科技, 2020, 36(9):117-125.
CHEN X H.Effect of pH on the emulsifying activity of c-phycocyanin[J].Modern Food Science and Technology, 2020, 36(9):117-125.
[21] 陈艾霖, 洪鹏志, 宋春勇, 等.热处理对负载叶黄素的罗非鱼分离蛋白乳液稳定性和体外消化的影响[J].食品与发酵工业, 2021, 47(16):173-180.
CHEN A L, HONG P Z, SONG C Y, et al.Effect of heat treatment on stability and in vitro digestion of lutein loaded tilapia protein isolate[J].Food and Fermentation Industries, 2021, 47(16):173-180.
[22] TENG Z, LUO Y C, WANG Q.Nanoparticles synthesized from soy protein:Preparation, characterization, and application for nutraceutical encapsulation[J].Journal of Agricultural and Food Chemistry, 2012, 60(10):2 712-2 720.
[23] WAN Z L, WANG L Y, WANG J M, et al.Synergistic interfacial properties of soy protein-stevioside mixtures:Relationship to emulsion stability[J].Food Hydrocolloids, 2014, 39:127-135.
[24] GARC A-MORENO P J, GUADIX A, GUADIXA E M, et al.Physical and oxidative stability of fish oil-in-water emulsions stabilized with fish protein hydrolysates[J].Food Chemistry, 2016, 203:124-135.
A-MORENO P J, GUADIX A, GUADIXA E M, et al.Physical and oxidative stability of fish oil-in-water emulsions stabilized with fish protein hydrolysates[J].Food Chemistry, 2016, 203:124-135.