活性氧(reactive oxygen species, ROS)在细胞内稳态、信号转导和各种生物反应中起着重要作用。然而,促氧化剂和抗氧化剂之间的不平衡会引起氧化应激,损害各种细胞成分(DNA、蛋白质和脂质等)并导致系列疾病[1]。氧化应激已被证明与高血压和其他慢性疾病(如关节炎、糖尿病和神经退行性疾病)的发展有密切关系,开发兼具抗氧化、降血压等多种活性功效的天然成分成为近年来研究的热点[2]。食源性生物活性肽或蛋白酶解物因具有良好的抗氧化能力、环保、可持续性、低成本和无毒副作用等优点引起了人们极大的兴趣[3]。已有研究表明,许多抗氧化酶解物或多肽具有良好的血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制活性[4-5]。牡蛎蛋白质含量丰富,氨基酸组成完善,同时牡蛎作为我国传统的药食同源的食品原料,是开发具有抗氧化和ACE抑制活性的生物活性肽的良好来源。
硒是人体所必需的微量元素,是一些生物酶的辅助因子,如谷胱甘肽过氧化物酶(glutathione peroxidase, GPx),硫氧还蛋白还原酶(thioredoxin reductase, TrxR)和脱碘酶(iodothyronine deiodinases, DIOs)等,在大多数生物体中表现出氧化还原酶的功能[6]。近年来,有机硒因其良好的安全性、良好的生物活性和生物利用度而受到世界范围内的广泛关注,在均衡饮食的框架下,有机硒比无机硒更值得推荐[7]。与单一的硒化合物和普通的生物活性肽相比,硒肽具有更有效的生物活性,是生物活性肽领域中极具研究价值的新颖肽[8]。目前,利用富硒酵母[9]、大豆[6]、堇叶碎米荠[10]和黄粉虫[11]等硒蛋白原料开发生物活性肽的研究已有报道。富硒生物活性肽具有多种功能活性,如堇叶碎米荠硒肽具有抗氧化和抗疲劳活性[10],富硒黄粉虫幼虫经碱性蛋白酶水解后的蛋白水解物显示出良好的抗氧化和免疫调节活性[11]。然而,利用北部湾富硒牡蛎开发天然有机硒活性肽的研究尚无报道。
1 材料与方法
1.1 材料与试剂
富硒牡蛎蛋白,北部湾滨海富硒功能农业研究院;碱性蛋白酶(2×105 U/g)、中性蛋白酶(2×105 U/g)、木瓜蛋白酶(2×105 U/g)、胰蛋白酶(2 500 Usp U/mg)、胃蛋白酶(3 000 NF),南宁庞博生物工程有限公司;血管紧张素转化酶(来源于兔肺)、N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(N-[3-(2-furyl)acryloyl]-L-phenylalanyl-glycyl-glycine, FAPGG)、4-羟乙基哌嗪乙磺酸[4-2-hydroxyethyl)piperazine-1-ethanesulfonic acid,HEPES]、2′,7′-二氯荧光素二乙酸酯(2,2′-dichlorodihydrofluorescein diacetate, DCFH-DA),美国Sigma公司;噻唑兰[3-(4,5-dimethylthiazol-2-yl)-2,5 diphenyl tetrazolium bromide, MTT]、DPPH、ABTS,上海麦克林生化科技有限公司;杜氏改良高糖培养基(Dulbecco′s modified eagle medium,DMEM)、胎牛血清、双抗(青霉素/链霉素),美国Gibico公司;2,2′-偶氮二异丁基脒二盐酸盐(2,2′-azobis(2-methylpropionamidine)dihydrochloride,AAPH),上海源叶生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
AL104电子天平,梅特勒-托利多仪器(上海)有限公司;DF-101S数显恒温水浴锅,巩义予华仪器有限公司;PHS-3CW pH计,赛多利斯科学仪器(京)有限公司;L530台式低速离心机,湖南湘仪实验室仪器开发有限公司;FD-1型冷冻干燥机,海门市其林贝尔仪器制造有限公司;S-433D全自动氨基酸分析仪,德国Sykam公司;AFS-9530原子荧光光度计,北京海光仪器有限公司;EnSpire2300多功能酶标仪,珀金埃尔默企业管理(上海)有限公司;CKX41倒置显微镜,日本Olympus公司。
1.3 实验方法
1.3.1 富硒牡蛎肽的酶法制备及工艺优化
1.3.1.1 工艺流程
称取一定量富硒牡蛎蛋白粉→按一定底物质量浓度加去离子水充分溶解→调节pH(1 mol/L NaOH或1 mol/L HCl溶液)→按照不同酶底比加入蛋白酶→水浴酶解→灭酶(95 ℃,10 min)→离心(4 000 r/min,20 min)→上清液(测定DPPH自由基清除率)→真空冷冻干燥→富硒牡蛎肽冻干粉
1.3.1.2 单因素试验
采用单因素试验研究了酶解条件对富硒牡蛎肽清除DPPH自由基的影响。单因素包括:酶种类(碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胰蛋白酶、胃蛋白酶);酶解时间(0.5、1、2、3、4 h);pH值(1.0、1.5、2.0、2.5、3.0);底物质量浓度(1、3、5、7、9 g/100mL);酶解温度(30、35、40、45、50 ℃)、酶底比(0.1%、0.2%、0.3%、0.4%、0.5%)。在优化实验因素的过程中,每次实验都只改变1个因素而保持其他因素不变。
1.3.1.3 响应面试验优化
在单因素试验的基础上,以酶解温度、酶解时间、酶底比为影响因素,各取3个水平值,以酶解物的DPPH自由基清除率为响应值,确定富硒牡蛎肽的最佳酶解工艺,试验因素及水平见表1。
表1 响应面分析试验因素水平
Table 1 Factor and level of response surface experiment

水平因素X1(酶解温度)/℃X2(酶解时间)/hX3(酶底比)/%-13520.304030.414540.5
1.3.2 硒含量测定
样品的硒含量测定参照GB 5009.93—2017《食品中硒的测定 氢化物原子荧光光谱法》。
1.3.3 氨基酸组成测定
氨基酸含量测定参照GB 5009.124—2016《食品中氨基酸的测定 氨基酸分析仪》。
1.3.4 抗氧化评价
1.3.4.1 DPPH自由基清除能力的测定
参考MIAO等[12]的方法进行测定。将100 μL不同质量浓度的样品溶液和100 μL DPPH溶液加入96孔板中,混匀后于室温、避光条件下反应30 min,立即测定其在517 nm处的吸光值。DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A0为100 μL无水乙醇+100 μL DPPH溶液的吸光值,Ai为100 μL样品溶液+100 μL DPPH溶液的吸光值,Aj为100 μL样品溶液+100 μL无水乙醇的吸光值。
1.3.4.2 ABTS阳离子自由基清除能力的测定
参考MIAO等[12]的方法配制ABTS工作液,依次加入100 μL ABTS工作液和100 μL不同质量浓度的样品溶液于96孔板中,混匀,于37 ℃下避光反应10 min后,在734 nm处测定吸光值。ABTS阳离子自由基清除率的计算如公式(2)所示:
ABTS阳离子自由基清除率![]()
(2)
式中:A0为100 μL去离子水+100 μL ABTS工作液的吸光值,Ai为100 μL样品溶液+100 μL ABTS工作液的吸光值,Aj为100 μL样品溶液+100 μL去离子水的吸光值。
1.3.4.3 细胞培养及细胞毒性试验
HepG2细胞培养参考LI等[13]的方法。富硒牡蛎肽对HepG2细胞的毒性检测参照MIAO等[12]的方法略作修改。将100 μL HepG2细胞细胞悬液(1×105 cells/mL)接种于96孔板中,37 ℃培养24 h后弃去培养液,样品组加入100 μL富硒牡蛎肽溶液(0.5、5、50、100、250、500、1 000、2 000、5 000 μg/mL),对照组加入100 μL培养基继续培养24 h。用PBS清洗后,加入100 μL MTT溶液(0.5 mg/mL)继续孵育4 h。弃去MTT溶液,加入100 μL 二甲基亚砜(dimethyl sulfoxide,DMSO),振荡10 min使蓝紫色结晶全部溶解后,酶标仪检测490 nm处的OD值。
1.3.4.4 细胞抗氧化活性(cellular antioxidant activity,CAA)测定
在黑色96孔板中每孔接种100 μL HepG2细胞悬液(6×105 cells/mL),分为对照孔(PC),空白孔(NC)和处理孔(TC),细胞培养24 h后,用PBS洗涤一遍。对照组和空白组中加入50 μL DCFH-DA(50 μmol/L)工作溶液和50 μL无菌水;样品组中加入50 μL DCFH-DA(50 μmol/L)工作溶液和50 μL不同浓度的富硒牡蛎肽溶液,37 ℃下孵育1 h。弃去处理培养基,用PBS洗涤3次,在空白组中加入培养基,在对照组和处理组中加入100 μL 2,2′-偶氮二异丁基脒二盐酸盐[2,2′-azobis(2-amidinopropane) dihydrochloride, ABAP](600 μmol/L)工作溶液。酶标仪测定波长528 nm的荧光值,激发波长为485 nm,测定时长为1 h,每5 min测1次。CAA的计算如公式(3)所示:
(3)
式中:AUC代表荧光强度-时间曲线下的积分面积。
1.3.4.5 对AAPH诱导损伤HepG2细胞的保护作用
将100 μL HepG2细胞悬液接种于96孔培养板中,得到每孔2×104个细胞,37 ℃,5% CO2培养箱中孵育24 h。弃去培养基,空白对照组加入100 μL培养基,实验组加入100 μL含AAPH的培养基(AAPH浓度为0~16 mmol/L),继续孵育24 h,弃去培养基,用PBS清洗后,采用MTT比色法测定细胞存活率,探索合适的AAPH浓度以构建细胞适度损伤模型。
将100 μL HepG2细胞细胞悬液(2×105cells/mL)接种于96孔板中,分为空白对照组、损伤组和保护组,37 ℃孵育24 h。弃去培养基,空白对照组和损伤组加入100 μL培养基,保护组加入100 μL的富硒牡蛎肽溶液(5、10、25、50、100 μg/mL)继续孵育24 h。然后,空白对照组加入50 μL培养基,损伤组和保护组加入50 μL含AAPH的培养基(AAPH终浓度为0.5 mmol/L),继续孵育24 h后,弃去培养基,用PBS清洗后,采用MTT比色法测定细胞存活率。
1.3.5 ACE抑制率测定
根据等CAO等[14]的方法加以修改测定富硒牡蛎肽的ACE抑制活性。依次加入10 μL ACE(0.1 U/mL)溶液,40 μL样品溶液,最后加入50 μL 1.0 mmol/L的FAPGG底物(用含有0.3 mol/L NaCl的80 mmol/L的HEPES缓冲液配制)。空白对照组使用等体积的80 mmol/L HEPES缓冲液代替样品。混匀后,立刻测定在340 nm处的初始OD值,37 ℃保温30 min后再测定其OD值。ACE抑制率的计算如公式(4)所示:
ACE抑制率![]()
(4)
式中:ΔAb为空白对照组吸光度在30 min内的变化,ΔAa为样品组吸光度在30 min内的变化。
1.4 数据处理
所有指标均重复测定3次,结果用平均值±标准差表示。采用Design-Expert v 8.0.6进行响应面实验设计和数据分析。采用SPSS 26.0对数据进行单因素方差分析(ANOVA),显著性分析采用Duncan检验。
2 结果与分析
2.1 富硒牡蛎肽的制备
2.1.1 单因素试验
由图1-a可知,在不同蛋白酶最优条件下,胃蛋白酶酶解产物的DPPH自由基清除率最高,达到(50.47±2.38)%,碱性蛋白酶酶解产物对DPPH自由基的清除活性最低,为(28.43±2.22)%。因此,在后续的实验中,以胃蛋白酶为最适用酶进一步优化酶解工艺参数。
如图1-b所示,随着酶解时间的延长,酶解产物DPPH自由基清除能力逐渐增强,在酶解3 h时达到最大值,之后其清除DPPH自由基的能力略有下降。分析原因可能是随着酶解时间的延长,底物特异性位点基本被完全反应,继续反应不会导致额外的活性基团暴露,甚至会导致底物过度酶解,产生活性较低的酶解产物[15]。因此,选择酶解时间3 h作为响应面优化试验的中心试验点。
由图1-c可知,利用胃蛋白酶酶解制备富硒牡蛎肽的最佳pH值为1.0。当pH值从1.0增加到3.0时,酶解物的DPPH自由基清除率呈下降趋势,可能是由于胃蛋白酶的最适pH为1.0~2.0,在这一范围内,胃蛋白酶的活性高,酶解效果好。pH继续升高会破坏蛋白酶的活性中心和空间结构,使其催化活性降低,所以确定最佳酶解pH为1.0。
由图1-d可知,在1~7 g/100mL的底物质量浓度范围内,酶解产物清除DPPH自由基的能力逐渐增加,但随着底物质量浓度的进一步增加,活性没有明显变化。由此可见,酶解早期,底物质量浓度的增加促进酶解过程的进行。然而,底物质量浓度过高会抑制分子的扩散和移动,限制蛋白酶的效率,导致酶解产生的活性抗氧化肽的相对含量降低[16]。考虑到节约成本,以7 g/100mL为最佳底物质量浓度进行进一步研究。
如图1-e所示,温度在30~40 ℃范围内,酶解物的DPPH自由基清除率随温度升高缓慢升高,在40 ℃达到最大值后下降。这是因为在相对较低的温度下,酶的活性较小,分子的动能较小,酶与底物之间的碰撞也较少,反应效率低。当超过其最适温度后,蛋白酶逐渐变性,酶活性降低,导致酶解作用减弱。因此,选取酶解温度35、40、45 ℃进一步响应面优化。
如图1-f所示,酶底比从0.1%增加到0.4%,酶解产物的DPPH自由基清除能力提高。而当酶底比进一步提高到0.5%时,酶解产物清除DPPH自由基的能力明显下降。合适的酶添加可提高富硒牡蛎蛋白的利用率,促进抗氧化肽的生成,过高的酶用量可能造成过度酶解,导致活性抗氧化肽过度降解,产生活性较低的氨基酸或小分子肽。因此,选择酶底比0.4%作为优化的中心点。
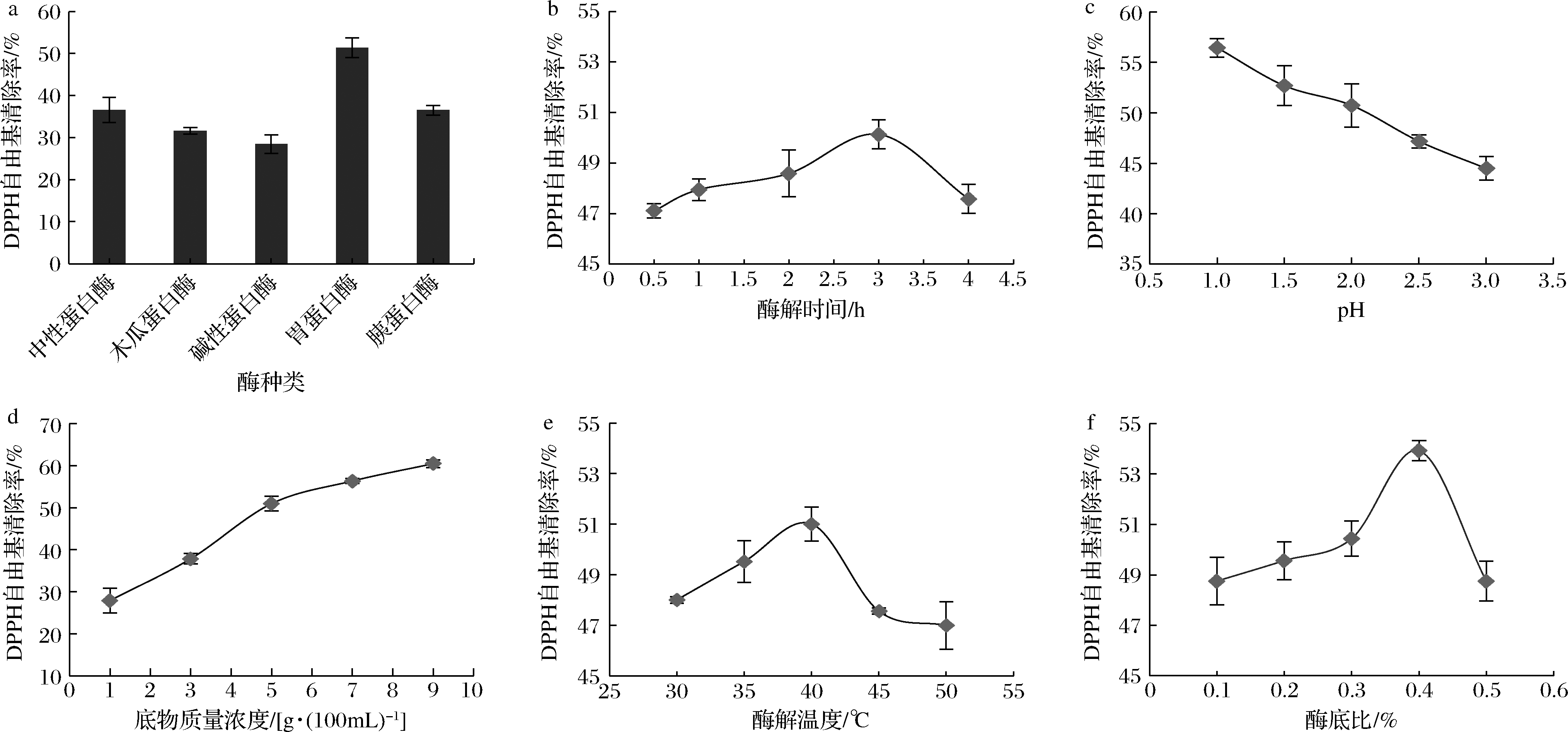
a-酶种类;b-酶解时间;c-pH;d-底物质量浓度;e-酶解温度;f-酶底比
图1 酶解条件对富硒牡蛎肽的DPPH自由基清除率的影响
Fig.1 Effect of enzymatic hydrolysis conditions on DPPH radical scavenging activity of selenium-enriched oyster peptides
2.1.2 响应面优化结果及分析
以酶解温度(X1)、酶解时间(X2)和酶底比(X3)3个因素为自变量,以DPPH自由基清除率为响应值(Y),进行3因素3水平试验设计,试验设计和结果见表2。对实验数据进行多元回归分析,得到如下二阶多项式方程,如公式(5)所示:
Y=58.26-0.54X1+0.53X2+0.080X3-0.96X1 X2+0.063X1 X3+0.54X2 X3-1.61X12+0.10X22+1.34X32
(5)
由回归方程模型的方差分析及显著性分析结果(表3)可知,回归模型具有较高的F值(F=18.41)和极低的P值(P=0.000 4),显示回归模型呈极显著水平。同时,该模型具有理想的决定系数(R2=0.959 5)和校正决定系数![]() 说明该模型具有较低的试验误差和良好实际情况拟合程度。失拟项的F值(F=0.20)和P值(P=0.892 6)显示模型失拟检验不显著,说明未知因素对试验结果干扰很小,可用该模型对富硒牡蛎肽的制备条件进行分析和预测。
说明该模型具有较低的试验误差和良好实际情况拟合程度。失拟项的F值(F=0.20)和P值(P=0.892 6)显示模型失拟检验不显著,说明未知因素对试验结果干扰很小,可用该模型对富硒牡蛎肽的制备条件进行分析和预测。
回归方程中各变量对响应值影响的显著性由F检验来判定,概率P值越小,则相应变量的显著程度越高。各因素对富硒牡蛎肽的DPPH自由基清除率的影响:酶解温度>酶解时间>酶底比,且酶解温度与酶解时间、酶解时间与酶底比交互作用影响显著(P<0.05),酶解温度与酶底比交互作用影响不显著(P>0.05)。
经回归模型预测,得到最佳酶解工艺参数为酶解时间3.96 h,酶解温度36.71 ℃,酶底比0.5%,在此条件下DPPH自由基清除率预测值为60.979%。在实验室验证试验中,为了便于操作,选取酶解时间4 h,酶解温度37 ℃,酶底比0.5%,pH 1.0,底物质量浓度7 g/100mL进行验证实验。在此工艺条件下所得富硒牡蛎肽的平均DPPH自由基清除率为(61.84±0.63)%,与模型预测值接近。
表2 响应面试验设计及结果
Table 2 Experimental design and corresponding results for respond surface analysis
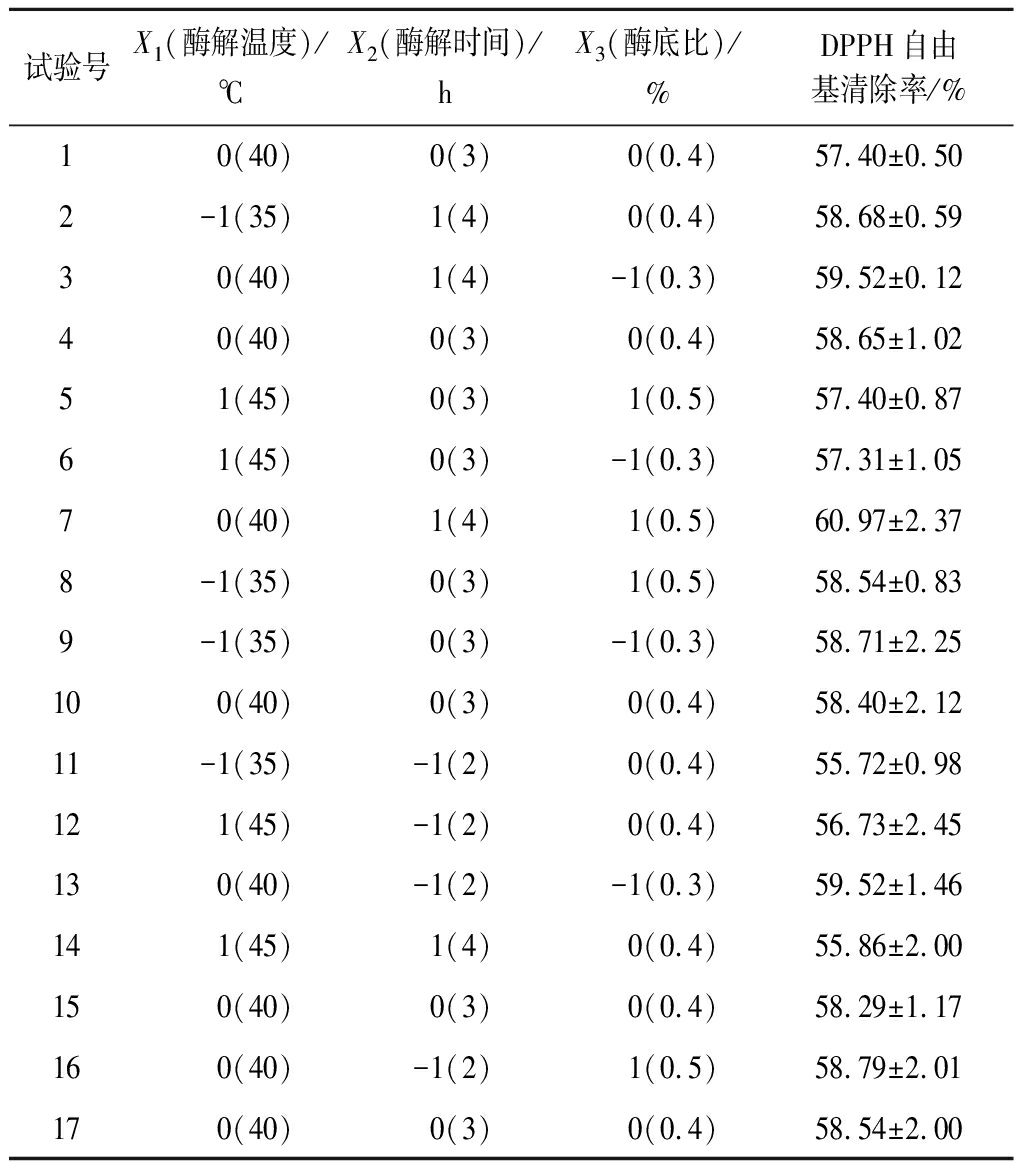
试验号X1(酶解温度)/℃X2(酶解时间)/hX3(酶底比)/%DPPH自由基清除率/%10(40)0(3)0(0.4)57.40±0.502-1(35)1(4)0(0.4)58.68±0.5930(40)1(4)-1(0.3)59.52±0.1240(40)0(3)0(0.4)58.65±1.0251(45)0(3)1(0.5)57.40±0.8761(45)0(3)-1(0.3)57.31±1.0570(40)1(4)1(0.5)60.97±2.378-1(35)0(3)1(0.5)58.54±0.839-1(35)0(3)-1(0.3)58.71±2.25100(40)0(3)0(0.4)58.40±2.1211-1(35)-1(2)0(0.4)55.72±0.98121(45)-1(2)0(0.4)56.73±2.45130(40)-1(2)-1(0.3)59.52±1.46141(45)1(4)0(0.4)55.86±2.00150(40)0(3)0(0.4)58.29±1.17160(40)-1(2)1(0.5)58.79±2.01170(40)0(3)0(0.4)58.54±2.00
表3 试验结果方差分析
Table 3 Results of variance analysis
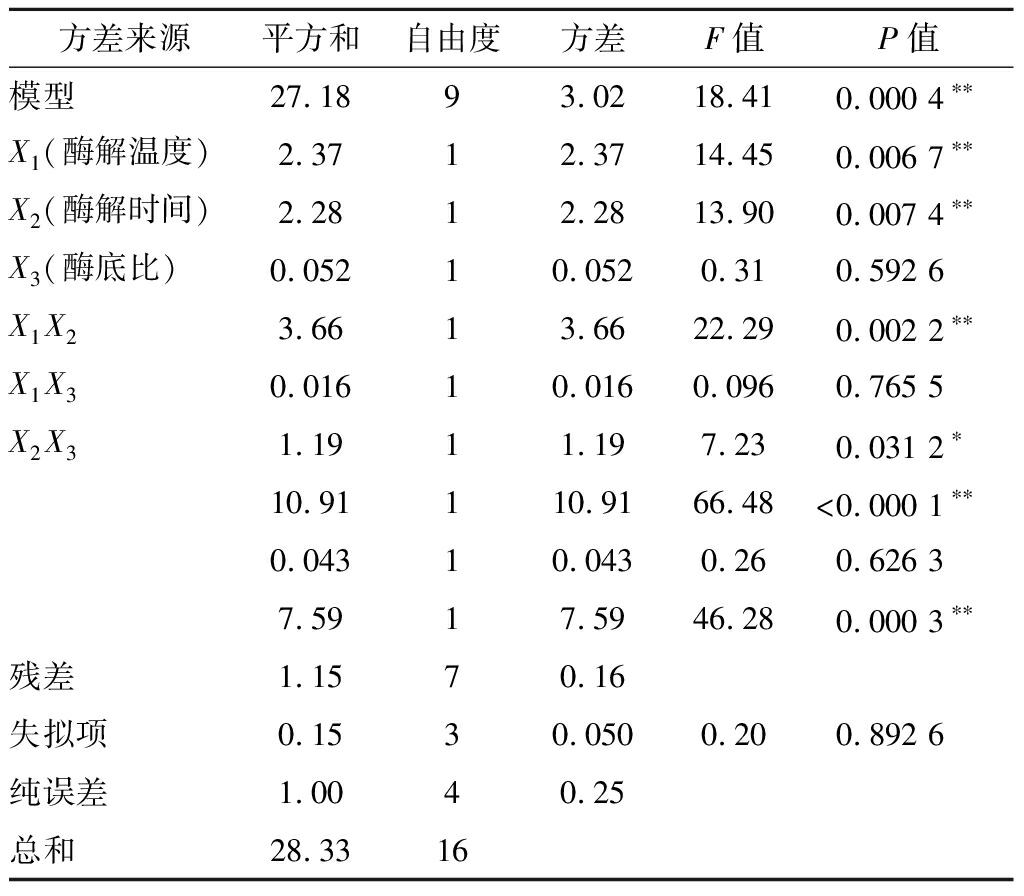
方差来源平方和自由度方差F值P值模型27.1893.0218.410.000 4∗∗X1(酶解温度)2.3712.3714.450.006 7∗∗X2(酶解时间)2.2812.2813.900.007 4∗∗X3(酶底比)0.05210.0520.310.592 6X1X23.6613.6622.290.002 2∗∗X1X30.01610.0160.0960.765 5X2X31.1911.197.230.031 2∗10.91110.9166.48<0.000 1∗∗0.04310.0430.260.626 37.5917.5946.280.000 3∗∗残差1.1570.16失拟项0.1530.0500.200.892 6纯误差1.0040.25总和28.3316
注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)
2.2 硒含量及氨基酸组成分析
富硒牡蛎蛋白的硒含量为(1.30±0.07) mg/kg,高于DB45/T 1061—2014《富硒农产品硒含量分类要求》中水产类硒含量指标(0.10~0.50 mg/kg)。经胃蛋白酶酶解优化后,所得富硒牡蛎肽的硒含量明显增加,达到(1.62±0.20) mg/kg,为其原料蛋白的1.24倍,这一结果表明酶解优化工艺使硒得到一定程度的富集,说明硒元素在酶解物活性方面发挥作用,特别对抗氧化活性起到关键作用。
由表4可知,富硒牡蛎肽中富含谷氨酸(15.51%),天冬氨酸(9.66%)、组氨酸(8.52%)、亮氨酸(7.57%)、甘氨酸(7.44%)和精氨酸(7.44%)。研究报道,疏水性氨基酸残基如亮氨酸、缬氨酸、丙氨酸、脯氨酸及苯丙氨酸能够提高抗氧化肽抑制脂质过氧化的能力[17],富硒牡蛎肽中疏水性氨基酸含量丰富(34.45%),对肽的抗氧化活性有重要贡献。酸性氨基酸和碱性氨基酸具有螯合促氧化的金属离子的作用,能增强肽的抗氧化能力[17],富硒牡蛎肽中酸性氨基酸和碱性氨基酸分别占总氨基酸含量的25.17%、18.85%,其中,谷氨酸含量最高,使富硒牡蛎肽具有较强的抗氧化活性。此外,有研究报道,富含谷氨酸、甘氨酸、丙氨酸和较多的疏水性氨基酸残基的肽通常具有很强的ACE抑制作用[18]。富硒牡蛎肽富含这些与抗氧化和ACE抑制活性相关的氨基酸,因此,富硒牡蛎肽在抗氧化和降血压方面有极大的潜力。
表4 氨基酸分析
Table 4 Amino acid analysis
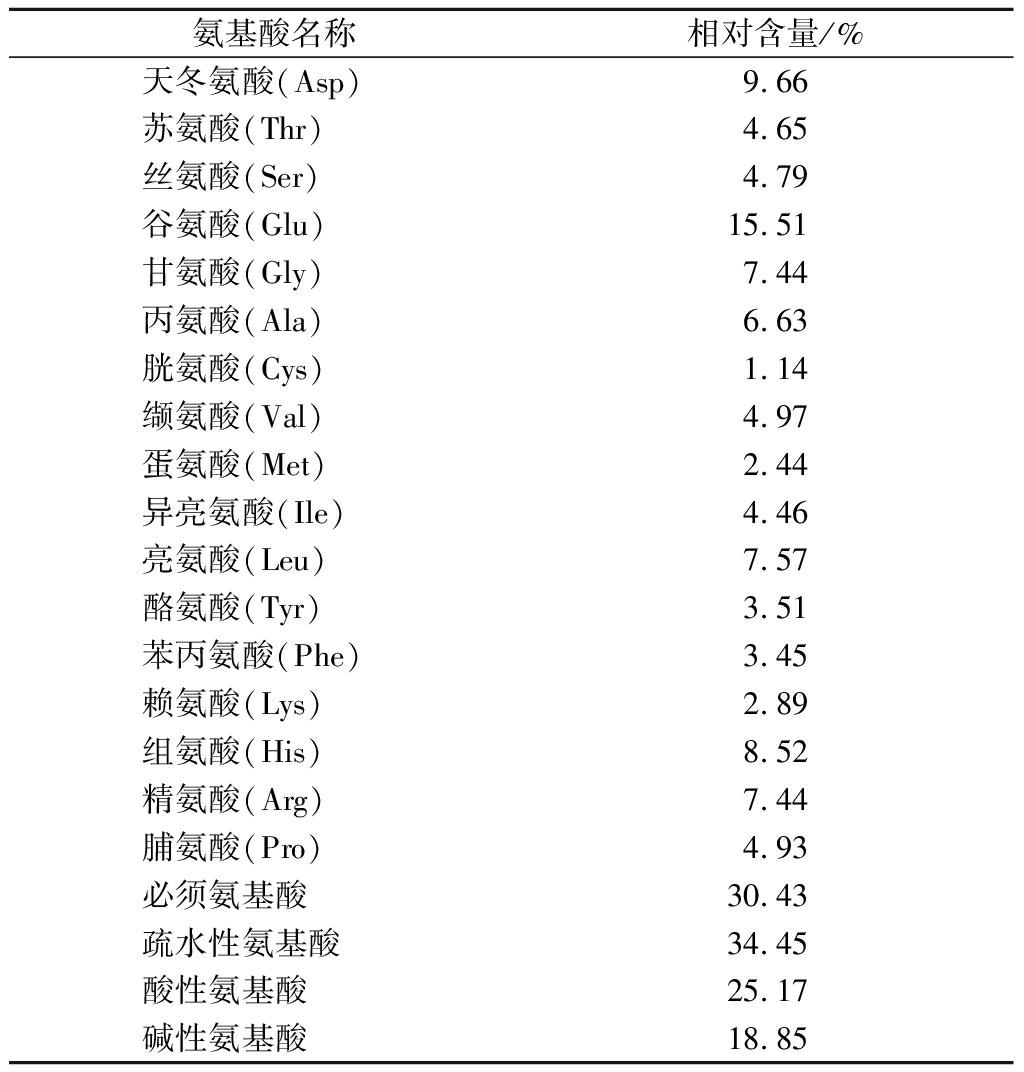
氨基酸名称相对含量/%天冬氨酸(Asp)9.66苏氨酸(Thr)4.65丝氨酸(Ser)4.79谷氨酸(Glu)15.51甘氨酸(Gly)7.44丙氨酸(Ala)6.63胱氨酸(Cys)1.14缬氨酸(Val)4.97蛋氨酸(Met)2.44异亮氨酸(Ile)4.46亮氨酸(Leu)7.57酪氨酸(Tyr)3.51苯丙氨酸(Phe)3.45赖氨酸(Lys)2.89组氨酸(His)8.52精氨酸(Arg)7.44脯氨酸(Pro)4.93必须氨基酸30.43疏水性氨基酸34.45酸性氨基酸25.17碱性氨基酸18.85
2.3 富硒牡蛎肽的抗氧化活性
2.3.1 DPPH自由基清除活性
如图2所示,在0.10~8.00 mg/mL质量浓度下,富硒牡蛎肽对DPPH自由基的清除能力为3.98%~96.64%,且具有显著的剂量效应。EC50值被广泛应用于对比目标活性物的活性强弱,EC50值越低,表明清除自由基的能力越强。富硒牡蛎肽清除DPPH自由基的EC50值为1.365 mg/mL,与堇叶碎米荠硒蛋白酶解物[10][EC50:(1.14±0.11) mg/mL]接近,非常明显低于尖吻鲈鱼皮明胶水解物[19](EC50:60~87 mg/mL)和牛乳奶酪抗氧化肽[20](EC50:7.02~7.60 mg/mL),表明富硒牡蛎肽具有较强的DPPH自由基清除活性,有机硒能增强活性肽的抗氧化效力。

图2 富硒牡蛎肽对DPPH自由基清除活性的影响
Fig.2 Effect of selenium-enriched oyster peptides on DPPH radical scavenging activity 注:不同小写字母代表差异显著(P<0.05),相同代表差异不显著(下同)
2.3.2 ABTS阳离子自由基清除活性
如图3所示,富硒牡蛎肽表现出良好的ABTS阳离子自由基清除活性(EC50:1.074 mg/mL),且在极低质量浓度(0.1 mg/mL)时也显示出ABTS阳离子自由基清除作用,具有显著的剂量效应。富硒牡蛎肽清除ABTS阳离子自由基的能力优于近江牡蛎多肽OP[21](EC50:6.77 mg/mL)。此外,富硒牡蛎肽清除ABTS阳离子自由基的EC50值低于清除DPPH自由基的EC50值,说明富硒牡蛎肽对ABTS阳离子自由基更敏感,能够通过断链反应防止脂质氧化[13]。
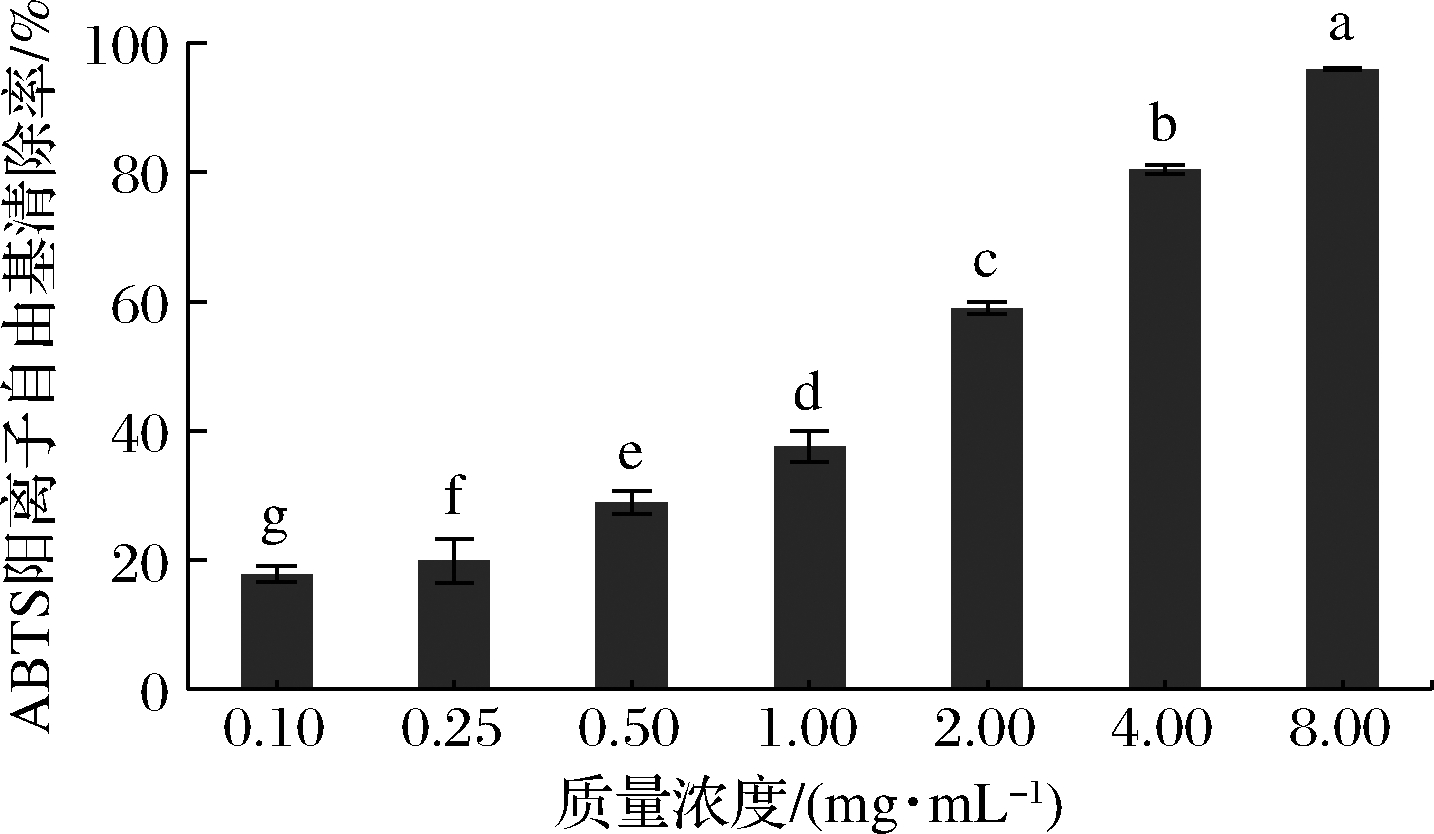
图3 富硒牡蛎肽对ABTS阳离子自由基清除活性的影响
Fig.3 Effect of selenium-enriched oyster peptides on ABTS cation radical scavenging activity
2.3.3 细胞抗氧化能力测定
富硒牡蛎肽对HepG2细胞活力的影响结果见图4-a,在0.5~500 μg/mL质量浓度范围内富硒牡蛎肽对HepG2细胞无毒性作用。因此,选择质量浓度小于500 μg/mL的富硒牡蛎肽进行后续细胞实验。由图4-b可知,即使在极低的质量浓度(0.5 μg/mL)下,富硒牡蛎肽也能发挥细胞抗氧化作用,并且随着浓度的增加,CAA值不断增加,呈现出极低的EC50值(1.114 μg/mL),显著低于兜唇石斛多肽DA-P[EC50=(2.88±0.14) mg/mL][22],这进一步表明富硒牡蛎肽是极好的天然抗氧化剂来源。此外,细胞抗氧化结果与DPPH自由基、ABTS阳离子自由基清除活性结果高度一致,均表现出抗氧化剂浓度依赖性,证明了富硒牡蛎肽是一种稳定高效的抗氧化剂。
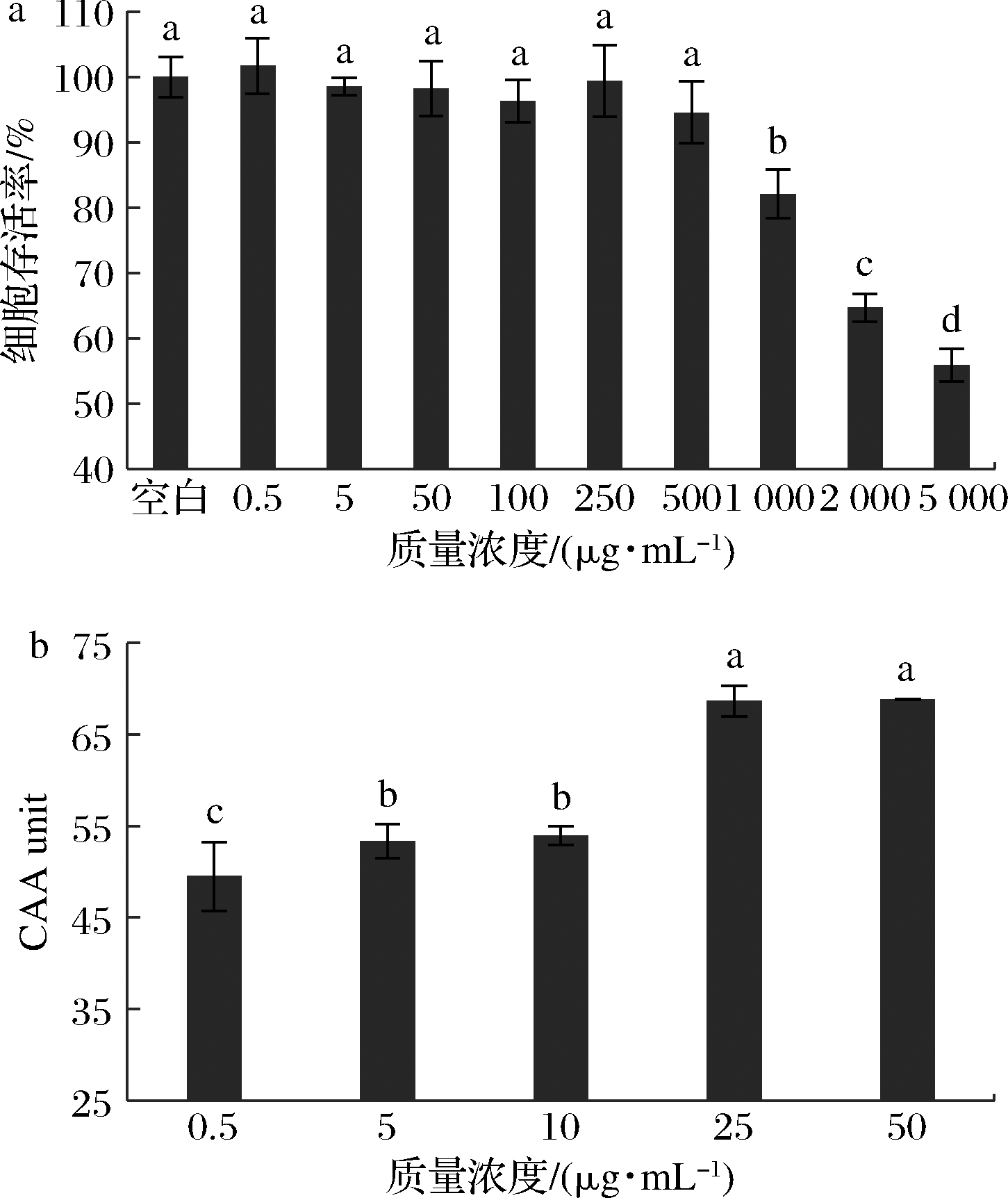
a-不同浓度富硒牡蛎肽作用;b-细胞抗氧化活性
图4 富硒牡蛎肽对HepG2细胞活力的影响及其 细胞抗氧化活性
Fig.4 Effects of selenium-enriched oyster peptides on the viability of HepG2 cells and its cellular antioxidant activity
2.3.4 对HepG2细胞氧化损伤的保护作用
如图5-a所示,随着AAPH作用浓度的增加,细胞活力逐渐降低,当用0.5 mmol/L浓度的AAPH处理细胞24 h,细胞增殖活力降至(75.72±1.12)%,与空白对照组相比具有显著差异(P<0.05),细胞处于适度损伤状态(部分损伤,但未被完全杀死,有损伤修复的可能性)。因此,选择0.5 mmol/L浓度的AAPH作用HepG2细胞24 h,建立AAPH诱导损伤HepG2细胞模型。
不同浓度的富硒牡蛎肽对HepG2细胞损伤保护的结果如图5-b所示,当用不同浓度的富硒牡蛎肽预处理细胞时,细胞存活率随富硒牡蛎肽的质量浓度增加逐渐增加,表明其对氧化损伤细胞的保护作用也越强。当富硒牡蛎肽的浓度≥25 μg/mL时,细胞存活率显著高于损伤组(P<0.05),在100 μg/mL时细胞存活率达到(94.81±1.15)%,几乎可以恢复到空白对照组正常细胞的水平。结果表明富硒牡蛎肽对HepG2细胞的氧化损伤具有很好的保护作用,再次证明牡蛎富硒肽具有优异的抗氧化活性。
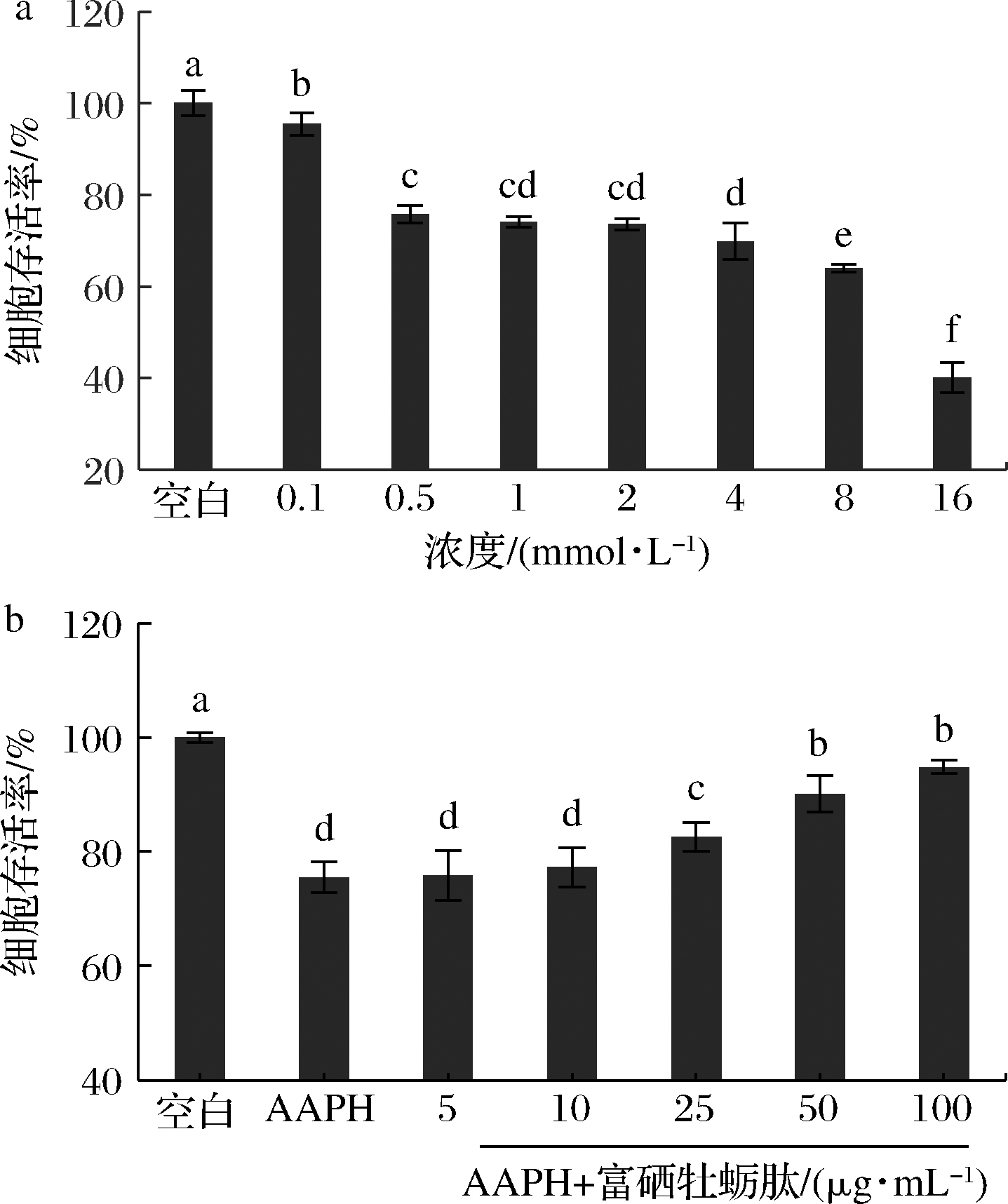
a-不同浓度AAPH处理;b-不同浓度富硒牡蛎肽预处理
图5 AAPH对HepG2细胞活力的影响和富硒牡蛎肽对 HepG2细胞氧化损伤的保护作用
Fig.5 Effect of AAPH on the viability of HepG2 cells and protective effects of selenium-enriched oyster peptides on oxidative damage of HepG2 cells
2.4 ACE抑制活性
已有研究表明,天然活性物的抗氧化活性与降血压活性密切相关,通常抗氧化活性强的活性物多数也具有良好的ACE抑制活性[4-5]。在上述体外化学抗氧化实验和细胞抗氧化实验中发现,富硒牡蛎肽表现出非常显著的抗氧化活性,因此猜测富硒牡蛎肽具有潜在的ACE抑制活性。由图6可知,样品质量浓度从0.10 mg/mL增加到8.00 mg/mL,富硒牡蛎肽的ACE抑制活性显著升高(P<0.05),其IC50值为2.162 mg/mL。富硒牡蛎肽的ACE抑制活性显著高于富硒碱溶性茶蛋白酶解肽(IC50=17.07 mg/mL)[23]和蛋黄蛋白酶解物超滤组分EYUF-2[24](≤2 kDa, IC50=5.44 mg/mL),这进一步确认了本研究的猜测,也与文献已报道的情况相符。本研究表明,富硒牡蛎肽具有良好的ACE抑制活性,具有开发作为降血压类药物的潜力。
本实验的研究结果表明相比于普通蛋白肽,富硒牡蛎肽具有更好的自由基清除能力和细胞抗氧化活性,并对氧化损伤细胞具有较强的保护作用,可作为一种稳定有效的抗氧化剂使用。此外,富硒牡蛎肽表现出良好的ACE抑制活性。分析原因可能是:一方面,海洋来源的牡蛎生物活性肽本身具有优异的抗氧化和降血压效果;另一方面,富硒肽的活性优于普通蛋白肽,有机硒对多肽的生物活性具有协同作用[9]。
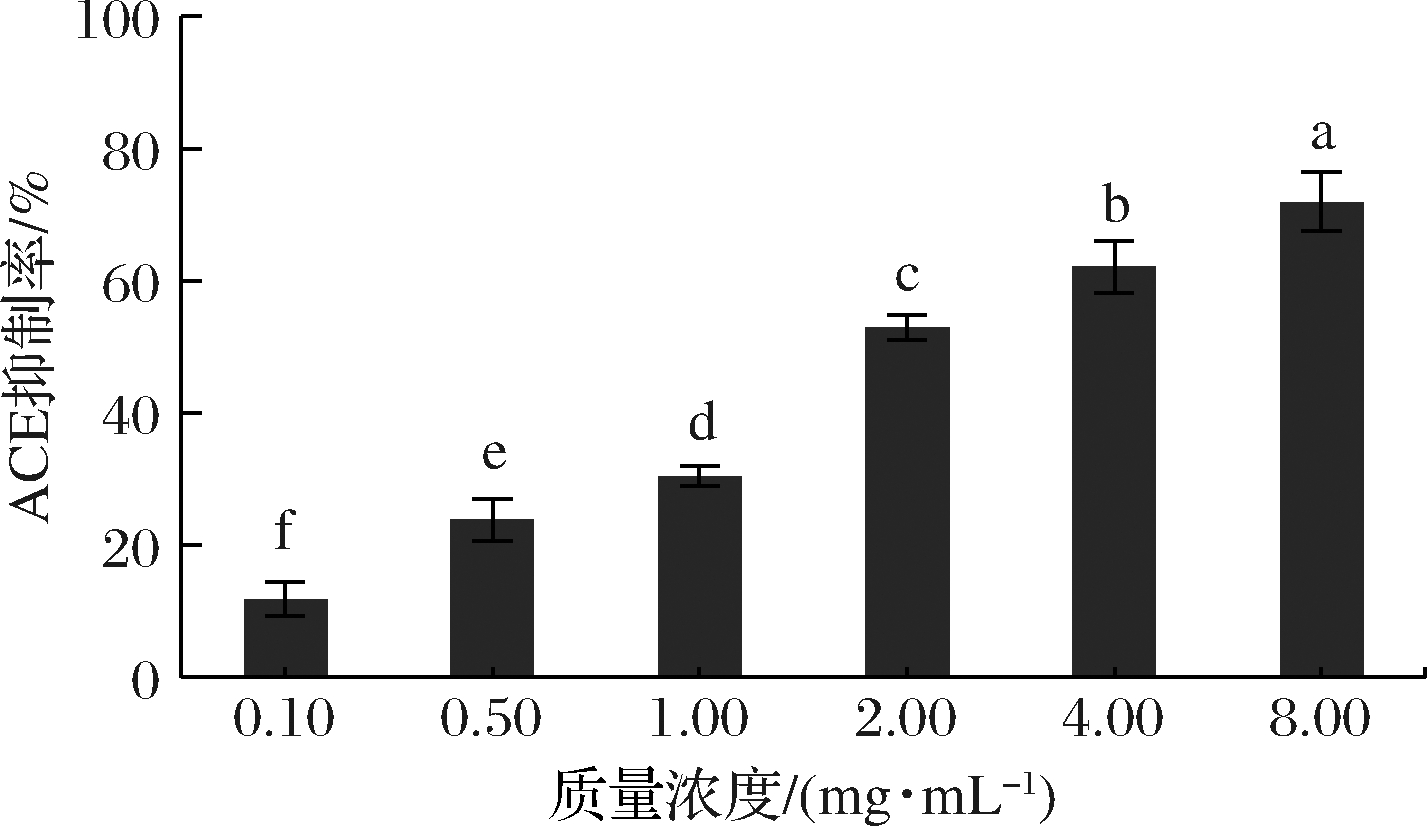
图6 富硒牡蛎肽对ACE抑制活性的影响
Fig.6 Effect of selenium-enriched oyster peptides on ACE inhibitory activity
3 结论
本研究通过响应面方法优化了富硒牡蛎肽的酶解制备工艺,得到最佳酶解条件为时间4 h、温度37 ℃、酶底比0.5%、pH 1.0、底物质量浓度7 g/100mL。氨基酸组成分析表明富硒牡蛎肽富含与抗氧化和ACE抑制活性相关的氨基酸。此外,酶解工艺优化过程中硒的富集也可能是富硒牡蛎肽具有较好的抗氧化和ACE抑制活性的原因。从DPPH自由基和ABTS阳离子自由基清除能力,细胞抗氧化活性和细胞损伤保护方面对富硒牡蛎肽的抗氧化能力进行较全面的评价,并对富硒牡蛎肽的ACE抑制活性进行了探究,结果揭示了富硒牡蛎肽的抗氧化和ACE抑制效果与其浓度呈正相关,明确了富硒牡蛎肽具有较好的抗氧化和ACE抑制活性。本研究首次利用富硒牡蛎开发同时具有抗氧化和ACE抑制活性的富硒肽,后续将对富硒牡蛎肽进行纯化鉴定、体内外活性评价、构效关系研究等,以明确其确切作用机制。
[1] NEHA K, HAIDER M R, PATHAK A, et al.Medicinal prospects of antioxidants:A review[J].European Journal of Medicinal Chemistry, 2019,178:687-704.
[2] ZHENG Y J, WANG X, ZHUANG Y L, et al.Isolation of novel ACE-inhibitory and antioxidant peptides from quinoa bran albumin assisted with an in silico approach:Characterization, in vivo antihypertension, and molecular docking[J].Molecules(Basel,Switzerland), 2019, 24(24):4 562.
[3] WEN C T, ZHANG J, ZHANG H, et al.Plant protein-derived antioxidant peptides:Isolation, identification, mechanism of action and application in food systems:A review[J].Trends in Food Science & Technology, 2020, 105:308-322.
[4] LI M Y, FAN W, XU Y.Identification of angiotensin converting enzyme (ACE) inhibitory and antioxidant peptides derived from Pixian broad bean paste[J].LWT, 2021, 151:112221.
[5] WANG X M, CHEN H, FU X, et al.A novel antioxidant and ACE inhibitory peptide from rice bran protein:Biochemical characterization and molecular docking study[J].LWT, 2017, 75:93-99.
[6] ZHANG X, HE H, XIANG J, et al.Selenium-containing soybean antioxidant peptides:Preparation and comprehensive comparison of different selenium supplements[J].Food Chemistry, 2021, 358:129888.
[7] ZHANG J, ZHOU H C, LI H, et al.Research progress on separation of selenoproteins/Se-enriched peptides and their physiological activities[J].Food & Function, 2021, 12(4):1 390-1 401.
[8] 贾蕾, 向极钎, 殷红清, 等.生物活性硒肽的研究进展[J].食品科学, 2021, 42(15):346-355.
JIA L, XIANG J Q, YIN H Q, et al.Progress in bioactive selenium-containing peptides[J].Food Science, 2021, 42(15):346-355.
[9] GUO H K, GUO S, LIU H.Antioxidant activity and inhibition of ultraviolet radiation-induced skin damage of Selenium-rich peptide fraction from selenium-rich yeast protein hydrolysate[J].Bioorganic Chemistry, 2020, 105:104431.
[10] ZHU S, YANG W, LIN Y, et al.Antioxidant and anti-fatigue activities of selenium-enriched peptides isolated from Cardamine violifolia protein hydrolysate[J].Journal of Functional Foods, 2021, 79:104412.
[11] DONG Z, LIN Y, WU H, et al.Selenium accumulation in protein fractions of Tenebrio molitor larvae and the antioxidant and immunoregulatory activity of protein hydrolysates[J].Food Chemistry, 2021, 334:127475.
[12] MIAO J Y, LIAO W W, KANG M, et al.Anti-fatigue and anti-oxidant activities of oyster (Ostrea rivularis) hydrolysate prepared by compound protease[J].Food & Function, 2018, 9(12):6 577-6 585.
[13] LI Z W, LAN Y, MIAO J, et al.Phytochemicals, antioxidant capacity and cytoprotective effects of jackfruit (Artocarpus heterophyllus Lam.) axis extracts on HepG2 cells[J].Food Bioscience, 2021, 41:100933.
[14] CAO S M, WANG Y, HAO Y J, et al.Antihypertensive effects in vitro and in vivo of novel angiotensin-converting enzyme inhibitory peptides from bovine bone gelatin hydrolysate[J].Journal of Agricultural and Food Chemistry, 2020, 68(3):759-768.
[15] 张靖, 苏琳, 陈晓雨, 等.羊骨抗氧化肽酶解法制备和响应面工艺优化[J].食品与生物技术学报, 2021, 40(3):18-27.
ZHANG J, SU L, CHEN X Y, et al.Optimization of enzymatic preparation of antioxidant peptides from sheep bone by response surface methodology[J].Journal of Food Science and Biotechnology, 2021, 40(3):18-27.
[16] 徐兆刚. 河蚌抗氧化肽的制备及其特性研究[D].长春:吉林大学, 2016.
XU Z G.Research on the preparation and properties of antioxidant peptides from mussel[D].Changchun:Jilin University, 2016.
[17] 郑淋. 抗氧化肽的构效关系及定向制备的研究[D].广州:华南理工大学, 2015.
ZHENG L.Structure-activity relationship and directional preparation of antioxidant peptide[D].Guangzhou:South China University of Technology, 2015.
[18] 张江涛, 冯晓文, 秦修远, 等.海洋蛋白低聚肽的抗氧化与降血压作用[J].中国食品学报, 2020, 20(11):63-70.
ZHANG J T, FENG X W, QIN X Y, et al.Antioxidation and blood pressure lowering effects of marine protein oligopeptides[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(11):63-70.
[19] SAE-LEAW T,O′CALLAGHAN Y C,BENJAKUL S, et al.Antioxidant activities and selected characteristics of gelatin hydrolysates from seabass (Lates calcarifer) skin as affected by production processes[J].Journal of Food Science and Technology, 2016, 53(1):197-208.
[20] TIM N M L, ANDRÉS A I, OTTE J, et al.Antioxidant peptides (<3 kDa) identified on hard cow milk cheese with rennet from different origin[J].Food Research International, 2019, 120:643-649.
N M L, ANDRÉS A I, OTTE J, et al.Antioxidant peptides (<3 kDa) identified on hard cow milk cheese with rennet from different origin[J].Food Research International, 2019, 120:643-649.
[21] 叶昱辉. 近江牡蛎多肽的分离纯化及其抗氧化、抗光老化活性研究[D].广州:华南理工大学, 2018.
YE Y H.Purification of Ostrea rivularis peptides and their antioxidant, antiphotoaging activities[D].Guangzhou:South China University of Technology, 2018.
[22] 刘袆帆. 兜唇石斛免疫活性多糖及抗氧化肽的结构鉴定及功能表征[D].广州:华南理工大学, 2018.
LIU H F.The identification of structure and characterization of immunoregulatory polysaccharide and antioxidative peptides isolated from Dendrobium aphyllumin[D].Guangzhou:South China University of Technology, 2018.
[23] 杜梦珂. 富硒碱性茶蛋白ACE抑制肽的制备、分离纯化及结构鉴定[D].上海:上海师范大学, 2018.
DU M K.Study on the preparation, purification and identification of ACE inhibitory activity peptides from Se-enriched tea protein[D].Shanghai:Shanghai Normal University, 2018.
[24] YOUSR M, HOWELL N.Antioxidant and ACE inhibitory bioactive peptides purified from egg yolk proteins[J].International Journal of Molecular Sciences, 2015, 16(12):29 161-29 178.