脂质积累量超过其生物量20%的一类微生物被称为产油微生物[1]。其中的产油丝状真菌高山被孢霉具有生产高附加值脂肪酸的能力,可积累大量的多不饱和脂肪酸(polyunsaturated fatty acid, PUFAs),尤其是花生四烯酸(arachidonic acid, AA),其AA含量可达总脂肪酸的40%。作为商业化生产AA的最主要来源,高山被孢霉现已被认定为是PUFAs生产中的重要工业化菌株[2],因而受到业界的广泛关注。PUFAs合成的两大关键因素是乙酰辅酶A和还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)[3]。NADPH的供应在产油微生物中引起了极大的研究兴趣。特别是RATLEDGE[4]通过化学计量学评价了产油微生物中苹果酸酶(malic enzyme, ME)和磷酸戊糖途径(pentose phosphate pathway, PPP)对NADPH的贡献,结果得出在某些产油微生物中以上2种途径产生的NADPH不能够满足产脂所需,并认为NADP+依赖型异柠檬酸脱氢酶(NADP-isocitrate dehydrogenase, NADP-IDH)可能是潜在的NADPH供应者。
IDH负责催化异柠檬酸氧化脱羧生成α-酮戊二酸(α-ketoglutaric acid, α-KG)和CO2,还原NAD(P)+为NAD(P)H[5]。根据辅酶依赖性不同可以将IDHs分为NAD-IDHs(EC 1.1.1.41)和NADP-IDHs(EC1.1.1.42)两种类型,前者在三羧酸循环中催化第1个氧化脱羧反应,因此在控制糖、脂质和氨基酸代谢中发挥重要的作用,后者通过合成NADPH以及α-KG,参与抗氧化反应,维持胞内异柠檬酸和α-KG平衡[6-7]。二者在自然界生物中广泛分布,但不同来源的IDH在功能方面存在一定的差异。
产油微生物中的IDH在脂肪酸合成中扮演着重要的角色。WYNN等[8]在探究芝麻酚抑制卷枝毛霉脂肪酸合成机制时,发现胞内NADP-IDH活性在芝麻酚作用后下降57%,NADPH的合成减少影响脂质的积累。产油微生物中主要的NADPH供应者PPP和ME的功能已得到充分的研究,本课题组研究发现高山被孢霉胞质中NADP+依顿型的IDH4(Mortierella alpina isocitrate dehydrogenase4, MaIDH4)的过量表达可以促进脂质的积累[9-12]。但MaIDH4的性质还未得到充分的研究,因此获得高活性高产量的纯酶具有重要的意义。
大肠杆菌(Escherichia coli)和毕赤酵母都是优良的表达宿主,前者具有培养简单、生长快速、遗传背景清晰等特点[13-14],后者具备真核生物共有的胞内环境和亚细胞结构,利于真核来源蛋白活性结构的组装[15]。基于实验室前期的研究结果,本文选择对高山被孢霉脂质积累影响较为明显的MaIDH4进行异源表达,并利用镍柱分离纯化目的蛋白,比较大肠杆菌和毕赤酵母两个宿主中纯酶比活力和酶产量的差异,为深入研究MaIDH4的酶学性质及生产应用奠定基础。
1 材料与方法
1.1 材料与试剂
宿主E.coli Top10、E.coli BL21(DE3)和PichiaPinkTM Strain 2菌株以及表达载体pET28a(+)和pPink-HC均购自Invitrogen公司,携带10×His标签的pPink-HC-3CZHEK是基于pPink-HC改造获得,现保存于江南大学食品生物技术中心。
KOD酶,东洋纺(上海)生物科技有限公司;DNA限制性内切酶,Thermo Fisher公司;DNA-T4连接酶,日本TaKaRa公司;DNA提取试剂盒、质粒提取试剂盒、PCR产物回收试剂盒,天根生化科技有限公司;DL-异柠檬酸三钠盐水合物,麦克林(中国上海);NADP氧化型辅酶Ⅱ,上海生工(中国上海);咪唑,国药沪式(中国上海);用于大肠杆菌和毕赤酵母培养的LB培养基、毕赤酵母腺嘌呤缺陷培养基(pichia adenine dropout, PAD)、缓冲甘油复合培养基(buffered glycerol-complex medium, BMGY)、缓冲甲醇复合培养基(buffered methanol-complex medium, BMMY)、酵母提取物蛋白胨葡萄糖培养基(yeast extract peptone dextrose medium, YPD)的配方,Thermo Fisher Scientific;引物的合成和基因测序由华大基因完成。
1.2 仪器与设备
HR30-IIA2生物安全柜,青岛海尔生物医疗股份有限公司;UV-2450岛津分光光度计,日本岛津公司;GRP-9160隔水式恒温培养箱,上海森信实验仪器有限公司;ZQZY-VAF振荡培养箱,上海知楚仪器有限公司;Tanon化学发光图像分析系统,上海天能科技有限公司;DYY-7C电泳仪电源,北京六一生物科技有限公司;SX-300高压蒸汽灭菌锅,日本Tomy Seiko有限公司;电转化仪,Eppendorf公司;17524701 HisTrapTM HP Ni柱,思拓凡公司;Sorvall ST40R台式冷冻离心机,美国赛默飞世尔科技公司。
1.3 重组菌的构建及诱导表达
1.3.1 重组大肠杆菌的构建及诱导表达
使用MaIDH4特异性引物(表1)和KOD高保真酶扩增高山被孢霉ATCC32222[12]中的目的片段,PCR产物通过核酸电泳进行验证。采用限制性核酸内切酶(Nde Ⅰ和EcoR Ⅰ)对目的基因和载体pET28a(+)进行双酶切处理,酶切产物经DNA-T4连接酶处理构建重组质粒。通过化学转化法将重组质粒[pET28a(+)-MaIDH4]和空载质粒转化到E.coli BL21(DE3)感受态细胞,使用pET28a(+)通用引物(T7引物)对转化子进行PCR验证,并送至公司测序,测序正确的转化子用于后续试验。
表1 引物序列
Table 1 Primer sequences
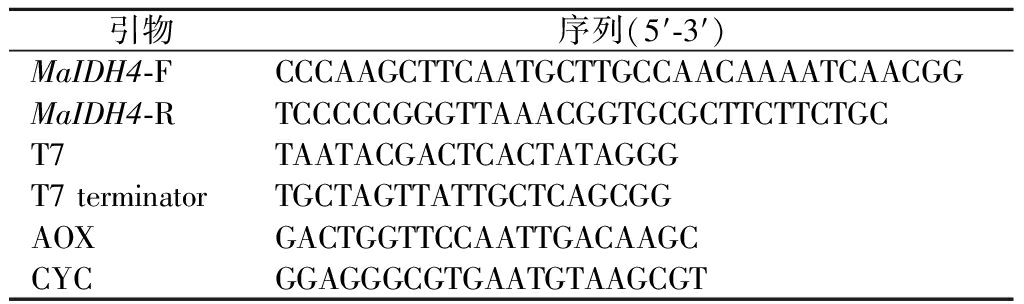
引物序列(5′-3′)MaIDH4-FCCCAAGCTTCAATGCTTGCCAACAAAATCAACGGMaIDH4-RTCCCCCGGGTTAAACGGTGCGCTTCTTCTGCT7TAATACGACTCACTATAGGGT7 terminatorTGCTAGTTATTGCTCAGCGGAOXGACTGGTTCCAATTGACAAGCCYCGGAGGGCGTGAATGTAAGCGT
将重组菌E.coli BL21(DE3)-pET28a(+)-MaIDH4接种于含有Kana的LB培养基中,在37 ℃,200 r/min的条件下培养12 h。随后按1%(体积分数)接种量接种于相同的新鲜LB培养基,使用以上培养条件进行扩大培养,当菌体密度OD600值达到0.6时向培养基中加入异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside, IPTG)(终浓度为0.4 mmol/L),于20 ℃,200 r/min培养16 h以诱导目的蛋白表达,之后于3 000×g离心5 min收集菌体,并保存于-80 ℃冰箱用于后续实验。
使用细胞破碎缓冲液[50 mmol/L磷酸二氢钠,pH 7.4;1 mmol/L苯甲基磺酰氟;5%(体积分数)甘油]回溶菌体,充分混匀后加入玻璃珠,漩涡振荡30 s,冰上静置30 s,重复此破碎步骤8~10次获得全细胞破碎液。将全细胞破碎液于4 ℃,8 000×g条件下离心10 min收集上清液,上清液即为粗酶液。向样品中加入Loading buffer,95 ℃金属浴变性10 min,进行SDS-PAGE和Western-Blot分析。
1.3.2 重组毕赤酵母的构建及诱导表达
采用Stu Ⅰ和EcoR Ⅰ依次消化目的基因和表达载体pPink-HC-3CZHEK,对消化产物进行核酸电泳验证,通过DNA-T4连接酶将二者连接构建重组质粒,采用化学转化法将重组质粒转化到E.coli Top10感受态细胞,挑取转化子进行PCR验证,并送至公司测序。提取空载质粒和阳性转化子中的重组质粒,使用Xag Ⅰ限制性核酸内切酶将其进行线性化,对线性化前后的产物进行核酸电泳验证。将线性化的重组载体和空载质粒电击转化入PichiaPinkTM Strain 2感受态细胞,提取白色转化子的基因组,使用pPink-HC-3CZHEK通用引物(AOX、CYC)进行PCR验证,验证正确的转化子用于后续试验。
挑取阳性转化子接入PAD液体培养基,在28 ℃,200 r/min条件下培养24 h。随后以1%的接种量接种于BMGY培养基,于28 ℃,200 r/min条件下扩大培养36 h。将菌液在4 ℃,1 500×g下离心5 min以去除BMGY培养基,使用BMMY培养基重悬菌体,在28 ℃,200 r/min条件下诱导培养24 h。之后于3 000×g离心5 min收集菌体,并保存于-80 ℃冰箱用于后续实验。重组毕赤酵母细胞破碎方法以及SDS-PAGE和Western-Blot样品制备方法同1.3.1中所述。
1.4 重组蛋白的纯化
1.4.1 大肠杆菌表达系统中目的蛋白的纯化
使用HisTrapTM HP Ni柱纯化目的蛋白,所有纯化操作均在4 ℃下完成。粗酶液经0.22 μm的水系滤膜过滤后用于后续亲和纯化。首先使用结合缓冲液(20 mmol/L磷酸钠缓冲液,500 mmol/L NaCl,pH 7.4)进行柱平衡,然后将过滤后的粗酶液加载到Ni柱中,结合缓冲液过柱去除非特异性结合的杂蛋白,后面依次通过含有100、200、350 mmol/L咪唑的洗脱液(20 mmol/L磷酸钠缓冲液,500 mmol/L NaCl,不同浓度的咪唑,5%甘油,pH 7.4),收集所有的过柱流出组分。通过透析去除纯化产物中的高浓度盐离子并置换缓冲体系,透析液(50 mmol/L Tris-HCl,5%甘油)更换3次依次透析2、4、12 h。对纯化过程中的每个流出组分进行SDS-PAGE分析,确定产物的纯度,并对分子质量进行验证。制备丙烯酰胺质量浓度分别为50 g/L和100 g/L的浓缩胶和分离胶用于电泳分析。使用BCA试剂盒对蛋白浓度进行定量。
1.4.2 毕赤酵母表达系统中目的蛋白的纯化
毕赤酵母的纯化方法同大肠杆菌,纯化过程所使用的细胞破碎液和结合缓冲液中需添加100 mmol/L咪唑。
1.5 酶活性分析
酶活力测定方法参考文献[16],并略有改动。反应体系包含Tris-HCl(82.2 mmol/L,pH 8.0)、MnCl2/MgCl2(3 mmol/L)、NADP氧化型辅酶Ⅱ(0.6 mmol/L)、DL-异柠檬酸三钠盐水合物(5 mmol/L),混合以上物质于30 ℃孵育2 min,添加酶液启动反应,然后在岛津UV-2450 UV-VIS分光光度计340 nm处监测NADPH的生成。酶活力单位定义为每分钟生成1 μmol的NADPH所需要的酶量。所有数据来自3个平行处理。
2 结果与分析
2.1 重组大肠杆菌的构建和目的蛋白的鉴定
以高山被孢霉cDNA为模板使用特异性引物扩增目的片段,PCR产物的核酸电泳结果如图1-a所示,泳道1的1 000~1 200 bp附近处出现明显的条带,这与MaIDH4基因的理论大小(1 233 bp)一致,表明成功扩增目的基因片段。重组质粒转化E.coli BL21感受态细胞获得转化子,利用载体的通用引物对转化子进行PCR验证,结果如图1-b所示,条带出现在1 500 bp附近,这与理论值(1 510 bp)接近(PCR结果等于目的基因减去终止密码子后的1 230 bp 加上含有6×His标签的载体片段280 bp,因此PCR的条带大小与目的基因的条带大小一致),转化子经测序验证正确,表明重组菌株E.coli BL21-pET28a(+)-MaIDH4构建成功。
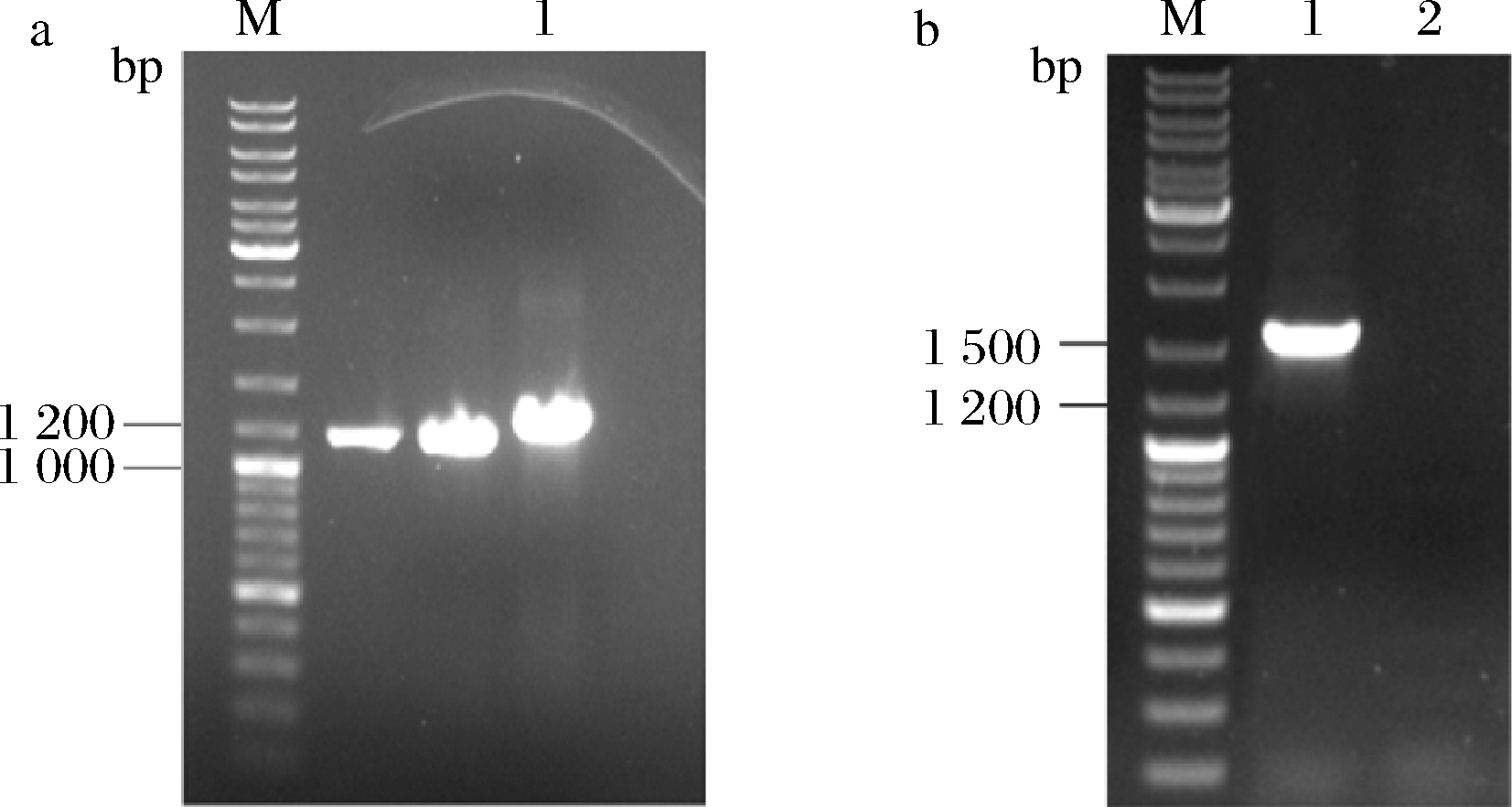
M-Marker a-MaIDH4 PCR扩增产物(1-目的基因PCR扩增产物); b-重组菌转化子PCR验证结果[1-重组菌BL21-pET28a(+)- MaIDH4转化子;2-阴性对照菌BL21-pET28a(+)转化子]
图1 目的基因扩增及重组大肠杆菌转化子鉴定结果
Fig.1 Amplification of target gene and identification of recombinant E.coli transformants
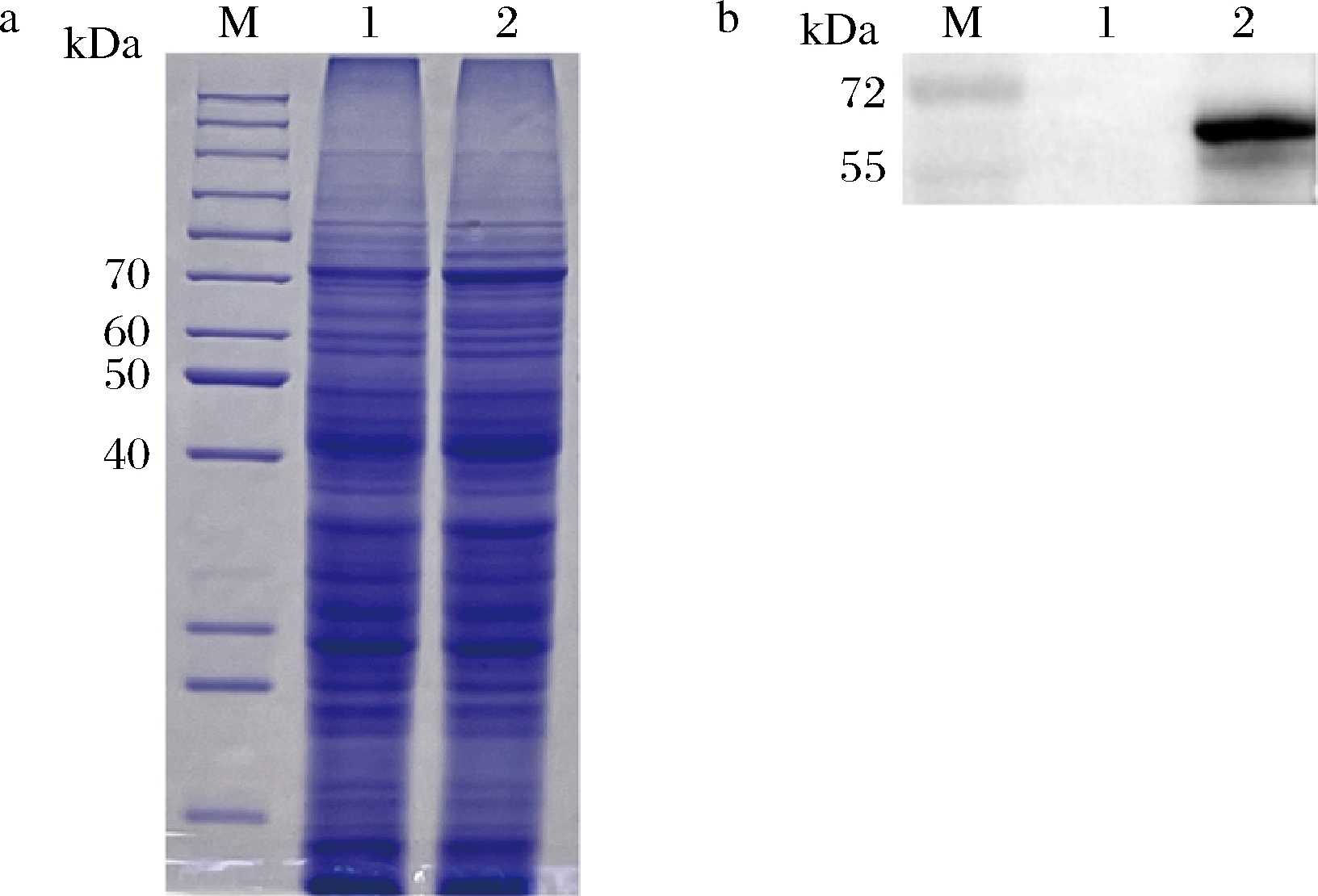
重组菌在IPTG诱导下表达目的蛋白。SDS-PAGE和Western-Blot结果如图2所示,条带出现在40~55 kDa附近,这与理论值46 kDa相一致,表明MaIDH4在E.coli BL21(DE3)中成功表达。
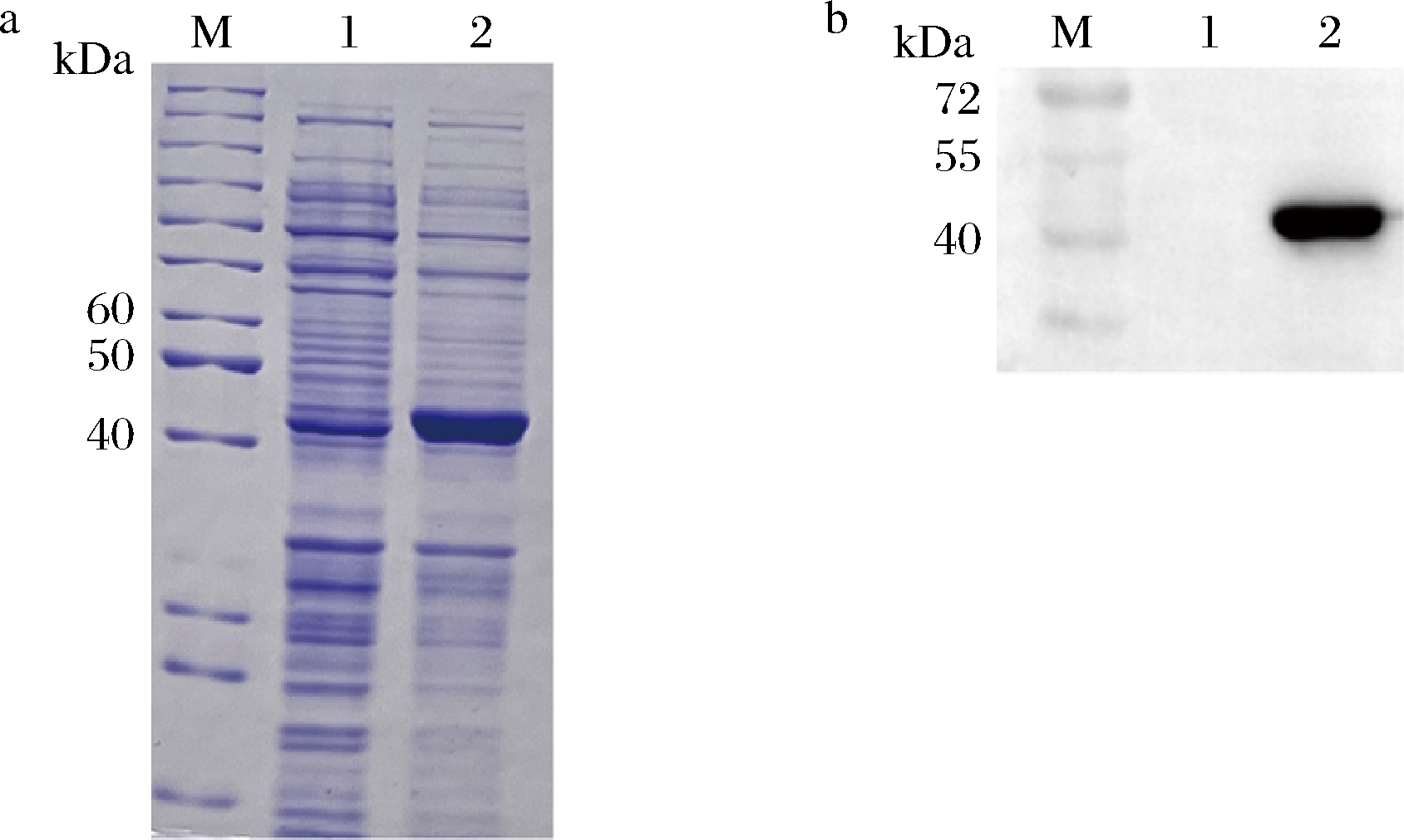
M-Marker;1-阴性对照菌E.coli BL21-pET28a(+) 细胞破碎液;2-重组菌E.coli BL21-pET28a(+)-MaIDH4 细胞破碎液 a-SDS-PAGE结果;b-Western-Blot结果
图2 目的蛋白诱导表达结果
Fig.2 The results of target protein induction expression
2.2 重组毕赤酵母的构建和目的蛋白的鉴定
将扩增获得的目的基因和载体pPink-HC-3CZHEK进行双酶切处理,酶切结果如图3-a和图3-b所示,酶切产物条带大小与预期值相符(1 233、8 156 bp)表明双酶切成功。重组质粒转化E.coli Top 10获得转化子,利用载体的通用引物对转化子进行PCR验证,结果如图3-c所示,条带位于2 000 bp左右这与理论值1 929 bp相接近(PCR结果等于目的基因减去终止密码子后的1 230 bp加上含有10×His标签和HRV 3C蛋白酶A的载体片段699 bp,因此PCR的条带大小与目的基因的条带大小一致),转化子经测序验证正确,表明重组菌株E.coli Top10-pPink-HC-3CZHEK-MaIDH4构建成功。
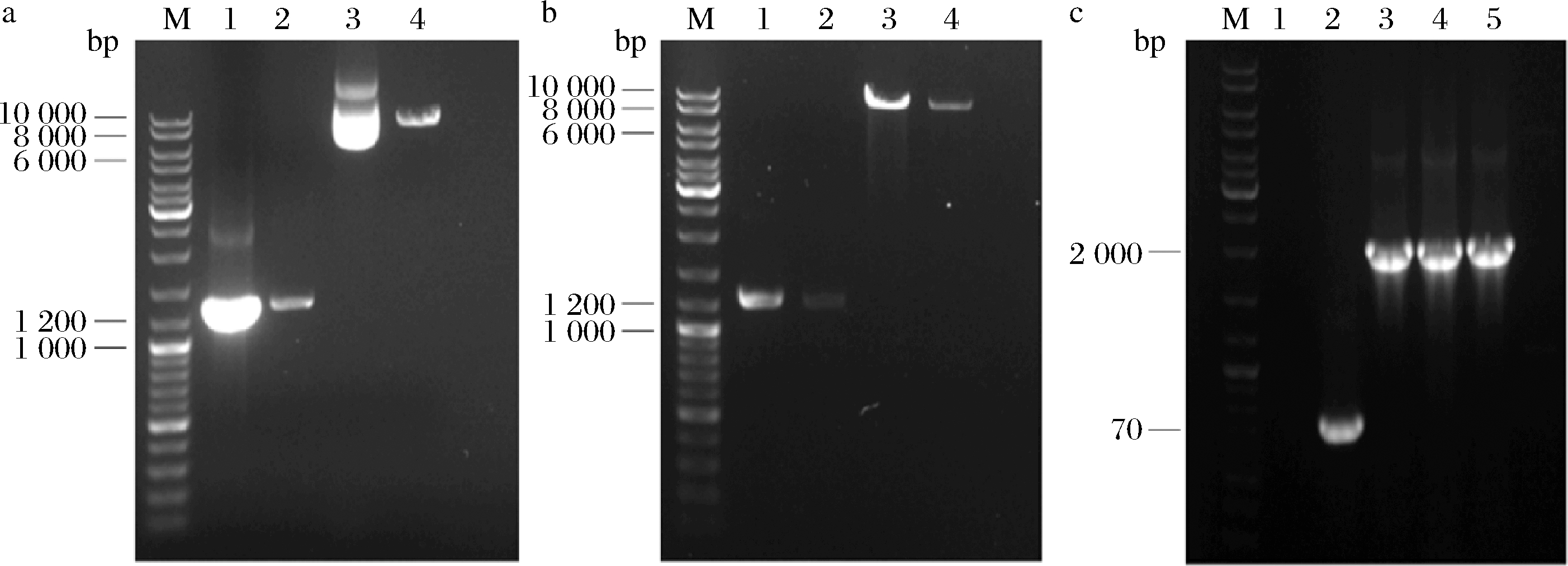
M-Marker a-Stu Ⅰ酶切结果(1-目的基因经Stu Ⅰ酶切前;2-目的基因经Stu Ⅰ酶切后;3-载体经Stu Ⅰ酶切前;4-载体经Stu Ⅰ酶切后);b-EcoR Ⅰ 酶切结果(1-目的基因经EcoR Ⅰ酶切前;2-目的基因经EcoRⅠ酶切后;3-载体经EcoR Ⅰ酶切前;4-载体经EcoR Ⅰ酶切后);c-转化子PCR 验证结果(1-空白反应体系;2-E.coli Top10-pPink-HC-3CZHEK转化子;3~5-E. coli Top10-pPink-HC-3CZHEK-MaIDH4转化子)
图3 酶切及转化子鉴定结果
Fig.3 The results of enzyme digestion and transformants identification
空载质粒和重组质粒经Xag Ⅰ线性化的核酸电泳结果如图4-a所示,条带在8 000~10 000 bp时与理论值(8 179、9 394 bp)相符合。线性化产物分别转化PichiaPinkTM Strain 2感受态细胞获得转化子,利用载体的通用引物对转化子的基因组进行PCR,其结果如图4-b所示,条带在2 000 bp附近时与理论值(1 929 bp)一致,表明重组菌PichiaPinkTM-pPink-HC-3CZHEK-MaIDH4构建成功。
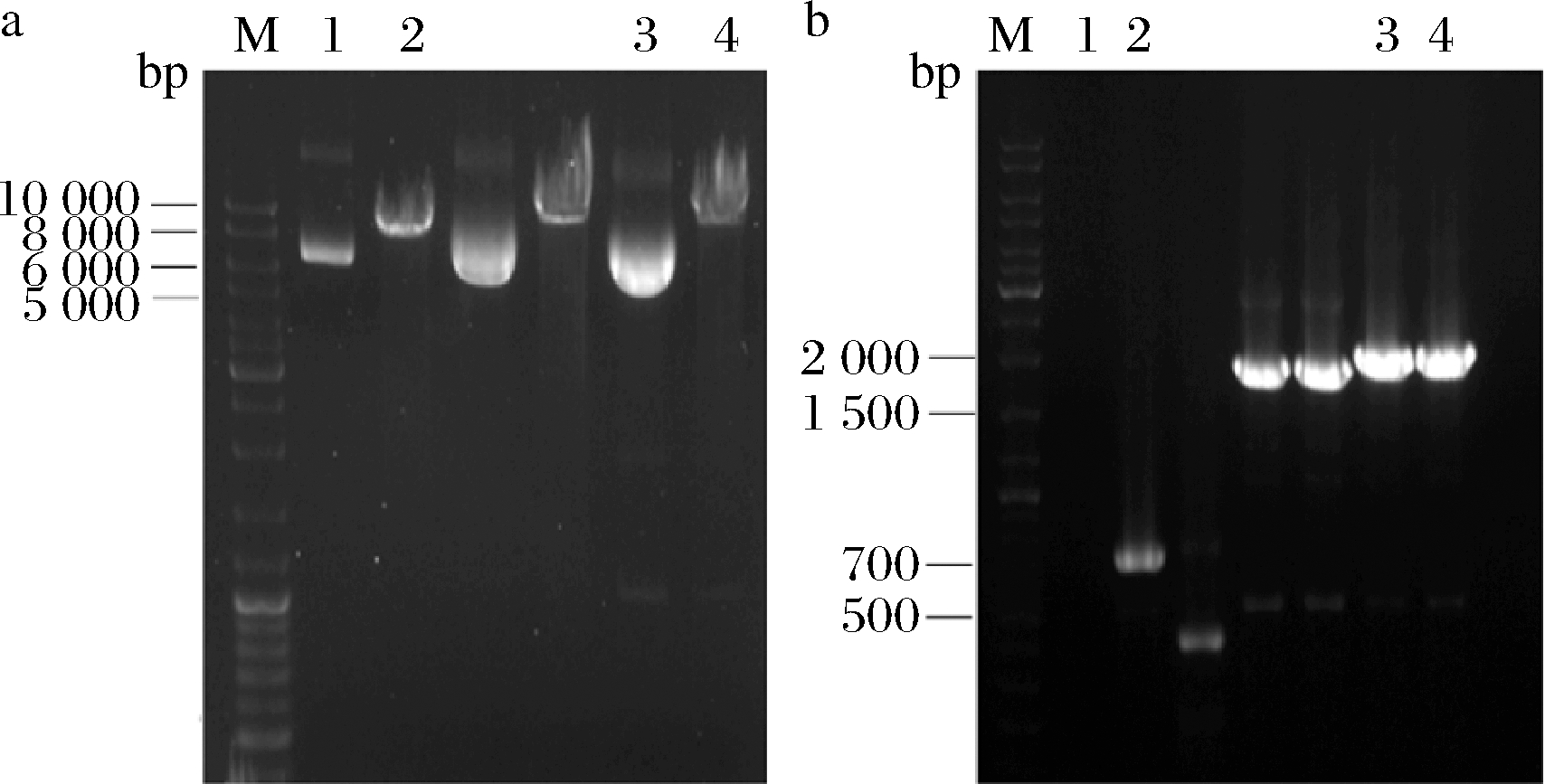
M-Marker a-重组质粒线性化结果(1-pPink-HC-3CZHEK经Xag Ⅰ酶切前; 2-pPink-HC-3CZHEK经Xag Ⅰ酶切后;3-pPink-HC-3CZHEK-MaIDH4 经Xag Ⅰ酶切前;4-pPink-HC-3CZHEK-MaIDH4经Xag Ⅰ酶切后;b-重组 菌转化子基因组PCR验证结果(1-空白反应体系;2-PichiaPinkTM- pPink-HC-3CZHEK转化子;3~4-PichiaPinkTM-pPink-HC-3CZHEK- MaIDH4转化子)
图4 线性化及转化子鉴定结果
Fig.4 The results of linearization and transformants identification
重组菌诱导培养结束,通过SDS-PAGE和Western-Blot对菌体样本进行分析,结果如图5所示。Western-Blot结果显示重组蛋白的条带出现在55~72 kDa附近,这与理论分子质量67 kDa接近,表明外源蛋白MaIDH4在PichiaPinkTM Strain 2中成功表达。由于二者使用的载体不同,大肠杆菌使用pET28a(+),毕赤酵母使用pPink-HC-3CZHEK,除了目的基因外,大肠杆菌表达载体中包括6×His标签表达元件,毕赤酵母表达载体包括10×His标签和HRV 3C蛋白酶A表达元件,导致翻译出来的蛋白质分子质量存在差异。pPink-HC-3CZHEK是在高拷贝质粒pPink-HC基础上加入10×His标签,相比于pET28a(+)中的6×His标签更利于目的蛋白与Ni柱结合。另外,宿主细胞PichiaPinkTMStrain 2是在腺嘌呤缺陷型基础上敲除了pep4基因,pep4的敲除可减少目的蛋白的水解,利用回补ADE2的pPink-HC质粒和营养缺陷型培养基来筛选转化子,相对于抗生素筛选更加方便,另外在蛋白表达放大试验中能够保持转化子的稳定性[17-18]。MaIDH4来源于真核生物高山被孢霉,这也是选择真核表达系统毕赤酵母的一个重要原因。
2.3 不同表达系统对MaIDH4表达效果的影响
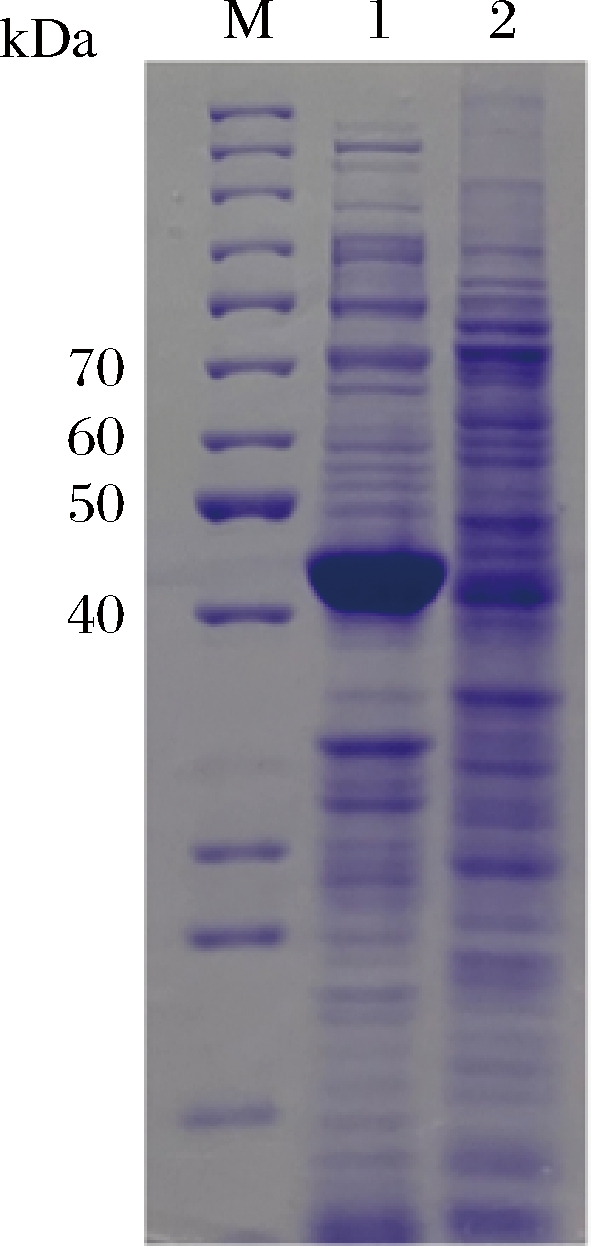
为探究MaIDH4在大肠杆菌和毕赤酵母两个表达系统中的蛋白表达情况,采用SDS-PAGE检测等质量蛋白(15 μg)上样的情况下,2个表达系统中目的蛋白的表达水平差异。由图6可知,在总蛋白质量一致的情况下,目的蛋白在大肠杆菌总蛋白中占比相对较高,主要因为大肠杆菌表达系统的总蛋白量较少,而毕赤酵母表达系统中总蛋白量较多,因此,目的蛋白在毕赤酵母总蛋白中占比相对较小。
M-Marker;1-阴性对照菌PichiaPinkTM-pPink-HC-3CZHEK细胞破碎液, 2-重组菌PichiaPinkTM-pPink-HC-3CZHEK-MaIDH4细胞破碎液 a-SDS-PAGE结果;b-Western-Blot结果
图5 目的蛋白诱导表达结果
Fig.5 The results of target protein induction expression
M-Marker;1-重组菌E.coli BL21-pET28a(+)-MaIDH4 细胞破碎液;2-重组菌PichiaPinkTM-pPink-HC-3CZHEK- MaIDH4细胞破碎液
图6 不同表达系统中MaIDH4蛋白表达水平结果
Fig.6 The results of MaIDH4 protein expression in different expression systems
2.4 重组蛋白的纯化与鉴定
2.4.1 大肠杆菌表达系统目的蛋白的纯化与鉴定
重组菌E.coli BL21-pET28a(+)-MaIDH4中目的蛋白的纯化结果如图7所示,在泳道7出现单一条带证明了产物的纯度,其大小在40~50 kDa,这与理论值(46 kDa)相一致。
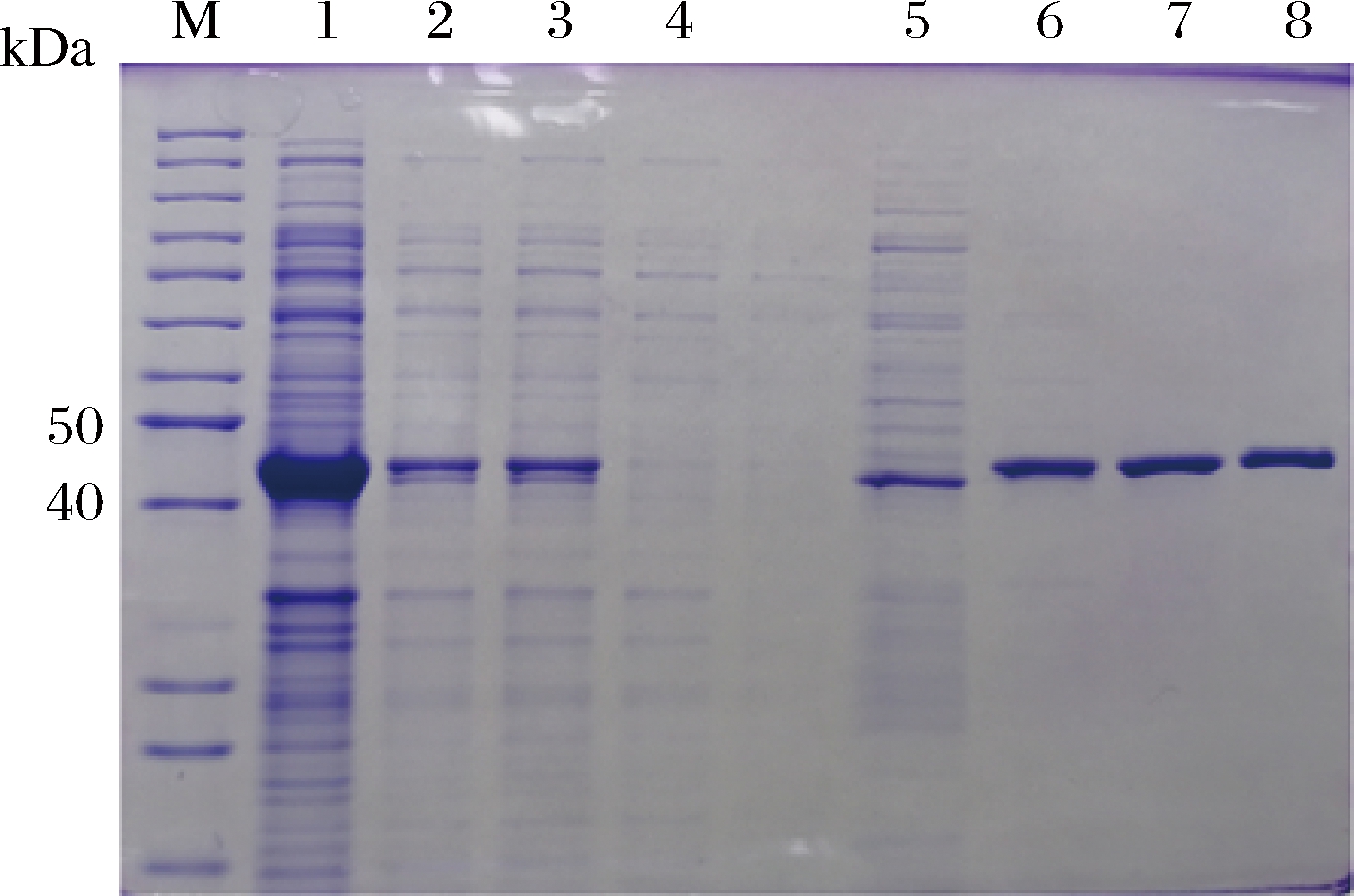
M-Marker;1-全细胞破碎液;2-粗酶液;3-粗酶过滤液 (0.22 μm);4-过柱流出液;5-含100 mmol/L咪唑的洗脱液; 6-含200 mmol/L咪唑的洗脱液;7~8-含350 mmol/L咪唑的洗脱液
图7 大肠杆菌重组菌目的蛋白的纯化
Fig.7 Purification of target proteins from E.coli BL21(DE3) recombinant strains
2.4.2 毕赤酵母表达系统目的蛋白的纯化与鉴定
重组菌PichiaPinkTM-pPink-HC-3CZHEK-MaIDH4中目的蛋白的纯化结果如图8所示。目的蛋白主要出现在含有350 mmol/L咪唑的洗脱液中,泳道13中出现单一条带证明了产物的纯度,条带大小位于60~70 kDa,这与理论分子质量(67 kDa)基本一致。相比于大肠杆菌重组酶,毕赤酵母重组酶的纯化相对复杂,毕赤酵母总蛋白量高于大肠杆菌,因此在酶纯化过程中需要提前加入100 mmol/L的咪唑以减少杂蛋白与Ni柱的结合。
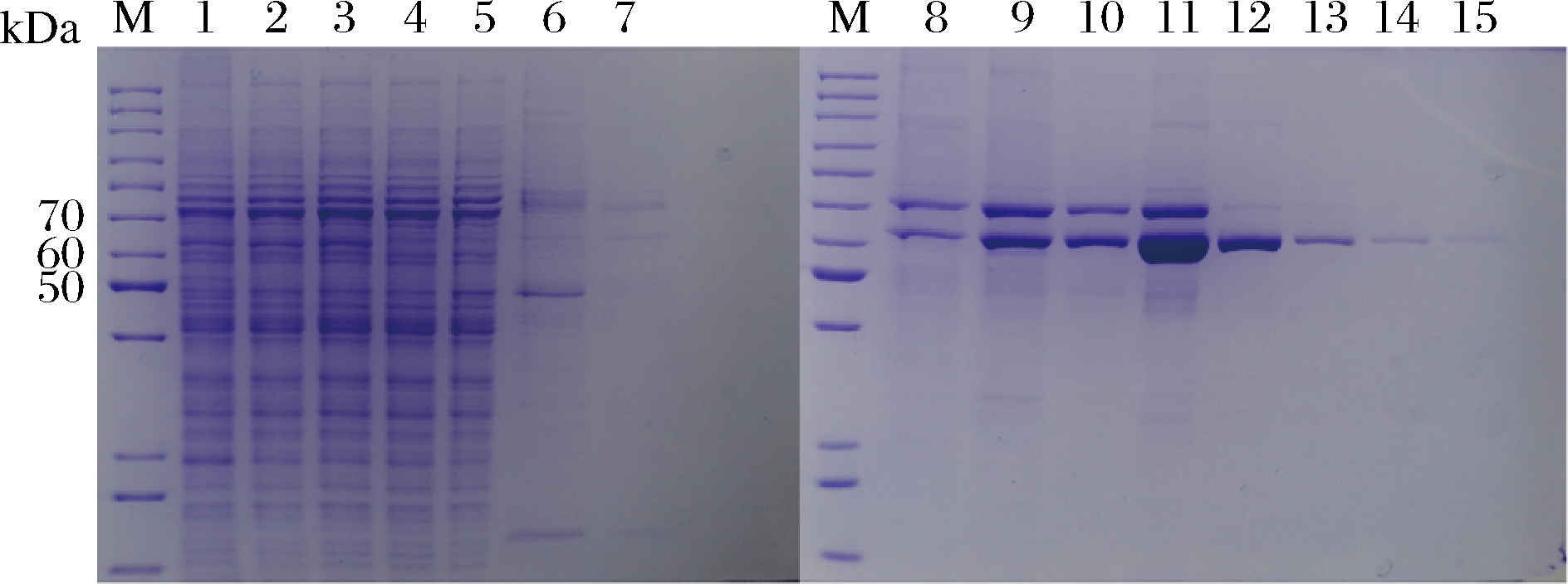
M-Marker;1-全细胞破碎液;2-粗酶液;3-粗酶过滤液 (0.22 μm);4-过柱流出液;5~7-含100 mmol/L咪唑的洗脱液; 8~10-含200 mmol/L咪唑的洗脱液;11~15-含350 mmol/L 咪唑的洗脱液
图8 毕赤酵母重组菌目的蛋白的纯化
Fig.8 Purification of target proteins from PichiaPink recombinant strains
2.5 不同表达系统对纯酶活性的影响
对不同表达系统的纯酶比活力和酶产量进行测定,结果如表2所示,毕赤酵母表达系统中的纯酶比活力和酶产量分别是大肠杆菌的1.3倍和15.5倍,毕赤酵母表达系统在这2个方面均优于大肠杆菌。因此毕赤酵母为MaIDH4的最佳表达宿主。真核表达体系毕赤酵母具有严格接受甲醇诱导而进行转录的醇氧化酶I启动子利于外源基因的控制表达,强有力呼吸系统可促进细胞的高密度生长[19],并且具备很多高级真核生物翻译后的修饰,利于外源蛋白活性结构的形成[20]。而大肠杆菌缺乏一些高级真核生物所具备的翻译后修饰功能,进而影响重组蛋白的稳定性和活性。另外,大肠杆菌缺乏真核生物中的一些稀有密码子,导致相关蛋白的表达提前终止[21]。MaIDH4更适合在毕赤酵母中表达,这一点与抗病毒蛋白RC28、黄曲霉毒素B1单链抗体以及木聚糖酶相一致[22-24]。这些可能是因为真核表达系统的翻译后修饰机制利于蛋白活性形式的组装。
表2 不同表达体系的MaIDH4活性和产量差异
Table 2 Differences in MaIDH4 activity and yield of different expression systems
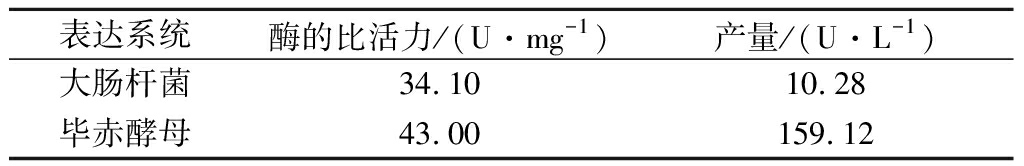
表达系统酶的比活力/(U·mg-1)产量/(U·L-1)大肠杆菌34.1010.28毕赤酵母43.00159.12
3 结论
丝状真菌高山被孢霉具有较强的脂肪酸合成能力,现已成为一个重要的脂质合成模式生物。作为还原力供应者之一的胞质NADP-IDH在PUFAs生产中发挥着一定的作用。目前关于高山被孢霉来源的MaIDH4还未得到表征,本研究在大肠杆菌表达系统和毕赤酵母表达系统中分别表达和纯化了MaIDH4,比较了2个系统的纯酶活性及酶产量的差异,确定了毕赤酵母为MaIDH4的优良表达宿主,该宿主更具大规模发酵的优势,这为MaIDH4的酶学性质研究奠定了坚实的基础。
[1] RATLEDGE C, WYNN J P.The biochemistry and molecular biology of lipid accumulation in oleaginous microorganisms[J].Advances in Applied Microbiology, 2002, 51:1-52.
[2] HIGASHIYAMA K, FUJIKAWA S, PARK E Y, et al.Production of arachidonic acid by Mortierella fungi[J].Biotechnology and Bioprocess Engineering, 2002, 7(5):252-262.
[3] CHANG L L, LU H Q, CHEN H Q, et al.Lipid metabolism research in oleaginous fungus Mortierella alpina:Current progress and future prospects[J].Biotechnology Advances, 2022, 54:107794.
[4] RATLEDGE C.The role of malic enzyme as the provider of NADPH in oleaginous microorganisms:A reappraisal and unsolved problems[J].Biotechnology Letters, 2014, 36(8):1 557-1 568.
[5] LOSMAN J A, KAELIN W G.What a difference a hydroxyl makes:Mutant IDH, (R)-2-hydroxyglutarate, and cancer[J].Genes & Development, 2013, 27(8):836-852.
[6] YANG E S, RICHTER C, CHUN J S, et al.Inactivation of NADP(+)-dependent isocitrate dehydrogenase by nitric oxide[J].Free Radical Biology and Medicine, 2002, 33(7):927-937.
[7] CONTRERAS-SHANNON V, LIN A P, MCCAMMON M T, et al.Kinetic properties and metabolic contributions of yeast mitochondrial and cytosolic NADP(+)-specific isocitrate dehydrogenases[J].Journal of Biological Chemistry, 2005, 280(6):4 469-4 475.
[8] WYNN J P, KENDRICK A, RATLEDGE C.Sesamol as an inhibitor of growth and lipid metabolism in Mucor circinelloides via its action on malic enzyme[J].Lipids, 1997, 32(6):605-610.
[9] HAO G F, CHEN H Q, WANG L, et al.Role of malic enzyme during fatty acid synthesis in the oleaginous fungus Mortierella alpina[J].Applied and Environmental Microbiology, 2014, 80(9):2 672-2 678.
[10] ZHAO L N, TANG X, LUAN X, et al.Role of pentose phosphate pathway in lipid accumulation of oleaginous fungus Mucor circinelloides[J].RSC Advances, 2015, 5(118):97 658-97 664.
[11] HAO G F, CHEN H Q, GU Z N, et al.Metabolic engineering of Mortierella alpina for enhanced arachidonic acid production through the NADPH-supplying strategy[J].Applied and Environmental Microbiology, 2016, 82(11):3 280-3 288.
[12] TANG X, SUN X Q, WANG X X, et al.Characterization of NAD+/NADP+-specific isocitrate dehydrogenases from oleaginous fungus Mortierella alpina involved in lipid accumulation[J].Frontiers in Nutrition, 2021, 8:746342.
[13] 刘丽琴, 陈婷婷, 李少伟, 等.大肠杆菌表达系统在基因工程疫苗研发中的应用与策略优化[J].中国新药杂志, 2020, 29(21):2 434-2 442.
LIU L Q, CHEN T T, LI S W, et al.Escherichia coli expression system applied in the development of recombinant human vaccines and its potential improvement[J].Chinese Journal of New Drugs, 2020, 29(21):2 434-2 442.
[14] YANG D, PARK S Y, PARK Y S, et al.Metabolic engineering of Escherichia coli for natural product biosynthesis[J].Trends in Biotechnology, 2020, 38 (7):745-765.
[15] CREGG J M.Introduction:Distinctions between Pichia pastoris and other expression systems[J].Methods in molecular biology (Clifton, N.J.), 2007, 389:1-10.
[16] WYNN J P, RATLEDGE C.Malic enzyme is a major source of NADPH for lipid accumulation by Aspergillus nidulans[J].Microbiology, 1997, 143(1):253-257.
[17] LI B Z, CAO Y Q, ZHOU L J, et al.A novel protein expression system-PichiaPink(TM)-and a protocol for fast and efficient recombinant protein expression[J].African Journal of Biotechnology, 2011, 10(83):19 464-19 472.
[18] HIGGINS D R.Overview of protein expression in Pichia pastoris[J].Current Protocols in Protein Science, 2001, Chapter 5: Unit5.7.
[19] INAN M, ARYASOMAYAJULA D, SINHA J, et al.Enhancement of protein secretion in Pichia pastoris by overexpression of protein disulfide isomerase[J].Biotechnology and Bioengineering, 2006, 93(4):771-778.
[20] CREGG J M, CEREGHINO J L, SHI J, et al.Recombinant protein expression in Pichia pastoris[J].Molecular Biotechnology, 2000, 16(1):23-52.
[21] FERRER-MIRALLES N, DOMINGO-ESP N J, CORCHERO J L, et al.Microbial factories for recombinant pharmaceuticals[J].Microbial Cell Factories, 2009, 8:17.
N J, CORCHERO J L, et al.Microbial factories for recombinant pharmaceuticals[J].Microbial Cell Factories, 2009, 8:17.
[22] 胡立强, 郑文, 钟艺, 等.抗病毒蛋白RC28在大肠杆菌和毕赤酵母中的表达及活性比较[J].中国生物工程杂志, 2017, 37(1):14-20.
HU L Q, ZHENG W, ZHONG Y, et al.Comparison of expression and activity of antiviral protein RC28 in Escherichia coli and Pichia pastoris[J].China Biotechnology, 2017, 37(1):14-20.
[23] 胡莉, 王小红.抗黄曲霉毒素B1单链抗体在大肠杆菌和毕赤酵母中的表达和活性研究[J].生物学杂志, 2018, 35(1):26-31.
HU L, WANG X H.Comparison of expression and activity of anti-AFB1 scFv in Escherichia coli and Pichia pastoris[J].Journal of Biology, 2018, 35(1):26-31.
[24] 周晨妍, 刘振华, 王丹丹, 等.木聚糖酶Xyn43A基因在大肠杆菌及毕赤酵母中的表达比较[J].食品与发酵工业, 2016, 42(6):15-19.
ZHOU C Y, LIU Z H, WANG D D, et al.Expression of xylanase Xyn43A gene in Escherichia coli and Pichia pastoris[J].Food and Fermentation Industries, 2016, 42(6):15-19.