生物胺(biogenic amines, BA)是一类低分子含氮化合物,普遍存在于富含蛋白质的食品和含酒精的发酵饮料中,一般经由氨基酸脱羧酶对相应的氨基酸进行脱羧化反应生成。食品中常见的BA包括色胺、腐胺、酪胺、组胺、精胺、尸胺等[1]。适量的BA有助于人体正常的生理功能,过量则会引起头痛、恶心、呕吐、腹泻、心悸、血压变化、呼吸紊乱等过敏反应,严重时会危及生命[2]。
樱桃味道鲜美、营养丰富且具有药用价值,但是随着引种栽培规模的不断扩大,鲜樱桃已出现供过于求的局面[3]。由于樱桃采摘期短,不易保存,容易受到微生物侵染以致腐败变质,由此造成的经济损失每年达上亿元[4]。将樱桃酿制成樱桃酒是解决上述难题的有效途径,符合国家倡导的“压缩粮食酒,发展水果酒”政策,也符合消费者追求天然、营养果酒的趋势[5]。
近年来樱桃酒在果酒市场的占比日渐增加,但有关其BA问题的相关研究却未引起重视,存在一定的安全隐患。据报道,樱桃酒发酵过程中会产生多种BA,以腐胺为主,此外还有一定量的组胺、亚精胺和色胺[6]。樱桃酒中的 BA 可能来源于酿造原料,也可能经由多个酿造阶段产生[7],例如果皮浸渍、酒精发酵、苹果酸乳酸发酵、陈酿等,其中苹果酸乳酸发酵和陈酿是导致BA合成或积累的主要阶段。如果发酵过程中卫生条件控制不力,导致混入带有氨基酸脱羧酶的污染菌,或者个别生产过程处理不得当,如酵母酒泥与樱桃酒长期共储、未及时分离等,则有可能导致酒体 BA 含量快速增加[8]。在食品体系中加入能够降解 BA 的酶类是近几年来新兴起的方法,这是降解果酒中已有BA的一种新的思路,具有高效性、经济性和专一性,已经引起了众多研究者的关注[9]。本课题组在前期研究中从自筛的一株植物乳杆菌中通过分离纯化获得了一种全新的BA降解酶——三磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase, GAPDH)[10],并在大肠杆菌中克隆和表达其基因活性,从而证实了该酶降解 BA 的新功能[11]。重组 GAPDH 在 pH 5.5 和 40 ℃ 条件下降解组胺的活性最强,并且对樱桃酒的限制因素(SO2、乙醇)有很强的抵抗力。但是,游离 GAPDH 与大多数酶分子一样,稳定性不高,而且在实际生产过程中无法实现重复利用,导致生产成本过高,所以在工业化应用中受到了极大的限制。
固定化酶可提高酶的稳定性,降低生产成本,是解决上述问题的有效手段。近年来,具有纳米尺寸的磁性Fe3O4纳米粒子(magnetic nanoparticles, MNPs)成为固定化酶领域研究的新热点,这是因为其具有优异的机械稳定性和较大的比表面积,易于功能化修饰,能够在外部磁场下快速地分离,生物相容性良好,因而极大地简化了固定化酶的回收和再利用[12-13]。本课题组在获得重组GAPDH的基础上,对其在磁性Fe3O4纳米粒子的固定化也进行了系统研究,发现对Fe3O4-MNPs进行表面改性后可以将GAPDH固定在Fe3O4-APTES纳米粒子上,从而成功制备了GAPDH@Fe3O4固定化酶。固定化酶的酸碱稳定性和热稳定性分别提高到4.5~8.5和50~60 ℃[14],但是有关其在樱桃酒环境中的实际作用效果还需要进一步研究。本文测试该固定化酶在樱桃酒陈酿阶段的应用,其在脱除BA的同时是否对酒体的各项指标,包括基本理化指标、挥发性组分、非挥发性酚类物质产生影响,以及固定化酶重复使用的批次问题。之所以选择在樱桃酒的陈酿阶段进行GAPDH@Fe3O4降解BA效果的测试,主要原因在于可以将之前产生BA的所有生产过程,包括皮渣浸渍、酒精发酵、苹果酸乳酸发酵等生成的BA[7]在该阶段进行统一处理,能够有效节约GAPDH@Fe3O4的使用成本。本文开启了有关固定化酶实际应用的相关研究,可以弥补以往针对固定化酶只关注酶的制备和催化活性方面研究的不足,将研究范围扩大到实际的食品体系,从新的视角解析了固定化酶的应用效果,对同类研究也具有良好的借鉴作用。此外,本文的研究结果有望为GAPDH@Fe3O4在果酒中的规模化应用奠定先期数据基础,也是将其开发成为商业化酶制剂进程中的必须过程。
1 材料与方法
1.1 试剂
腐胺、尸胺、精胺、酪胺、亚精胺、组胺、苯乙胺、色胺、丹磺酰氯(纯度均≥99%),Sigma公司;没食子酸、原儿茶酸、2,3,4-三羟基苯甲酸、新绿原酸、对羟基苯甲酸、绿原酸(均为色谱级),上海麦克林生化科技有限公司;甲醇、乙腈(均为色谱纯),美国TEDIA天地试剂公司。
1.2 实验方法
1.2.1 GAPDH@Fe3O4的制备
GAPDH制备参考SUN等[11]的方法制备并保存在实验室中。Fe3O4-MNPs根据共沉淀法合成。将FeCl2·4H2O(1.0 g)和FeCl3·6H2O(2.7 g)溶解于50 mL水中,然后向溶液中逐滴添加25%(体积分数)氨水,直到pH值达到12。接着将溶液在70 ℃搅拌3 h,用磁铁收集黑色产物,洗涤并真空干燥过夜。在超声波作用下,采用Stober法合成了氨基官能化Fe3O4纳米粒子。将0.5 g Fe3O4纳米颗粒分散在150 mL乙醇中。然后连续添加25%氨水(2.5 mL)、超纯水(40 mL)和正硅酸乙酯(0.5 mL)机械搅拌12 h。将收集的纳米颗粒洗涤并分散在200 mL异丙醇中,继续添加1.5 mL 3-氨丙基三甲氧基硅烷(3-aminopropyltriethoxysilane,APTES)(50 mL异丙醇中)。在40 ℃机械搅拌12 h,用永磁铁收集。接着将制得的氨基包覆的Fe3O4-MNPs溶解在磷酸盐缓冲液(0.1 mol/L,pH 7.0)中,使质量浓度达到10 mg/mL,然后在40 kHz下超声处理15 min,然后加入1.0%(体积分数)戊二醛溶液,在40 ℃下搅拌30 min。通过永磁体收集得到的Fe3O4-APTES-戊二醛,并用磷酸盐缓冲液(0.1 mol/L,pH 7.0)洗涤3次。将Fe3O4-APTES-戊二醛按照40 mg/mL先加入到无外源BA的樱桃酒样中静置5 h,反应结束后,使用永磁铁将其回收,再用磷酸盐缓冲液(0.1 mol/L,pH 7.0)洗涤3次。之后将Fe3O4-APTES-戊二醛络合物(8 mg/mL)添加到GAPDH溶液(3 mg/mL)中固定1.5 h,结束后使用永磁铁分离GAPDH@Fe3O4纳米颗粒,并用磷酸盐缓冲液(0.1 mol/L,pH 7.0)洗涤3次。
1.2.2 樱桃酒的制备
挤压新鲜樱桃成樱桃浆,加入SO2和果胶酶,并使二者的质量浓度分别达到50、30 mg/L。25 ℃下反应6 h后,加入蔗糖,使还原糖质量浓度达到200 g/L。将经过预处理的樱桃浆输入发酵罐中,接种商业化酿酒酵母Lalvin D254,接种量为250 mg/L,25 ℃恒温发酵,间隔6~8 h循环搅拌,直至总糖质量浓度<4 g/L。发酵结束后,8 000 r/min离心取出樱桃清酒,再次加入SO2至其质量浓度为30 mg/L。将樱桃清酒再次置于发酵罐中,调整温度至20 ℃,进行自然苹果酸乳酸发酵。利用苹果酸检测试剂盒测定酒中的苹果酸浓度,待苹果酸质量浓度<0.5 g/L,12 000 r/min离心取出樱桃酒,输入陈酿罐中,并加入SO2至其质量浓度为50 mg/L。陈酿2个月后,从罐中取出樱桃酒,用于GAPDH@Fe3O4降解BA的试验。
1.2.3 固定化酶在樱桃酒中的应用
1.2.3.1 GAPDH@Fe3O4去除樱桃酒中BA的研究
本文测试GAPDH@Fe3O4对8种常见BA的降解效果。由于自制樱桃酒中的BA含量较低,故外源添加了6种胺类(色胺、苯乙胺、尸胺、精胺、组胺、亚精胺),加入量均为5 mg/L,而酪胺(4.102 mg/L)和腐胺(8.528 mg/L)含量较高,因此不需再补充。将此污染的樱桃酒样品等分为20 份,作为GAPDH@Fe3O4降解BA试验的试材。每份污染的樱桃酒样品为5 mL,向其中加入200 mg GAPDH@Fe3O4,然后置于18 ℃下密闭反应5 h,期间每间隔1 h轻微振荡樱桃酒,使固定化酶与酒样充分混合。平行反应进行2次。反应结束后用永磁铁回收固定化酶,并用PBS缓冲液(20 mmol/L,pH 7.4)将回收的GAPDH@Fe3O4清洗3次用于后续的樱桃酒降胺反应。
1.2.3.2 GAPDH@Fe3O4重复使用性试验
对GAPDH@Fe3O4重复使用性进行测试。在每一轮次试验中,将200 mg GAPDH@Fe3O4置于5 mL污染的樱桃酒样中密闭反应5 h,而后立即回收、洗涤固定化酶,并再次投入其他盛有5 mL污染樱桃酒的烧杯中,开启下一批次的BA降解试验。同样的反应过程共计进行10轮次,每轮次设有2个平行样品。
每轮次BA降解反应完成后,立即将处理后的樱桃酒样置于4 ℃冰箱中,用于后续的基本理化指标、挥发性组分和非挥发性酚类物质的测定。
1.2.4 樱桃酒分析方法
1.2.4.1 樱桃酒基本理化指标分析
樱桃酒中的还原糖、总酸、挥发酸的含量依据GB/T 15038—2006《葡萄酒、果酒通用分析方法》进行测定,具体方法:采用斐林试剂法测定还原糖;采用氢氧化钠滴定法测定总酸和挥发酸;酒精度依据GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》中的密度瓶法进行测定;使用酸度计测定酒体的pH值。
1.2.4.2 樱桃酒挥发性组分测定
参考LIU[15]的方法,采用FlavourSpec®气相离子迁移谱仪(具备自动顶空进样器、分析软件和定性软件)测定樱桃酒样中的挥发性香气物质。
顶空进样条件:取1 mL的樱桃酒样置于20 mL的顶空小瓶中,60 ℃孵育10 min,进样量为100 μL,进样针温度设为65 ℃。
GC条件:载气为氮气(纯度≥99.999%),初始流速设定2 mL/min,维持2 min后上升,10 min上升至10 mL/min,20 min上升至100 mL/min,持续10 min。
离子迁移谱(ion mobility spectrometry,IMS)条件:漂移气为氮气(纯度≥99.999%),流速150 mL/min,漂移管长度98 mm,温度45 ℃,放射源为3H,正离子化模式。使用FlavourSpec®气相离子迁移谱仪自带的LAV软件及NIST和IMS数据库对挥发性香气化合物定性分析。
1.2.4.3 樱桃酒中非挥发性酚类物质的测定
将樱桃酒通过0.22 μm尼龙过滤膜过滤后,直接进样。采用HPLC对非挥发性酚类物质进行分离、鉴定。具体色谱操作条件如下:色谱柱:Besil C18-H(250 mm×4.6 mm,5 μm);柱温:25 ℃;流动相:A相为水相[0.1%(体积分数)的三氟乙酸],B相由纯甲醇与纯乙腈按体积比1∶1混合而成;流速1 mL/min;进样体积10 μL;检测波长:UV 280 nm;温度30 ℃;梯度:20~40 min 12%~18% B,40~45 min 18%~22% B,45~60 min 22%~35% B,60~65 min 35%~45% B,65~75 min 45%~80% B,75~80 min 80%~5% B,80~92 min 5% B。
通过比较标准品和样品的出峰时间及光谱图对非挥发性酚类物质进行鉴定,计算出峰面积,根据保留时间,以各样品的进样浓度为横坐标,峰面积为纵坐标进行标准曲线绘制,对各类组分进行定量。
1.2.4.4 樱桃酒中BA的测定
参考LIU等[16]的方法,将樱桃酒使用丹磺酰氯衍生后,通过0.22 μm尼龙过滤膜过滤上清液,然后进行HPLC分析,樱桃酒中的BA浓度通过高效液相色谱-氢火焰离子化检测器(high performance liquid chromatography-flame ionization detector, HPLC-FID)测定。在FLD探测器中,激发波长和发射波长分别设置为320、523 nm。乙腈和超纯水分别为溶剂A和溶剂B。梯度曲线为0~5 min,65%~70% A;5~20 min,70%~100% A;24~25 min,100%~65% A;25~40 min,65% A。
BA的鉴定是通过比较其保留时间与相应的标准。樱桃酒样品中BA的定量是通过峰面积比(每种BA/内标物)与每种BA浓度的标准曲线进行的。
1.2.4.5 樱桃酒感官质量分析
樱桃酒感官评价小组由11位具有果酒品评经验的老师和同学(7名女性,4名男性,年龄22~49岁)组成。在正式品评之前,小组成员先接受樱桃酒描述性感官分析的培训,通过进行多次检验与讨论,品评小组确定了樱桃酒中主要的香气属性特征,包括整体香气、水果香、花香、甜香和辛辣气味。品评实验在感官评价室进行,室温20 ℃,通风良好。品评者采取10点制打分,0表示无,9表示特征性最强[17]。香气分值在0~3为低强度,3~6为中等强度,6~9为高强度。
1.3 统计分析
为了保证实验的准确性,每个指标至少进行3次平行测定。采用SPSS Statistics 25.0软件对获取的各指标数据做方差分析(ANOVA)和显著性差异(P<0.05)分析。
2 结果与分析
本文的研究目的在于测试GAPDH@Fe3O4固定化酶在樱桃酒陈酿中的实际应用效果,特别关注对BA的降解作用、对酒体各项指标的影响以及固定化酶重复利用批次。本研究共测试了GAPDH@Fe3O4重复利用1~10次后对樱桃酒体的影响,但为了表述和比较方便,取固定化酶第1次使用(IT-1)、第5次使用(IT-5)和第10次使用(IT-10)的结果列于本文中,并与未进行GAPDH@Fe3O4处理的样品(ES)为对照。详细结果见下文。
2.1 GAPDH@Fe3O4对降解樱桃酒BA的影响
GAPDH@Fe3O4重复使用1次、5次和10次后,利用HPLC法测定樱桃酒的BA含量,结果如表1所示。4种酒样均检测出8种BA,分别为色胺、苯乙胺、尸胺、精胺、组胺、酪胺、亚精胺和腐胺。在添加完外源BA后,检测到ES中腐胺的含量最高(8.528 mg/L),其次是色胺(5.974 mg/L)、组胺(5.897 mg/L)、精胺(5.729 mg/L)、亚精胺(5.646 mg/L)、苯乙胺(5.442 mg/L)、尸胺(4.822 mg/L)和酪胺(4.102 mg/L)。在使用GAPDH@Fe3O4处理后,樱桃酒的BA浓度明显降低。与ES相比,在IT-1中,BA降解率达到了28.54%,其中色胺、苯乙胺、尸胺、精胺、组胺、酪胺、亚精胺、腐胺的降解率分别达到了28.9%、55.2%、35.0%、27.0%、28.0%、18.8%、21.4%、18.6%;在IT-5中,上述各BA的降解率分别为22.3%、33.1%、18.0%、17.7%、21.0%、17.4%、19.4%、10.5%,总BA降解率为19.4%,与IT-1相比降解率下降了9.5%;在IT-10中,上述各BA的降解率分别为8.6%、17.1%、14.3%、11.1%、15.9%、8.5%、13.2%、6.4%,总BA降解率仍有11.6%。由上述数据看出,随着循环次数的增多,GAPDH@Fe3O4降解BA的活性出现了下降,这可能与溶液环境干扰了GAPDH的构象、酶稳定性被破坏[18]、酶分子与纳米颗粒逐渐脱离有关,但仍然维持了基本的活性,说明经过反复利用的GAPDH@Fe3O4结构仍比较稳定。
表1 GAPDH@Fe3O4重复利用批次下樱桃酒BA含量
Table 1 Biogenic amines content in cherry wines treated with reuse batch of GAPDH@Fe3O4
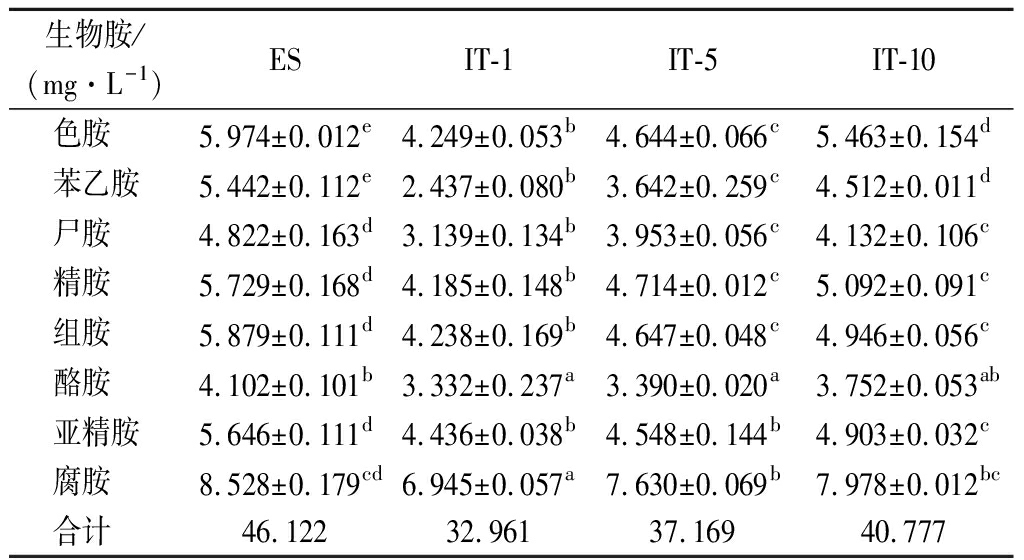
生物胺/(mg·L-1)ESIT-1IT-5IT-10色胺 5.974±0.012e4.249±0.053b4.644±0.066c5.463±0.154d苯乙胺5.442±0.112e2.437±0.080b3.642±0.259c4.512±0.011d尸胺 4.822±0.163d3.139±0.134b3.953±0.056c4.132±0.106c精胺 5.729±0.168d4.185±0.148b4.714±0.012c5.092±0.091c组胺 5.879±0.111d4.238±0.169b4.647±0.048c4.946±0.056c酪胺 4.102±0.101b3.332±0.237a3.390±0.020a3.752±0.053ab亚精胺5.646±0.111d4.436±0.038b4.548±0.144b4.903±0.032c腐胺 8.528±0.179cd6.945±0.057a7.630±0.069b7.978±0.012bc合计 46.12232.96137.16940.777
注:同行不同小写字母(a~e)表示差异显著(P<0.05)(下同)
近年来,利用磁性纳米粒子为载体制备固定化酶成为了固定化酶研究领域研究的热点,国内外相关报道逐渐增多。LIU等[19]用共沉淀法合成了由APTES修饰的Fe3O4纳米粒子,并成功地将α-葡萄糖苷酶直接共价固定在了该纳米粒子上。与游离酶相比,固定化α-葡萄糖苷酶的耐酸碱度和热稳定性均略有提高,也表现出了良好的重复利用性,经7次循环利用后,剩余活性仍达到66%。GUPTA等[20]将脂肪酶固定在磁性纳米颗粒上,进行酯化反应,在温和的条件下其最大转化率达到82.7%,重复5次后转化率仍然可以达到80.2%。上述研究结果与本文的研究结果趋势相同,说明利用Fe3O4磁性纳米粒子为载体制备固定化酶具有BA容性良好、易于回收等优势,值得在相关领域进行更深入的研究和应用。本研究制备的GAPDH@Fe3O4具有BA降解效率高、操作简便、成本可控等优点,具备在食品领域进行推广应用的潜力。
2.2 樱桃酒中基本理化指标分析
GAPDH@Fe3O4多批次处理结束后,立即测定樱桃酒的基本理化指标,结果如表2所示。所有样品的还原糖含量在2.17~2.20 g/L,酒精度均在11.4%vol左右,pH在3.40~3.41,总酸含量在8.36~8.38 g/L,挥发酸质量浓度为0.47 g/L。表2中的数据表明樱桃酒在投入GAPDH@Fe3O4处理后,基本理化指标没有发生明显变化,说明固定化酶对酒体指标没有负面作用。
表2 GAPDH@Fe3O4重复利用批次对 樱桃酒理化指标的影响
Table 2 Effect of GAPDH@Fe3O4 reuse batch on physicochemical indexes of cherry wine

基本理化指标ESIT-1IT-5IT-10酒精度/%vol11.40±0.1a11.40±0.1a11.40±0.1a11.30±0.1a还原糖/(g·L-1)2.19±0.04a2.21±0.04a2.17±0.04a2.20±0.04a总酸/(g·L-1)8.37±0.02a8.36±0.02a8.38±0.02a8.36±0.02a挥发酸/(g·L-1)0.47±0.01a0.48±0.01a0.47±0.01a0.47±0.01apH3.40±0.1a3.41±0.1a3.40±0.1a3.40±0.1a
2.3 樱桃酒挥发性组分分析
GAPDH@Fe3O4多批次处理结束后,利用GC-IMS对樱桃酒的挥发性香气组分进行检测,从樱桃酒中共鉴定出37种挥发性化合物,其中酯类物质10种、醇类物质10种、醛类物质5种、酮类物质3种、酸类物质3种、萜烯及杂环类6种。每组样品中每个物质的平均浓度及标准偏差如表3所示。
表3 GC-IMS分析樱桃酒中挥发性化合物的信号强度
Table 3 Signal intensities of volatile compounds in Cherry wine by GC-IMS
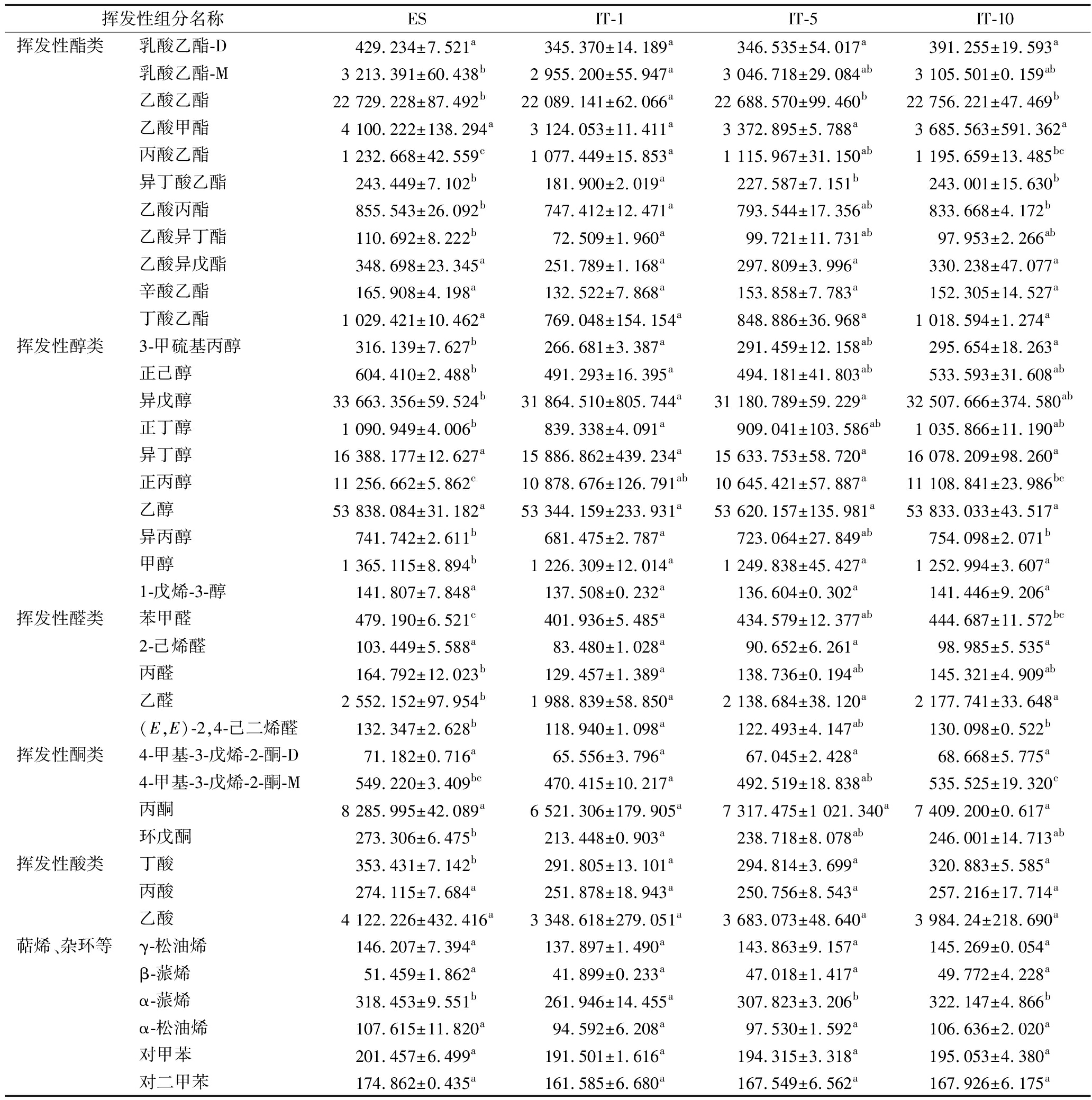
挥发性组分名称ESIT-1IT-5IT-10挥发性酯类乳酸乙酯-D429.234±7.521a345.370±14.189a346.535±54.017a391.255±19.593a乳酸乙酯-M3 213.391±60.438b2 955.200±55.947a3 046.718±29.084ab3 105.501±0.159ab乙酸乙酯22 729.228±87.492b22 089.141±62.066a22 688.570±99.460b22 756.221±47.469b乙酸甲酯4 100.222±138.294a3 124.053±11.411a3 372.895±5.788a3 685.563±591.362a丙酸乙酯1 232.668±42.559c1 077.449±15.853a1 115.967±31.150ab1 195.659±13.485bc异丁酸乙酯243.449±7.102b181.900±2.019a227.587±7.151b243.001±15.630b乙酸丙酯855.543±26.092b747.412±12.471a793.544±17.356ab833.668±4.172b乙酸异丁酯110.692±8.222b72.509±1.960a99.721±11.731ab97.953±2.266ab乙酸异戊酯348.698±23.345a251.789±1.168a297.809±3.996a330.238±47.077a辛酸乙酯165.908±4.198a132.522±7.868a153.858±7.783a152.305±14.527a丁酸乙酯1 029.421±10.462a769.048±154.154a848.886±36.968a1 018.594±1.274a挥发性醇类3-甲硫基丙醇316.139±7.627b266.681±3.387a291.459±12.158ab295.654±18.263a正己醇604.410±2.488b491.293±16.395a494.181±41.803ab533.593±31.608ab异戊醇33 663.356±59.524b31 864.510±805.744a31 180.789±59.229a32 507.666±374.580ab正丁醇1 090.949±4.006b839.338±4.091a909.041±103.586ab1 035.866±11.190ab异丁醇16 388.177±12.627a15 886.862±439.234a15 633.753±58.720a16 078.209±98.260a正丙醇11 256.662±5.862c10 878.676±126.791ab10 645.421±57.887a11 108.841±23.986bc乙醇53 838.084±31.182a53 344.159±233.931a53 620.157±135.981a53 833.033±43.517a异丙醇741.742±2.611b681.475±2.787a723.064±27.849ab754.098±2.071b甲醇1 365.115±8.894b1 226.309±12.014a1 249.838±45.427a1 252.994±3.607a1-戊烯-3-醇141.807±7.848a137.508±0.232a136.604±0.302a141.446±9.206a挥发性醛类苯甲醛479.190±6.521c401.936±5.485a434.579±12.377ab444.687±11.572bc2-己烯醛103.449±5.588a83.480±1.028a90.652±6.261a98.985±5.535a丙醛164.792±12.023b129.457±1.389a138.736±0.194ab145.321±4.909ab乙醛2 552.152±97.954b1 988.839±58.850a2 138.684±38.120a2 177.741±33.648a(E,E)-2,4-己二烯醛132.347±2.628b118.940±1.098a122.493±4.147ab130.098±0.522b挥发性酮类4-甲基-3-戊烯-2-酮-D71.182±0.716a65.556±3.796a67.045±2.428a68.668±5.775a4-甲基-3-戊烯-2-酮-M549.220±3.409bc470.415±10.217a492.519±18.838ab535.525±19.320c丙酮8 285.995±42.089a6 521.306±179.905a7 317.475±1 021.340a7 409.200±0.617a环戊酮273.306±6.475b213.448±0.903a238.718±8.078ab246.001±14.713ab挥发性酸类丁酸353.431±7.142b291.805±13.101a294.814±3.699a320.883±5.585a丙酸274.115±7.684a251.878±18.943a250.756±8.543a257.216±17.714a乙酸4 122.226±432.416a3 348.618±279.051a3 683.073±48.640a3 984.24±218.690a萜烯、杂环等γ-松油烯146.207±7.394a137.897±1.490a143.863±9.157a145.269±0.054aβ-蒎烯51.459±1.862a41.899±0.233a47.018±1.417a49.772±4.228aα-蒎烯318.453±9.551b261.946±14.455a307.823±3.206b322.147±4.866bα-松油烯107.615±11.820a94.592±6.208a97.530±1.592a106.636±2.020a对甲苯201.457±6.499a191.501±1.616a194.315±3.318a195.053±4.380a对二甲苯174.862±0.435a161.585±6.680a167.549±6.562a167.926±6.175a
酯类物质既呈香也呈味,是酒类中重要的风味化合物。由表3可知,酯类物质中乙酸乙酯和乙酸甲酯所占比例较高,它们具有花香、甜香和果味,是樱桃酒果香的重要来源[21]。对于樱桃酒的挥发性酯类物质来说,与ES相比,GAPDH@Fe3O4多批次处理后,部分物质的含量发生了下降。例如,IT-1中,乳酸乙酯、异丁酸乙酯、乙酸异丁酯、乙酸异戊酯、丁酸乙酯的信号强度分别下降了19.5%、25.3%、34.5%、27.8%、25%,而乙酸甲酯、丙酸乙酯、乙酸丙酯、辛酸乙酯的信号强度几乎未发生改变。IT-5中各物质的信号强度的损失率均小于IT-1,其中乳酸乙酯、异丁酸乙酯、乙酸异丁酯、乙酸异戊酯、丁酸乙酯的信号强度分别下降了19.3%、6.5%、10%、14.6%、17.5%,同样地,乙酸甲酯、丙酸乙酯、乙酸丙酯、辛酸乙酯的信号强度也未发生改变。而在IT-10中,除乳酸乙酯和乙酸异丁酯的信号强度分别下降了8.8%和11.5%外,其余挥发性酯类的信号强度与ES相比均无变化。
本研究从樱桃酒中鉴定出10种醇类物质,醇类物质是酵母在酒精发酵过程中利用氨基酸或糖代谢产生的次级产物,构成酒类的主体香气成分[22]。樱桃酒中对香气有正面贡献作用的醇类有正丙醇和异戊醇,均为一些具有花果香的化合物。由表3可知,GAPDH@Fe3O4多批次处理后,与ES相比,IT-1中,3-甲硫基丙醇、正己醇、正丁醇的信号强度分别下降了15.6%、18.7%、23%,而异戊醇、异丁醇、正丙醇、乙醇、异丙醇、甲醇、1-戊烯-3-醇等物质的信号强度未发生明显降低。在IT-5中各物质的信号强度减少量均小于IT-1,3-甲硫基丙醇、正己醇、正丁醇的信号强度分别下降了7.8%、18.2%、16.7%,其余物质的信号强度均未降低。在IT-10中只有正己醇的信号强度下降了11.7%,其余挥发性醇类的信号强度与ES相比均未降低。
对樱桃酒中挥发性酮类、醛类、酸类及萜烯、杂环等物质来说,酸类化合物在果酒中可起到协调香气、减少刺激感等辅助作用[23]。虽然樱桃酒中醛酮类物质和萜烯类含量较少,但其在维持酒体风味平衡及协调香气中起着不可或缺的作用。与ES相比,IT-1中苯甲醛、2-己烯醛、丙醛、乙醛、丙酮、环戊酮、乙酸、α-蒎烯的信号强度均下降了20%左右,在IT-5中,上述物质的信号强度均下降了10%~12%左右;IT-10中只有乙醛的信号强度下降了14.7%。此外,不论是IT-1、IT-5还是IT-10中,丁酸、α-松油烯、丙酸、γ-松油烯、蒎烯、对甲苯、对二甲苯等物质的信号强度均未发生明显降低,GAPDH@Fe3O4对上述物质没有任何的负面影响。
综上,随着GAPDH@Fe3O4使用轮次的增加,樱桃酒中挥发性组分的含量与初始样品的差异性逐步减小,说明该固定化酶挥发性组分的吸附越来越少,处于几乎饱和的状态。
2.4 樱桃酒酚类物质分析
樱桃酒中非挥发性酚类物质的分离和鉴定通过HPLC法完成,通过对比标品和样品的出峰时间来鉴定酚类物质,经过比较发现,如表4所示,ES中非挥发性酚类物质有没食子酸(5.646 mg/L)、原儿茶酸(16.337 mg/L)、2,3,4-三羟基苯甲酸(9.541 mg/L)、新绿原酸(2 689.152 mg/L)、对羟基苯甲酸(9.335 mg/L)和绿原酸(47.475 mg/L)。
表4 GAPDH@Fe3O4重复利用批次对樱桃酒的非挥发性酚类物质的影响
Table 4 Effect of GAPDH@Fe3O4 reuse batch on non-volatile phenols of cherry wine
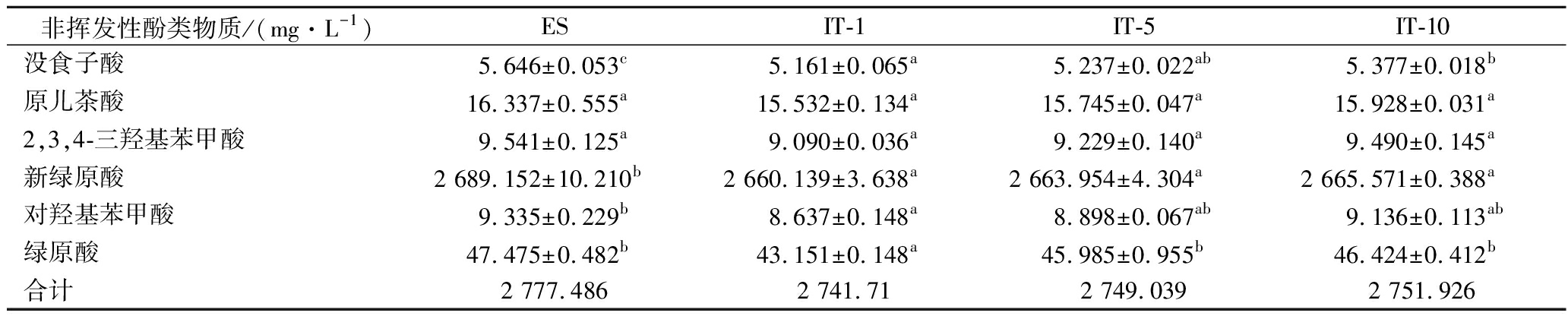
非挥发性酚类物质/(mg·L-1)ESIT-1IT-5IT-10没食子酸5.646±0.053c5.161±0.065a5.237±0.022ab5.377±0.018b原儿茶酸16.337±0.555a15.532±0.134a15.745±0.047a15.928±0.031a2,3,4-三羟基苯甲酸9.541±0.125a9.090±0.036a9.229±0.140a9.490±0.145a新绿原酸2 689.152±10.210b2 660.139±3.638a2 663.954±4.304a2 665.571±0.388a对羟基苯甲酸9.335±0.229b8.637±0.148a8.898±0.067ab9.136±0.113ab绿原酸47.475±0.482b43.151±0.148a45.985±0.955b46.424±0.412b合计2 777.4862 741.712 749.0392 751.926
由表4可知,樱桃酒中非挥发性酚类物质含量为2 777.486 mg/L,并且在GAPDH@Fe3O4多批次处理后,可以发现其对非挥发性酚类物质含量影响较小。与ES相比,在IT-1中,没食子酸、原儿茶酸、2,3,4-三羟基苯甲酸、新绿原酸、对羟基苯甲酸、绿原酸的降解率分别为8.6%、4.9%、4.7%、1.08%、7.5%、9.1%,非挥发性酚类物质的总降解量为1.29%;在IT-5中,各物质的降解率都发生了不同程度的下降,上述物质的降解率为7.24%、3.6%、3.27%、0.94%、4.68%、3.1%,非挥发性酚类物质的总降解量为1%;在IT-10中,非挥发性酚类物质仍检测出2 751.926 mg/L,其总降解量仅为0.9%,即在IT-10中,GAPDH@Fe3O4对非挥发性酚类物质几乎无影响。
由于本研究在预实验中发现磁性纳米Fe3O4对多酚等物质具有一定的吸附作用(数据未列出),故如材料与方法中所述,在磁性Fe3O4-APTES-戊二醛固定GAPDH之前,先将其投入樱桃酒中静置5 h进行预处理吸附多酚,使其达到吸附饱和状态,洗涤后再进行磁性纳米粒子与酶的结合。所以在正式投入使用后,樱桃酒中主要的酯类化合物、醇类化合物、酸类化合物和酚类化合物等物质的种类数未发生改变并且各成分含量变化较小,总体稳定。可以发现GAPDH@Fe3O4对樱桃酒的基本组成和风味物质都没有负面影响。
2.5 樱桃酒感官质量分析
虽然GC-IMS已对不同处理方式的樱桃酒挥发性成分进行检测分析,但其结果不能完全体现出酒体的整体香气。因此由一个训练有素的11人小组对酒体香气进行感观评估分析,结果如图1所示。樱桃酒的甜香和果香最浓郁,同时具有中等强度的花香,以及低强度的生青气味,总体香气得分ES和IT-10最高,IT-1和IT-5次之,GAPDH@Fe3O4重复利用批次下樱桃酒的各项得分和总体得分均几乎没有差异,说明其对樱桃酒的整体香气没有负面影响。
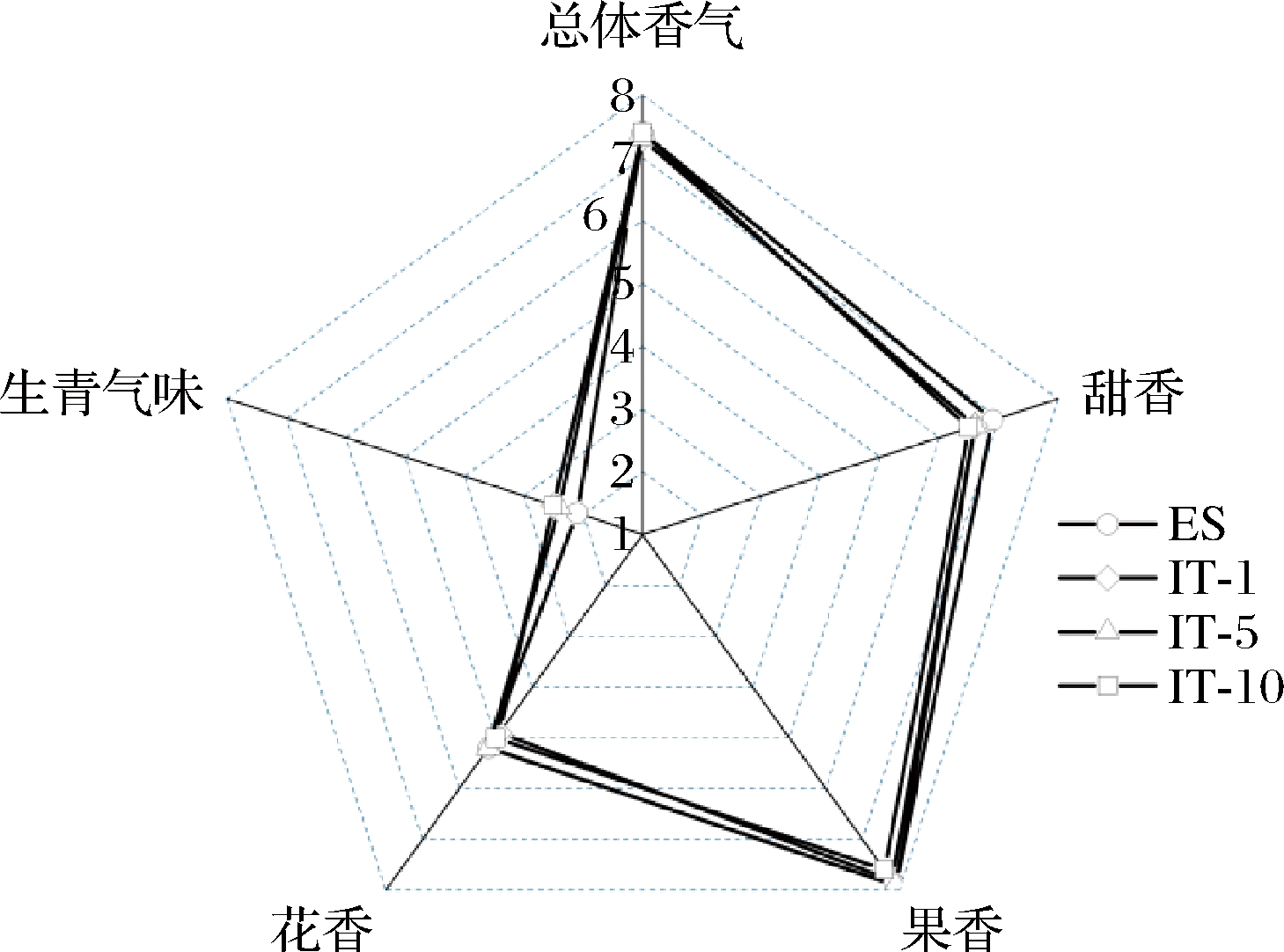
图1 GAPDH@Fe3O4重复利用批次下樱桃酒 感官评价雷达图
Fig.1 Radar chart of sensory evaluation of cherry wine under GAPDH@Fe3O4 reuse batch
这些结果表明,在实际的樱桃酒环境中,GAPDH@Fe3O4在其底物上具有活性,并且其可重复使用性、可回收性和易回收性使其成为未来工业应用的一种强大的生物催化剂。
3 结论
在本研究中,通过将合成的新型功能化磁性纳米颗粒固定三磷酸甘油醛脱氢酶,结合改性氧化铁易于分离和特殊物理特性的优点,GAPDH@Fe3O4作为一种有效的纳米生物催化剂被用于樱桃酒中BA的去除。通过HPLC和GC-IMS分析樱桃酒中BA和各项理化指标,发现其在BA的去除方面有极大的活性,并且在经过10次循环使用后还保持较高的BA降解活性,而对樱桃酒的基本理化指标、挥发性物质以及非挥发性酚类物质几乎无影响。综上所述,GAPDH@Fe3O4在果酒酿造过程中去除BA方面具有巨大的潜力。
[1] 曾立威, 蔡翔宇, 吴玉杰, 等.超高效液相色谱法同时快速测定多种动物源食品中9种生物胺的含量[J].食品安全质量检测学报, 2017, 8(3):968-974.
ZENG L W, CAI X Y, WU Y J, et al.Rapid and simultaneous determination of 9 kinds of biogenic amines in various animal-derived foodstuffs by ultra performance liquid chromatographyy[J].Journal of Food Safety & Quality, 2017, 8(3):968-974.
[2] 周军, 敖宗华, 邵燕,等.中国传统酒类中生物胺的研究进展[J].酿酒科技, 2020(7):58-64;70.
ZHOU J, AO Z H, SHAO Y, et al.Research progress in biogenic amine in traditional Chinese alcoholic drinks[J].Liquor-Making Science & Technology, 2020(7):58-64;70.
[3] 吕廷良. 临朐甜樱桃产业发展现状及对策[J].落叶果树, 2021, 53(5):82-84.
LYU T L.Current situation and countermeasures of sweet cherry industry development in linqu[J].Deciduous Fruit, 2021, 53(5):82-84.
[4] 孟军, 张建才, 邹静, 等.不同品种樱桃利口酒香气成分分析[J].酿酒科技, 2018(3):93-97.
MENG J, ZHANG J C, ZOU J, et al.Analysis of flavoring components in cherry liqueur produced by different species of cherry[J].Liquor-Making Science & Technology, 2018(3):93-97.
[5] 秦伟帅, 姜凯凯, 孙玉霞, 等.SPME-GC/MS联用测定“红灯”樱桃酒中香气成分[J].食品工业, 2016, 37(9):296-298.
QIN W S, JIANG K K, SUN Y X, et al.Using headspace solid phase micro-extraction for analysis of aromatic compounds in ‘Hongdeng’ cherry wine[J].The Food Industry, 2016, 37(9):296-298.
[6] 王舒, 董庆苓, 胡潇,等.樱桃品种对樱桃酒品质及生物胺含量的影响[J].食品与发酵工业, 2017, 43(8):81-85.
WANG S, DONG Q L, HU X, et al.The effect of cherry variety on the quality and biogenic amine levels of cherry wines[J].Food and Fermentation Industries, 2017, 43(8):81-85.
[7] SUN S Y, ZHANG Q F, LIU W L, et al.Influence of maceration techniques on the chemical, aromatic, sensory and biogenic amine profiles of cherry wine[J].Journal of the Institute of Brewing, 2018, 124(4):477-484.
[8] 倪秀梅, 杨涛, 方芳.生物胺降解酶研究进展及其应用[J].微生物学通报, 2021, 48(11):4 398-4 411.
NI X M, YANG T, FANG F.Biogenic amines-degrading enzymes and their applications:A review[J].Microbiology Bulletin, 2021, 48(11):4 398-4 411.
[9] 李彬彬, 徐晔, 牛淑慧, 等.食品中生物胺含量及生物胺氧化酶的研究进展[J].食品科学, 2019, 40(1):341-347.
LI B B, XU Y, NIU S H, et al.Recent progress in biogenic amines and bioamine oxidases in foods[J].Food Science, 2019, 40(1):341-347.
[10] 张沁芳. 植物乳杆菌组胺分解酶的分离纯化及性质研究[D].烟台:烟台大学, 2018.
ZHANG Q F.Purification and characterization of an enzyme capable of histamine degradation from Lactobacillus plantarum[D].Yantai:Yantai University, 2018.
[11] SUN S Y, JIANG D Q, FAN M T, et al.Selection of a versatile Lactobacillus plantarum for wine production and identification and preliminary characterisation of a novel histamine-degrading enzyme[J].International Journal of Food Science & Technology, 2020, 55(6):2 608-2 618.
[12] 韩林, 侯忠毕, 张敏, 等.磁性纳米复合材料固定化酶的研究进展[J].生物加工过程, 2021, 19(3):241-249.
HAN L, HOU Z B, ZHANG M, et al.Progess in enzyme immobilization by megnetic nanocomposites[J].Chinese Journal of Bioprocess Engineering, 2021, 19(3):241-249.
[13] 张玮玮, 杨慧霞, 薛屏.功能化磁性纳米粒子在固定化酶研究中的应用[J].中国生物化学与分子生物学报, 2020, 36(4):392-400.
ZHANG W W, YANG H X, XUE P.Applications of fFunctionalized magnetic nanoparticles in immobilized enzymes[J].Chinese Journal of Biochemistry and Molecular Biology, 2020, 36(4):392-400.
[14] WANF L L, FAN M T, XING X, et al.Immobilization of glyceraldehyde-3-phosphate dehydrogenase on Fe3O4 magnetic nanoparticles and its application in histamine removal[J].Colloids and Surfaces B:Biointerfaces, 2021, 205:111917.
[15] LIU W L, LI H M, JIANG D Q, et al.Effect of Saccharomyces cerevisiae, Torulaspora delbrueckii and malolactic fermentation on fermentation kinetics and sensory property of black raspberry wines[J].Food Microbiology, 2020, 91:103551.
[16] LIU Y, HAN F L, LIU Y J, et al.Determination of biogenic amines in wine using modified liquid-liquid extraction with high performance liquid chromatography-fluorescence detector[J].Food Analytical Methods, 2020, 13(4):911-922.
[17] LI H M, JIANG D Q, LIU W L, et al.Comparison of fermentation behaviors and properties of raspberry wines by spontaneous and controlled alcoholic fermentations[J].Food Research International, 2020, 128:108801.
[18] 朱敏, 李宝坤, 蒋彩虹, 等.乙醇胁迫对植物乳杆菌D5-5代谢活力的影响[J].食品与生物技术学报, 2016, 35(12):1 300-1 306.
ZHU M, LI B K, JIANG C H, et al.Effect of ethanol stress on the metabolic activity of Lactobacillus plantarum D5-5[J].Journal of Food Science and Biotechnology, 2016, 35(12):1 300-1 306.
[19] LIU D M, CHEN J, SHI Y P, et al.α-Glucosidase immobilization on chitosan-modified cellulose filter paper:Preparation, property and application[J].International Journal of Biological Macromolecules, 2018, 122:298-305.
[20] GUPTA A R, RATHOD V K.Biodiesel synthesis from palm fatty acid distillate using enzyme immobilized on magnetic nanoparticles[J].SN Applied Sciences, 2020, 2(11):1-10.
[21] 王轩, 周健, 明红梅, 等.樱桃果酒酿酒酵母的筛选及香气成分分析[J].食品与发酵工业, 2020, 46(3):124-130.
WANG X, ZHOU J, MING H M, et al.Screening of Saccharomyces cerevisiae for the fermentation of cherry fruit wine and its aroma components analysis[J].Food and Fermentation Industries, 2020, 46(3):124-130.
[22] 张婷, 陈小伟, 张沙沙, 等.不同酒曲发酵生产木薯酒香气成分GC-MS分析[J].食品研究与开发, 2019, 40(2):125-131.
ZHANG T, CHEN X W, ZHANG S S, et al.Analysis of the aroma components of cassava wine fermented with different koji[J].Food Research and Development, 2019, 40(2):125-131.
[23] XIAO Q, ZHOU X, XIAO Z B, et al.Characterization of the differences in the aroma of cherry wines from different price segments using gas chromatography-mass spectrometry, odor activity values, sensory analysis, and aroma reconstitution[J].Food Science and Biotechnology, 2017, 26(2):331-338.