枸杞别称苟起子、枸杞红实、甜菜子等,味甘,性平,主要活性物质有枸杞多糖、类胡萝卜素、黄酮类化合物,具有免疫调节、抗氧化、抗衰老、抗肿瘤等多种功能[1-6]。沙棘别称黄酸刺、酸刺柳等,作为世界干旱地区中能够将经济、生态与社会效益有效结合的农作物,果实营养丰富,含有多种维生素、有机酸、微量元素、亚油素、沙棘黄酮、超氧化物等活性物质和人体所需的各种氨基酸,具有独特的药用和营养价值。研究表明,沙棘对心血管系统、消化系统、肝脏,以及抗氧化、免疫调节均有很好的效果[7-11]。枸杞、沙棘均具有提高免疫力的效果,但两者配伍使用增强免疫力效果的研究尚未见报道。为此,本实验通过分析高、中、低3种不同剂量的枸杞沙棘配伍对小鼠免疫功能的影响,探讨其增强免疫力功能的相关机制,为后续产品的开发以及临床应用提供科学依据。
1 材料与方法
1.1 实验动物
SPF级雄性昆明种小鼠,由湖北省实验动物研究中心提供,共200只,体重18~22 g,动物饲养室温度为20~25 ℃,湿度为40%~70%。实验动物及饲料生产许可证号:SCXK(鄂)2008—0005;实验动物使用许可证号:SYXK(鄂)2012—0065;批准文号:2021-11-05。
1.2 材料与试剂
本研究所用的药品为枸杞沙棘胶囊,由西安金牛生物工程有限公司提供,由枸杞子、沙棘、女贞子等为原料制成,人体推荐量2.1 g/d,折合沙棘生药1.8 g/d,枸杞生药2.4 g/d。
Hank′s液、RPMI1640培养基、台酚蓝,武汉普诺赛生命科技有限公司;刀豆蛋白(concanavalin A, ConA)、NP40,北京索莱宝科技有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4, 5)-dimethylthiahiazo (-z-yl)-3,5-di-phenytetrazoliumromide, MTT],普洛麦格(北京)生物技术有限公司;乳酸脱氢酶(lactate dehydrogenase, LDH),杭州联科美讯生物医药技术有限公司;甲醇,天津市富宇精细化工有限公司;丙酮、异丙醇、碳酸钠、琼脂糖、冰醋酸,合肥天健化工有限公司。
1.3 仪器与设备
YLS-25A打孔器,济南益延科技发展有限公司;MK3酶标仪,Thermo Labsystems;PTF-A500电子天平、PTT-A+200千分之一电子天平,福州华志科学仪器;LDZX-50KB立式压力蒸汽灭菌器,上海申安医疗器械厂;BPN-80CH CO2培养箱,上海一恒科学仪器有限公司;DHP-9162恒温培养箱,上海慧泰仪器制造有限公司;TDL-50B低速台式离心机,上海安亭科技仪器厂;BSC-1000生物安全柜,苏州安泰空气技术有限公司;UB203i显微镜,重庆奥普光电有限公司;T6-新世纪紫外分光光度计,北京普析通用仪器有限责任公司;等。
1.4 实验方法
1.4.1 分组与给药
将200只雌性小鼠随机分为5组进行8项实验,1组进行迟发型变态反应(delayed type hypersensitivity, DTH),2组为小鼠测定和淋巴器官/体重比值测定和碳廓清实验,3组为ConA诱导的小鼠脾淋巴细胞转化实验和自然杀伤细胞(natural killer cell, NK细胞)活性测定,4组为抗体生成细胞检测和血清溶血素测定,5组为小鼠腹腔巨噬细胞吞噬鸡红细胞实验。每组40只小鼠随机分为4小组,分别为枸杞沙棘胶囊粉低(0.35 g/kg·BW)、中(0.70 g/kg·BW)、高(1.05 g/kg·BW)3个剂量组,另设1个阴性对照组(蒸馏水),每小组10只小鼠[12]。各组动物按照剂量每天灌胃20 mL/kg枸杞沙棘胶囊粉1次,阴性对照组灌等量蒸馏水,连续灌胃30 d后开始实验[13]。
1.4.2 ConA诱导的小鼠脾淋巴细胞转化实验
参考杨迪等[14]的方法并略作修改。小鼠经口灌服枸杞沙棘胶囊粉和蒸馏水30 d后,颈椎脱臼处死。在无菌的环境中取脾,置于含有无菌Hank′s液的培养皿中轻轻磨碎,制成单个样品细胞悬浮液,过200目筛网进行筛选,用Hank′s液洗2次、离心10 min(1 000 r/min)后于1 mL的完全培养液中悬浮,计活细胞数(95%)并将细胞浓度调整为3×106个/mL。将每个样品悬液分两孔加入24孔培养板中,每孔1 mL,其中一孔加入75 μL ConA液,另一孔不加作为对照,于5% CO2的培养箱中37 ℃培养72 h。培养至68 h时,每孔吸取0.7 mL上清液的同时加入0.7 mL不含小牛血清的RPMI1640培养液和MMT(5 mg/mL)50 μL,之后继续培养4 h至结束。结束后,每孔加入1 mL酸性异丙醇,使紫色结晶完全溶解,用分光光度计于波长570 nm处测定OD值。
1.4.3 二硝基氟苯(2,4-dinitrofluorobenzene, DNFB)诱导的小鼠迟发型变态反应
参考杨迪等[14]的方法,用1%的DNFB进行致敏,免疫后第5天用DNFB攻击右耳,24 h后处死小鼠,用打孔器各取下左右耳壳直径8 mm的耳片进行称重,用左右耳重量差表示DTH的程度。
1.4.4 血清溶血素的测定
参考史顶聪等[15]的方法并略作修改。取适量羊血,用生理盐水清洗3次后离心10 min(2 000 r/min),之后将羊血红细胞[压积绵羊红细胞(sheep red blood cell,SRBC)]用生理盐水配制成2%(体积分数)的细胞悬液,每只小鼠腹腔注射0.2 mL进行免疫,免疫后4~5 d摘眼球采血并分离血清,于微量血凝板内用生理盐水稀释,每孔100 μL,再加入100 μL 0.5%(体积分数)SRBC悬液混匀,之后将微量血凝实验板装入湿润的平盘内加盖,于37 ℃温箱孵育3 h后进行血清溶血素测定。统计血球凝集度,计算相应抗体积数。
1.4.5 小鼠腹腔巨噬细胞吞噬鸡红细胞实验(半体内法)
参考杨迪等[14]的方法并略作修改。小鼠经口灌服枸杞沙棘胶囊粉和蒸馏水30 d后,每只小鼠均腹腔注射20%(体积分数)的鸡红细胞悬液1 mL,颈椎脱臼处死后注射生理盐水2 mL,转动鼠板1 min后吸出腹腔洗液1 mL平均滴于2片载玻片上,放入湿润的容器内37 ℃孵育30 min,之后用生理盐水漂洗晾干,用1∶1(体积比)的甲醇丙酮溶液固定,4%(体积分数)Giemsa-磷酸缓冲液染色,再用蒸馏水漂洗晾干。镜检,油镜下计数100个巨噬细胞,吞噬率和吞噬指数的计算分别如公式(1)、公式(2)所示:
吞噬率![]()
(1)
吞噬指数![]()
(2)
1.4.6 小鼠碳廓清实验
参考史顶聪等[15]的方法并加以修改。各组小鼠末次给药1 h后,尾静脉注射印度墨汁(生理盐水稀释4倍)10 mL/kg,2 min(t1)和10 min(t2)分别从小鼠内眦静脉丛采血20 μL,并迅速加入到2 mL 0.1%(质量分数)碳酸钠溶液中摇匀,于紫外分光光度计600 nm处测定吸光值。之后将小鼠处死后取肝脏和脾脏分别称重,吞噬指数(α)的计算如公式(3)所示:
(3)
式中:K为未经校正吞噬指数;OD1为t1时(2 min)血标本光密度值;OD2为t2时(10 min)血标本光密度值。
1.4.7 抗体生成细胞检测(Jerne改良玻片法)
参考杨迪等[14]的方法并略作修改。SRBC注射免疫方法同1.4。将SRBC免疫4 d后的小鼠处死,取出脾脏,脾脏处理方法同1.4.2,最后将细胞悬浮在5 mL RPMI1640培养液中计数,并将细胞浓度调整为5×106个/mL。
空斑的测定:将表层培养基(1 g琼脂糖+双蒸水至100 mL)加热溶解后45~50 ℃保温,与等量pH 7.2~7.4、2倍浓度的Hank′s液混合后分装,每管0.5 mL,再向管内加50 μL 10%(体积分数)用SA缓冲液配制的SRBC和20 μL脾细胞悬液(5×106个/mL),迅速混匀,倾倒于已刷琼脂糖薄层的玻片上做平行片,待琼脂凝固后,将玻片水平扣放在片架上,放入二氧化碳培养箱中孵育1.5 h,然后用SA缓冲液稀释补体(1∶8,体积比)加入玻片架凹槽内,继续温育1.5 h后,计数溶血空斑数。各剂量组结果与阴性对照组进行方差分析。
1.4.8 NK细胞活性测定
参考杨迪等[14]方法并略作修改,实验前24 h将靶细胞进行传代培养。使用前用Hank′s液洗3次、RPMI1640完全培养液将细胞浓度调整为4×105个/mL。
无菌取脾,脾脏处理方法同1.4.2,1 000 r/min离心10 min后弃上清液并弹起细胞浆,加入0.5 mL灭菌水20 s对红细胞进行裂解,再加入Hank′s液8 mL和2倍的Hank′s液0.5 mL,1 000 r/min离心10 min,加入含10%小牛血清的RPMI1640完全培养液1 mL进行重悬,1%(体积分数)冰醋酸稀释后计数,并调整细胞浓度为2×107个/mL。
取靶细胞和效应细胞各10 μL,加入U型96孔培养板中:靶细胞自然释放孔加靶细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和1% NP40各10 μL,分别设3个平行孔,于5%的CO2培养箱中37 ℃培养4 h,1500 r/min离心5 min,每孔吸取上清100 μL加入96孔平底培养板中,同时加入LDH基质液100 μL,反应8 min,每孔加入1 mol/L的HCL 30 μL,在酶标仪490 nm处测定光密度值(OD),NK细胞活性的计算如公式(4)所示:
NK细胞活性![]()
(4)
2 结果与分析
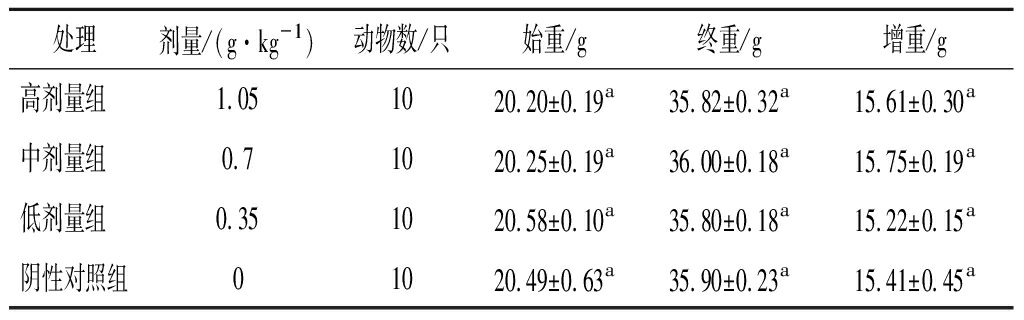
2.1 各剂量组受试物对小鼠体重的影响
由表1可知,各组小鼠生长发育情况良好,体重稳定增加,与阴性对照组比较,各剂量组小鼠体重均无显著变化,说明枸杞沙棘胶囊粉对小鼠体重影响不显著。
表1 各剂量组受试物对实验组小鼠体重的影响
Table 1 Effect of test substance in each dose group on body weight of mice in the test group
处理剂量/(g·kg-1)动物数/只始重/g终重/g增重/g高剂量组 1.051020.20±0.19a35.82±0.32a15.61±0.30a中剂量组 0.71020.25±0.19a36.00±0.18a15.75±0.19a低剂量组 0.351020.58±0.10a35.80±0.18a15.22±0.15a阴性对照组01020.49±0.63a35.90±0.23a15.41±0.45a
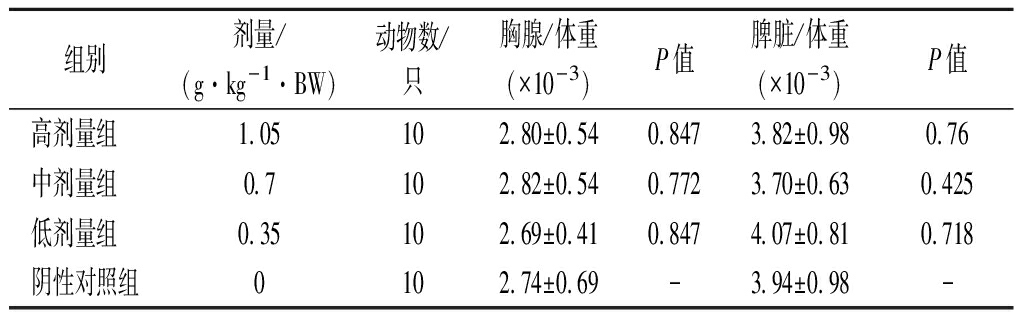
2.2 各剂量组受试物对小鼠淋巴器官/比重比值的影响
脾脏是人体最大的淋巴器官,参与机体多种免疫反应。T淋巴细胞是整个淋巴器官的发育和机体免疫不可或缺的,而胸腺产生T淋巴细胞,所以胸腺的损伤和退化会导致T淋巴细胞的减少,降低机体免疫力。由表2可知,小鼠经口灌服沙棘枸杞胶囊粉和蒸馏水30 d后,胸腺/体重的比值和脾脏/体重的比值均无明显变化,且与阴性对照组比较无显著差异(P>0.05),说明各剂量组受试物对小鼠免疫系统无损伤。
表2 各剂量组受试物对小鼠淋巴器官/体重比值的影响
Table 2 Effect of test substance of each dose group on the ratio of lymphoid organs/specific gravity of mice
组别剂量/(g·kg-1·BW)动物数/只胸腺/体重(×10-3)P值脾脏/体重(×10-3)P值高剂量组 1.05102.80±0.540.8473.82±0.980.76中剂量组 0.7102.82±0.540.7723.70±0.630.425低剂量组 0.35102.69±0.410.8474.07±0.810.718阴性对照组0102.74±0.69-3.94±0.98-
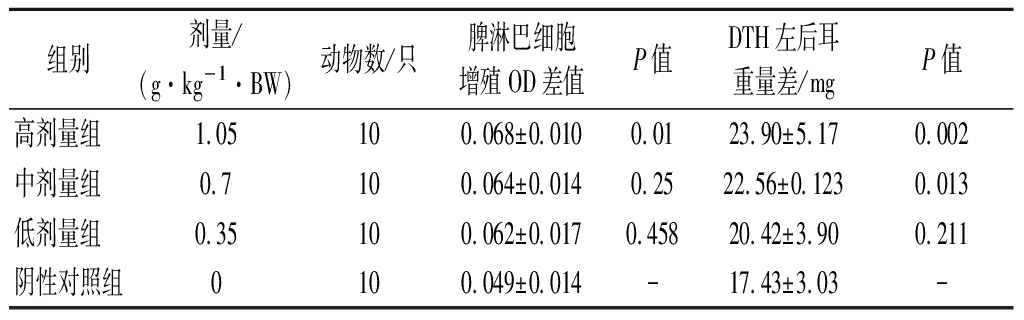
2.3 各剂量组受试物对小鼠脾淋巴细胞转化能力及小鼠迟发型变态反应的影响
淋巴细胞的转化可以在体外检测淋巴细胞的应答能力。由表3可知,与阴性对照组相比,中、低剂量组均无显著变化(P>0.05),而高剂量组能够显著增强ConA诱导的小鼠脾淋巴细胞转化能力。
迟发型变态反应又称“迟发型超敏反应”,是由T淋巴细胞介导的一种超敏反应。它的发生不需要抗体或补体参加,是在变应原作用下形成致敏淋巴细胞,当机体再次接触相同变应原时,会表现出一种迟缓的、以单个核细胞浸润和细胞变性坏死为特征的局部变态反应性炎症。经口给予小鼠不同剂量的受试物30 d后,用耳肿胀法进行DNFB诱导的DTH实验,结果表明,低、中、高剂量组的耳壳增重均高于阴性对照组,且与阴性对照组相比,中剂量组差异明显(P<0.05),高剂量组差异显著(P<0.01),具有统计学意义。
表3 各剂量组受试物对ConA诱导的小鼠脾淋巴细胞 转化能力及小鼠迟发型变态反应的影响
Table 3 Effects of test substances in each dose group on ConA induced splenic lymphocyte transformation ability and delayed allergic reaction in mice
组别剂量/(g·kg-1·BW)动物数/只脾淋巴细胞增殖OD差值P值DTH左后耳重量差/mgP值高剂量组 1.05100.068±0.0100.0123.90±5.170.002中剂量组 0.7100.064±0.0140.2522.56±0.1230.013低剂量组 0.35100.062±0.0170.45820.42±3.900.211阴性对照组0100.049±0.014-17.43±3.03-
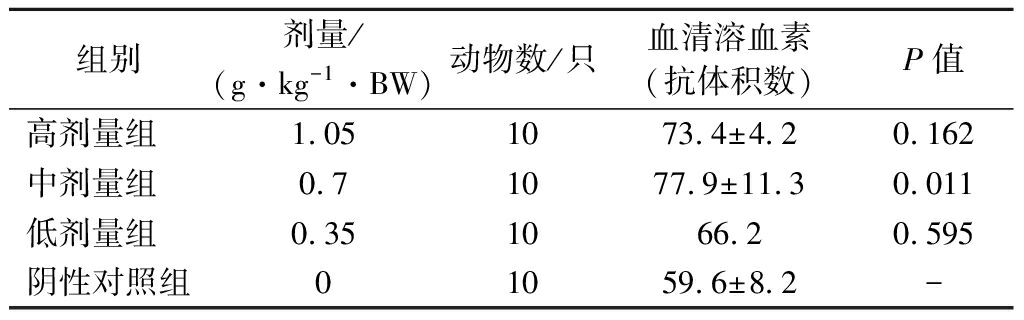
2.4 各剂量组受试物对小鼠血清溶血素水平的影响
用绵羊红细胞免疫小鼠,可以引发小鼠血清中的特异性抗绵羊红细胞抗体的产生,该抗体是一种溶血素,能够溶解绵羊红细胞。由表4可知,与阴性对照组比较,各剂量组的小鼠抗体积数均增高,且中剂量组抗体积数最大,显著高于阴性对照组(P<0.05)。由于在增强小鼠体液免疫功能方面,影响作用并不随剂量增大而增强,中剂量组效果最佳,可能是因为剂量过大对机体产生其他作用而影响体液免疫功能,具体原因有待进一步研究证实。
表4 各剂量组受试物对小鼠血清溶血素水平的影响
Table 4 Effect of test substance in each dose group on serum hemolysin level of mice
组别剂量/(g·kg-1·BW)动物数/只血清溶血素(抗体积数)P值高剂量组 1.051073.4±4.20.162中剂量组 0.71077.9±11.30.011低剂量组 0.351066.20.595阴性对照组01059.6±8.2-
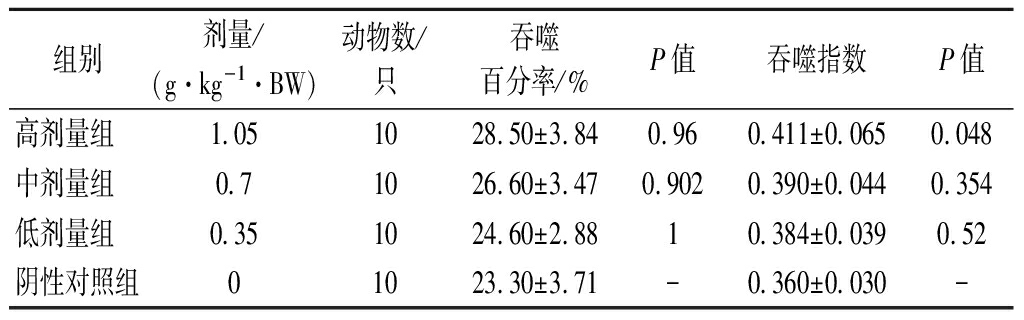
2.5 各剂量组受试物对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响
巨噬细胞又称组织细胞,主要功能是对细胞碎片和病原体进行识别、吞噬和消化,并激活淋巴球或其他免疫细胞对病原体作出反应。由表5可知,各剂量组受试物的吞噬率均大于阴性对照组,且随着剂量的升高,吞噬率逐渐升高。与阴性对照组相比,高剂量组能提高吞噬指数,且差异显著(P<0.05)。
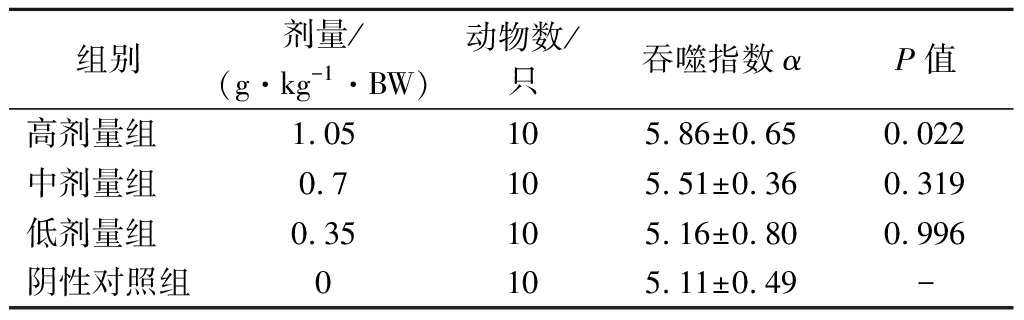
2.6 各剂量组受试物对小鼠碳廓清功能的影响
由表6可知,经口给予小鼠不同剂量的受试物30 d后,与阴性对照组相比,低、中剂量组的吞噬指数α均无显著变化(P>0.05),而高剂量组能显著提高小鼠碳廓清吞噬指数(P<0.05)。
表5 各剂量组受试物对小鼠腹腔巨噬细胞吞噬鸡 红细胞能力的影响
Table 5 Effects of test substances in each dose group on the ability of mouse peritoneal macrophages to phagocytize chicken erythrocytes
组别剂量/(g·kg-1·BW)动物数/只吞噬百分率/%P值吞噬指数P值高剂量组 1.051028.50±3.840.960.411±0.0650.048中剂量组 0.71026.60±3.470.9020.390±0.0440.354低剂量组 0.351024.60±2.8810.384±0.0390.52阴性对照组01023.30±3.71-0.360±0.030-
表6 各剂量组受试物对小鼠碳廓清功能的影响
Table 6 Effect of test substance in each dose group on carbon clearance function of mice
组别剂量/(g·kg-1·BW)动物数/只吞噬指数αP值高剂量组 1.05105.86±0.650.022中剂量组 0.7105.51±0.360.319低剂量组 0.35105.16±0.800.996阴性对照组0105.11±0.49-
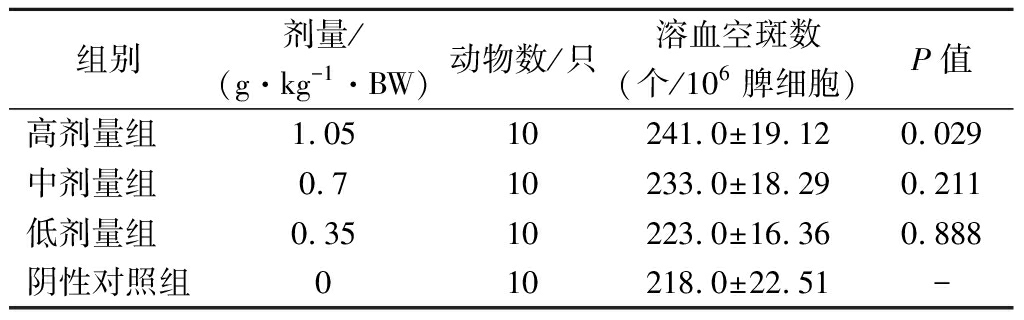
2.7 各剂量组受试物对小鼠抗体生成细胞功能的影响
经口给予小鼠不同剂量的受试物30 d后,用半数溶血值法测定小鼠的血清半数溶血值(HC50),并进行统计学分析。由表7可知,与阴性对照组比较,低、中剂量组的溶血空斑数无显著变化(P>0.05),而高剂量组能显著提高抗体生成细胞数量(P<0.05),有统计学意义。
表7 各剂量组受试物对小鼠抗体生成细胞功能的影响
Table 7 Effect of test substance in each dose group on the function of antibody producing cells in mice
组别剂量/(g·kg-1·BW)动物数/只溶血空斑数(个/106脾细胞)P值高剂量组 1.0510241.0±19.120.029中剂量组 0.710233.0±18.290.211低剂量组 0.3510223.0±16.360.888阴性对照组010218.0±22.51-
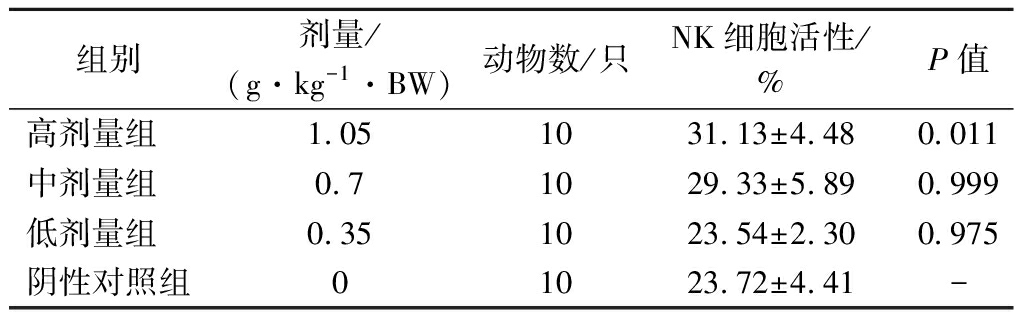
2.8 各剂量组受试物对小鼠NK细胞活性的影响
NK细胞是机体重要的免疫细胞,不仅与抗肿瘤、抗病毒感染和免疫调节有关,并且能够识别靶细胞、杀伤介质,在某些情况下参与超敏反应和自身免疫性疾病的发生。由表8可知,与阴性对照组比较,低、中剂量组的NK细胞活性均无显著变化(P>0.05),高剂量组能够增加小鼠NK细胞活性,且差异显著(P<0.05)。
表8 各剂量组受试物对小鼠NK细胞活性的影响
Table 8 Effect of test substance in each dose group on NK cell activity in mice
组别剂量/(g·kg-1·BW)动物数/只NK细胞活性/%P值高剂量组 1.051031.13±4.480.011中剂量组 0.71029.33±5.890.999低剂量组 0.351023.54±2.300.975阴性对照组01023.72±4.41-
3 讨论与结论
免疫功能是维护自身健康的重要的生理机能。机体的免疫功能由免疫系统担任,与身体的健康状态密切相关。免疫力低下是导致身体亚健康的重要原因之一,长期的亚健康状态也会导致机体免疫功能的减退[16-17]。机体免疫功能低下会导致机体功能的衰退,可引发多种疾病,最主要表现为易感染、容易疲倦等。世界卫生组织调查数据显示,全球有超75%的人群处于亚健康状态[18],亚健康状态现患率与年龄成正相关,目前我国老年人处于亚健康状态者高达90%[19],亚健康问题已经成为全球流行的亟需解决的问题。党的十九大提出“健康中国”战略的重大决策部署,目前我国已经进入已预防为主,倡导健康文明生活方式,预防重大疾病。因此,如何减少亚健康的患病率,改善人体亚健康状态,提高免疫力将会是未来研究的热点问题[20-21]。
研究表明,枸杞和沙棘均具有很好的增强免疫力的功效。枸杞多糖能够增强细胞介入免疫和体液免疫反应,进而提高机体免疫力;适当浓度的枸杞多糖或可促进免疫器官的发育。枸杞多糖通过下调衰老基因的表达、调控P13K/AKT信号通路抵抗细胞氧化等方法,增强免疫细胞抗氧化、抗疲劳的能力,减缓免疫细胞衰老。此外,枸杞多糖能够通过调节凋亡相关分子的表达以调节老龄T细胞的凋亡,调节免疫活性;还可影响肠道通透性和组织学变化,增强肠道抗氧化能力,激活肠道中存在的T细胞、B细胞、巨噬细胞以及派氏结等免疫细胞[22]。
沙棘可以增加小鼠巨噬细胞的吞噬功能,促进体液免疫及淋巴细胞的转化。沙棘粉具有调节血脂、减轻肝脏氧化损伤、预防血脂代谢紊乱的作用。沙棘多糖能够显著促进巨噬细胞的增殖、细胞因子的释放;在体内,沙棘多糖能够增强免疫低下小鼠的免疫器官指数、提升小鼠巨噬细胞的吞噬功能、提高脾脏组织中细胞因子的水平[23]。
本研究所用的受试物是由枸杞、沙棘配伍组成,对小鼠进行一系列提高免疫力的实验,结果表明,与阴性对照组比较,高剂量组能够显著增强ConA诱导的小鼠脾淋巴细胞转化能力及DNFB诱导的DTH反应、吞噬率、吞噬指数、小鼠碳廓清吞噬指数、NK细胞活性及抗体生成细胞数量,差异显著(P<0.05);中剂量组可显著提高小鼠抗体积数,差异显著(P<0.05)。根据《保健食品检验与技术评价规范》(2003)版,该产品对细胞和体液免疫功能测定结果均为阳性,该产品具有增强免疫力的功效。且实验结果显示,由枸杞、沙棘配伍的产品不良反应较少,不会破坏机体正常的免疫功能,安全性高,且效果好,本研究可为后续枸杞沙棘的综合利用开发提供思路。目前对于枸杞、沙棘提高免疫力的量效关系、构效关系仍不清楚,对于其调节免疫机制,还需进行大量实验研究予以证实。因此,可加强对这2种中药的基础研究,为其进一步临床应用及资源开发提供科学依据。
[1] 史蓉, 李婷婷, 周丽, 等.甘肃枸杞功能性物质及其功效研究综述[J].甘肃农业科技, 2019, (9):81-86.
SHI R, LI T T, ZHOU L, et al.Review on functional substances and efficacy of Lycium barbarum in Gansu and its efficacys[J].Gansu Agricultural Science and Technology, 2019, (9):81-86.
[2] 刘敦华, 刘军, 李佩佩, 等.枸杞深加工产品开发现状及研究进展[J].食品科学技术学报, 2020, 38(4):10-20.
LIU D H, LIU J, LI P P, et al.Development status and research progress of deep processing products of Lycium barbarum[J].Journal of Food Science and Technology, 2020, 38 (4):10-20.
[3] 丁丽娜. 青海特色食品资源沙棘、黑青稞、枸杞、黑枸杞中的黄酮类与脂肪酸类组分分析[D].杭州:浙江大学, 2019.
DING L N.Analysis of flavonoids and fatty acids in Qinghai specialty food resources seabuckthorn, black barley, Lycium chinensis, Lycium ruthenicum Murr[D].Hangzhou:Zhejiang University, 2019.
[4] 高凯. 宁夏枸杞子的活性成分研究和应用开发[D].西安:第四军医大学, 2014.
GAO K.Studies on the bioactive constituents of the fruits Lycium barbarum originated in Ningxia and the application and development of the fruits[D].Xi′an:Fourth Military Medical University, 2014.
[5] 胡志斌, 李喆勉.枸杞多糖的研究进展[J].食品安全导刊, 2018, 224(33):144.
HU Z B, LI J M.Research progress of Lycium barbarum polysaccharides[J].China Food Safety Magazine, 2018, 224 (33):144.
[6] 谢文, 陈华国, 赵超, 等.枸杞多糖的生物活性及作用机制研究进展[J].食品科学, 2021, 42(5):349-359.
XIE W, CHEN H G, ZHAO C, et al.Recent progress in understanding the bioactivity and mechanism of action of Lycium barbarum polysaccharide[J].Food Science, 2021, 42 (5):349-359.
[7] 臧茜茜, 邓乾春, 从仁怀, 等.沙棘油功效成分及药理功能研究进展[J].中国油脂, 2015, 40(5):76-81.
ZANG X X, DENG Q C, CONG R H, et al.Review on functional components and pharmacological property of sea buckthorn (Hippophae rhamnoides L.) oil[J].China Oils and Fats, 2015, 40(5):76-81.
[8] 尼亚孜·乌吉艾合买提, 刘续元, 阿卜来海提·阿卜杜瓦伊提, 等.沙棘不同部位化学成分和药理作用研究概况[J].中国民族民间医药, 2020, 29(12):72-76.
NIYAZI U A, LIU X Y, ABULAHITI A, et al.Research advances on chemical constituents and pharmacological effects of various parts of Hippophae rhamnoides[J].Chinese Journal of Ethnomedicine and Ethnopharmacy, 2020, 29(12):72-76.
[9] 张程慧, 祁玉霞, 程康蓉, 等.沙棘的综合价值研究进展[J].食品工业科技, 2017, 38(22):331-335.
ZHANG C H, QI Y X, CHENG K R, et al.Advances on research and applications of Hippophea rhamnoides[J].Science and Technology of Food Industry, 2017, 38(22):331-335.
[10] 冉贝贝, 李卫东.沙棘果与沙棘叶化学成分及其差异的研究进展[J].中国中药杂志, 2019, 44(9):1 767-1 773.
RAN B B, LI W D.Research progress on chemical constituents and their differences between sea buckthorn berries and leaves[J].China Journal of Chinese Materia Medica, 2019, 44(9):1 767-1 773.
[11] 刘勇, 廉永善, 王颖莉, 等.沙棘的研究开发评述及其重要意义[J].中国中药杂志, 2014, 39(9):1 547-1 552.
LIU Y, LIAN Y S, WANG Y L, et al.Review of research and development and significant effect of Hippophae rhamnoides[J].China Journal of Chinese Materia Medica, 2014, 39(9):1 547-1 552.
[12] WANG Z J, LI Y H, WANG C J, et al.Oral administration of Urtica macrorrhiza Hand.-Mazz.polysaccharides to protect against cyclophosphamide-induced intestinal immunosuppression[J].Experimental and Therapeutic Medicine, 2019, 18(3):2 178-2 186.
[13] MENG M, GUO M Z, FENG C C, et al.Water-soluble polysaccharides from Grifola Frondosa fruiting bodies protect against immunosuppression in cyclophosphamide-induced mice via JAK2/STAT3/SOCS signal transduction pathways[J].Food & Function, 2019, 10(8):4 998-5 007.
[14] 杨迪, 李丽杰, 张曾亮, 等.南极磷虾油灵芝孢子油纳米乳复合物提高小鼠的免疫功能[J].现代食品科技, 2020, 36(5):14-21;50.
YANG D, LI L J, ZHANG Z L, et al.Nanoemulsion complex of Euphausia superba (Antarctic krill) oil and Ganoderma lucidum spore oil enhances the immunity of mice[J].Modern Food Science and Technology, 2020, 36(5):14-21;50.
[15] 史顶聪, 赵宏宇, 佟晓乐, 等.红景天当归不同配伍对免疫低下小鼠免疫功能的影响[J].食品研究与开发, 2020, 41(5):28-33.
SHI D C, ZHAO H Y, TONG X L, et al.Effects of different compatibility of Rhodiola angelica on immune function of mice with immune defect state[J].Food Research and Development, 2020, 41(5):28-33.
[16] 王春华, 胡玲, 刘磊, 等.亚健康状态人群的疲劳与免疫指标相关性研究[J].中医药临床杂志, 2015, 27(1):50-52.
WANG C H, HU L, LIU L, et al.Research on the correlation between fatigue people with sub health and immune targets[J].Clinical Journal of Traditional Chinese Medicine, 2015, 27(1):50-52.
[17] 徐孝平, 潘永明, 刘瑞敏, 等.亚健康状态大鼠的神经一免疫一内分泌机制的研究[J].中国比较医学杂志, 2012, 22(8):33-39.
XU X P, PAN Y M, LIU R M, et al.Study on mechanism of neuro-immuno-endocrine system of rats in sub-health state[J].Chinese Journal of Comparative Medicine, 2012, 22(8):33-39.
[18] 李晓静, 徐国和.中国亚健康研究及干预对策的探讨[J].中国慢性病预防与控制, 2011, 19(4):427-429.
LI X J, XU G H.Research and intervention strategy of sub-health in China[J].Chinese Journal of Prevention and Control of Chronic Diseases, 2011, 19(4):427-429.
[19] 马宁, 刘民.亚健康状态的流行病学研究进展[J].中国预防医学杂志, 2012, 13(7):556-559.
MA N, LIU M.The epidemiological research progress of sub-health status[J].China Preventive Medicine, 2012, 13(7):556-559.
[20] 郝文丽. 枸杞多糖对亚健康小鼠改善作用的研究[D].大庆:黑龙江八一农垦大学, 2015.
HAO W L.Improving study of Lycium barbarum polysaccharide on sub-health in mice[D].Daqing:Heilongjiang Bayi Agricultural Reclamation University, 2015.
[21] 陈垚. 茯苓、枸杞、黄芪提取物和海参冻干粉配伍增强免疫力作用的实验研究[J].中医临床研究, 2021, 13(1):1-5.
CHEN Y.An experimental study on efficacy of Fuling extract, Gouqi extract, Huangqi extract and freeze-dried sea cucumber powder on the immunity-enhancing[J].Clinical Journal of Chinese Medicine, 2021, 13(1):1-5.
[22] 万和林, 叶毅丰, 韩抒恒, 等.枸杞多糖及其免疫调节机制研究进展[J/OL].中国食物与营养, 2022.DOI:10.19870/j.cnki.11-3716/ts.20210902.001.
WANG H L, YE Y F, HAN S H, et al.Research progress on Lycium barbarum polysaccharide and its immunomodulatory mechanism[J/OL].Food and Nutrition in China, 2022.DOI:10.19870/j.cnki.11-3716/ts.20210902.001.
[23] 李帅奇, 陈相如, 杨明凡, 等.沙棘粉和沙棘原浆对小鼠免疫增强作用的研究[J].饲料工业, 2021, 42(22):37-43.
LI S Q, CHEN X R, YANG M F, et al.Study on immunological enhancement effect of seabuckthorn powder and seabuckthorn plasma in mice[J].Feed industry, 2021, 42(22):37-43.