红花椒(Zanthoxylum bungeanum Maxim.)是芸香科花椒属植物,其果皮被誉为“八大味之一”,是我国传统的香辛料[1]。红花椒是我国一种重要的经济作物,主要种植于甘肃、云南、山西、陕西和四川等省[2],其中甘肃秦安、云南昭通、山西芮城和陕西韩城的花椒产量大而品质好,是我国种植花椒的重点产区。红花椒中的主要活性成分包括精油、酰胺、黄酮和生物碱等,其中,精油是评价红花椒果皮质量的重要指标[3]。研究表明,红花椒精油(Zanthoxylum bungeanum essential oils, ZBEOs)具有广谱抗菌活性,能有效抑制大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和沙门氏菌的生长[4]。此外,LI等[5]研究发现ZBEOs能破坏硫色镰刀菌细胞膜的完整性导致细菌死亡,从而达到抑菌效果。然而,关于ZBEOs对致口臭菌的抗菌和抗生物膜活性研究鲜有报道。
口臭是指从口腔、鼻、咽等充满气体的空腔中散发出的难闻气味,其主要是由口腔中存在的革兰氏阴性厌氧菌,如具核梭杆菌(Fusobacterium nucleatum)和牙龈卟啉单胞菌(Porphyromonas gingivalis)等,分解食物残渣所产生的挥发性硫化物所致[6]。具核梭杆菌和牙龈卟啉单胞菌易黏附于牙齿和舌苔表面形成耐药性更强的生物膜,且难以通过机械疗法根除[7]。因此,清除致口臭菌生物膜是治疗口臭的关键之一。目前治疗口臭的主要手段是使用含化学抗菌剂的漱口水抑制或杀灭致口臭菌,如葡萄糖酸氯己定(chlorhexidine gluconate,CHX)[8],但长期使用此类漱口水可能会导致口腔黏膜灼伤、口腔菌群失调等不良后果[9]。精油是植物的次生代谢产物,具有安全、低细胞毒性和环境友好等特性,已作为天然抗菌剂在漱口水等口腔护理产品中广泛使用[3]。研究表明,柑橘精油在1 mg/mL时即可有效抑制牙龈卟啉单胞菌的生长[10]。王小玉[11]研究发现,柠檬精油在4.5 mg/mL和9 mg/mL时可有效抑制具核梭杆菌和牙龈卟啉单胞菌的生长;在2.5~9 mg/mL时,对牙龈卟啉单胞菌生物膜的形成有抑制作用。此外,《中华人民共和国药典》记载,红花椒可用于改善口腔卫生[12],且红花椒与柑橘、柠檬同属芸香科植物,由此推测,ZBEOs可能对致口臭菌同样具有抗菌和抗生物膜活性,但迄今尚无相关研究报道。
本研究以我国甘肃秦安、云南昭通、山西芮城和陕西韩城4个代表性产地的红花椒为原料,分别提取精油,分析其主要化学成分;并选取与口臭密切相关的具核梭杆菌和牙龈卟啉单胞菌为受试菌,研究ZBEOs对致口臭菌的抗菌和抗生物膜活性,以期为ZBEOs在口臭防治中的潜在应用提供理论依据。
1 材料与方法
1.1 材料与试剂
以我国甘肃秦安、云南昭通、山西芮城和陕西韩城4个代表性产地的红花椒为原料,其品种与地理位置信息如表1所示。
表1 原料信息
Table 1 Raw material information
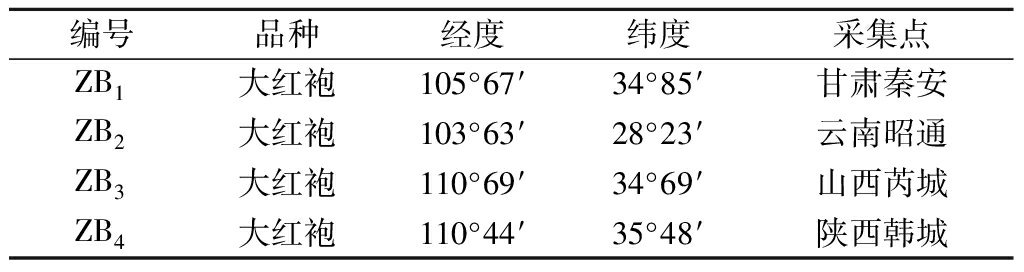
编号品种经度纬度采集点ZB1大红袍105°67′34°85′甘肃秦安ZB2大红袍103°63′28°23′云南昭通ZB3大红袍110°69′34°69′山西芮城ZB4大红袍110°44′35°48′陕西韩城
脑心浸液培养基(brain heart infusion,BHI),美国BD公司;酵母粉、CHX、4%多聚甲醛固定液,麦克林生化科技有限公司;L-半胱氨酸盐酸盐,青岛海博生物科技有限公司;氯化血红素、维生素K1,广东环凯微生物科技有限公司;PBS、结晶紫,上海源叶生物科技有限公司;Gluta固定液(电镜专用,2.5%),北京索莱宝科技有限公司;氯化钠、无水硫酸钠、无水乙醇、叔丁醇(均为分析纯),国药集团化学试剂有限公司;L13152活/死菌染色试剂盒,美国赛默飞世尔科技公司。
1.2 仪器与设备
FW-200高速万能粉碎机、SXKW-3000ML智能电热套、SPX-250BⅢ生化培养箱,中兴伟业仪器有限公司;ATY124电子天平,岛津公司;Pegasus®4D全二维气相色谱-飞行时间质谱,美国力可公司;LDZM-80 L立式高压蒸汽灭菌锅,申安医疗器械厂;YC-R50恒温培养摇床,天津市泰斯特仪器有限公司;BBS-SDC医用洁净工作台,山东博科医疗器械有限公司;VERSA max酶标仪,美谷分子仪器有限公司;JSM-IT500扫描电子显微镜,日本电子株式会社;激光共聚焦显微镜,日本奥林巴斯株式会社。
1.3 菌株
供试菌株:具核梭杆菌(ATCC 25586)、牙龈卟啉单胞菌(ATCC 33277),北纳创联生物科技有限公司。
1.4 实验方法
1.4.1 ZBEOs的制备
ZBEOs的制备采用水蒸气蒸馏法[13]。将干燥的红花椒果皮粉碎后过60目筛,再行蒸馏。收集精油层,使用无水硫酸钠脱水后,置于棕色螺旋盖密封小瓶中,在(4±1) ℃贮存。ZBEOs提取率的计算如公式(1)所示:
提取率![]()
(1)
式中:m1为所用红花椒的质量,g;m2为提取后所得 ZBEO的质量,g。
1.4.2 ZBEOs的成分分析
ZBEOs的化学组成通过全二维气相色谱-飞行时间质谱(comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry,GC×GC-TOFMS)进行分析,其试验条件在YAN等[14]的方法基础上稍作修改。
GC×GC条件:第一维柱为DB-WAX(30 m×250 μm×0.25 μm),进样温度250 ℃,初始温度60 ℃保留1 min,以5 ℃/min升至260 ℃,保留4 min;氦气(99.999 9%)流速为1.0 mL/min;分流比10∶1。第二维柱为DB-17MS(2 m×100 μm×0.10 μm),柱温高于第一维柱15 ℃;调制解调器温度始终保持高于第二维柱15 ℃;全二维分析调制周期4.0 s,接口温度270 ℃。
MS条件:离子源温度230 ℃,电子轰击源70 eV,检测器1 670 V,采集率50张/s,质谱扫描范围m/z 33~550。
将10 μL精油样品溶于1 mL无水乙醇中,取0.5 μL进样。检索NIST标准质谱库,结合相关文献确认精油的各个化学成分。采用面积归一化法计算各成分相对含量。
1.4.3 菌悬液的制备
BHI液体培养基:准确称取3.7 g BHI培养基,溶于100 mL去离子水中,高温高压灭菌,备用。
BHI-S液体培养基:准确称取3.7 g BHI培养基、0.5 g酵母粉和0.004 g L-半胱氨酸盐酸盐,溶于100 mL去离子水中,高温高压灭菌后,室温冷却至40 ℃左右(手背触碰不烫),加入0.5 mL维生素K1和0.5 g氯化血红素,备用。
具核梭杆菌悬液:挑取1环具核梭杆菌菌落于BHI液体培养基中,37 ℃摇床厌氧培养48 h后,用无菌生理盐水稀释至107CFU/mL,备用。
牙龈卟啉单胞菌悬液:挑取1环牙龈卟啉单胞菌菌落于BHI-S液体培养基中,37 ℃摇床厌氧培养72 h后,用无菌生理盐水稀释至107 CFU/mL,备用。
1.4.4 ZBEOs对致口臭菌的抗菌活性研究
1.4.4.1 最小抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)的测定
MIC的测定:采用微量肉汤稀释法[15]。将ZBEOs溶解于无菌液体培养基中稀释至32 mg/mL,通过连续二倍稀释使ZBEOs的最终质量浓度为0.25~32 mg/mL,在无菌96孔板中加入100 μL菌悬液和等量梯度精油溶液。设置等量无菌液体培养基为阴性对照,等量12 mg/mL CHX溶液为阳性对照。96孔板在厌氧条件下于37 ℃培养48~72 h。MIC值为无可见细菌生长时ZBEOs的最低浓度。
MBC的测定:参考ZHANG等[15]的方法测定MBC值,并在此基础上稍作修改。吸取10 μL无可见细菌生长孔的液体涂布于哥伦比亚血琼脂平板上,在37 ℃下厌氧培养48~72 h,以确定MBC值。MBC值为无菌落形成时ZBEOs的最低浓度。
根据MIC和MBC值的测定结果确定抗菌活性最佳的ZBxEO,用于后续试验。
1.4.4.2 致口臭菌生长曲线的测定
生长曲线的测定参考ZHANG等[16]的方法。将100 μL菌悬液和等量无菌液体加入至无菌96孔板中,37 ℃厌氧培养,分别在细菌生长的迟缓期和指数期加入终浓度为1×MIC的ZBxEO后继续培养,每间隔2 h,从测试培养物中采集样品,并通过酶标仪测量630 nm处的OD值。以细菌培养时间为横坐标,OD值为纵坐标,绘制生长曲线。
1.4.4.3 致口臭菌微观结构的观察
致口臭菌的微观结构通过扫描电子显微镜观察[17]。将无菌细胞爬片置于无菌24孔板中,每孔分别加入1 mL菌悬液和等量ZBxEO(1×MIC),在37 ℃厌氧条件下孵育48~72 h,用无菌PBS轻轻漂洗爬片以去除浮游细菌,室温干燥,加入Gluta固定液固定4 h后,用梯度乙醇(35%~100%,体积分数)脱水,叔丁醇脱去乙醇,所得样品喷金后通过扫描电子显微镜观察细菌的微观结构。设置等量无菌液体培养基为阴性对照组,等量12 mg/mL CHX溶液为阳性对照组。
1.4.5 ZBxEO对致口臭菌的抗生物膜活性研究
1.4.5.1 ZBxEO对致口臭菌生物膜清除能力的测定
ZBxEO清除致口臭菌生物膜的能力采用结晶紫染色法测定[18]。将100 μL菌悬液和等量无菌液体培养基加入至无菌96孔板中,37 ℃厌氧培养48~72 h以预先形成生物膜。弃培养液,用无菌PBS轻轻漂洗以去除浮游菌。分别吸取200 μL已梯度稀释的精油溶液(0.125~16 mg/mL)对应注入已形成生物膜的孔中,在37 ℃下继续厌氧培养48~72 h后,弃培养液,漂洗。每孔注入200 μL 4%多聚甲醛固定液以固定生物膜,15 min后吸出,室温干燥。每孔注入200 μL 1 g/L结晶紫溶液,染色5 min后弃去溶液,用无菌PBS洗去未结合的结晶紫溶液,室温干燥。每孔加入200 μL 95%(体积分数)乙醇溶液振荡以溶解结晶紫。将振荡后孔板中的混合溶液对应转入新的无菌96孔板中,在酶标仪中读取波长595 nm处OD值。设置等量无菌液体培养基为阴性对照组,等量12 mg/mL CHX溶液为阳性对照组。MBEC50(50% of minimum biofilm eradication concentration,MBEC50)被定义为清除50%及以上细菌生物膜所需最低ZBxEO浓度,清除率的计算如公式(2)所示:
清除率![]()
(2)
式中:ODNC为阴性对照组在595 nm下测得的OD值,%;ODTC为试验组在595 nm下测得的OD值。
1.4.5.2 致口臭菌生物膜结构的观察
致口臭菌的生物膜结构通过激光共聚焦显微镜观察[19]。如1.4.5.1所述,在激光共聚焦培养皿中预先形成生物膜。将2 mL含ZBxEO(1×MBEC50)的液体培养基加入培养皿中,在37 ℃继续厌氧培养48~72 h。用无菌蒸馏水轻轻漂洗培养皿以去除浮游菌。按照活/死菌染色试剂盒说明书,将SYTO 9(对活菌进行染色,绿色)和PI(对死菌进行染色,红色)2种荧光染料预先混合,对培养皿底生物膜避光染色15 min。用无菌蒸馏水漂洗以去除未结合的染料。通过激光共聚焦显微镜观察样品中细菌生物膜结构。设置等量无菌液体培养基为阴性对照组,等量12 mg/mL CHX溶液为阳性对照组。
1.5 数据处理与统计分析
使用GraphPad Prism 9软件对试验数据进行方差分析(Two-way ANOVA,Turkey)和绘图。所有试验重复3次,结果均表示为平均值±标准偏差,P<0.05表示具有显著性差异。
2 结果与分析
2.1 ZBEOs的提取
2.1.1 ZBEOs的提取率
水蒸气蒸馏法制备所得ZBEOs为淡黄色油状液体。其中,云南红花椒精油(ZB2EO)提取率最高,为(5.28±0.61)%,其次为甘肃红花椒精油(ZB1EO)、山西红花椒精油(ZB3EO)和陕西红花椒精油(ZB4EO),提取率分别为(4.07±0.29)%、(3.12±0.43)%和(2.54±0.57)%。
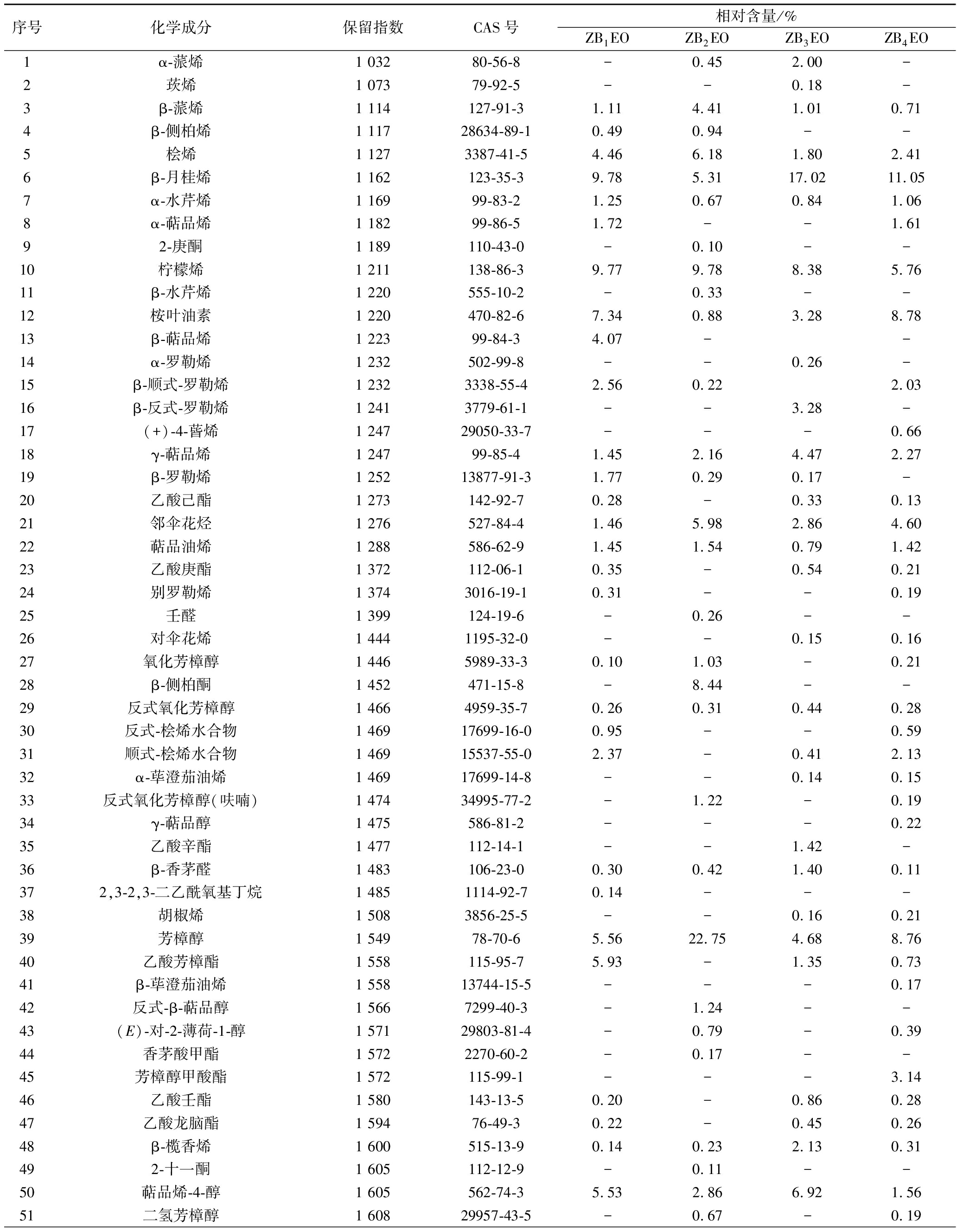
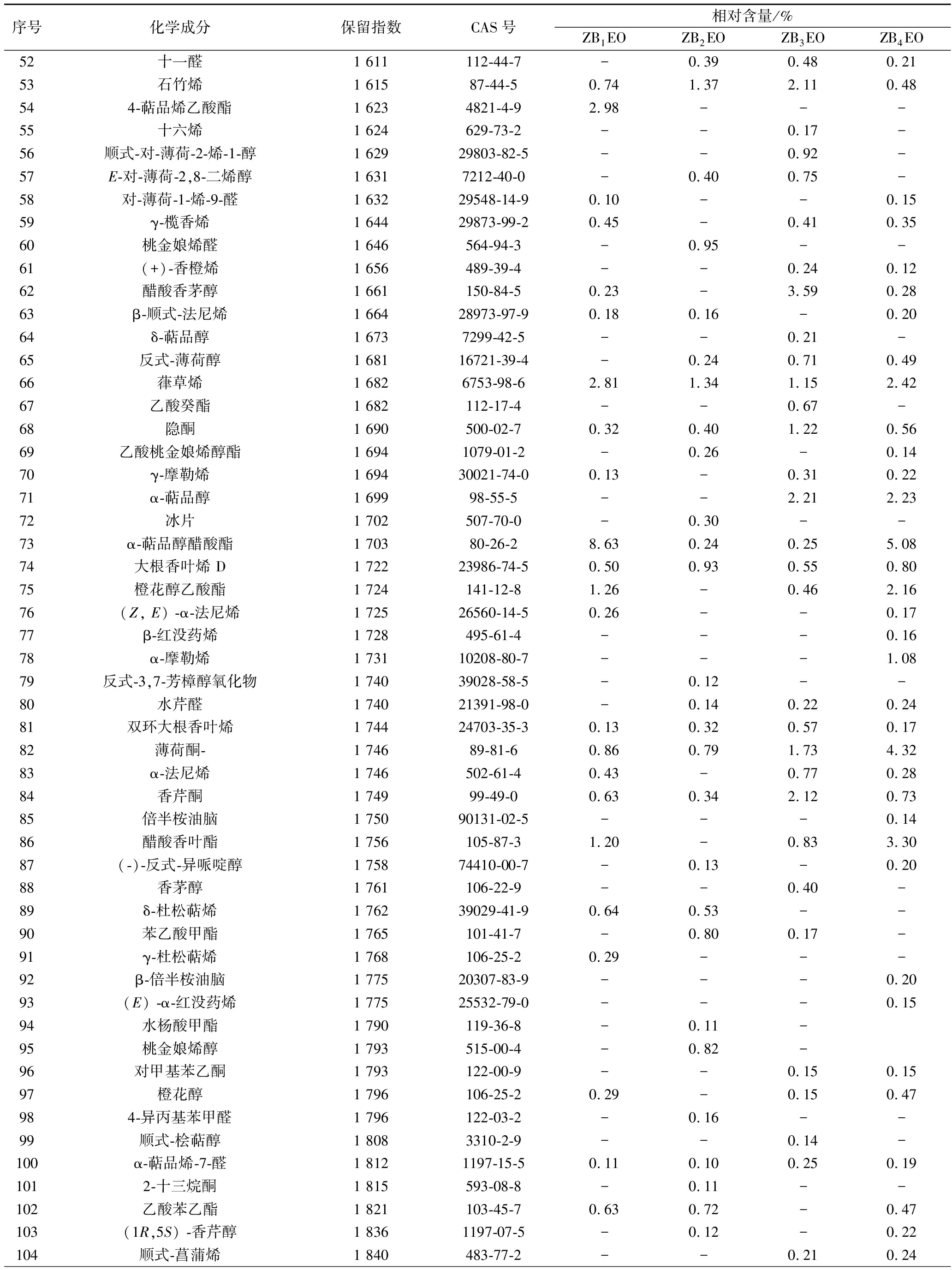
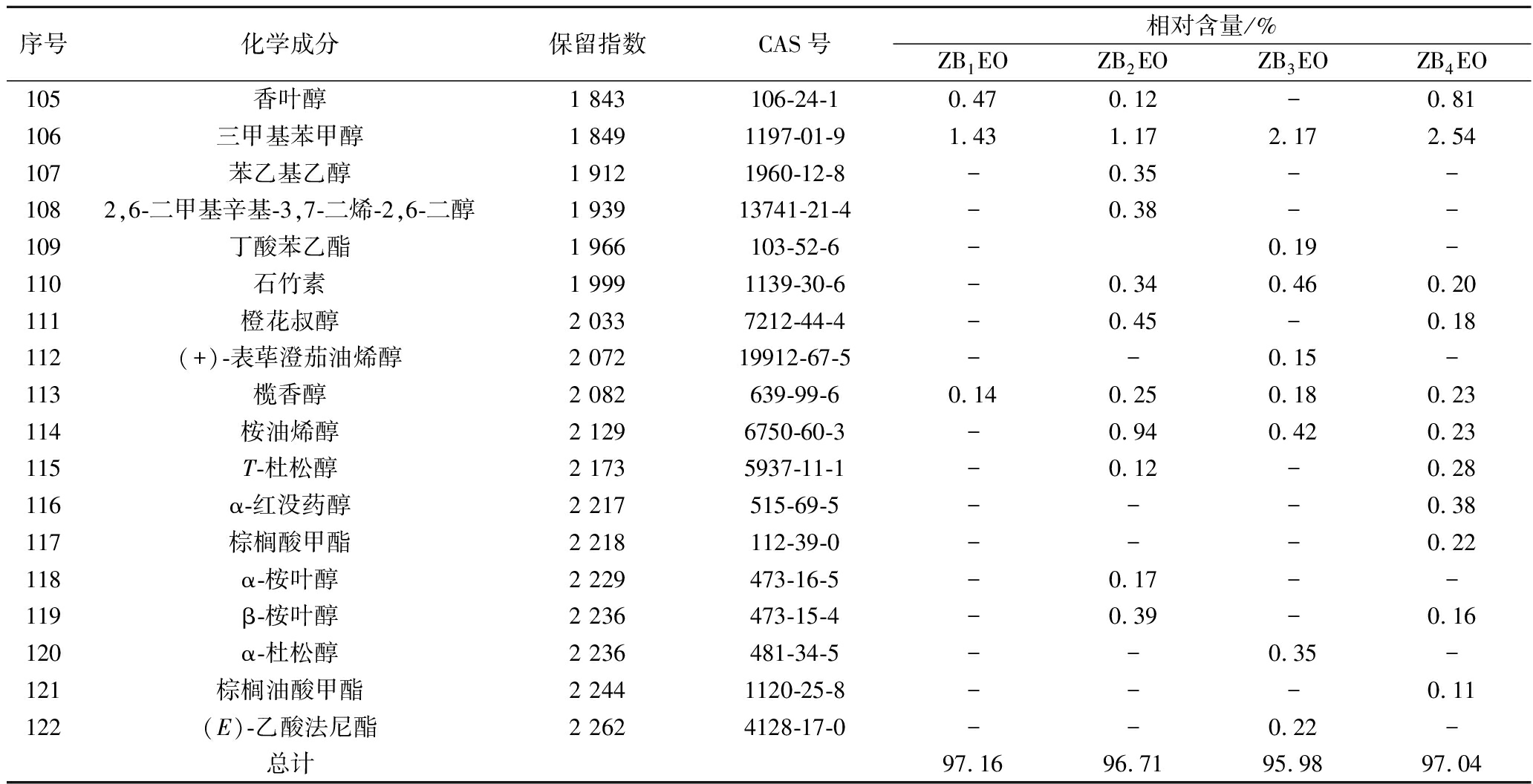
2.1.2 ZBEOs的成分分析
从ZB1EO、ZB2EO、ZB3EO和ZB4EO中分别鉴定出55、67、67、80种成分(相对含量>0.10%),占总成分的95.98%~97.16%。受试红花椒精油中均富含芳樟醇(4.68%~22.75%)、β-月桂烯(5.31%~17.02%)、柠檬烯(5.76%~9.78%)和桧烯(1.80%~6.18%)。其中ZB2EO中芳樟醇(22.75%)、柠檬烯(9.78%)和桧烯(7.18%)相对含量最高,ZB3EO中β-月桂烯的相对含量最高,达17.02%(附表https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CAPJ&dbname=CAPJLAST &filename=SPFX20220511003)。
花椒精油化学组成与花椒的品种、产地、提取方法等多个因素有关[20]。LI等[21]采用水蒸气蒸馏法从陕西红花椒中提取精油,运用GC-MS从ZBEOs中鉴定出39种化合物,占总成分的96.29%,其主要成分为D-柠檬烯(22.19%)、β-月桂烯(9.66%)、反式-β-罗勒烯(9.58%)、萜烯-4-醇(8.96%)和γ-萜烯(4.45%)。LEI等[22]以安徽红花椒为原料,采用超临界二氧化碳萃取法制备ZBEOs,运用GC-MS从ZBEOs共鉴定出48种化合物,占中成分的98.77%,其主要成分为6,9,12,15-十六碳四烯酸甲酯(12.40%)、4-松油基乙酸酯(11.87%)、D-柠檬烯(8.28%)、桉叶醇(5.69%)和α-松油醇(4.77%)。
2.2 ZBEOs对致口臭菌的抗菌活性
2.2.1 ZBEOs对致口臭菌的抑制效果
ZBEOs对具核梭杆菌和牙龈卟啉单胞菌的MIC和MBC值如表2所示。受试ZBEOs对具核梭杆菌和牙龈卟啉单胞菌的MIC分别为1~2 mg/mL和2~4 mg/mL,MBC分别为1~4 mg/mL和4~8 mg/mL。其中ZB2EO对具核梭杆菌和牙龈卟啉单胞菌的MIC和MBC值最小,MIC分别为1 mg/mL和2 mg/mL,MBC分别为1 mg/mL和4 mg/mL。
由ZBEOs对2种致口臭菌MIC和MBC值的结果可知,受试ZBEOs对2种致口臭菌均具有一定的抑制作用,其中ZB2EO的抑制效果最佳。研究发现,芳樟醇[23]和柠檬烯[24]对荧光假单胞菌、大肠杆菌、金黄色葡萄球菌和铜绿假单胞菌具有良好的抗菌活性,可用作食品抗菌剂。ZB2EO的抗菌活性可能与其组成中芳樟醇和柠檬烯相对含量较高,以及不同组分之间的协同作用有关[25]。根据本实验结果,选用ZB2EO进行后续试验。
表2 ZBEOs对2种致口臭菌MIC和MBC值 单位:mg/mL
Table 2 MIC and MBC value of ZBEOs against the two halitosis-causing bacteria

菌种ZB1EOZB2EOZB3EOZB4EOMICMBCMICMBCMICMBCMICMBC具核梭杆菌 24111124牙龈卟啉单胞菌48244448
2.2.2 ZB2EO对致口臭菌生长的影响
ZB2EO对具核梭杆菌和牙龈卟啉单胞菌生长的影响结果如图1所示。空白组中无ZB2EO添加,受试菌的生长曲线呈典型“S”型,具核梭杆菌和牙龈卟啉单胞菌分别在10 h和28 h后进入对数期,又分别在38 h和60 h后进入稳定期。在迟缓期将ZB2EO(1×MIC)加入培养基,生长曲线呈平缓直线状,表明受试菌增殖停止。在细菌生长对数期加入ZB2EO(1×MIC),菌液OD值缓慢增长后停止,表明ZB2EO可有效抑制受试菌的增殖。此结果与LEI等[22]报道的1×MIC ZBEO(MIC=24 mg/mL)在体外对大肠杆菌生长的抑制效果相似,在细菌生长的不同时期加入ZBEO(1×MIC)均可有效抑制细菌增殖。

a-空白组,未添加ZB2EO(1×MIC);b-对数期组,在对数中期 (分别在18 h和46 h)添加ZB2EO(1×MIC);c-迟缓期组,在0 h 添加ZB2EO(1×MIC) A-具核梭杆菌;B-牙龈卟啉单胞菌
图1 ZB2EO(1×MIC)对具核梭杆菌和 牙龈卟啉单胞菌生长的影响
Fig.1 Effects of ZB2EO (1×MIC) on the growth of F.nucleatum and P.gingivalis
2.2.3 ZB2EO对致口臭菌微观结构的影响
经ZB2EO处理后具核梭杆菌和牙龈卟啉单胞菌的微观结构变化如图2所示。阴性对照组中的具核梭杆菌呈细长饱满的纺锤状。经12 mg/mL CHX处理后,具核梭杆菌细胞膜向内收缩,菌体表面有明显褶皱。与12 mg/mL CHX处理结果不同,经ZB2EO(1×MIC)处理后细菌通透性发生明显变化。阴性对照组中的牙龈卟啉单胞菌呈圆润的短棒状。而经12 mg/mL CHX和ZB2EO(1×MIC)处理后,牙龈卟啉单胞菌菌体明显变形、收缩和破碎。
扫描电子显微镜结果直观的反映出经ZB2EO(1×MIC)处理后,具核梭杆菌和牙龈卟啉单胞菌的形态结构严重损伤。精油可以穿透细胞壁并破坏细胞膜,从而对细菌的代谢产生负面影响,甚至导致细菌死亡[26]。研究表明,经1×MIC肉桂精油(MIC=6.25 μg/mL)处理后,牙龈卟啉单胞菌细胞膜通透性改变、形态被严重破坏[27]。LEI等[22]发现经1×MIC ZBEO(MIC=24 mg/mL)处理后,大肠杆菌严重变形,表面呈凹陷、皱缩状,细菌形态的改变可能是由于ZBEO改变了细胞膜通透性,导致细菌内容物的泄漏所致。本研究结果与ZBEO对其他病原菌的作用结果较为一致,由此推测,ZB2EO(1×MIC)可能通过破坏具核梭杆菌和牙龈卟啉单胞菌的细胞膜,改变细胞膜通透性,导致其不能维持正常的生理结构,从而发挥抗菌作用。

图2 ZB2EO(1×MIC)对2种致口臭菌微观结构的影响 (×10 000)
Fig.2 Effects of ZB2EO (1×MIC) on the microstructure against the two halitosis-causing bacteria (×10 000)
2.3 ZB2EO对致口臭菌的抗生物膜活性
2.3.1 ZB2EO清除致口臭菌生物膜的能力
ZB2EO清除2种致口臭菌生物膜的能力如图3所示,ZB2EO对生物膜的清除能力存在剂量依赖性。ZB2EO对具核梭杆菌和牙龈卟啉单胞菌生物膜的MBEC50分别为4 mg/mL和8 mg/mL,清除率分别为(55.47±1.28)%和(55.66±1.71)%。当浓度高于MBEC50时,ZB2EO对具核梭杆菌和牙龈卟啉单胞菌生物膜的清除能力与阳性对照组相当(P>0.05)。当质量浓度为2~8 mg/mL时,ZB2EO对具核梭杆菌生物膜的清除能力极显著高于对牙龈卟啉单胞菌生物膜的清除能力(P<0.01)。生物膜能抵御宿主防御机制、抗生素和其他环境波动等影响,赋予了细菌抵抗外界恶劣环境的能力,难以清除[7]。当肉桂精油浓度为4×MIC时(MIC=6.25 μg/mL),可清除33.5%牙龈卟啉单胞菌生物膜[27]。研究表明,对伞花烃和γ-萜品烯对变形链球菌B200生物膜的MBEC50分别169 μg/mL和379 μg/mL[28]。此外,经1×MIC芳樟醇(MIC=0.5%)处理8 h后即可降低单核细胞增生李斯特氏菌生物膜中56.6%的生物量[29]。ZB2EO中含有对伞花烃、γ-萜品烯和芳樟醇,结合本试验结果推测,ZB2EO可能具有替代化学抗菌剂防治口臭的潜力。
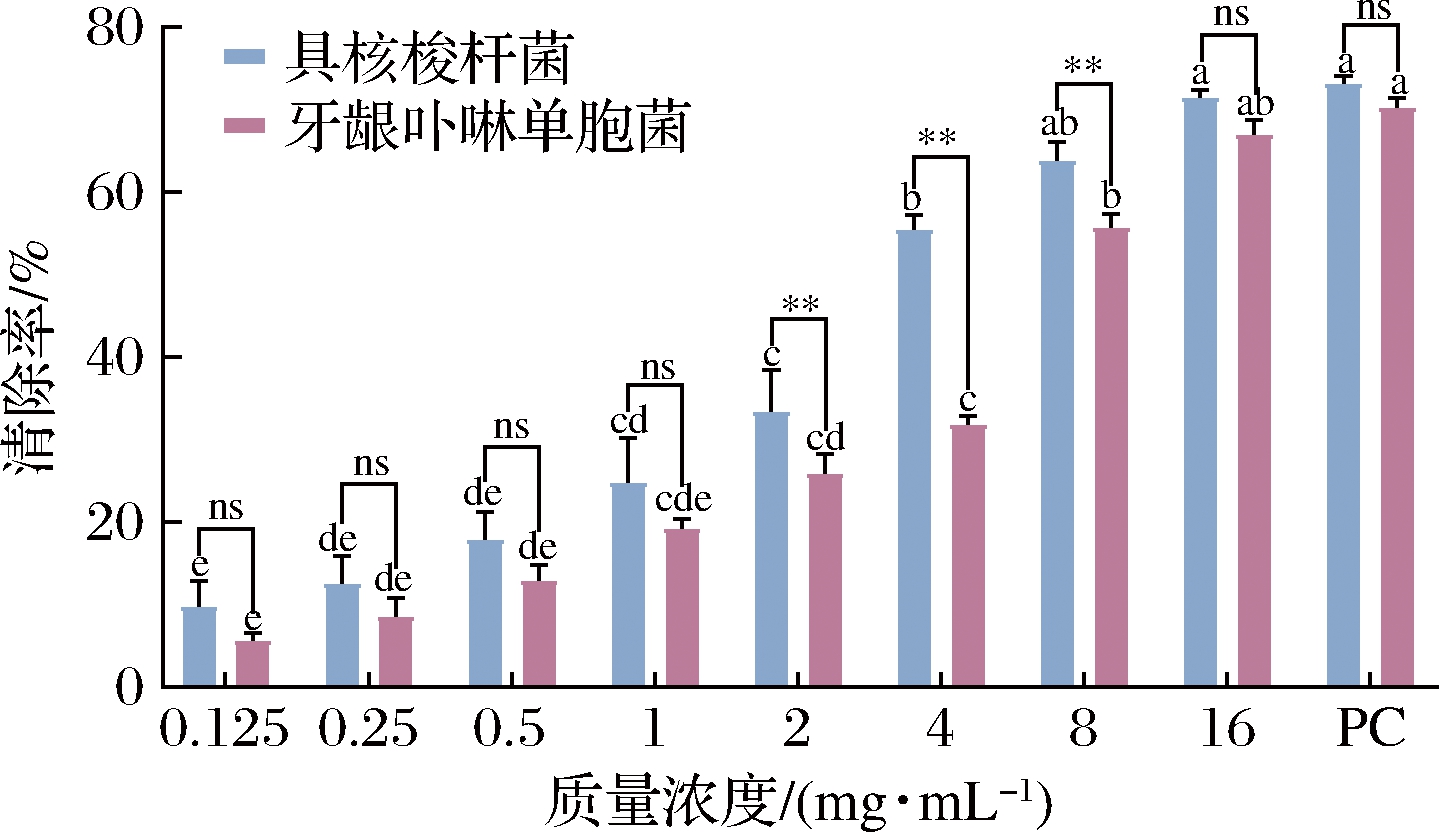
图3 ZB2EO清除2种致口臭菌生物膜的能力
Fig.3 Eradication ability of ZB2EO against the two halitosis-causing bacteria biofilms 注:不同字母表示同菌种不同浓度之间差异显著(P<0.05), **表示同浓度不同菌种之间差异极显著(P<0.01),ns表示 同浓度不同菌种之间差异不显著(P>0.05);PC代表阳性对照组
2.3.2 ZB2EO对致口臭菌生物膜结构的影响
ZB2EO(1×MBEC50)对受试菌生物膜的影响如图4所示,活菌经SYTO 9染色呈绿色荧光,死菌经PI染色呈红色荧光。阴性对照组中,生物膜中具核梭杆菌和牙龈卟啉单胞菌大量存活,且结构致密、生物膜形状完整。经ZB2EO(1×MBEC50)和12 mg/mL CHX处理后,生物膜结构呈松散状,膜中具核梭杆菌和牙龈卟啉单胞菌出现大量死亡但同时存在少许活菌。ZB2EO对具核梭杆菌和牙龈卟啉单胞菌的MBEC50大于其对2种受试菌的MBC值。由此推测,ZB2EO可能通过杀死生物膜内细菌,从而发挥清除生物膜作用。郭佳婧[29]研究发现,经柑橘精油处理后,单核细胞增生李斯特氏菌生物膜中的生物量减少,生物膜明显变薄,与本研究结果相似。
如前所述,ZB2EO化学组成复杂,含有多种具有抗菌和抗生物膜活性的化合物。其中,对伞花烃、γ-萜品烯[28]和芳樟醇[29]可与细菌细胞膜结合,破坏菌体细胞膜完整性,使菌体内容物泄露,从而发挥抗菌活性,导致生物膜内生物量减少。而β-石竹烯则可与细菌胞外酶结合,通过抑制酶的活性间接影响细菌生物膜的形成与发展[30]。然而,ZB2EO是否可通过抑制致口臭菌的毒力因子(如菌毛、产酸、产糖等)而发挥抗生物膜活性,有待进一步研究。
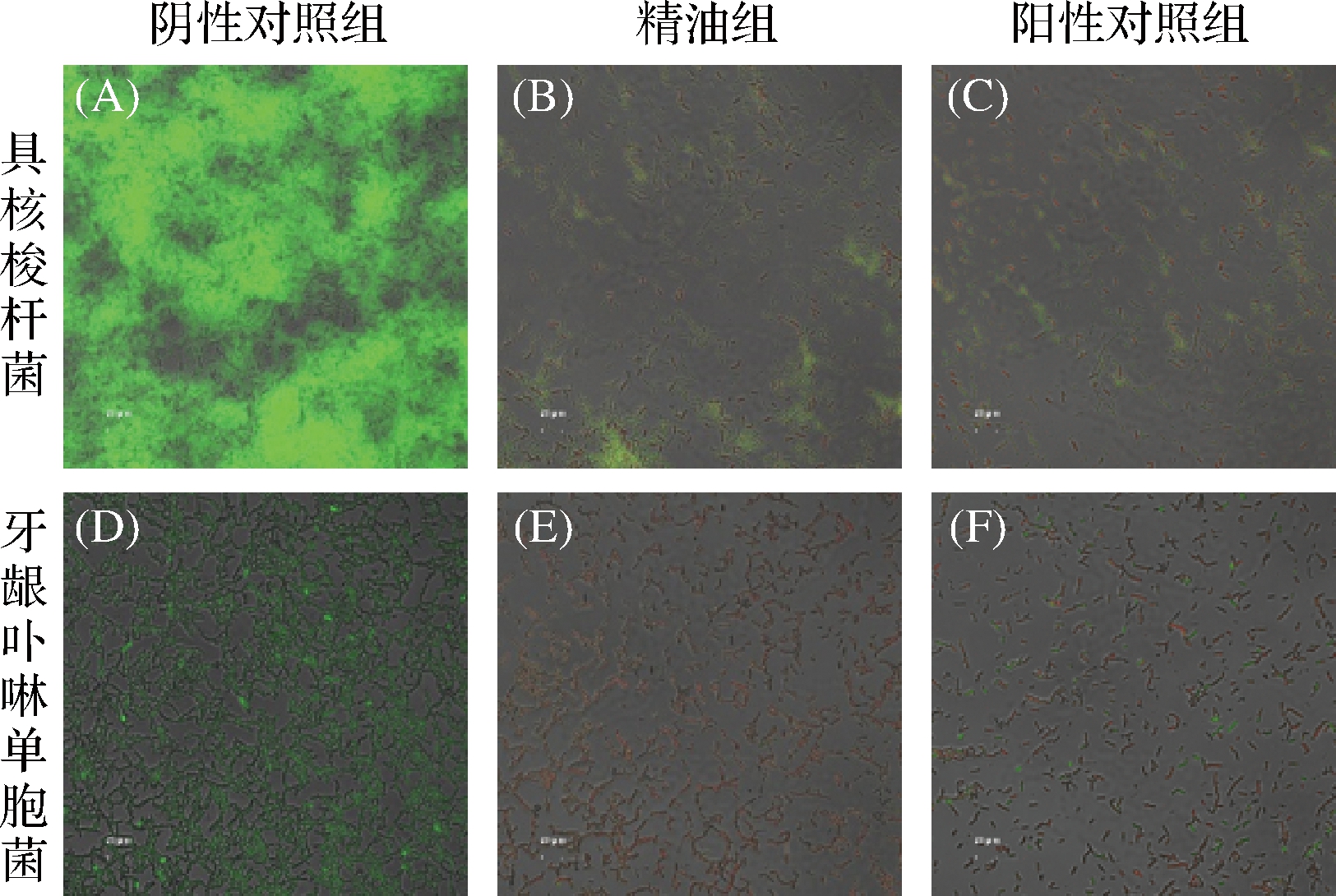
图4 ZB2EO对2种致口臭菌生物膜结构的影响
Fig.4 Effects of ZB2EO against the two halitosis-causing bacteria biofilm structure
3 结论
本研究分析了我国4个代表性产地ZBEOs的主要化学成分,首次评估了ZBEOs对具核梭杆菌和牙龈卟啉单胞菌的抗菌和抗生物膜活性。研究结果表明,从云南红花椒果皮中提取的精油(ZB2EO)的抗菌活性最强,并能有效清除受试菌生物膜,但其具体抗菌和抗生物膜机制有待进一步研究。后期体外研究可从基因学角度出发,探讨ZBEOs对具核梭杆菌和牙龈卟啉单胞菌毒力因子相关基因表达的影响。但考虑到人体口腔微生态的复杂性,ZBEOs在体内使用是否安全,能否发挥相应的抗菌作用,宜通过动物模型进行深入研究,以期为ZBEOs在口腔中的应用提供理论参考。
[1] 袁新跃, 胡丽霞, 印方平, 等.气相色谱-串联质谱法测定花椒中氯菊酯的不确定度评定[J].食品与发酵工业, 2021, 47(20):291-296.
YUAN X Y, HU L X, YIN F P, et al.Uncertainty evaluation of permethrin in Zanthoxylum bungeanum based on gas chromatography-tandem mass spectrometry[J].Food and Fermentation Industries, 2021, 47(20):291-296.
[2] 郝旭东, 张盛贵, 王倩文, 等.四个不同地区大红袍花椒主体风味物质分析研究及香气评价[J].食品与发酵科技, 2021, 57(4):63-74.
HAO X D, ZHANG S G, WANG Q W, et al.Analysis of main flavor compounds and aroma evaluation of Dahongpao Zanthoxylum bungeanum in four different regions[J].Food and Fermentation Sciences & Technology, 2021, 57(4):63-74.
[3] JI Y, LI S M, HO C T, et al.Chemical composition, sensory properties and application of Sichuan pepper (Zanthoxylum genus)[J].Food Science and Human Wellness, 2019, 8(2):115-125.
[4] 童光森. 不同种源大红袍花椒油风味分析及抑菌效果研究[J].中国调味品, 2020, 45(9):38-42.
TONG G S.Study on the flavor analysis and antibacterial effect of Dahongpao Zanthoxylum oils with different provenances[J].China Condiment, 2020, 45(9):38-42.
[5] LI X D, XUE H L.Antifungal activity of the essential oil of Zanthoxylum bungeanum and its major constituent on Fusarium sulphureum and dry rot of potato tubers[J].Phytoparasitica, 2014, 42(4):509-517.
[6] VELOSO D J, ABRAO F, MARTINS C H G, et al.Potential antibacterial and anti-halitosis activity of medicinal plants against oral bacteria[J].Archives of Oral Biology, 2020, 110:104585.
[7] PENESYAN A, GILLINGS M, PAULSEN I T.Antibiotic discovery:Combatting bacterial resistance in cells and in biofilm communities[J].Molecules(Basel,Switzerland), 2015, 20(4):5 286-5 298.
[8] BROOKES Z L S, BESCOS R, BELFIDLD L A, et al.Current uses of chlorhexidine for management of oral disease:A narrative review[J].Journal of Dentistry, 2020, 103:103497.
[9] BROOKES Z L S, LOUISE A B, ANN A, et al.Effects of chlorhexidine mouthwash on the oral microbiome[J].Journal of Dentistry, 2021, 113:103768.
[10] MIZRAHI B, SHAPIRA L, DOMB A J, et al.Citrus oil and MgCl2 as antibacterial and anti-inflammatory agents[J].Journal of Periodontology, 2006, 77(6):963-968.
[11] 王小玉. 柠檬精油对口臭抑制作用的研究[D].天津:天津医科大学, 2017.
WANG X Y.Inhibitation of lemon essential oil on halitosis[D].Tianjin:Tianjin Medical University, 2017.
[12] 国家药典委员会. 中华人民共和国药典-一部:2020年版[M].北京:中国医药科技出版社, 2020.
Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China (Volume 1) [M].Beijing:China Medical Science Press, 2020.
[13] MITROPOULOU G, SIDIRA M, SKITSA M, et al.Assessment of the antimicrobial, antioxidant, and antiproliferative potential of Sideritis raeseri subsp.raeseri essential oil[J].Foods(Basel,Switzerland), 2020, 9(7):860.
[14] YAN Y, CHEN S, NIE Y, et al.Characterization of volatile sulfur compounds in soy sauce aroma type Baijiu and changes during fermentation by GC×GC-TOFMS, organoleptic impact evaluation, and multivariate data analysis[J].Food Research International, 2020, 131:109043.
[15] ZHANG Y B, LIU X Y, WANG Y F, et al.Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J].Food Control, 2016, 59(1):282-289.
[16] ZHANG L L, ZANG L F, HU Q P, et al.Chemical composition, antibacterial activity of Cyperus rotundus rhizomes essential oil against Staphylococcus aureus via membrane disruption and apoptosis pathway[J].Food Control, 2017, 80(1):290-296.
[17] LEBEL G, HAAS B, ADAM A A, et al.Effect of cinnamon (Cinnamomum verum) bark essential oil on the halitosis-associated bacterium Solobacterium moorei and in vitro cytotoxicity[J].Archives of Oral Biology, 2017, 83:97-104.
[18] JARDAK M, MNIF S, AYED R B, et al.Chemical composition, antibiofilm activities of Tunisian spices essential oils and combinatorial effect against Staphylococcus epidermidis biofilm[J].LWT, 2021, 140:110691.
[19] ZHANG Z, LIU Y D, LU M, et al.Rhodiola rosea extract inhibits the biofilm formation and the expression of virulence genes of cariogenic oral pathogen Streptococcus mutans[J].Archives of Oral Biology, 2020, 116:104762.
[20] 张怀予, 王军节, 陈园凡, 等.水蒸气蒸馏法提取花椒精油及挥发性成分分析[J].食品与发酵工业, 2014, 40(7):166-172.
ZHANG H Y, WANG J J, CHEN Y F, et al.Optimization of steam distillation extraction of Zanthoxylum bungeanum essential oil by response surface methodology and essential volatile components analysis[J].Food and Fermentation Industries, 2014, 40(7):166-172.
[21] LI K Y, ZHOU R, JIA W W, et al. Zanthoxylum bungeanum essential oil induces apoptosis of HaCaT human keratinocytes[J].Journal of Ethnopharmacology, 2016, 186:351-361.
[22] LEI H, WU J, WANG Q, et al.Inhibitory effect of Zanthoxylum bungeanum essential oil (ZBEO) on Escherichia coli and intestinal dysfunction[J].Food & Function, 2017, 8(4):1 569-1 576.
[23] GUO F Y, CHEN Q P, LIANG Q, et al.Antimicrobial activity and proposed action mechanism of linalool against Pseudomonas fluorescens[J].Frontiers in Microbiology, 2021, 12:562094.
[24] ![]() , FREITASA P R, DOS SANTOS BARBOSA C R.GC-MS-FID characterization and antibacterial activity of the Mikania cordifolia essential oil and limonene against MDR strains[J].Food and Chemical Toxicology, 2020, 136:111023.
, FREITASA P R, DOS SANTOS BARBOSA C R.GC-MS-FID characterization and antibacterial activity of the Mikania cordifolia essential oil and limonene against MDR strains[J].Food and Chemical Toxicology, 2020, 136:111023.
[25] OUSSALAH M, CAILLET S, SAUCIER L, et al.Inhibitory effects of selected plant essential oils on the growth of four pathogenic bacteria:E.coli O157:H7, Salmonella typhimurium, Staphylococcus aureus and Listeria monocytogenes[J].Food Control, 2007, 18(5):414-420.
[26] WANG X L, XU F X, ZHANG H H, et al.Orthogonal test design for optimization of the extraction of essential oil from Asarum heterotropoides var.Mandshuricum and evaluation of its antibacterial activity against periodontal pathogens[J].3 Biotech, 2018, 8(11):473-483.
[27] WANG Y, ZHANG Y, SHI Y Q, et al.Antibacterial effects of cinnamon (Cinnamomum zeylanicum) bark essential oil on Porphyromonas gingivalis[J].Microbial Pathogenesis, 2018, 116:26-32.
[28] MILADI H, ZMANTAR T, KOUIDHI B, et al.Synergistic effect of eugenol, carvacrol, thymol, p-cymene and γ-terpinene on inhibition of drug resistance and biofilm formation of oral bacteria[J].Microbial Pathogenesis, 2017, 112:156-163.
[29] 郭佳婧. 柑橘精油对单核细胞增生李斯特氏菌的抗菌活性与机理研究[D].长沙:湖南大学, 2020.
GUO J J.The study on the antibacterial activity and mechanism of citrus essential oils against Listeria monocytogenes[D].Changsha:Hunan University, 2020.
[30] YOO H J, JWA S K.Inhibitory effects of β-caryophyllene on Streptococcus mutans biofilm[J].Archives of Oral Biology, 2018, 88:42-46.