欧李(又称“钙果”)是我国独有特殊的沙生药用植物,蔷薇科樱属矮生小灌木[1]。欧李中含有丰富的营养物质,如蛋白质、矿质元素、维生素以及原花青素等酚类化合物[2-3]。原花青素一般呈红棕色粉末且易溶于水,是一种生物类黄酮[4],具有抗氧化、抗癌、降血糖等作用[5-6]。肝脏作为动物体内最大的器官,为全身各组织器官供应血液,长期肝损伤是不可逆的,会进一步发展成肝硬化或者肝癌[7-8],现代生活中的汽车尾气、化工厂排出的废水废气,不健康饮食和过度饮酒都是导致化学性肝损伤发病率不断增高的诱因,如何有效预防和改善化学性肝损伤越来越受到人们重视[9]。有研究发现,其他植物如葡萄籽和莲房中的原花青素分别对小鼠和大鼠肝损伤有一定保护作用[10-11],但尚未见有研究证明欧李中的原花青素对肝有保护作用。CCl4是一种无色液体,吸入或者口服会肝中毒、引起肝功能衰竭[12]。CCl4进入生物体内代谢产生自由基和氧活性物质,和肝细胞膜脂质发生过氧化反应,破坏肝细胞膜的完整性和结构[13]。本实验拟研究欧李中原花青素清除自由基的能力,再探讨对CCl4诱导小鼠肝损伤的保护作用,为欧李作为副产品在食品及医药行业的开发应用提供新的思路。
1 材料与方法
1.1 实验动物
4周龄ICR雄性小鼠60只,购自宁夏医科大学,许可证号:SCXK(宁)2020-0001。动物实验在宁夏医科大学动物实验中心进行,所有动物实验均经过宁夏医科大学实验动物伦理委员会(伦理审查号:IACUC-NYLAC-2020-186)审查批准,实验过程严格遵守动物福利伦理与3R原则。动物饲养于SPF级动物房,相对湿度(50±10)%,温度(22±2) ℃,每12 h明暗轮换。
1.2 材料与试剂
欧李购于宁夏中卫地区的农大四号。欧李原花青素,实验室自制(欧李原花青素含量24.28 mg/g,由AB-8型大孔树脂纯化后纯度最高可达58.53%),通过高效液相色谱-质谱联用技术测得欧李原花青素含有十余种原花青素种类,主要单体为表儿茶素,其次是原花青素B2。制备流程如下:
原料预处理(去核,冻干,粉碎)→有机溶剂浸提→减压浓缩浸提液→离心除蛋白→低温处理后抽滤除果胶→乙酸乙酯萃取→石油醚沉淀→冷冻干燥沉淀物→粗品→纯化
原花青素标准品,源叶生物科技;抗坏血酸,北京博奥拓达科技有限公司;过硫酸钾,天津市大茂化学试剂厂;四氯化碳,上海麦克林生化科技有限公司;2,2-二氮-双(3-乙基苯并噻唑-6-磺酸)铵盐、联苯双脂,上海源叶生物科技有限公司;DPPH标准品,梯希爱化成工业发展有限公司;丙氨酸转氨酶(alanine aminotransferase,ALT)测定试剂盒、天冬氨酸转氨酶(aspartate aminotransferase,AST)测定试剂盒、氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒、琥珀酸脱氢酶(succinate dehydrogenase,SDH)测定试剂盒,南京建成生物工程研究所。
1.3 仪器与设备
TG16-W离心机,湖南湘仪实验室仪器开发有限公司;HH-3A数显恒温水浴锅,国华电器有限公司;BioTek酶标仪,西安腾领生物科技有限公司;麦克奥迪MOTIC生物显微镜,南京贝登医疗股份有限公司。
1.4 实验方法
1.4.1 欧李原花青素体外抗氧化活性研究[14-16]
1.4.1.1 ABTS阳离子自由基清除能力
7.4×10-3mol/mL ABTS与2.6×10-6mol/mL过硫酸钾体积比1∶1混合,避光放置到溶液变为绿色,用无水乙醇稀释至734 nm处的吸光值为0.7±0.02,分别加入1.0 mL质量浓度为1、2、3、4、5、6、7、8、9、10 μg/mL的原花青素样品液、抗坏血酸溶液,原花青素标准品溶液,再加入2.0 mL ABTS阳离子自由基工作液,混合摇匀室温下反应几分钟后在波长734 nm下测吸光度A1。
1.4.1.2 DPPH自由基清除能力
抗坏血酸、欧李原花青素、原花青素标准品溶于甲醇溶液,分别配制成质量浓度为1、2、3、4、5、6、7、8、9、10 g/mL的样品液,加入3.8 mL DPPH-甲醇溶液,快速混匀反应30 min后在波长515 nm下测定吸光值A1。
上述实验空白用蒸馏水代替样品,测出吸光度为A0,分别计算ABTS阳离子自由基、DPPH自由基的清除率,计算如公式(1)所示:
清除率![]()
(1)
式中:A0为空白上清液的吸光度;A1为样品上清液的吸光度。
1.4.2 动物实验设计与模型建立
60只4周龄ICR雄性小鼠,适应性饲养1周后随机分为正常组、模型组、阳性组、欧李原花青素低、中、高剂量组,每组10只,除正常组外,其余各组每隔3 d腹腔注射1次CCl4和橄榄油的混合物1 mL/kg(体积比为1∶3),正常组腹腔注射等量橄榄油。阳性组给予联苯双脂50 mg/kg、欧李原花青素低、中、高分别给药25、50、100 mg/kg[17]。每日1次,连续灌胃5周。末次给药后,小鼠禁食不禁水18 h,麻醉后心脏取血后处死。迅速取出小鼠肝、脾、肾脏组织并称重,取部分肝脏和肾脏做苏木精-伊红(hematoxylin-eosin staining,HE)染色。另一部分迅速采用液氮速冻,移至-80 ℃备用[18]。
1.4.3 小鼠体重及脏器指标测定
实验期间每隔3 d记录1次小鼠体重,小鼠处死后,立即取出小鼠肝、脾、肾脏进行称重,按公式(2)计算小鼠脏器指数:
脏器指数![]()
(2)
式中:m1为小鼠脏器质量,g;m2为小鼠体重,g。
1.4.4 小鼠肝脏指标测定
精确称取0.5 g肝脏组织,用无菌生理盐水制成10%肝组织匀浆,5 000 r/min离心15 min,取上清液稀释并测定小鼠肝组织MDA含量、GSH-Px和SOD活力大小,严格按照试剂盒说明书操作。
1.4.5 小鼠血清指标测定
末次给药后,麻醉心脏取血,静置20 min,3 000 r/min离心10 min制备血清。测定小鼠血清中AST和ALT水平,严格按照试剂盒说明书操作测定。
1.4.6 小鼠肝脏病理观察
取肝脏和肾脏未有机械损伤部分于4%(体积分数)多聚甲醛中固定24 h后,脱水包埋,定位切片,做HE染色,最后镜检。
1.4.7 数据分析
所有实验重复3次,实验数据采用Origin 8.5软件工具进行分析。
2 结果与分析
2.1 欧李原花青素体外抗氧化活性分析
如图1和图2所示,原花青素标准品、欧李原花青素提取样品和抗坏血酸对于ABTS阳离子自由基和DPPH自由基的清除率与3种样品使用浓度呈正相关,且ABTS阳离子自由基清除率最终可以达到100%。相同浓度条件下,3种样品对ABTS阳离子自由基和DPPH自由基的清除率由高到低的顺序均为:原花青素标准品>欧李原花青素提取样品>抗坏血酸。
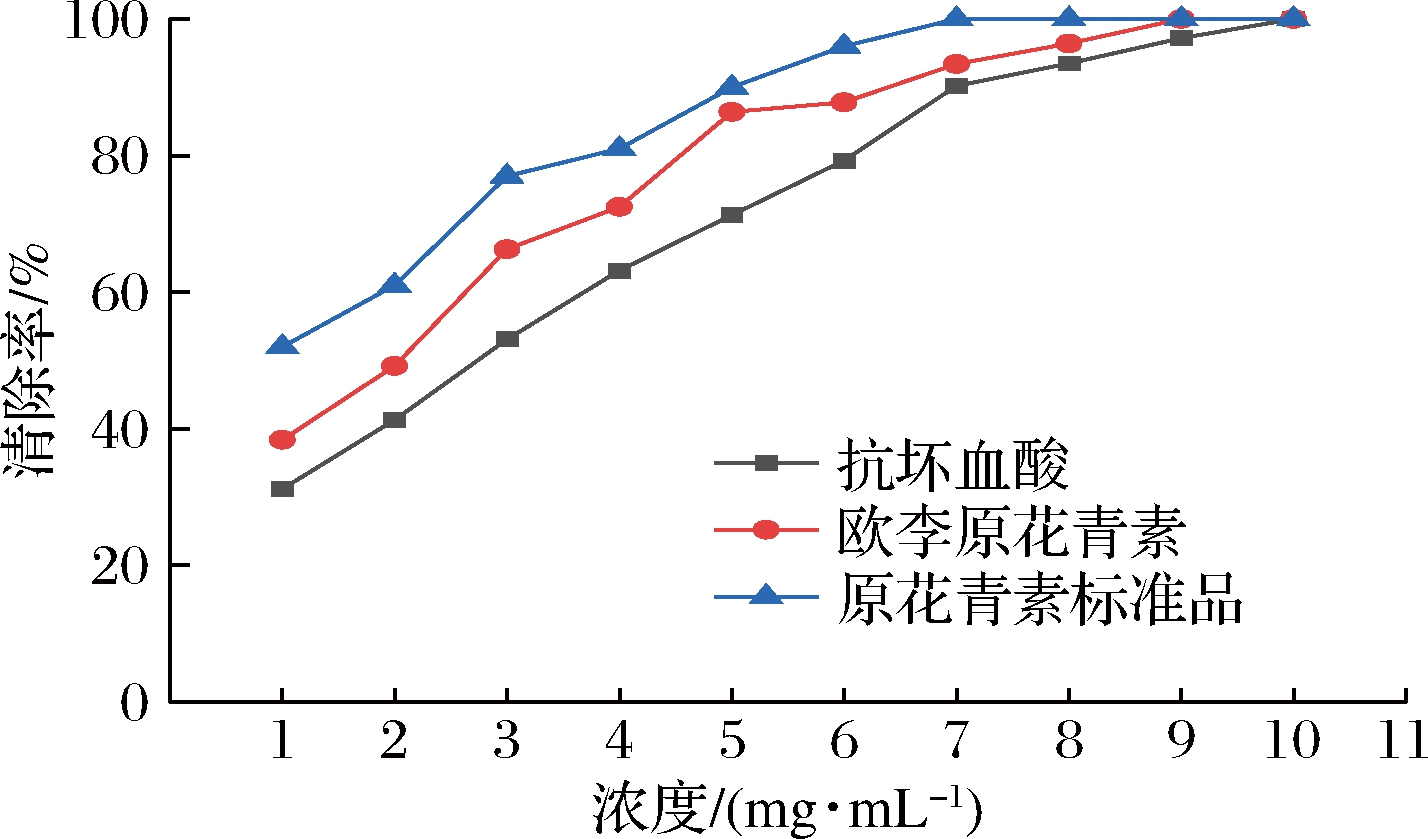
图1 欧李原花青素对ABTS阳离子自由基的清除作用
Fig.1 The scavenging effect of Cerasus humilis proanthocyanidins on ABTS cationic radicals

图2 欧李原花青素对DPPH自由基清除作用
Fig.2 The scavenging effect of Cerasus humilis proanthocyanidins on DPPH free radicals
2.2 欧李原花青素对小鼠体重及脏器指数的影响
如图3所示,自然生长的情况下,小鼠的平均体重呈增长趋势,模型组比正常组整体体重减轻。由图4可知,对比正常组、模型组小鼠肝脏质量上升,肝脏指数显著增加(P<0.05),说明CCl4能导致肝脏一定程度上病变肿大。与模型组相比,高剂量组小鼠肝脏指数为模型组的90.55%,说明欧李原花青素能显著抑制CCl4造成的肝组织肿大趋势。脾脏为机体的淋巴器官,含淋巴细胞和巨噬细胞,在免疫系统中起重要作用。因此,脾脏指数可作为免疫反应功能变化的参考指标[19]。欧李原花青素中、高剂量组的肾脏和脾脏指数都有所降低,说明激发了小鼠机体的免疫反应,抑制脂肪在肝组织中的沉积和脾肾组织肿大效果更明显。
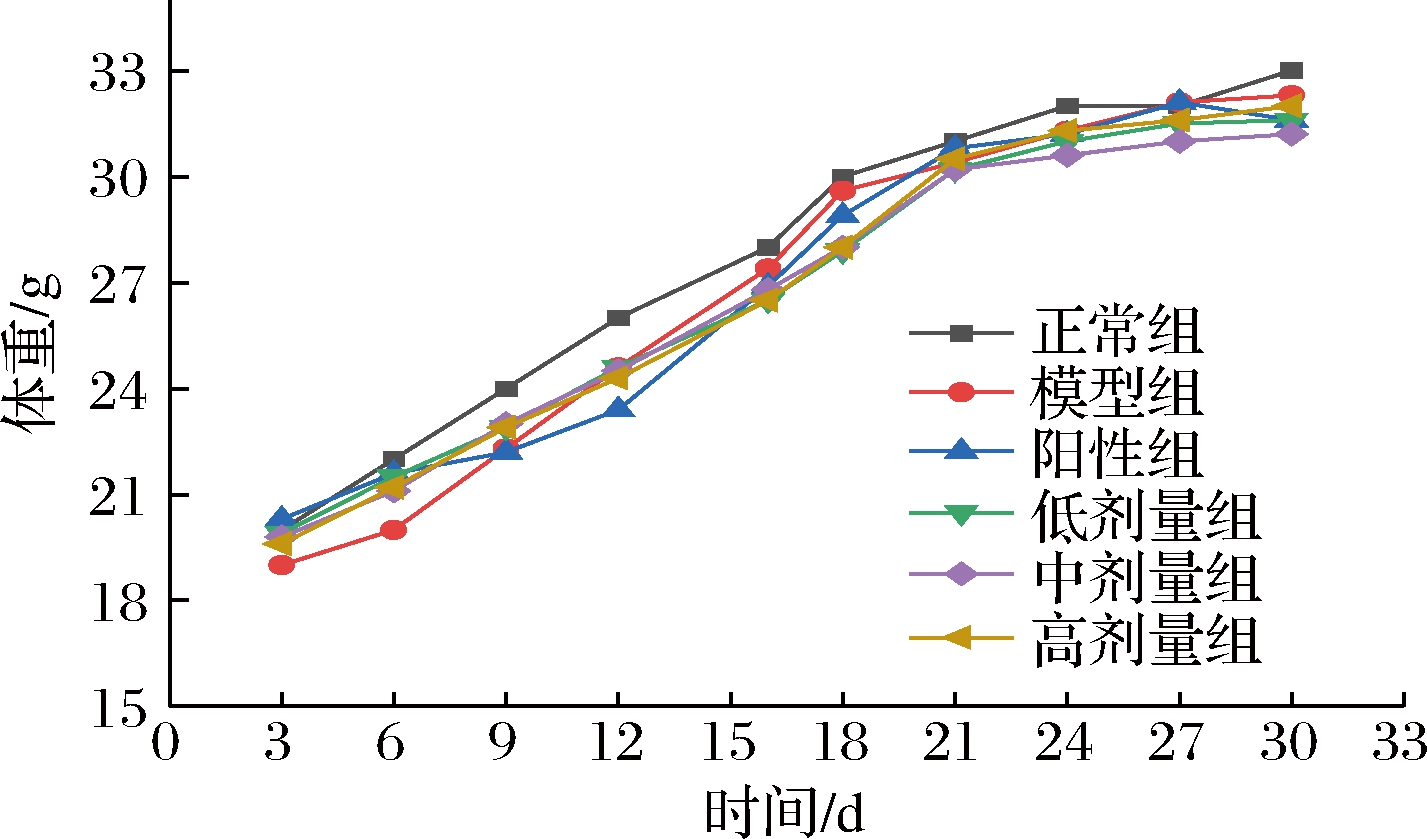
图3 小鼠体重指标
Fig.3 Body weight index of mice in each group
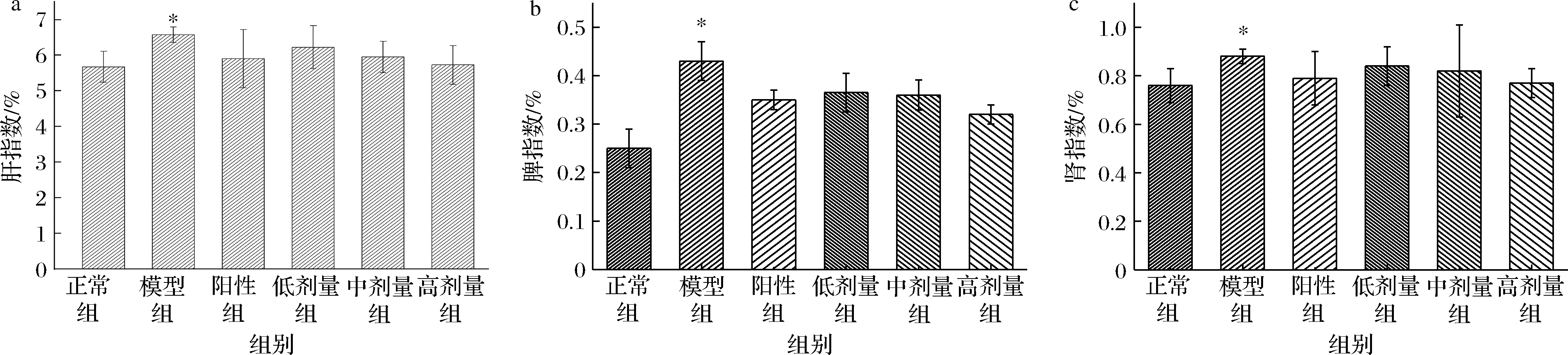
a-肝指数;b-脾指数;c-肾指数
图4 小鼠脏器指数
Fig.4 Organ index of mice in each group 注:与正常组比较,*代表P<0.05, **代表P<0.01;与模型组比较,#代表P<0.05,##代表P<0.01(下同)
2.3 欧李原花青素对小鼠肝脏酶活力的影响
如图5所示,与正常组相比,模型组MDA值显著升高(P<0.05),SOD、GSH-Px值显著下降(P<0.05);与模型组相比,欧李原花青素中、高剂量组SOD、GSH-Px活性极显著增加(P<0.01),MDA含量极显著下降(P<0.01)。MDA值是脂质过氧化的终产物,其活性大小可以反映脂质过氧化程度,活性越高表明对人体肝损伤越大[20]。结果表明,欧李原花青素各剂量组能够提高机体抗氧化酶的活性,加速体内清除自由基的能力,降低脂质过氧化发生,原花青素在小鼠体内通过提升机体的抗氧化能力来减少CCl4对肝细胞的损伤,对CCl4引起的化学性肝损伤有较好的保护作用。
2.4 欧李原花青素对小鼠血清的影响
由图6可知,与正常组相比,模型组血清中ALT显著上升(P<0.01)、AST显著上升(P<0.05),表明CCl4诱导肝组织损伤模型建立,这是一种常用的模型,与人类肝脏病变相似[21]。肝细胞受到损伤时,其细胞膜通透性增加,胞质会释放出ALT和AST,血清中两者活力会显著升高,是评价肝损伤程度的重要指标[22]。与模型组相比,欧李原花青素中、高剂量组小鼠血清中ALT、AST活性极显著降低(P<0.01),其中高剂量组ALT与AST活性分别比模型组降低了82.46%和69.41%,强于阳性药物联苯双酯(29.15%、8.80%)。结果表明,欧李原花青素高剂量可以降低肝细胞膜的通透性,保护肝组织由于CCl4引起的损伤。
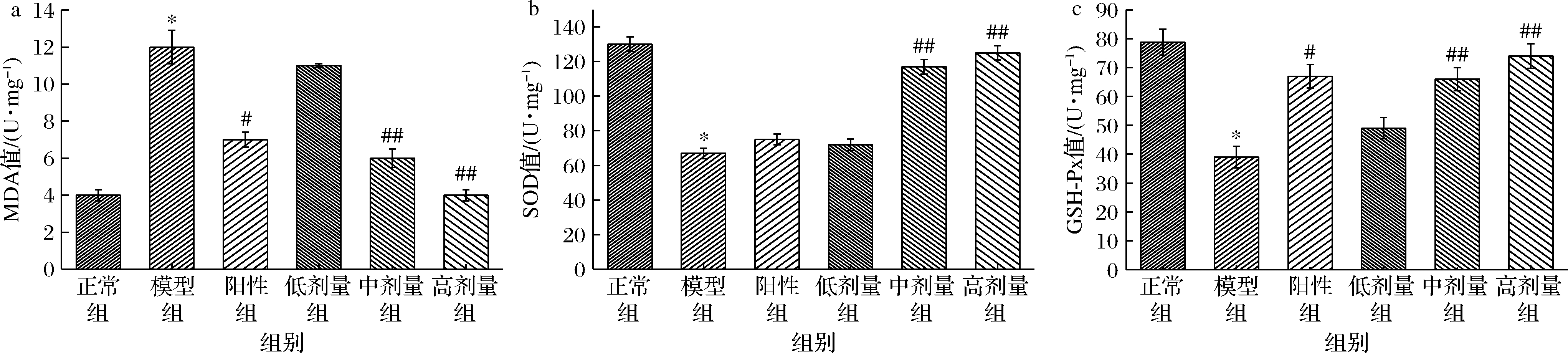
a-MDA值;b-SOD值;c-GSH-Px值
图5 小鼠肝脏指标
Fig.5 Liver index of mice in each group

a-ALT值;b-AST值
图6 欧李原花青素对小鼠血清水平的影响
Fig.6 Effect of Cerasus humilis proanthocyanidins on serum in mice
2.5 肝组织病理观察结果
CCl4诱导的肝损伤是一种化学性模型,肝细胞会出现弥漫性脂肪变性[23]。如图7所示,正常组肝组织结构正常,肝细胞形状规则,排列整齐且形态清晰,模型组对比正常组有多处细胞死亡,细胞结构模糊且杂乱无章,箭头处可以看到细胞间有明显脂肪变性。欧李原花青素组随着剂量增高,肝细胞中的脂肪变性有显著缓解,但是低、中剂量组还是有明显的脂肪变性,说明欧李原花青素可能具有护肝作用,且与剂量呈正相关。
3 结论与讨论
本实验通过腹腔注射CCl4建立肝损伤模型,CCl4在人体肝脏内进行一系列代谢,生成三氯甲基、氯自由基、羟自由基等,这些自由基会造成细胞脂质过氧化性损伤,使得肝细胞中ALT、AST得到充分释放导致血清中ALT、AST含量明显升高,脂质过氧化物MDA升高[24-25]。给予欧李原花青素干预后,与模型组相比较,MDA值显著下降,血清中ALT、AST含量也显著降低。结合肝病理观察结果,说明欧李原花青素可以缓解小鼠肝细胞受到的病理损伤。综上所述,欧李原花青素对CCl4造成的肝损伤有保护作用,其作用机理可能与降低脂质过氧化水平、提高肝细胞抗氧化酶活性、清除自由基有关。

a-正常组;b-模型组;c-阳性组;d欧李原花青素低剂量组;e-欧李原花青素中剂量组;f-欧李原花青素高剂量组
图7 CCl4诱导肝损伤小鼠肝组织病理学观察结果
Fig.7 Histopathological examination of CCl4-induced liver injury in mice
[1] WANG R F, HUANG F L, ZHANG J, et al.Establishment of a high-frequency regeneration system in Cerasus humilis, an important economic shrub[J].Journal of Forest Research, 2016, 21(5):244-250.
[2] 李卫东, 顾金瑞.果药兼用型欧李的保健功能与药理作用研究进展[J].中国现代中药, 2017,19(9):1 336-1 340.
LI W D,GU J R.Research progress on healthy function and pharmacological effect in Cerasus humilis of fruit medicine dual-purpose type[J].Modern Chinese medicine,2017,19(9):1 336-1 340.
[3] ZHANG H W, YERIGUI, YANG Y M, et al.Structures and antioxidant and intestinal disaccharidase inhibitory activities of A-type proanthocyanidins from peanut skin[J].Journal of Agricultural and Food Chemistry, 2013,61(37):8 814-8 820.
[4] 韩红艳, 杜俊杰.药食同源果树欧李分子水平研究进展[J].山西果树, 2019(2):12-15.
HAN H Y,DU J J.Medicine food homologous plant research progress of Cerasus humilis[J].Shanxi Fruits, 2019(2):12-15.
[5] LI T, LI Q L, WU W G, et al.Lotus seed skin proanthocyanidin extract exhibits potent antioxidant property via activation of the Nrf2-ARE pathway[J].Acta Biochimica et Biophysica Sinica, 2018,51(1):31-40.
[6] ANJOM-SHOAE J, MILAJERDI A, LARIJANI B, et al.Effects of grape seed extract on dyslipidaemia:A systematic review and dose-response meta-analysis of randomised controlled trials[J].The British Journal of Nutrition, 2020,6:1-14.
[7] 李兆新,何金洋,潘卫松,等.复方肝毒清对急性肝损伤小鼠的护肝作用[J].新中医, 2021,53(16):1-5.
LI Z X, HE J Y, PAN W S, et al.Protective effect of compound Ganduqing on acute liver injury in mice[J].Journal of New Chinese Medicine,2021,53(16):1-5.
[8] 邓青芳, 周欣, 陈华国.多糖抗肝损伤作用及其机制研究进展[J].中国中药杂志, 2016,41(16):2 958-2 967.
DENG Q F, ZHOU X, CHEN H G.Advance in study on hepatoprotective effects and its mechanism of polysaccharides[J].China Journal of Chinese Materia Medica, 2016, 41(16):2 958-2 967.
[9] 洪珊珊. 肝脏疾病临床流行病学与肝脏生化临床价值研究[D].石家庄:河北医科大学, 2014.
HONG S S.Study on clinical epidemiology of liver diseases and clinical value of liver biochemistry[D].Shijiazhuang:Hebei Medical University, 2014.
[10] 王新财,杨和.葡萄籽原花青素对酒精性肝损伤小鼠的保护作用[J].中国现代应用药学,2018,35(7):1 054-1 057.
WANG X C, YANG H.Protective effects of grape seed procyanidin on alcoholic liver injury in mice[J].Chinese Journal of Modern Applied Pharmacy,2018,35(7):1 054-1 057.
[11] 凌智群. 莲房原花青素及其生物、药理活性研究[D].武汉:华中农业大学, 2001.
LING Z Q.Study on procyanidins and its biological, pharmacological activities form the seedpod of Nelumbo nucifera gaertn[D].Wuhan:Huazhong Agricultural University, 2001.
[12] 谷宁宁. 四氯化碳诱导的大鼠急性肝损伤中自噬的作用及其机理研究[D].新乡:河南师范大学, 2016.
GU N N.The effects of autophagy in rat on CCl4-induced acute liver injury and it′s mechanism[D].Xinxiang:Henan Normal University, 2016.
[13] KHAN R A, KHAN M R,SAHREEN S.CCl4-induced hepatotoxicity:Protective effect of rutin on p53, CYP2E1 and the antioxidative status in rat[J].BMC Complementary and Alternative Medicine, 2012, 12:178.
[14] 王满生, 杨晶, 王延周.莲房原花青素提取纯化及其抗氧化活性研究进展[J].食品科技, 2020, 45(8):174-179.
WANG M S, YANG J, WANG Y Z.Research progress on extraction, purification and antioxidant activities of Lotus seedpod procyanidins[J].Food Science and Technology, 2020, 45(8):174-179.
[15] 梁佩诗, 周旺, 江振洲, 等.补骨脂素通过延缓肝再生加重四氯化碳所致肝毒性的机制研究[J].中国中药杂志, 2020,45(12):2 916-2 923.
LIANG P S, ZHOU W, JIANG Z Z,et al.Mechanism of psoralen in aggravating hepatotoxicity induced by CCl4 by delaying liver regeneration[J].China Journal of Chinese Materia Medica, 2020, 45(12):2 916-2 923.
[16] 于立恒, 许静, 李诚诚, 等.白芍总苷对急性肝损伤小鼠肝脏保护作用的研究[J].河南中医, 2020,40(5):738-741.
YU L H, XU J, LI C C,et al.Study on the protective effect of total glucosides of paeony on acute liver injury in mice[J].Henan Traditional Chinese Medicine, 2020, 40(5):738-741.
[17] 李绍波, 刘雪梅, 毕倩宇, 等.柿叶总黄酮对急性肝损伤小鼠肝组织的保护作用[J].西北药学杂志,2020,35(1):72-76.
LI S B, LIU X M, BI Q Y, et al.Protective effect of persimmon leaf total flavonoids on acute liver injury in mice[J].Northwest Pharmaceutical Journal, 2020, 35(1):72-76.
[18] 任敏霞, 吴素香, 詹淑玉, 等.白芍总苷及其所含主要成分芍药苷和芍药内酯苷对四氯化碳致小鼠急性肝损伤的保护作用[J].中华中医药学刊, 2020,38(5):244-247;283.
REN M X, WU S X, ZHAN S Y, et al.Protective effects of total glucosides of paeony and its main components paeoniflorin and albiflorin in carbon tetrachloride-induced acute liver injury[J].Chinese Archives of Traditional Chinese Medicine, 2020, 38(5):244-247;283.
[19] 胡涛. 细胞因子及脾脏淋巴细胞凋亡在重症急性胰腺炎大鼠发病机制中的作用[D].唐山:河北联合大学, 2011.
HU T.The study on the role of cytokines and spleen lymphocyte apoptosis in rat severe acute pancreatitis[D].Tangshan:Hebei Union University, 2011.
[20] 杨牧祥,田元祥, 姚树坤,等.解酒护肝饮对酒精性肝损伤大鼠血清和肝组织MDA、GSH的影响[J].河北中医药学报, 2000, 15(4):1-5;14.
YANG M X,TIAN Y X,YAO S K, et al.The effect of anti-alcohol & liver-protection drink on blood serum and liver tissue MDA and GSH of rat with alcoholic liver injury[J].Journal of Hebei Traditional Chinese Medicine and Pharmacology, 2000, 15(4):1-5;14.
[21] LIN Y C, CHENG K M, HUANG H Y, et al.Hepatoprotective activity of Chhit-Chan-Than extract powder against carbon tetrachloride-induced liver injury in rats[J].Journal of Food and Drug Analysis, 2014, 22(2):220-229.
[22] 张扬, 朱彩平, 林杨楠, 等.平菇多糖对四氯化碳诱导雄性昆明种小鼠肝损伤的保护作用[J].食品科学, 2019, 40(23):157-162.
ZHANG Y, ZHU C P, LIN Y N, et al.Hepatoprotective effect of Pleurotus ostreatus polysaccharides on carbon tetrachloride-induced liver injury in male Kunming mice[J].Food Science,2019, 40(23):157-162.
[23] 侯伊雪. 外源线粒体纠正四氯化碳诱导的肝纤维化与治疗机制研究[D].重庆:西南大学,2020.
HOU Y X.Exogenous mitochondria corrects carbon tetrachloride-induced liver fibrosis and its therapeutic mechanism[D].Chongqing:Southwest University, 2020.
[24] MART N-GARC
N-GARC A B, PASINI F, VERARDO V, et al.Optimization of sonotrode ultrasonic-assisted extraction of proanthocyanidins from brewers′spent grains[J].Antioxidants(Basel,Switzerland), 2019, 8(8):282.
A B, PASINI F, VERARDO V, et al.Optimization of sonotrode ultrasonic-assisted extraction of proanthocyanidins from brewers′spent grains[J].Antioxidants(Basel,Switzerland), 2019, 8(8):282.
[25] TUNGMUNNITHUM D, DROUET S, KABRA A, et al.Enrichment in antioxidant flavonoids of stamen extracts from Nymphaea lotus L.using ultrasonic-assisted extraction and macroporous resin adsorption[J].Antioxidants(Basel,Switzerland), 2020, 9(7):576.