藤椒,学名竹叶花椒(Zanthoxylum armatum DC.,Z. armatum),属芸香科花椒属落叶植物,具有独特的“香、麻”风味,是一种特色的药食同源资源[1-2]。藤椒具有抗炎镇痛、降血糖等功效[3-4]。在我国主要分布于西南等地,其中在四川省种植历史悠久,尤以洪雅的藤椒种植较早[5]。
新鲜藤椒果实为翠绿色,表面布满油胞,水分含量高[6],极易褐变、霉变,因此大多加工为藤椒油[7]。藤椒油常见生产方法与花椒油类似,有油浸法(閟制法)、压榨法、CO2超临界萃取、溶剂萃取法、微波提取法等[8-10]。不同工艺生产的藤椒油呈现以香气为主、麻味为辅的风味,其中“麻”和“香”由藤椒中的主要化学成分酰胺类和挥发油类组成[11]。
藤椒作为农产品或农副产品,大多数企业加工为藤椒油产品销售。尽管目前藤椒油的工艺有很多,但对不同工艺制备的藤椒油中主要麻味物质含量及挥发性风味成分的比较鲜有报道。因此,本实验以鲜榨工艺、閟制工艺和CO2超临界萃取3种不同加工工艺制备的藤椒油为样品,采用HPLC测定藤椒油中主要麻味物质含量及顶空固相微萃取联合气相色谱-质谱法(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)测定挥发性风味成分的组成,以期为藤椒油产品的开发及标准建立提供技术参考,为进一步研究藤椒油的生产加工奠定基础。
1 材料与方法
1.1 材料与试剂
鲜榨藤椒油、閟制藤椒油和CO2超临界萃取藤椒油由幺麻子食品股份有限公司提供,菜籽油购于成都新兴粮油有限公司。
色谱纯甲醇、分析纯甲醇、色谱纯乙腈,成都市科隆化学品有限公司;羟基-α-山椒素标准品、羟基-β-山椒素标准品、羟基-γ-山椒素标准品,成都普思生物科技股份有限公司。
1.2 仪器与设备
ME-204分析天平,梅特勒-托列多仪器(上海)有限公司;FD-15-F-500A粉粹机,浙江永康市奋斗工程有限公司;YM-040S超声波清洗器,深圳市方奥微电子有限公司;DZKW-S-4恒温水浴锅,北京市光明医疗仪器有限公司;1260高效液相色谱仪、Agilent CTC-8890—5977B气相色谱-质谱联用仪,美国安捷伦。
1.3 实验方法
1.3.1 藤椒油加工工艺
1.3.1.1 鲜榨加工工艺
鲜榨藤椒油的加工工艺如图1所示。
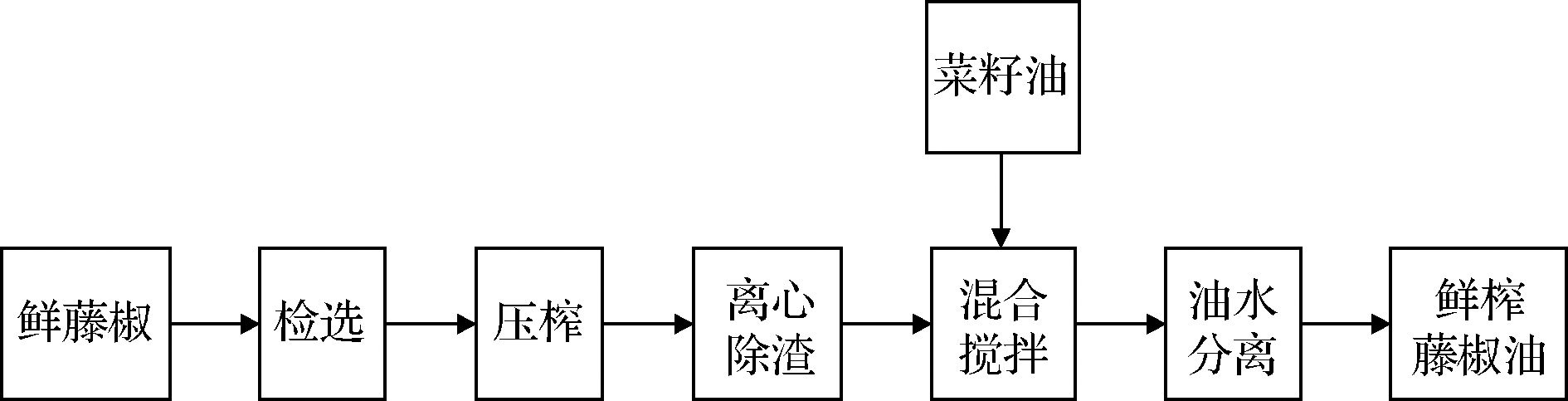
图1 鲜榨藤椒油加工工艺
Fig.1 Processing technology of freshly squeezed Z. armatum oil
1.3.1.2 閟制加工工艺
閟制藤椒油的加工工艺如图2所示。
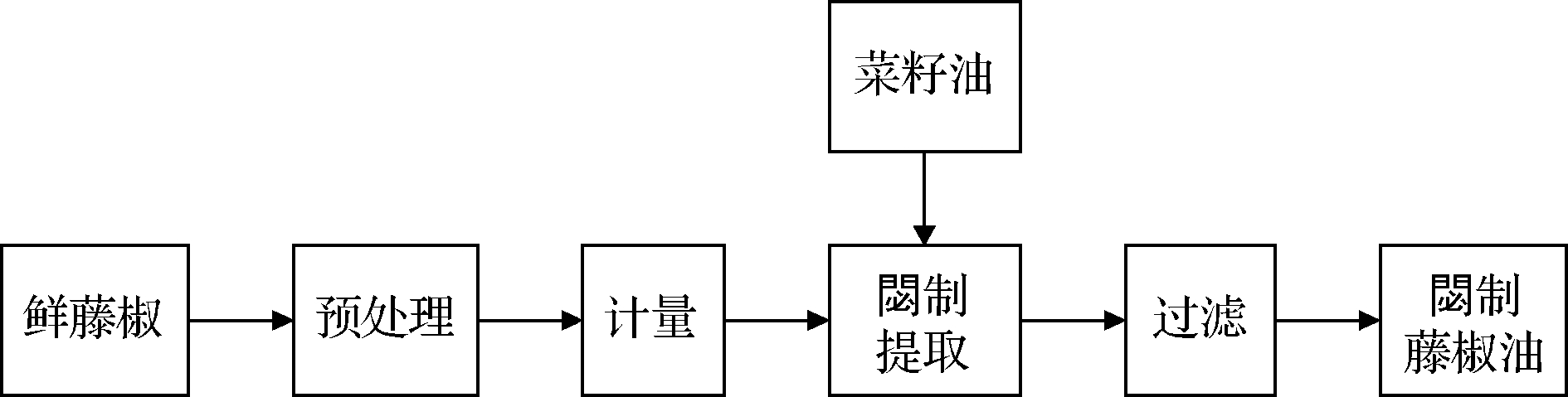
图2 閟制藤椒油加工工艺
Fig.2 Processing technology of fried Z. armatum oil
1.3.1.3 CO2超临界萃取藤椒油加工工艺
CO2超临界萃取藤椒油的加工工艺如图3所示。

图3 CO2超临界萃取藤椒油加工工艺
Fig.3 Processing technology of supercritical CO2 extraction of Z. armatum oil
1.3.2 藤椒油感官评定方法
感官评价小组一共有12名,其中男、女各6名。由经过专业培训并具有熟悉感官评定方法的人员组成,参考感官品质评分标准对人员进行色泽、气味、滋味及组织形态培训描述,同时熟悉藤椒油相关知识。藤椒油评价要求及标准如表1所示[12]。
表1 藤椒油感官品质评分标准
Table 1 The Sensory quality scoring standard of Z.armatum oil

项目(权重)评价标准色泽(28分)黄褐色、光泽明显(22~28)黄褐色、光泽较明显(15~21)黄褐色、光泽暗淡(8~14)黄褐色、无光泽感(0~7)气味(37分)藤椒芳香味纯正浓郁(28~37)藤椒芳香味纯正、较浓(19~27)藤椒芳香味淡(10~18)几乎无藤椒芳香味(0~9)滋味(14分)口味清爽、麻味绵长、柔和、持久(11~14)口味清爽、麻味绵长、柔和、较持久(7~10)口味较清爽、麻味绵长、持续时间短(4~6)口味不清爽、麻味重、不持久(0~3)组织形态(21分)透明油状液体、无杂质(17~21)微浊油状液体、无杂质(12~17)浑浊油状液体、无杂质(6~11)浑浊油状液体、底部可见沉淀物(0~5)
1.3.3 藤椒油麻味物质的测定
1.3.3.1 样品处理
准确称取1.000 0 g(精确至0.000 1 g)藤椒油加入20.0 mL色谱级甲醇后,置于离心管涡旋1 min后在超声波中浸提10 min,超声结束后在4 500 r/min的条件下离心5 min,取上清液转入25.0 mL棕色容量瓶中定容。制得的样品在进样前使用0.22 μm的有机相过滤膜过滤至进样瓶中,-20 ℃冷冻保藏待用[13]。
1.3.3.2 液相色谱条件
1260型高效液相色谱仪,色谱柱Agilent Eclipse XDB-C18(4.6 mm×150 mm,5 μm),检测器DAD,流动相为超纯水(A)-乙腈(B),检测波长268 nm,柱温35 ℃,流速0.8 mL/min,进样量10 μL。洗脱程序如表2所示。
表2 HPLC洗脱程序
Table 2 HPLC elution procedure
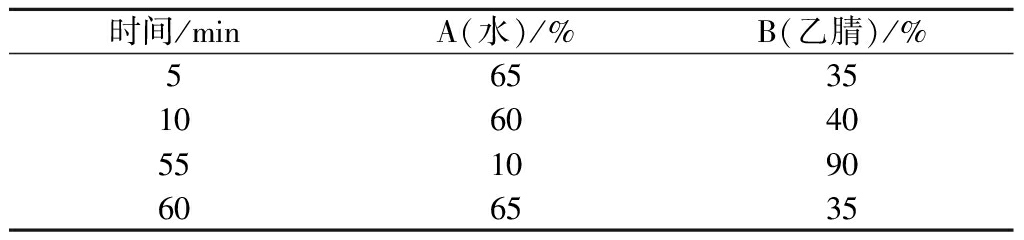
时间/minA(水)/%B(乙腈)/%56535106040551090606535
1.3.3.3 羟基-α-山椒素标准曲线的绘制
准确称取羟基-α-山椒素标准品0.010 0 g(精确至0.000 1 g),用色谱级甲醇溶液定容于10.0 mL的棕色容量瓶中,配制成质量浓度为1 mg/mL的对照品贮备液。分别吸取对照品贮备液0.1、0.2、0.4、0.8、1.2 mL,用色谱级甲醇定容至2 mL,配制成一系列浓度的羟基-α-山椒素溶液(0.05、0.1、0.2、0.4、0.6 mg/mL)。各浓度分别取10 μL进行HPLC检测,以峰面积为Y轴,浓度为X轴,绘制得到藤椒油麻味物质中羟基-α-山椒素的标准曲线为y=28.347x-185.72,R2=0.999 2。
1.3.3.4 羟基-β-山椒素标准曲线的绘制
准确称取羟基-β-山椒素标准品0.001 0 g(精确至0.000 1 g),用色谱级甲醇溶液定容于10.0 mL的棕色容量瓶中,配制成质量浓度为0.1 mg/mL的对照品贮备液。分别吸取对照品贮备液0.02、0.04、0.08、0.12、0.2 mL,用色谱级甲醇定容至2 mL,配制成一系列浓度的羟基-β-山椒素溶液(0.001、0.002、0.004、0.006、0.01 mg/mL)。各浓度分别取10 μL进行HPLC检测,以峰面积为Y轴,浓度为X轴,绘制得到藤椒油麻味物质中羟基-β-山椒素的标准曲线为y=71.352x+17.05,R2=0.999 8。
1.3.3.5 羟基-γ-山椒素标准曲线的绘制
准确称取羟基-γ-山椒素标准品0.002 0 g(精确至0.000 1 g),用色谱级甲醇溶液定容于10.0 mL的棕色容量瓶中,配制成质量浓度为0.01 mg/mL的对照品贮备液。分别吸取对照品贮备液0.02、0.1、0.2、0.4、0.6 mL,用色谱级甲醇定容至2 mL,配制成一系列浓度的羟基-γ-山椒素溶液(0.000 1、0.000 5、0.001、0.002、0.003 mg/mL)。各浓度分别取10 μL进行HPLC检测,以峰面积为Y轴,浓度为X轴,绘制得到藤椒油麻味物质中羟基-γ-山椒素的标准曲线为y=68.568x-1.702 5,R2=0.999 1。
1.3.3.6 样品中羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素含量的计算
根据样品峰面积从标准曲线中计算出山椒素的浓度,再根据公式(1)计算出样品中羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素的含量:
山椒素含量/(mg·g-1)
(1)
1.3.4 藤椒油挥发性风味成分的测定
1.3.4.1 样品处理
称取样品约0.1 g于5 mL顶空瓶中,压盖密封后,待上机分析。
老化温度250 ℃;进样前老化时间3 min;进样后老化时间3 min;样品平衡温度60 ℃;样品平衡时间10 min;萃取时间20 min;解吸时间3 min。
1.3.4.2 测试条件
色谱条件:色谱柱DB-WAX 50 m×0.25 μm×0.25 mm;程序升温:初始柱温为35 ℃,保持1 min,以5 ℃/min升至230 ℃,保持5 min;载气为高纯He;进样口温度230 ℃,分流比为10∶1;流量1 mL/min;全扫描。
质谱条件:电轰击电离,离子源温度230 ℃,NIST11.1标准谱库检索。
1.3.4.3 定性和定量
挥发性风味成分定性分析时,鲜榨藤椒油、閟制藤椒油和CO2超临界萃取藤椒油的HS-SPME-GC-MS检测结果采用NIST11.1标准谱库检索,从检索结果中选择匹配度>90%的挥发性风味成分,并结合相关文献,确定其化学组成,进行定性分析[14]。
挥发性风味成分定量分析时,根据峰面积归一化法计算藤椒油中挥发性风味成分的相对含量[15-16]。
1.3.5 数据统计分析
采用Microsoft Excel 2010软件处理实验数据和统计分析,运用Visio 2013、Origin 9.0软件作图。
2 结果与分析
2.1 不同加工工艺对藤椒油感官评价的影响
根据藤椒油的感官品质评价结果(图4)可以看出,因加工工艺的不同,鲜榨藤椒油、閟制藤椒油和CO2超临界萃取藤椒油在色泽和气味上存在明显差异。采用鲜榨工艺能够较好地保留新鲜藤椒的色泽及风味,使得加工的鲜榨藤椒油色泽翠绿、藤椒清香风味突出;通过閟制工艺生产的閟制藤椒油呈现出黄褐色的椒香风味,CO2超临界萃取加工工艺制备的藤椒油在色泽、气味上呈现出深褐色的麻香风味。对于滋味和组织形态的结果可以看出3种藤椒油均呈现为口味清爽、麻味绵长、柔和、持久的无杂质透明油状液体。说明3种藤椒油加工工艺能够赋予藤椒油不同的感官品质。
2.2 不同加工工艺对藤椒油麻味物质含量的影响
由图5可知,鲜榨藤椒油、閟制藤椒油和CO2超临界萃取藤椒油HPLC色谱峰的保留时间基本一致,峰面积大小存在区别,其中羟基-α-山椒素的峰面积明显高于羟基-β-山椒素、羟基-γ-山椒素。结合表3可知,3种山椒素的保留时间差异不显著(P>0.05),说明采用不同加工工艺制备藤椒油,其主要麻味物质成分相同。
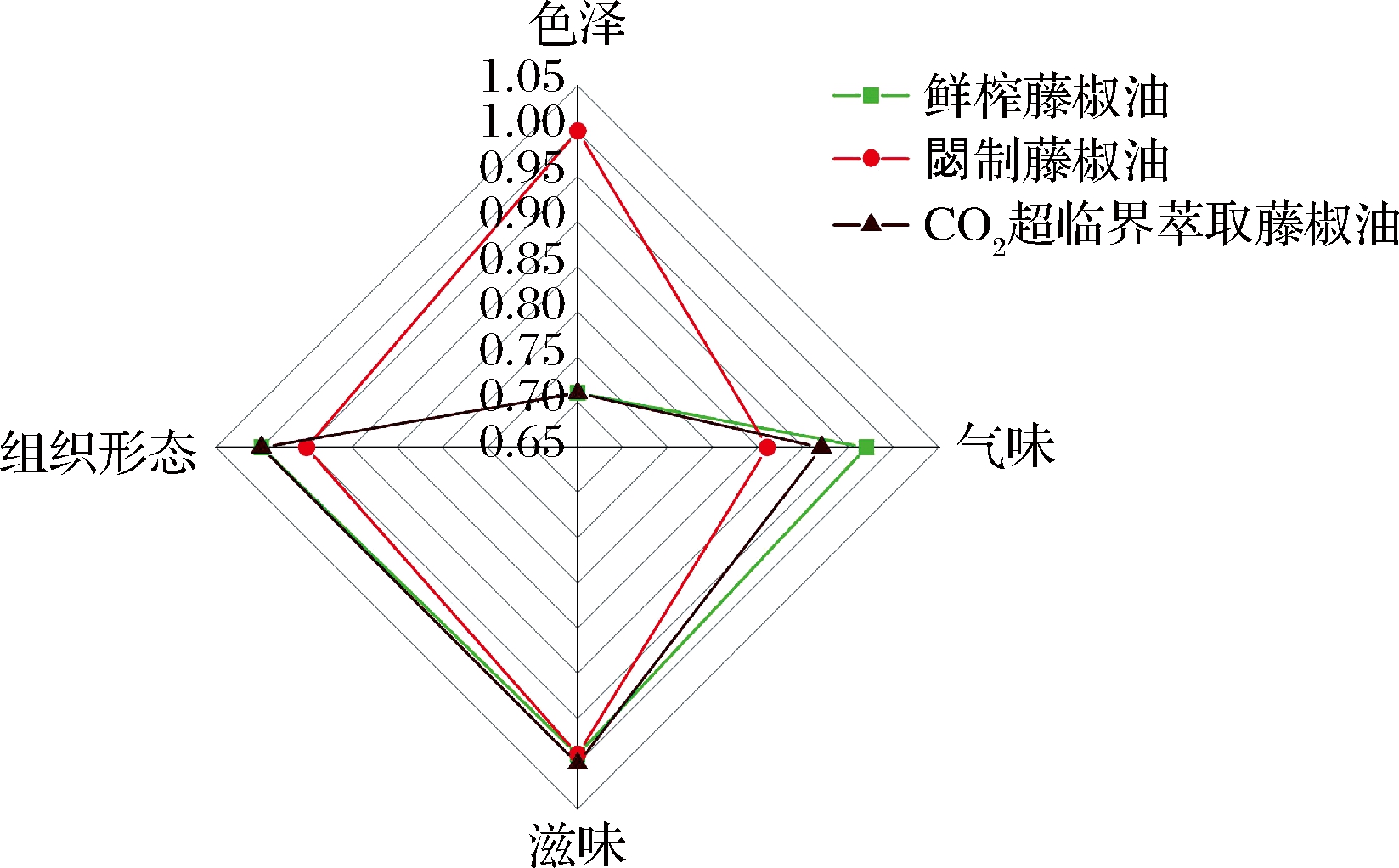
图4 鲜榨、閟制和CO2超临界萃取藤椒油的感官评价雷达图
Fig.4 Sensory radar map of freshly squeezed Z.armatum oil, fried Z.armatum oil and supercritical CO2 extraction of Z.armatum oil
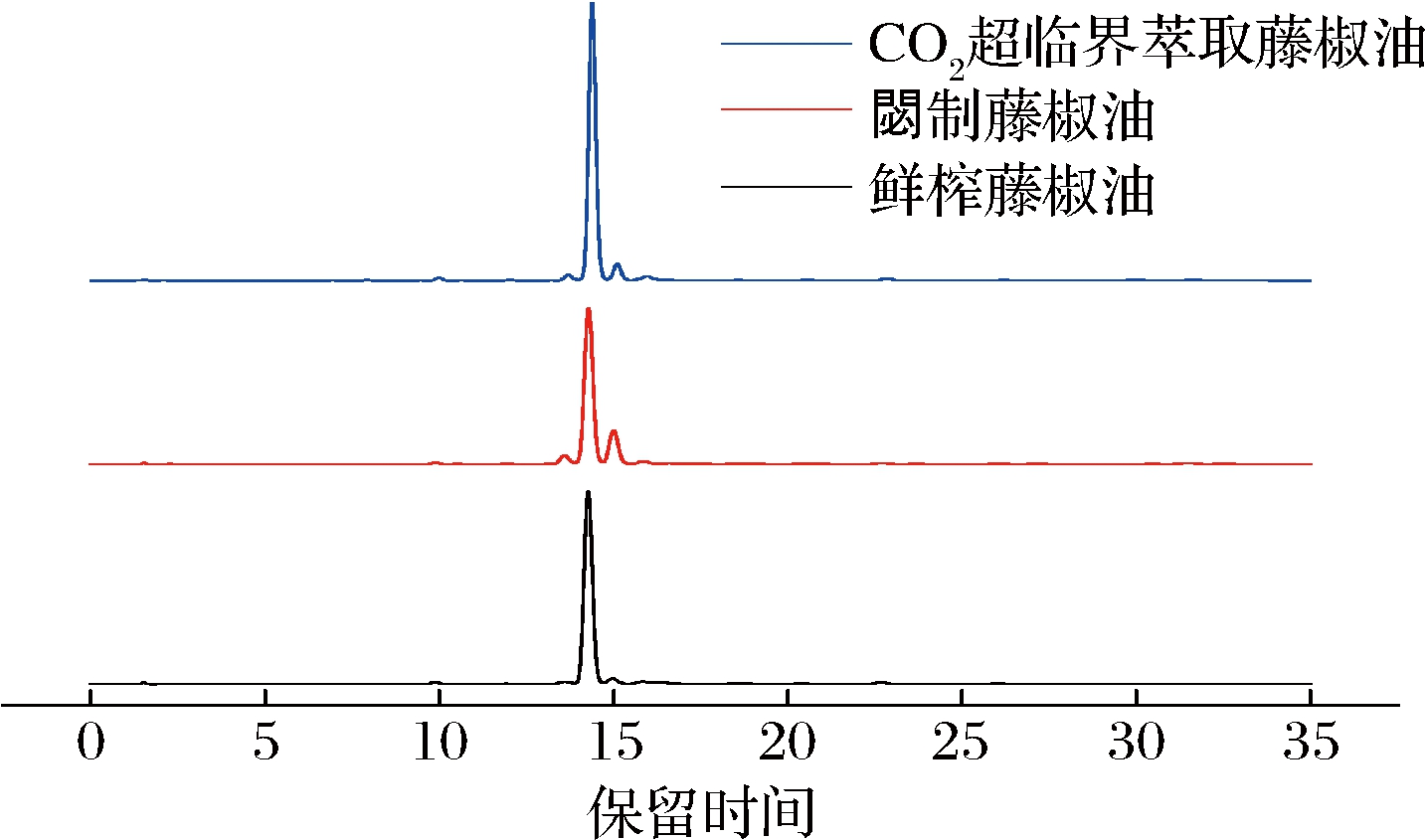
图5 鲜榨、閟制和CO2超临界萃取藤椒油的HPLC色谱图
Fig.5 HPLC chromatograms of freshly squeezed Z.armatum oil, fried Z.armatum oil, and supercritical CO2 extraction of Z.armatum oil
由表3可知,鲜榨藤椒油、閟制藤椒油、CO2超临界萃取藤椒油3种藤椒油的羟基-α-山椒素含量最高,是因为3种藤椒油原料中的主要麻味物质为羟基-α-山椒素[17-18]。ZHAO等[19]对花椒油和和青花椒油的主要麻味物质含量分析也得到了类似的结论。CO2超临界萃取藤椒油中羟基-α-山椒素、羟基-β-山椒素含量及羟基-γ-山椒素显著高于其他2种藤椒油(P<0.05),羟基-α-山椒素含量达到(605.02±7.940) mg/g,分别是鲜榨藤椒油的10倍、閟制藤椒油的86倍;羟基-β-山椒素含量为(48.76±0.673) mg/g,是鲜榨藤椒油的83倍、閟制藤椒油的318倍;羟基-γ-山椒素含量为(1.58±0.004) mg/g,是鲜榨藤椒油的10倍、閟制藤椒油的68倍。超临界萃取可以借助减压、升温的方法使超临界流体CO2变成普通气体,被萃取物质则完全或基本析出,从而达到分离提纯的目的[20],因此CO2超临界萃取藤椒油中3种山椒素的含量均远高出其他2种藤椒油。
鲜榨藤椒油的羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素含量均高于閟制藤椒油。一方面是因为鲜榨藤椒油是由鲜藤椒直接压榨制得,閟制藤椒油则是以菜籽油为媒介浸提出麻味物质,使得閟制藤椒油中鲜藤椒原料占比少;另一方面是因为閟制工艺温度较高,造成不稳定的山椒素发生分解或异构化[21]。
表3 羟基-α-山椒素、羟基-β-山椒素、 羟基-γ-山椒素保留时间及含量
Table 3 The eretention time content of hydroxy-α-sanshool, hydroxy-β-sanshool, and hydroxy-γ-sanshool

样品羟基-α-山椒素羟基-β-山椒素羟基-γ-山椒素保留时间/min含量/(mg·g-1)保留时间/min含量/(mg·g-1)保留时间/min含量/(mg·g-1)鲜榨藤椒油14.28±0.005a56.43±0.458b14.98±0.012a0.59±0.000b22.69±0.012a0.15±0.001b閟制藤椒油14.39±0.010a7.10±1.562c15.11±0.006a0.15±0.034c22.85±0.008a0.02±0.006cCO2超临界藤椒油14.29±0.007a605.02±7.940a15.01±0.005a48.76±0.673a22.71±0.014a1.58±0.004a
注:字母不同表示差异显著(P<0.05)(下同)
2.3 不同加工工艺对藤椒油挥发性风味成分组成和含量的影响
2.3.1 鲜榨藤椒油挥发性风味成分测定结果
鲜榨藤椒油挥发性风味成分结果如表4所示。鲜榨藤椒油挥发性风味成分共计76种,烯类物质有28种、醛类物质有13种、酮类物质有5种、酯类物质有10种、醇类物质有13种、其他有7种,含量最高的是烯类物质,占总数的53.65%。76种鲜榨藤椒油挥发性风味成分中,相对含量大于2%的共有7种,分别为芳樟醇(30.04%)、D-柠檬烯(20.95%)、(-)-β-蒎烯(11.92%)、3-异丙基-6-亚甲基-1-环己烯(5.53%)、乙酸芳樟酯(3.08%)、(Z)-3,7-二甲基-1,3,6-十八烷三烯(2.75%)、α-崖柏烯(2.37%)。与鲜藤椒相同,鲜榨藤椒油中主要挥发性风味成分为芳樟醇、柠檬烯[5]。芳樟醇作为鲜榨藤椒油的主要挥发性风味成分,具有独特的花香、青香、木香、甜香[22];常被作为芳香剂和调味剂添加到洗涤剂和食品中,同时还具备抗菌、抗炎症等功效[23]。梅佳林等[24]研究了芳樟醇对三文鱼源莓实假单胞菌的抑菌机理,结果显示芳樟醇能破坏莓实假单胞菌的细胞膜和细胞壁的通透性和完整性,对细菌有良好的抑制作用。其次,D-柠檬烯是一种单萜类化合物[25],呈现为薄荷味、柑橘味,使得鲜榨藤椒油体现出浓郁的清香风味。
2.3.2 閟制藤椒油挥发性风味成分测定结果
经过高温閟制得到的藤椒油拥有鲜藤椒的清香和麻味,体现出浓郁的椒香风味。閟制藤椒油挥发性风味成分结果如表4所示。閟制藤椒油挥发性风味成分共计78种。烯类物质有18种、醛类物质有23种、酮类物质有8种、酯类物质有4种、醇类物质有13种、其他物质有12种,含量最高的是醇类物质,占总数的43.62%。閟制藤椒油78种挥发性风味成分中,相对含量大于2%的共有6种,分别为芳樟醇(40.57%)、D-柠檬烯(18.54%)、月桂烯(7.28%)、桧烯(5.75%)、3-异丙基-6-亚甲基-1-环己烯(2.97%)、(E,E)-2,4-庚二烯醛(2.75%)。其中,芳樟醇含量高达40.57%,是D-柠檬烯的2.19倍。閟制工艺的高温,导致鲜藤椒中部分不稳定的挥发性风味成分散失或分解,而稳定的D-柠檬烯得到保留。因此,相较于鲜榨藤椒油的芳樟醇,閟制藤椒油的芳樟醇相对含量得到提升。
2.3.3 CO2超临界萃取藤椒油挥发性风味成分测定结果
CO2超临界萃取藤椒油极大的保存藤椒的麻味物质和挥发性风味成分,体现出了浓郁的麻香风味。其挥发性风味成分结果如表4所示。CO2超临界萃取藤椒油挥发性风味成分共计74种。烯类物质有23种、醛类物质有12种、酮类物质有3种、酯类物质有6种、醇类物质有12种、其他物质有18种,含量最高的是烯类物质,占总数的68.01%。其中,相对含量大于2%的共有10种,分别为芳樟醇(17.20%)、D-柠檬烯(16.51%)、桧烯(14.24%)、(-)-β-蒎烯(12.41%)、3-异丙基-6-亚甲基-1-环己烯(3.65%)、α-水芹烯(3.54%)、乙酸芳樟酯(3.41%)、β-可帕烯(2.93%)、(+)-α-蒎烯(2.68%)、β-石竹烯(2.34%)。与鲜榨藤椒油和閟制藤椒油一样,芳樟醇和D-柠檬烯在CO2超临界萃取藤椒油中也是主要挥发性风味成分,但芳樟醇的相对含量显著少于鲜榨藤椒油和閟制藤椒油,D-柠檬烯的差异不显著。一方面是因为CO2超临界萃取藤椒油的原料是干藤椒,鲜榨藤椒油与閟制藤椒油的原料是鲜藤椒,挥发性风味成分存在区别,SRIWICHAT等[26]的研究表明干燥会导致藤椒中芳樟醇的含量降低;另一方面是芳樟醇属于链状结构化合物,D-柠檬烯是环状结构化合物,在面临超临界萃取的高压时,环状结构的D-柠檬烯稳定性高于链状结构的芳樟醇。
表4 藤椒油挥发性风味成分相对含量
Table 4 Relative content of volatile flavor components in Z.armatum oil
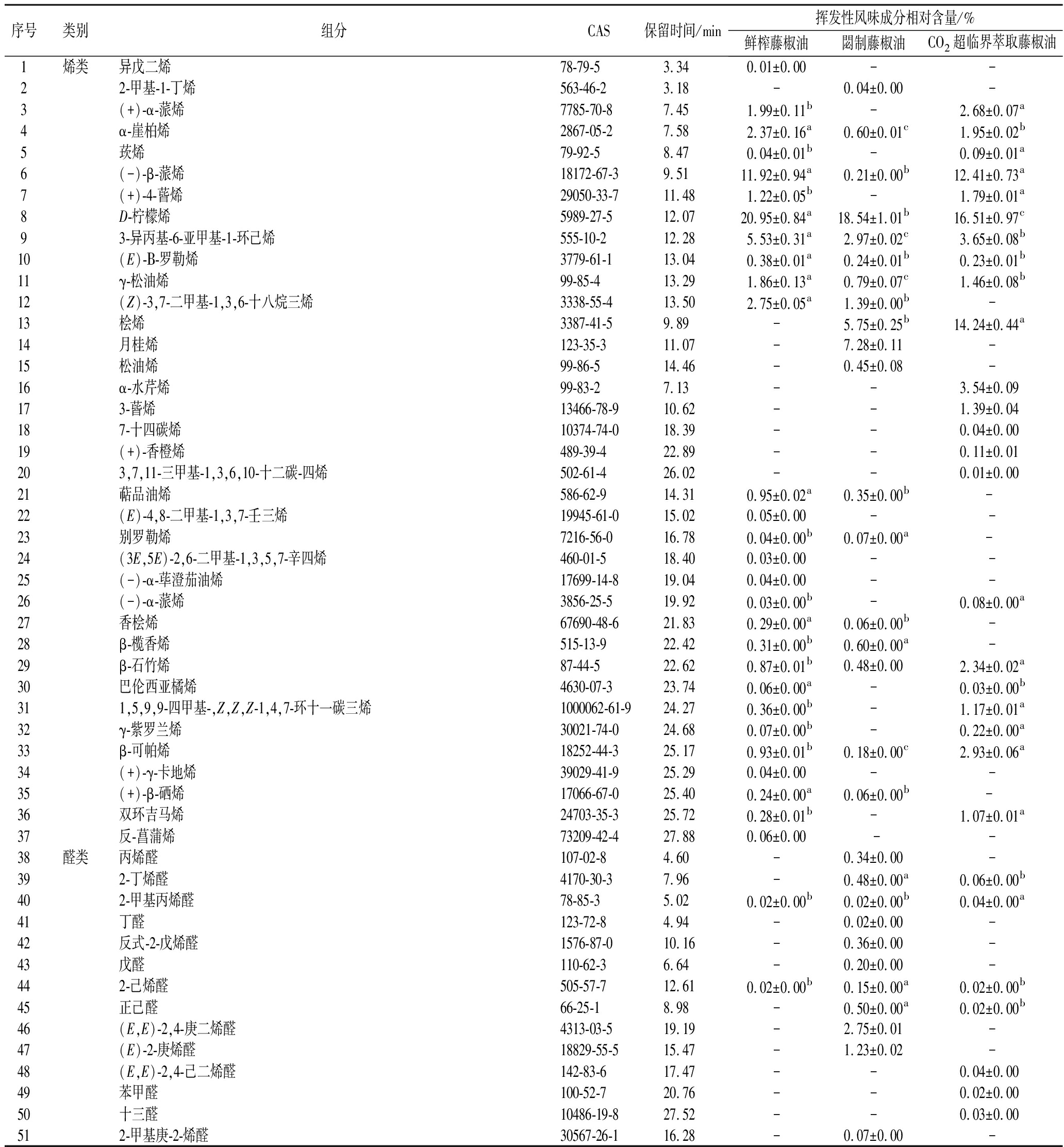
序号类别组分CAS保留时间/min挥发性风味成分相对含量/%鲜榨藤椒油閟制藤椒油CO2超临界萃取藤椒油1烯类异戊二烯78-79-53.340.01±0.00--22-甲基-1-丁烯563-46-23.18-0.04±0.00-3(+)-α-蒎烯7785-70-87.451.99±0.11b-2.68±0.07a4α-崖柏烯2867-05-27.582.37±0.16a0.60±0.01c1.95±0.02b5莰烯79-92-58.470.04±0.01b-0.09±0.01a6(-)-β-蒎烯18172-67-39.5111.92±0.94a0.21±0.00b12.41±0.73a7(+)-4-蒈烯29050-33-711.481.22±0.05b-1.79±0.01a8D-柠檬烯5989-27-512.0720.95±0.84a18.54±1.01b16.51±0.97c93-异丙基-6-亚甲基-1-环己烯555-10-212.285.53±0.31a2.97±0.02c3.65±0.08b10(E)-Β-罗勒烯3779-61-113.040.38±0.01a0.24±0.01b0.23±0.01b11γ-松油烯99-85-413.291.86±0.13a0.79±0.07c1.46±0.08b12(Z)-3,7-二甲基-1,3,6-十八烷三烯3338-55-413.502.75±0.05a1.39±0.00b-13桧烯3387-41-59.89-5.75±0.25b14.24±0.44a14月桂烯123-35-311.07-7.28±0.11-15松油烯99-86-514.46-0.45±0.08-16α-水芹烯99-83-27.13--3.54±0.09173-蒈烯13466-78-910.62--1.39±0.04187-十四碳烯10374-74-018.39--0.04±0.0019(+)-香橙烯489-39-422.89--0.11±0.01203,7,11-三甲基-1,3,6,10-十二碳-四烯502-61-426.02--0.01±0.0021萜品油烯586-62-914.310.95±0.02a0.35±0.00b- 22(E)-4,8-二甲基-1,3,7-壬三烯19945-61-015.020.05±0.00--23别罗勒烯7216-56-016.780.04±0.00b0.07±0.00a- 24(3E,5E)-2,6-二甲基-1,3,5,7-辛四烯460-01-518.400.03±0.00--25(-)-α-荜澄茄油烯17699-14-819.040.04±0.00--26(-)-α-蒎烯3856-25-519.920.03±0.00b-0.08±0.00a27香桧烯67690-48-621.830.29±0.00a0.06±0.00b-28β-榄香烯515-13-922.420.31±0.00b0.60±0.00a-29β-石竹烯87-44-522.620.87±0.01b0.48±0.002.34±0.02a30巴伦西亚橘烯4630-07-323.740.06±0.00a-0.03±0.00b311,5,9,9-四甲基-,Z,Z,Z-1,4,7-环十一碳三烯1000062-61-924.270.36±0.00b-1.17±0.01a32γ-紫罗兰烯30021-74-024.680.07±0.00b-0.22±0.00a33β-可帕烯18252-44-325.170.93±0.01b0.18±0.00c2.93±0.06a34(+)-γ-卡地烯39029-41-925.290.04±0.00--35(+)-β-硒烯17066-67-025.400.24±0.00a0.06±0.00b- 36双环吉马烯24703-35-325.720.28±0.01b-1.07±0.01a37反-菖蒲烯73209-42-427.880.06±0.00 --38醛类丙烯醛107-02-84.60-0.34±0.00-392-丁烯醛4170-30-37.96-0.48±0.00a0.06±0.00b402-甲基丙烯醛78-85-35.020.02±0.00b0.02±0.00b0.04±0.00a41丁醛123-72-84.94-0.02±0.00-42反式-2-戊烯醛1576-87-010.16-0.36±0.00-43戊醛110-62-36.64-0.20±0.00-442-己烯醛505-57-712.610.02±0.00b0.15±0.00a0.02±0.00b45正己醛66-25-18.98-0.50±0.00a0.02±0.00b46(E,E)-2,4-庚二烯醛4313-03-519.19-2.75±0.01-47(E)-2-庚烯醛18829-55-515.47-1.23±0.02-48(E,E)-2,4-己二烯醛142-83-617.47--0.04±0.0049苯甲醛100-52-720.76--0.02±0.0050十三醛10486-19-827.52--0.03±0.00512-甲基庚-2-烯醛30567-26-116.28-0.07±0.00-
续表4
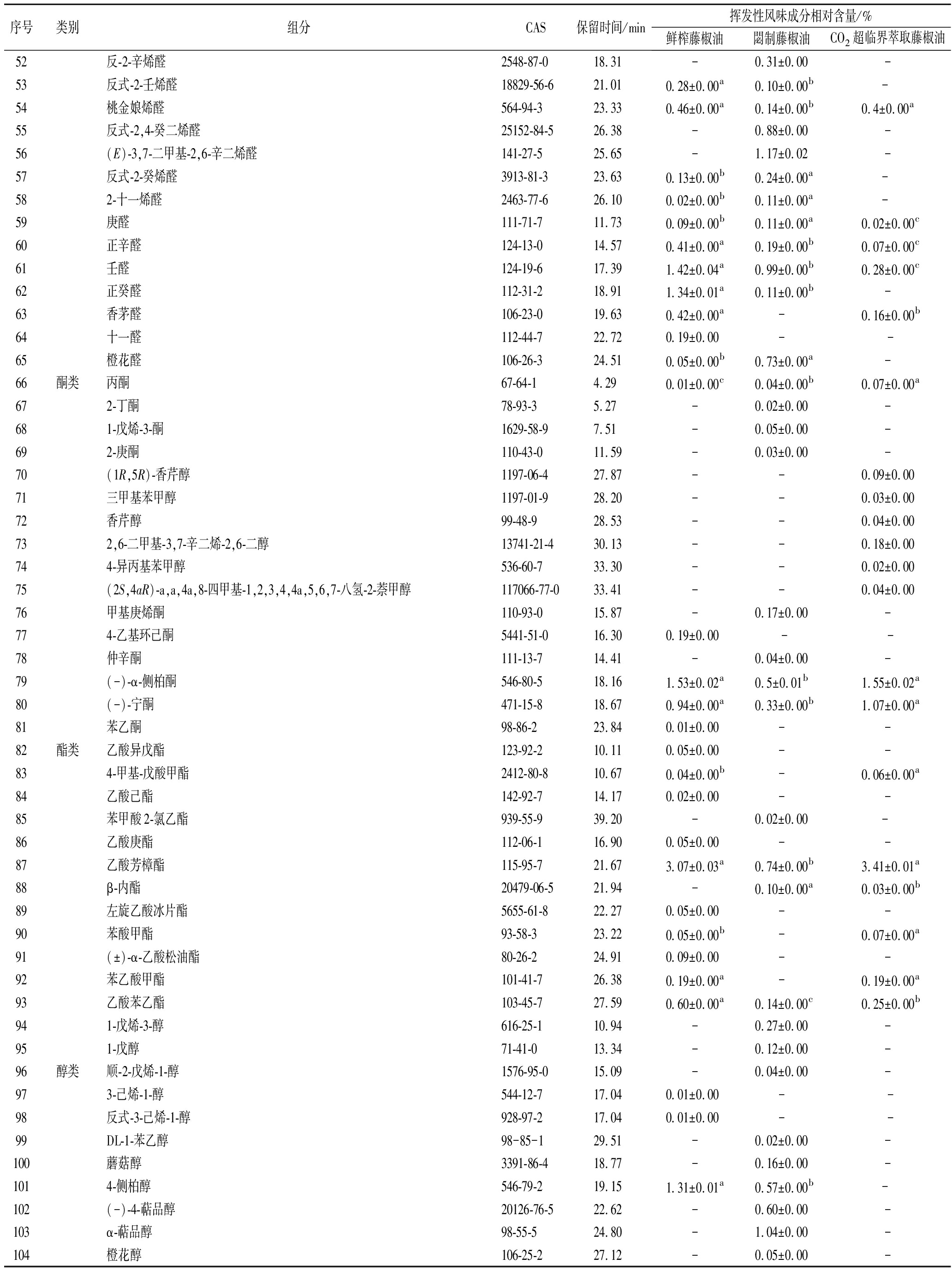
序号类别组分CAS保留时间/min挥发性风味成分相对含量/%鲜榨藤椒油閟制藤椒油CO2超临界萃取藤椒油52反-2-辛烯醛2548-87-018.31-0.31±0.00-53反式-2-壬烯醛18829-56-621.010.28±0.00a0.10±0.00b- 54桃金娘烯醛564-94-323.330.46±0.00a0.14±0.00b0.4±0.00a55反式-2,4-癸二烯醛25152-84-526.38-0.88±0.00-56(E)-3,7-二甲基-2,6-辛二烯醛141-27-525.65-1.17±0.02-57反式-2-癸烯醛3913-81-323.630.13±0.00b0.24±0.00a- 582-十一烯醛2463-77-626.100.02±0.00b0.11±0.00a- 59庚醛111-71-711.730.09±0.00b0.11±0.00a0.02±0.00c60正辛醛124-13-014.570.41±0.00a0.19±0.00b0.07±0.00c61壬醛124-19-617.391.42±0.04a0.99±0.00b0.28±0.00c62正癸醛112-31-218.911.34±0.01a0.11±0.00b-63香茅醛106-23-019.630.42±0.00a-0.16±0.00b64十一醛112-44-722.720.19±0.00- -65橙花醛106-26-324.510.05±0.00b0.73±0.00a-66酮类丙酮67-64-14.290.01±0.00c0.04±0.00b0.07±0.00a672-丁酮78-93-35.27-0.02±0.00-681-戊烯-3-酮1629-58-97.51-0.05±0.00-692-庚酮110-43-011.59-0.03±0.00-70(1R,5R)-香芹醇1197-06-427.87--0.09±0.0071三甲基苯甲醇1197-01-928.20--0.03±0.0072香芹醇99-48-928.53--0.04±0.00732,6-二甲基-3,7-辛二烯-2,6-二醇13741-21-430.13--0.18±0.00744-异丙基苯甲醇536-60-733.30--0.02±0.0075(2S,4aR)-a,a,4a,8-四甲基-1,2,3,4,4a,5,6,7-八氢-2-萘甲醇117066-77-033.41--0.04±0.0076甲基庚烯酮110-93-015.87-0.17±0.00-774-乙基环己酮5441-51-016.300.19±0.00 --78仲辛酮111-13-714.41-0.04±0.00-79(-)-α-侧柏酮546-80-518.161.53±0.02a0.5±0.01b1.55±0.02a80(-)-宁酮471-15-818.670.94±0.00a0.33±0.00b1.07±0.00a81苯乙酮98-86-223.840.01±0.00--82酯类乙酸异戊酯123-92-210.110.05±0.00--834-甲基-戊酸甲酯2412-80-810.670.04±0.00b-0.06±0.00a84乙酸己酯142-92-714.170.02±0.00--85苯甲酸2-氯乙酯939-55-939.20-0.02±0.00- 86乙酸庚酯112-06-116.900.05±0.00--87乙酸芳樟酯115-95-721.673.07±0.03a0.74±0.00b3.41±0.01a88β-内酯20479-06-521.94-0.10±0.00a0.03±0.00b89左旋乙酸冰片酯5655-61-822.270.05±0.00--90苯酸甲酯93-58-323.220.05±0.00b-0.07±0.00a91(±)-α-乙酸松油酯80-26-224.910.09±0.00--92苯乙酸甲酯101-41-726.380.19±0.00a-0.19±0.00a93乙酸苯乙酯103-45-727.590.60±0.00a0.14±0.00c0.25±0.00b941-戊烯-3-醇616-25-110.94-0.27±0.00-951-戊醇71-41-013.34-0.12±0.00-96醇类顺-2-戊烯-1-醇1576-95-015.09-0.04±0.00-973-己烯-1-醇544-12-717.040.01±0.00--98反式-3-己烯-1-醇928-97-217.040.01±0.00--99DL-1-苯乙醇98-85-129.51-0.02±0.00-100蘑菇醇3391-86-418.77-0.16±0.00-1014-侧柏醇546-79-219.151.31±0.01a0.57±0.00b- 102(-)-4-萜品醇20126-76-522.62-0.60±0.00-103α-萜品醇98-55-524.80-1.04±0.00-104橙花醇106-25-227.12-0.05±0.00-
续表4

序号类别组分CAS保留时间/min挥发性风味成分相对含量/%鲜榨藤椒油閟制藤椒油CO2超临界萃取藤椒油105γ-萜品醇586-81-219.370.21±0.00a-0.14±0.00b106芳樟醇78-70-621.4030.04±0.77b40.57±0.86a17.20±0.43c107正辛醇111-87-521.500.11±0.00a0.06±0.00b0.030.00±0.00c108正壬醇143-08-823.900.07±0.00--109α-松油醇10482-56-124.801.13±0.02a-0.65±0.00b110桃金娘烯醇19894-97-426.990.18±0.00a0.08±0.00b- 111香叶醇106-24-127.120.14±0.00--112苯甲醇100-51-628.780.03±0.00a-0.02±0.00b113苯乙醇60-12-829.500.10±0.00b-0.20±0.00a114反式-橙花叔醇40716-66-323.03-0.04±0.00-115橙花叔醇7212-44-432.110.31±0.00--116其他甲酸64-18-620.26-0.56±0.00a0.07±0.00b117乙酸64-19-718.85-0.89±0.01-118戊烷油109-66-03.10-0.18±0.00-119十四烷629-59-417.510.10±0.00b-0.76±0.00a120(1S,4S,4As)-1-异丙基-4,7-二甲基-1,2,3,4,4a,5-六氢萘267665-20-321.100.09±0.00a-0.09±0.00a121壬酸112-05-034.520.04±0.00b0.14±0.00a-122吲哚120-72-939.480.07±0.00a0.03±0.00b0.03±0.00b123庚烷142-82-53.51-0.11±0.00-124正辛烷111-65-94.09-0.21±0.00-125二甲醚115-10-65.76-0.02±0.00b0.04±0.00a1262-乙基呋喃3208-16-06.17-0.03±0.00-1271,3,3-三甲基-2,6-环-正十八烷488-97-17.42-0.23±0.00-128对-(1-丙烯基)-甲苯1000429-54-918.480.06±0.00a-0.05±0.00b1294-乙烯基-1,2-二甲基-苯27831-13-618.46-0.07±0.00-1307,7-二甲基-2-甲基降冰片烷471-84-18.27--0.01±0.001312-甲基十二烷1560-97-013.67--0.12±0.001324-四氢呋喃17699-16-019.16--1.44±0.02133正十五烷629-62-920.23--0.67±0.00134正十六烷544-76-322.57--0.42±0.001352-甲基二六烷1560-92-523.88--0.06±0.001361-甲基-4-(1-甲基乙烯基)环己烷-1,2-二醇1946-00-536.41--0.05±0.00137缩水甘油556-52-53.54--0.01±0.00138乙酸铵631-61-818.83--0.78±0.01139(1S,8aR)-1-异丙基-4,7-二甲基-1,2,3,5,6,8a-六氢萘483-76-126.22--0.39±0.00140(1S)-1,2-二氢-4,7-二甲基-1-(1-甲基乙基)-萘21391-99-129.68--0.03±0.00141石竹素1139-30-631.07--0.07±0.00142间-伞花烃535-77-314.010.30±0.00--143邻-伞花烃527-84-414.010.31±0.00c0.43±0.00b0.48±0.00a
注:“-”表示未检出
2.3.4 三种不同工艺的藤椒油挥发性风味成分对比
根据表4所示,3种藤椒油共检测出的挥发性风味成分有143种,分别为:烯类物质37种、醛类物质28种、醇类物质28种、酯类物质12种、酮类物质10种、其他物质28种。其中,鲜榨藤椒油、閟制藤椒油和CO2超临界萃取藤椒油共有的挥发性风味成分有23种,包括烯类物质8种(24.02%~44.81%)、醛类物质6种(0.82%~2.42%)、酮类物质3种(0.87%~2.69%)、酯类物质2种(0.88%~3.67%)、醇类物质2种(17.23%~30.15%)、其他物质2种(0.38%~0.50%)。采用热图可减少分析中的干扰和误差,同时能将3种藤椒油共有挥发性风味成分的相对含量数据进行可视化[27-28]。图6为3种藤椒油共有的23种挥发性风味成分热图,蓝色代表同类挥发性风味成分在不同藤椒油中的相对含量高、红色代表同类挥发性风味成分在不同藤椒油中的相对含量低。可明显观察出共有的23种挥发性风味成分中,芳樟醇和D-柠檬烯相对含量较高,分别达到17.20%~30.04%、16.51%~20.95%。与閟制藤椒油相比,鲜榨藤椒油和CO2超临界萃取藤椒油中的(-)-β-蒎烯相对含量较高,分别达到11.92%和12.41%。
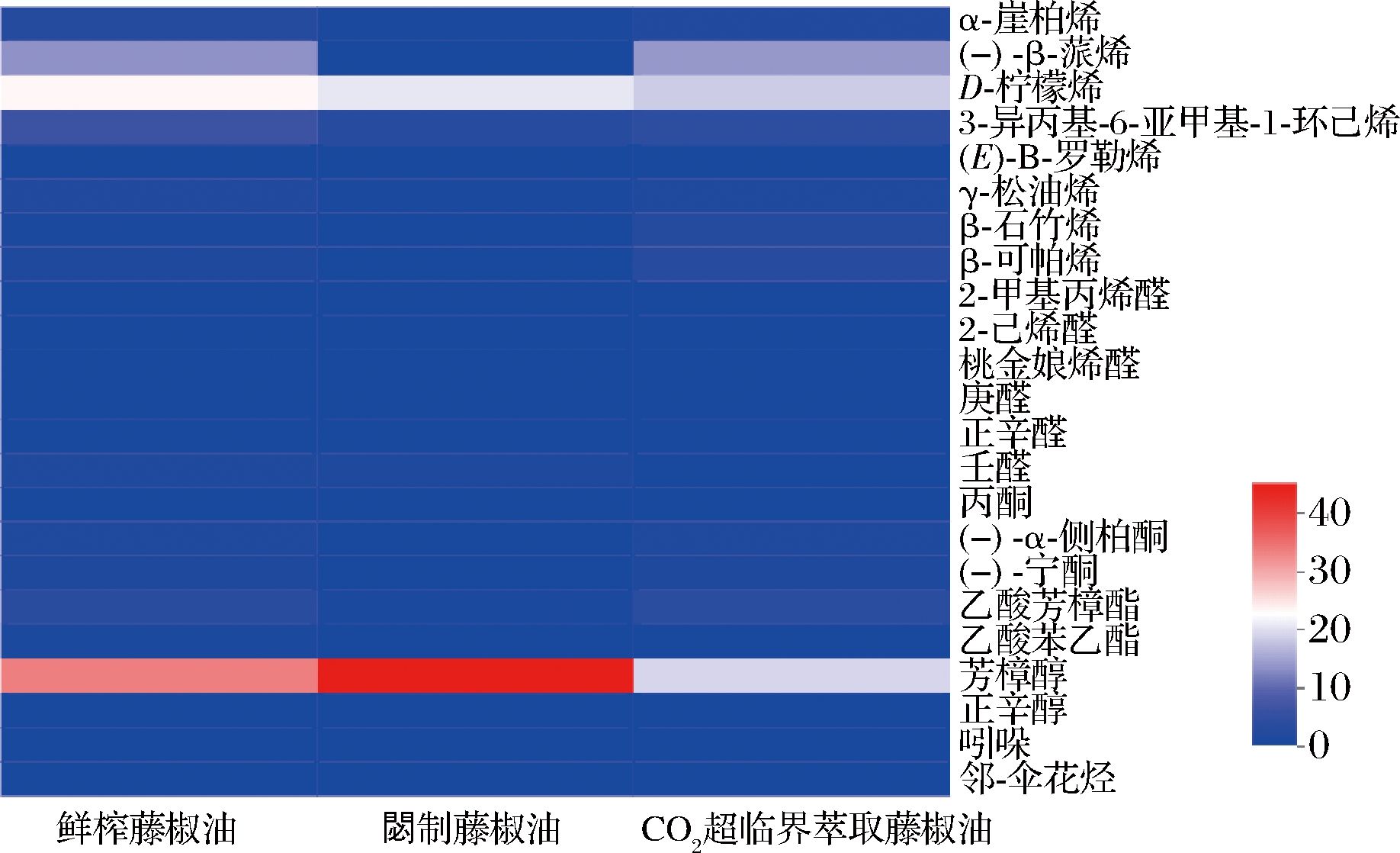
图6 藤椒油共同挥发性风味成分热图
Fig.6 Heat map of common volatile flavor components of Z.armatum oil
图7列出了鲜榨藤椒油、閟制藤椒油和CO2超临界萃取藤椒油的HS-SPME-GC-MS色谱图。从色谱图中可知3种藤椒油的挥发性风味成分在种类和含量上存在差异,CO2超临界萃取藤椒油的挥发性风味成分种类大于其他2种藤椒油。3种藤椒油分别含有特有挥发性风味成分,分别为鲜榨藤椒油的特有挥发性风味成分共有20种,分别为烯类物种6种[异戊二烯、(E)-4,8-二甲基-1,3,7-壬三烯、(3E,5E)-2,6-二甲基-1,3,5,7-辛四烯、(-)-α-荜澄茄油烯、(+)-γ-卡地烯、反-菖蒲烯]、醛类物种1种(十一醛)、酮类物种2种(4-乙基环己酮、苯乙酮)、酯类物种5种[乙酸异戊酯、乙酸己酯、乙酸庚酯、左旋乙酸冰片酯、(±)-α-乙酸松油酯]、醇类物种5种(3-己烯-1-醇、反式-3-己烯-1-醇、正壬醇、香叶醇、橙花叔醇)、其他物种1种(间-伞花烃),其中含量最多的为橙花叔醇,是一种重要的香料和倍半萜精油成分,同时具有抗菌、抗氧化等生物学功能[29],相对含量为0.31%。閟制藤椒油的特有挥发性风味成分共有35种,分别为烯类物种3种(2-甲基-1-丁烯、月桂烯、松油烯)、醛类物种10种[丙烯醛、丁醛、戊醛、反式-2-戊烯醛、(E)-2-庚烯醛、2-甲基庚-2-烯醛、反-2-辛烯醛、(E,E)-2,4-庚二烯醛、(E)-3,7-二甲基-2,6-辛二烯醛、反式-2,4-癸二烯醛]、酮类物种5种(2-丁酮、1-戊烯-3-酮、2-庚酮、仲辛酮、甲基庚烯酮)、酯类物种1种(苯甲酸2-氯乙酯)、醇类物种9种[1-戊烯-3-醇、1-戊醇、顺-2-戊烯-1-醇、蘑菇醇、(-)-4-萜品醇、α-萜品醇、橙花醇、苏合香醇、反式-橙花叔醇]、其他物种7种(醋酸、戊烷油、庚烷、正辛烷、2-乙基呋喃、1,3,3-三甲基2,6-环-正十八烷、4-乙烯基-1,2-二甲基-苯),其中含量最多的为月桂烯,具有独特的花香气味[22],相对含量达到7.28%。CO2超临界萃取藤椒油的特有挥发性风味成分共有26种,分别为烯类物质5种[α-水芹烯、3-蒈烯、7-十四碳烯、(+)-香橙烯、3,7,11-三甲基-1,3,6,10-十二碳-四烯]、醛类物质3种[(E,E)-2,4-己二烯醛、苯甲醛、十三醛]、醇类物质6种[(1R,5R)-香芹醇、三甲基苯甲醇、香芹醇、2,6-二甲基-3,7-辛二烯-2,6-二醇、4-异丙基苯甲醇、2S,4aR)-a,a,4a,8-四甲基-1,2,3,4,4a,5,6,7-八氢-2-萘基醇)]、其他物质12种[7,7-二甲基-2-甲基降冰片烷、2-甲基十二烷、4-四氢呋喃、正十五烷、正十六烷、2-甲基二六烷、1-甲基-4-(1-甲基乙烯基)环己烷-1,2-二醇、缩水甘油、乙酸铵、(1S,8aR)-1-异丙基-4,7-二甲基-1,2,3,5,6,8a-六氢萘、(1S)-1,2-二氢-4,7-二甲基-1-(1-甲基乙基)-萘、石竹素],其中含量最多的为α-水芹烯,具有黑胡椒香和蔼荷香[22],相对含量为3.54%。3种藤椒油挥发性风味成分的种类及相对含量存在的差异,可能是3种藤椒油分别具有独特香味的原因。
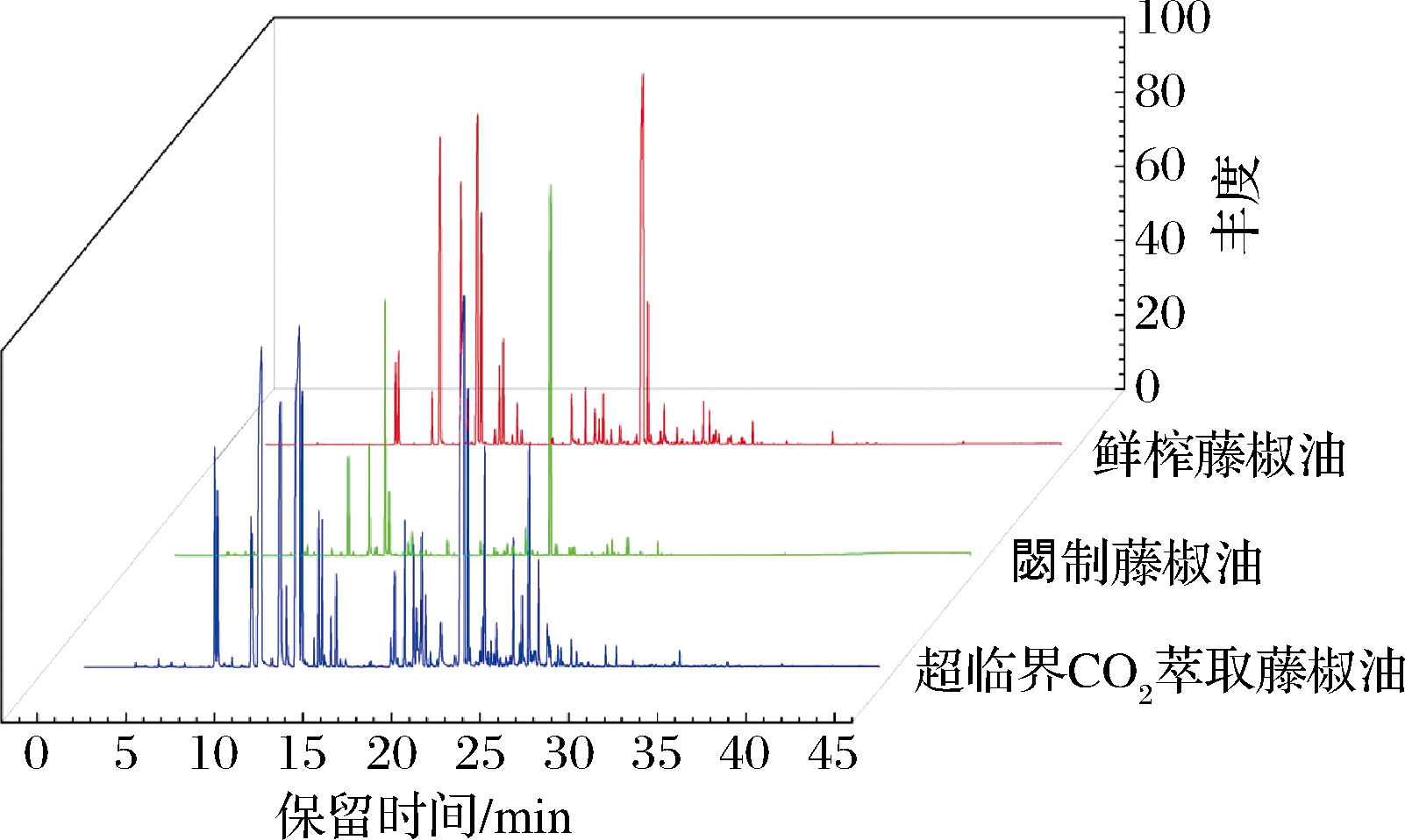
图7 鲜榨、閟制和CO2超临界萃取藤椒油的 HS-SPME-GCMS色谱图
Fig.7 HS-SPME-GCMS chromatogram of freshly squeezed Z. armatum oil, fried Z. armatum oil and supercritical CO2 extraction of Z.armatum oil
3 结论
本文研究对比分析了鲜榨藤椒油、閟制藤椒油和CO2超临界萃取藤椒油3种藤椒油产品中主要麻味物质和挥发性风味成分。结果发现,三者的羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素含量存在显著差异(P<0.05),CO2超临界萃取藤椒油中3种山椒素含量最高,羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素含量分别为(605.02±7.940) mg/mL、(48.76±0.673) mg/mL、(1.58±0.004) mg/mL。从3种藤椒油中共鉴定出143种挥发性成分,主要种类是烯类、醛类和醇类化合物,共有挥发性风味成分有23种。其中,作为主要成分的芳樟醇、D-柠檬烯相对含量分别到达17.20%~30.04%和16.54%~20.95%。而3种藤椒油的特有风味成分分别有20种、35种、26种。可见,不同加工工艺制备的藤椒油中麻味成分含量和挥发性风味成分的种类及相对含量存在差异,影响了藤椒油产品的感官品质,为藤椒油组分的进一步研究提供了数据参考。
[1] 祝磊, 陈茜, 黎江华, 等.藤椒来源的考证与定义的思考[J].中草药, 2018,49(4):987-992.
ZHU L, CHEN X, LI J H, et al.Textual research on origin of Zanthoxylum armatum and consideration of its definition [J].Chinese Traditional and Herbal Drugs, 2018,49(4):987-992.
[2] LIU Y P, LI Q R, YANG W X, et al.Characterization of the potent odorants in Zanthoxylum armatum DC. Prodr.pericarp oil by application of gas chromatography-mass spectrometry-olfactometry and odor activity value[J].Food Chemistry, 2020, 319:126564.
[3] ALAM F, SHAH A J.Butyrlycholine esterase inhibitory activity and effects of extracts (fruit, bark and leaf) from Zanthoxylum armatum DC. in gut, airways and vascular smooth muscles[J].BMC Complementary and Alternative Medicine, 2019,19(1):180.
[4] MUSHTAQ M N, GHIMIRE S, ALAMGEER, et al.Tambulin is a major active compound of a methanolic extract of fruits of Zanthoxylum armatum DC. causing endothelium-independent relaxations in porcine coronary artery rings via the cyclic AMP and cyclic GMP relaxing pathways[J].Phytomedicine, 2019, 53:163-170.
[5] 杜钢, 钟慈平, 杨诗嘉, 等.鲜藤椒中柠檬烯和芳樟醇测定方法研究及含量分析[J].食品科技, 2020,45(2):324-328.
DU G, ZHONG C P, YANG S J, et al.Determination method and content analysis of limonene and linalool in the Zanthoxylum armatum DC[J].Food Science and Technology, 2020,45(2):324-328.
[6] XIA D, JIANG L Y, CHENG J X, et al.Influence of drying methods on quality of Zanthoxylum armatum DC.and mathematical modelling of the drying kinetics[J].E3S Web of Conferences, 2021,269:02005.
[7] 胡强, 王延云, 王燕, 等.两种生产工艺藤椒油产品挥发性成分对比分析[J].食品工业科技, 2019,40(13):215-220.
HU Q, WANG Y Y, WANG Y, et al.Comparison analysis of volatile components in two kinds of rattan pepper oil produced from different processing[J].Science and Technology of Food Industry, 2019,40(13):215-220.
[8] WANG X G, YANG Y Y, MI P.Microwave-assisted extraction and GC-MS analysis of “Zanthoxylum” oil from “Zanthoxylum bungeanum”[J].Advance Journal of Food Science and Technology, 2015, 7(9):723-726.
[9] 周婷, 蒲彪, 姜欢笑, 等.不同方法提取的藤椒油脂肪酸组成成分分析[J].核农学报, 2015,29(7):1 323-1 328.
ZHOU T, PU B, JIANG H X, et al.Analysis of fatty acid compositions in Zanthoxylum armatum DC.oil with different extraction methods[J].Journal of Nuclear Agricultural Sciences, 2015, 29(7):1 323-1 328.
[10] 孙婧, 吴建华, 甘笛.响应面法优化超临界CO2萃取花椒油的工艺[J].中国油脂, 2019,44(5):5-7.
SUN J,WU J H,GAN D.Optimization of extraction of pepper oil by supercritical CO2 through response surface methodology [J].China Oils and Fats, 2019, 44(5):5-7.
[11] 向安娅, 周丹, 连紫凌, 等.青花椒油中多烯酰胺类成分分子蒸馏分离富集研究[J].中药材, 2020,43(8):1 956-1 961.
XIANG A Y, ZHOU D, LIAN Z L, et al.Study on molecular distillation separation and enrichment of polyenamides in oil of Zanthoxylum schinifolium Peels [J].Journal of Chinese Medicinal Materials, 2020, 43(8):1 956-1 961.
[12] 古明亮, 陈延伟.模糊数学法在藤椒油感官评定中的应用[J].中国调味品, 2018, 43(1):143-146.
GU M L, CHEN Y W.Application of fuzzy mathematics in sensory assessment of Zanthoxylum schinifolium et Zucc oil[J].China Condiment, 2018, 43(1):143-146.
[13] CHENG J X, KE J X, HOU X Y, et al.Changes in qualities of dried Zanthoxylum armatum DC.at different storage methods[J].Food Packaging and Shelf Life, 2021, 29:100716.
[14] 课净璇, 瞿瑗, 黎杉珊, 等.基于GC-MS建立花椒挥发油指纹图谱及在汉源红花椒鉴定中的应用[J].中国粮油学报, 2018, 33(11):116-126.
KE J X, QU Y, LI S S, et al.Establishment of GC-MS fingerprint based on essential oil components in Zanthoxylum and application on hanyaun Zanthoxylum bungeanum[J].Journal of the Chinese Cereals and Oils Association, 2018, 33(11):116-126.
[15] 张子希, 苗俨龙, 萧奕童, 等.不同浓缩工艺对龙眼浓缩汁的色泽及挥发性成分的影响[J].食品与发酵工业, 2022,48(6):84-89.
ZHANG Z X, MIAO Y L, XIAO Y T, et al.Effects of different concentration techniques on color and volatile components of longan concentrated juice[J].Food and Fermentation Industries, 2022,48(6):84-89.
[16] 郝旭东, 张盛贵, 王倩文, 等.四个不同地区大红袍花椒主体风味物质分析研究及香气评价[J].食品与发酵科技, 2021, 57(4):63-74.
HAO X D, ZHANG S G, WANG Q W, et al.Analysis of main flavor compounds and aroma evaluation of Dahongpao Zanthoxylum bungeanum in four different regions [J].Food and Fermentation Sciences & Technology, 2021, 57(4):63-74.
[17] 杜钢, 温泉, 钟慈平, 等.藤椒中山椒素测定方法研讨及含量分析[J].食品科技, 2019,44(9):318-322.
DU G, WEN Q, ZHONG C P, et al.The determination method and content analysis of functional components in the Zanthoxylum armatum DC.[J].Food Science and Technology, 2019,44(9):318-322.
[18] 蒋燕. 冷榨藤椒油饼粕再利用价值初探[D].雅安:四川农业大学, 2016.
JIANG Y.Preliminary research on the reuse value of cold pressed oil cake of Zanthoxylum armatum DC.Prodr.[D].Ya′an:Sichuan Agricultural University, 2016.
[19] ZHAO Z F, ZHU R X, ZHONG K, et al.Characterization and comparison of the pungent components in commercial Zanthoxylum bungeanum oil and Zanthoxylum schinifolium oil[J].Journal of Food Science, 2013, 78(10):C1 516-C1 522.
[20] 肖新生, 周旭, 蒋黎艳.植物油加工工艺对风味物质影响的研究进展[J].中国油脂, 2021, 46(9):51-56;70.
XIAO X S, ZHOU X, JIANG L Y.Progress on influence of vegetable oil processing technology on flavor compounds [J].China Oils and Fats, 2021, 46(9):51-56;70.
[21] SUGAI E, MORIMITSU Y, KUBOTA K.Quantitative analysis of sanshool compounds in Japanese pepper (Xanthoxylum piperitum DC.) and their pungent characteristics[J].Bioscience, Biotechnology, and Biochemistry, 2005, 69(10):1 958-1 962.
[22] 高夏洁, 高海燕, 赵镭, 等.SPME-GC-MS结合OAV分析不同产区花椒炸花椒油的关键香气物质[J].食品科学, 2022,43(4):208-214
GAO X J, GAO H Y, ZHAO L, et al.Analysis of the key aroma components of fried Zanthoxylum bungeanum oil from differentproducing areas based on SPME-GC-MS and OAV[J].Food Science, 2022,43(4):208-214.
[23] CAMARGO S B, SIM ES L O, DE AZEVEDO MEDEIROS C F, et al.Antihypertensive potential of linalool and linalool complexed with β-cyclodextrin:Effects of subchronic treatment on blood pressure and vascular reactivity[J].Biochemical Pharmacology, 2018, 151:38-46.
ES L O, DE AZEVEDO MEDEIROS C F, et al.Antihypertensive potential of linalool and linalool complexed with β-cyclodextrin:Effects of subchronic treatment on blood pressure and vascular reactivity[J].Biochemical Pharmacology, 2018, 151:38-46.
[24] 梅佳林, 李婷婷, 张星晖, 等.芳樟醇对三文鱼源莓实假单胞菌的抑菌机理[J].食品科学, 2022,43(9):199-206.
MEI J L, LI T T, ZHANG X H, et al.Antibacterial mechanism of linalool against Pseudomonas fragi from salmon[J].Food Science, 2022,43(9):199-206.
[25] 刘洋, 吉燕华, 雒珂昕, 等.柠檬烯应用的研究现状[J].中药药理与临床,2021,37(5):244-248.
LIU Y, JI Y H, LUO K X, et al.Research status of limonene application [J].Pharmacology and Clinics of Chinese Materia Medica, 2021, 37(5):244-248.
[26] SRIWICHAI T, SOOKWONG P, SIDDIQUI M W, et al.Aromatic profiling of Zanthoxylum myriacanthum (makwhaen) essential oils from dried fruits using different initial drying techniques[J].Industrial Crops & Products, 2019, 133:284-291.
[27] FAN S S, TANG K, XU Y, et al.Characterization of the potent odorants in Tibetan Qingke Jiu by sensory analysis, aroma extract dilution analysis, quantitative analysis and odor activity values[J].Food Research International, 2020, 137:109349.
[28] 杨芳, 范成梦, 贾洪锋, 等.基于气相色谱-离子迁移谱对不同产地羊肚菌风味化合物的分析[J].食品与发酵工业,2021,47(10):207-213.
YANG F, FAN C M, JIA H F, et al.Analysis of flavor compounds of Morchella spp.from different habitats based on gas chromatography-ion mobility spectrum[J].Food and Fermentation Industries,2021,47(10):207-213.
[29] 屈朕朕. 酿酒酵母工程菌合成橙花叔醇的研究[D].杭州:浙江工业大学, 2020.
QU Z Z.Nerolidol synthesis in engineered Saccharomyces cerevisiae[D].Hangzhou:Zhejiang University of Technology, 2020.