缢蛏(Sinonovacula constricta)是瓣鳃纲竹蛏科贝类动物,俗称蛏子,在北方称之为蜻。缢蛏广泛分布于中国沿海地区,是中国四大养殖贝类之一,也是浙江、福建等地重要的养殖品种[1]。缢蛏含有丰富的碳水化合物和灰分,并以高蛋白和低热量的特点深受消费者喜爱。随着缢蛏养殖技术的成熟,培育出的优良品种具有生长周期短、成本低、经济效益高等优点[2],同时缢蛏池塘养殖规模也逐渐扩大,但天气变化[3]和季节更替[4]常常引起池塘水体温度的剧烈波动,对其生长和存活造成不利影响。因此,研究温度变化对缢蛏的影响具有重要的现实意义。
温度是影响贝类生长及代谢的重要环境因子,温度的急剧变化会引起贝类的多种应激反应,使生理代谢加速并导致其耗氧量大幅增加,当贝类长时间处于这种应激状态下,机体进一步生成活性氧并大量积累[5-6]。杨俭等[7]研究了文蛤(Meretrix meretrix)在不同急性温度(20、25、30、35 ℃)胁迫下的生理响应,发现由于温度的上升提高了文蛤体内相关酶的活性,加快了生化反应的速率,导致了耗氧率的升高;孟广玮等[8]研究了长牡蛎(Crassostrea gigas)在温度渐升和温度突升胁迫下的存活情况,发现高温胁迫会导致长牡蛎内脏团中过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)、总抗氧化能力(total antioxidant capacity, T-AOC)以及丙二醛(malondialdehyde, MDA)显著上升。李晓英等[9]在对青蛤(Cyclina sinensis Gmelin)过氧化物酶(peroxidase, POD)的研究中发现,青蛤机体内不同组织受到的氧化应激程度各不相同,温度骤升胁迫引起青蛤机体中POD的大量表达,在各组织中肝胰腺POD活性最高,其次为外套膜和鳃瓣。贝类机体应激胁迫状态下常常伴随着抗氧化酶活性的变化,其中SOD、CAT、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)以及T-AOC被认为是研究氧化应激的重要指标[10]。目前,国内外学者在温度胁迫对贝类生理机能的影响方面进行了大量的研究,但对缢蛏温度胁迫的研究均限于单一组织,而对缢蛏不同组织的氧化应激和生理代谢的研究少有报道。因此,本研究以缢蛏为试验对象,探讨缢蛏外套膜、鳃和消化腺组织中抗氧化酶活性和活性氧代谢物质在急性温度胁迫(25、28、30、32、35 ℃)下的变化规律,旨在为缢蛏主要组织的氧化应激响应机制提供更完善的科学依据。
1 材料与方法
1.1 材料与试剂
试验用缢蛏于2021年4月购自上海市浦东新区南汇新城镇芦潮港集贸市场,1 h内运至实验室,壳长(5.8±0.3) cm,壳宽(2.1±0.2) cm。挑选富有活力且双壳均无破损的缢蛏作为试验研究对象。
超氧化物歧化酶测试盒、过氧化氢酶测试盒、谷胱甘肽过氧化物酶测试盒、总抗氧化能力测试盒、丙二醛测试盒、过氧化氢测试盒、谷胱甘肽测试盒、总蛋白定量测试盒,南京建成生物工程研究所。
1.2 仪器与设备
BPS-100CA 型恒温恒湿箱,上海一恒科学仪器有限公司;AUW320 型分析天平,上海亚津电子科技有限公司;FSH-2A 型匀浆机,江苏金怡仪器科技有限公司;H-2050R 型离心机,湖南湘仪离心机仪器有限公司;紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 实验设计
为使缢蛏处在适宜的生长代谢环境,且减少盐度改变导致渗透压的变化带来的应激反应,首先在大塑料箱中配制盐度为(18±0.5) ‰的人工海水,并用增氧泵持续充气,不断增加溶解氧,使水中溶氧量≥4.0 mg/L,形成一个小型暂养池。将带有泥沙的缢蛏清洗干净后分装在2个塑料筐中,完全浸没于大塑料箱人工海水中进行暂养,贝水比(体积比)约为1∶3,每隔3 h换1次水,在整个暂养过程中使暂养池水温保持在(20±1) ℃。
试验设置25、28、30、32、35 ℃共5个温度组,每个温度组3个平行,每个平行100只缢蛏。暂养结束后,随机选取规格相近的缢蛏,平均体质量为(15±0.6) g。将缢蛏由暂养池中取出,直接转移至恒温恒湿箱中,在温度胁迫4 h后取样,每个平行组随机取3只缢蛏。
1.3.2 样品采集
解剖缢蛏,提取外套膜、鳃和消化腺组织,分别在冷的生理盐水中漂洗,用滤纸擦干其表面水分后,在分析天平上称重并移入匀浆管中。同时按质量(g)∶体积(mL)=1∶9的比例加入0.86%(质量分数)生理盐水,冰浴条件下使用匀浆机匀浆,转速为8 000~10 000 r/min。将10%匀浆液用离心机以8 000 r/min的转速离心20 min, 所得上清液进行总蛋白定量、抗氧化酶活性以及MDA、H2O2、还原型谷胱甘肽(glutathione,GSH)含量的测定。
1.3.3 SOD、CAT、GPX、T-AOC活性的测定
SOD活性的测定参照南京建成SOD测试盒说明书,采用羟胺法,定义每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位(U)。CAT活性的测定参照南京建成CAT测试盒说明书,采用紫外比色法,定义每毫克组织蛋白中CAT每秒钟分解吸光度为0.50~0.55的底物中的H2O2相对量为1个CAT活力单位(U)。GPX活性的测定参照南京建成GPX测试盒说明书,采用分光光度法,定义每毫克蛋白质每分钟扣除非酶反应的作用,使反应体系中GSH浓度降低1 mol/L为1个GPX活力单位(U)。T-AOC的测定参照南京建成T-AOC测试盒说明书,采用比色法,定义每分钟每毫克组织蛋白使反应体系的吸光度值每增加0.01时为1个T-AOC活力单位(U)。
1.3.4 MDA、H2O2以及GSH含量的测定
MDA含量的测定参照南京建成MDA测试盒说明书,采用硫代巴比妥酸(thiobarbituric acid,TBA)法,结果以nmol/mg表示;H2O2含量的测定参照南京建成H2O2测试盒说明书,采用分光光度法,结果以mmol/g表示。GSH含量的测定参照南京建成GSH测试盒说明书,采用比色法,结果以mg/g表示。
1.4 数据处理分析
应用SPSS 19.0软件对试验结果进行单因素方差分析及Duncan多重比较,显著性水平为P<0.05。
2 结果与分析
2.1 急性温度胁迫对缢蛏不同组织MDA含量的影响
MDA是细胞膜脂过氧化作用的产物之一[5]。如图1所示,不同温度组之间,只有缢蛏消化腺中MDA含量差异显著(P<0.05);且随着胁迫温度的升高,3个组织中MDA含量均呈现出持续升高的趋势,并在35 ℃时达到最大值,分别为6.03、4.96、4.49 nmol/mg,其中35 ℃时消化腺MDA含量大幅上升,是25 ℃的2.6倍,相较于32 ℃上升了53.0%。在同一温度下,各组织MDA含量由高到低分别为外套膜、鳃、消化腺,与SOD等抗氧化酶的活性变化趋势相反;除35 ℃鳃和消化腺组织,其他温度下各组织MDA含量均有显著性差异(P<0.05),这表明温度的升高对缢蛏机体产生的氧化应激较为严重,外套膜中脂质过氧化作用较鳃和消化腺更为显著。

图1 急性温度胁迫对缢蛏不同组织MDA含量的影响
Fig.1 Effects of acute temperature stress on MDA content in different tissues of Sinonovacula constricta 注:图中不同小写字母表示不同温度组间的差异显著(P<0.05), 不同大写字母表示同一温度组不同组织间的差异显著(P<0.05) (下同)
2.2 急性温度胁迫对缢蛏不同组织H2O2含量的影响
H2O2是一种具有细胞毒性的物质,会导致氧化应激和细胞损伤。如图2所示,在同一温度下,除28 ℃外,外套膜和消化腺中H2O2含量无显著性差异(P>0.05),且与鳃中差异显著(P<0.05)。随着胁迫温度的升高,鳃和消化腺中H2O2含量持续升高,而外套膜中H2O2含量则呈现出先降低后升高的趋势;整体来看,3个组织H2O2含量均在35 ℃时达到最大值,分别为184.52、162.74、180.30 mmol/g。在较高温度的胁迫下,对比3个组织,外套膜中H2O2含量上升幅度最大,35 ℃时相较于32 ℃上升了25.0%,而消化腺上升幅度最小,仅比32 ℃上升了18.4%,这表明在高温环境下消化腺中活性氧积累速率较慢,且清除H2O2的能力强于外套膜。

图2 急性温度胁迫对缢蛏不同组织H2O2含量的影响
Fig.2 Effects of acute temperature stress on H2O2 content in different tissues of Sinonovacula constricta
2.3 急性温度胁迫对缢蛏不同组织SOD活性的影响
SOD 能够将细胞内的超氧阴离子自由基![]() 分解为H2O2和O2,减轻氧化损伤[5],其活性变化如图3所示。随着胁迫温度的升高,缢蛏外套膜、鳃和消化腺中SOD活性均呈现出先升高后降低的趋势,且在28 ℃时达到最大值,分别为64.29、72.64、77.66 U/mg。但当胁迫温度继续升高时,SOD活性出现了明显的回落,30、32、35 ℃组的SOD活性较28 ℃组显著下降(P<0.05),尤其在35 ℃时,外套膜、鳃和消化腺中SOD活性相较于峰值分别降低了18.6%、20.2%、21.1%,可见适宜的胁迫温度诱导了缢蛏体内SOD活性的增强,而过度的高温胁迫又会在很大程度上抑制SOD活性。在同一温度下,各组织SOD活性存在显著性差异(P<0.05),由高到低分别为消化腺、鳃、外套膜,这表明缢蛏消化腺清除活性氧的能力强于鳃和外套膜。
分解为H2O2和O2,减轻氧化损伤[5],其活性变化如图3所示。随着胁迫温度的升高,缢蛏外套膜、鳃和消化腺中SOD活性均呈现出先升高后降低的趋势,且在28 ℃时达到最大值,分别为64.29、72.64、77.66 U/mg。但当胁迫温度继续升高时,SOD活性出现了明显的回落,30、32、35 ℃组的SOD活性较28 ℃组显著下降(P<0.05),尤其在35 ℃时,外套膜、鳃和消化腺中SOD活性相较于峰值分别降低了18.6%、20.2%、21.1%,可见适宜的胁迫温度诱导了缢蛏体内SOD活性的增强,而过度的高温胁迫又会在很大程度上抑制SOD活性。在同一温度下,各组织SOD活性存在显著性差异(P<0.05),由高到低分别为消化腺、鳃、外套膜,这表明缢蛏消化腺清除活性氧的能力强于鳃和外套膜。

图3 急性温度胁迫对缢蛏不同组织SOD活性的影响
Fig.3 Effects of acute temperature stress on SOD activity in different tissues of Sinonovacula constricta
2.4 急性温度胁迫对缢蛏不同组织CAT活性的影响
CAT能够直接将 H2O2分解为H2O[5],其活性变化如图4所示。与SOD类似的是,在同一温度下3个不同组织之间的CAT活性有着显著性差异(P<0.05),其中消化腺中CAT活性最高,鳃次之,外套膜最低。不同温度组之间,随着胁迫温度的升高,外套膜和消化腺中CAT活性均呈现出持续降低的趋势;在鳃中,其CAT活性先升高后降低,但25和28 ℃组CAT活性无显著差异(P>0.05)。3个组织CAT活性均在35 ℃时达到最小值,分别为7.33、10.63、19.87 U/mg,其中外套膜中CAT活性下降得最快,较峰值下降了22.6%,这表明缢蛏机体内CAT活性与温度变化呈负相关,且温度越高,CAT失活越快,各组织内CAT失活速率由高到低分别为外套膜、鳃、消化腺。
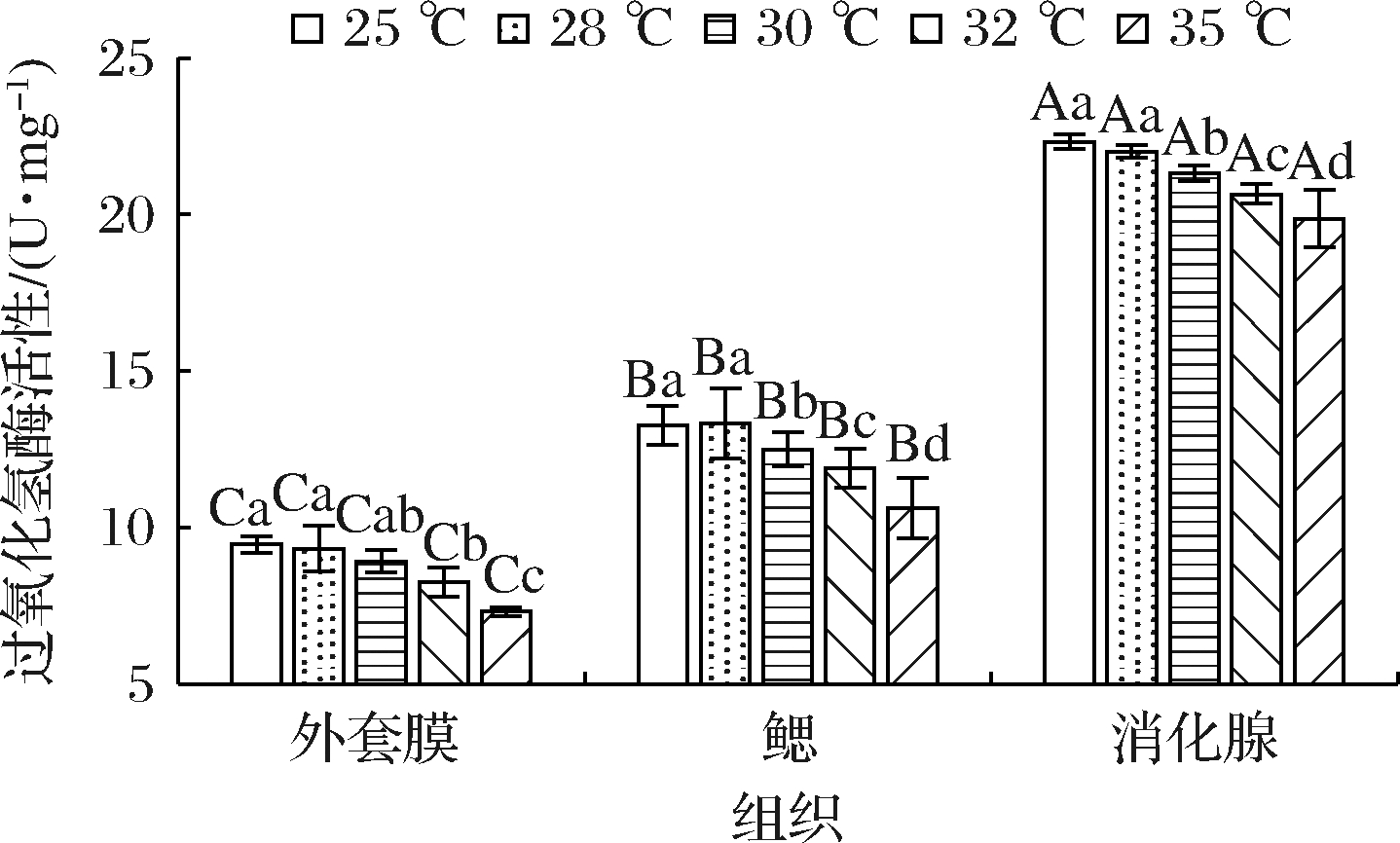
图4 急性温度胁迫对缢蛏不同组织CAT活性的影响
Fig.4 Effects of acute temperature stress on CAT activity in different tissues of Sinonovacula constricta
2.5 急性温度胁迫对缢蛏不同组织GPX活性的影响
GPX能与SOD、CAT协同作用,进一步将H2O2分解为无毒性物质[11],其活性变化如图5所示。同一温度下各组活性出现了明显下降的趋势,且与32 ℃差异显著(P<0.05);而消化腺中GP织GPX活性有显著性差异(P<0.05), 由高到低分别为消化腺、鳃、外套膜,表明在缢蛏消化腺中GPX受温度影响被大量激活。外套膜和鳃中GPX活性随着胁迫温度的持续升高均呈现出先升高后降低的趋势,在32 ℃时达到峰值,分别为93.13、119.52 U/mg,当胁迫温度为35 ℃时,鳃中GPX活性则在35 ℃组达到峰值,为172.36 U/mg, 较25 ℃上升了17.1%,并相较其他温度组均有显著性差异(P<0.05),这表明消化腺中GPX活性与温度变化呈正相关,与CAT活性持续下降的趋势不一致。
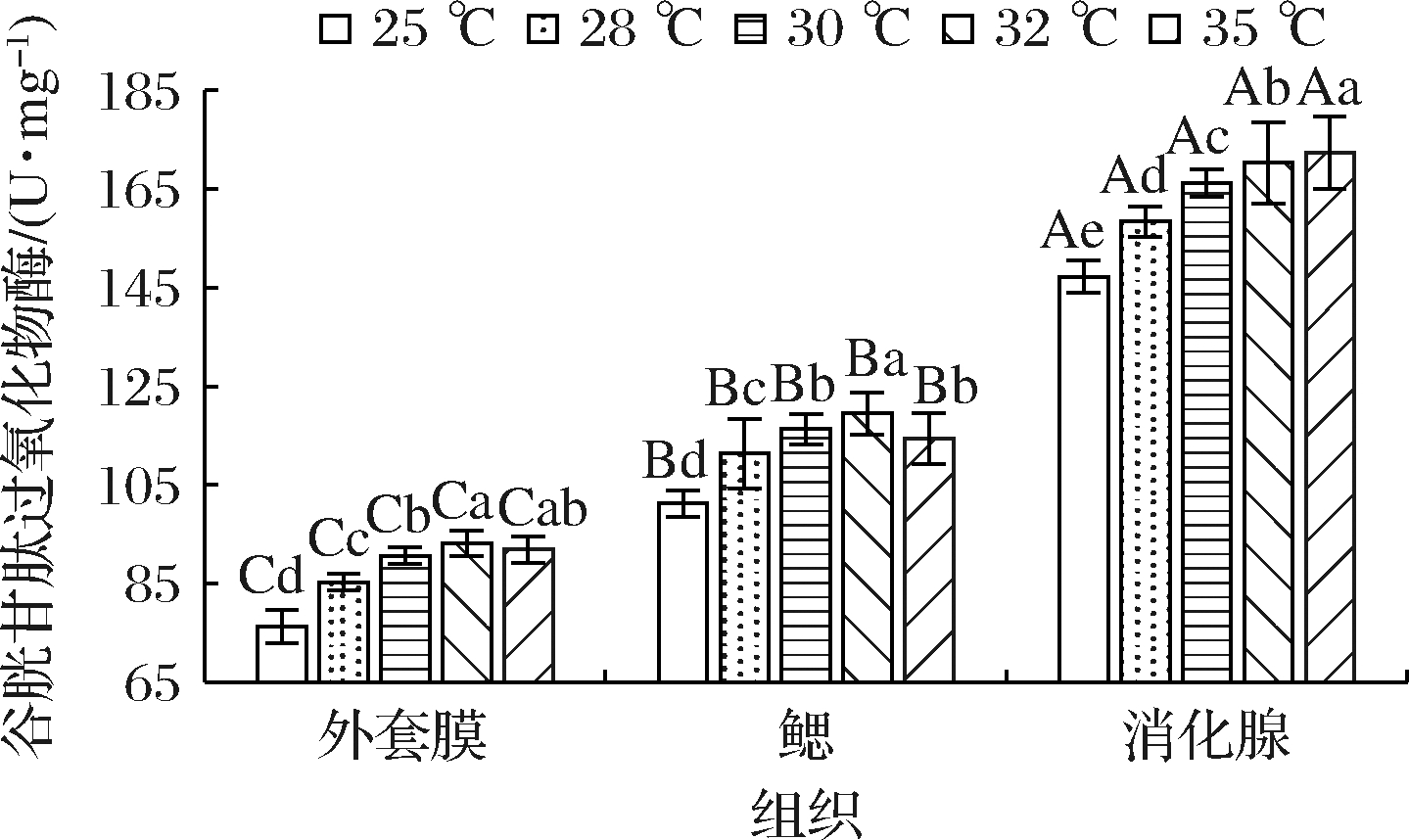
图5 急性温度胁迫对缢蛏不同组织GPX活性的影响
Fig.5 Effects of acute temperature stress on GPX activity in different tissues of Sinonovacula constricta
2.6 急性温度胁迫对缢蛏不同组织GSH含量的影响
GSH是一种重要的非酶类抗氧化剂,能清除机体内的活性氧,保护细胞不被氧化[12]。如图6所示,缢蛏3个组织中GSH含量在高温胁迫条件下差异显著(P<0.05),其中消化腺中最高,鳃中次之,外套膜中最低,这与SOD等抗氧化酶的活性变化趋势相一致。不同温度的胁迫对缢蛏各组织GSH含量的影响也各不相同,鳃和消化腺中GSH含量均在28 ℃热水应激下达到最大值,分别为31.53、38.25 mg/g,其中28 ℃消化腺中GSH含量与30 ℃胁迫差异显著(P<0.05);在35 ℃时,鳃和消化腺中GSH含量均出现明显回落,并与其他胁迫温度有显著性差异(P<0.05)。外套膜中GSH含量则始终处于较低水平,可见外套膜细胞缺少足够的GSH进行保护,温度升高产生的氧化损伤较鳃和消化腺严重。
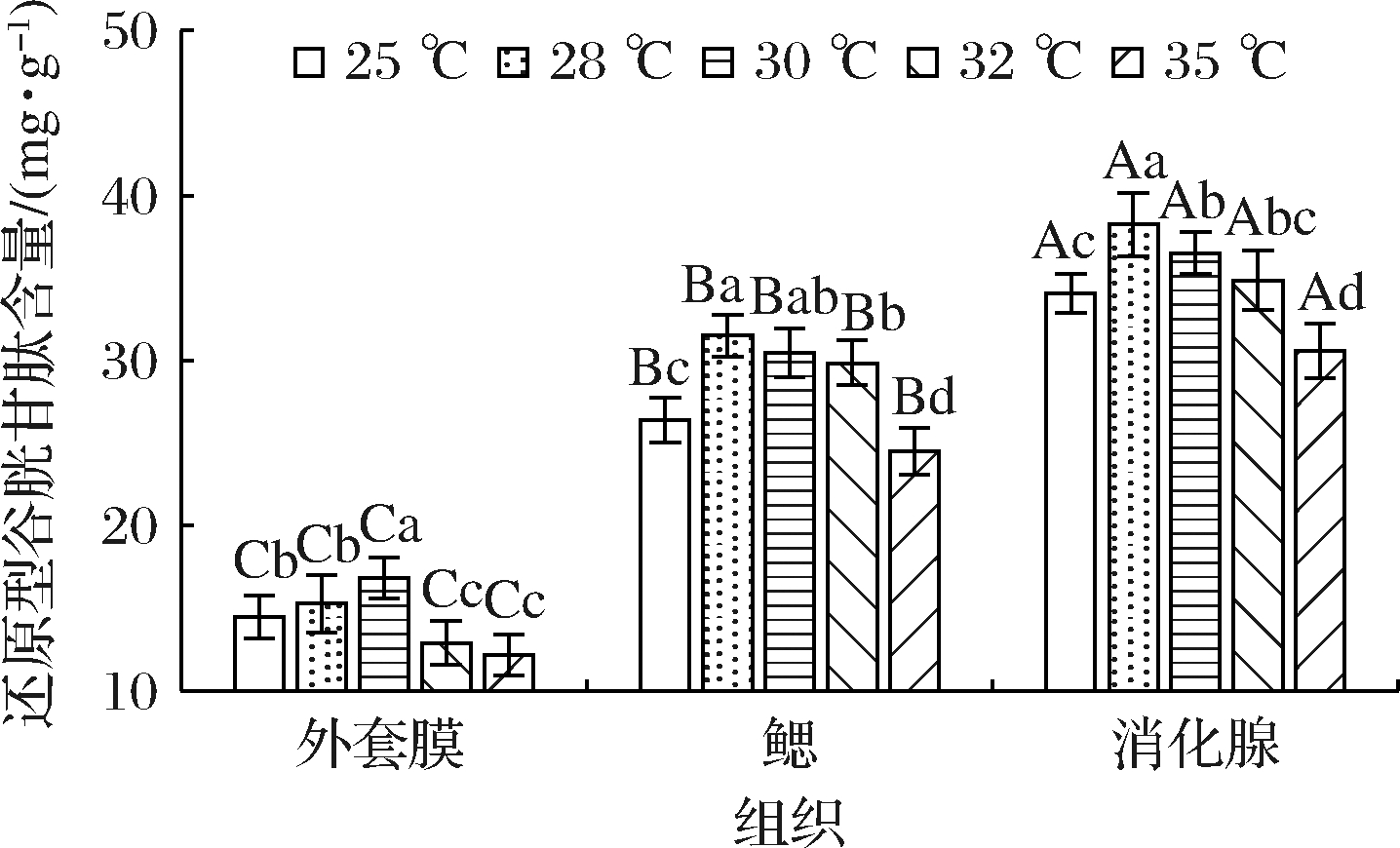
图6 急性温度胁迫对缢蛏不同组织GSH含量的影响
Fig.6 Effects of acute temperature stress on GSH content in different tissues of Sinonovacula constricta
2.7 急性温度胁迫对缢蛏不同组织T-AOC的影响
T-AOC体现了机体防御体系抗氧化能力的整体水平[13],其变化趋势如图7所示。随着胁迫温度的升高,缢蛏3个组织中T-AOC均先升高后降低,且在28 ℃ 时T-AOC达到峰值,分别为5.21、8.42、10.52 U/mg。当温度继续升高时,T-AOC出现了明显的回落,其中30、32以及35 ℃的T-AOC较28 ℃显著下降(P<0.05),尤其在35 ℃时,外套膜、鳃和消化腺的T-AOC相较于峰值分别降低了35.6%、29.1%和25.2%,与SOD活性的变化趋势一致。在同一温度下,各组织中T-AOC存在显著性差异(P<0.05),消化腺中最高,鳃中次之,外套膜中最低,这与SOD、CAT、GPX这些抗氧化酶相一致,可见缢蛏机体抗氧化防御能力与SOD等抗氧化酶活性高低紧密相关,也表明了缢蛏消化腺的总抗氧化防御能力高于鳃和外套膜。
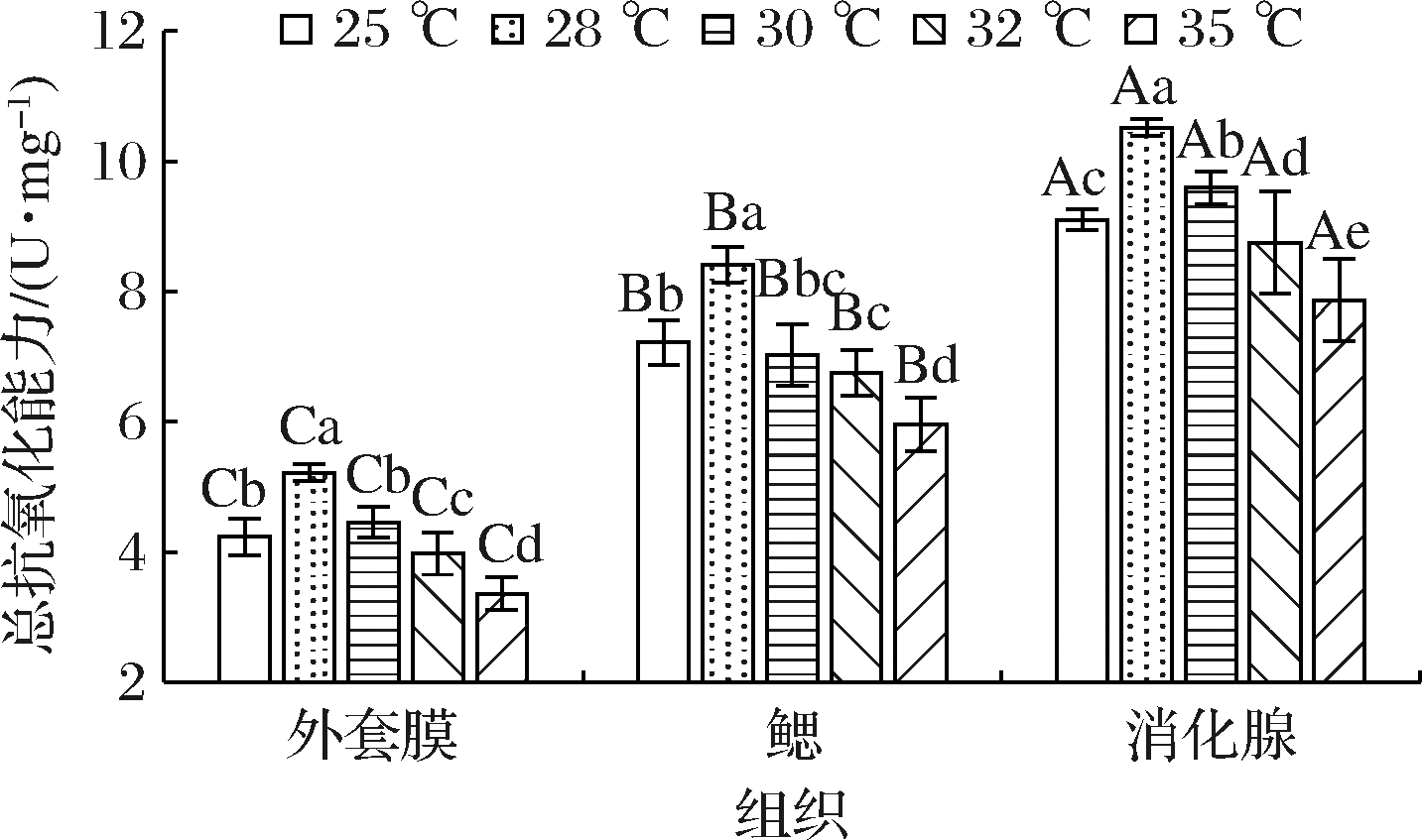
图7 急性温度胁迫对缢蛏不同组织T-AOC的影响
Fig.7 Effects of acute temperature stress on T-AOC in different tissues of Sinonovacula constricta
3 讨论
逆境条件下机体产生的氧自由基会攻击生物膜中多不饱和脂肪酸(polyunsaturated fatty acids,PUFA),通过脂质过氧化作用,生成大量脂质氢过氧化物(lipid hydroperoxide,LOOH)[14],使缢蛏颜色、香味和质地发生改变。与此同时,脂质过氧化反应还会形成MDA等有毒物质,导致缢蛏肌肉进一步发生有害变化。MDA作为氧化终产物之一,通过其含量高低可以判断机体受到自由基损伤的程度以及肉质是否出现异味或酸败现象[15]。本研究中,各组织中MDA含量随着胁迫温度的升高大幅上升,可见高温显著影响了缢蛏活性氧代谢,洪美玲等[16]研究了中华绒螯蟹(Eriocheir sinensis) 20~32 ℃的升温胁迫过程,同样发现胁迫6 h后其MDA含量显著上升。此外,在较高温度的胁迫条件下,外套膜中MDA含量显著高于鳃和消化腺,表明缢蛏外套膜对升温有着极高的敏感性,细胞膜受损程度严重,而在鳃和消化腺中MDA含量得到有效抑制。H2O2是一种氧化性很强的物质,在机体活性氧代谢中会穿透细胞膜,与细胞内一些金属离子发生反应生成具有极强细胞毒性的羟自由基(·OH),因此H2O2含量也代表了机体活性氧水平[17]。本研究发现,温度胁迫产生的活性氧打破了原有氧化还原循环的平衡,鳃中H2O2含量显著低于外套膜和消化腺,推测升温导致耗氧量的大幅上升,而相较于外套膜和消化腺,鳃作为呼吸器官能进行氧交换,从而补充更多O2维持正常代谢,使得H2O2处在较低水平[18-19]。
双壳贝类体内有一种防御机制来应对活性氧的侵害,该防御体系主要分为酶促体系和非酶促体系。酶促体系主要由SOD、CAT、GPX等抗氧化酶组成,SOD是抗活性氧一线防御系统的组成部分,存在于机体细胞中的一种以![]() 为底物的内源性抗氧化
为底物的内源性抗氧化![]() 和 H+在其催化作用下转化为 H2O2 和O2,从而使潜在有害的
和 H+在其催化作用下转化为 H2O2 和O2,从而使潜在有害的![]() 减少对机体的损伤,终止活性氧对机体氧化的连锁反应[12]。本研究中,缢蛏各组织中SOD活性先升高后降低,且均在28 ℃时达到最大值,由此可以推测,升温促使缢蛏机体内产生大量的活性氧,活性氧浓度的升高同时也诱导了SOD活性的升高;而当胁迫温度高于28 ℃时,SOD活性却持续下降,可见当温度升高超过至某一温度临界区间时,缢蛏机体内环境活性氧浓度过高,导致SOD活性显著下降,这表明了缢蛏机体在28 ℃左右可能存在一个阈值温度,超过该阈值温度则说明暴露于高温下的缢蛏受到了严重的氧化损伤,SOD活性被显著抑制。RAHMAN等[20]同样研究发现,暴露于急性热应激(22、26 ℃)的美国牡蛎的SOD活性增加,但当温度升至30 ℃时SOD活性表达却低于对照组水平。CAT以铁或锰作为辅助因子,催化经SOD歧化反应产生的H2O2,使其降解或还原为H2O和O2,从而协同SOD进一步清除活性氧[10]。本研究中,经历高温胁迫后,3种不同组织之间的CAT活性差异显著(P<0.05),其中消化腺中CAT活性最高,鳃中次之,外套膜中最低,这与SOD活性的变化趋势有一致性。随着胁迫温度的不断升高,CAT活性均持续降低,推测可能的原因是,更高温度的胁迫环境下,SOD在清除
减少对机体的损伤,终止活性氧对机体氧化的连锁反应[12]。本研究中,缢蛏各组织中SOD活性先升高后降低,且均在28 ℃时达到最大值,由此可以推测,升温促使缢蛏机体内产生大量的活性氧,活性氧浓度的升高同时也诱导了SOD活性的升高;而当胁迫温度高于28 ℃时,SOD活性却持续下降,可见当温度升高超过至某一温度临界区间时,缢蛏机体内环境活性氧浓度过高,导致SOD活性显著下降,这表明了缢蛏机体在28 ℃左右可能存在一个阈值温度,超过该阈值温度则说明暴露于高温下的缢蛏受到了严重的氧化损伤,SOD活性被显著抑制。RAHMAN等[20]同样研究发现,暴露于急性热应激(22、26 ℃)的美国牡蛎的SOD活性增加,但当温度升至30 ℃时SOD活性表达却低于对照组水平。CAT以铁或锰作为辅助因子,催化经SOD歧化反应产生的H2O2,使其降解或还原为H2O和O2,从而协同SOD进一步清除活性氧[10]。本研究中,经历高温胁迫后,3种不同组织之间的CAT活性差异显著(P<0.05),其中消化腺中CAT活性最高,鳃中次之,外套膜中最低,这与SOD活性的变化趋势有一致性。随着胁迫温度的不断升高,CAT活性均持续降低,推测可能的原因是,更高温度的胁迫环境下,SOD在清除![]() 后产生大量H2O2,而缢蛏机体中CAT不足以分解这些H2O2,从而抑制了其活性的增加。LUSHCHAK等[21]发现暴露在35 ℃条件下1 h的金鱼(Carassius auratus L.)肝脏组织CAT活性显著下降。GPX主要存在于线粒体中,是一类重要的抗氧化巯基化合物。GPX能与SOD、CAT协同作用,将H2O2进一步分解成H2O[10]。本研究中,消化腺中GPX活性受升温作用持续升高,在35 ℃组达到峰值,这可能是由于缢蛏产生的H2O2没有被CAT及时分解,因此机体诱导生成更多GPX来清除剩余的H2O2。谢明媚等[22]将银鲳(Pampus argenteus)幼鱼转移至32 ℃的水中进行高温胁迫,同样研究发现在12 h后,其肝脏GPX活性达到最大值。此外,由缢蛏消化腺中低水平MDA含量和高水平GPX活性可知,GPX能分解脂质过氧化物并对脂质过氧化过程起到有效抑制的作用[5]。非酶促体系主要由一些低分子活性氧清除剂组成。GSH 是一种重要的生物功能因子,可以被GPX催化,因其本身具有还原性,能将有毒的过氧化物分解为无毒物质,进而保护细胞膜防止被氧化,是反应机体抗氧化能力的重要指标之一[4]。本研究中,升温之后消化腺内仍有显著最高的GSH含量,这表明了相较于外套膜和鳃,消化腺在应对活性氧的侵害作用时,会释放更多的GSH来使机体免受氧化损伤。
后产生大量H2O2,而缢蛏机体中CAT不足以分解这些H2O2,从而抑制了其活性的增加。LUSHCHAK等[21]发现暴露在35 ℃条件下1 h的金鱼(Carassius auratus L.)肝脏组织CAT活性显著下降。GPX主要存在于线粒体中,是一类重要的抗氧化巯基化合物。GPX能与SOD、CAT协同作用,将H2O2进一步分解成H2O[10]。本研究中,消化腺中GPX活性受升温作用持续升高,在35 ℃组达到峰值,这可能是由于缢蛏产生的H2O2没有被CAT及时分解,因此机体诱导生成更多GPX来清除剩余的H2O2。谢明媚等[22]将银鲳(Pampus argenteus)幼鱼转移至32 ℃的水中进行高温胁迫,同样研究发现在12 h后,其肝脏GPX活性达到最大值。此外,由缢蛏消化腺中低水平MDA含量和高水平GPX活性可知,GPX能分解脂质过氧化物并对脂质过氧化过程起到有效抑制的作用[5]。非酶促体系主要由一些低分子活性氧清除剂组成。GSH 是一种重要的生物功能因子,可以被GPX催化,因其本身具有还原性,能将有毒的过氧化物分解为无毒物质,进而保护细胞膜防止被氧化,是反应机体抗氧化能力的重要指标之一[4]。本研究中,升温之后消化腺内仍有显著最高的GSH含量,这表明了相较于外套膜和鳃,消化腺在应对活性氧的侵害作用时,会释放更多的GSH来使机体免受氧化损伤。
T-AOC是衡量机体抗氧化能力的综合指标[13]。本研究中,各组织T-AOC先升高后降低,与SOD活性的变化趋势有一致性,可见在缢蛏抗氧化防御体系中,酶促体系起到了主导作用,升温诱导抗氧化酶水平的升高,SOD在响应氧化应激与清除过量中起重要作用;且在阈值温度左右,T-AOC达到最大值,表明在该温度临界区间附近,适宜的升温提高了抗氧化酶的表达以及诱导释放更多的低分子清除剂,如GSH[12]。而外套膜中T-AOC始终处于较低水平,说明外套膜组织在升温后仍处于应激状态,大量活性氧未得到及时清除,需要更长的时间恢复原有的代谢平衡。
缢蛏的外套膜能够分泌形成贝壳,同时包裹着内脏团,在防护免疫过程中发挥着作用[23]。鳃是其重要的呼吸器官,能与外界环境直接作气体交换,同时也是负责一些酶的生物转化过程的组织器官[24]。双壳贝类的消化腺主要为肝胰腺,是体内的消化器官[25]。本研究中,缢蛏外套膜中主要抗氧化酶活性在响应高温胁迫带来的氧化应激时受到了不同程度的抑制,可能由于外套膜同样也是作为缢蛏抵挡外界有害物质入侵机体的第一道防线,组织中抗氧化系统受损较为严重;鳃组织在应对高温胁迫时能及时补充O2从而显著抑制H2O2的积累;消化腺组织在活性氧代谢过程中,氧化应激促进了抗氧化酶的合成,诱导抗氧化酶活性的升高,有效地减轻了脂质过氧化反应带来的生物膜损伤。
4 结论
在25~35 ℃温度胁迫下,相比外套膜和鳃,缢蛏消化腺维持着最高的SOD、T-AOC活性以及GSH含量,且随温度升高而先升高后降低,在28 ℃达到最高值。此外,缢蛏CAT活性持续下降并于35 ℃时达到最低值,而GPX活性则呈现出不断升高的趋势。缢蛏3个组织中MDA含量均受胁迫温度的升高而升高,但在同一胁迫温度下,消化腺中的MDA积累最少。综合对比3个组织,消化腺维持着显著最高的SOD、CAT、GPX、T-AOC活性和GSH含量以及显著最低的MDA含量,这表明缢蛏消化腺较外套膜和鳃在应对外界升温胁迫时能更好地引起抗氧化酶的大量表达以及激活非酶促体系,有效地减轻了缢蛏在不利温度胁迫条件下的氧化损伤。因此,消化腺是缢蛏活性氧代谢的主要场所,同时也是较能代表缢蛏机体抗氧化防御变化的组织。
[1] 刘广丰, 沈和定, 陈慧, 等.不同微藻对缢蛏稚贝摄食和生长的影响[J].上海海洋大学学报, 2009, 18(6):708-714.
LIU G F, SHEN H D, CHEN H, et al.Effects of different microalgae on ingestion and growth of juvenile razor clam Sinonovacula constricta[J].Journal of Shanghai Ocean University, 2009, 18(6):708-714.
[2] 祁营利, 李含, 邱万伟, 等.缢蛏无水保活技术研究[J].冷藏技术, 2016,39(4):17-21.
QI Y L, LI H, QIU W W, et al.Research on waterlessly keep-alive technique of Sinonovacula constricta[J].Cold Storage Technic, 2016,39(4):17-21.
[3] 胡益鸣, 李琪, 刘士凯, 等.温度和盐度急性胁迫对岩牡蛎存活及免疫指标的影响[J].中国水产科学, 2020, 27(3):286-294.
HU Y M, LI Q, LIU S K, et al.Effects of acute temperature and salinity stress on the survival and immune indexes of lwagaki oysters, Crassostrea nippona[J].Journal of Fishery Sciences of China, 2020, 27(3):286-294.
[4] 孙永旭, 董宏标, 王文豪, 等.温度对大口黑鲈幼鱼不同组织抗氧化能力及免疫相关蛋白表达的影响[J].生态科学, 2019, 38(3):18-25.
SUN Y X, DONG H B, WANG W H, et al.Effects of temperature on antioxidant capacity and immune associated protein expression in different tissues and organs of juvenile Micropterus salmoides[J].Ecological Science, 2019, 38(3):18-25.
[5] 亢玉静, 郎明远, 赵文.水生生物体内抗氧化酶及其影响因素研究进展[J].微生物学杂志, 2013, 33(3):75-80.
KANG Y J, LANG M Y, ZHAO W.Advance in antioxidant enzymes and its effect factors in aquatic organisms[J].Journal of Microbiology, 2013, 33(3):75-80.
[6] LUSHCHAK V I, BAGNYUKOVA T V.Temperature increase results in oxidative stress in goldfish tissues.1.Indices of oxidative stress[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2006, 143(1):30-35.
[7] 杨俭, 魏伟, 唐保军.温度胁迫对文蛤耗氧率和排氨率的影响[J].渔业信息与战略, 2018, 33(4):279-283.
YANG J, WEI W, TANG B J.Effects of temperature stress on oxygen consumption rate and ammonia excretion rate of Meretrix meretrix[J].Fishery Information & Strategy, 2018, 33(4):279-283.
[8] 孟广玮, 李琪, 徐成勋, 等.高温胁迫对长牡蛎‘海大3号’品系存活及5项免疫指标的影响[J].中国水产科学, 2019, 26(4):738-744.
MENG G W, LI Q, XU C X, et al.Effects of high-temperature stress on survival and five immune indicators of Pacific oyster ‘Haida No.3’[J].Journal of Fishery Sciences of China, 2019, 26(4):738-744.
[9] 李晓英, 董志国, 阎斌伦, 等.青蛤POD组织差异及温度骤升和窒息胁迫对青蛤POD的影响[J].海洋通报, 2010, 29(5):521-525.
LI X Y, DONG Z G, YAN B L, et al.Differences of peroxidase activity in four organs and the impact of sharp temperature increase and hypoxia on peroxidase activity in Cyclina sinensis[J].Marine Science Bulletin, 2010, 29(5):521-525.
[10] IGHODARO O M, AKINLOYE O A.First line defence antioxidants-superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GPX):Their fundamental role in the entire antioxidant defence grid[J].Alexandria Journal of Medicine, 2018, 54(4):287-293.
[11] LADENSTEIN R, EPP O, BARTELS K, et al.Structure analysis and molecular model of the selenoenzyme glutathione peroxidase at 2.8 Å resolution[J].Journal of Molecular Biology, 1979, 134(2):199-218.
[12] 郝爽, 张敏, 方佳琪.缢蛏在急性温度胁迫下的氧化应激响应及生理代谢变化[J].上海海洋大学学报, 2021, 30(2):214-221.
HAO S, ZHANG M, FANG J Q.Study on oxidative stress response and physiological metabolism of Sinonovacula constricta under acute temperature stress[J].Journal of Shanghai Ocean University, 2021, 30(2):214-221.
[13] 曹善茂, 王潇, 刘钢, 等.温度胁迫对岩扇贝幼贝抗氧化酶活力的影响[J].大连海洋大学学报, 2018, 33(2):223-227.
CAO S M, WANG X, LIU G, et al.Effects of water temperature on antioxidant enzyme activity of juvenile rock scallop Crassadoma gigantea[J].Journal of Dalian Ocean University, 2018, 33(2):223-227.
[14] 郝爽, 张敏.不同冷胁迫方式对缢蛏无水保活期抗氧化酶活性及脂质过氧化的影响[J].大连海洋大学学报, 2020, 35(4):584-590.
HAO S, ZHANG M.Effects of different cold stress methods on antioxidant enzyme activity and lipid peroxidation of zazor clam Sinonovacula constricta during keeping alive under air exposure[J].Journal of Dalian Ocean University, 2020, 35(4):584-590.
[15] 吴明, 黄晓红, 杨勇, 等.肉类低温保鲜技术研究进展[J].肉类研究, 2021, 35(5):60-69.
WU M, HUANG X H, YANG Y, et al.A review of preservation technologies for meat products stored under low-temperature conditions[J].Meat Research, 2021, 35(5):60-69.
[16] 洪美玲, 陈立侨, 顾顺樟, 等.不同温度胁迫方式对中华绒螯蟹免疫化学指标的影响[J].应用与环境生物学报, 2007, 13(6):818-822.
HONG M L, CHEN L Q, GU S Z, et al.Effect of temperature change on immunochemical indexes of Eriocheir sinensis[J].Chinese Journal of Applied and Environmental Biology, 2007, 13(6):818-822.
[17] 石瑶瑶, 叶元土, 蒋蓉, 等.过氧化氢诱导的草鱼原代肝细胞氧化损伤模型的构建及其对天然植物抗氧化能力的评价[J].动物营养学报, 2021, 33(4):2 290-2 301.
SHI Y Y, YE Y T, JIANG R, et al.Establishment of oxidative injury model of grass carp hepatocytes induced by hydrogen peroxide and its application in antioxidant ability evaluation of natural plants[J].Chinese Journal of Animal Nutrition, 2021, 33(4):2 290-2 301.
[18] HU M H,LI L S,SUI Y M, et al.Effect of pH and temperature on antioxidant responses of the thick shell mussel Mytilus coruscus[J].Fish and Shellfish Immunology, 2015, 46(2):573-583.
[19] BAGNYUKOVA T V, LUSHCHAK O V, STOREY K B, et al.Oxidative stress and antioxidant defense responses by goldfish tissues to acute change of temperature from 3 to 23 ℃[J].Journal of Thermal Biology, 2007, 32(4):227-234.
[20] RAHMAN M S, RAHMAN M S.Effects of elevated temperature on prooxidant-antioxidant homeostasis and redox status in the American oyster:Signaling pathways of cellular apoptosis during heat stress[J].Environmental Research, 2021, 196:110428.
[21] LUSHCHAK V I, BAGNYUKOVA T V.Temperature increase results in oxidative stress in goldfish tissues.2.Antioxidant and associated enzymes[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2006, 143(1):30-35.
[22] 谢明媚, 彭士明, 张晨捷, 等.急性温度胁迫对银鲳幼鱼抗氧化和免疫指标的影响[J].海洋渔业, 2015,37(6):541-549.
XIE M M, PENG S M, ZHANG C J, et al.Effects of acute temperature stress on antioxidant enzyme activities and immune indexes of juvenile Pampus argenteus[J].Marine Fisheries, 2015,37(6):541-549.
[23] 刘彧成, 梁健, 王培, 等.缢蛏外套膜的组织学和组织化学研究[J].水产学杂志, 2020, 33(3):61-65.
LIU Y C, LIANG J, WANG P, et al.Histological and histochemical observation of mantle membrane of razor clam Sinonovacula constricta[J].Chinese Journal of Fisheries, 2020, 33(3):61-65.
[24] 田立立, 万金娟, 孟祥龙, 等.高pH急性和慢性胁迫对克氏原螯虾非特异性免疫和抗氧化能力的影响[J].淡水渔业, 2021, 51(4):101-107.
TIAN L L, WAN J J, MENG X L, et al.Effects of acute and chronic high pH stress on non-specific immunity and antioxidant capacity in Procambarus clarkii[J].Freshwater Fisheries, 2021, 51(4):101-107.
[25] 陈丽梅, 刘利华, 胡宏辉, 等.温度突变对毛蚶不同组织抗氧化酶活性的影响[J].水产科学, 2019, 38(4):435-442.
CHEN L M, LIU L H, HU H H, et al.Effect of sudden temperature change on antioxidant enzyme activity in different organs of ark shell Scapharca subcrenata[J].Fisheries Science, 2019, 38(4):435-442.