L-高丝氨酸是一种重要的非蛋白质氨基酸,是合成苏氨酸和甲硫氨酸等多种天冬氨酸家族氨基酸的重要前体物质,具有重要的生理功能,在食品、饲料、化工和医药领域具有广泛的应用[1-2]。研究表明,L-高丝氨酸可以诱导植物免疫反应,增加植物对疾病的抵抗力[3]。在雏鸡日粮中添加L-高丝氨酸,可以替代苏氨酸改善幼雏的生长性能。作为一种重要的医药中间体,L-高丝氨酸可合成具有抗癌活性物质生物碱和神经酰胺等药物,而且还可用于合成低毒性除草剂L-草铵膦[4]。此外,L-高丝氨酸也是一种重要的C4平台化学品,可用于γ-丁内酯、丙烯酸和1,3-丙二醇等多种大宗化学品的合成[5-7]。近年来,随着对L-高丝氨酸研究的不断深入和下游产品的持续开发,L-高丝氨酸需求量迅速增大,市场规模持续提升。
微生物发酵法具有环境友好、周期短、过程容易控制等优势,被广泛应用于氨基酸和有机酸等化合物的工业生产[8-10]。近年来,利用微生物发酵法生产L-高丝氨酸越来越受到关注[11-15]。发酵法生产L-高丝氨酸的关键是菌种选育,需要对菌株进行不断地测试和改造,以获得最优的生产菌株。在此过程中存在大量的L-高丝氨酸分析检测工作,然而目前L-高丝氨酸的检测方法非常有限。常用的检测方法主要是HPLC,此法虽然灵敏度、准确度高,但对仪器精密度和设备要求较高,且需要邻苯二甲醛(O-phthalaldehyde, OPA)、2,4-二硝基氟苯(2,4-dinitrofluorobenzene, DNFB)等柱前衍生[11,15],步骤繁琐,检测时间长,对于样品多、工作量大的L-高丝氨酸生产菌的高通量筛选并不适用。因此,本研究建立了一种基于双酶偶联的L-高丝氨酸快速检测方法。该方法将L-高丝氨酸浓度与NADH浓度关联,具有结果准确、操作简便、特异性强、检测速度快、能同时检测大批量样本等优点,可用于发酵液中L-高丝氨酸含量的测定和L-高丝氨酸高产菌株的高通量筛选工作。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
大肠杆菌(Escherichia coli)DH5α、BL21(DE3)由中国科学院天津工业生物技术研究所保藏。大肠杆菌表达质粒pET21b由本实验室保藏。
1.1.2 试剂
甘氨酸(Gly)、丙氨酸(Ala)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile)、苯丙氨酸(Phe)、脯氨酸(Pro)、色氨酸(Trp)、丝氨酸(Ser)、酪氨酸(Tyr)、半胱氨酸(Cys)、蛋氨酸(Met)、天冬酰胺(Asn)、谷氨酰胺(Gln)、苏氨酸(Thr)、天冬氨酸(Asp)、谷氨酸(Glu)、赖氨酸(Lys)、精氨酸(Arg)和组氨酸(His),北京索莱宝生物科技有限公司;L-高丝氨酸、L-亮氨酸脱氢酶、L-乳酸脱氢酶,上海源叶生物试剂有限公司;NADH,碧云天试剂公司;限制性内切酶Nde I、Xho I、T4 DNA连接酶、蛋白Marker、Phusion DNA聚合酶,Thermo Fisher公司;质粒提取试剂盒和胶回收试剂盒,天根生物公司;氨苄青霉素(ampicillin, Amp)、磷酸吡哆醛(pyridoxal phosphate, PLP)、异丙基-β-D-硫代吡喃半乳糖苷(isopropyl -β-D- thiopyrangalactoside, IPTG)、咪唑,索莱宝生物科技有限公司;其他试剂如Na2HPO4、NaH2PO4、NaCl等均为国产分析纯。
1.1.3 培养基
LB培养基(g/L):酵母粉5.0,胰蛋白胨10.0,NaCl 10.0,氨苄青霉素0.1。固体培养基加20 g/L的琼脂粉。
1.2 仪器与设备
Synergy NEO2多功能酶标仪,美国Biotek仪器有限公司;摇床,美国精骐有限公司;Scientz-ⅡD超声破碎仪,宁波新芝公司;高速冷冻离心机,德国Eppendoff股份公司;Agilent 1260高效液相色谱仪,美国Agilent公司。
氨基酸含量测定方法:色谱柱:Agilent ZORBAX Eclipse AAA色谱柱(4.6 mm × 150 mm,5 μm);检测器:紫外检测器,检测波长280 nm;流动相:A:40 mmol/L磷酸二氢钠溶液(pH=7.8),B:V(乙腈)∶V(甲醇)∶V(水)=45∶45∶10。流速2.0 mL/min;检测波长338 nm;柱温40 ℃。自动衍生化进样程序:吸取0.4 mol/L硼酸缓冲液(pH=10)2.5 μL,吸取待测样品0.5 μL,自动混合2次,等待0.5 min;吸取OPA衍生溶液0.5 μL,自动混合2次;吸取水32 μL,自动混合2次,进样。自动梯度洗脱程序:0~1.9 min,100%流动相A;1.9~18.1 min,43%流动相A,57%流动相B;18.1~18.6 min,100%流动相B;18.6~22.3 min,100%流动相B;22.3~26 min,100%流动相A。有机酸含量检测方法:色谱柱采用Bio-Rad Aminex HPX-87H Column;流动相为5 mmol/L的硫酸溶液;流速0.6 mL/min;柱温40 ℃。
1.3 实验方法
1.3.1 重组菌E.coli BL21(pET21b-cgl)的构建
采用Phusion DNA聚合酶,以合成的cgl基因为模板,通过PCR方法获得基因片段。然后用Nde I和Xho I双酶切cgl基因片段和质粒pET21b,连接酶切后的片段,转化到E.coli DH5α感受态中,涂布于含100 μg/mL Amp的LB平板上,提取质粒测序,测序正确后将重组质粒转化到E.coli BL21感受态细胞中,获得重组菌E.coli BL21(pET21b-cgl)。
1.3.2 胱硫醚γ-裂解酶诱导表达和纯化
将过夜培养的重组菌E.coli BL21(pET21b-cgl)按照1%接种量接种含有100 μg/mL Amp的LB液体培养基中,37 ℃、200 r/min培养至菌液OD600值为0.6,加入终浓度为0.4 mmol/L的IPTG,16 ℃、200 r/min诱导培养20 h。4 ℃、6 000 r/min离心收集菌体,加入适量裂解缓冲液(20 mmol/L Na2HPO4,200 mmol/L NaCl,pH 7.5)重悬,冰水浴超声破碎处理20 min,随后在4 ℃、6 000 r/min条件下离心10 min,收集上清液即为粗酶液。采用镍柱亲和层析的方法对含有His标签的胱硫醚γ-裂解酶进行纯化,用保存缓冲液[20 mmol/L Na2HPO4溶液,5%(体积分数)甘油,pH 7.5]进行超滤,除去咪唑,分装保存于-80 ℃冰箱中。用SDS-PAGE方法检测粗酶液和纯化的胱硫醚γ-裂解酶,并用Bradford方法测定蛋白质含量。
1.3.3 胱硫醚γ-裂解酶催化L-高丝氨酸反应产物的确定
胱硫醚γ-裂解酶催化L-高丝氨酸的反应产物通过HPLC测定。反应体系为100 mmol/L Na2HPO4缓冲液(pH 7.5),10 mmol/L L-高丝氨酸,0.1 mmol/L PLP,并加入50 μg酶液,反应体积为1 mL,37 ℃反应30 min后,加盐酸终止反应,经0.22 μm滤膜过滤,用于HPLC分析。
1.3.4 α-酮酸还原酶的确定
为了确定合适的α-酮酸还原酶,分别在反应体系中加入乳酸脱氢酶和亮氨酸脱氢酶,测定NADH的消耗量。反应体系为0.1 g/L L-高丝氨酸,100 mmol/L Na2HPO4缓冲液(pH 7.5),0.5 mmol/L NADH,0.1 mmol/L PLP,10 μg胱硫醚γ-裂解酶,反应体积为200 μL。同时向体系中分别添加50 U/mL的乳酸脱氢酶和亮氨酸脱氢酶,在37 ℃测量340 nm处吸光度的变化值。
1.3.5 胱硫醚γ-裂解酶催化底物特异性的测定
将常见的20种氨基酸配制成质量浓度为10.0 g/L,添加到反应液中,反应体系为100 mmol/L Na2HPO4缓冲液(pH 7.5),0.5 mmol/L NADH,0.1 mmol/L PLP,10 μg胱硫醚γ-裂解酶,氨基酸终质量浓度为0.5 g/L,反应体积为200 μL,检测10 min 内340 nm处的吸光度的变化,以反应体系中去离子水取代氨基酸为对照。
1.3.6 胱硫醚γ-裂解酶酶学性质的测定
胱硫醚γ-裂解酶的活性是通过偶联乳酸脱氢酶来测定的。反应体系为100 mmol/L Na2HPO4缓冲液(pH 7.5),4 mmol/L L-高丝氨酸,0.5 mmol/L NADH,0.1 mmol/L PLP,10 μg胱硫醚γ-裂解酶,50 U/mL乳酸脱氢酶,反应体积为200 μL。在此条件下,分别测定胱硫醚γ-裂解酶的最适温度,最适pH和动力学常数。酶活力单位定义:在40 ℃、pH 7.5条件下,1 min催化消耗1 nmol NADH的酶量为1个酶活力单位(1 U)。
1.3.7 胱硫醚γ-裂解酶检测L-高丝氨酸反应条件的确定
在1.3.6中反应体系的基础上,对反应体系中胱硫醚γ-裂解酶的浓度、乳酸脱氢酶的浓度、辅因子NADH的浓度和辅酶PLP的浓度进行优化,测定340 nm处吸光度的减少,以确定最佳的反应体系。
1.3.8 标准曲线制定
准确配制10.0 g/L L-高丝氨酸样品,加入到反应体系中,使L-高丝氨酸终质量浓度分别为0.005、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1 g/L。根据1.3.6测定方法,在1.3.7确定的最适条件下,以不加L-高丝氨酸的反应体系为空白对照,在340 nm处测定其吸光度,以L-高丝氨酸浓度为横坐标,以吸光度变化值为纵坐标,绘制回归曲线。
1.3.9 加标回收实验
取L-高丝氨酸发酵液,加入不同浓度L-高丝氨酸标准液混匀,以发酵培养基为空白对照,分别检测对照样本及回收样本,平行检测3次。
2 结果与分析
2.1 胱硫醚γ-裂解酶的表达及纯化
2.1.1 胱硫醚γ-裂解酶重组质粒的构建
胱硫醚γ-裂解酶(cystathionine γ-lyase,EC4.4.1.1),是一种磷酸吡哆醛依赖酶,能催化胱硫醚γ位裂解,脱去NH3后生成α-酮酸。本研究从BRENDA数据库中选择具有较高活性的来源于家鼠(Rattus norvegicus)的胱硫醚γ-裂解酶(RnCGL),该酶由cgl基因(NCBI-GeneID:24962)编码,含有398个氨基酸。将上述基因按照大肠杆菌密码子偏好性进行密码子优化,由金斯瑞生物科技公司合成。将目的基因连接至pET21b表达载体上,并且在C末端加上组氨酸标签用于后期表达纯化。利用通用引物T7和T7 Ter对重组质粒进行检测验证。如图1所示,经核酸电泳检测,PCR产物条带大小位于1 000~2 000 bp,与预期结果相符。随后将重组质粒利用限制性内切酶Nde I和Xho I双酶切验证,电泳图谱上可见有5 500 bp左右的质粒骨架条带和1 200 bp左右的基因片段条带,说明重组质粒pET21b-cgl构建正确。
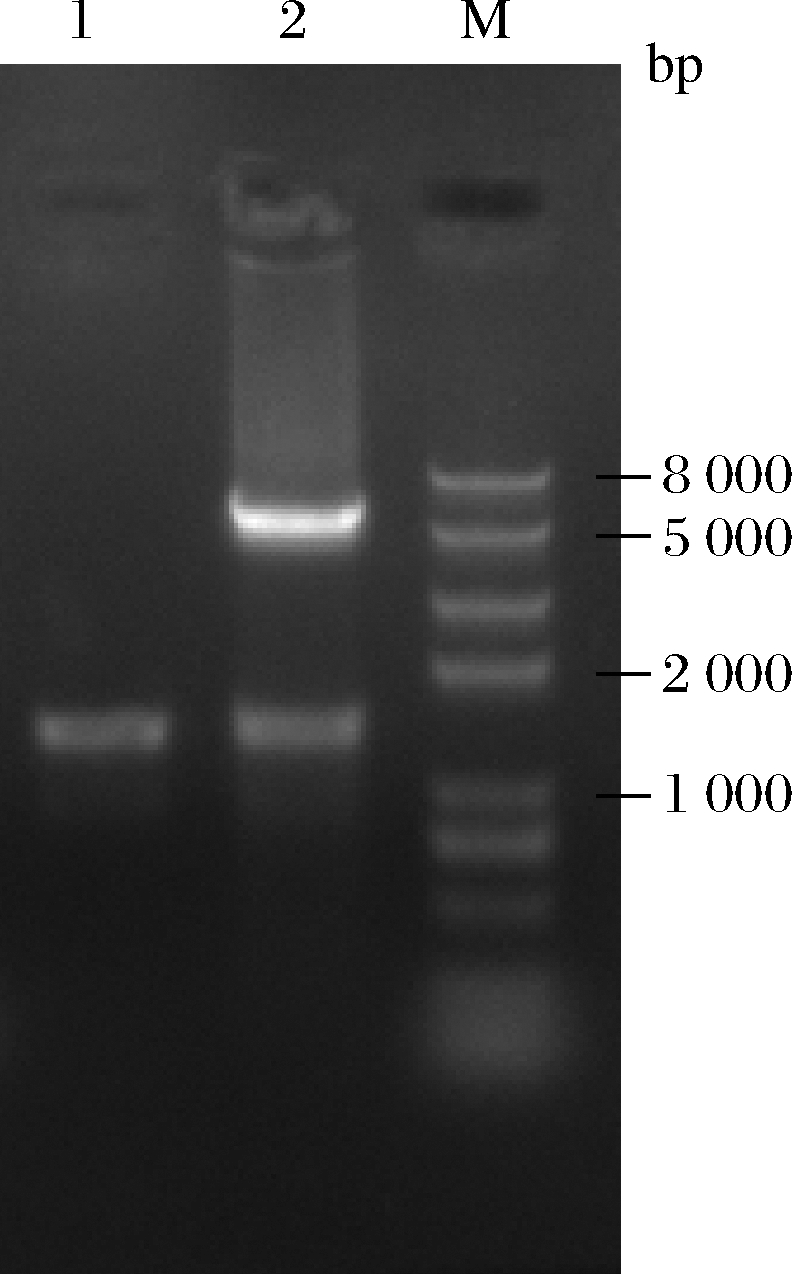
泳道1-PCR验证;泳道2-双酶切验证;M-DNA ladder Marker
图1 质粒PCR和酶切验证
Fig.1 Verification of plasmid by PCR and restriction enzyme digestion
2.1.2 RnCGL的诱导表达及纯化
将含有表达质粒pET21b-cgl的重组菌株E.coli BL21(DE3)在37 ℃下培养至OD600值为0.6左右,加入终浓度为0.4 mmol/L IPTG于16 ℃诱导约20 h,离心收集菌体,超声破碎,采用镍柱亲和层析方法纯化胱硫醚γ-裂解酶,并对粗酶液和纯酶进行SDS-PAGE分析。结果如图2所示,纯化后RnCGL蛋白条带单一,蛋白分子质量约为40 kDa,与预测结果一致,说明该蛋白在E.coli BL21中成功表达。

泳道1-破碎上清液;泳道2-破碎沉淀;泳道3-穿柱液; 泳道4-洗杂液;泳道5-100 mmol/L咪唑洗脱液;泳道6-200 mmol/L 咪唑洗脱液;泳道7-300 mmol/L咪唑洗脱液;泳道8-400 mmol/L 咪唑洗脱液;泳道9-500 mmol/L咪唑洗脱液;M-protein ladder Marker
图2 SDS-PAGE检测分析RnCGL
Fig.2 SDS-PAGE analysis of RnCGL
2.2 双酶偶联法测定L-高丝氨酸方法的建立
2.2.1 双酶偶联法测定L-高丝氨酸含量的原理
L-高丝氨酸在胱硫醚γ-裂解酶(RnCGL)催化下脱去氨基生成α-酮酸,α-酮酸在脱氢酶的催化作用下,与NADH偶联发生还原反应生成醇酸。NADH在340 nm吸光度处有吸光度,其下降速率与L-高丝氨酸浓度呈正比。反应方程式(1)如下:
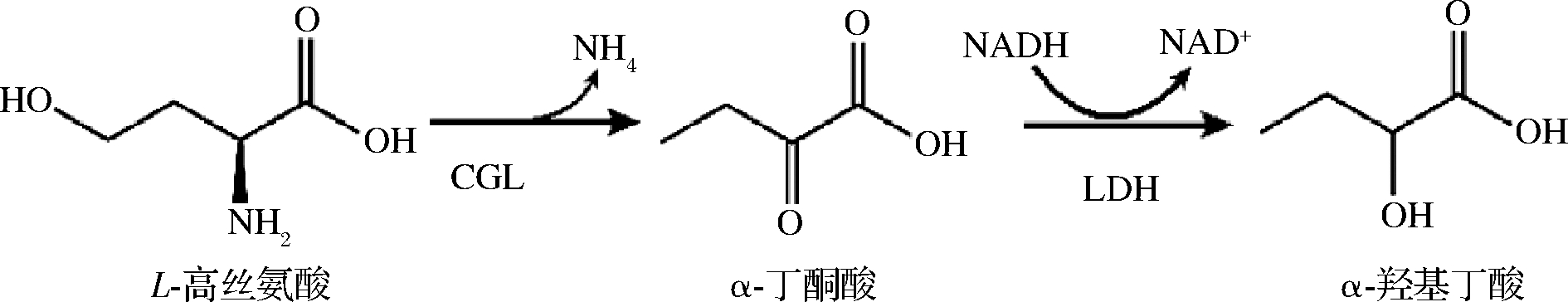
(1)
2.2.2 RnCGL催化L-高丝氨酸反应产物的确定
研究表明,RnCGL催化L-高丝氨酸发生γ消除反应,生成的产物为α-丁酮酸和氨[反应方程式(1)]。本研究利用HPLC方法检测确定RnCGL催化L-高丝氨酸的反应产物,结果如图3所示,反应体系中产物相对单一,一个为高丝氨酸底物峰,另一个为α-丁酮酸产物峰,且产物峰与标准品α-丁酮酸出峰时间完全一致,说明RnCGL能够催化L-高丝氨酸裂解生成α-丁酮酸,与文献报道结果相符[16]。

图3 HPLC检测分析RnCGL催化L-高丝氨酸的产物
Fig.3 HPLC analysis to confirm the catalytic product of RnCGL using L-homoserine as substrate
2.2.3 α-丁酮酸与NADH偶联反应的建立
亮氨酸脱氢酶(leucine dehydrogenase,EC1.4.1.9)和乳酸脱氢酶(lactate dehydrogenase,EC1.1.1.27)是依赖NAD(H)的氧化还原酶,可选择性催化多种脂肪族2-氧代酸或α-酮酸还原为相应的α-氨基酸及其衍生物。因此,本研究首先尝试利用亮氨酸脱氢酶催化α-丁酮酸的反应偶联NADH。但实验结果并没有检测到在340 nm(NADH氧化)下吸光度的下降。说明在该体系中亮氨酸脱氢酶不能有效发挥作用,可能原因是亮氨酸脱氢酶还原过程中不仅需要NADH,还需要铵根离子,尽管该体系中L-高丝氨酸裂解可生产部分铵根离子,但是浓度很低,从而影响酶活性。接下来,尝试利用乳酸脱氢酶催化该反应。结果如图4所示,在340 nm处吸光度随着时间的增加而下降,说明NADH发生反应生成NAD+。通过上述实验,本研究将L-高丝氨酸浓度与NADH浓度变化相偶联,建立了基于双酶偶联的L-高丝氨酸测定方法,即RnCGL将L-高丝氨酸裂解为α-丁酮酸,生成的α-丁酮酸在乳酸脱氢酶的催化下消耗NADH生成2-羟基丁酸。在反应过程中,NADH减少量与L-高丝氨酸浓度呈正比。

图4 α-丁酮酸与NADH偶联反应的建立
Fig.4 The coupling relationship of α-ketobutyric acid and NADH
2.2.4 双酶偶联L-高丝氨酸检测法特异性验证
为了验证基于双酶偶联的L-高丝氨酸测定方法的特异性,本研究分别以20种常用氨基酸为底物,在10 min内监测340 nm处吸光度的变化量,并以不加氨基酸底物的体系作为空白对照。如图5-a所示,在10 min内L-高丝氨酸在340 nm处吸光度下降值为0.26,而其他氨基酸在该体系中340 nm处吸光度均无明显变化。结果表明该方法能够特异性地检测L-高丝氨酸。此外,为确定该方法中L-高丝氨酸检测是否受到其他氨基酸干扰,本研究配制含有等量L-高丝氨酸和20种氨基酸的混合液,并利用双酶体系检测方法对该混合液进行检测,以等浓度的L-高丝氨酸标准液为对照。结果如图5-b所示,混合液在340 nm处的吸光度下降值与对照组只有L-高丝氨酸标准液的减少量基本相当。结果说明,该方法具有良好的特异性和稳定性,不会受到其他氨基酸的干扰。

a-双酶偶联方法检测20种氨基酸的吸光度下降值; b-氨基酸混合液对L-高丝氨酸检测方法的影响
图5 双酶偶联L-高丝氨酸检测法特异性的验证
Fig.5 Verification of the specificity of the double-enzyme coupling method for L-homoserine detection
2.3 RnCGL酶学性质测定
2.3.1 温度对酶活性的影响
为进一步确定和优化基于双酶体系的L-高丝氨酸测定方法,本研究对RnCGL的酶学性质进行测定,分别探究温度和pH对其酶活性的影响。在pH 8.0的100 mmol/L Na2HPO4缓冲液中,分别测定RnCGL在25、30、35、37、40、45 ℃条件下酶活性。结果如图6-a所示,重组酶RnCGL在25~45 ℃均有活性,在25~40 ℃,酶活性随着温度的升高逐渐提高,在40 ℃时酶活性达到最高为125 U/mg。由于双酶偶联检测体系需要保证较高的RnCGL活性,因此确定40 ℃为该反应体系的最适温度。
2.3.2 pH对酶活性的影响
在40 ℃最适温度条件下,分别测定RnCGL在不同pH条件下的Na2HPO4缓冲体系中的酶活性,其中pH条件设定为6.0、7.0、7.5和8.0。结果如图6-b所示,重组酶RnCGL在pH 6.0~8.0均有酶活性,在pH 6.0~7.5,CGL酶活性持续升高,在pH 7.5时酶活性达到最高为145 U/mg。但随着pH继续升高,酶活性反而降低。结果表明pH 7.5为RnCGL的最适pH。
2.3.3 动力学常数测定
在确定的RnCGL最适催化温度和pH反应条件下(pH 7.5、40 ℃),对RnCGL的动力学常数进行了测定。分别测定在L-高丝氨酸0~10 mmol/L浓度下的酶活性,并按照Lineweaver-Burk的方法利用双倒数作图求算RnCGL对底物L-高丝氨酸的Km和Vmax。结果如图6-c和图6-d所示,RnCGL在以L-高丝氨酸为底物时,动力学常数Km为6.76 mmol/L,最大反应速率Vmax为217.39 U/mg。
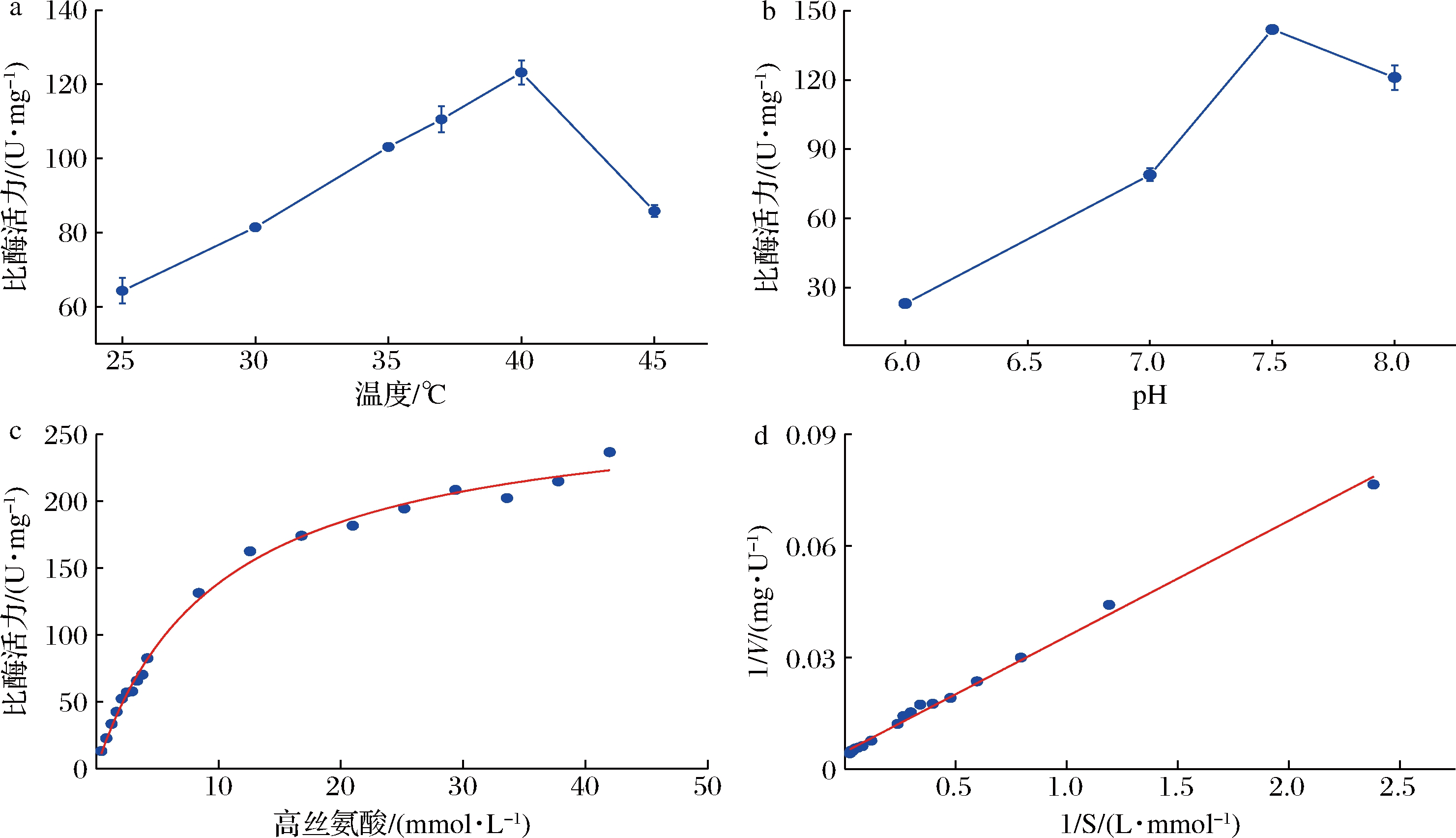
a-温度对RnCGL酶活性的影响;b-pH对RnCGL酶活性的影响;c-RnCGL在不同L-高丝氨酸浓度下酶活性拟合; d-双倒数分析RnCGL动力学常数
图6 RnCGL酶学性质测定
Fig.6 Determination of the enzymatic properties of RnCGL
2.3.4 保存时间对RnCGL酶活性的影响
分别在纯化的第1天、第10天、第20天、第30天取出保存于-80 ℃冰箱的RnCGL,测定其比酶活力,分别为27.87、31.30、28.30、33.87 U/mg。结果表明RnCGL在-80 ℃条件下保存30 d后,比酶活力无明显变化,说明RnCGL具有良好的稳定性,无需每次重新表达纯化,可现取现用。
2.4 单因素优化L-高丝氨酸检测系统中各组分含量
2.4.1 RnCGL浓度优化
RnCGL的酶量直接影响反应速率,在一定底物浓度下,反应体系中酶应过量。向反应体系中加入2、6、10、12、13 U/mL的胱硫醚γ-裂解酶,结果如图7-a所示,反应速率随酶量的增加而变大,当酶量为12 U/mL时,反应速率达到最大,且再增加酶量,反应速率也不再增加,最终确定在L-高丝氨酸质量浓度为0.1 g/L时,RnCGL的浓度为12 U/mL。
2.4.2 乳酸脱氢酶浓度优化
偶联的乳酸脱氢酶的浓度影响检测方法的准确性,只有在偶联的乳酸脱氢酶处于过量时,乳酸脱氢酶的浓度才不是限制因素。向反应体系中加入12.5、25、50、75、100、150 U/mL的乳酸脱氢酶,结果如图7-b所示,当乳酸脱氢酶的量为50、75、100、150 U/mL时,反应速率达到最大,且基本不再变化。因此,选择乳酸脱氢酶的浓度为50 U/mL。
2.4.3 NADH浓度优化
辅因子NADH的浓度直接影响反应速率和中间产物α-丁酮酸的生成。向反应体系中加入终浓度为0.25、0.5、1、1.5 mmol/L的NADH,结果如图7-c所示,当NADH的浓度为0.25 mmol/L时,反应速率较慢,而当NADH的浓度为0.5、1、1.5 mmol/L时,反应速率达到最大,因此,选择NADH的浓度为0.5 mmol/L。
2.4.4 PLP浓度优化
辅酶PLP也参与胱硫醚γ-裂解酶催化L-高丝氨酸的反应,辅酶的浓度也限制反应速率。当反应体系中PLP的浓度为0.1、0.2、0.3、0.4 mmol/L时,结果如图7-d所示,随着PLP浓度的增加,反应速率变化不大,说明0.1 mmol/L的PLP已经足够催化反应,所以确定PLP的浓度为0.1 mmol/L。
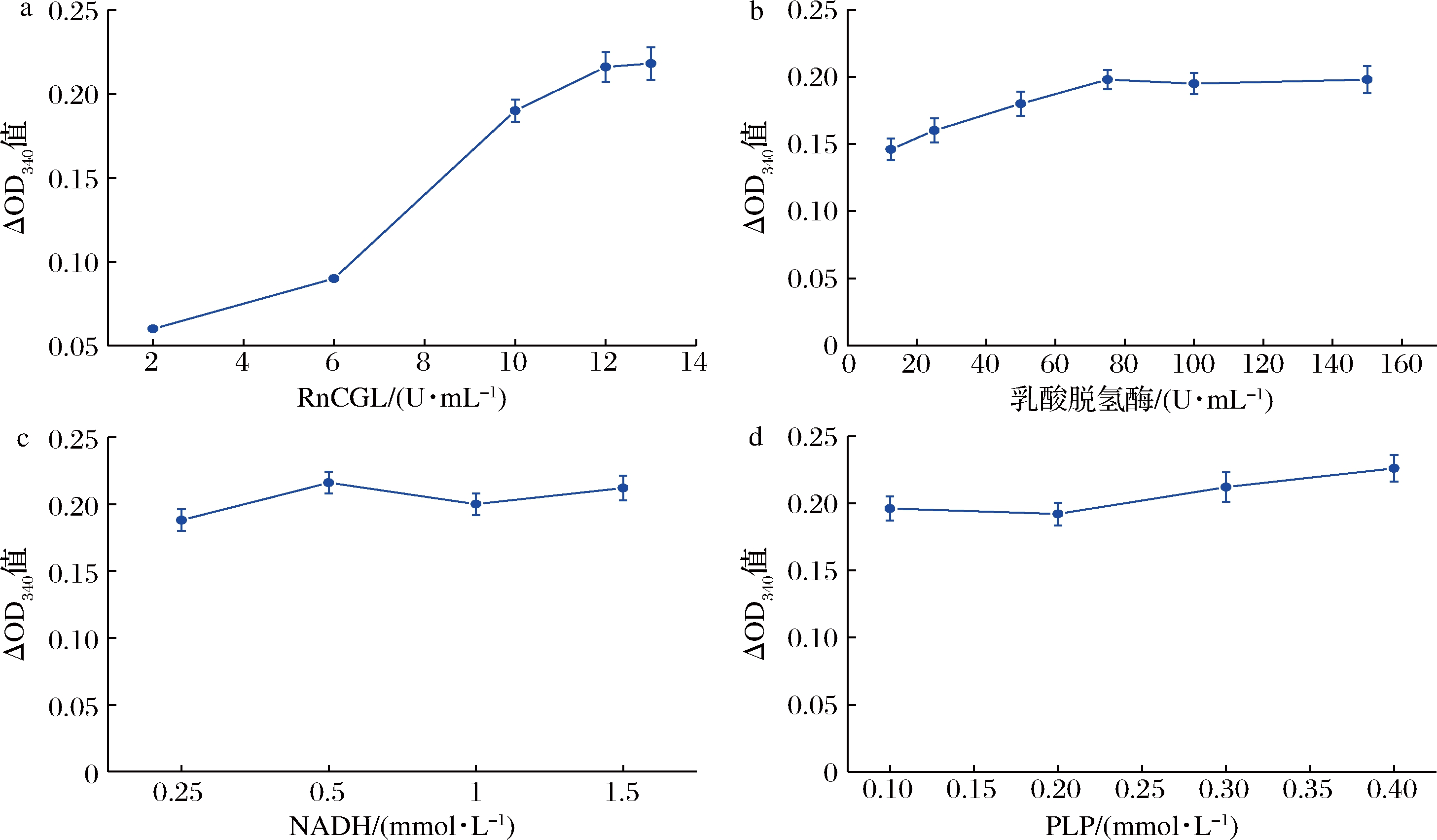
a-RnCGL浓度对检测体系效率的影响;b-LDH浓度对检测体系效率的影响;c-NADH浓度对检测体系效率的影响; d-PLP浓度对检测体系效率的影响
图7 单因素优化双酶偶联L-高丝氨酸检测体系中各组分的含量
Fig.7 Single factor optimization of the component concentration in the enzyme-coupled L-homoserine detection system
2.5 标准曲线绘制
根据1.3.8的方法,在反应体系中分别加入终质量浓度为0.005~0.1 g/L的L-高丝氨酸,测定10 min内在340 nm处吸光度的下降值。结果表明,L-高丝氨酸终质量浓度在0.005~0.1 g/L,吸光度的减少值(ΔOD340值)和L-高丝氨酸浓度呈良好的线性关系。标准曲线的回归方程为Y=3.72X+0.024,R2为0.998 2。标准曲线的R2接近于1,说明ΔOD值和L-高丝氨酸浓度的线性关系较为理想,检测范围为0.005~0.1 g/L,检测灵敏度高,检测范围宽,适用于L-高丝氨酸浓度的检测。
2.6 双酶偶联检测方法的回收率测定
取L-高丝氨酸发酵液,在反应体系中分别加入终质量浓度为10、20、30 g/L的L-高丝氨酸标准液振荡混匀,将混合液稀释到标准曲线检测范围以内,利用双酶偶联检测方法测定L-高丝氨酸的回收率。结果如表1所示,HPLC和酶法测定发酵液中L-高丝氨酸质量浓度分别为12.4、12.1 g/L,2种方法结果基本一致。通过加标实验检测,双酶偶联检测方法平均回收率达到98.87%。结果表明,本方法能满足发酵过程中L-高丝氨酸定量的要求。
表1 发酵液中L-高丝氨酸回收率测定
Table 1 Determination of L-homoserine recovery in fermentation broth
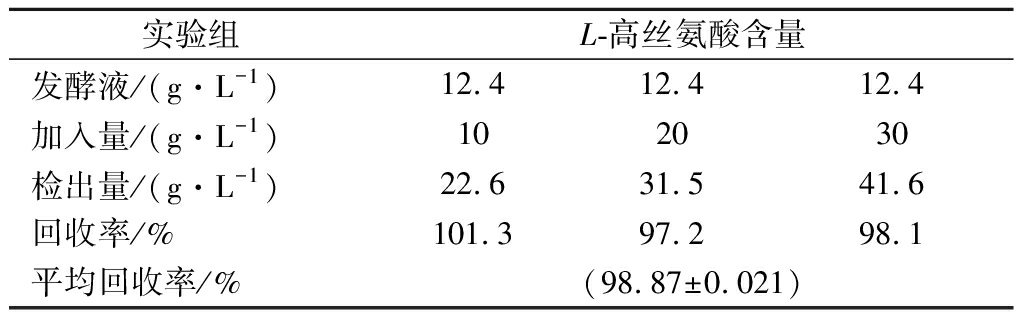
实验组L-高丝氨酸含量发酵液/(g·L-1)12.412.412.4加入量/(g·L-1)102030检出量/(g·L-1)22.631.541.6回收率/%101.397.298.1平均回收率/%(98.87±0.021)
3 结论
本方法利用胱硫醚γ-裂解酶和乳酸脱氢酶偶联催化,将L-高丝氨酸浓度与NADH在340 nm处吸光度变化相关联,建立了一种简单快速、专一性强的L-高丝氨酸检测技术。通过测定RnCGL的酶学性质和酶催化体系各组分浓度,最终确定该方法的测定温度为40 ℃,pH 7.5,RnCGL为12 U/mL,乳酸脱氢酶为50 U/mL,NADH 0.5 mmol/L,PLP 0.1 mmol/L,测定范围为0.005~0.1 g/L。本方法分析仪器简单,试剂价格低廉,准确性高,能在较短时间内完成L-高丝氨酸含量的检测,能够适用于L-高丝氨酸菌株选育过程中大批量样品的检测工作。而且本方法可实现发酵液样品的高通量检测,为L-高丝氨酸高产菌种的高通量筛选和选育提供了重要技术保障。
[1] LI H, WANG B S, LI Y R, et al.Metabolic engineering of Escherichia coli W3110 for the production of L-methionine[J].Journal of Industrial Microbiology Biotechnology, 2017, 44(1):75-88.
[2] PARK J H,LEE S Y.Metabolic pathways and fermentative production of L-aspartate family amino acids[J].Biotechnology Journal, 2010, 5(6):560-577.
[3] VAN DAMME M, ZEILMAKER T, ELBERSE J, et al.Downy mildew resistance in Arabidopsis by mutation of homoserine kinase[J].The Plant Cell, 2009, 21(7):2 179-2 189.
[4] XU X S, TENG H B, QIU G F, et al.A facile synthetic route to L-phosphinothricin[J].Chinese Chemical Letters, 2006, 17(2):177-179.
[5] HONG K K, KIM J H, YOON J H, et al.O-succinyl-L-homoserine based C4- chemical production:Succinic acid, homoserine lactone, γ-butyrolactone, γ-butyrolactone derivatives, and 1,4-butanediol[J].Journal of Industrial Microbiology & Biotechnology, 2014, 41(10):1 517-1 524.
[6] ZHANG Y J, MA C W, DISCHERT W, et al.Engineering of phosphoserine aminotransferase increases the conversion of l-homoserine to 4-hydroxy-2-ketobutyrate in a glycerol-independent pathway of 1,3-propanediol production from glucose[J].Biotechnology Journal, 2019, 14(9):e1900003.
[7] XU J, SAUNDERS C W, GREEN P W, et al.Microorganisms and methods for producing acrylate and other products from homoserine:US20140099676[P].2014-04-10.
[8] LI Y J, WEI H, WANG T, et al.Current status on metabolic engineering for the production of L-aspartate family amino acids and derivatives[J].Bioresour Technology, 2017, 245:1 588-1 602.
[9] XU J Z, HAN M, ZHANG J L, et al.Metabolic engineering Corynebacterium glutamicum for the L-lysine production by increasing the flux into L-lysine biosynthetic pathway[J].Amino Acids, 2014, 46(9):2 165-2 175.
[10] 王颖珊, 郭峰, 严伟, 等.四碳有机酸生物合成的代谢工程研究进展[J].生物工程学报, 2021, 37(5):1 697-1 720.
WANG Y S, GUO F, YAN W, et al.Advances in the metabolic engineering for the production of tetracarbon organic acids[J].Chinese Journal of Biotechnology, 2021, 37(5):1 697-1 720.
[11] LI H, WANG B S, ZHU L H, et al.Metabolic engineering of Escherichia coli W3110 for L-homoserine production[J].Process Biochemistry, 2016, 51(12):1 973-1 983.
[12] LI N, XU S, DU G C, et al.Efficient production of L-homoserine in Corynebacterium glutamicum ATCC 13032 by redistribution of metabolic flux[J].Biochemical Engineering Journal, 2020, 161:107665.
[13] ZHANG Y, WEI M H, ZHAO G H, et al.High-level production of L-homoserine using a non-induced, non-auxotrophic Escherichia coli chassis through metabolic engineering[J].Bioresource Technology, 2021, 327(4):124814.
[14] MU Q X, ZHANG S S, MAO X J, et al.Highly efficient production of L-homoserine in Escherichia coli by engineering a redox balance route[J].Metabolic Engineering, 2021, 67:321-329.
[15] LIU M, LOU J L, GU J L, et al.Increasing L-homoserine production in Escherichia coli by engineering the central metabolic pathways[J].Journal of Biotechnology, 2020, 314-315:1-7.
[16] BRIDGES C C, KRASNIKOV B F, JOSHEE L, et al.New insights into the metabolism of organomercury compounds:Mercury-containing cysteine S-conjugates are substrates of human glutamine transaminase K and potent inactivators of cystathionine γ-lyase[J].Archives of Biochemistry & Biophysics, 2012, 517(1):20-29.