全球范围内,植物病害直接或间接造成的经济损失约400亿美元/年,严重影响全球作物、水果的生产及粮食安全[1],植物病害中最常见的类型是真菌病害(约占70%~80%)[2]。化学防霉剂是当前防治植物真菌病害的主要手段,但由于化学农药在减轻植物病害的同时会对人类健康、环境和生物多样性产生不利影响,因此,越来越多的研究表明,生物源防霉剂是极具潜力的选择之一[3]。
波拉霉素(polaramycin)是由中国医学科学院医药生物技术研究所和中国农科院生物防治研究所首次发现的一种新型农用天然抗菌化合物[4],由波拉霉素A和B 2个组分组成,是从吸水链霉菌LP-93(Streptomyces hygroscopicus LP-93)发酵培养物中分离得到的具有很强抗真菌活性的多羟基大环内酯类抗生素[5],其中波拉霉素A占比超过90%[6]。波拉霉素除对酵母菌、丝状真菌和革兰氏阳性菌有抑制作用外,特别是对许多引起植物病害的真菌具有较高的抑制活性[7],是一类广谱抗真菌抗生素。
目前,大环内酯类抗生素的检测方法主要以HPLC[8]、液相色谱-质谱联用法[9]以及免疫分析方法[10]为主。由于现阶段关于波拉霉素检测方法的相关报道较少,且没有基于HPLC法开发的测定、分离纯化发酵液中波拉霉素的方法,因此,为了推进波拉霉素生物合成的相关研究,应对菌株改造、发酵条件优化等大量样品检测及产物分离纯化工作,需要一种可准确定量且相对快速的检测方法及有效的分离鉴定方法。
本研究建立了吸水链霉菌发酵液中波拉霉素A含量的HPLC检测方法,并利用高效制备色谱仪(high performance preparative chromatography, HPPC)从发酵培养物中分离纯化得到了较高纯度波拉霉素A溶液,并通过超高效液相色谱-四极杆-飞行时间串联质谱(ultra-high performance liquid chromatography quadrupole time-of-flight mass spectrometer, UPLC-Q-TOF)获得了其质谱图,为波拉霉素的应用研究提供技术支持。
1 材料与方法
1.1 材料与试剂
波拉霉素标准品、波拉霉素B标准品(纯度均>90%),实验室自制;乙腈、甲醇(均为色谱纯),德国Merck公司。
1.2 仪器与设备
UltiMate 3000超高效液相色谱仪,美国赛默飞世尔科技公司;1290-6545超高效液相色谱-四极杆-飞行时间质谱联用仪、PrepHT XDB-C18色谱柱(21.2 mm×250 mm,7 μm),美国安捷伦科技有限公司;COSMOSIL 5C18-MS-Ⅱ色谱柱(250 mm×4.6 mm,5 μm),日本Nacai Tesque公司;Prostar高效制备色谱仪,美国Varian公司。
1.3 波拉霉素A检测方法的建立
1.3.1 色谱条件
色谱柱:COSMOSIL 5C18-MS-Ⅱ反相柱(250 mm×4.6 mm,5 μm);流动相∶V(乙腈)∶V(水)=45∶55;进样量10 μL;流速1 mL/min;柱温30 ℃;检测波长220 nm。
1.3.2 标准溶液的制备
波拉霉素标准溶液的配制:精密称取波拉霉素适量,用流动相溶解配制成质量浓度为1 g/L的储备液。分别精密量取该储备液适量,用流动相逐级稀释成质量浓度为2.5、5、25、50、125、250、500 mg/L的波拉霉素系列标准溶液,置4 ℃冰箱备用。
1.3.3 发酵液样品处理方法
取2 mL发酵液,加入4 mL色谱纯级别的甲醇溶液,充分振荡混匀后,置4 ℃冰箱避光放置24 h,12 000 r/min,4 ℃冷冻离心10 min,取上清液用0.22 μm微孔滤膜过滤[11-12]。
1.3.4 最大吸收波长的测定
使用高效液相色谱二极管阵列检测器(diode array detector, DAD)紫外全波长检测功能,对波拉霉素A、B色谱峰进行190~400 nm扫描[13],测定其最大吸收波长。
1.3.5 标准曲线的测定
对波拉霉素系列标准溶液,按1.3.1方法进行测定,以波拉霉素A的峰面积(y)对其质量浓度(x, g/L)进行线性回归运算,求得线性回归方程,既为标准曲线。
1.3.6 检出限(limit of detection, LOD)和定量限(limit of quantitation, LOQ)的测定
按1.3.1方法测定发酵液样品中波拉霉素A质量浓度和信噪比(S/N),并使用空白样品溶液稀释,以3倍信噪比(S/N≥3)所对应的波拉霉素A质量浓度为检测限,以10倍信噪比(S/N≥10)所对应的波拉霉素A质量浓度为最低定量限[14]。
1.3.7 加标回收率的测定
按照1.3.3方法制备发酵液样品,采用样品加标的方法,向样品中分别加入1倍、2倍、10倍定量限浓度3个水平的波拉霉素A标准品(GB/T 27404—2008《实验室质量控制规范 食品理化检测》),重复测定3次,加标回收率的计算如公式(1)所示[15]:
加标回收率![]()
(1)
式中:Cs为加标试样测定质量浓度,mg/L;C0为未加标试样测定质量浓度,mg/L;CT为理论加标质量浓度,mg/L。
1.3.8 方法的精密度
将处理好的不同批次且波拉霉素A质量浓度不同的3个样品,每个样品连续测定11次,计算方法的精密度,方法的精密度用相对标准偏差(relative standard deviation, RSD)表示。
1.3.9 波拉霉素A的分离纯化
取发酵培养液1 000 mL,加无水草酸调pH至4~4.5,离心弃上清液,用冻干机将沉淀物干燥过夜。干燥的固体粉末用95%(体积分数)乙醇浸泡,避光静置24 h,期间每隔8 h振荡混匀1次,离心收集上清液,45 ℃,200 r/min,减压浓缩至只余水,将水不溶物用乙酸乙酯洗涤2次后,加1倍体积乙腈复溶,获得浓缩发酵培养液,用0.22 μm微孔滤膜过滤,使用HPPC分离滤液,获得波拉霉素A纯化收集液,重复3次,并利用1.3.1方法测定浓缩发酵培养液和纯化收集液中波拉霉素A的质量浓度,计算纯度[16]和纯化得率[17]。
HPPC条件:色谱柱:PrepHT XDB-C18[(21.2 mm×250 mm,7 μm);流动相:V(乙腈)∶V(水)=45∶55)];进样量3 mL;流速1 mL/min;检测波长220 nm。纯度和纯度得率的计算如公式(2)和公式(3)所示:
纯度![]()
(2)
纯化得率![]()
(3)
式中:Ai为目标物色谱峰面积,mAU·min;At为总色谱峰面积,mAU·min;CA集为纯化收集液波拉霉素A质量浓度,mg/L;VA集为纯化收集液体积,mL;CA缩为浓缩发酵培养液波拉霉素A质量浓度,mg/L;VA缩为浓缩发酵培养液体积,mL。
1.3.10 UPLC-Q-TOF的质谱条件
正离子(Dual AJS ESI+)模式,离子源温度350 ℃,毛细管电压4 000 V,干燥气流速11 L/min,鞘气温度250 ℃,鞘气流速11 L/min,雾化气压力55 psi。一级母离子扫描范围m/z为800~1 200,二级质谱使用Targeted-MS/MS模式,选择1 090.699 6 m/z作为母离子,质量精度误差±50 ppm,碎片离子扫描范围m/z为100~1 200,碰撞能为70 eV。
2 结果与分析
2.1 方法专属性考察
将一定质量浓度的波拉霉素混标溶液、波拉霉素B标准溶液、样品和空白样品,按1.3.1方法操作,获得波拉霉素混标溶液色谱图(图1-A)、波拉霉素B标准溶液色谱图(图1-B)、样品色谱图(图1-C)和空白样品色谱图(图1-D)。可见,波拉霉素A、B的保留时间分别约为14.1、16.1 min(图1),最大吸收波长均为220 nm(图2),发酵培养基中的物质不干扰波拉霉素A和B的测定。
2.2 波拉霉素的标准曲线
按1.3.5的方法测定波拉霉素标准曲线,得到线性回归方程为y=0.035 18x+0.086 84,r2=0.999 8。结果表明,波拉霉素在2.5~500 mg/L线性关系良好。检出限为1 mg/L,定量限为2.5 mg/L。
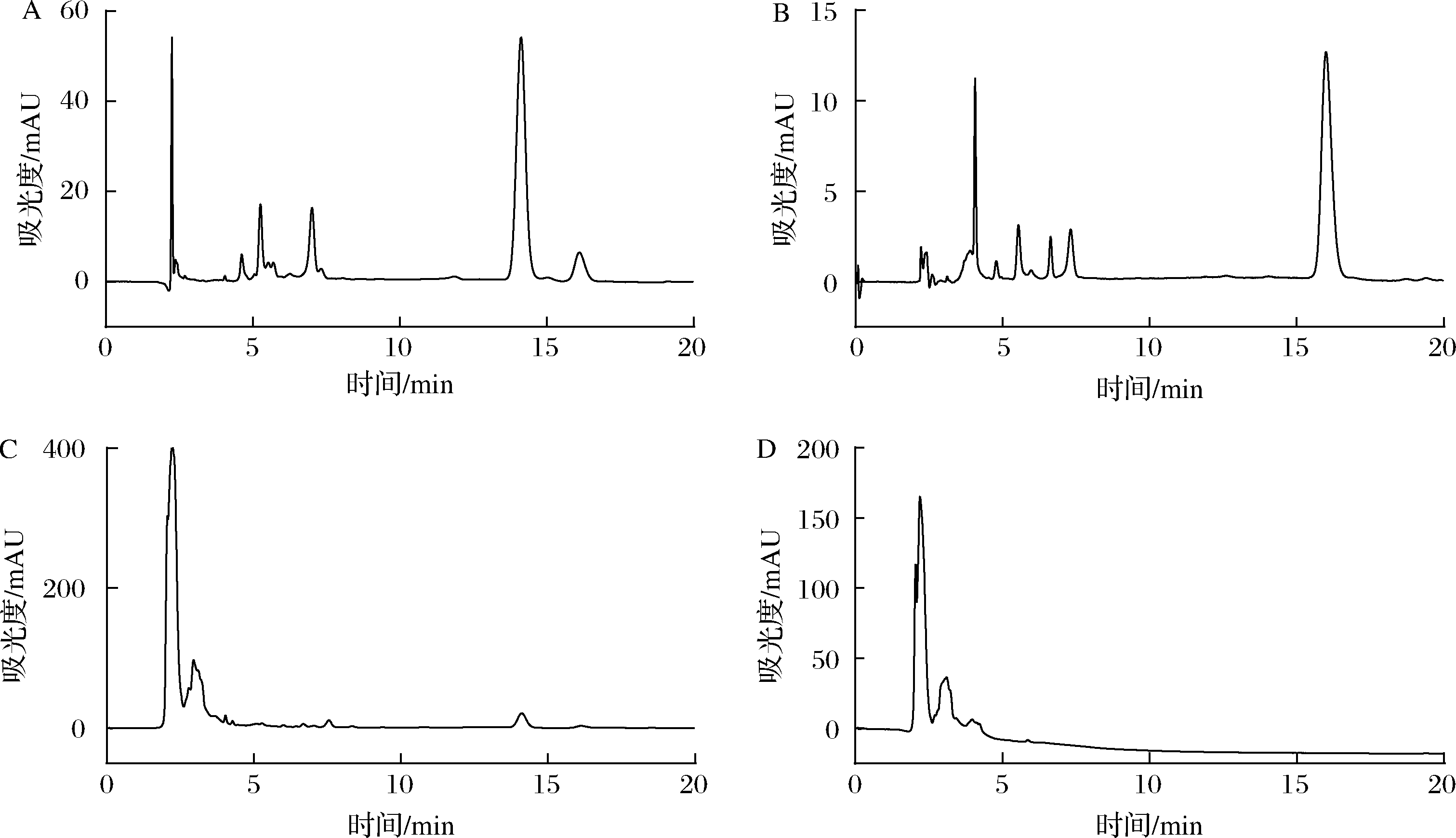
A-波拉霉素混标溶液;B-波拉霉素B标准品溶液;C-样品溶液;D-空白样品溶液
图1 波拉霉素混合标准品、波拉霉素B标准品、样品和空白样品的HPLC色谱图
Fig.1 HPLC chromatograms of mixed standard of polaramycin, standard of polaramycin A, sample, and blank sample
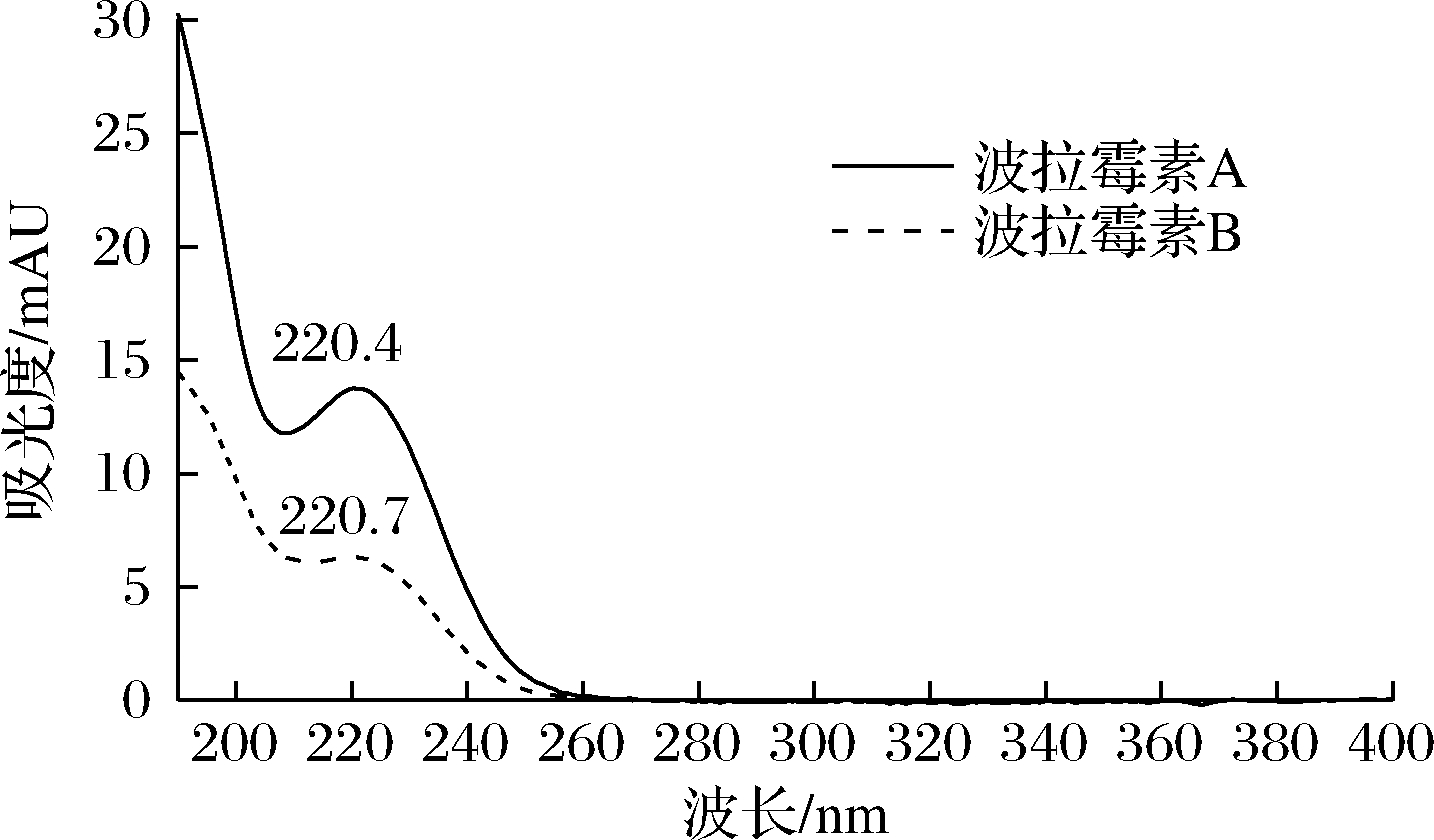
图2 波拉霉素190~400 nm吸收曲线
Fig.2 190~400 nm wavelength absorption curve of polaramycin
2.3 加标回收实验
表1为回收率实验结果,加标回收率在90.53%~101.96%。该方法的回收率符合要求。
2.4 精密度
本实验通过3组浓度样品考察了方法的精密度,由表2可知,RSD最高为1.65%,<2%,精密度良好。
表1 样品中波拉霉素的加标回收率(n=3)
Table 1 Adding standard recoveries of polaramycin in samples(n=3)
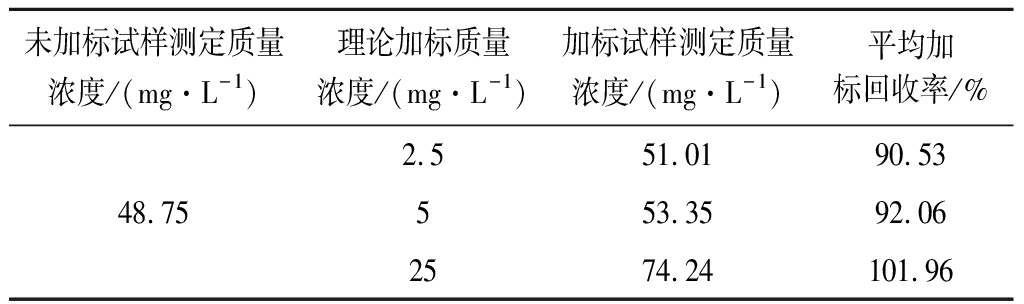
未加标试样测定质量浓度/(mg·L-1)理论加标质量浓度/(mg·L-1)加标试样测定质量浓度/(mg·L-1)平均加标回收率/%2.551.0190.5348.75553.3592.062574.24101.96
表2 样品中波拉霉素的精密度(n=11)
Table 2 Precision of polaramycin in samples (n=11)

样品测定均值/(mg·L-1)标准偏差RSD/%1146.560.470.322169.690.520.313207.163.421.65
2.5 波拉霉素A的分离纯化与鉴定
通过1.3.9的分离方法,获得了含波拉霉素的浓缩发酵培养液,并通过HPPC收集得到了波拉霉素A纯化收集液45 mL,按1.3.1方法操作,测定获得浓缩发酵培养液色谱图(图3-A)和波拉霉素A纯化收集液色谱图(图3-B),按2.2标准曲线计算得浓缩发酵培养液和纯化收集液中波拉霉素A质量浓度分别为(654.96±50.28)、(33.97±5.01) mg/L,纯化得率为(71.84±5.95)%,纯化收集液中波拉霉素A的纯度为(87.52±7.12)%。
按1.3.10的方法,用UPLC-Q-TOF对波拉霉素A纯化收集液进行测定,得到波拉霉素A纯化收集液总离子流色谱图(图4),一级质谱(图5-A,保留时间=13.841 min)下产生显著的m/z 1 090.716 0[M+H]+分子离子峰,根据响应值和质荷比推断该纯化收集液中主成分为波拉霉素A,质量精度误差为15 ppm,二级质谱(图5-B,保留时间=13.869 min)下波拉霉素A分子离子在70 eV碰撞能下进一步裂解,产生二级碎片离子m/z 306.295 9[M+H-C36H63O18]+、664.534 4[M+H-C17H29O12]+、1 010.701 3[M+H-H2O-OH-COOH]+、1 028.712 4[M+H-OH-COOH]+、1 046.723 2[M+H-COOH]+。
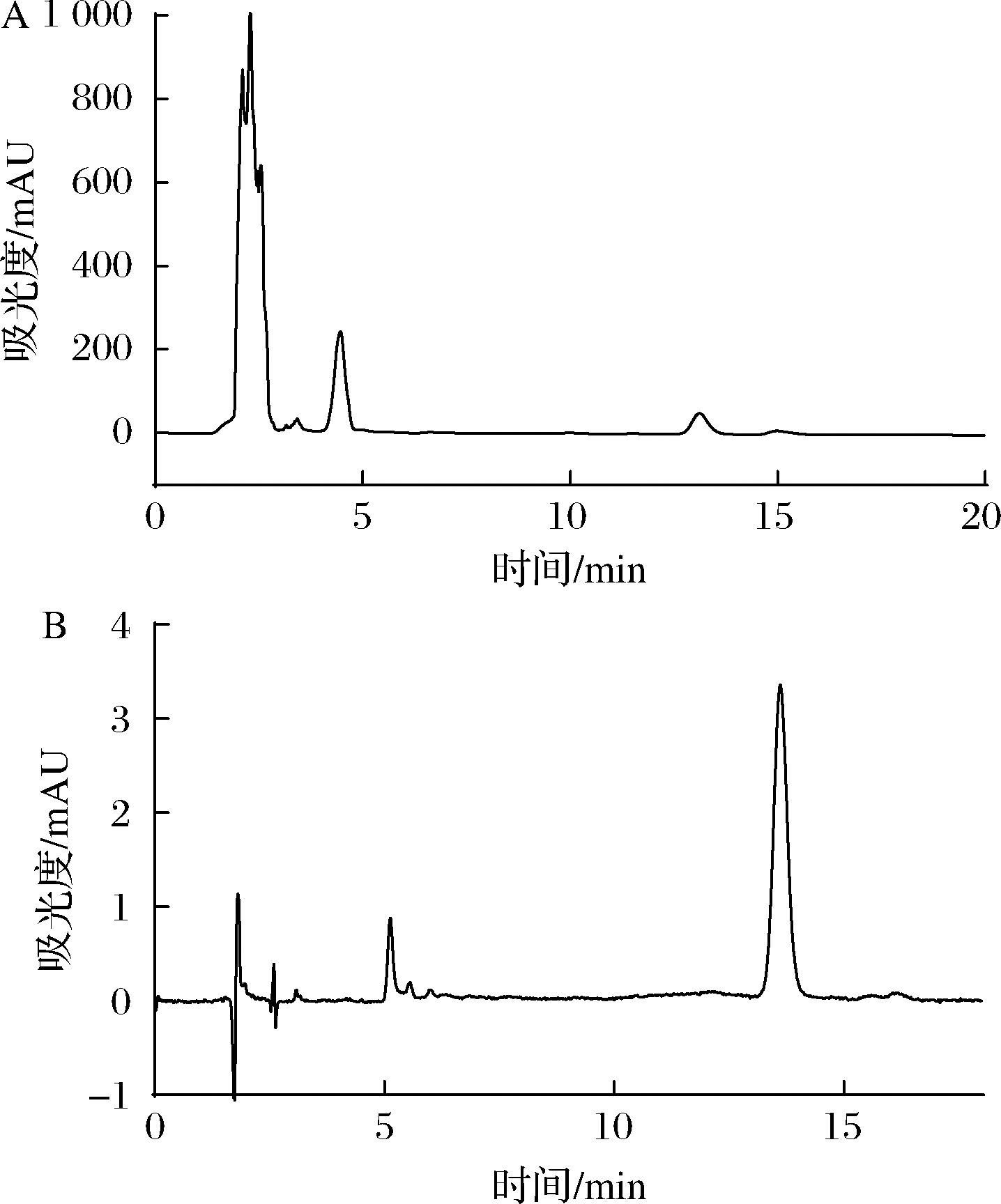
A-波拉霉素浓缩发酵培养液;B-波拉霉素A纯化收集液
图3 浓缩发酵培养液、波拉霉素A的纯化收集液 的HPLC色谱图
Fig.3 HPLC chromatograms of concentrated fermentation broth and purified fraction of polaramycin A
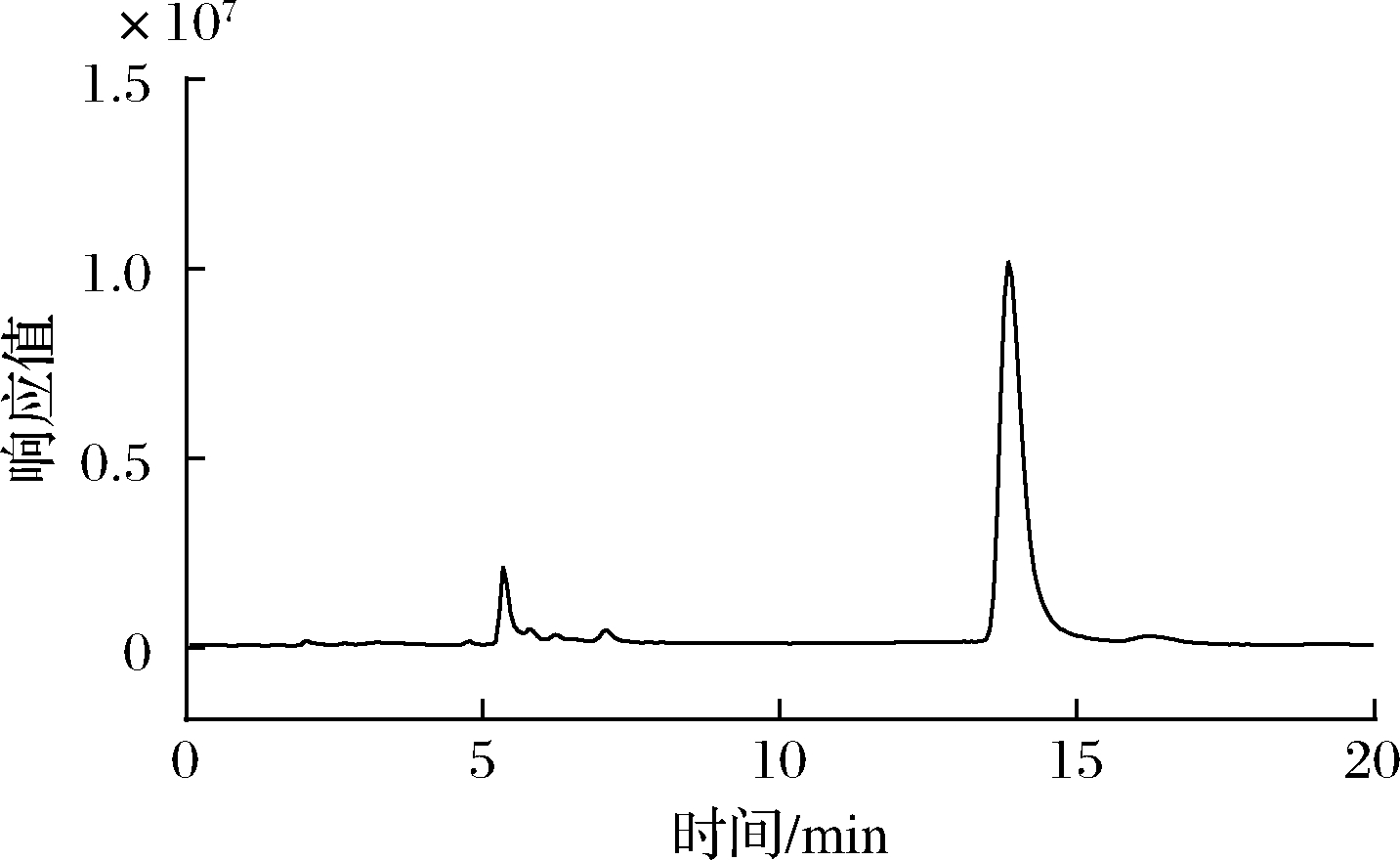
图4 波拉霉素A纯化收集液总离子流色谱图
Fig.4 Total ion current chromatogram of purified fraction of polaramycin A
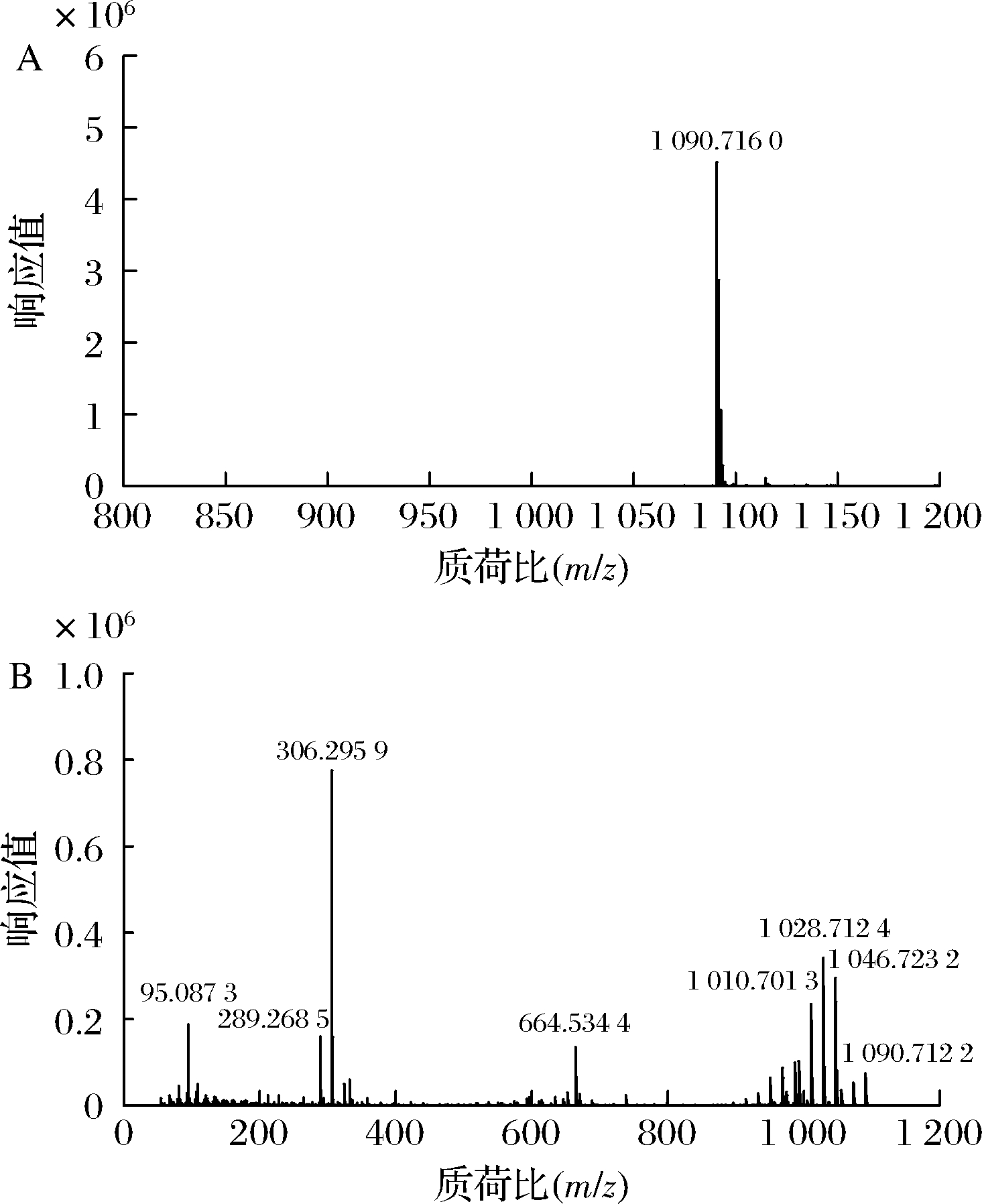
A-一级质谱图;B-二级质谱图
图5 波拉霉素A纯化收集液一级和二级质谱图
Fig.5 MS and MS/MS spectra of purified fraction of polaramycin A
3 结论
本实验建立了吸水链霉菌发酵液波拉霉素A的HPLC检测和纯化方法,结果表明,波拉霉素A和波拉霉素B均在220 nm附近有最大吸收,保留时间分别为14.1、16.1 min左右,分离度较好,峰形较好,基本无拖尾,培养基组分不干扰实验测定。首次对检测波拉霉素A所建立的分析方法进行了方法学验证,采用外标法测定波拉霉素A的含量操作简单,线性关系良好结果准确,回收率高,重复性好。该方法是测定吸水链霉菌发酵液中波拉霉素A的简单、快速、准确方法。将液相色谱条件应用于HPPC及UPLC-Q-TOF,从吸水链霉菌发酵液中分离纯化得到了较高纯度的波拉霉素A溶液,并获得了波拉霉素A的一级和二级质谱图,为该天然产物的分离纯化提供了参考。
[1] SYED AB RAHMAN S F, SINGH E, PIETERSE C M J, et al.Emerging microbial biocontrol strategies for plant pathogens[J].Plant Science, 2018, 267:102-111.
[2] 冯丹丹, 邓蕾, 汪祖鹏, 等.寄主诱导的基因沉默在增强植物真菌病害抗性方面的研究进展[J].植物科学学报, 2021, 39(3):316-323.
FENG D D, DENG L, WANG Z P, et al.Research progress on host-induced gene silencing to promote plant resistance against fungal disease[J].Plant Science Journal, 2021, 39(3):316-323.
[3] RAYMAEKERS K, PONET L, HOLTAPPELS D, et al.Screening for novel biocontrol agents applicable in plant disease management-a review[J].Biological Control, 2020, 144:104240.
[4] 冯东岳. 波拉毒素对稻瘟病的防治效果评价及机制初探[D]. 北京:中国农业科学院, 2004.
FENG D Y. The mechanism and effect of polaramycin on magnaporthe grisea[D]. Beijing: Chinese Academy of Agricultural Sciences, 2004.
[5] 孟伟, 金文藻.新抗生素波拉霉素A和B的结构测定[J].药学学报, 1997, 32(5):352-356.
MENG W, JIN W Z.Synthesis and antibacterial activity of tricycic fluoroquinolones[J].Acta Pharmaceutica Sinica, 1997, 32(5):352-356.
[6] 金文藻, 孟伟, 王以光, 等.新抗生素波拉霉素(polaramycin)A或B及其制造方法:中国, CN1048496C[P].2000-01-19.
JIN W Z, MENG W, WANG Y G, et al.Antibiotic polaramycin A or B and preparation method thereof:China, CN1048496C[P].2000-01-19.
[7] 孙正阳, 吕广新, 孟浩毅, 等.波拉霉素发酵工艺的优化[J].中国医药生物技术, 2018, 13(2):163-168.
SUN Z Y, LYU G X, MENG H Y, et al.Optimization of fermentation process on polaramycin[J].Chinese Medicinal Biotechnology, 2018, 13(2):163-168.
[8] JOSHI S.HPLC separation of antibiotics present in formulated and unformulated samples[J].Journal of Pharmaceutical and Biomedical Analysis, 2002, 28(5):795-809.
[9] GBYLIK-SIKORSKA M, GAJDA A, NOWACKA-KOZAK E, et al.Multi-class procedure for analysis of 50 antibacterial compounds in eggshells using ultra-high-performance liquid chromatography-tandem mass spectrometry[J].Molecules(Basel,Switerland), 2021, 26(5):1373.
[10] LI L, WANG X Q, HOU R L, et al.Single-chain variable fragment antibody-based ic-ELISA for rapid detection of macrolides in porcine muscle and computational simulation of its interaction mechanism[J].Food Control, 2022, 133:108571.
[11] LU C Z, YIN J, ZHAO F L, et al.Metabolomics analysis of the effect of dissolved oxygen on spinosad production by Saccharopolyspora spinosa[J].Antonie Van Leeuwenhoek, 2017, 110(5):677-685.
[12] HUANG Y, ZHANG X L, ZHAO C, et al.Improvement of spinosad production upon utilization of oils and manipulation of β-oxidation in a high-producing Saccharopolyspora spinosa strain[J].Microbial Physiology, 2018, 28(2):53-64.
[13] DE S SALES Q, DA S MATHIAS M, DE OLIVEIRA R R.Determination of phenolic compounds in the methanolic extract of pourouma guianensis leaves by UPLC-DAD-MS[J].The Natural Products Journal, 2020, 10(5):566-570.
[14] 杨欣宜, 郭辉, 陈云菲, 等.高效液相色谱法测定蔗糖-6-乙酯[J].食品与发酵工业, 2019, 45(22):240-245.
YANG X Y, GUO H, CHEN Y F, et al.Determination of sucrose-6-acetate by high performance liquid chromatography[J].Food and Fermentation Industries, 2019, 45(22):240-245.
[15] 方国珊, 张磊, 张端丽, 等.HPLC检测大鼠组织样品中花椒麻素方法的建立[J].食品科学, 2014, 35(2):141-145.
FANG G S, ZHANG L, ZHANG D L, et al.Development of an HPLC method for determining alkylamide from Sichuan pepper (Zanthoxylum bungeanum) in tissues of rats aAdministered with it[J].Food Science, 2014, 35(2):141-145.
[16] 薛宏坤, 李鹏程, 钟雪, 等.高速逆流色谱分离纯化桑葚花色苷及其抗氧化活性[J].食品科学, 2020, 41(15):96-104.
XUE H K, LI P C, ZHONG X, et al.Separation and purification of anthocyanins from mulberry fruit by high-speed counter-current chromatography and their antioxidant activity[J].Food Science, 2020, 41(15):96-104.
[17] 王姣琳, 岳田利, 袁亚宏.红曲霉与乳酸菌混合发酵藜麦制备降压肽[J].食品与发酵工业, 2021, 47(21):217-224.
WANG J L, YUE T L, YUAN Y H.Preparation of antihypertensive peptides from quinoa by fermentation with Monascus and lactic acid bacteria[J].Food and Fermentation Industries, 2021, 47(21):217-224.