中华绒螯蟹俗称大闸蟹,因其口感风味良好,营养成分丰富而广受消费者喜爱[1]。中华绒螯蟹中富含胆固醇,胆固醇作为一种重要的化合物,参与维持细胞膜的渗透性和流动性,并能够作为前体合成胆汁酸和固醇激素[2-3]。新鲜的蟹肉中几乎不存在胆固醇氧化物(cholesterol oxides,COPs),外源性COPs在蟹肉中通过胆固醇的光氧化、热氧化等反应过程而形成。烹饪、辐射和储藏方式都会促进COPs的产生[4-5]。氧化产物在结构上与胆固醇相似,但对人体健康有危害。目前常见的COPs约有25种,包括5,6α-环氧化胆固醇、胆甾烷-3β,5α,6β-三醇、7α-胆固醇、7β-羟基胆固醇、7-酮基胆固醇和25-羟基胆固醇等。研究表明,部分胆固醇氧化物具有细胞毒性,诱导细胞异常凋亡,会对人体健康造成不良影响[6-7]。
利用现代仪器分析技术检测胆固醇氧化物是目前主流的手段,液相色谱与气相色谱技术在一定程度上能够满足部分肉制品中COPs分离的需要[8-10],但液相色谱的分离效果取决于色谱柱的容量,COPs的分离要求较高,因此液相色谱法对COPs的分离效果有限。结合目前广受欢迎的质谱分离技术,更能准确地分离并定量不同类型的的胆固醇氧化物[11-17],但液相色谱-质谱法由于仪器设备昂贵,用于定量COPs并不普遍。气相色谱法可对COPs实现有效分离,而气相色谱-串联质谱法结合了气相色谱的高分离度和质谱的高灵敏度,适合食品中COPs的分离和检测。本工作通过优化样品的前处理条件及色谱-质谱条件,建立了固相萃取-气相色谱-三重四极杆串联质谱法同时测定蟹肉中6种COPs含量的方法,并对经加热处理后中华绒螯蟹蟹肉中胆固醇氧化物进行分析,为评价加热处理的中华绒螯蟹安全性提供了参考。
1 材料与方法
1.1 材料与试剂
中华绒螯蟹,上海海洋大学崇明养殖基地;双(三甲基硅基)三氟乙酰胺,上海联硕科技有限公司;甲醇、正己烷、丙酮、乙腈、三氯甲烷、无水乙醚、乙酸乙酯(均为色谱纯),麦克林公司;无水吡啶,上海试一化学试剂有限公司;无水硫酸钠(分析纯),嘉兴艾森化工有限公司。
6种COPs标准品:胆甾烷-3β,5α,6β-三醇(97%),凯试(上海)科技有限公司;7β-羟基胆固醇(99%),上海抚生实业有限公司;5α,6α-环氧化胆固醇(95%),麦克林公司;7α-羟基胆固醇(98%)、7-酮基胆固醇(98%),吴睿化学有限公司;25-羟基胆固醇(99%),TRC公司。
1.2 仪器与设备
TSQ 800型气相色谱-三重四极杆质谱联用仪,美国Thermo Fisher公司;HP-5 ms型毛细管色谱柱(30 m×0.25 mm×0.25 μm),美国Agilent公司;MTN-2800D型氮吹仪,上海申生科技有限公司;RE-2000B型旋转蒸发仪,上海亚荣生化仪器厂;SH2-3型循环水多用真空泵、VORTEX-3型旋涡混合仪,上海沪西分析仪器厂有限公司;BSAP243-CW型万分之一天平,德国Sartorius公司;SBEQ-CG1824型固相萃取装置、HLB固相萃取柱(200 mg, 6 mL),德国CNW公司。
1.3 实验方法
1.3.1 标准溶液的配制
(1)COPs单标准储备液:分别称取6种COPs标准品5.00 mg,用正己烷溶解并定容至10 mL。
(2)COPs混合标准储备液:分别移取6种COPs单标准储备液5 mL,用正己烷溶解并定容至50 mL,配制50 μg/mL的混合标准储备液,于-20 ℃条件下保存。
(3)COPs混合标准溶液系列:分别移取COPs混合标准储备液40、100、200、1 000、2 000 μL,用正己烷稀释,得到0.2、0.5、1.0、5.0、10.0 μg/mL混合标准溶液系列,现用现配。
1.3.2 样品前处理
样品提取:准确称取4.0 g均质的样品于离心管中,加入30 mL V(甲醇)∶V(氯仿)=1∶2混合溶液,充分振荡,于4 ℃条件下避光静置12 h,然后经过盛有5.0 g无水硫酸钠的漏斗过滤后转移到100 mL的平底烧瓶中,于40 ℃真空条件下,蒸发至无水后,溶解于5 mL的正己烷,过0.22 μm有机滤膜,得到提取液。
样品净化:向已提前活化的固相萃取柱中平缓注入已得到的提取液,过柱后弃去,依次用10 mL含10%乙醚和20 mL 20%乙醚的正己烷溶液进行淋洗,除去杂质后用6 mL丙酮对保留的目标物进行洗脱,收集含有待测组分的滤液,在氮吹仪中进行吹干。
样品衍生化:加入500 μL无水吡啶和100 μL的双(三甲基硅基)三氟乙酰胺,V(无水吡啶)∶V[双(三甲基硅基)三氟乙酰胺]=5∶1,于25 ℃的条件下避光衍生化1 h,衍生化结束后用氮气吹干,1 mL正己烷定容,待上机检测。
1.3.3 仪器工作条件
1.3.3.1 色谱条件
采用HP-5 ms型毛细管色谱柱对COPs进行分离,1 mL/min的载气(He)流速;升温程序:初始温度为200 ℃(保持5 min),再升至270 ℃(10 ℃/min,保持1 min),继续升至280 ℃(2 ℃/min,保持1 min),最后升至300 ℃(5 ℃/min,保持10 min);采用不分流进样模式,进样体积为1 μL。
1.3.3.2 质谱条件
采用电子轰击(EI)离子源;离子源温度为230 ℃,传输线温度260 ℃,四极杆温度为150 ℃,设定70 eV的电离能量和选择离子扫描(SIM)模式,溶剂延迟为5 min,对6种COPs的质谱离子进行扫描监测。
1.3.4 方法学考察
1.3.4.1 方法的线性和检出限
取COPs混合标准溶液系列按1.3.2方法进行衍生化反应并上机,6种COPs不同梯度标准溶液的浓度作为横坐标,相应的定量离子峰面积作为纵坐标,得到线性方程,并以产生3倍信噪比(S/N)时化合物的质量浓度为检出限。
1.3.4.2 精密度与回收试验
选取新鲜的中华绒螯蟹蟹肉进行均质,作为空白样品,分别加入低、中、高3种浓度的COPs混合标准溶液,并根据1.3.2方法分别进行3次水平平行实验,进行相应加标回收率和相对标准偏差(relative standard deviations,RSD)的计算。
1.3.5 基质效应
本实验取空白蟹肉样品,配制与标准储备液浓度水平相同的空白基质溶液,将两种溶液上机,分别记录各自对应的响应值,对应基质效应ME的计算如公式(1)所示:
(1)
式中:A为添加样品基质溶液响应值;B为纯标准溶液响应值。
2 结果与分析
2.1 仪器工作条件的确定
2.1.1 色谱条件的选择
本实验采用HP-5 ms毛细管色谱柱。文献中提到,当色谱柱温度低于200 ℃时,COPs均不能被检出;温度超过300 ℃,COPs对应的信号响应值不会改变[18]。考虑到衍生化后的COPs结构差别不大,为更好地区分不同COPs的色谱峰,提高检测灵敏度,通过不断优化,确定了合适的柱温升温程序(见1.3.3.1)。采用单标溶液进样,确定了6种COPs的保留时间分别为11.36、12.95、15.14、17.57、19.80、20.46 min;再通过混标进样,分析得到6种COPs标准的色谱图,如图1所示,所有的COPs在21 min内实现了完全分离,分离效果良好。
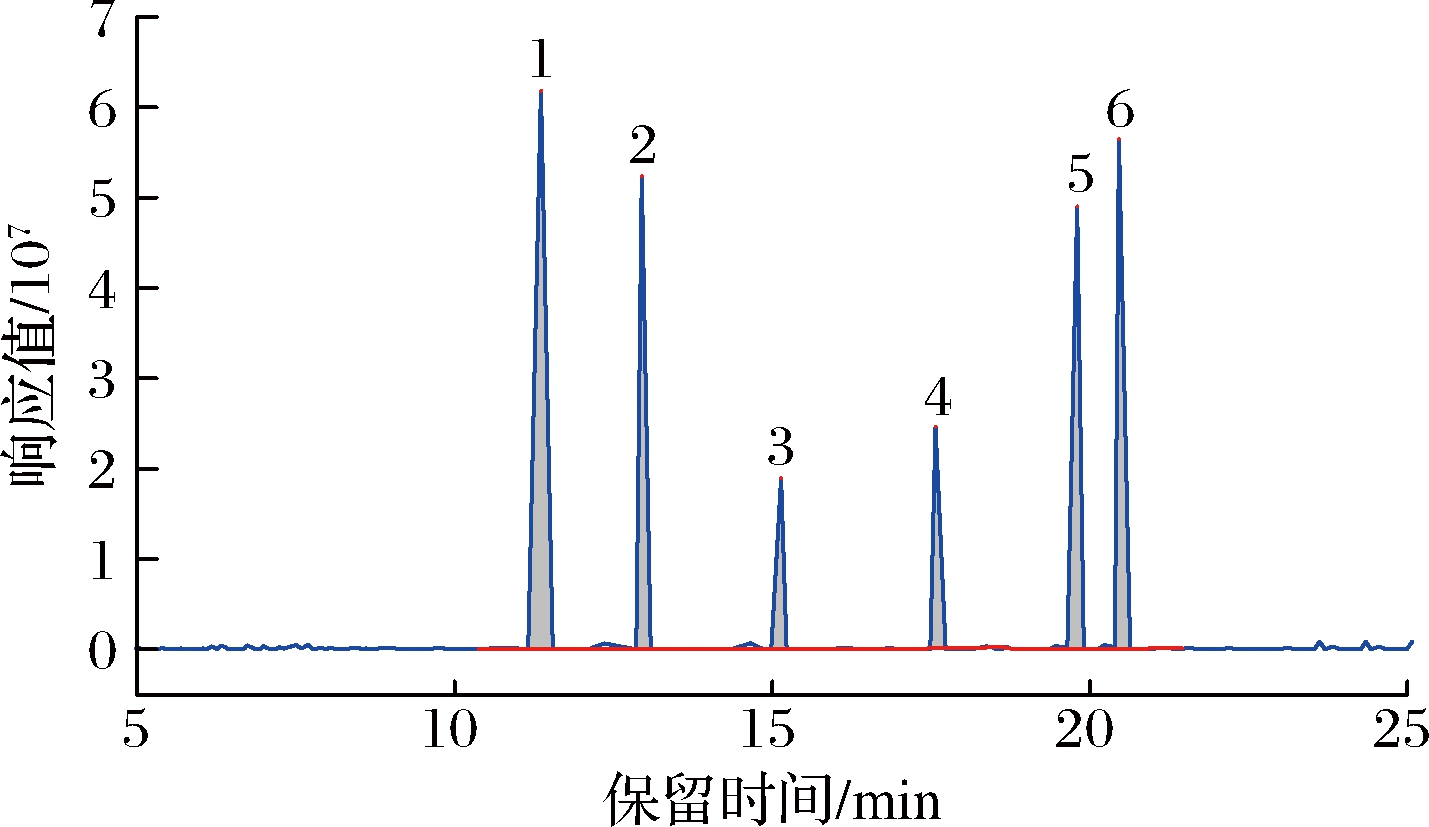
1-7α-羟基胆固醇;2-7β-羟基胆固醇;3-5α,6α-环氧化胆固醇; 4-胆甾烷-3β,5α,6β-三醇;5-25-羟基胆固醇;6-7-酮基胆固醇
图1 六种COPs混合标准溶液(5.0 μg/mL)的总离子流色谱图
Fig.1 Total ion chromatogram of six COPs mixed standards (5.0 μg/mL)
2.1.2 质谱条件的选择
胆固醇的衍生化有利于提高仪器分析时样品的分离度与检测的灵敏度,但经衍生化后,部分COPs的主要子离子相近。为了更加准确地定量样品中的COPs,并排除样品基质的干扰,采用SIM模式,根据6种COPs不同的保留时间,进行分段扫描。设定不同的采集时间段:0~12 min,采集7α-羟基胆固醇,12~13 min,采集7β-羟基胆固醇,13~16 min,采集5α,6α-环氧化胆固醇,16~18 min,采集胆甾烷-3β,5α,6β-三醇,18~20 min,采集25-羟基胆固醇,20~21 min,采集7-酮基胆固醇,根据SIM模式得到的丰度离子,分别选择m/z为457、457、384、403、271、367离子作为相对应的定量离子,具体采集参数见表1。
表1 六种COPs的质谱分析参数
Table 1 Mass spectrometric parameters of the six COPs
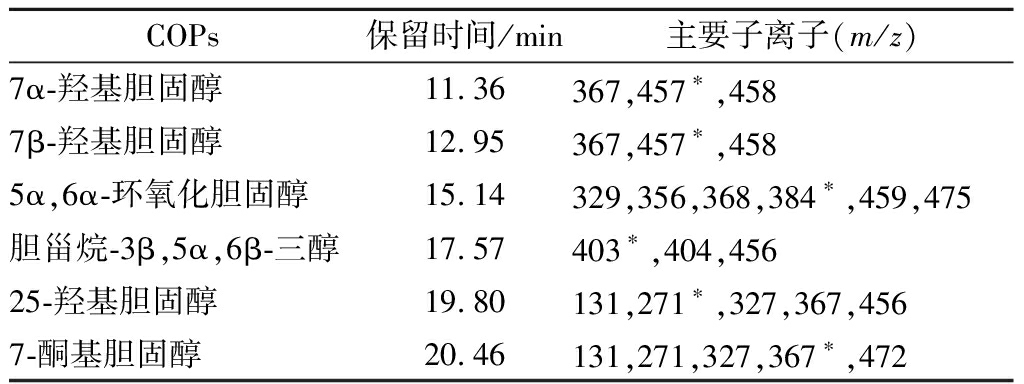
COPs保留时间/min主要子离子(m/z)7α-羟基胆固醇11.36367,457∗,4587β-羟基胆固醇12.95367,457∗,4585α,6α-环氧化胆固醇15.14329,356,368,384∗,459,475胆甾烷-3β,5α,6β-三醇17.57403∗,404,45625-羟基胆固醇19.80131,271∗,327,367,456 7-酮基胆固醇20.46131,271,327,367∗,472
注:*定量离子
2.2 前处理条件的优化
2.2.1 提取方法的选择
索氏抽提法作为最经典的粗脂肪提取方法,操作简便,稳定有效,但由于7-酮基胆固醇等部分胆固醇氧化物的不稳定性,在高温条件下发生分解或转化,会导致测定结果出现偏差。钱烨等[15]研究报道,溶剂萃取法能克服样品基质的干扰,有效地提取出不同极性的脂质。皂化法也通常作为提取胆固醇氧化物的方法并能有效地除去样品中的甘油酯类物质[19]。为此本实验对比了V(甲醇)∶V(氯仿)=1∶2溶剂萃取法和皂化法对胆固醇氧化物的提取效果。图2结果表明,采用V(甲醇)∶V(氯仿)=1∶2试剂进行萃取时,回收率为79.36%~86.35%,明显高于皂化法,这是由于皂化法的外部碱性条件,将使部分COPs发生分解或转化,导致其回收率降低。因此选用V(甲醇)∶V(氯仿)=1∶2溶剂萃取法对样品中的脂质进行提取。
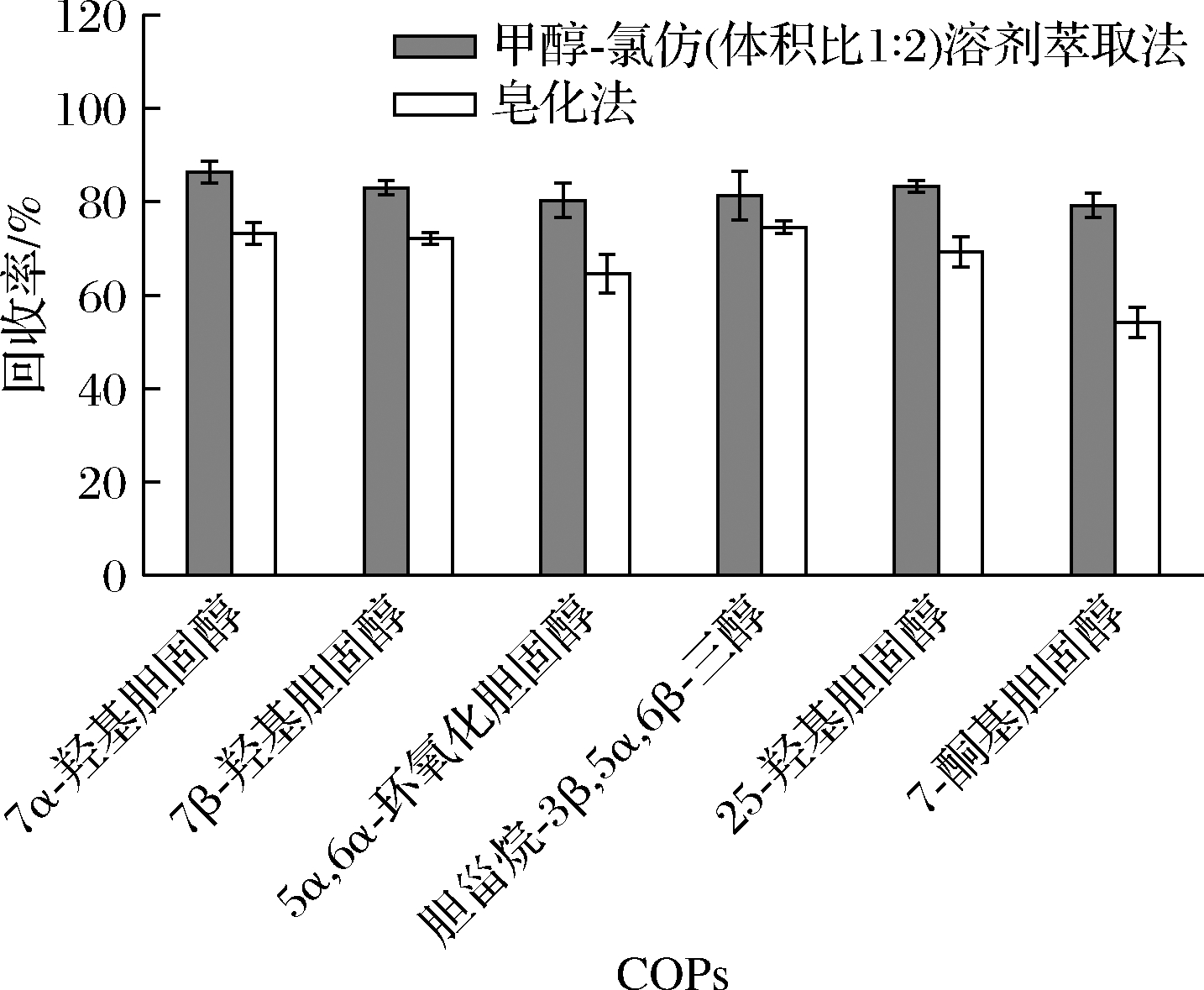
图2 不同提取方法对6种COPs回收率的影响(n=3)
Fig.2 Effect of different extraction methods on the recovery of six COPs (n=3)
2.2.2 固相萃取柱的选择
蟹肉中含有大量的脂溶性物质,若不能有效去除,会影响到COPs的含量分析,因此需对样品进行净化与富集,通过选择性吸附与脱除[20],从脂溶性混合物中提取COPs。本实验考察了Poly-Sery HLB、Oasia HLB和Sep-Pak Vac C18三种固相萃取柱对COPs回收率的影响。由图3可知,6种COPs在Oasia HLB和Sep-Pak Vac C18固相萃取柱的回收率偏低。采用Poly-Sery HLB固相萃取柱,6种COPs的回收率均高于另外2种固相萃取柱,平均回收率为85.58%。故Poly-Sery HLB固相萃取柱能有效满足样品中COPs的净化和富集要求。
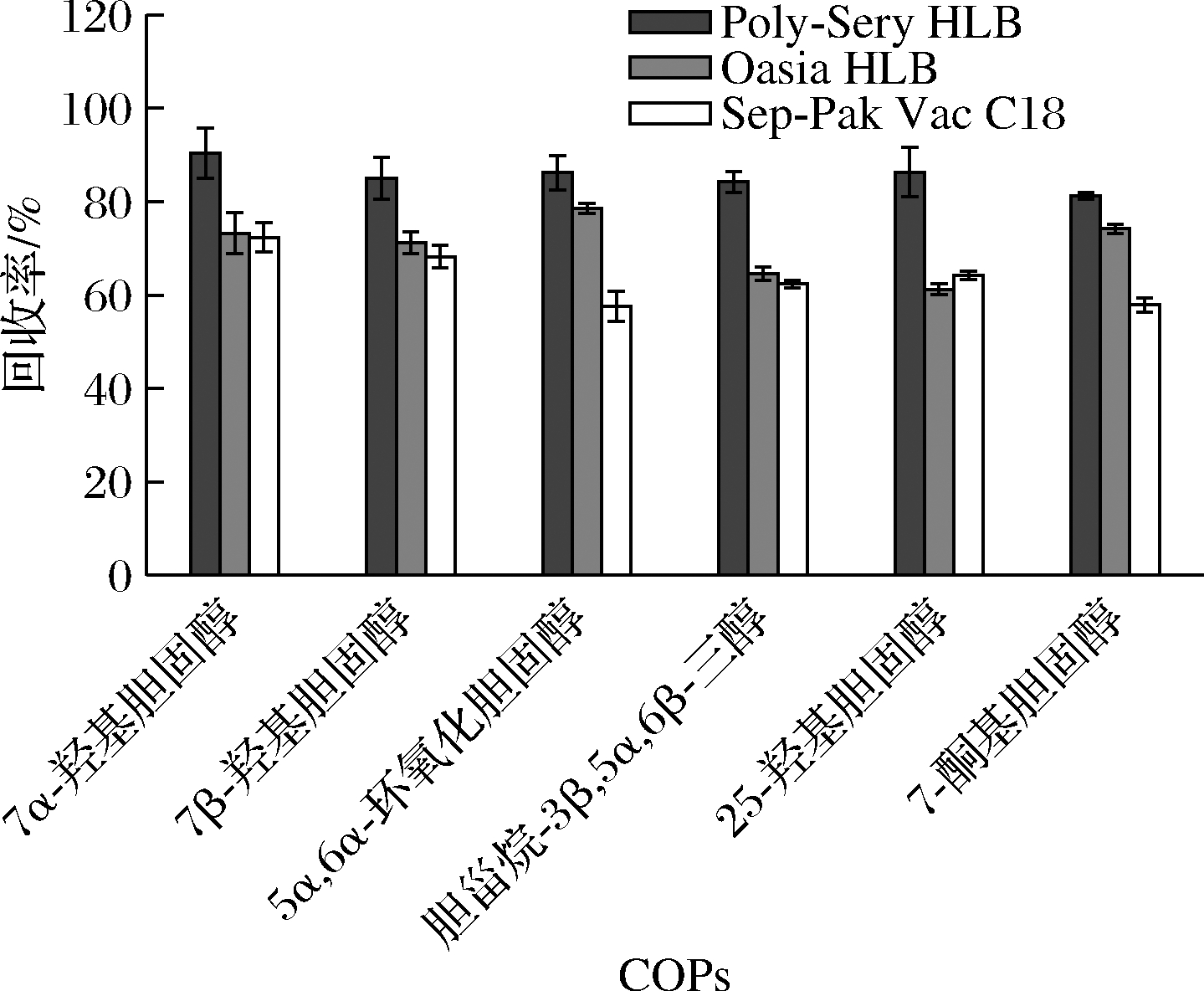
图3 不同固相萃取柱对6种COPs回收率的影响(n=3)
Fig.3 Effect of different solid phase extraction columns on the recovery of six COPs (n=3)
2.2.3 净化试剂的选择
固相萃取过程分为2个步骤。首先通过净化试剂将固相萃取柱中的杂质淋洗出来,使目标物得以净化。本实验考察了正己烷-乙醚、正己烷-乙酸乙酯和正己烷3种净化试剂对回收率的影响。由图4可知,纯正己烷的淋洗效果并不好,回收率较低。2种混合溶液相比较而言,正己烷-乙醚淋洗的效果更好,6种COPs回收率明显较高。故选择正己烷-乙醚混合溶液作为净化试剂。并参考钱烨[21]的净化方法,通过反复实验,最终确定采用10 mL V(正己烷)∶V(乙醚)=9∶1和20 mL V(正己烷)∶V(乙醚)=8∶2进行梯度淋洗。
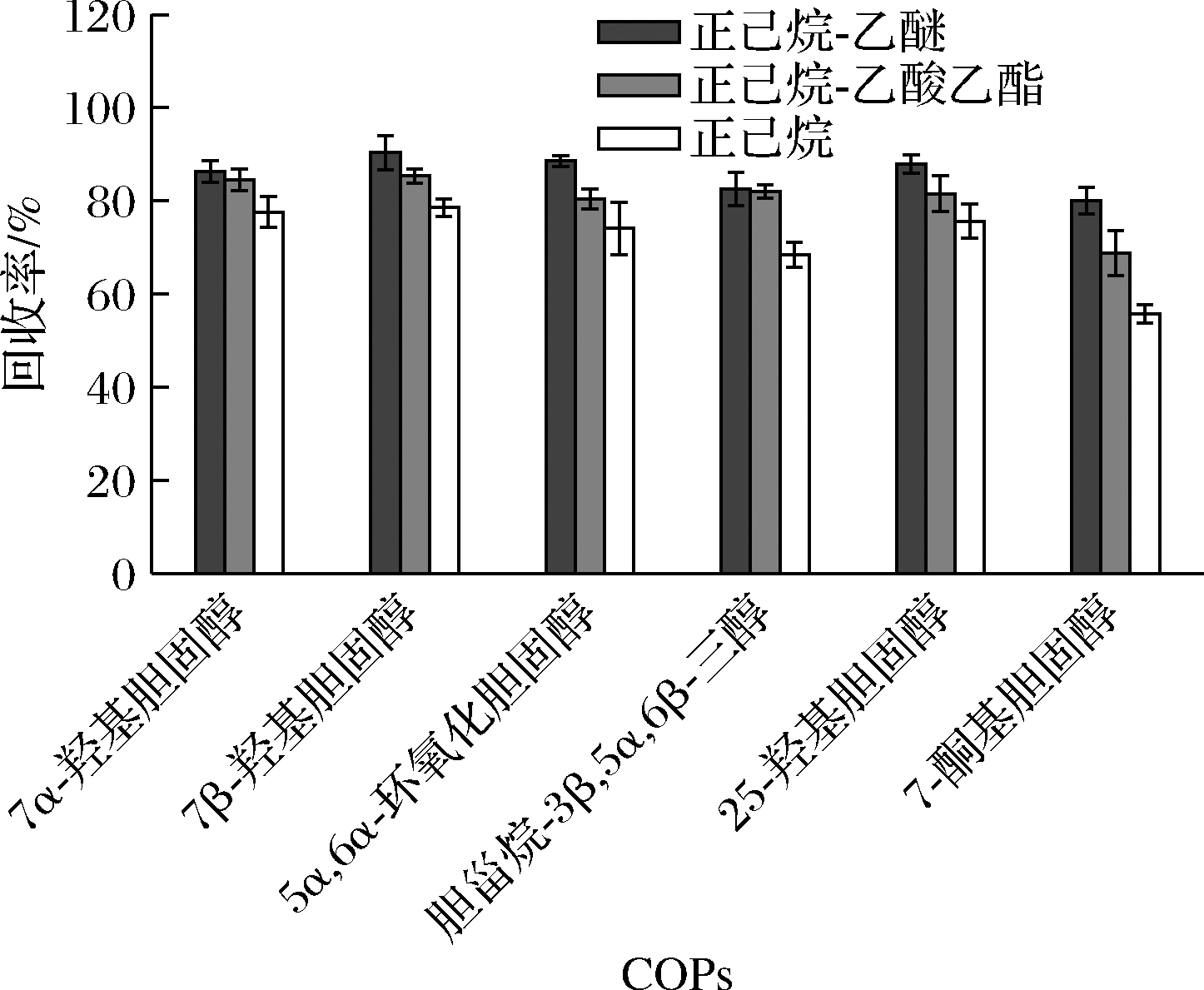
图4 不同净化试剂对6种COPs回收率的影响(n=3)
Fig.4 Effect of different purification reagents on the recovery of six COPs (n=3)
2.2.4 洗脱剂的选择
在固相萃取最后的洗脱步骤中,洗脱剂的选择会直接影响到样品洗脱的效果。本实验比较乙酸乙酯、乙腈和丙酮3种洗脱剂的洗脱效果。由图5可知,乙酸乙酯回收率最低,洗脱效果最差。丙酮和乙腈洗脱效果相近,考虑到乙腈毒性更强,故选择丙酮作为洗脱剂对样品中的COPs进行提取。
在此基础上进一步考察了不同体积的丙酮对6种COPs回收率的影响,计算6种COPs的平均回收率,结果如图6所示,当丙酮体积为2 mL和4 mL时,6种COPs的平均回收率均低于80%,丙酮体积为6 mL时,6种COPs的平均回收率为87.03%,当丙酮体积大于6 mL时,对回收率影响不大,而更多的洗脱剂体积意味着试剂的消耗量增大和氮吹时间的增长。因此最终采用6 mL体积的丙酮对目标物进行洗脱。
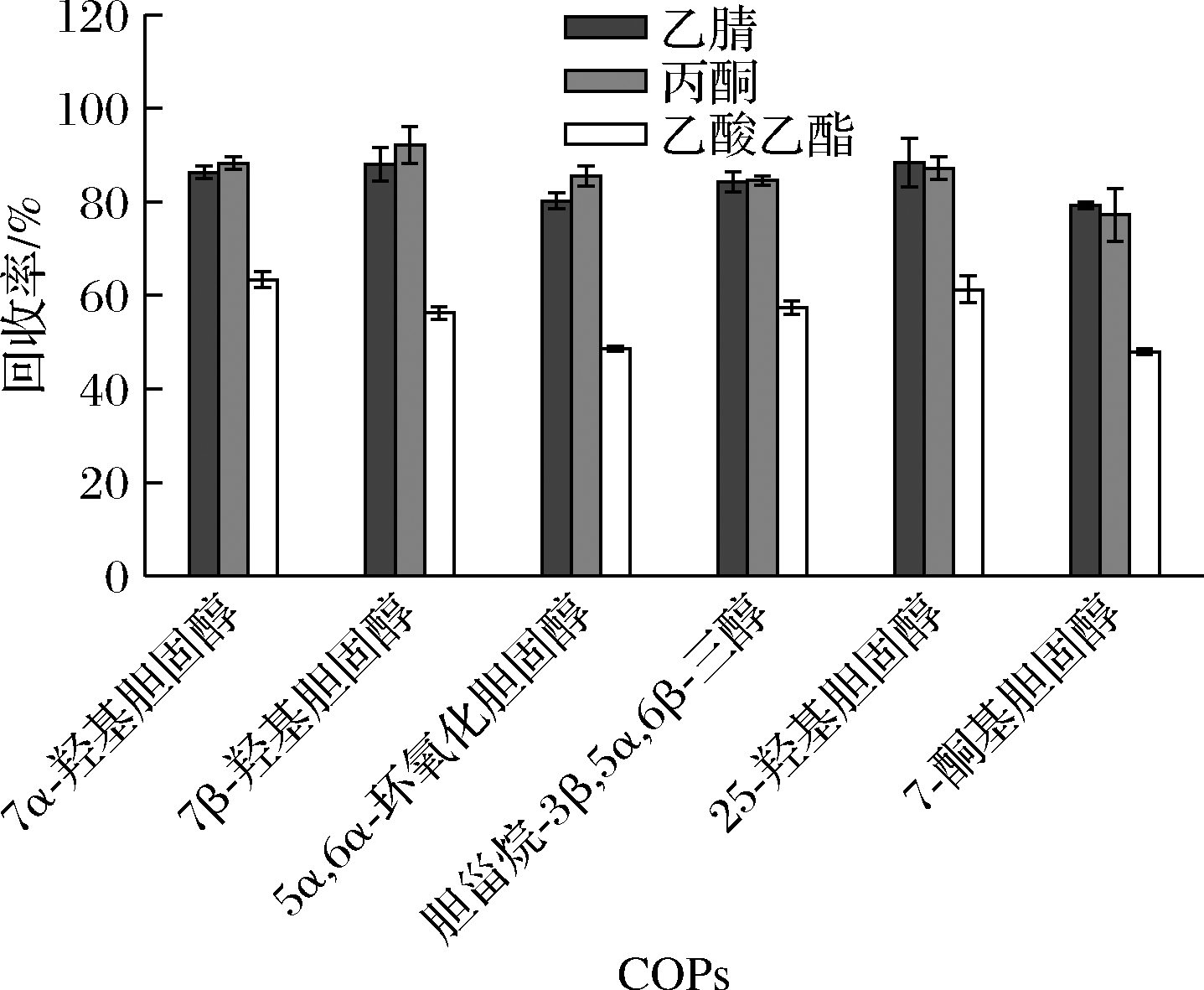
图5 不同洗脱剂对6种COPs回收率的影响(n=3)
Fig.5 Effect of different elution reagents on the recovery of six COPs (n=3)

图6 不同洗脱体积对6种COPs回收率的影响(n=3)
Fig.6 Effect of different elution volumes on the recovery of six COPs (n=3)
2.3 方法学验证结果
2.3.1 方法的线性和检出限
由表2可知,这6种COPs在0.2~10.0 μg/mL之间有较好的线性关系,回归系数均大于0.999 0,检出限为0.08~3.60 ng/g。
2.3.2 精密度与回收试验
由表3可知,6种COPs的加标回收率为77.64%~93.54%,相对标准偏差为2.34%~8.25%,表明该方法能够满足蟹肉中COPs含量分析的要求。
表2 六种COPs的线性范围、线性方程、相关系数和检出限
Table 2 Linear ranges, linear equations, correlation coefficients and detection limits for the six COPs

COPs线性范围/(μg·mL-1)线性方程相关系数检出限/(ng·g-1)7α-羟基胆固醇0.2~10.0Y=3.64×104X+1.30×1040.999 60.167β-羟基胆固醇0.2~10.0Y=2.21×104X+6.79×1040.999 80.085α,6α-环氧化胆固醇0.2~10.0Y=7.38×103X+1.60×1030.999 40.32胆甾烷-3β,5α,6β-三醇0.2~10.0Y=4.50×104X+2.62×1040.999 01.5625-羟基胆固醇0.2~10.0Y=1.19×104X+3.20×1040.999 10.827-酮基胆固醇0.2~10.0Y=1.36×105X-5.70×1040.999 43.60
表3 空白蟹肉中6种COPs加标回收率和精密度(n=3)
Table 3 Spiked recoveries and precision of the six COPs in blank crab meat (n=3)
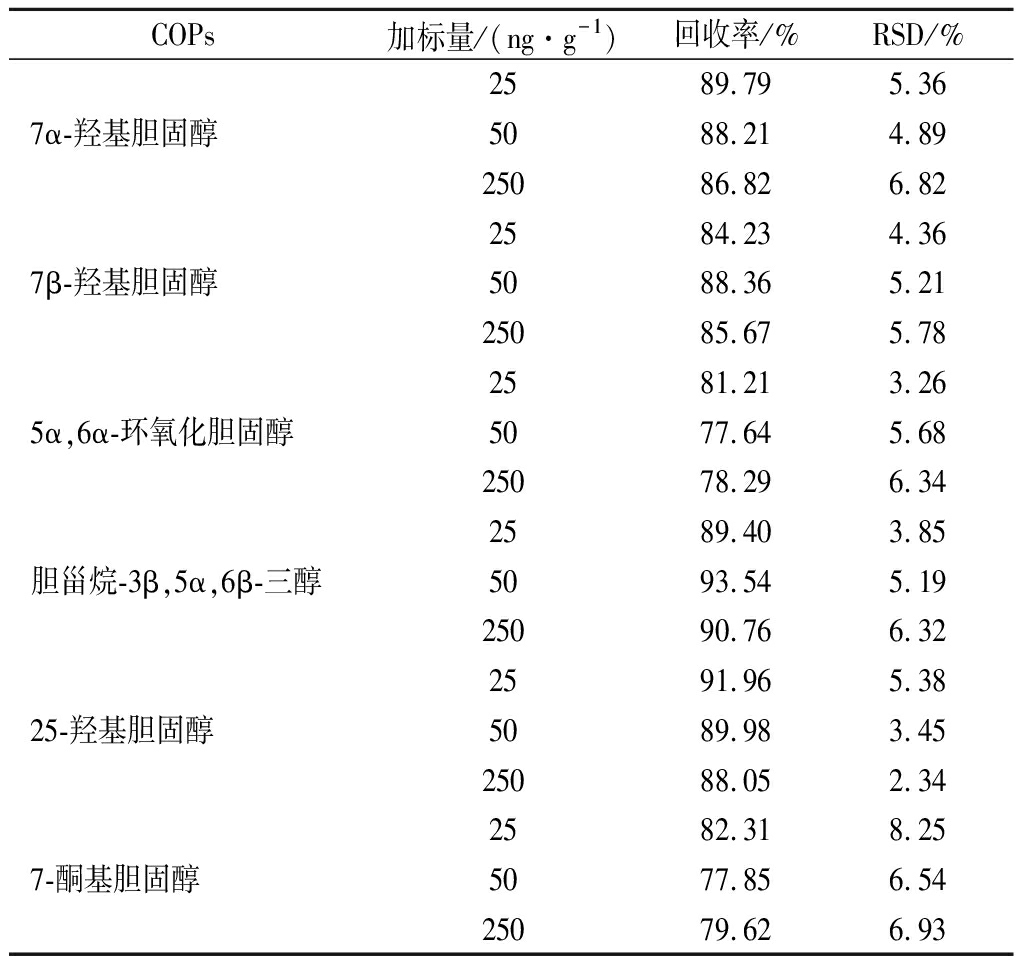
COPs加标量/(ng·g-1)回收率/%RSD/%2589.795.367α-羟基胆固醇5088.214.8925086.826.822584.234.367β-羟基胆固醇5088.365.2125085.675.782581.213.265α,6α-环氧化胆固醇5077.645.6825078.296.342589.403.85胆甾烷-3β,5α,6β-三醇5093.545.1925090.766.322591.965.3825-羟基胆固醇5089.983.4525088.052.342582.318.257-酮基胆固醇5077.856.5425079.626.93
2.4 基质效应
在采用气相色谱-串联质谱法进行检测的过程中,由于不能达到完全的除杂,因此检测分析的结果一般会受到样品中被分析物以外组分的影响,导致分析结果出现偏差,故常采用基质效应(matrix effect,ME)中相对响应值法对方法的灵敏度与选择性进行评价。
计算得出6种COPs的基质效应见图7,6种COPs的ME绝对值均低于8%。表明经过前处理条件的优化,基质效应不明显,故可直接采用标准溶液的线性方程进行定量。
2.5 实际样品测定
按本实验建立的方法对前后3批采集新鲜的中华绒螯蟹蟹肉进行测定,均未检出COPs。由表4可知,对不同加热时间的中华绒螯蟹中COPs的含量进行检测时发现,COPs的含量随着时间的增加而升高,在20 min之后,几种COPs的含量均趋于稳定,说明在一定时间内的热氧化过程中,胆固醇会发生氧化,形成胆固醇氧化物,具体的氧化机制还需进一步探究。
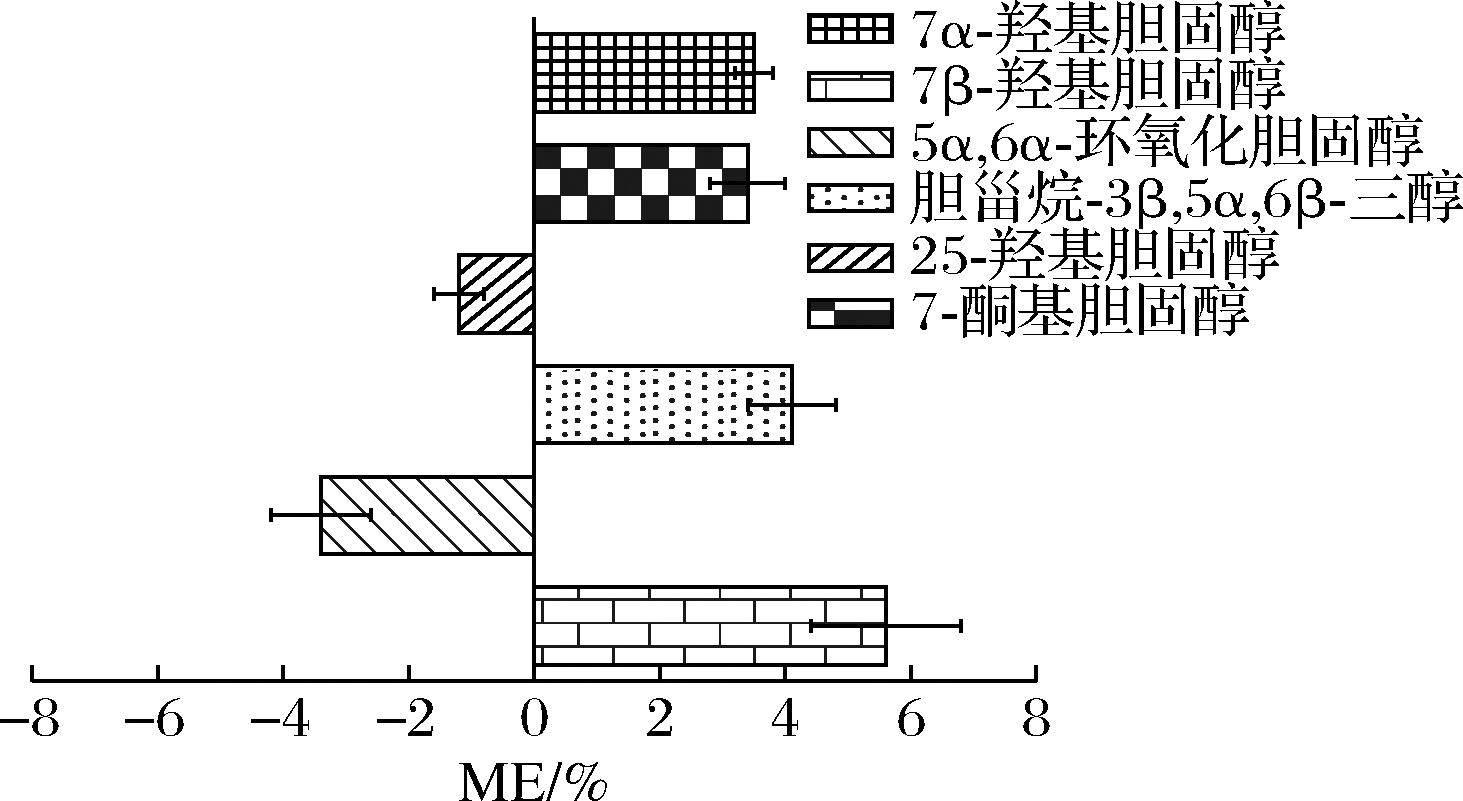
图7 蟹肉中6种COPs基质效应评价图
Fig.7 Evaluation of matrix effects of six COPs in crab meat
表4 不同加热时间下6种COPs的含量 单位:ng/g
Table 4 Contents of six COPs under different heating times

COPs时间/min10152025307α-羟基胆固醇20.5±3.6a28.3±2.2b29.6±4.4bc30.4±2.7c30.0±4.8bc7β-羟基胆固醇14.7±1.1a15.4±2.9a19.1±6.3b24.8±2.0c24.5±5.3c5α, 6α-环氧化胆固醇N.D.N.D.2.7±0.8a4.2±1.5b5.0±2.5b胆甾烷-3β, 5α, 6β-三醇28.6±5.8a38.0±6.1c35.2±3.7b37.4±7.2c34.3±3.0b25-羟基胆固醇16.3±1.3a24.8±4.0c22.7±3.9b25.8±4.6c23.0±2.3b7-酮基胆固醇48.5±9.3b45.7±4.8a55.3±11.4c58.5±9.2d55.6±13.1c
注:同一行标字母不同表示差异显著(P<0.05);N.D.表示未检出
3 结论
本研究采用固相萃取-气相色谱-三重四极杆串联质谱法对蟹肉中7α-羟基胆固醇,7β-羟基胆固醇,5α,6α-环氧化胆固醇,胆甾烷-3β,5α,6β-三醇,25-羟基胆固醇,7-酮基胆固醇等6种COPs含量进行检测分析。该方法以V(甲醇)∶V(氯仿)=1∶2为提取溶剂,Poly-Sery HLB固相萃取柱对目标物进行净化,选用正己烷-乙醚混合梯度溶液为净化试剂,6 mL体积的丙酮为洗脱剂,设置合理的色谱-质谱条件,6种COPs能在21 min内实现良好分离。该方法提取效率高,选择性好,基质效应不明显,方法学评价能满足实际样品检测的需要,为蟹肉中COPs的定量分析与控制提供了技术参考。
[1] 谢辉, 尹明雨, 张玉非, 等.不同产地雌性中华绒螯蟹感官品质与滋味品质的差异性[J].食品与发酵工业, 2021, 47(6):114-120;126.
XIE H, YIN M Y, ZHANG Y F, et al.The effect of different culturing region on the sensory and taste quality of Chinese mitten crab(Eriocheir sinensis)[J].Food and Fermentation Industries, 2021, 47(6):114-120;126.
[2] BOYER J L, SOROKA C J.Bile formation and secretion:An update[J].Journal of Hepatology, 2021, 75(1):190-201.
[3] FARIDI K F, LUPTON J R, MARTIN S S, et al.Vitamin D deficiency and non-lipid biomarkers of cardiovascular risk[J].Archives of Medical Science:AMS, 2017, 13(4):732-737.
[4] GUO X Y, ZHANG Y W, QIAN Y, et al.Effects of cooking cycle times of marinating juice and reheating on the formation of cholesterol oxidation products and heterocyclic amines in marinated pig hock[J].Foods(Basel,Switzerland), 2020, 9(8):1 104.
[5] DANTAS N M, SAMPAIO G R, FERRARI C K B, et al.Cholesterol oxidation in fish and fish products[J].Journal of Food Science, 2015, 80(12):R2 627-R2 639.
[6] VICENTE S J V, SAMPAIO G R, FERREARI C K B, et al.Oxidation of cholesterol in foods and its importance for human health[J].Food Reviews International, 2012, 28(1):47-70.
[7] 徐贵华, 刘东红, 赵瑞香, 等.抗氧化剂对胆固醇高温氧化抑制作用研究[J].中国粮油学报, 2016, 31(4):100-103.
XU G H, LIU D H, ZHAO R X, et al.Inhibition effects of antioxidants on the thermo-oxidation of cholesterol[J].Journal of the Chinese Cereals and Oils Association, 2016, 31(4):100-103.
[8] 李向梅, 周建科, 付艳芳.高效液相色谱法测定卤制鸡肝中两种胆固醇氧化物[J].中国食品卫生杂志, 2014, 26(2):156-159.
LI X M, ZHOU J K, FU Y F.Determination of two cholesterol oxidation products in marinated chicken liver by high performance liquid chromatography[J].Chiese Journal of Food Hygiene, 2014, 26(2):156-159.
[9] 卓成飞, 胡盛本, 邓泽元, 等.液态乳中胆固醇、7-脱氢胆固醇及25-羟基胆固醇的同步测定方法[J].中国食品学报, 2019, 19(4):226-234.
ZHUO C F, HU S B, DENG Z Y, et al.Synchronous determination method of cholesterol, 7-dehydrocholesterol and 25-hydroxycholesterol in liquid milk[J].Journal of Chinese Institute Food Science and Technology, 2019, 19(4):226-234.
[10] MIN J S, KHAN M I, LEE S O, et al.Impact of cooking, storage, and reheating conditions on the formation of cholesterol oxidation products in pork loin[J].Korean Journal for Food Science of Animal Resources, 2016, 36(1):23-28.
[11] 丁磊, 周典兵, 宋伟, 等.液相色谱-大气压化学电离串联质谱法测定油脂中9种胆固醇氧化物[J].化学分析计量, 2020, 29(1):40-44.
DING L, ZHOU D B, SONG W, et al.Determination of nine kinds of cholesterol oxides in fats and oils by liquid chromatography-atmospheric pressure chemical ionization tandem mass spectrometry[J].Chemical Analysis and Meterage, 2020, 29(1):40-44.
[12] 柯星, 黄百芬, 吕美玲, 等.酶解-UPLC-MS/MS法同时测定咸鸭蛋黄中的11种胆固醇氧化物[J].分析化学, 2015, 43(12):1 920-1 926.
KE X, HUANG B F, LYU M L, et al.Simultaneous determination of 11 cholesterol oxidation products in salted duck egg yolk by enzymolysis-LC-MS/MS method[J].Analytical Chemistry, 2015, 43(12):1 920-1 926.
[13] HASHARI S Z, RAHIM A A, MENG G Y, et al.Quantification of cooking method effect on COP content in meat types using triple quadrupole GC-MS/MS[J].Molecules(Basel,Switerland), 2020, 25(21):4978.
[14] CHIU C W, KAO T H, CHEN B H.Improved analytical method for determination of cholesterol oxidation products in meat and animal fat by QuEChERS coupled with gas chromatography-mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2018, 66(13):3 561-3 571.
[15] 钱烨, 张雅玮, 王震, 等.气相色谱-质谱法测定酱猪蹄和酱猪肘中5种胆固醇氧化物[J].色谱, 2019, 37(5):539-546.
QIAN Y, ZHANG Y W, WANG Z, et al.Determination of five cholesterol oxidation products in marnated pig feet and hocks by gas chromatography-mass spectrometry[J].Chinese Journal of Chromatography, 2019, 37(5):539-546.
[16] 沈雅萍, 王凤玲, 关文强, 等.气质联用法测定反复冻融畜禽肉中胆固醇及其氧化物含量[J].食品工业科技, 2019, 40(9):78-84;90.
SHEN Y P, WANG F L, GUAN W Q, et al.Effects of repeated freezing and thawing of livestock and poultry on cholesterol and its oxide contents[J]. Science and Technology of Food Industry, 2019, 40(9):78-84;90.
[17] 方益, 赵巧灵, 严忠雍, 等.气相色谱-质谱联用法测定水产加工品中胆固醇氧化物的研究[J].食品科技, 2015, 40(3):309-314.
FANG Y, ZHAO Q L, YAN Z Y, et al.Determination of cholesterol oxidation products in aquatic products by gas chromatography-mass spectrometry[J].Food Science and Technology, 2015, 40(3):309-314.
[18] ![]() .Cholesterol oxides content in selected animal products determined by GC-MS[J].European Journal of Lipid Science & Technology, 2010, 112(10):1 130-1 137.
.Cholesterol oxides content in selected animal products determined by GC-MS[J].European Journal of Lipid Science & Technology, 2010, 112(10):1 130-1 137.
[19] SALDANHA T, SAWAYA A C H F, EBERLIN M N, et al.HPLC separation and determination of 12 cholesterol oxidation products in fish:comparative study of RI, UV, and APCI-MS detectors[J].Journal of Agricultural & Food Chemistry, 2006, 54(12):4 107-4 113.
[20] 薛霞, 赵慧男, 魏莉莉, 等.超高效液相色谱-串联质谱法测定蜂蜜中五种水溶性维生素的含量[J].食品与发酵工业, 2021, 47(12):250-256.
XUE X, ZHAO H N, WEI L L, et al.Determination of five water-soluble vitamins in honey by ultra performance liquid chromatography-tandem mass spectrometry[J].Food and Fermentation Industries, 2021, 47(12):250-256.
[21] 钱烨. 酱猪肘中胆固醇氧化物及杂环胺的形成与消减[D].南京:南京农业大学, 2019.
QIAN Y.The formation and reduction of cholesterol oxidation products and heterocyclic amines in marinated pig hock[D].Nanjing:Nanjing Agricultural University, 2019.