α-葡萄糖苷酶(EC 3.2.1.20)是一种外切碳水化合物酶,能催化α-D-葡萄糖基从不同大小的底物,包括麦芽低聚糖、α-糖苷和α-葡聚糖等非还原端水解糖苷键,释放α-D-葡萄糖[1],除水解作用外,α-葡萄糖苷酶还可通过转糖基化作用[2-3],将葡萄糖基从底物转移至受体,形成相应的低聚糖、糖脂或糖肽等,在生产功能性低聚异麦芽糖(isomaltooligosaccharides,IMOs)和有生物功能的糖-共轭复合物方面显示出巨大的应用潜力。
α-葡萄糖苷酶可由包括细菌、真菌、动物和植物在内的各种生物体产生[4],这种广泛的分布导致其底物特异性也因酶的来源而不同。根据底物特异性,α-葡萄糖苷酶传统上分为3组,第1组可水解多种异质底物(主要来自细菌),如蔗糖、芳香基-α-葡萄糖苷,而且比水解同质底物更有效,第2组在水解同质底物上更有效(主要来自真菌),如麦芽糖、异麦芽糖等,第3组与2组活性相似,但对淀粉等长链底物也有高水解活性(大多来自植物)[5-6]。α-葡萄糖苷酶的主要微生物来源有曲霉、乳酸杆菌和芽孢杆菌,而黑曲霉α-葡萄糖苷酶具有较高的转糖基化活性,且耐酸性强,容易避免细菌污染,因此被成功地应用于生产IMOs[2],然而,在工业化应用过程中仍存在着热稳定性差、底物特异性差、底物谱窄等问题,其应用受到了极大的限制,因此学者通过克隆不同生物来源的酶,并对其进行分子改造和异源表达等,以克服规模化生产中鲁棒性差和产量不高的问题。
α-葡萄糖苷酶作为目前工业化生产IMOs的关键酶制剂,其高效表达直接影响IMOs的生产成本,此外,α-葡萄糖苷酶还能以麦芽糖等作为糖基供体,催化合成糖-共轭复合物等生物活性物质,在化妆品、食品、医药行业展现出巨大的应用前景。因此,本文介绍了不同来源的α-葡萄糖苷酶的特性和异源表达情况,综述了α-葡萄糖苷酶用于高效生产IMOs的工业合成途径和糖苷类生物活性物质合成等方面的研究进展,并展望了α-葡萄糖苷酶分子改造的发展方向,为将来获得符合特殊需求的糖苷合成酶突变体提供参考。
1 α-葡萄糖苷酶的异源表达
到目前为止,大量具有转糖基化活性的α-葡萄糖苷酶已经被鉴定和表征,大多数商业上可用的α-葡萄糖苷酶,均通过黑曲霉(Aspergillus niger)发酵生产,如日本天野(Amano Enzymes Inc.)酶制剂公司生产的α-葡萄糖苷酶,占据了国内IMOs生产用酶的大部分市场,由于α-葡萄糖苷酶本体表达水平有限且需要纯化回收,成本仍居高不下,所以学者对不同来源的α-葡萄糖苷酶进行了异源表达和酶学性质表征,如表1所示。
1.1 在大肠杆菌中的表达
大肠杆菌由于表达体系成熟完善、繁殖迅速、培养简单、成本低廉等,是目前采用最多的原核表达体系。学者们先前已将嗜热脂肪芽孢杆菌、爪洼毛霉、硫矿硫化叶菌、青春双歧杆菌、酿酒酵母、阪崎肠杆菌、黑曲霉、白色念珠菌、巴西曲霉、肠膜明串珠菌等来源的α-葡萄糖苷酶在大肠杆菌(Escherichia coli)中进行了重组表达[7],结果表明其底物特异性、分子质量等因其来源不同而存在差异,学者们研究了该酶对硝基苯-α-D-葡萄糖苷(4-nitrophenyl α-D-glucopyranoside ,pNPG)和麦芽糖等底物的水解活性,而少数也对该酶的转糖基化活性进行了检测,因黑曲霉来源的α-葡萄糖苷酶活性高,因此已应用于制备IMOs等食品领域。CHAUDET等[8]报道了来自多形拟杆菌(Bacteroides thetaiotaomicron)的两种G31家族的糖苷水解酶(BT_0339 和BT_3299),两种α-葡萄糖苷酶通过pET-29a表达载体在E.coli中得到高水平的可溶性表达,研究表明这两种酶在麦芽糖、异麦芽糖和麦芽低聚糖底物上均表现出水解活性,但对蔗糖和乳糖的水解活性较低。
此外,α-葡萄糖苷酶的工业应用需要在高温下的稳定性以及对常见的变性剂的稳定性,因此目前已从不同极端微生物中发现并表征了许多耐热的α-葡萄糖苷酶,以获得稳定性好的酶源。ZHANG等[9]将来自地芽孢杆菌属(Geobacillus sp.) 的α-葡萄糖苷酶在E.coli中重组表达,酶水解的最适温度为65 ℃, pH 7.0时水解活性最大,水解活性达107.9 U/mL,最终用300 g/L的麦芽糖浆合成IMOs的转化率达到37%。LI等[10]从深海假单胞菌(Pseudoalteromonas sp.)中克隆得到一种新型α-葡萄糖苷酶(Ⅱ型酶),在E.coli中表达,结果表明在pH 8.5和30 ℃时表现出最佳活性(19.4 U/mg,麦芽糖)。CUEBAS-IRIZARRY等[11]报道了第一个来自极端嗜盐菌(Halophiles walsbyi)的α-葡萄糖苷酶,通过表达载体pET28b(+)在E.coli中表达,表明在40 ℃和pH 6.0下检测到水解α-pNPG的最佳活性,且在3 mol/L的NaCl或3~4 mol/L的KCl条件下,酶水解活性最高。ZHOU等[12]用E.coli表达来源于嗜热栖热菌(Thermus thermophilus TC11)的α-葡萄糖苷酶,该重组酶对pNPG、蔗糖、海藻糖和潘糖等都具有水解活性,并以蔗糖和海藻糖为底物时,显示出糖基化活性,该酶在70 ℃下能稳定7 h以上,耐热性好。PARK等[13]将超嗜热泉古菌(Sulfolobus tokodaii)来源的α-葡萄糖苷酶在E.coli中表达,该重组酶在95 ℃和pH 4.0时观察到最大活性,显示出稳定的耐酸和耐热性能。综上,目前已从极端嗜热微生物中克隆出耐高温的酶源,但其底物专一性仍需要更深入了解该酶的结构与功能,才能有助于指导酶分子进行定向改造,因此,从极端环境中获取稳定性好的酶源,要求有强的转糖基化活性和底物专一性,同时应结合同源建模和分子对接的方法对其进行改造,最终以异源表达方式进行高密度发酵提高产量,突破α-葡萄糖苷酶在工业应用上的限制。
表1 α-葡萄糖苷酶的重组表达及特征(近10年)
Table 1 Recombinant expression and characteristic of α-glucosidase (nearly ten years)
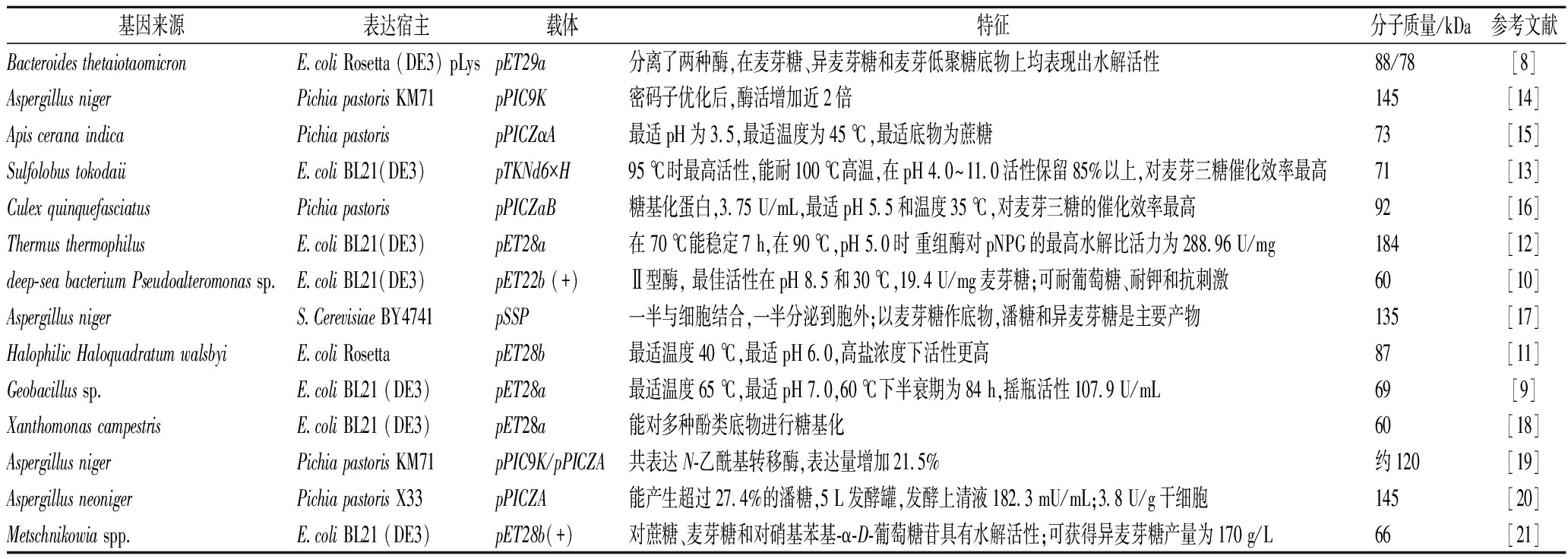
基因来源表达宿主载体特征分子质量/kDa参考文献Bacteroides thetaiotaomicronE.coli Rosetta (DE3) pLyspET29a分离了两种酶,在麦芽糖、异麦芽糖和麦芽低聚糖底物上均表现出水解活性88/78[8]Aspergillus nigerPichia pastoris KM71pPIC9K密码子优化后,酶活增加近2倍145[14]Apis cerana indicaPichia pastorispPICZαA最适pH为3.5,最适温度为45 ℃,最适底物为蔗糖73[15]Sulfolobus tokodaiiE.coli BL21(DE3)pTKNd6×H95 ℃时最高活性,能耐100 ℃高温,在pH 4.0~11.0活性保留85%以上,对麦芽三糖催化效率最高71[13]Culex quinquefasciatusPichia pastorispPICZaB糖基化蛋白,3.75 U/mL,最适pH 5.5和温度35 ℃,对麦芽三糖的催化效率最高92[16]Thermus thermophilusE.coli BL21(DE3)pET28a在 70 ℃能稳定7 h,在90 ℃,pH 5.0时 重组酶对pNPG的最高水解比活力为288.96 U/mg 184[12]deep-sea bacterium Pseudoalteromonas sp.E.coli BL21(DE3)pET22b (+)Ⅱ型酶, 最佳活性在pH 8.5和30 ℃,19.4 U/mg麦芽糖;可耐葡萄糖、耐钾和抗刺激60[10]Aspergillus nigerS.Cerevisiae BY4741pSSP一半与细胞结合,一半分泌到胞外;以麦芽糖作底物,潘糖和异麦芽糖是主要产物135[17]Halophilic Haloquadratum walsbyiE.coli RosettapET28b最适温度40 ℃,最适pH 6.0,高盐浓度下活性更高87[11]Geobacillus sp.E.coli BL21 (DE3)pET28a最适温度65 ℃,最适pH 7.0,60 ℃下半衰期为84 h,摇瓶活性107.9 U/mL69[9]Xanthomonas campestrisE.coli BL21 (DE3)pET28a能对多种酚类底物进行糖基化60[18]Aspergillus nigerPichia pastoris KM71pPIC9K/pPICZA共表达N-乙酰基转移酶,表达量增加21.5%约120[19]Aspergillus neonigerPichia pastoris X33pPICZA能产生超过27.4%的潘糖,5 L发酵罐,发酵上清液182.3 mU/mL;3.8 U/g干细胞145[20]Metschnikowia spp.E.coli BL21 (DE3)pET28b(+)对蔗糖、麦芽糖和对硝基苯基-α-D-葡萄糖苷具有水解活性;可获得异麦芽糖产量为170 g/L66[21]
1.2 在酵母中的表达
早前有学者以酿酒酵母(Saccharomyces cerevisiae)为宿主,对α-葡萄糖苷酶进行了克隆表达。DHANAWANSA等[22]将S.cerevisiae中克隆的α-葡萄糖苷酶I基因(CWH41)过表达,其可溶性表达量增加了28倍,胞内酶的水解活性达306 U/g湿菌体,纯化后该酶的比活力达8 550 U/mg蛋白。TANAKA等[23]将来源于葱状被孢霉(Mortierella alliacea)的α-葡萄糖苷酶重组表达于S.cerevisiae,研究表明胞内和胞外的α-葡萄糖苷酶对麦芽糖和淀粉的水解能力均显著增加。HOSTINOV 等[24]从扣囊复膜酵母(Saccharomyces fibuligera)中克隆α-葡萄糖苷酶基因,在S.cerevisiae中表达,该酶为膜结合蛋白,分子质量为110 kDa,对麦芽糖和低聚麦芽糖均有活性,但不水解可溶性淀粉。CASA-VILLEGAS等[17]通过构建pSSP-aglA表达载体,在S.cerevisiae中表达来自A.niger的α-葡萄糖苷酶基因,该重组酶一半与细胞结合,一半分泌到胞外,当麦芽糖为底物时,主要的糖基化产物是潘糖和异麦芽糖。通过以上研究表明,酿酒酵母作为重组蛋白的表达宿主,对分子质量超过100 kDa的蛋白分泌水平不高,不便于分离纯化。
等[24]从扣囊复膜酵母(Saccharomyces fibuligera)中克隆α-葡萄糖苷酶基因,在S.cerevisiae中表达,该酶为膜结合蛋白,分子质量为110 kDa,对麦芽糖和低聚麦芽糖均有活性,但不水解可溶性淀粉。CASA-VILLEGAS等[17]通过构建pSSP-aglA表达载体,在S.cerevisiae中表达来自A.niger的α-葡萄糖苷酶基因,该重组酶一半与细胞结合,一半分泌到胞外,当麦芽糖为底物时,主要的糖基化产物是潘糖和异麦芽糖。通过以上研究表明,酿酒酵母作为重组蛋白的表达宿主,对分子质量超过100 kDa的蛋白分泌水平不高,不便于分离纯化。
由于酿酒酵母缺乏强有力的启动子,且重组蛋白分泌水平不高,而巴斯德毕赤酵母(Pichia pastoris)具备强启动子、翻译后修饰能力、分泌效率高、培养成本低、发酵工艺成熟和易放大等优点,是目前最为成功的真核蛋白表达系统之一。WU等[25]将自米曲霉(Aspergillus oryzae ZL-1)来源的α-葡萄糖苷酶转化P.pastoris进行表达,结果表明该酶的转糖基化活性在pH 5.2和37 ℃下最高,纯化后的酶比活力为83.5 U/mg,以麦芽糖为底物,主要产物为潘糖。SUTHANGKORNKUL等 [16]从致倦库蚊(Culex quinquefasciatus)的唾液中克隆α-葡萄糖苷酶基因,并在P.pastoris中重组表达,结果表明该酶可水解异质底物(Ⅱ型酶),最适pH和温度分别为5.5和35 ℃,且对麦芽三糖的催化效率高于蔗糖、麦芽糖、麦芽糖和pNPG。MUSLIN等 [26]在P.pastoris中表达了来自大麦(Barley)的α-葡萄糖苷酶,证实了该酶可在体外水解完整的淀粉颗粒,属Ⅲ型酶,分泌表达量为2 g/L,且水解麦芽糖的最佳pH值在3.5~4.5。此外,学者们还将黑曲霉[27]、印度蜜蜂[15]等来源的α-葡萄糖苷酶P.pastoris中进行了表达,研究证明真核生物来源的α-葡萄糖苷酶大都为糖基化蛋白,而毕赤酵母可对该酶进行糖基化并将其分泌到胞外,因此,毕赤酵母作为真核生物来源的α-葡萄糖苷酶的表达宿主,在保证其生物活性的同时还利于分离纯化,而且可采用优化密码子和共表达分子伴侣等策略提高表达水平[14, 19],是工业化制备α-葡萄糖苷酶的理想宿主。
1.3 在其他宿主中的表达
α-葡萄糖苷酶在构巢曲霉(Aspergillus nidulans)、乳酸菌、枯草芽孢杆菌和黑曲霉中也进行了过表达,如NAKAMURA等[28]将来源于A.niger的α-葡萄糖苷酶在构巢曲霉中表达,结果表明α-葡萄糖苷酶受碳源调控,麦芽糖和淀粉均可诱导该酶的表达,而葡萄糖会抑制其表达,这与黑曲霉中α-淀粉酶和糖化酶的表达情况一致。GIULIANO等[29]以乳酸乳球菌(Lactococcus lactis)为表达体系,重组表达来自硫矿硫化叶菌(Sulfolobus solfataricus)的α-葡萄糖苷酶,优化后α-葡萄糖苷酶的表达量比野生菌株高1 000倍。HUNG等[30]从马里亚纳海沟沉积物中分离出地芽孢杆菌(Geobacillus)HTA-462,将其α-葡萄糖苷酶在枯草芽孢杆菌(Bacillus subtilis)中重组表达,低离子强度下,该酶以同源二聚体形式存在(130 kDa),在15 mmol/L 的Gly-NaOH缓冲体系中,60 ℃和pH 9.0时具有最大水解活性,麦芽糖作为糖供体时,可将麦芽糖转化为异麦芽糖。此外,张津浩等[31]通过农杆菌介导法,以pSZH10-6-1为表达载体,将来源于A.niger 的α-葡萄糖苷酶整合到黑曲霉基因组,重组酶分子质量为97 kDa,最适反应温度为40 ℃左右,最适pH值在6.0左右,胞外发酵液中的酶水解活性可达180 U/mL。综上,学者们通过在构巢曲霉、乳酸菌、枯草芽孢杆菌和黑曲霉中过表达α-葡萄糖苷酶,研究表明总体表达水平较低,且转糖基化活性不高,难以满足工业化生产的需求,近年来相关研究已不多。
因此,α-葡萄糖苷酶的异源表达体系虽研究较多,但表达水平以大肠杆菌和毕赤酵母最高,且不同来源的α-葡萄糖苷酶的最适温度、最适pH、底物偏好性等酶学性质存在较大的差异,如何将发掘的该酶的所有不同的生物学信息进行分析和整合,实现优势位点组合,是亟待解决的的问题。目前已有通过随机诱变、定点突变等方法对该酶进行分子改造的报道,虽在一定程度上提高了稳定性, 但要满足工业化的需要,仍需要利用易错PCR、DNA改组等分子定向进化策略,并借助计算机模拟分析,通过3D建模、分子对接和分子模拟等技术,将优势位点组合,产生超级突变株,获得比天然酶活力更高、稳定性更好的工业用酶。
2 α-葡萄糖苷酶的应用研究
2.1 合成低聚异麦芽糖
IMOs的工业化生产,一般是以淀粉为原料,首先经α-淀粉酶液化,进而被β-淀粉酶和普鲁兰酶等糖化酶糖化为麦芽糖浆,最后经α-葡萄糖苷酶的转苷作用催化合成IMOs。α-淀粉酶,β-淀粉酶和普鲁兰酶等研究和工业应用已成熟,但α-葡萄糖苷酶催化的转糖基化反应是制备IMOs的关键步骤,因此α-葡萄糖苷酶是工业化生产IMOs的关键酶制剂[32]。
KUMAR等[20]将曲霉变种(A.neoniger)来源的α-葡萄糖苷酶经P.pastoris重组表达后用于合成IMOs,最终产物中潘糖和异麦芽糖的比例分别达到61.29%和12.72%,而且对潘糖有较低速率的二次水解。GARCIA-GONZALEZ等[21]将梅奇酵母属(Metschnikowia spp.)来源的α-葡萄糖苷酶在E.coli中重组表达,研究表明该重组酶对蔗糖、麦芽糖和对硝基苯基-α-D-葡萄糖苷均具有水解活性,将其用于合成IMOs, 最终产量达到170 g/L,是迄今为止报道最高的产量。此外,学者通过对α-葡萄糖苷酶进行固定化或将表达α-葡萄糖苷酶的细胞进行固定化,以提高酶的稳定性和利用率。WANG等[33]将黑曲霉来源的α-葡萄糖苷酶固定于环氧树脂上,在55 ℃和pH 4.5的乙酸丁酯缓冲体系下,IMOs的产率可达50.83%,完成反应后α-葡萄糖苷酶被分配到有机相,保持了良好的可重复使用性。OJHA等[34]报道了以海藻酸钙包埋的微杆菌(Microbacterium sp.)用于固定床全细胞催化合成IMOs,在400 g/L的麦芽糖初始浓度下反应24 h,产量达到85 g/L,与游离细胞相比,IMOs的生产效率提高4.2倍[达到4.0 g/(L·h)],底物转化率可达24%。
IMOs的工业化生产工艺中存在工序多、周期长、底物转化率低、工艺参数控制困难等缺点[35],且酶法转化产品中重要功能性低聚糖的含量不高,制约着IMOs的应用,其核心技术问题之一是酶的合理组合与优化利用,IMOs的工业合成途径及策略如图1所示。CHEN等[36]将来自嗜热脂肪地芽孢杆菌(G.stearothermophilus)纯化的α-葡萄糖苷酶进行固定化,以淀粉作底物,采用壳聚糖膜固定化α-葡萄糖苷酶、α-淀粉酶、β-淀粉酶、普鲁兰酶等小规模制备IMOs,最终产物中IMOs的含量达到41.74%,该法简化了IMOs的生产工序,显示出以淀粉为原料一步法生产IMOs的潜力,但还需验证在规模化反应器中的稳定性和重复操作能力。此外,学者还利用酵母细胞表面展示α-葡萄糖苷酶技术直接用于合成IMOs,展现出良好的应用潜力。CASA-VILLEGAS等[17]将A.niger来源的α-葡萄糖苷酶与酵母的糖基磷脂酰肌醇锚定序列融合表达,展示于S.cerevisiae细胞表面用于制备IMOs,其主要产物为潘糖和异麦芽糖,且通过调节底物中麦芽糖与葡萄糖的比例可控制产物IMOs中潘糖和异麦芽糖的产量,该法提供了一种使用酵母细胞表面展示α-葡萄糖苷酶来低成本制备IMOs的方法。此外,ZHAO等[37]将A.niger来源的α-葡萄糖苷酶展示于P.pastoris细胞表面用于制备IMOs,在0.5 L的催化体系中,反应2 h后转化率约为44%。WANG等[38]利用醛基修饰磁性壳聚糖载体,将表面展示α-葡萄糖苷酶的P.pastoris细胞进行固定化,并用于催化麦芽糖,连续运行48 h后IMOs的产量达90 g/L。研究表明,α-葡萄糖苷酶展示于酵母细胞表面及细胞固定化后重复利用率高,转化率稳定,系统稳定性强。目前,IMOs规模化生产的成本主要在于酶的生产和纯化,而酵母细胞表面展示系统不需对α-葡萄糖苷酶进行纯化,可提高该酶的反应效率和操作稳定性,且能多次重复利用,是规模化制备IMOs的最具前景的高效催化系统之一,但目前的研究仍停留在小试阶段,要实现工业化生产还应进行生产模拟放大实验,以及考虑可能存在的底物抑制、产物抑制及不同的反应条件对细胞表面展示合成系统稳定性的影响。

图1 低聚异麦芽糖的工业合成途径及策略
Fig.1 Industrial synthetic approaches and strategies of isomaltooligosaccharide
2.2 催化合成糖苷类生物活性物质
某些化合物由于被糖基化后可有效改善其水溶性、生物利用度、稳定性和药效学反应等,从而使得其糖苷复合物广泛应用于食品、医药和化妆品等行业。在天然植物体内,糖苷类活性物质一般由糖基转移酶(glycosyltransferase,GT)催化合成,但GT在体外其稳定性较差,且需昂贵的糖基供体核苷酸二磷酸糖(NDP-sugars)[39],限制了其在合成糖苷上的规模化应用,而α-葡萄糖苷酶,除能对糖苷键进行水解外,还能使用多种碳水化合物(葡萄糖、麦芽糖、木糖、甘露糖、半乳糖等)作为糖基供体,转移糖基形成糖苷,因此在生产糖苷类生物活性物质方面有着巨大的应用潜力(图2)。
类黄酮可通过糖基化增加其水溶性和生物利用度,是改善其药代动力学和生物活性的一种有前景的方法[40],临床应用的黄酮类药物多为糖苷类,如芸香(槲皮素3-O-芸香苷)胶囊给药,葛根素(大豆黄酮8-C-葡萄糖苷)注射给药等。LI等[41]利用硫磺矿硫化叶菌(Sulfolobus solfataricus)来源的耐热α-葡萄糖苷酶衍生的O-α-糖苷连接酶,开发了一种高效合成类黄酮O-α-糖基化的方法,该酶底物谱宽,对黄酮、黄烷酮、黄烷酮醇、黄烷醇和异黄酮类均有较强的转糖基化活性,产率均在90%以上,最终可合成7-O-α-葡萄糖苷类黄酮。CHEN等[18]将来自野油菜黄单胞菌(Xanthomonas campestris)的α-葡萄糖苷酶(Agl2)在E.coli中重组表达,该酶以麦芽糖为糖基供体,可对苯酚、香兰素和乙基香兰素等酚类底物进行糖基化,且其催化效率主要受糖基化/水解选择性和催化环境中葡萄糖含量的影响。
L-抗坏血酸(ascorbic acid,AA)在维持皮肤弹性和修复受损皮肤方面有重要作用,可作为化妆品的主要护肤成分。研究发现α-葡萄糖苷酶可对L-抗坏血酸进行糖基化,一定条件下形成不同比例的6-O-α-D-葡萄糖基-L-抗坏血酸(AA-6G)和2-O-α-D-葡萄糖基-L-抗坏血酸(AA-2G),两者的抗氧化活性均保持在AA的水平,但AA-2G的稳定性远高于AA-6G,且AA-2G在体内容易被酶处理以释放活性AA[42]。LI等[43]将来自A.niger的α-葡萄糖苷酶(α-glucosidase,Agl)的截短版本AglA-t在P.pastoris中表达并纯化后合成L-抗坏血酸-O-葡萄糖苷,主要产物为AA-2G,在pH 6.0和40 ℃时产量最高,为0.53 g/L,并分析猜测AglA的信号肽可能对糖基化位点的选择起主要作用。来自水稻种子和哺乳动物等高等真核细胞的α-葡萄糖苷酶用于合成AA-2G,有副产物少的优点,如QI等[44]将亚洲稻(Oryza sativa)来源的Agl在P.pastoris中表达并纯化,以麦芽糖为糖基供体,在37 ℃,pH 4.0的最适条件下可合成约8.7 g/L的AA-2G。以上研究表明不同来源的α-葡萄糖苷酶底物活性不同,糖基化位点不同,形成的糖基化产物的活性和稳定性会受到影响。熊果素可通过抑制酪氨酸酶的活性,减少黑色素的沉积,从而在美白等化妆品方面有重要的应用。PARK等[45]以嗜酸热原体(Thermoplasma acidophilum)来源的Agl为对象,提出了一种用AglA及其糖苷合成酶突变体合成熊果苷的新方法,通过用非亲核的甘氨酸取代亲核试剂构建α-糖苷合成酶AglA,研究表明AglA以麦芽糖为供体,熊果素为受体,合成主要产物C-3、C-4和C-6熊果苷,但其转糖基化产物可再次被酶水解并最终降低产率,但AglA糖苷合成酶突变体只产生一种主要产物C-4熊果苷,其产量为38%,且没有被进一步水解。综上,α-葡萄糖苷酶对不同底物的偏好性,及对形成 C-糖苷和O-糖苷的区域和立体特异性的选择,影响着糖苷类物质的生物活性及稳定性,而不同来源的α-葡萄糖苷酶的底物谱及催化特性,给揭示该酶及突变体的糖基化区域和立体选择性的分子机制提供了结构信息,以便运用理性设计的方法构建α-葡萄糖苷酶突变体,最终可合成生物活性高且稳定性强的糖苷类物质。
目前,除α-葡萄糖苷酶外,研究发现糖苷磷酸化酶(glycoside phosphorylases),也能以简单的磷酸化糖作为供体合成糖苷,且产率较高,如蔗糖磷酸化酶(sucrose phosphorylase)[46],此外,还有葡聚糖蔗糖酶(glucansucrases)[47],环糊精糖基转移酶(cyclodextrin glucanotransferase)[48],淀粉蔗糖酶(amylosucrases)[49]等,它们在催化对苯二酚、抗坏血酸、槲皮素、白藜芦醇和没食子酸丙酯等α-糖基化反应方面有较大的应用潜力。目前虽已揭示了某些酶的三维构象及催化位点,但尚没有明确的理论基础用于指导“糖苷合成酶”的改造,它们之间的构效关系也掌握的并不彻底,我们需要更多的蛋白质方面的生物学信息,如来自嗜热解糖热厌氧杆菌(Thermoanaerobacterium thermosaccharolyticum)的蔗糖磷酸化酶由于活性部位精氨酸和Loop环的空间限制,当以蔗糖-6-磷酸为供体时,不能对白藜芦醇进行糖基化,但研究发现其R134A突变体可高效合成白藜芦醇-3-α-葡萄糖苷,原因在于R134A突变体引起了空间构象的变化[50],因此,掌握涉及β/α-糖基化构型、立体选择性及引起构象变化的结构信息,是未来半理性或理性设计糖基合成酶突变体的分子基础,因此只有充分的掌握这些结构与功能信息,才能在转糖基化效率、特异性和立体选择性上进行更有效的工程设计。
2.3 其他方面
α-葡萄糖苷酶的应用研究,还体现在α-葡萄糖苷酶抑制剂、生物传感器及代谢工程等方面(图2)。由于α-葡萄糖苷酶抑制剂可有效降低餐后血糖水平,成为当前治疗Ⅱ型糖尿病的研究热点[51],目前关于α-葡萄糖苷酶抑制剂主要集中在多糖、皂苷、生物碱、黄酮、多肽、萜类等天然活性成分的研究上。MOHIUDDIN等[52]将α-葡萄糖苷酶共价固定在氨基化的多壁碳纳米管上,开发了一种用于测定药用植物抗糖尿病潜力的生物传感器,该传感器灵敏度高,方法简便,对于快速筛选α-葡萄糖苷酶抑制剂有显著效果。此外,KOJIMA等[53]研究了敲除米曲霉α-葡萄糖苷酶基因(agdA)对酿造日本清酒转糖基化产物的影响,agdA基因的敲除降低了清酒中α-乙基葡萄糖苷和α-甘油葡萄糖苷的含量,并通过核磁共振鉴定出新化合物乙基-α-麦芽糖苷和乙基-α-异麦芽糖苷是日本清酒中常见的苷类。YU[54]将自丙酮丁醇梭菌(Clostridium acetobutylicum)克隆得到的α-葡萄糖苷酶(agluI和agluⅡ)过表达于酪丁酸梭菌(Clostridiumtyrobutyricum tyrobutyricum),结果表明,突变株可利用麦芽糖和可溶性淀粉生产正丁醇,丁醇产量可达17.2 g/L,产率比原来提高了近1倍,且在间歇发酵时表现稳定,这种方法为以麦芽糖和淀粉为原料工业化生产正丁醇提供了新思路。
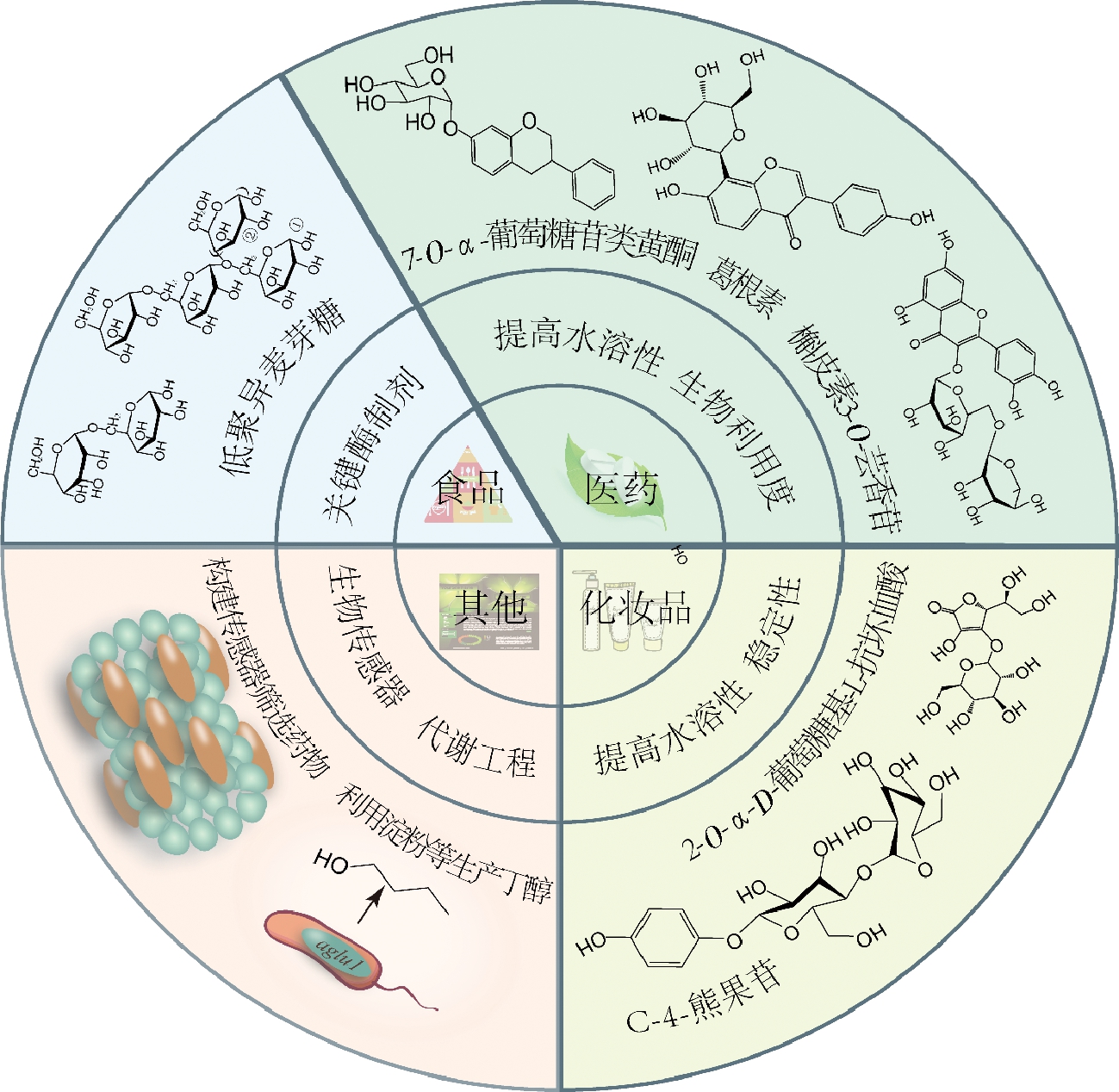
图2 α-葡萄糖苷酶在不同领域的研究和应用
Fig.2 Research and application of α-glucosidase in different fields
3 展望
糖基化的化合物在食品、制药和个人护理行业有广泛的应用,但它们的合成远远不能满足需求。糖基化合物的化学合成法由于产量低和缺乏选择性,使生物催化途径作为有效的和“绿色”替代品受到了越来越多的关注。目前α-葡萄糖苷酶主要用于IMOs的合成,而要降低IMOs的工业生产成本,仍需通过半理性设计或理性设计策略,利用该酶突变体的序列信息,结构与功能信息,以及计算机预测算法等手段,对α-葡萄糖苷酶进行分子改造。天然的糖苷水解酶、糖苷磷酸化酶等,除能通过糖基化来改善某些化合物的水溶性和稳定性等性能外,在红景天苷、人参皂苷的合成方面也有着巨大的应用潜力[55-56]。但由于转移葡萄糖基、半乳糖基、木糖基、甘露糖基等残基可能需要不同的糖苷合成酶突变体来完成,要求其底物特异性和立体选择性专一性强,才能高效合成单一的目的产物,因此糖苷合成酶突变体的研究,是未来学者研究的重点方向之一。笔者认为,应鉴别出“高功能性”糖苷类化合物的关键糖基化位点及其构型,并建立生物信息学数据库,进而结合酶的定向进化及高通量筛选技术,借助模型构建、计算机预测、信息整合、分析优化等手段,快速高效的筛选出活性高、稳定性强的符合特定需求的酶突变体。此外,自然界是糖苷合成酶的天然宝库,应重视对生物资源中天然糖苷合成酶的开发和利用,分析其序列及结构信息,并通过蛋白质工程拓宽或改变底物特异性,这对于开发适合特定应用需要的新型酶突变体意义重大。
[1] GUTIÉRREZ-ALONSO P, GIMENO-PÉREZ M, RAM REZ-ESCUDERO M, et al.Molecular characterization and heterologous expression of a Xanthophyllomyces dendrorhous α-glucosidase with potential for prebiotics production[J].Applied Microbiology and Biotechnology, 2016, 100(7):3 125-3 135.
REZ-ESCUDERO M, et al.Molecular characterization and heterologous expression of a Xanthophyllomyces dendrorhous α-glucosidase with potential for prebiotics production[J].Applied Microbiology and Biotechnology, 2016, 100(7):3 125-3 135.
[2] ZHANG Y K, LI W, WU K Y, et al.Purification and characterization of an intracellular α-glucosidase with high transglycosylation activity from A.niger M-1[J].Preparative Biochemistry and Biotechnology, 2011, 41(2):201-217.
[3] NGIWSARA L, IWAI G, TAGAMI T, et al.Amino acids in conserved region Ⅱ are crucial to substrate specificity, reaction velocity, and regioselectivity in the transglucosylation of honeybee GH-13 α-glucosidases[J].Bioscience Biotechnology and Biochemistry, 2012, 76(10):1 967-1 974.
[4] XIAO J B, WESTBROEK W, MOTABAR O, et al.Discovery of a novel noniminosugar acid alpha glucosidase chaperone series[J].Journal of Medicinal Chemistry, 2012, 55(17):7 546-7 559.
[5] NIMPIBOON P, NAKAPONG S, PICHYANGKURA R, et al.Synthesis of a novel prebiotic trisaccharide by a type Ⅰ α-glucosidase from B.licheniformis strain TH4-2[J].Process Biochemistry, 2011, 46(2):448-457.
[6] AUIEWIRIYANUKUL W, SABURI W, KATO K, et al.Function and structure of GH13_31 α-glucosidase with high α-(1→4)-glucosidic linkage specificity and transglucosylation activity[J].FEBS Letters, 2018, 592(13):2 268-2 281.
[7] 吴孔阳,陈桂光,黄时海,等.α-葡萄糖苷酶的异源表达及纯化研究进展[J].食品工业科技, 2011, 32(12):547-551.
WU K Y, CHEN G G, HUANG S H, et al.Advancement in heterologous expression and purification of α-glucosidase[J].Science and Technology of Food Industry, 2011, 32(12):547-551.
[8] CHAUDET M M, ALLEN J L, ROSE D R.Expression and purification of two family GH31 α-glucosidases from Bacteroides thetaiotaomicron[J].Protein Expression and Purification, 2012, 86(2):135-141.
[9] ZHANG F, WANG W Y, BAH F B M, et al.Heterologous expression of a thermostable α-glucosidase from Geobacillus sp.Strain HTA-462 by Escherichia coli and its potential application for isomaltose-oligosaccharide synthesis[J].Molecules, 2019, 24(7):1 413.
[10] LI W, XUE Y, LI J J, et al.A cold-adapted and glucose-stimulated type Ⅱ α-glucosidase from a deep-sea bacterium Pseudoalteromonas sp.K8[J].Biotechnology Letters, 2016, 38(2):345-349.
[11] CUEBAS-IRIZARRY M F, IRIZARRY-CARO R A, L PEZ-MORALES C, et al.Cloning and molecular characterization of an alpha-glucosidase (MalH) from the halophilic archaeon Haloquadratum walsbyi [J].Life, 2017, 7(4):46.
PEZ-MORALES C, et al.Cloning and molecular characterization of an alpha-glucosidase (MalH) from the halophilic archaeon Haloquadratum walsbyi [J].Life, 2017, 7(4):46.
[12] ZHOU C, XUE Y F, MA Y H.Evaluation and directed evolution for thermostability improvement of a GH13 thermostable α-glucosidase from Thermus thermophilus TC11 [J].BMC biotechnology, 2015, 15:97.
[13] PARK J E, PARK S H, WOO J Y, et al.Enzymatic properties of a thermostable α-glucosidase from acidothermophilic crenarchaeon Sulfolobus tokodaii strain 7[J].Journal of Microbiology and Biotechnology, 2013, 23(1):56-63.
[14] LIU X, WU D, WU J, et al.Optimization of the production of Aspergillus niger α-glucosidase expressed in Pichia pastoris[J].World Journal of Microbiology and Biotechnology, 2013, 29(3):533-540.
[15] KAEWMUANGMOON J, KILASO M, LEARTSAKULPANICH U, et al.Expression of a secretory α-glucosidaseⅡ from Apis cerana indica in Pichia pastoris and its characterization[J].BMC Biotechnology, 2013, 13:16.
[16] SUTHANGKORNKUL R, SIRICHAIYAKUL P, SUNGVORNYOTHIN S, et al.Functional expression and molecular characterization of Culex quinquefasciatus salivary α-glucosidase (MalI) [J].Protein Expression and Purification, 2015, 110:145-150.
[17] CASA-VILLEGAS M, MAR N-NAVARRO J, POLAINA J.Synthesis of isomaltooligosaccharides by Saccharomyces cerevisiae cells expressing Aspergillus niger α-glucosidase[J].ACS Omega, 2017, 2(11):8 062-8 068.
N-NAVARRO J, POLAINA J.Synthesis of isomaltooligosaccharides by Saccharomyces cerevisiae cells expressing Aspergillus niger α-glucosidase[J].ACS Omega, 2017, 2(11):8 062-8 068.
[18] CHEN H C, YANG S S, XU A J, et al.Insight into the glycosylation and hydrolysis kinetics of alpha-glucosidase in the synthesis of glycosides[J].Applied Microbiology and Biotechnology, 2019, 103(23-24):9 423-9 432.
[19] WU D, ZHU H F, CHU J, et al.N-acetyltransferase co-expression increases α-glucosidase expression level in Pichia pastoris[J].Journal of Biotechnology, 2019, 289:26-30.
[20] KUMAR S, MUTTURI S.Expression of a novel α-glucosidase from Aspergillus neoniger in Pichia pastoris and its efficient recovery for synthesis of isomaltooligosaccharides[J].Enzyme and Microbial Technology, 2020, 141:109653.
[21] GARCIA-GONZALEZ M, MINGUET-LOBATO M, PLOU F J, et al.Molecular characterization and heterologous expression of two α-glucosidases from Metschnikowia spp, both producers of honey sugars[J].Microbial Cell Factories, 2020, 19(1):1-14.
[22] DHANAWANSA R, FARIDMOAYER A, VAN DER MERWE G, et al.Overexpression, purification, and partial characterization of Saccharomyces cerevisiae processing alpha glucosidase I[J].Glycobiology, 2002, 12(3):229-234.
[23] TANAKA Y, AKI T, ISHIHARA K, et al.cDNA cloning and functional expression of α-glucosidase from mortierella alliacea[J].Applied Microbiology and Biotechnology, 2003, 62(2-3):202-209.
[24] HOSTINOV E, SOLOVICOV
E, SOLOVICOV A, GASPER
A, GASPER K J.Cloning and expression of a gene for an alpha-glucosidase from Saccharomycopsis fibuligera homologous to family GH31 of yeast glucoamylases[J].Applied Microbiology and Biotechnology, 2005, 69(1):51-56.
K J.Cloning and expression of a gene for an alpha-glucosidase from Saccharomycopsis fibuligera homologous to family GH31 of yeast glucoamylases[J].Applied Microbiology and Biotechnology, 2005, 69(1):51-56.
[25] WU K Y, HUANG S H, DING S, et al.Expression, purification and characterization of recombinant α-glucosidase in Pichia pastoris[J].Folia Microbiologica, 2010, 55(6):582-587.
[26] MUSLIN E H, KANIKULA A M, CLARK S E, et al.Overexpression, purification, and characterization of a barley α-glucosidase secreted by Pichia pastoris[J].Protein Expression and Purification, 2000, 18(1):20-26.
[27] CHEN D L, TONG X, CHEN S W, et al.Heterologous expression and biochemical characterization of α-glucosidase from Aspergillus niger by Pichia pastroris[J].Journal of Agricultural and Food Chemistry, 2010, 58(8):4 819-4 824.
[28] NAKAMURA A, NISHIMURA I, YOKOYAMA A, et al.Cloning and sequencing of an α-glucosidase gene from Aspergillus niger and its expression in A.nidulans[J].Journal of Biotechnology, 1997, 53(1):75-84.
[29] GIULIANO M, SCHIRALDI C, MAROTTA M R, et al.Expression of Sulfolobus solfataricus α-glucosidase in Lactococcus lactis[J].Applied Microbiology and Biotechnology, 2004, 64(6):829-832.
[30] HUNG V S, HATADA Y, GODA S, et al.α-Glucosidase from a strain of deep-sea Geobacillus:A potential enzyme for the biosynthesis of complex carbohydrates[J].Applied Microbiology and Biotechnology, 2005, 68(6):757-765.
[31] 张津浩, 宋婷婷, 田野, 等.α-葡萄糖苷酶基因在黑曲霉中的同源表达[J].分子植物育种,2018, 16(1):110-114.
ZHANG J H, SONG T T, TIAN Y, et al.Homologous expression of α-glucosidase gene in Aspergillus niger[J].Molecular Plant Breeding, 2018, 16(1):110-114.
[32] BASU A, MUTTURI S, PRAPULLA S G.Production of isomaltooligosaccharides (IMO) using simultaneous saccharification and transglucosylation from starch and sustainable sources[J].Process Biochemistry, 2016, 51(10):1 464-1 471.
[33] WANG J, LI W, NIU D D, et al.Improved synthesis of isomaltooligosaccharides using immobilized α-glucosidase in organic-aqueous media[J].Food Science and Biotechnology, 2017, 26(3):731-738.
[34] OJHA S, MISHRA S, CHAND S, et al.Production of isomalto-oligosaccharides by cell bound α-glucosidase of Microbacterium sp.[J].LWT-Food Science Technology, 2015, 60(1):486-494.
[35] 田康明, 乔舰, 李普均, 等.快速酶法制备低聚异麦芽糖工艺建立与优化[J].食品工业科技, 2016, 37(16):238-241;247.
TIAN K M, QIAO J, LI P J, et al.Development and optimization of rapid enzymatic process for isomaltooligosaccharides preparation[J].Science and Technology of Food Industry, 2016, 37(16):238-241;247.
[36] CHEN P, XU R X, WANG J H, et al.Starch biotransformation into isomaltooligosaccharides using thermostable alpha-glucosidase from Geobacillus stearothermophilus[J].PeerJ, 2018, 6:e5086.
[37] ZHAO N N, XU Y S, WANG K, et al.Synthesis of isomalto-oligosaccharides by Pichia pastoris displaying the Aspergillus niger α-glucosidase[J].Journal of Agricultural and Food Chemistry, 2017, 65(43):9 468-9 474.
[38] 王框.表面展示α-葡萄糖苷酶毕赤酵母的固定及其在低聚异麦芽寡糖合成中的应用[D].广州:华南理工大学, 2018.
WANG K.Immobilization of Pichia pastoris surface displayed with α-glucosidase and its application in the synthesis of isomaltooligosaccharides[D].Guangzhou:South China University of Technology, 2018
[39] DANBY P M, WITHERS S G.Advances in enzymatic glycoside synthesis[J].ACS Chemical Biology, 2016,11(7):1 784-1 794.
[40] WANG H M, YANG Y, LIN L, et al.Engineering Saccharomyces cerevisiae with the deletion of endogenous glucosidases for the production of flavonoid glucosides[J].Microbial Cell Factories, 2016, 15(1):134.
[41] LI C, ROY J K, PARK K C, et al.pH-promoted O-α-glucosylation of flavonoids using an engineered α-glucosidase mutant[J].Bioorganic Chemistry, 2021, 107:104581.
[42] HAN R Z, LIU L, LI J H, et al.Functions, applications and production of 2-O-D-glucopyranosyl-L-ascorbic acid[J].Applied Microbiology and Biotechnology, 2012, 95(2), 313-320.
[43] LI Z J, HAN H J, WANG B, et al.Transglucosylation of ascorbic acid to ascorbic acid 2-glucoside by a truncated version of α-glucosidase from Aspergillus niger[J].Journal of Food Biochemistry, 2017, 41(6):e12432.
[44] QI X L, SHAO J L, CHENG Y C, et al.Biocatalytic synthesis of 2-O-α-D-glucopyranosyl-L-ascorbic acid using an extracellular expressed α-glucosidase from Oryza sativa[J].Biotechnology Journal, 2021, 16(11):e2100199.
[45] PARK I, LEE H, CHA J.Glycoconjugates synthesized via transglycosylation by a thermostable α-glucosidase from Thermoplasma acidophilum and its glycosynthase mutant[J].Biotechnology Letters, 2014, 36(4):789-796.
[46] LI Y, LI Z, He X Y, et al.Characterization of a Thermobacillus sucrose phosphorylase and its utility in enzymatic synthesis of 2-O-α-D-glucopyranosyl-L-ascorbic acid[J].Journal of Biotechnology, 2019, 305:27-34.
[47] KLINGEL T, HADAMJETZ M, FISCHER A, et al.Glucosylation of flavonoids and flavonoid glycosides by mutant dextransucrase from Lactobacillus reuteri TMW 1.106[J].Carbohydrate Research, 2019, 483:107741.
[48] TAO X M, WANG T, SU L Q, et al.Enhanced 2-O-α-D-glucopyranosyl-L-ascorbic acid synthesis through iterative saturation mutagenesis of acceptor subsite residues in Bacillus stearothermophilus NO2 cyclodextrin glycosyltransferase[J].Journal of Agricultural and Food Chemistry, 2018, 66(34):9 052-9 060.
[49] ZHU L J, JIANG D, ZHOU Y Y, et al.Batch-feeding whole-cell catalytic synthesis of α-arbutin by amylosucrase from Xanthomonas campestris[J].Journal of Industrial Microbiology and Biotechnology, 2019, 46(6):759-767.
[50] DIRKS-HOFMEISTER M E, VERHAEGHE T, DE WINTER K, et al.Creating space for large acceptors:Rational biocatalyst design for resveratrol glycosylation in an aqueous system[J].Angewandte Chemie, 2015,54(32):9 289-9 292.
[51] DAOU M, ELNAKER N A, OCHSENKÜHN M A, et al.In vitro α-glucosidase inhibitory activity of Tamarix nilotica shoot extracts and fractions[J].PLoS One, 2022, 17(3):e0264969.
[52] MOHIUDDIN M, ARBAIN D, ISLAM A K M S, et al.Alpha-glucosidase enzyme biosensor for the electrochemical measurement of antidiabetic potential of medicinal plants[J].Nanoscale Research Letters, 2016, 11(1):95.
[53] KOJIMA Y, HONDA C, KOBAYASHI I, et al.Transglycosylation forms novel glycoside ethyl α-maltoside and ethyl α-isomaltoside in sake during the brewing process by α-glucosidase A of Aspergillus oryzae[J].Journal of Agricultural Food Chemistry, 2020, 68(5):1 419-1 426.
[54] YU M R. Metabolic engineering of Clostridium tyrobutyricum for n-butanol production[J]. Metabolic Engineering, 2011, 13(4):373-382.
[55] YANG X P, WANG F F, YAN J, et al.A new family-3 glycoside hydrolase from Penicillium oxalicum BL 3005 catalyzing tyrosol glucosylation to form salidroside[J].Biotechnology and Applied Biochemistry, 2017, 64(4):525-531.
[56] KIM M J, UPADHYAYA J, YOON M S, et al.Highly regioselective biotransformation of ginsenoside Rb2 into compound Y and compound K by β-glycosidase purified from Armillaria mellea mycelia[J].Journal of Ginseng Research, 2018, 42(4):504-511.