发酵食品是指通过微生物(如细菌、酵母菌和菌丝体真菌)以及酶促作用使食品成分发生变化而得到的食品或饮料[1]。目前,主要通过“自然发酵”或“接种发酵剂发酵”来生产发酵食品。自然发酵又称“自发发酵”或“野生发酵”,主要利用食品原辅料或加工环境中自然存在的微生物来进行食品加工,自然发酵食品包括泡菜、酸菜和榨菜等。接种发酵剂发酵又称“培养依赖性发酵”,主要利用已经商业化的优良菌种进行食品加工,通过此方法所得的发酵食品包括开菲尔、康普茶和纳豆等[2]。
发酵食品因具有制作方法简单、能够延长食品保质期、富含多种有益成分(如维生素、膳食纤维、有机酸、矿物质、益生菌和氨基酸等)、原材料来源广等优势,极大地推动了食品产业的发展[3]。在食品发酵过程中,由于受原辅料质量、发酵环境以及发酵微生物等诸多因素的影响,不可避免会产生有害物质,如金黄色葡萄球菌、单核细胞增生李斯特菌和大肠杆菌等致病菌。同时,还会产生亚硝酸盐、生物胺、丙烯酰胺和杂环胺等有害成分[4]。
随着天然产物开发的逐渐兴起,包括茶多酚在内的天然植物多酚因具有分布广泛、生理活性效应高、无毒副作用等优势,逐渐成为食品科学领域的研究热点[5]。在此,本文重点论述了发酵食品的分类和功效,茶多酚的功效及其在发酵食品中的应用研究现状,以期为发酵食品的安全性研究及品质调控提供参考。
1 发酵食品概述
1.1 发酵食品分类
发酵食品种类较多,主要包括发酵乳制品、发酵蔬菜、发酵豆制品、发酵肉制品、谷物发酵产品和酒精发酵饮料等,图1表示国内外现有的典型发酵食品。

图1 典型发酵食品
Fig.1 Typical fermented foods
发酵乳制品是通过乳酸菌、双歧杆菌、酵母菌等特定微生物发酵牛奶获得的,如酸奶、奶酪和开菲尔等[6]。其中,开菲尔是一种发酵乳饮料,它起源于高加索山脉,主要通过在牛奶中添加一种称为“开菲尔谷物”的发酵剂生产[1]。研究表明,开菲尔中含有比普通酸奶多60%的β-半乳糖苷酶,这种酶可以水解乳糖,从而降低饮料中的乳糖浓度。研究表明,与未发酵的牛奶相比,开菲尔中的乳糖含量降低了30%。因此,开菲儿发酵乳饮料特别适合乳糖吸收不良的人食用[7]。
发酵蔬菜主要包括泡菜、酸菜、榨菜、辣白菜以及康普茶等植物发酵产品。其中,泡菜是最常见的液态发酵蔬菜,尤以“四川泡菜”最为出名。酸菜、榨菜和辣白菜通常是固态或半固态腌制发酵蔬菜。康普茶是最受欢迎的植物发酵饮料之一,其酒精和二氧化碳含量很低。传统的康普茶是通过红茶(或绿茶)、白砂糖和多种发酵剂(如乳酸菌、醋酸菌和酵母菌等)在有氧和常温下发酵而成[8]。由于具有较低的pH值,康普茶能够抑制幽门螺杆菌、大肠杆菌、鼠伤寒沙门氏菌和空肠弯曲杆菌等致病菌的生长。此外,即使在中性 pH和热变性后,康普茶也能够抑制病原菌的生长[9]。
发酵豆制品主要包括纳豆、腐乳、豆豉、酱油和味噌等[10]。纳豆起源于日本,通常指的是“伊藤引”纳豆(也称黏性纳豆),这种纳豆主要通过将先浸泡好的豆子在 121 ℃ 下蒸煮 35~45 min,然后接种 104~106个纳豆枯草芽孢杆菌(Bacillus subtilis natto)孢子/g,随后在35~47 ℃ 下发酵 12~20 h制成的。优质纳豆表面呈白色黏液状,风味独特,质地柔软,呈淡黄色,搅拌时会产生像丝一样的黏性物质[10]。味噌又称面豉酱,是以黄豆为主原料,加入盐及发酵剂(如米曲霉、酿酒酵母和乳酸菌等)发酵而成[11]。
发酵肉制品主要包括香肠、腊肉、火腿和培根等。香肠主要通过在肠衣(通常是动物肠衣)内填充粉碎、切块或切碎的肉,然后经过乳酸菌(如清酒乳杆菌、弯曲乳杆菌和植物乳杆菌)和微球菌等细菌发酵,采用烟熏、晒干或其他干燥方式加工而成的发酵食品。发酵肉制品不仅具有独特的风味、口感和质地,还能延长食品的保质期,同时也是人体所需益生菌的良好来源[12]。
谷物发酵产品主要是以玉米、小麦、大米、小米、高粱、荞麦、大麦等谷物为主要原料,经酵母菌、乳酸菌等发酵微生物发酵而成[13]。目前,谷物发酵产品主要包括各种发酵面包、糕点以及各种含乙醇的饮料,如啤酒、白酒等[13]。发酵酒精饮料主要以苹果、葡萄、柑桔和桑葚等果蔬为主要原料,经酵母菌、乳酸菌等发酵剂发酵而成。首先,利用酵母菌发酵产生乙醇,随后,乳酸杆菌属、片球菌属、酒球菌属和明串珠菌属等乳酸菌利用体系中残留的糖和其他营养物质发酵产酸,并赋予产品最终的感官性质和品质特性[14]。
1.2 发酵食品的功效
最初,人们主要通过发酵来延长食品(尤其是时令生鲜食品)的保质期。迄今,发酵仍是最古老、最经济的食物加工方法之一[15]。发酵不仅能够改善食品风味,对人体健康还有许多益处。在食品发酵过程中,以乳酸菌为代表的微生物能够合成维生素(如叶酸、核黄素、维生素B12、维生素 K2)、矿物质、生物活性肽、细菌素、胞外多糖等有益物质[1]。发酵还可以将某些化合物转化为具有生物活性的代谢物。例如,乳酸菌可以将不同类型的黄酮糖苷转化成相应的游离型黄酮苷元[15]。经过发酵,蛋白质和碳水化合物的消化率以及维生素、矿物质和异黄酮等有益物质的生物利用度也得以提高。此外,经过发酵,食品中毒素和抗营养物质含量也会减少。例如,大豆经过发酵之后,植酸浓度降低[16]。
已有研究发现,食品发酵过程中产生的生物活性肽具有抗氧化、抗菌、抗病毒、抗过敏、降血压、降血脂等作用。最重要的生物活性肽亚组是血管紧张素-1-转换酶(angiotensin-1-converting enzyme,ACE)抑制肽,它是在牛奶发酵过程中形成的。其中,缬氨酰-脯氨酰-脯氨酸和异亮氨酰-脯氨酰-脯氨酸具有明显的抗高血压作用[17]。此外,与未发酵的牛奶相比,发酵牛奶具有更高的抗氧化活性。这是由于发酵乳中的乳蛋白水解后能够释放生物活性肽(如α-乳清蛋白、β-乳球蛋白和 α-酪蛋白),这些物质增强了发酵食品的抗氧化能力[17]。
发酵产生的胞外多糖具有抗氧化、抗糖尿病、抗癌、降低胆固醇和免疫调节特性等潜在益处。胞外多糖在宿主-微生物相互作用中也起着重要的作用。它们参与微生物定殖、附着和免疫调节,并保护细菌壁免受极端条件(如温度、渗透压、pH或光照)的影响[18]。
由于发酵食品中含有大量的乳酸菌、酵母菌等益生菌,这些益生菌也会带来许多健康益处,如预防抗生素相关性腹泻、预防细菌感染以及治疗炎症性肠综合征、小儿急性腹泻和幽门螺杆菌感染等[9]。已有研究发现,在味噌样品中发现的乳球菌GM005,能够产生一种具有强抗菌活性的细菌素,可抑制枯草芽孢杆菌、乳酸片球菌和植物乳杆菌等许多细菌的生长[11]。PARLINDUNGAN等[12]研究发现,植物乳杆菌 41G对抗生素最敏感,且对胆汁盐、苯酚和氯化钠胁迫具有较高耐受性。
2 茶多酚概述
2.1 茶多酚的结构与组成
茶起源于中国,由茶树的叶子制成。目前,茶已成为世界上最受欢迎的非酒精饮料之一。据悉,世界上超过三分之二的人都有饮茶的习惯[19]。根据加工方式不同,可将茶分为绿茶、白茶、黄茶、乌龙茶、红茶和黑茶六类。其中,黑茶的发酵程度最大,其次是红茶(完全发酵)、乌龙茶(半发酵)、黄茶(部分发酵)、白茶(轻微发酵)和绿茶(不发酵)[20]。茶叶主要由3.5%~7%的无机化合物和93%~96.5%的有机化合物组成。其中,茶多酚约占有机化合物的18%~36%。研究发现,儿茶素(黄烷醇类)是茶中的主要多酚类物质,占茶多酚总量的60%~80%,占茶叶干重的12%~24%[21]。常见的儿茶素包括表儿茶素(epicatechin,EC),表没食子儿茶素(epigallocatechin,EGC),表儿茶素-3-没食子酸酯(epicatechin-3-gallate,ECG)和表没食子儿茶素-3-没食子酸酯(epigallocatechin-3-gallate,EGCG)4种(图2)。其中,EC和EGC被称为非酯型儿茶素(或简单儿茶素),ECG和EGCG被称为酯型儿茶素(或复杂儿茶素)。在上述儿茶素中,EGCG含量最高,约占儿茶素总量的65%,其次分别是EGC、ECG和EC[21]。此外,绿茶中还含有少量的其他多酚,如甲基黄嘌呤、黄酮醇、花青素、茶没食子素、奎尼酸没食子酸、酚酸、缩酚酸以及其他黄酮类化合物[21]。红茶中的儿茶素在发酵过程中,被氧化和二聚化成橙黄色的茶黄素,或聚合成红色的茶红素。乌龙茶是一种部分发酵的产品,含有的多酚主要包括儿茶素、茶黄素和茶红素[19]。
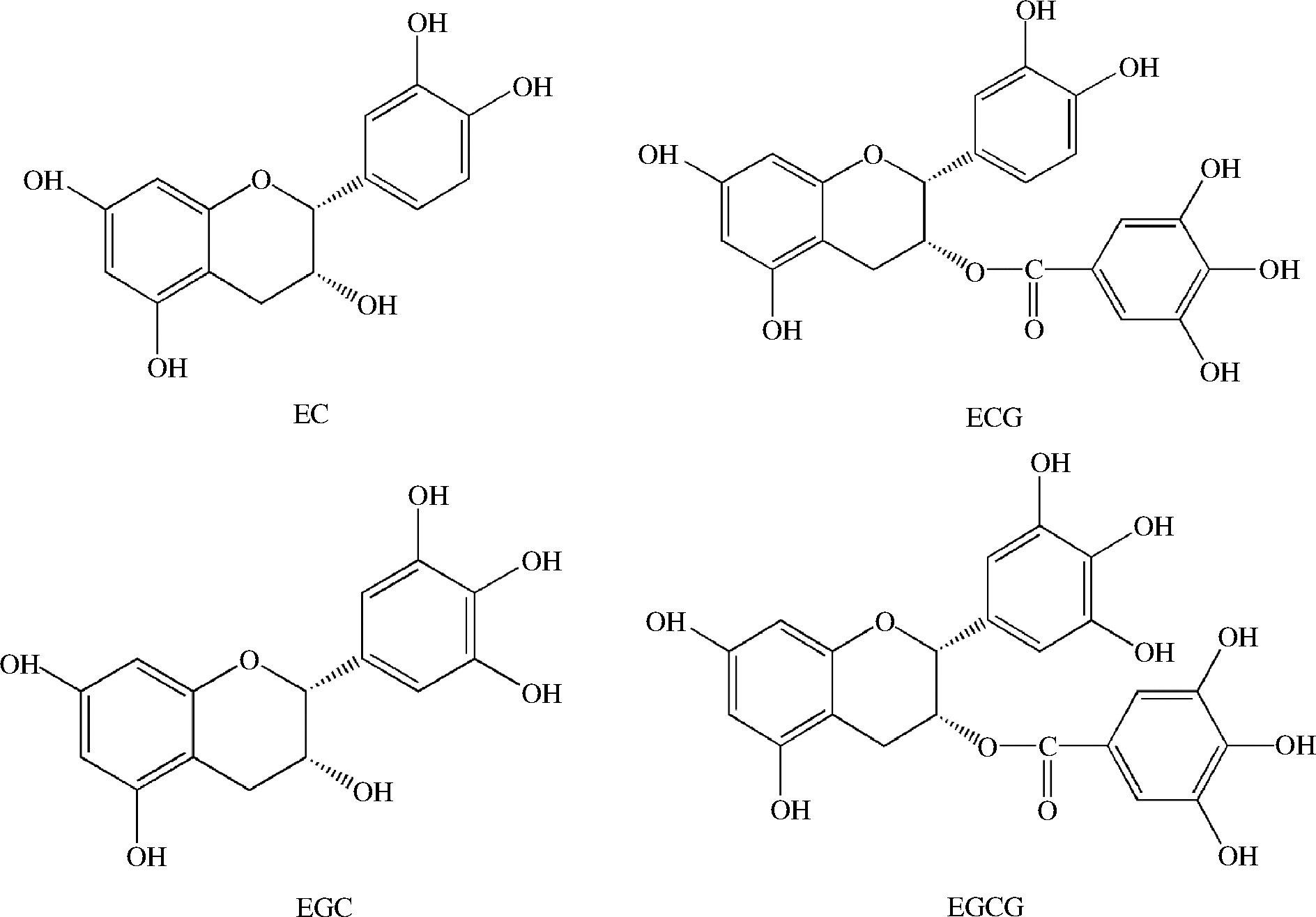
图2 茶叶中主要儿茶素的化学结构
Fig.2 Chemical structures of the major catechins in tea
2.2 茶多酚的功能特性
在茶叶中,多酚类物质不仅含量丰富,而且也是一类具有多种功能特性的生物活性化合物,具有抗氧化、抗菌、抗病毒、抗炎、预防糖尿病、降血脂和降血糖等功效。
2.2.1 抗氧化活性
抗氧化活性是指活性物质通过抑制氧化链反应的起始或传播途径,或形成稳定的自由基,以延缓或抑制脂质或其他分子氧化的性质。食物中的脂质氧化(即自由基链式反应)主要包括3个阶段,自由基在第一阶段产生[1]。体外研究表明,茶多酚分子中存在的活性羟基能够与食品体系(如脂肪、油和乳液)中甘油三酯氧化过程中产生的自由基(如过氧自由基、羟自由基等)相互作用,并将其清除,从而终止自由基链式反应的发生。由于在铁、铜、锌等过渡金属存在下,自由基和脂质过氧化物的产生能力增强,茶多酚可通过发挥其优异的过渡金属螯合能力,防止过渡金属催化的自由基形成[2]。体内研究表明,茶多酚可通过提高血浆中还原型谷胱甘肽的含量以及增强抗氧化酶(如过氧化氢酶、血红素加氧酶1、γ-谷氨酰半胱氨酸合成酶、谷胱甘肽还原酶、超氧化物歧化酶和谷胱甘肽过氧化物酶等)的解毒活性,来间接发挥抗氧化作用[3-4]。
目前,茶多酚已成为最重要的天然抗氧化剂之一,其抗氧化能力通常与羟基的结构、位置和数量有关。一般情况下,羟基数量越多,其抗氧化能力越强。因此,在4种儿茶素中,EGCG的自由基清除活性最强,其次是 ECG、EC 和 EGC[5]。此外,茶多酚的抗氧化活性也受浓度、溶解度、活性基团对氧化剂的可及性以及产品的稳定性等因素影响[22]。
2.2.2 抗菌和抗病毒活性
已有研究表明,茶多酚对金黄色葡萄球菌、枯草芽孢杆菌、空肠弯曲杆菌、单核细胞增生李斯特菌、鼠伤寒沙门氏菌和大肠杆菌等多种致病细菌和植物源真菌都有较好的抑制作用[23]。此外,当茶多酚与有机酸(如苹果酸、酒石酸、苯甲酸等)、乳酸链球菌素等细菌素或 EDTA 等螯合剂联合使用时,其抗菌活性增强[19]。
茶多酚可通过与细菌细胞膜上的磷脂酰胆碱和磷脂酰乙醇胺双分子层结合,改变相关结构的物理性质,导致细菌细胞膜的损伤。细菌的细胞膜一旦发生损伤,其与宿主细胞以及与其他细菌细胞的结合能力受到抑制,细菌分泌有毒物质的能力大大降低。同时,其耐药性也减弱[24]。由于细菌主要通过结合其他细胞诱发一系列的疾病。因此,茶多酚的抗菌活性能够降低细菌的致病性和毒害作用[21]。NAKAYAMA等[25]研究发现,EGCG可以通过抑制枯草芽孢杆菌细胞膜中寡肽 ATP 结合转运蛋白、磷酸转移酶系统转运蛋白、青霉素结合蛋白 5和磷酸盐转运蛋白等多种膜蛋白的活性,从而抑制其生长繁殖。LEE等[26]研究了EGCG对粪肠球菌的影响,发现与对照组相比,经EGCG处理7 d之后,粪肠球菌的生长和其生物膜的形成明显受到抑制,细菌数量明显减少。
此外,茶多酚还具有较好的抗病毒作用。EGCG对单纯疱疹病毒、腺病毒、人乳头瘤病毒和乙型肝炎病毒等具有较好的抗病毒活性[27]。同时,对人类免疫缺陷病毒、丙型肝炎病毒、埃博拉病毒、寨卡病毒、西尼罗河病毒和猪繁殖和呼吸道病毒等RNA病毒也具有很好的抗性[28]。茶多酚可附着在病毒血凝素上,阻止病毒与细胞的靶受体结合,从而阻止病毒传播。同时,还会改变病毒的包膜结构,防止病毒感染其他细胞[27]。此外,茶多酚的结构与其抗病毒活性存在一定的构效关系,具有3-没食子酰基和5′-OH基团的儿茶素往往表现出更高的抗病毒活性[27]。
2.2.3 抗炎活性
正常情况下,抗炎细胞因子,如白细胞介素(interleukin,IL)-4、IL-10、IL-11、IL-13等维持正常组织稳态和肠道通透性。然而,促炎细胞因子,如肿瘤坏死因子-α (tumor necrosis factor,TNF-α)、IL-1b 和IL-6的产生会破坏正常生理状况,诱导产生炎症。
体外研究表明,茶黄素可通过下调IL-1、IL-6、TNF-α、趋化因子配体 8、基质金属蛋白酶(matrix metalloprotease,MMP)- 3、MMP-8 和 MMP-9等炎症因子,提高牙龈角质形成细胞抗炎活性[29]。此外,EGCG和EGC可通过抑制IL-6、IL-8和MMP-2的产生和环氧化物酶-2的表达,发挥对原发性类风湿性关节炎滑膜成纤维细胞的抗炎作用。其中,EGCG的抗炎作用最强[29]。体内研究表明,茶多酚主要通过抑制脂氧合酶、环氧化物酶-2、一氧化氮合酶等促炎酶的活性,以及调节信号转导和转录因子(如丝裂原活化蛋白激酶、NF-κB、核因子-红细胞2、激活蛋白1)等方式,发挥抗炎活性[19]。LIU等[30]研究发现,茶多酚(300 mg/kg BW)可显著减轻大鼠急性力竭运动介导的炎症。此外,EGCG通过降低小鼠体内 TNF-α、IL-6、一氧化氮合酶和环氧化物酶-2等炎症因子水平,提高 IL-10抗炎因子水平,从而降低小鼠患败血症的风险。LAKSHMI等[31]研究发现,EGCG通过降低 P65 蛋白的表达,抑制了 NF-κB 介导的转录激活途径。
2.2.4 预防糖尿病
糖尿病是世界上最常见的代谢性疾病之一,可诱发多种并发症。目前,糖尿病肾病、糖尿病心血管、糖尿病神经病变、糖尿病视网膜病变、糖尿病肝病等并发症的发生率和死亡率逐年增高[32]。已有研究表明,茶多酚可以通过降低胰岛素耐受性、抑制胰岛素信号通路、保护胰岛B细胞、清除自由基和减少炎症等方式来增强胰岛素作用,从而预防和治疗糖尿病及并发症[32]。例如,EGCG可减少肿瘤坏死因子,并阻断胰岛素受体底物Ⅰ与胰岛素受体的相互作用[22]。一项研究表明,在我国,常喝茶的人比不喝茶的人患糖尿病的风险低50%。每天喝超过 1 杯茶,患糖尿病的风险将降低14 %[33]。
2.2.5 其他功能活性
茶多酚还具有护肝、降低胆固醇、降血脂、降血糖、神经保护、心血管保护、抗癌和抗肥胖等多种活性。
肝脏作为生物体最重要的脏器之一,在人体和动物体发挥重要作用。MAITI等[34]研究表明,EGCG通过抑制溶血磷脂酸(肝纤维化激活元件)并增强丝裂原活化蛋白激酶(p38、Erk1/2 和 c-jun 激酶)磷酸化,从而降低肝纤维化风险。该课题组还发现,茶多酚通过激活甾醇调节元件结合蛋白,增强低密度脂蛋白受体的表达,使HepG2细胞中胆固醇水平降低了30%。IMRAN等[35]研究发现,茶红素可显著降低血脂蛋白胆固醇质量浓度(约0.01 mg/mL)。TANG等[22]研究发现,EC和 EGCG 可通过甾醇调节元件结合蛋白网络来减少血脂异常。此外,茶多酚可通过控制抗氧化酶和谷胱甘肽水平,减少认知缺陷,从而起到神经保护作用[35]。研究表明,每天摄入含有 200~300 mg EGCG 的绿茶对心血管有很好的保护作用。在抗癌活性方面,已有研究发现,茶多酚对肺癌、胃癌、食道癌、肠癌、胰腺癌、肝癌、乳腺癌、皮肤癌和结肠癌等具有抗癌特性,其可以通过调节细胞周期相关蛋白分子和诱导细胞周期停滞来抑制肿瘤发生[36]。目前,随着生活水平的提高,由营养过剩导致的肥胖人群越来越多。研究发现,每天摄入含有270~1 200 mg儿茶素的绿茶可减轻体重和脂肪堆积,因此,茶多酚在抗肥胖方面也具有一定活性效应[36]。
2.3 茶多酚的代谢和生物转化
现有研究表明,当茶多酚进入人体后,主要在肝脏中代谢,也有少量在肠道微生物的作用下发生代谢或生物转化[37]。
2.3.1 茶多酚在肝脏中的代谢
本论文主要以EGC在肝脏中的代谢为例进行阐述。当茶多酚进入肝脏后,主要经历3种类型的代谢,包括甲基化、葡萄糖醛酸化和硫酸化(图3)[37]。EGC的甲基化是指儿茶酚-O-甲基转移酶(catechol-O-methyltransferase,CMOT)催化甲基从S-腺苷-L-甲硫氨酸转移到具有邻二酚(儿茶酚)结构的多酚中。在此过程中,EGC与甲基基团结合,主要形成4′-甲基表没食子儿茶素结合物。茶多酚的葡萄糖醛酸化是指尿苷二磷酸葡萄糖醛酸转移酶(uridine diphosphate-glucuronosyltransferase,UDP-GT)催化葡萄糖醛酸从 UDP-葡萄糖醛酸转移到EGC中,主要形成7-葡萄糖醛酸表没食子儿茶素结合物。EGC的硫酸化是指苯酚磺基转移酶催化硫酸盐部分从3′-磷酸腺苷-5′-磷酸硫酸盐转移到EGC的羟基上,主要形成3′-硫酸表没食子儿茶素结合物。经肝脏代谢之后,代谢物进一步进入其他组织和肾脏中,最终经胆汁和尿液排泄。此外,没有被代谢的多酚将以游离态的形式在血液中循环。
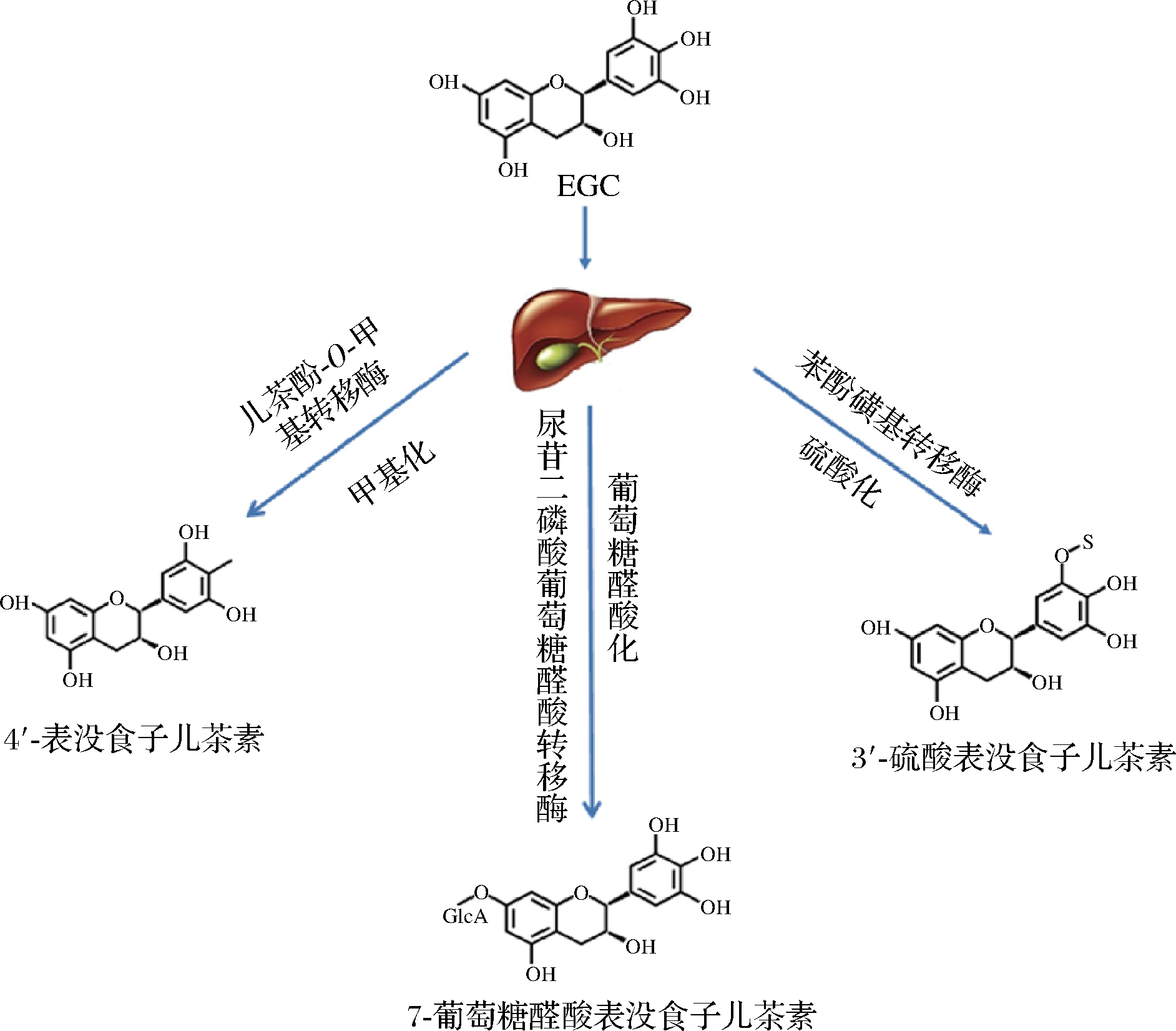
图3 EGC代谢图
Fig.3 Metabolism of EGC
2.3.2 茶多酚在肠道微生物作用下的生物转化
茶多酚在肠道微生物的作用下,首先被水解成各种苷元,然后被进一步代谢成各种芳香酸。在此过程中,黄酮醇主要产生羟基苯乙酸,黄酮和黄烷酮主要产生羟基苯丙酸,黄烷醇主要产生苯戊内酯和羟基苯丙酸,随后,这些酸被进一步代谢为苯甲酸衍生物,如4-羟基苯甲酸、3, 4-二羟基苯甲酸、3-甲氧基-4-羟基-马尿酸等[36]。现有研究表明,经微生物转化产生的茶多酚代谢物可能高于器官和组织产生的代谢物,部分代谢物可能成为评估茶多酚摄入量与人体健康相关性的生物标志物,如3-羟基马尿酸[37]。因此,茶多酚的微生物代谢物具有重要研究意义。
经肠道菌群生物转化后,部分代谢物具有重要生理作用。已有研究表明,羟基苯乙酸可以抑制血小板聚集[38]。动物实验表明,没食子酸、香草酸、丁香酸和原儿茶酸等代谢物能够通过调节线粒体代谢,增强线粒体功能,从而有助于延缓细胞衰老。
此外,茶多酚代谢物能够调节肠道微生物菌群的组成,使菌群数量维持在相对平衡状态,以抑制或减轻由于代谢失衡而引发的相关疾病(如肥胖)的发生[36]。同时,已有研究发现,人体中茶多酚代谢物可通过改善人体特异性肠道有益菌的活性,在防止病原体感染、刺激免疫系统和调节氧化应激等方面发挥着重要作用。比如,茶多酚代谢物能够通过增强肠道中乳酸杆菌、双歧杆菌和拟杆菌等有益微生物活性,进而促进丁酸盐的产生,这种物质具有促进线粒体功能、改善大脑健康、减少结肠炎并预防结肠癌等作用[36]。
3 茶多酚在发酵食品中的应用
茶多酚可从天然来源的茶叶中获取,不含任何具有毒副作用的化学成分,因此具有较大的开发利用价值。目前,茶多酚主要在发酵肉制品、发酵乳制品和谷物发酵产品中应用较多。
3.1 茶多酚在发酵肉制品中的应用
目前,茶多酚在发酵香肠、腊肉、火腿等发酵肉制品中的应用较多。同时,在培根、虾酱等发酵肉制品中也有应用。
一项研究发现,将绿茶茶多酚加入土耳其干发酵香肠之后,香肠中腐胺、酪胺和组胺含量显著降低。其中腐胺平均含量从107.50 mg/kg降低到70.45 mg/kg。酪胺平均含量从99.42 mg/kg降低到64.31 mg/kg。组胺平均含量从255 mg/kg降低到175 mg/kg。此外,与对照组相比,添加茶多酚,香肠中硫代巴比妥酸值也明显降低(从0.95 mg/kg 降低到0.42 mg/kg)。由此可知,茶多酚在提高香肠的抗氧化性和安全性等方面发挥着重要作用[39]。
SIRIPATRAWAN等[40]研究发现,添加茶多酚之后,猪肉香肠的硫代巴比妥酸值也显著低于对照组(P<0.05),表明茶多酚可增强猪肉香肠的抗氧化性。此外,将含有茶多酚的壳聚糖膜用于猪肉香肠包装,发酵20 d时,与未添加茶多酚的猪肉香肠相比,添加茶多酚后,猪肉香肠的菌落总数、酵母菌和霉菌数明显降低,分别从(4 365.16±0.17) CFU/g降至(331.13±0.09) CFU/g、从(109 647.8±0.08) CFU/g降至(1 479.11±0.23) CFU/g。表明茶多酚可以显著抑制金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌等有害微生物的生长。也有将茶多酚(1%)与乳酸链球菌肽(10 000 IU)联合应用于土耳其发酵香肠中的研究,研究发现,在4 ℃和10 ℃下发酵28 d之后,香肠中的单核细胞增生李斯特菌数量显著减少(减少量>100 CFU/g)[41]。
ZHAO等[42]研究了茶多酚对腊肉、香肠和火腿等发酵食品的影响。研究发现,与对照组相比,在腊肉中添加0.1%的茶多酚,能较好地抑制酸价和过氧化值,且使肉色呈色效果更好,利于腊肉保鲜。向鸭肉发酵香肠添加0.3%~0.4%的茶多酚能降低其氧化速度,而且香肠的色泽更好,保质期延长至 88 d(对照组为30 d)。此外,在金华火腿中添加茶多酚之后,火腿脂质氧化、丙二醛等均受到抑制,抑制率分别为21%~29%和52%~68%。此外,茶多酚还能抑制火腿中亚硝酸盐的生成,且对产品的色泽、香气和滋味等感官品质有改善作用。
杂环胺主要是由富含蛋白质的食物(如鱼类和各种肉制品)在热处理过程中产生的有害物质,已被证明具有较高的致突变性和致癌性。目前,已鉴定出超过25种不同类型的杂环胺。研究发现,EGCG能够有效抑制培根中杂环胺的形成,抑制率达55%~70%[43]。在此过程中,EGCG通过与热处理过程中形成的活性羰基物质(如苯乙醛)反应形成复合物,从而阻断了杂环胺的形成途径。
CAI等[44]将茶多酚添加到虾酱(一种虾发酵食品)中,以研究茶多酚对虾酱品质的影响。研究发现,茶多酚对虾酱中的组胺、腐胺、尸胺、2-苯乙胺、色胺和酪胺等生物胺有较好的抑制作用,抑制率分别为63.06%、63.64%、55.48%、58.75%、56.06%和59.79%,说明茶多酚可抑制虾酱中生物胺的产生。此外,添加茶多酚后,虾酱样品的最终硫代巴比妥酸值比对照组降低了23.70%,说明茶多酚可抑制虾酱的脂质氧化。对虾酱挥发性盐基氮检测发现,添加茶多酚之后,该值由178.05 mg N/100g降低到113.02 mg N/100g,表明茶多酚可抑制样品中氨基酸(尤其是蛋氨酸和酪氨酸)的破坏。感官评价发现,添加茶多酚之后,最终产品的亮度值提高(由38.64增加到41.95),说明茶多酚能够较好地提升产品的感官品质。
3.2 茶多酚在发酵乳制品中的应用
ROMERO等[45]研究表明,与对照相比,添加茶多酚能够增强酸奶的硬度、凝聚性和抗氧化能力。进一步模拟消化后,发现酸奶的生物相容性提高,且酸奶本身的色泽和乳酸菌活力不受影响。说明可通过向酸奶中加入茶多酚以开发功能性酸奶食品。已有研究发现,茶多酚能够降低奶酪的水分含量并增强奶酪的凝胶强度。此外,茶多酚还能抑制酪蛋白水解,与对照组相比,添加茶多酚(添加量为2 g/kg)之后,酪蛋白水解率降低了14%~18%。同时,向奶酪中添加茶多酚(添加量分别为125 mg/kg和250 mg/kg)后,在90 d的发酵成熟期内,酸奶的pH值显著降低,由于低pH有利于抑制杂菌生长,说明茶多酚可进一步延长奶酪保质期[46]。RASHIDINEJAD等[47]将EGCG(添加量分别为0.125%、0.25% 和 0.5%)加入低脂奶酪中,发现奶酪的抗氧化性和稳定性增强。
3.3 茶多酚在谷物发酵产品中的应用
丙烯酰胺主要是由富含碳水化合物的食物在热加工过程中产生的一种有害物质,对人体具有潜在的致癌性。研究发现,向饼干模型原料中添加一定浓度的EC(每 100 g面粉添加30 mmol/L),得到的饼干成品中丙烯酰胺明显减少(与对照组相比,减少了10.3%~19.2%)[48]。这主要是由于EC的C环中含有3-羟基结构,这种结构能够与形成丙烯酰胺的前体物质反应,从而抑制了丙烯酰胺的形成[49]。此外,向饼干模型中添加0.25%(质量分数)的EC,也能显着降低晚期糖基化终产物——Ne-(羧甲基)赖氨酸的含量(抑制率为31.8%~87.6%)[50]。
4 结论与展望
本文主要对茶多酚及其在发酵食品中的应用现状进行了综述,研究发现,茶多酚在发酵肉制品中的研究最多,此外也有在发酵乳制品和谷物发酵食品中的应用研究。在发酵肉制品中,茶多酚对于生物胺(主要包括腐胺、酪胺、组胺和尸胺)、杂环胺和丙二醛等有害物质均有很好的抑制效果,抑制率分别为31.37%~63.64%、55%~70%和52%~68%。同时,茶多酚还能通过降低油脂酸价、过氧化值、硫代巴比妥酸值和挥发性盐基氮等含量,抑制发酵肉制品脂质氧化和蛋白质水解,从而提升产品的色泽、口感、香气和营养价值,并延长产品保质期。茶多酚能够降低发酵乳制品中蛋白质水解、增强乳制品的抗氧化性和稳定性并提升乳制品的营养价值。此外,茶多酚能够抑制发酵谷物产品中的丙烯酰胺和晚期糖基化终产物的产生,提升食品的安全性。通过对发酵食品中茶多酚的研究分析认为后续可进一步开展以下研究:
(1)目前的研究已经表明,茶多酚对生物胺、杂环胺、丙二醛、丙烯酰胺、晚期糖基化终产物以及脂质氧化均有较好抑制作用,这些有害物质在高蛋白、高碳水化合物和高脂食品中经常出现,而这三大类食物是我们日常生活中的主要饮食来源。因此,后续需进一步开展茶多酚在肉制品、乳制品、豆制品、蛋制品、鱼产品、焙烤食品和油炸食品等食品中的相关研究,以提高食品安全性。
(2)目前,虽有较多关于茶多酚在发酵食品中的应用研究,但缺乏对于有害物质的抑制规律和抑制机理的研究。因此,后续需继续开展相关研究,以期为实际生产生活中茶多酚在发酵食品中有害物质的控制提供理论支撑。
(3)现有研究中,茶多酚主要来源于绿茶,而鲜有关于其他类型的茶中多酚的研究,后续可开展不同来源茶多酚在发酵食品品质控制中的研究。通过对比分析不同来源茶多酚对发酵食品品质的调控规律,以找到针对不同发酵食品品质调控的最适来源的茶多酚。
[1] DIMIDIE, COX S R, ROSSI M, et al.Fermented foods:Definitions and characteristics, impact on the gut microbiota and effects on gastrointestinal health and disease[J].Nutrients, 2019, 11(8):1 806.
[2] REZAC S, KOK C R, HEERMANN M, et al.Fermented foods as a dietary source of live organisms[J].Frontiers in Microbiology, 2018, 9:1 785.
[3] TALLEI T E, FATIMAWALI, NIODE N J, et al.A Comprehensive review of the potential use of green tea polyphenols in the management of COVID-19[J].Evidence-Based Complementary and Alternative Medicine, 2021, 2021:7170736.
[4] VENKATAKRISHNAN K, CHIU H F, CHENG J C, et al.Comparative studies on the hypolipidemic, antioxidant and hepatoprotective activities of catechin-enriched green and oolong tea in a double-blind clinical trial[J].Food and Function, 2018, 9(2):1 205-1 213.
[5] WU Q, ZHOU J.The application of polyphenols in food preservation[J].Advances in Food and Nutrition Research, 2021, 98:35-99.
[6] SIVAMARUTHI B S, KESIKA P, PRASANTH M I, et al.A mini review on antidiabetic properties of fermented foods[J].Nutrients, 2018, 10(12):1 973.
[7] MAKI R, MATSUKAWA M, MATSUDUKA A, et al.Therapeutic effect of lyophilized, Kefir-fermented milk on constipation among persons with mental and physical disabilities[J].Japan Journal of Nursing Science, 2018, 15(3):218-225.
[8] VILLARREAL-SOTO S A, BEAUFORT S, BOUAJILA J, et al.Understanding kombucha tea fermentation:A review[J].Journal of Food Science, 2018, 83(3):580-588.
[9] GAGG A F, BAFFONI L, GALIANO M, et al.Kombucha beverage from green, black and rooibos teas:A comparative study looking at microbiology, chemistry and antioxidant activity[J].Nutrients, 2018, 11(1):1.
A F, BAFFONI L, GALIANO M, et al.Kombucha beverage from green, black and rooibos teas:A comparative study looking at microbiology, chemistry and antioxidant activity[J].Nutrients, 2018, 11(1):1.
[10] CAO Z H, GREEN-JOHNSON J M, BUCKLEY N D, et al.Bioactivity of soy-based fermented foods:A review[J].Biotechnology Advances, 2019, 37(1):223-238.
[11] MANO F, IKEDA K, SATO T, et al.Reduction in gastroesophageal reflux disease symptoms is associated with miso soup intake in a population-based cross-sectional study:The nagahama study[J].Journal of Nutritional Science and Vitaminology, 2018, 64(5):367-373.
[12] PARLINDUNGAN E, LUGLI G A, VENTURA M, et al.Lactic acid bacteria diversity and characterization of probiotic candidates in fermented meats[J].Foods(Basel,Switzerland), 2021, 10(7):1 519.
[13] SHA S P, SURYAVANSHI M V, TAMANG J P.Mycobiome diversity in traditionally prepared starters for alcoholic beverages in india by high-throughput sequencing method[J].Frontiers in Microbiology, 2019, 10:348.
[14] DIMOPOULOU M, DOLS-LAFARGUE M.Exopolysaccharides producing lactic acid bacteria in wine and other fermented beverages:For better or for worse?[J].Foods(Basel,Switzerland), 2021, 10(9):2 204.
[15] 陈露, 尹礼国, 朱文优, 等.泡菜中生物胺污染及控制方法研究进展[J].食品与发酵工业, 2022, 48(11):303-309;323.
CHEN L, YIN L G, ZHU W Y, et al, Review on the contamination of biogenic amines and its control methods in pickle[J].Food and Fermentation Industries, 2022, 48(11):303-309;323.
[16] LINARES D M, G MEZ C, RENES E, et al.Lactic acid bacteria and bifidobacteria with potential to design natural biofunctional health-promoting dairy foods[J].Frontiers in Microbiology, 2017, 8:846-856.
MEZ C, RENES E, et al.Lactic acid bacteria and bifidobacteria with potential to design natural biofunctional health-promoting dairy foods[J].Frontiers in Microbiology, 2017, 8:846-856.
[17]  ANLIER N, GÖKCEN B B, SEZGIN A C.Health benefits of fermented foods[J].Critical Reviews in Food Science and Nutrition, 2019, 59(3):506-527.
ANLIER N, GÖKCEN B B, SEZGIN A C.Health benefits of fermented foods[J].Critical Reviews in Food Science and Nutrition, 2019, 59(3):506-527.
[18] GILLE D, SCHMID A, WALTHER B, et al.Fermented food and non-communicable chronic diseases:A Review[J].Nutrients, 2018, 10(4):448.
[19] BAG S, MONDAL A, MAJUMDER A, et al.Tea and its phytochemicals:Hidden health benefits & modulation of signaling cascade by phytochemicals[J].Food Chemistry, 2022, 371:131098.
[20] WANG S Z, ZENG T, ZHAO S, et al.Multifunctional health-promoting effects of oolong tea and its products[J].Food Science and Human Wellness, 2022, 11(3):512-523.
[21] HE H F, WEI K, YIN J F, et al.Insight into tea flavonoids:Composition and chemistry[J].Food Reviews International, 2021, 37(8):812-823.
[22] TANG G Y, MENG X, GAN R Y, et al.Health functions and related molecular mechanisms of tea components:An update review[J].International Journal of Molecular Sciences, 2019, 20(24):6 196.
[23] ZHANG Z H.Advances in research on interactions between polyphenols and biology-based nano-delivery systems and their applications in improving the bioavailability of polyphenols[J].Trends in Food Science and Technology, 2021, 116:492-500.
[24] PAGET C, TROTTEIN F.Mechanisms of bacterial superinfection post-influenza:A role for unconventional T cells[J].Frontiers in Immunology, 2019, 10:336-346.
[25] NAKAYAMA M, SHIMATANI K, OZAWA T, et al.Mechanism for the antibacterial action of epigallocatechin gallate (EGCG) on Bacillus subtilis[J].Bioscience, Biotechnology, and Biochemistry, 2015, 79(5):845-854.
[26] LEE P.Effects of epigallocatechin gallate against Enterococcus faecalis biofilm and virulence[J].Archives of Oral Biology, 2015, 60(3):393-399.
[27] PRADHAN P, NGUYEN M L.Herpes simplex virus virucidal activity of MST-312 and epigallocatechin gallate[J].Virus Research, 2018, 249:93-98.
[28] RAEKIANSYAH M, BUERANO C C, LUZ M A D, et al.Inhibitory effect of the green tea molecule EGCG against dengue virus infection[J].Archives of Virology, 2018, 163(6):1 649-1 655.
[29] BEN LAGHA A, GRENIER D.Black tea theaflavins attenuate Porphyromonas gingivalis virulence properties, modulate gingival keratinocyte tight junction integrity and exert anti-inflammatory activity[J].Journal of Periodontal Research, 2017, 52(3):458-470.
[30] LIU L X, WU X Q, ZHANG B C, et al.Protective effects of tea polyphenols on exhaustive exercise-induced fatigue, inflammation and tissue damage[J].Food and Nutrition Research, 2017, 61(1):1333390.
[31] LAKSHMI S P, REDDY A T, KODIDHELA L D, et al.The tea catechin epigallocatechin gallate inhibits NF-κB-mediated transcriptional activation by covalent modification[J].Archives of Biochemistry and Biophysics, 2020, 695:108620.
[32] MENG J M, CAO S Y, WEI X L, et al.Effects and mechanisms of tea for the prevention and management of diabetes mellitus and diabetic complications:An updated review[J].Antioxidants(Basel,Switzerland), 2019, 8(6):170.
[33] MA Q H, CHEN D D,SUN H P, et al.Regular Chinese green tea consumption is protective for diabetic retinopathy:A clinic-based case-control study[J].Journal of Diabetes Research, 2015, 2015:231570.
[34] MAITI S, NAZMEEN A, MEDDA N, et al.Flavonoids green tea against oxidant stress and inflammation with related human diseases[J].Clinical Nutrition Experimental, 2019, 24:1-14.
[35] IMRAN A, BUTT M S, ARSHAD M S, et al.Exploring the potential of black tea based flavonoids against hyperlipidemia related disorders[J].Lipids in Health and Disease, 2018, 17(1):57.
[36] RAJHA H N, PAULE A, ARAGON S G, et al.Recent advances in research on polyphenols:Effects on microbiota, metabolism, and health[J].Molecular Nutrition and Food Research, 2022, 66(1):2100670.
S G, et al.Recent advances in research on polyphenols:Effects on microbiota, metabolism, and health[J].Molecular Nutrition and Food Research, 2022, 66(1):2100670.
[37] MANACH C, SCALBERT A, MORAND C, et al.Polyphenols:Food sources and bioavailability[J].The American Journal of Clinical Nutrition,2004,79(5):727-747.
[38] LI Y Y, GAO X, LOU Y J.Interactions of tea polyphenols with intestinal microbiota and their implication for cellular signal conditioning mechanism[J].Journal of Food Biochemistry,2019, 43(8):e12953.
[39] BOZKURT H.Utilization of natural antioxidants:Green tea extract and Thymbra spicata oil in Turkish dry-fermented sausage[J].Meat Science, 2006, 73(3):442-450.
[40] SIRIPATRAWAN U, NOIPHA S.Active film from chitosan incorporating green tea extract for shelf life extension of pork sausages[J].Food Hydrocolloids, 2012, 27(1):102-108.
[41] PERUMALLA A V S, HETTIARACHCHY N S.Green tea and grape seed extracts — Potential applications in food safety and quality[J].Food Research International, 2011, 44(4):827-839.
[42] ZHAO L, ZHOU T, YAN F F, et al.Synergistic inhibitory effects of procyanidin B2 and catechin on acrylamide in food matrix[J].Food Chemistry, 2019, 296:94-99.
[43] ZHU Q, ZHANG S, WANG M F, et al.Inhibitory effects of selected dietary flavonoids on the formation of total heterocyclic amines and 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) in roast beef patties and in chemical models[J].Food and Function, 2016, 7(2):1 057-1 066.
[44] CAI L Y, LIU S C, SUN L J, et al.Application of tea polyphenols in combination with 6-gingerol on shrimp paste of during storage:Biogenic amines formation and quality determination[J].Frontiers in Microbiology, 2015, 16(6):981-989.
[45] MEDIZA ROMERO M L, VON STASZEWSKI M, MART NEZ M J.The effect of green tea polyphenols addition on the physicochemical, microbiological and bioactive characteristics of yogurt[J].British Food Journal, 2021, 123(7):2 380-2 397.
NEZ M J.The effect of green tea polyphenols addition on the physicochemical, microbiological and bioactive characteristics of yogurt[J].British Food Journal, 2021, 123(7):2 380-2 397.
[46] CUTRIM C S, CORTEZ M A S.A review on polyphenols:Classification, beneficial effects and their application in dairy products[J].International Journal of Dairy Technology, 2018, 71(3):564-578.
[47] RASHIDINEJAD A, BIRCH E J, SUN-WATERHOUSE D, et al.Delivery of green tea catechin and epigallocatechin gallate in liposomes incorporated into low-fat hard cheese[J].Food Chemistry, 2014, 156:176-183.
[48] TENG J, HU X Q, TAO N P, et al.Impact and inhibitory mechanism of phenolic compounds on the formation of toxic Maillard reaction products in food[J].Frontiers of Agricultural Science and Engineering, 2018, 5(3):321-329.
[49] TENG J, HU X Q, TAO N P, et al.Structure-guided unravelling:Phenolic hydroxyls contribute to reduction of acrylamide using multiplex quantitative structure-activity relationship modelling[J].Food Chemistry, 2016, 199:492-501.
[50] MILDNER-SZKUDLARZ S, SINGER A, SZWENGIEL A, et al.Phenolic compounds reduce formation of Nε-(carboxymethyl)lysine and pyrazines formed by Maillard reactions in a model bread system[J].Food Chemistry, 2017, 231:175-184.