鞣花酸(ellagic acid,EA)是一种广泛分布于石榴、蓝莓等水果和核桃等坚果、以及茶和多种药用植物中的天然多酚类化合物[1],研究显示其具有抗氧化、抗炎、抗癌、抗衰老及神经保护等多种生物活性[2]。但是,鞣花酸有益于人体健康的临床研究结果并不一致。欧洲食品安全局(European Food Safety Authority, EFSA)曾刊文认为,摄入富含鞣花酸的石榴与其声称的健康益处之间没有因果关系。研究显示,鞣花酸生物利用度极低,在血液及组织中往往不能达到其发挥生物活性的有效浓度[3]。不被吸收的鞣花酸到达结肠后会被肠道菌群代谢转化生成尿石素A和尿石素 B等尿石素类物质[4]。尿石素类物质被证实亦有抗氧化[5]、抗炎症[6]和抗衰老[7]等多种生物活性,因此,越来越多的实验聚焦于其肠道菌群代谢物尿石素类物质,认为其是鞣花酸在体内发挥其健康作用的物质基础[8]。但是,由于个体肠道菌群组成的差异,摄入鞣花酸后生成尿石素类物质种类和数量存在显著差异[9],这可能是人群摄入富含鞣花酸的食品后临床健康效果存在较大差异的原因之一。
研究人员根据摄入鞣花酸后产生的尿石素类物质的定性分析,将人群分为3种尿石素代谢型,即尿石素代谢型A(只生成尿石素A,urolithin metabotype A,UM-A)、尿石素代谢型B(除了尿石素A 外,还生成尿石素B/异尿石素A,urolithin metabotype B,UM-B)和 尿石素代谢型0(不生成尿石素类物质,urolithin metabotype 0,UM-0)[10]。不同种类的尿石素生物活性存在显著差异,研究证明,尿石素A相比于尿石素B和异尿石素A具有更好的抗氧化[11]、抗炎症活性[12],比其母体化合物鞣花酸具有更高的生物利用度[13]。因此,开展鞣花酸在UM-A型肠道菌群代谢途径转化过程研究,分析参与鞣花酸代谢转化生成尿石素A的关键细菌类群,以及鞣花酸对UM-A型肠道菌群的调节作用,对于认识鞣花酸的健康作用具有重要意义。
本实验采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(UPLC-Q-Exactive Orbitrap/MS)检测UM-A型菌群体外代谢鞣花酸生成尿石素A过程中主要转化产物及含量,分析其代谢规律,通过16S rRNA检测菌群变化,分析鞣花酸对UM-A肠道菌群结构的影响。
1 材料与方法
1.1 材料与试剂
鞣花酸胶囊(鞣花酸含量≥40%),德国Sanct Bernhard;鞣花酸(纯度≥ 99%),上海泰坦科技股份有限公司;尿石素A(纯度≥99%),Sigma-Aldrich公司;尿石素C(纯度≥98%),四川省维克奇生物技术有限公司;甲酸 (质谱级)、乙腈(质谱级),美国Supelco公司;BHI肉汤培养基,广东环凯微生物科技有限公司;L-半胱氨酸盐酸盐(纯度≥99%),MYM生物科技有限公司;乙酸乙酯(分析纯),天津市大茂化学试剂厂;粪便基因组DNA试剂盒(生物试剂),天根生化科技(北京)有限公司。
1.2 仪器与设备
UPLC-Q-E-MS/MS,美国Thermo公司;5810R台式冷冻离心机,德国Eppendorf公司;AW500SG厌氧工作站,英国伊莱泰科公司。
1.3 试验方法
1.3.1 UM-A型肠道菌群的制备
使用无菌管收集鞣花酸代谢型为A型的志愿者的粪便,要求志愿者至少3个月未服用过抗生素相关药物,且无肠胃病史。志愿者均签署书面知情同意书。在厌氧条件下把粪便转移至离心管中,按1∶3.6(g∶mL)加入磷酸盐缓冲溶液,过滤后,加入10%甘油,最终粪便按1∶4(g∶mL)的比例被稀释,分装后存于-80 ℃ 冷冻备用。
1.3.2 鞣花酸体外代谢实验
称取7.4 g粉末BHI脑心浸液培养基加入200 mL水稀释搅至完全溶解,每管8 mL分装至离心管,灭菌后转至厌氧工作站备用。取1 mL粪菌悬液接种于BHI培养基的离心管中,再加入1 mL鞣花酸质量浓度为300 μg/mL的含0.5%半胱氨酸盐酸盐的BHI培养基,即鞣花酸终质量浓度为30 μg/mL,培养条件为37 ℃,N2/CO2/H2的比例为80/15/5分别于培养0、24、48、72 h后取样检测,用等体积含1.5%甲酸的乙酸乙酯灭活萃取,涡旋,合并上清液,氮吹,沉淀用300 μL含15%二甲基亚砜的甲醇溶液复溶,定容,0.22 μm聚四氟乙烯滤器过滤,于4 ℃冷藏待测。
1.3.3 代谢物的鉴定
采用UPLC-Q-Exactive Orbitrap/M对代谢物进行定性定量检测。质谱条件如下:ACQUITY UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm,Waters,Milford,MA),柱温40 ℃,流动相A和B分别为milli-Q水(1‰甲酸)和乙腈(1‰甲酸),流速0.3 mL/min,进样体积为5 μL。梯度洗脱如下:0~3 min 95%~85% A,3~11 min 85%~70% A,11~15 min 70%~50% A,15~21 min 50%~10% A,21~22 min 10%~95% A。UPLC-Q-Exactive Orbitrap/MS以电喷雾离子化(electrospray ionization, ESI)源在负离子模式下进行定性和定量分析。质谱实验在以下条件下进行:干燥气体(N2)30 arb;辅助气体(N2)10 arb;毛细电压3 200 V;毛细管温度320 ℃;扫描范围100~1 500 m/z。利用保留时间、一级质谱信息、二级碎片离子信息和峰面积外标法对代谢物进行定性定量分析。
1.3.4 16S rRNA高通量测序检测肠道菌群
根据TIANamp Stool DNA Kit 粪便基因组DNA提取试剂盒说明书的步骤和方法抽提总DNA,V3~V4可变区进行PCR扩增。构建文库后通过Illumina HiSeq 平台进行测序[14]。总DNA提取、PCR 扩增及Illumina HiSeq测序均委托上海美吉生物医药科技有限公司协助完成。
1.3.5 数据处理
所有样品平行测定3次,数据表示为平均值±标准差(mean±SD),使用SPSS 24.0软件进行统计学分析,P≤0.05表示结果具有统计学差异。
2 结果与分析
2.1 鞣花酸在UM-A型人肠道菌群中体外转化产物分析
采用UPLC-Q-Exactive Orbitrap/MS分析鞣花酸在UM-A型人肠道菌群中体外转化的产物及途径。表1为负离子模式下二级质谱碎片信息,结合保留时间和二级质谱碎片离子特征,推测其代谢产物结构。鞣花酸在UM-A型人肠道菌群中体外转化0、24、72 h的总离子流图如图1所示。与0 h比较,在转化24 h时,检测到4个代谢产物,其中峰2代谢物 m/z 260.028 1,通过文献对比和碎片离子信息匹配,证实其为尿石素M6;峰3代谢物 m/z 244.082 2,与尿石素M6母离子相差16,推测峰3代谢物可能是尿石素M6在C环上损失1分子羟基得到的,其碎片离子信息与标准品尿石素C一致,鉴定其为尿石素C;峰4代谢物 m/z 275.014 8,与鞣花酸母离子m/z 300.998 9相差26,推测峰4有可能是鞣花酸先水解再经脱羧后得到的产物;峰5代谢物 m/z 227.034 3与尿石素C母离子相差16,推测其可能是尿石素C丢失1分子羟基得到的,通过与标准品碎片离子信息比对,鉴定其为尿石素A。推测鞣花酸的转化路径为EA→未知→UroM6→UroC→UroA,尿石素A为最终代谢产物[15]。
表1 鞣花酸在UM-A型人肠道菌群体外转化的MS/MS数据
Table 1 MS/MS data of EA and transformation products in UM-A human intestinal flora metabolism in vitro
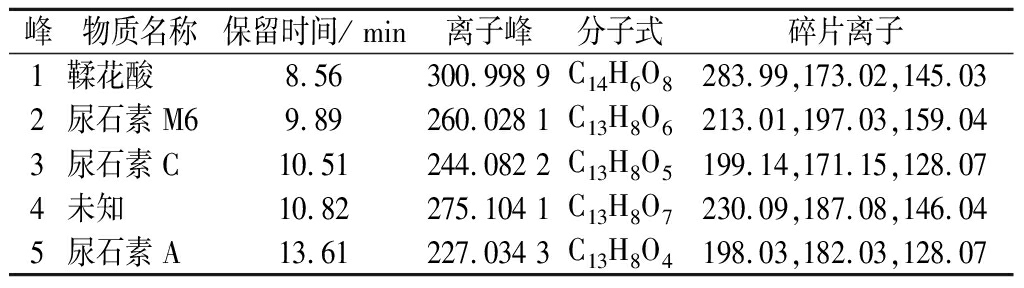
峰物质名称保留时间/ min离子峰分子式碎片离子1鞣花酸8.56300.998 9C14H6O8283.99,173.02,145.032尿石素M69.89260.028 1C13H8O6213.01,197.03,159.043尿石素C10.51244.082 2C13H8O5199.14,171.15,128.074未知10.82275.104 1C13H8O7230.09,187.08,146.045尿石素A13.61227.034 3C13H8O4198.03,182.03,128.07
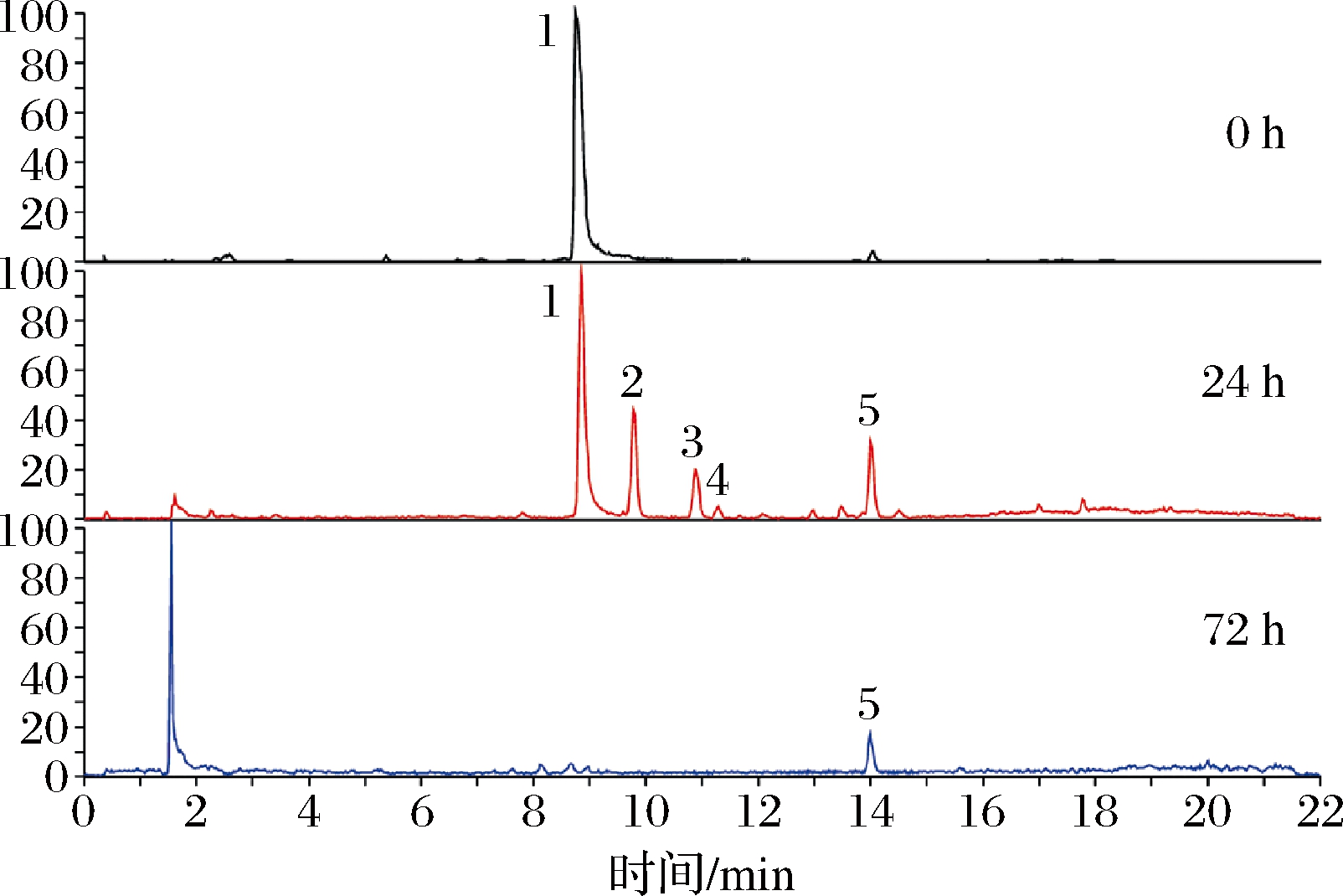
1-鞣花酸;2-尿石素M6;3-尿石素C;4-未知;5-尿石素A
图1 鞣花酸在UM-A型人肠道菌群中体外转化 0、24、72 h总离子流图
Fig.1 Total ion chromatograms of EA metabolites at 0, 24, 72 h incubation with UM-A human gut microbiota
UM-A菌群体外代谢过程的鞣花酸及代谢物含量变化如图2所示。鞣花酸在24 h内被迅速代谢,并在后续24~72 h缓慢减少,鞣花酸作为代谢底物,其消耗速率也与尿石素A的生成速率相似。尿石素A含量在0~24 h内快速增长,在24 h含量为 (4.86±0.48) μg/mL,随后在24~72 h缓慢升高。尿石素M6含量在24 h时最高,为 (2.05±0.43) μg/mL,在后续24~72 h含量缓慢减少,推测在体外代谢过程中鞣花酸会快速被UM-A菌群代谢成为尿石素M6[16],随后继续转化生成尿石素C。尿石素C含量在体外代谢过程中始终低于0.30 μg/mL,可能是尿石素C作为鞣花酸代谢过程的中间体,在体外被快速进一步代谢为尿石素A,因此能检测到的尿石素C含量较低。
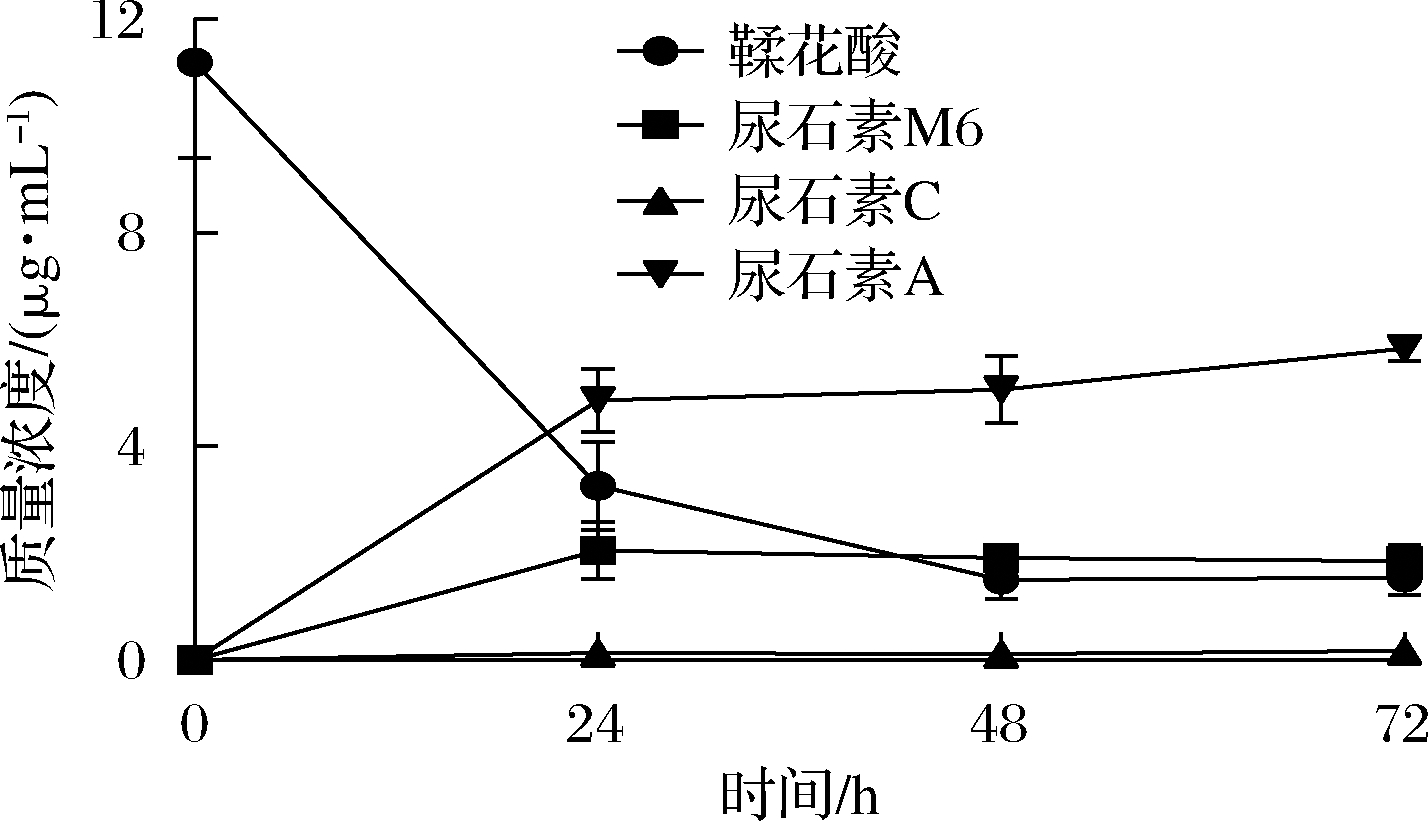
图2 鞣花酸及其转化产物含量随时间变化曲线
Fig.2 Time-concentration curve of EA and transformed products
2.2 鞣花酸对UM-A型肠道菌群结构的影响
2.2.1 肠道菌群α多样性
如图3所示,各组样本的coverage指数均大于0.999,说明此次测序结果真实可靠。鞣花酸对UM-A菌群丰富度(chao指数)无显著影响(P>0.05)。

A-coverage指数;B-chao指数
图3 菌群α多样性
Fig.3 Alpha diversity index
2.2.2 肠道菌群主坐标分析(principal co-ordinates analysis,PCoA)
采用PCoA分析样本在操作分类单元(operational taxonomic units,OTU)水平上微生物群落结构的总体差异(图4),其中第一成分贡献率为95.67%,第二成分的贡献率为2.37%,共同预测了98.10%的样本数据。同一时间点的数据样本分布比较密集,可知此次实验所取的菌群样本较为均匀及稳定。鞣花酸在UM-A菌群体外代谢后,鞣花酸组与空白组的距离较远,说明鞣花酸的代谢对微生物群落产生显著影响。
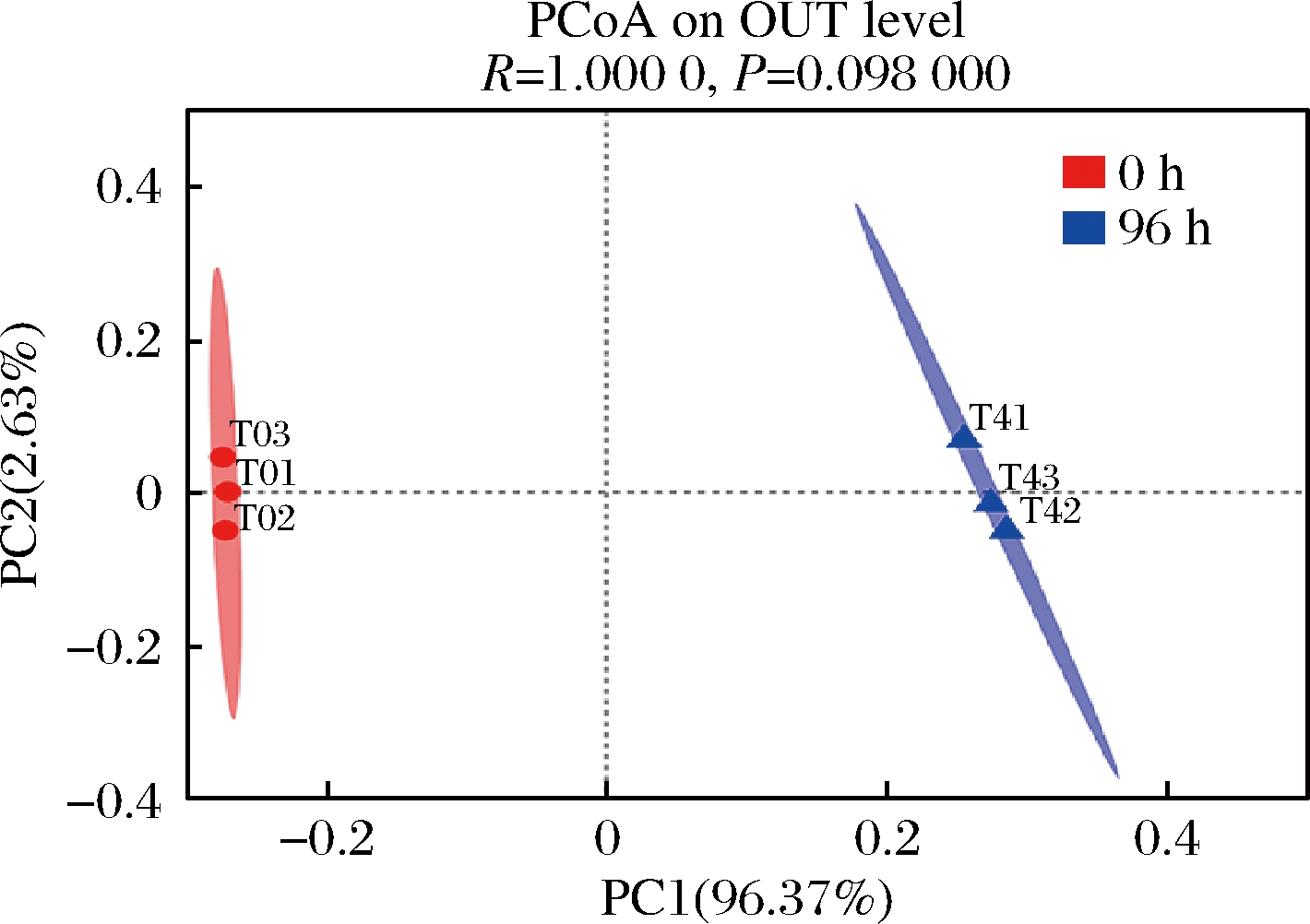
图4 肠道菌群PCoA
Fig.4 Principal co-ordinates analysis of gut microbiota
2.2.3 在门、属水平上肠道菌群结构组成分析
如图5-A所示,在门水平上,对照组厚壁菌门、拟杆菌门、放线菌门与变形菌门是优势菌门,其相对丰度分别为65.43%、31.63%、1.50%和0.72%。鞣花酸组厚壁菌门的相对丰度升高,拟杆菌门、放线菌门和变形菌门的相对丰度下降。ROCIO等[17]在鞣花酸体外胃肠道模拟实验中也发现了相似的现象,随着鞣花酸的代谢,在不同部位的结肠模拟罐中的厚壁菌门也有一定的上升趋势,同时拟杆菌门也出现下降的趋势。图5-B所示,在属水平上共有96个菌属被检测出,其中相对丰度较高的菌属包括拟杆菌属(Bacteroides)、粪杆菌属(Faecalibacterium)、粪球菌属(Coprococcus)、丁酸弧菌属(Anaerostipes)、多尔氏菌属(Dorea)、布劳特氏菌属(Blautia)、毛螺杆菌属(Lachnospira)、瘤胃球菌属(Ruminococcus)、罗斯氏菌属(Roseburia)、直肠真杆菌属(Agathobacter)等。此外,黄杆菌属(Flavonifractor)、产丁酸杆菌属(Intestinimonas)、迟缓埃格特菌属(Eggerthella)在鞣花酸组中相对丰度出现显著性上升。与对照组相比,鞣花酸组Coprococcus的相对丰度极显著升高(P<0.001)(图6-A),由2.16%升高至23.16%,Coprococcus能发酵碳水化合物,同时产生细菌素等抑菌物质保护肠道健康、增强胃肠道机能降低炎症水平。肠道有益菌属Anaerostipes在鞣花酸组相对丰度极显著上调(P<0.001)(图6-B),相对丰度由5.44%升高至8.90%。Anaerostipes可产生对人体有益的丁酸盐[18],参与肠屏障功能调节和免疫调控。“降解抗性淀粉的关键菌” Ruminococcus相对丰度由1.06%上升至3.53%(图6-C),大量研究表明瘤胃球菌能有效地分解如细胞壁等坚硬的植物物质,具有稳定肠道屏障、逆转腹泻、降低结直肠癌风险等作用。GU等[19]研究发现, 瘤胃球菌科是小鼠大肠和粪便中的优势菌群, 与本试验的结果相似。Lachnospira相对丰度由3.38%升至4.29%(图6-D),Lachnospira具有发酵碳水化合物的特点,对宿主健康维护具有重要的促进作用。Flavonifractor相对丰度出现显著性上升,由0.03%升至0.5%(图6-E),研究发现粪便中Flavonifractor丰度的变化与粪中戊酸含量的变化呈正相关[20]。Intestinimonas相对丰度由0.02%上升至0.04%(图6-F),Intestinimonas是一种产丁酸细菌,研究发现患有慢性肾病或炎症性肠病的患者粪便中其丰度显著低于健康人[21],JIANG等[22] 提出可以将R.intestinalis作为慢性肾病检测的“微生物标志物”,并且R.intestinalis可以调节抗炎转录信号和转录激活因子的表达,减少结肠中炎性巨噬细胞和Th17细胞的数量,改善炎症性肠病。被证实能把鞣花酸代谢为尿石素类物质的Eggerthella[23]相对丰度由0.073%上升至0.47%(图6-G),出现极显著性升高,推测Eggerthella可能是参与鞣花酸生物转化为尿石素A的关键肠道菌之一。日本株式会社大赛璐在专利中报道Eggerthella具有高的尿石素类物质产生能力[24]。本研究结果显示鞣花酸能够调节肠道微生物菌群结构,促进潜在有益菌的增殖,同时富集代谢转化自身生成尿石素的细菌类群。

A-门水平;B-属水平
图5 鞣花酸代谢过程中UM-A肠道菌群的变化
Fig.5 Composition of gut microbiota during metabolism of EA in vitro
2.2.4 鞣花酸对UM-A菌群KEGG代谢通路的影响
如图7所示,功能预测分析发现鞣花酸组与对照组有182条通路有显著性差异(P≤0.05)。与对照组相比,鞣花酸组25条通路极显著下调,包括脂多糖生物合成蛋白、脂肪细胞因子信号通路、蛋白质消化吸收、碳水化合物消化吸收等代谢通路,7条通路极显著上调,包括RIG-I样受体信号通路、金黄色葡萄球菌感染以及电子转移载体等代谢通路。KANG等[25]发现,鞣花酸能够通过肠道微生物能够调控脂肪代谢,对高糖高脂饮食导致的血脂异常有明显的改善作用,达到预防肥胖的效果。菌群代谢通路基因预测分析,表明鞣花酸的摄入可能通过影响肠道菌群代谢进而发挥对机体的健康作用。

A-粪球菌属;B-丁酸弧菌属;C-瘤胃球菌属;D-毛螺杆菌属;E-黄杆菌属;F-产丁酸杆菌属;G-迟缓埃格特菌属
图6 鞣花酸影响的主要菌属的相对丰度变化
Fig.6 Relative abundance of major genera changed by EA 注:*表示P≤0.05;**表示P≤0.01;***表示P≤0.001;****表示P<0.000 1
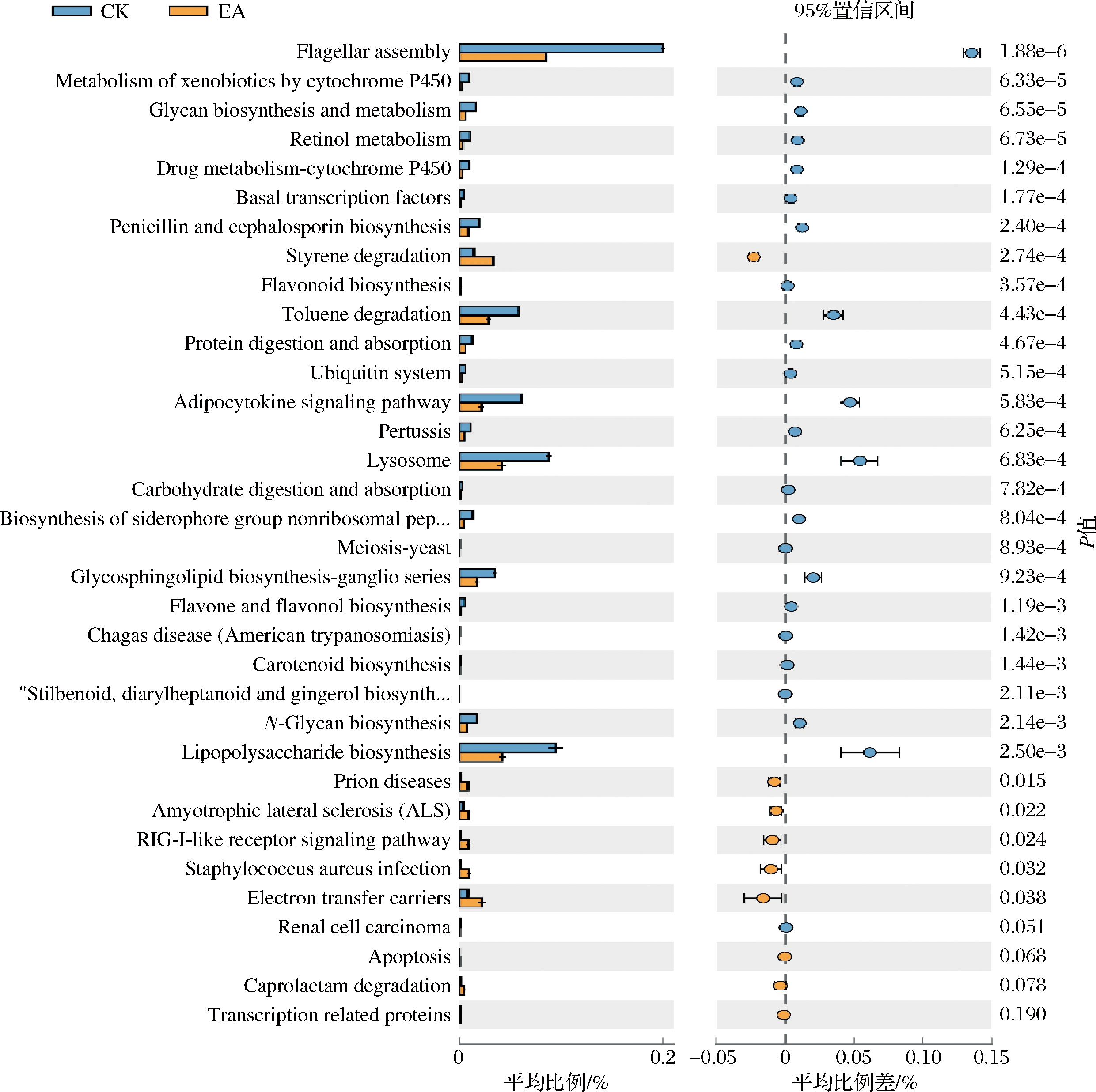
图7 鞣花酸对UM-A菌群KEGG代谢通路的影响
Fig.7 Effect of EA on the related KEGG signaling pathway in UM-A gut microbiota
3 结论
本研究利用UPLC-Q-TOF/MS 分析鞣花酸在UM-A型人肠道菌群中体外代谢转化途径,同时结合16S rRNA高通量测序技术分析鞣花酸对肠道菌群组成及代谢通路的影响。结果表明,鞣花酸在UM-A型人肠道菌群中体外转化过程中,主要产物为尿石素M6,尿石素C、尿石素A;推测鞣花酸转化路径为EA→未知→UroM6→UroC→UroA,尿石素A为最终代谢产物。鞣花酸能促进丁酸弧菌(Anaerostipes)、粪球菌属(Coprococcus)、产丁酸杆菌属(Intestinimonas)等肠道潜在益生菌生长。通过肠道菌群基因功能注释KEGG 通路的差异性分析,鞣花酸可能通过调节UM-A菌群脂多糖生物合成蛋白、脂肪细胞因子信号通路、RIG-I样受体信号通路、以及蛋白质和碳水化合物消化吸收等代谢通路等影响机体代谢。
[1] YANG S Y, ZHANG Y Y, LI W, et al.Gut microbiota composition affects procyanidin A2-attenuated atherosclerosis in ApoE-/- mice by modulating the bioavailability of its microbial metabolites[J].Journal of Agricultural and Food Chemistry, 2021,69(25):6 989-6 999.
[2] TOM S-BARBER
S-BARBER N F A, GONZ
N F A, GONZ LEZ-SARR
LEZ-SARR AS A, GARC
AS A, GARC A-VILLALBA R, et al.Urolithins, the rescue of “old” metabolites to understand a “new” concept:Metabotype as a nexus among phenolic metabolism, microbiota dysbiosis, and host health status[J].Molecular Nutrition & Food Research, 2017,61(1):1500901.
A-VILLALBA R, et al.Urolithins, the rescue of “old” metabolites to understand a “new” concept:Metabotype as a nexus among phenolic metabolism, microbiota dysbiosis, and host health status[J].Molecular Nutrition & Food Research, 2017,61(1):1500901.
[3] CERD B, LLORACH R, CER
B, LLORACH R, CER N J J, et al.Evaluation of the bioavailability and metabolism in the rat of punicalagin, an antioxidant polyphenol from pomegranate juice[J].European Journal of Nutrition, 2003.42(1):18-28.
N J J, et al.Evaluation of the bioavailability and metabolism in the rat of punicalagin, an antioxidant polyphenol from pomegranate juice[J].European Journal of Nutrition, 2003.42(1):18-28.
[4] MAR L, MARIA T G, JUAN C E, et al.Ellagitannins, ellagic acid and vascular health[J].Molecular Aspects of Medicine, 2010,31(6):513-539.
[5] DJEDJIBEGOVIC J, MARJANOVIC A, PANIERI E, et al.Ellagic acid-derived urolithins as modulators of oxidative stress[J].Oxidative Medicine and Cellular Longevity,2020,2020:5194508.
[6] GIMÉNEZ-BASTIDA J A, GONZ LEZ-SARR
LEZ-SARR AS A, LARROSA M, et al.Ellagitannin metabolites, urolithin A glucuronide and its aglycone urolithin A, ameliorate TNF-alpha-induced inflammation and associated molecular markers in human aortic endothelial cells[J].Molecular Nutrition and Food Research,2012,56(5):784-796.
AS A, LARROSA M, et al.Ellagitannin metabolites, urolithin A glucuronide and its aglycone urolithin A, ameliorate TNF-alpha-induced inflammation and associated molecular markers in human aortic endothelial cells[J].Molecular Nutrition and Food Research,2012,56(5):784-796.
[7] RYU D, MOUCHIROUD L, ANDREUX P A, et al.Urolithin A induces mitophagy and prolongs lifespan in C-elegans and increases muscle function in rodents[J].Nature Medicine,2016,22(8):879-888.
[8] XIAN W Y, YANG S Y, DENG Y, et al.Distribution of urolithins metabotypes in healthy chinese youth:Difference in gut microbiota and predicted metabolic pathways[J].Journal of Agricultural and Food Chemistry, 2021,69(44):13 055-13 065.
[9] SELMA M V, TOM S-BARBER
S-BARBER N F A, BELTR
N F A, BELTR N D, et al. Gordonibacter urolithinfaciens sp.Nov, a urolithin-producing bacterium isolated from the human gut[J].International Journal of Systematic and Evolutionary Microbiology, 2014,64(7):2 346-2 352.
N D, et al. Gordonibacter urolithinfaciens sp.Nov, a urolithin-producing bacterium isolated from the human gut[J].International Journal of Systematic and Evolutionary Microbiology, 2014,64(7):2 346-2 352.
[10] 肖玉欣, 王楠, 王婧, 等. 鞣花酸和尿石素类代谢产物的生物活性及其对肠道健康的作用研究进展[J]. 食品科学, 2022, 43(9):275-284.
XIAO Y X, WANG N, WANG J, et al. A review of the bioactivity and gut health benefits of ellagic acid and its metabolites, urolithins[J]. Food Science, 2022, 43(9):275-284.
[11] BELCARO G, SAGGINO A, CORNELLI U, et al.Improvement in mood, oxidative stress, fatigue, and insomnia following supplementary management with robuvit[J].Journal of Neurosurgical Sciences, 2018, 62(4):423-427.
[12] MUKU G E, MURRAY I A, ESP N J C, et al.Urolithin A is a dietary microbiota-derived human aryl hydrocarbon receptor antagonist[J].Metabolites, 2018, 8(4):86.
N J C, et al.Urolithin A is a dietary microbiota-derived human aryl hydrocarbon receptor antagonist[J].Metabolites, 2018, 8(4):86.
[13] 张远洋, 李德冠.尿石素A的生物活性研究进展[J].生命科学,2020,32(9):979-984.
ZHANG Y Y, LI D G.The advances in the biological activities of urolithin A[J].Chinese Bulletin of Life Sciences, 2020, 32(9):979-984.
[14] 李梦寒, 王志勇, 盛雪, 等.基于16S rRNA技术分析α-乳白蛋白对大鼠肠道菌群的影响[J].食品科学,2020,41(6):155-162.
LI M H, WANG Z Y, SHENG X, et al.Effect of α-lactalbumin on intestinal flora in rats analyzed by 16S rRNA high-throughput sequencing[J].Food Science, 2020, 41(6):155-162.
[15] 金丹, 张红盼, 郭咸希, 等.安石榴苷大鼠体内肠代谢产物的鉴定分析[J].中国药师,2020,23(6):1 086-1 090.
JIN D, ZHANG H P, GUO X X, et al.Identification and analysis of punicalagin intestinal metabolites in vivo[J].China Pharmacist,2020,23(6):1 086-1 090.
[16] 陈鹏, 涂晶晶, 李巧玲, 等.肠道菌群对石榴皮鞣质的分解代谢作用研究[J].中草药,2019,50(14):3 396-3 402.
CHEN P, TU J J, LI Q L, et al.Study of metabolism of tannins from granati pericarpium in intestinal flora[J].Chinese Herbal Medicine,2019,50(14):3 396-3 402.
[17] ROCIO G V, HANNE V, JUDIT P, et al.Gastrointestinal simulation model twin-shime shows differences between human urolithin metabotypes in gut microbiota composition, pomegranate polyphenol metabolism, and transport along the intestinal tract[J].Journal of Agricultural and Food Chemistry, 2017,65(27):5 480-5 493.
[18] 高文文, 孟祥晨.人肠道产丁酸细菌及其所产丁酸的促健康作用研究进展[J].食品科学,2019,40(21):273-279.
GAO W W, MENG X C.A review of recent literature on eutyrate-producing bacteria in the human intestine and health-promoting functions of their metabolite butyrate[J].Food Science,2019,40(21):273-279.
[19] GU S H, CHEN D D, ZHANG J N, et al.Bacterial community mapping of the mouse gastrointestinal tract[J].PLoS One,2013,8(10):e74957.
[20] KUTSCHERA M, ENGST W, BLAUT M, et al.Isolation of catechin converting human intestinal bacteria[J].Journal of Applied Microbiology 2011,111(1):165-175.
[21] KELLERMAYER R.Roseburia species:Prime candidates for microbial therapeutics in inflammatory bowel disease[J].Gastroenterology, 2019, 157(4):1 164-1 165.
[22] JIANG S H, XIE S, LYU D, et al.A reduction in the butyrate producing species Roseburia spp.and Faecalibacterium prausnitzii is associated with chronic kidney disease progression[J].Antonie Van Leeuwenhoek, 2016, 109(10):1 389-1 396.
[23] GARC A-MANTRANA I, CALATAYUD M, ROMO-VAQUERO M, et al.Urolithin metabotypes can determine the modulation of gut microbiota in healthy individuals by tracking walnuts consumption over three days[J].Nutrients, 2019,11(10):2 483.
A-MANTRANA I, CALATAYUD M, ROMO-VAQUERO M, et al.Urolithin metabotypes can determine the modulation of gut microbiota in healthy individuals by tracking walnuts consumption over three days[J].Nutrients, 2019,11(10):2 483.
[24] 工藤真丈,中岛贤则,山本浩明.新型微生物及使用了该新型微生物的尿石素类的制造方法:日本, CN110325638A [P].2019-10-11.
KUDO M, NAKAJIMA K, YAMAMOTO H.Microorganism and production method for urolithins using same:Japan, CN110325638A [P].2019-10-11.
[25] KANG I, OKLA M, CHUNG S, et al.Ellagic acid inhibits adipocyte differentiation through coactivator-associated arginine methyltransferase 1-mediated chromatin modification[J].The Journal of Nutritional Biochemistry,2014, 25(9):946-953.