褐藻胶是海洋多糖资源中含量最为丰富的一类多糖,由β-D-甘露糖醛酸(β-D-mannuronic,M)和α-L-古罗糖醛酸(α-L-guluronic,G)通过β-1,4糖苷键连接而成[1]。褐藻胶分子质量大、黏度高,对其充分利用开发的基础是高效降解为较低分子质量的低聚糖。褐藻胶寡糖不仅改善了多糖物化性质的局限性,同时具有抗炎、抑菌、抗肿瘤、免疫与肠道菌群调节等多种生理活性[2-3]。我国首个获批的通过靶向脑-肠轴治疗阿尔茨海默症的新药——甘露特钠胶囊(代号GV-971,商品名“九期一”),即是以褐藻提取物为原料衍生制备得到的低分子酸性寡糖化合物,这也进一步推动了海洋功能糖资源开发方向的研究。
褐藻胶裂解酶是高效、特异性降解褐藻胶的一种重要工具酶[4-5],所得寡糖产物在非还原端糖醛酸残基C4与C5间形成的不饱和双键有利于进一步结构改造和衍生开发。褐藻胶裂解酶可以广泛地从海洋动物、海洋藻类及微生物等多种来源中分离得到,其中,微生物来源的酶最为丰富,已达上百种,如Isoptericola halotolerans WX[6]、Sphingomonas sp.MJ-3[7]和Flavobacterium sp.S20[8]等。然而,野生菌产酶普遍存在酶活力低、稳定性差、难分离等问题,这些可借助基因工程技术对酶的高效表达而有效改善。褐藻胶裂解酶的重组表达体系以大肠杆菌(Escherichia coli)为主。比较来看,枯草芽孢杆菌(Bacillus subtilis)作为另一种表达外源蛋白的成熟工具菌株,具有更为突出的蛋白分泌能力[9-10],且已被美国食品和药物管理局和欧洲食品安全局批准为可食用的安全菌株[10]。目前,利用芽孢杆菌表达褐藻胶裂解酶的工作还较少,表达后的酶活力也普遍偏低,如来源于Flavobacterium sp.strain A1的褐藻胶裂解酶A1-Ⅲ,在枯草芽孢杆菌中的表达量为0.3 g/L [11];本课题组前期构建的一株产褐藻胶裂解酶的Bacillus subtilis WB600/pMA5-aly-cob酶活力也仅21.71 U/mL,表明利用枯草芽孢杆菌体系重组表达褐藻胶裂解酶的研究还有待深入。
实验室前期从腐烂海带中分离得到一株I. halotolerans WX,野生菌产酶活力达到432 U/mL[12],具有良好的降解褐藻胶的能力。本研究通过基因克隆的方法获得了褐藻胶裂解酶产酶基因aly-ih,构建了枯草芽胞杆菌工程菌,并联合通过启动子改造、培养基优化的方法提高褐藻胶裂解酶的活力,为进一步推动该酶及其降解产物的应用提供研究基础。
1 材料与方法
1.1 实验材料
I. halotolerans WX、E.coli JM109、B.subtilis WB600和质粒pMA5保存在本实验室;Taq、PrimerSTAR HS、Dpn I、DNA聚合酶,TaKaRa公司;ClonExpress Ⅱ One Step Cloning Kit,诺维赞生物科技股份有限公司;聚β-D-甘露糖醛酸(pM,>97%)和聚α-L-古罗糖酸(pG,>97%),青岛博智汇力生物技术有限公司;其余试剂均购自国药集团化学试剂有限公司。
1.2 仪器与设备
UV-2100紫外分光光度计,美国尤尼柯仪器有限公司;T100热循环PCR仪,美国Bio-Rad公司;NanoDrop One/OneC微量核酸蛋白浓度测定仪,美国Thermo Fisher科技公司;SW-CJ-2FD/2F超净工作台、SPX-250B-Z生化培养箱,上海博迅实业有限公司。
1.3 实验方法
1.3.1 褐藻胶裂解酶的异源表达
以菌株I. halotolerans WX基因组为模板,设计特异性引物为aly-ih-F:aaatcagggggatccATGAGACTCCACCGCA;aly-ih-R:acctctagaacgcgtTCAGGAGTGCTTGA(小写字母为同源臂),将扩增出的目的片段与酶切后的pMA5线性质粒进行同源重组连接,通过热击法将连接产物导入克隆宿主E.coli JM109感受态细胞,挑取转化子进行PCR及测序验证。对测序验证正确提取质粒,导入表达宿主B.subtilis WB600中,挑取转化子进行PCR验证并测序验证。将构建好的重组表达质粒命名为pMA5-aly-ih,工程菌命名为B.subtilis-pMA5-aly-ih。
1.3.2 工程菌发酵条件及酶活力测定
工程菌在含0.1%(体积分数)卡那霉素的LB培养基中过夜培养,之后按照1%(体积分数)的接种量接种于TB培养基中,37 ℃、220 r/min发酵36 h。离心分别收集上清液和菌体用于测定胞外与胞内酶活力。采用改良3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[12]测量还原糖浓度。将0.1 mL酶液加入0.9 mL 10 g/L 海藻酸钠溶液中,混匀后于45 ℃反应20 min,然后向体系中加入1 mL DNS,沸水浴3 min终止反应,迅速定容至10 mL,吸取200 μL 加入96孔板,于520 nm 处测定吸光值。对照组为去离子水。1个酶活力单位(U)定义:上述条件下,1 mL 的酶液每分钟产生1 μg 还原糖所需的酶量。
1.3.3 SDS-PAGE分析验证
将收集的胞外粗酶样品与4倍 Loading Buffer混合,置于100 ℃金属浴5 min,使蛋白变性。Maker与变性后的蛋白上样量分别为5、20 μL。电泳条件为80 V,30 min以及120 V,70 min。最后用考马斯亮蓝染色2 h,再利用洗脱液[V(水)∶V(甲醇)∶V(冰醋酸)=6∶3∶1]脱至背景无色,拍照分析。
1.3.4 启动子改造
从NCBI数据库(https://www.ncbi.nlm.nih.gov/)的B.subtilis 168(ACCESSION:NC_000 964)基因组中获得组成型或自诱导型启动子的基因序列,包括trnQ、sigX、yolA、wapA、gapB、cdd、veg、mpr、nprE、aprE、epr、bpr、nprB、pst、gsiB、srfA共16条启动子序列。以B.subtilis 168 基因组为模板,分别采用表1所示的引物扩增启动子序列,以 pMA5 质粒为模板,扩增去除原有启动子HpaII的全质粒片段;之后利用同源重组的方法将待替换启动子序列插入至原启动子位置。将重组质粒转化至E.coli JM109感受态细胞进行扩增和鉴定后,转化至表达宿主B.subtilis WB600感受态细胞。通过酶活力比较,筛选合适的启动子。进一步考查启动子拷贝数的影响,以筛选得到的重组质粒mpr-pMA5-aly-ih为模板,扩增其全质粒片段,同上采用同源重组的方法将启动子mpr添加到原有mpr序列后,获得启动子拷贝数为2的重组质粒mpr×2-pMA5- aly-ih,工程菌命名为B.subtilis- mpr×2-pMA5-aly-ih。启动子拷贝数为3和4的构建方法以此类推。
表1 扩增启动子的引物序列
Table 1 Primer sequences for promoter amplification

名称序列pMA5-FATGAGTTATGCAGTTTGTAGAATGCApMA5-RTTTTTTGAGAAGATCACTCAAAAAATCtrnQ-FtgagtgatcttctcaaaaaaGAGAATAAATGTCATACGCTCTTTCCtrnQ-RctacaaactgcataactcatATATAGACTGCGTTATGAGAACGTCAsigX-FtgagtgatcttctcaaaaaaCAAAGACTCCGGGTCTGGCsigX-RctacaaactgcataactcatTTGAAACCCCTCCGTTCACTTyolA-FtgagtgatcttctcaaaaaaGGCTTGCTCGTTGTCAAATCTGyolA-RctacaaactgcataactcatTTCCTAAATCCTCCTTGGTACAAGTwapA-FtgagtgatcttctcaaaaaaATTTCAATCATTGTATTTCTCGACCCwapA-RctacaaactgcataactcatTTCCTCTCTCCTTTTGTAATAAAAGTAgapB-FtgagtgatcttctcaaaaaaAGAAGGGATTTTAGATATGCTGTGTGgapB-RctacaaactgcataactcatGTTGGACACCCCTTATCAATTATGCP43-FtgagtgatcttctcaaaaaaCGGTTGATTTAATAACTGACAAACATP43-RctacaaactgcataactcatGTGTACATTCCTCTCTTACCTATAATGveg-FtgagtgatcttctcaaaaaaACGGATTAATGTATGGGAAGTGCveg-RctacaaactgcataactcatTGCATCCACCTCACTACATTTATTGmpr-FtgagtgatcttctcaaaaaaTTAGCGGATTACACTGTTGAAGGAmpr-RctacaaactgcataactcatTTTGTCATCTCCCTCCTTTAGTGTCnprE-FtgagtgatcttctcaaaaaaATTGAATCAGCAGGGTGCTTTGnprE-RctacaaactgcataactcatAATAAATCCCCCTTTTTGAAAATACTaprE-FtgagtgatcttctcaaaaaaCGATAATATCCATTGTTCTCACGGaprE-RctacaaactgcataactcatTCTTTACCCTCTCCTTTTAAAAAAATTepr-FtgagtgatcttctcaaaaaaAGGATAATTCCGTCACGCAAAGepr-RctacaaactgcataactcatGATTCATCTCCTTTTTCTATGATGTTTbpr-FtgagtgatcttctcaaaaaaTCGATTTTGTCCTTTTTTGTTTTTCbpr-RctacaaactgcataactcatTTTCATCCCCCTTTTTCAACATnprB-FtgagtgatcttctcaaaaaaCATATGGAGCAGGGGTTATTATTTATnprB-RctacaaactgcataactcatAACACCACATCCTTCCTATTTTGGpst-FtgagtgatcttctcaaaaaaTGACAATCCTGAGATTGCTATTTCTGpst-RctacaaactgcataactcatTTCCTGAATTCCCCCTGCGgsiB-FtgagtgatcttctcaaaaaaGAAAAAACTTTTCCAGATAGTGCCGgsiB-RctacaaactgcataactcatTTTGAATTCCTCCTTTAATTGGTGTsrfA-FtgagtgatcttctcaaaaaaAATGTTTAGTGGAAATGATTGCGGsrfA-RctacaaactgcataactcatATTGTCATACCTCCCCTAATCTTTATAmpr0-FATGAGTTATGCAGTTTGTAGAATGCAmpr0-RTTTGTCATCTCCCTCCTTTAGTGTCmpr-2/3/4-FtaaaggagggagatgacaaaTTAGCGGATTACACTGTTGAAGGAmpr-2/3/4-RctacaaactgcataactcatTTTGTCATCTCCCTCCTTTAGTGTC
注:小写字母为同源臂
1.3.5 褐藻胶裂解酶培养基优化
(1)碳源种类筛选及浓度优化:选择初始质量浓度为4 g/L的甘油、玉米糊精、D-无水葡萄糖、D-麦芽糖、可溶性淀粉和蔗糖;对筛选得到的碳源进一步优化浓度,设置质量浓度为1、4、8、12、16、20、24、28 g/L。
(2)氮源种类筛选及浓度优化:初始质量浓度为12 g/L的胰蛋白胨、蛋白胨、棉籽饼粉、大豆蛋白胨、酵母浸膏、玉米浆;对筛选得到的氮源进一步优化浓度,设置质量浓度为1、4、8、12、16、20、24、28 g/L。
(3)金属离子种类筛选及浓度优化:初始浓度均为2 mmol/L Na+、K+、Mg2+、Zn2+、Cu2+、Ca2+、Mn2+、Fe2+(对应的试剂分别为氯化钠、硫酸钾、硫酸镁、硫酸锌、无水硫酸铜、氯化钙、五水合硫酸锰、七水合硫酸亚铁);对筛选得到的金属离子进一步优化浓度,设置浓度为2、4、6、10、15、20、25、30 mmol/L。
分别按照上述培养基的配方优化褐藻胶裂解酶发酵培养基,发酵条件按照实验步骤1.3.2。
1.3.6 褐藻胶酶解
配制质量浓度分别为1、5、10 g/L的海藻酸钠底物溶液,酶解4 h,分别在0.2、0.5、1、1.5、2.0、2.5、3、3.5、4 h时取样测定还原糖含量,方法同1.3.2。
1.3.7 褐藻胶寡糖平均聚合度测定
采用苯酚-硫酸法测定总糖浓度[13],以总糖浓度与还原糖浓度的比值定义为平均聚合度,监测酶解过程。
2 结果与分析
2.1 重组褐藻胶裂解酶的构建与表达
2.1.1 工程菌的构建
从实验室前期筛选的I. halotolerans WX中克隆得到一段大小为771 bp的序列(图1-a),编码 256个氨基酸残基,其中信号肽序列为Met 1-Ala 32(图2)。以限制性内切酶BamH I和Mlu I对表达质粒pMA5进行双酶切(图1-b),通过同源重组构建重组质粒,随后转化至表达宿主菌B.subtilis WB600感受态细胞中。结果表明,重组质粒的PCR产物在771 bp处有单一条带(图1-c)。测序正确的重组质粒命名为pMA5-aly-ih,工程菌命名为B.subtilis-pMA5-aly-ih。
2.1.2 重组褐藻胶裂解酶的表达及酶活力测定
将构建成功的B.subtilis-pMA5-aly-ih工程菌进行摇瓶发酵。分别测定发酵上清液及胞内酶活力,结果如表2所示,重组酶Aly-IH主要分泌到胞外,酶活力约30.3 U/mL。通过SDS-PAGE分析后发现,在25~35 kDa有1条单一、明亮的条带(图3),与Aly-IH蛋白理论分子质量28 kDa吻合。依据文献[14]中有关褐藻胶裂解酶分类,该酶属于低分子质量的褐藻胶裂解酶。

a-褐藻胶裂解酶基因aly-ih扩增(M-2 000 bp DNA Maker;1-aly-ih扩增 产物);b-双酶切后的pMA5质粒(M- 10 000 bp DNA Maker;1-BamH I 和Mul I酶切后的pMA5质粒);c-工程菌B.subtilis-pMA5-aly-ih 验证(M-2 000 bp DNA Maker;1-B.subtilis-pMA5- aly-ih PCR验证)
图1 重组表达载体的构建
Fig.1 Construction of recombinant expression vector

图2 褐藻胶裂解酶Aly-IH的氨基酸序列
Fig.2 Amino acid sequence of Aly-IH 注:红色方框表示信号肽
表2 工程菌发酵产酶活力
Table 2 Enzymatic activity of recombinant enzyme

工程菌酶活力/(U·mL-1)发酵上清液破碎上清液对照B.subtilis-WB600-pMA5NDNDB.subtilis-WB600-pMA5-aly-ih30.31.3
注:ND表示未检测到
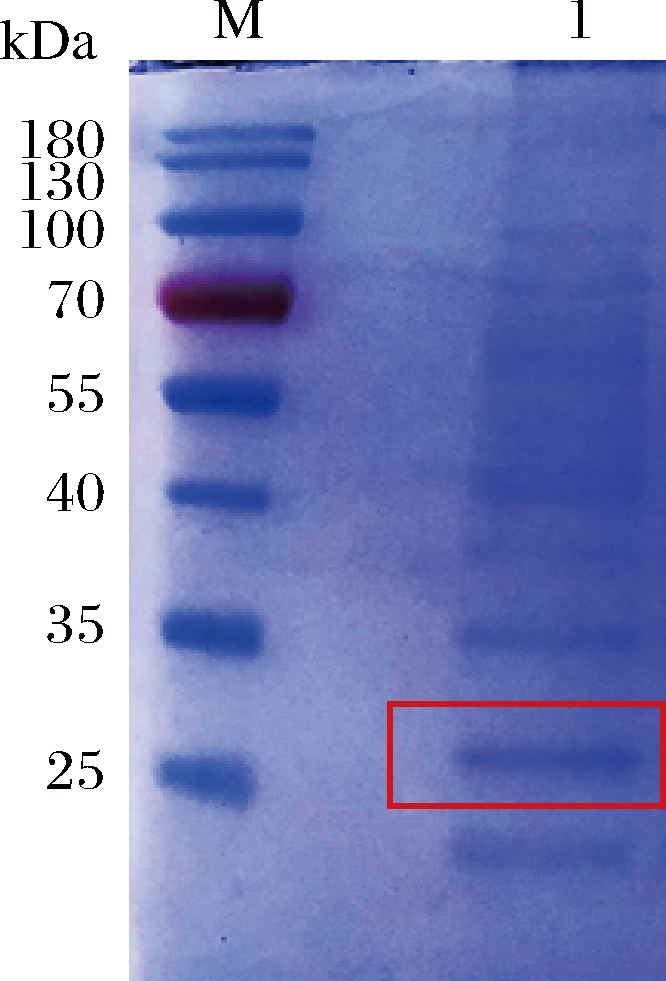
M-Marker;1-重组表达后的Aly-IH
图3 重组褐藻胶裂解酶SDS-PAGE分析
Fig.3 SDS-PAGE analysis of recombinant alginate lyase
2.2 褐藻胶裂解酶Aly-IH的启动子改造
2.2.1 启动子替换
将内源性启动子HpaⅡ替换为B.subtilis 168来源的16条启动子。结果显示,启动子替换为sigX、P43、epr、bpr、nprB、pst、srfA后,Aly-IH的酶活力提高了20%~53%;替换为nprE和aprE后,酶活力提高至2.8倍;替换为veg和mpr后,酶活力提高最为显著,特别是启动子mpr,可以将酶活力提高至初始酶活力的4倍(图4)。因此,选择mpr作为进一步优化的启动子序列。
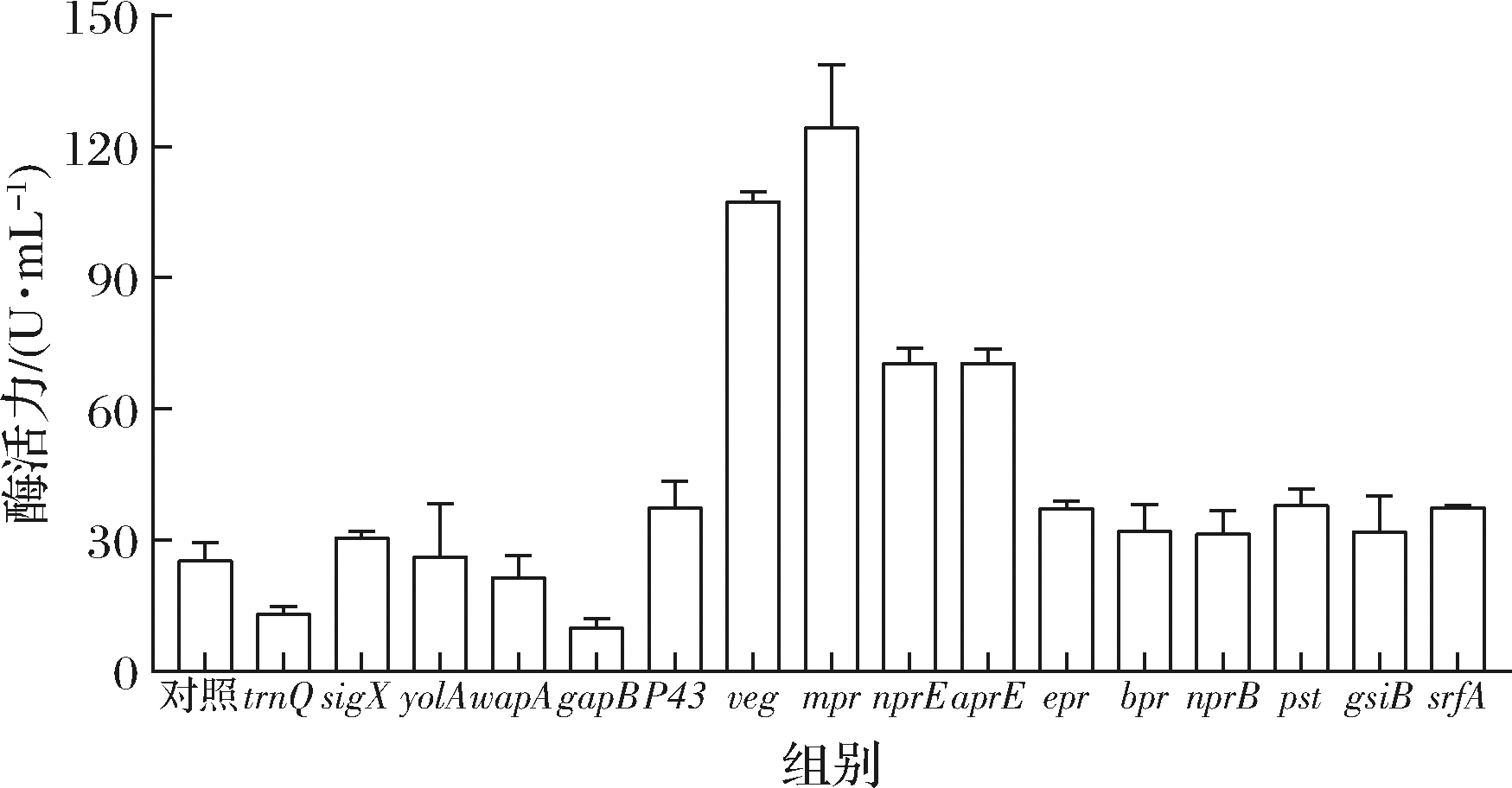
图4 启动子替换对酶活力的影响
Fig.4 Effect of promoter on enzymatic activity
2.2.2 启动子拷贝数优化
通过启动子串联提高mpr拷贝数。相较于单启动子,通过多拷贝启动子优化后,酶活力随拷贝数增加而增加,当拷贝数为3时,发酵36 h时Aly-IH酶活力最高可达到154 U/mL。拷贝数进一步增加时酶活力降低。结合工程菌的生长曲线分析发现,高拷贝数影响菌体生长,随拷贝数增加,OD600值逐渐下降,在发酵36 h时,OD600值由12.1降至10.2。依据酶活力,后续研究选择mpr拷贝数为3的工程菌作进一步优化。
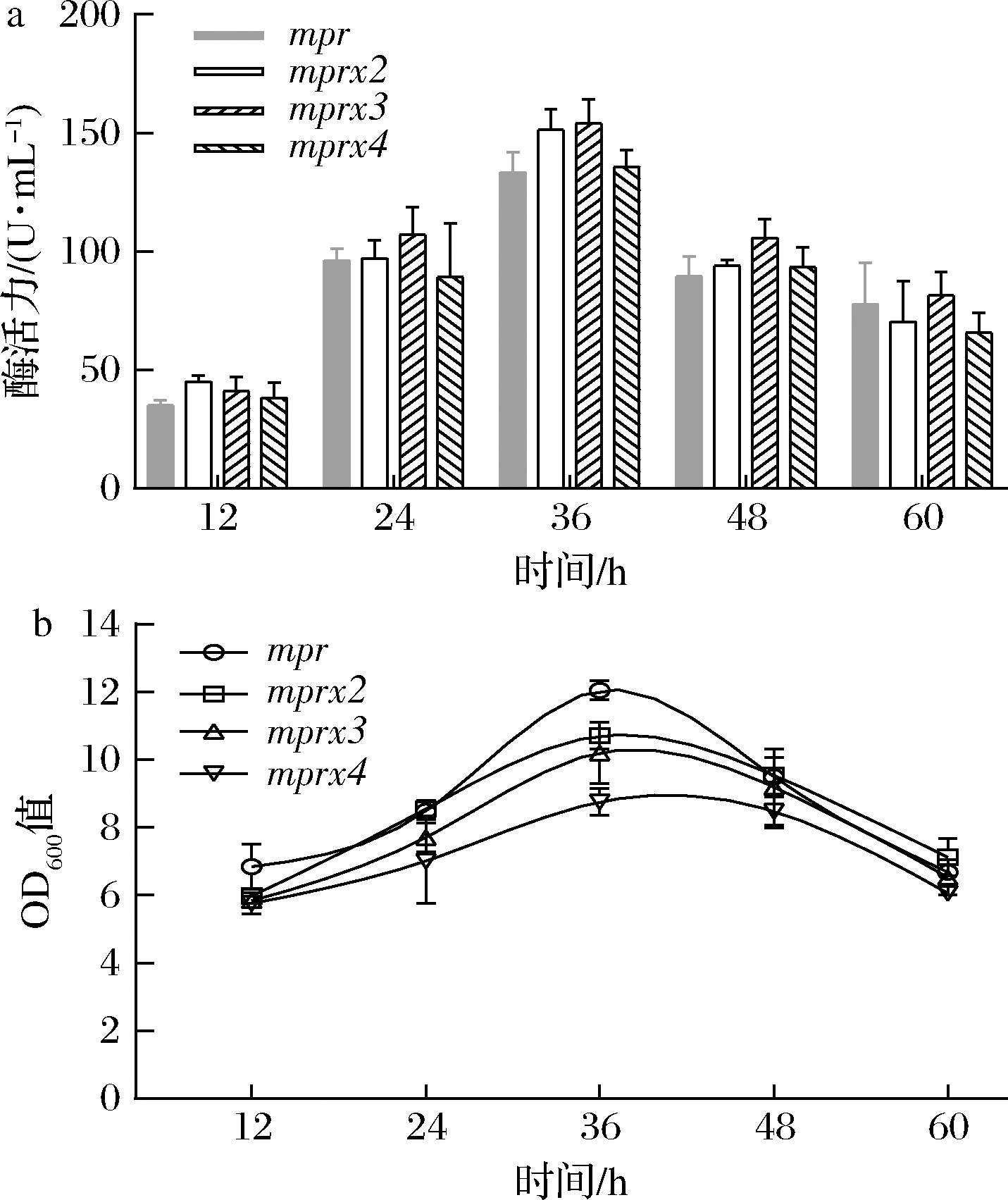
a-启动子拷贝数优化后Aly-IH酶活力;b-启动子拷贝数优化后工程菌生长曲线
图5 启动子拷贝数的影响
Fig.5 Effect of promoter copy number
2.3 褐藻胶裂解酶的培养基优化
2.3.1 碳源优化
选择初始质量浓度为4 g/L的甘油、玉米糊精、D-无水葡萄糖、D-麦芽糖、可溶性淀粉和蔗糖作为碳源进行优化。相较其他碳源,甘油培养时OD600值最高,酶活力也略高于其他种类碳源(图6)。进一步优化甘油浓度发现,质量浓度在16 g/L时酶活力最高,同时随着甘油浓度的提高菌体生长量呈现下降趋势。这说明甘油有利于菌体生长和产酶,但过高浓度可能会影响甘油代谢酶促反应进而影响菌株生长和产酶[15]。

a-碳源种类;b-甘油浓度优化
图6 碳源对生长与产酶的影响
Fig.6 Effect of carbon source on strain growth and enzymatic activity
2.3.2 氮源优化
分别以初始质量浓度为12 g/L的胰蛋白胨、蛋白胨、棉籽粉、酵母浸膏、大豆蛋白胨和玉米浆作为氮源进行发酵优化培养。结果显示,大豆蛋白胨为氮源时菌体生长与产酶情况均较好(图7-a)。进一步优化得到大豆蛋白胨最优添加质量浓度为16 g/L。过高浓度的大豆蛋白胨引起酶活力和OD600值的下降(图7-b)。经氮源优化后Aly-IH酶活力达到220 U/mL左右。
2.3.3 金属离子优化
考查初始浓度为2 mmol/L的Na+、K+、Mg2+、Zn2+、Cu2+、Ca2+、Mn2+、Fe2+的不同金属离子对酶活力的影响。添加K+、Zn2+、Mg2+、Ca2+、Mn2+可显著提高酶活力(图8-a),特别是添加Mn2+时,酶活力和OD600值分别达到230 U/mL和9.6,效果最佳。继续探究不同浓度Mn2+对酶活力的影响发现,Mn2+浓度的增加可促进酶活力的提高,当增加至25 mmol/L时酶活力达到最高,为320 U/mL,进一步提高浓度则表现出明显的抑制作用(图8-b)。说明过高浓度的Mn2+对产酶有一定的副作用。
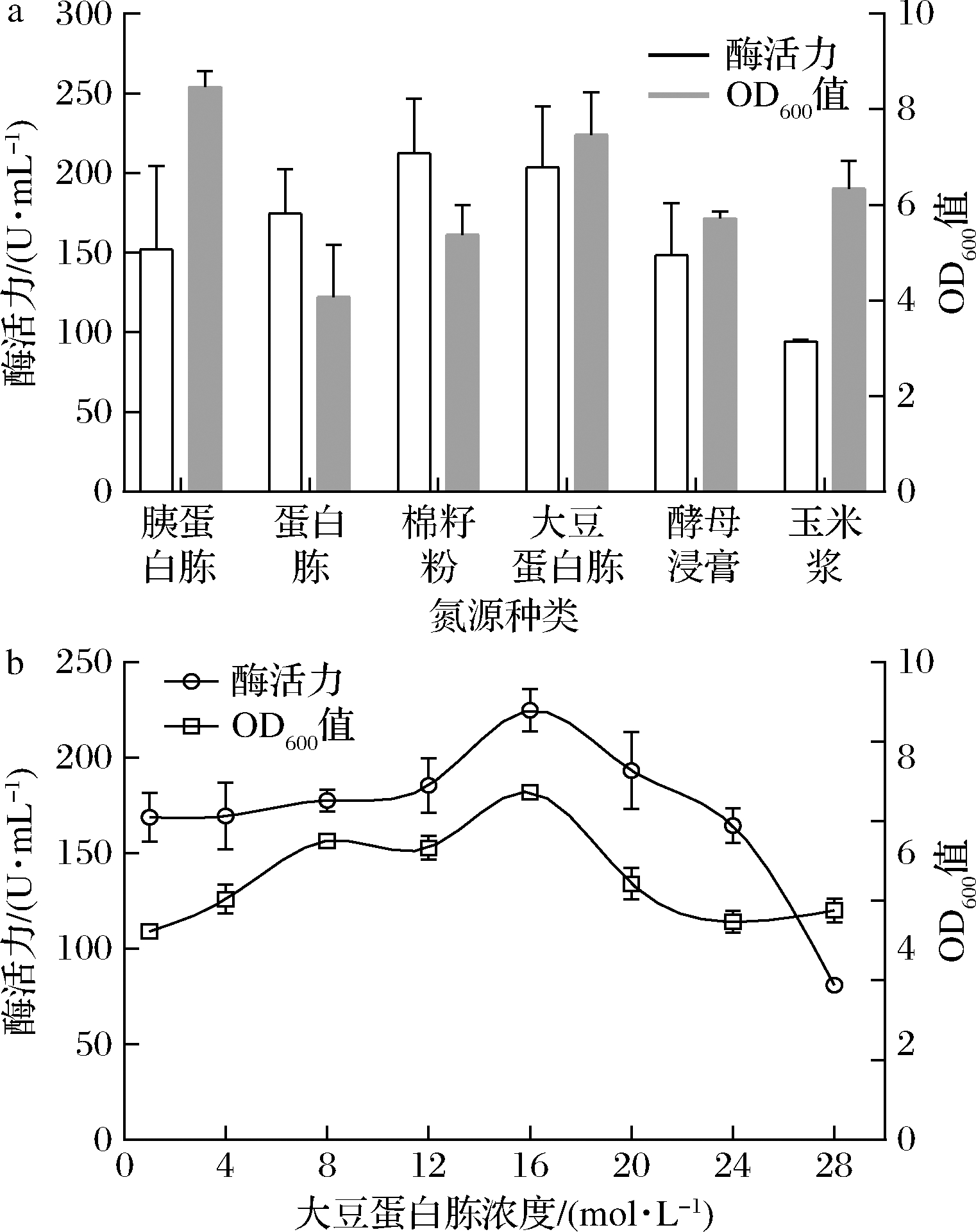
a-氮源种类;b-大豆蛋白胨浓度优化
图7 氮源对生长与产酶的影响
Fig.7 Effect of nitrogen source on strain growth and enzymatic activity
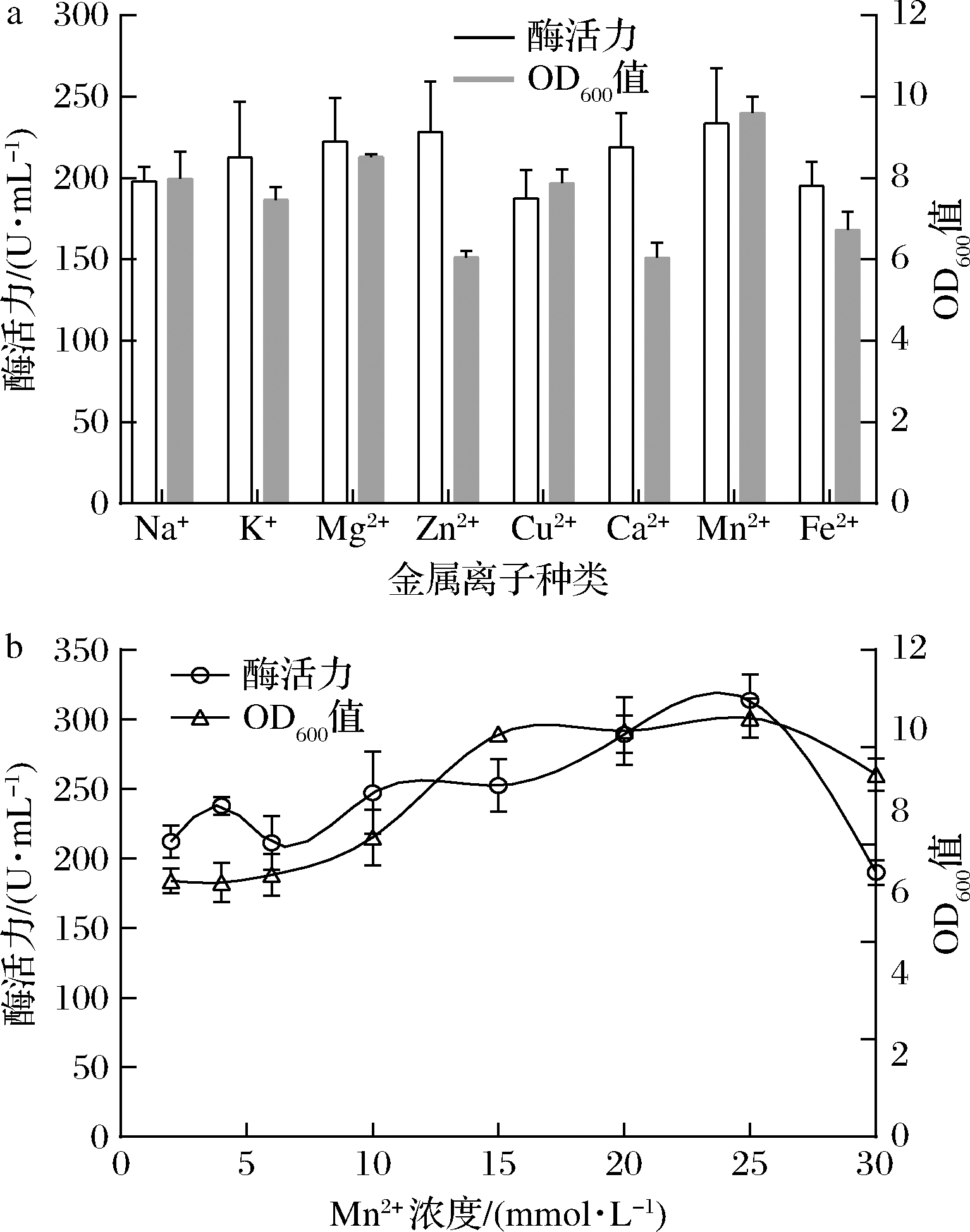
a-金属离子种类;b-Mn2+浓度优化
图8 金属离子对生长与产酶的影响
Fig.8 Effect of metal ion on strain growth and enzymatic activity
2.4 褐藻胶裂解酶的酶解应用
为了探究Aly-IH降解海藻酸钠的情况,分别选取1、5、10 g/L的底物进行酶解实验。如图9-a所示,酶解0~2 h,酶解液中还原糖浓度随时间延长而迅速增加;2 h时,酶解速率降低,还原糖浓度增加缓慢;进一步延长时间并不能显著促进酶解。不同底物浓度下酶解行为基本相同,酶解在3 h均达到终点。平均聚合度测定结果显示,低浓度底物酶解时,底物快速降解,但随酶解过程的进行,不同浓度底物酶解的最终产物平均聚合度均为2.3(图9-b)。
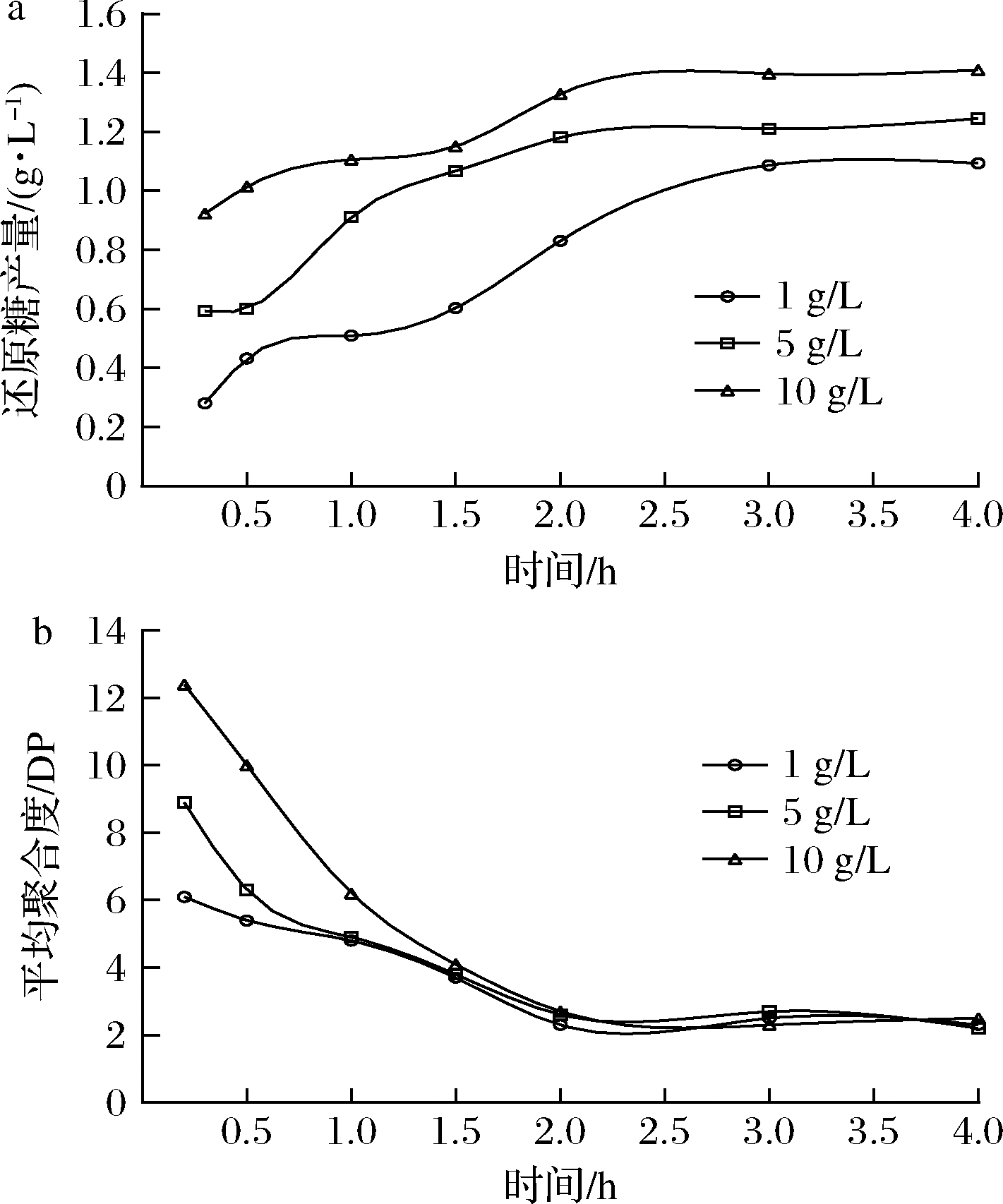
a-还原糖产生量变化;b-平均聚合度变化
图9 海藻酸钠的酶解与产物平均聚合度的测定
Fig.9 Enzymatic hydrolysis of sodium alginate and determination of the average degree of polymerization of hydrolysates
3 结论与讨论
褐藻胶裂解酶可高效且特异性降解褐藻胶制备褐藻胶寡糖,在海洋多糖利用开发中具有重要应用[16]。从海洋等环境样本中获得的大部分野生酶存在活力弱、产量低、难分离等问题,这在一定程度上限制了其推广应用。利用基因工程技术进行酶的表达和改造是进一步提高褐藻胶裂解酶活力的有效途径。目前,褐藻胶裂解酶的异源表达体系多为大肠杆菌,如来源于Vibrio sp.NJ04的AlgNJ04比酶活力达2 416 U/mg[17],来源于Microbulbifer sp.BY17的BY17PV7比酶活力达(150.42±3.32) U/mg[18]。与此相比,枯草芽孢杆菌因其强大的蛋白分泌能力,可大大简化重组酶下游分离的流程和投入,是食品、药品行业中众多重组酶分泌表达的理想宿主。但是目前报道的利用枯草芽孢杆菌成功表达的褐藻胶裂解酶还不多,且酶活力普遍不高。RHEIN-KNUDSEN等[19]最新报道了来源于北极大洋中脊(AMOR)宏基因组文库里的嗜热褐藻胶裂解酶AMOR-PL7 和AMOR-PL17,发酵50 h后还原糖浓度分别为3.5、2.5 mmol/L,酶活力换算约为315、225 U/mL(OD600值分别为9和7)。现阶段,借助发酵技术可显著提高枯草芽孢杆菌产酶水平,如黄杆菌来源的褐藻胶裂解酶rFlAlyA在枯草芽孢杆菌表达后,通过高密度发酵OD600值达85,最高酶活力为2 550 U/mL[20]。南宁汉和生物与中科院天津工生所合作,采用枯草芽孢杆菌发酵产褐藻胶裂解酶实现酶活力全球最高。因此,进一步利用B.subtilis体系探究并提高褐藻胶裂解酶的催化性能具有良好的应用潜力。从实验室前期筛得的一株高产褐藻胶裂解酶的菌株I. halotolerans WX中成功克隆出一段褐藻胶裂解酶基因aly-ih,基因全长771 bp,编码256个氨基酸。进而构建了1株B.subtilis-pMA5-aly-ih工程菌,蛋白电泳结果显示该重组褐藻胶裂解酶Aly-IH分子质量为28 kDa,与理论分子质量及野生菌产酶特性相符[12],酶活力为30.3 U/mL。
在现代酶工程研究领域中,基因元件的精细表达与调控是高效提升酶的催化与应用性能的策略之一。启动子序列是决定RNA聚合酶转录识别效率的重要因素,与目的蛋白的表达水平密切相关[21]。因此选择合适的启动子是提高蛋白产量的重要手段[22]。本研究中,采用启动子替换及拷贝数优化的方法考查启动子元件对褐藻胶裂解酶表达的影响。实验从B.subtilis 168基因组中获得16种组成型或自诱导型启动子序列,将内源性启动子HpaⅡ换成mpr后,酶活力较初始增加至4倍。进一步优化启动子拷贝数提高转录强度,发现串联后的多拷贝启动子能促进褐藻胶裂解的酶活力提升,但同时也一定程度上抑制菌体生长[23],其中mpr拷贝数为3时,酶活力最高且生长未受显著影响。在此基础上,优化菌株培养条件,通过碳源、氮源和金属离子的种类与浓度的优化,Aly-IH酶活力达到320 U/mL,较初始酶活力提高至10.7倍。考查Aly-IH酶解褐藻胶的性能,该酶在0.5 h内快速降解底物,3 h即完成酶解,所得寡糖产物的平均聚合度为2.3。由于该酶是内切酶,且酶解产物主要为2-6糖,结合其降解特性可推测酶解产物中含有大量二糖,说明该酶具有较高的酶解效率。酶解产物的定量分析以及酶进一步改造优化工作仍在进行中。
本研究构建B.subtilis-pMA5-aly-ih工程菌,通过同源重组方法对其进行启动子改造,并通过培养基优化使褐藻胶裂解酶的酶活力由初始30.3 U/mL提高至320 U/mL,可高效酶解获得平均聚合度为2.3的寡糖产物。这为进一步拓展褐藻胶裂解酶在枯草芽孢杆菌体系中的表达及其在食药行业的应用奠定了基础。
[1] ARNTZEN M Ø, PEDERSEN B, KLAU L J, et al.Alginate degradation:Insights obtained through characterization of a thermophilic exolytic alginate lyase[J].Applied and Environmental Microbiology, 2021, 87(6):e02399-e02320.
[2] DE SOUSA A P A, TORRES M R, PESSOA C, et al.In vivo growth-inhibition of Sarcoma 180 tumor by alginates from brown seaweed Sargassum vulgare[J].Carbohydrate Polymers, 2007, 69(1):7-13.
[3] WANG X Y, SUN G Q, FENG T, et al.Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer′s disease progression[J].Cell Research, 2019, 29 (10):787-803.
[4] 罗丹丹, 薛永常.褐藻胶裂解酶的研究进展[J].生物学杂志, 2016, 33(6):95-98.
LUO D D, XUE Y C.Advance in alginate lyases[J].Journal of Biology, 2016, 33(6):95-98.
[5] WARGACKI A J, LEONARD E, WIN M N, et al.An engineered microbial platform for direct biofuel production from brown macroalgae[J].Science.2012, 335 (6 066):308-313.
[6] 魏丹, 窦文芳, 李恒, 等.高效降解褐藻胶新菌种的筛选、鉴定及产酶条件优化[J].食品与发酵工业, 2012, 38(7):26-31.
WEI D, DOU W F, LI H, et al.Isolation, identification, and fermentation optimization of a high efficient novel alginate-degrading strain[J].Food and Fermentation Industries, 2012, 38(7):26-31.
[7] PARK H H, KAM N, LEE E Y, et al.Cloning and characterization of a novel oligoalginate lyase from a newly isolated bacterium Sphingomonas sp.MJ-3[J].Marine Biotechnology, 2012, 14(2):189-202.
[8] HUANG L, ZHOU J G, LI X, et al.Characterization of a new alginate lyase from newly isolated Flavobacterium sp.S20[J].Journal of Industrial Microbiology & Biotechnology, 2013, 40(1):113-122.
[9] 苗苗, 黄昆仑, 梁志宏.芽孢杆菌表达系统的特点及研究进展[J].食品工业科技, 2017, 38(18):312-316;322.
MIAO M, HUANG K L, LIANG Z H.The characters and advances of Bacillus expression system [J].Science and Technology of Food Industry, 2017, 38(18):312-316;322.
[10] SCHALLMEY M, SINGH A, WARD O P.Developments in the use of Bacillus species for industrial production[J].Canadian Journal of Microbiology, 2004, 50(1):1-17.
[11] HISANO T, NISHIMURA M, YAMASHITA T, et al.Production of bacterial alginate-specific lyase by recombinant Bacillus subtilis[J].Journal of Fermentation and Bioengineering, 1994, 78(1):79-83.
[12] DOU W F, WEI D, LI H, et al.Purification and characterisation of a bifunctional alginate lyase from novel Isoptericola halotolerans CGMCC 5336[J].Carbohydrate Polymers, 2013, 98(2):1 476-1 482.
[13] 梁梅芳, 吴利洋, 倪辉, 等.褐藻胶裂解酶AlgL17酶解工艺优化及酶解产物分析[J].集美大学学报(自然科学版), 2018, 23(6):429-435.
LIANG M F, WU L Y, NI H, et al.Optimization of enzymatic hydrolysis process and analysis of hydrolysates by alginate lyase AlgL17 [J].Journal of Jimei University (Natural Science), 2018, 23(6):429-435.
[14] 吴阳, 霍峥, 李刚, 等.褐藻胶裂解酶研究进展[J].食品工业, 2021, 42(7):261-266.
WU Y, HUO Z, LI G, et al.Research advances on alginate lyase[J].The Food industry, 2021,42 (7):261-266.
[15] 李星霖. 褐藻胶裂解酶的分子改造及其应用[D].无锡:江南大学, 2021.
LI X L.Molecular modification and application of alginate lyase [D].Wuxi:Jiangnan University, 2021.
[16] 栾明鉴, 何熹, 林荣芳, 等.褐藻胶裂解酶研究进展[J].食品工业, 2021, 42(8):214-217.
LUAN M J, HE X, LIN R F, et al.Research progress of alginate lyase[J].The Food Industry, 2021, 42(8):214-217.
[17] ZHU B, NI F, NING L, et al.Cloning and characterization of a new pH-stable alginate lyase with high salt tolerance from marine Vibrio sp.NJ-04[J].International Journal of Biological Macromolecules, 2018, 115:1 063-1 070.
[18] YAN F, CHEN J Y, CAI T, et al.Cloning, expression, and characterization of a novel endo-type alginate lyase from Microbulbifer sp.BY17[J].Journal of the Science of Food and Agriculture, 2022,102(11):4 522-4 531.
[19] RHEIN-KNUDSEN N, GUAN C, MATHIESEN G, et al.Expression and production of thermophilic alginate lyases in Bacillus and direct application of culture supernatant for seaweed saccharification[J].Algal Research, 2021, 60:102512.
[20] 江君, 刘军, 杨绍青, 等.黄杆菌褐藻胶裂解酶的高效表达及其在褐藻寡糖制备中的应用[J].食品科学, 2021.42(4):145-152.
JIANG J, LIU J, YANG S Q, et al.High level expression of alginate lyase from Flavobacterium sp.and its application in preparation of alginate oligosaccharides [J].Food Science, 2021.42(4):145-152.
[21] 于慧敏, 郑煜堃, 杜岩, 等.合成生物学研究中的微生物启动子工程策略[J].合成生物学, 2021, 2(4):598-611.
YU H M, ZHENG Y K, DU Y, et al.Microbial promoter engineering strategies in synthetic biology [J].Synthetic Biology Journal, 2021, 2(4):598-611.
[22] BLAZECK J, GARG R, REED B, et al.Controlling promoter strength and regulation in Saccharomyces cerevisiae using synthetic hybrid promoters[J].Biotechnology and Bioengineering, 2012, 109(11):2 884-2 895.
[23] SU C, GONG J S, SUN Y X, et al.Combining pro-peptide engineering and multisite saturation mutagenesis to improve the catalytic potential of keratinase[J].ACS Synthetic Biology, 2019, 8(2):425-433.