龋齿是世界上最常见的慢性口腔疾病之一。口腔细菌可附着于牙齿表面形成牙菌斑生物膜,同时其产生的酸性物质能够腐蚀牙齿矿物质,最终形成龋齿[1]。龋齿常发病于儿童期,由此引发牙疼影响进食,出现机体营养不良的现象,阻碍儿童的正常发育。所以控制细菌生物膜保护口腔牙齿矿物质对于预防口腔龋齿至关重要。然而近些年在临床治疗过程中传统抗生素的过度使用和滥用,不仅改变口腔和肠道菌群,口腔环境也极易发生波动,使抗生素的抑菌作用显著降低。因此寻找一种对龋齿起预防及治疗作用且安全持续有效的新型抗菌剂,是保护口腔健康的关键之一。
抗菌肽(antimicrobial peptides, AMPs),因具有天然来源、快速杀菌、不易产生耐药性等特点受到了广泛关注。大部分抗菌肽是阳离子抗菌肽,具有两亲性,一般由12~50个氨基酸短链构成。常见的二级结构包括α-螺旋、β-折叠、环(β-发夹)和延伸结构。通常抗菌肽在水溶液中呈现非结构状态,在与膜脂双层相互作用时表现出最终构型。抗菌肽可以破坏细胞膜、穿过细胞与核酸结合、抑制蛋白质合成并阻止细胞壁的合成发挥杀菌作用[2]。已有研究表明抗菌肽可以靶向杀死病原细菌,保护口腔健康微生物群落[3]。TAO等[4]发现口腔中的天然抗菌肽如防御素、导管素、组蛋白等,具有保护牙齿和口腔黏膜的作用。MAI等[5]报道抗菌肽对变异链球菌等口腔病原体和生物膜具有抗菌活性。然而,由于抗菌肽的半衰期较短且在体内的稳定性较低,大大限制了抗菌肽的应用。研究人员正在开发具有良好稳定性和低细胞毒性的抗菌肽。合成抗菌肽可以安全有效地维持口腔稳态保护机体健康,因此合成抗菌肽作为一种新型抗菌疗法具有极大的潜力。
乳铁蛋白(lactoferrin, LF),作为一种转铁蛋白,具有抗菌、抗病毒等特性,不仅构成宿主非特异性免疫系统,也是口腔唾液防御体系中的重要组成部分。LF在酸性条件下经胃蛋白酶消化得到lactoferricin(LFcin),在蛋白水解条件下得到lactoferrampin(LFampin)。LFcin具有以β-折叠为主的两亲性结构,更易黏附于带负电荷的细胞膜,且LFampin的氨基端存在螺旋帽结构,能够增加α-螺旋稳定性。因此与LF相比,LFcin和LFampin抗菌效果更强[6]。研究表明,在牙科领域,带正电的乳铁蛋白与革兰氏阴性菌细胞壁的脂多糖结合导致变异链球菌等口腔细菌在牙齿表面的黏附功能障碍[7]。驼乳作为一种功能性乳品,具有低胆固醇、低糖,矿物质和脂肪酸种类及含量丰富且维生素C含量高等特点。驼乳中LF的含量为200~1 000 mg/L。与除人乳以外的其他动物乳相比,驼乳中乳铁蛋白的含量明显偏高,是牛乳的2.4倍、山羊乳的2.2倍[8]。
目前,国内主要通过提取纯化获取驼乳源生物活性肽并分析其营养特性和功能特性,在人工合成驼乳生物活性肽方面尚处于空白阶段。此外,天然驼乳源乳铁蛋白活性肽来源困难,成本昂贵,而LFcin和LFampin抗菌效果更强。因此,本研究通过化学合成驼乳源LFA-LFC嵌合肽,并探究其对3种主要致龋菌[变异链球菌(Streptococcus mutans)、唾液链球菌(Streptococcus salivarius)、远缘链球菌(Streptococcus sobrinus)]的抗菌能力及其作用机制。
1 材料与方法
1.1 材料与试剂
驼乳源LFA-LFC嵌合肽(纯度≥98%),上海楚肽生物科技有限公司采用化学固相合成法合成;S.mutans ATCC 2517、S.salivarius ATCC 13419、S.sobrinus ATCC 33478,广东省科学院微生物研究所;胰蛋白胨大豆肉汤(琼脂)、营养肉汤(琼脂)、脑心浸液肉汤(琼脂),青岛海博生物有限公司;PBS缓冲溶液、十二烷基硫酸钠(sodium dodecyl sulfate, SDS),北京索莱宝科技有限公司;氯己定,上海易恩化学技术有限公司;细菌基因组DNA提取试剂盒(离心柱型),北京天根生化科技有限公司;所有无机溶剂均为国产分析纯。
1.2 仪器与设备
博迅净化工作台,上海博迅医疗生物仪器股份有限公司;SQ810C蒸汽灭菌器,日本YAMATO公司;恒温振荡器、隔水式培养箱,上海一恒科学仪器有限公司;FE28台式酸度计,梅特勒-托利多国际贸易有限公司;Synergy H1酶标仪、Gel-Doc XR+凝胶成像系统,美国Biotek公司;5810 R冷冻离心机,德国Eppendorf公司;小型水平电泳槽,美国BIO-RAD公司。
1.3 实验方法
1.3.1 驼乳源LFA-LFC嵌合肽的合成及理化性质
本研究委托上海楚肽生物科技有限公司采用化学固相合成法,通过嵌入一个带正电荷的赖氨酸连接乳铁蛋白第265~284位氨基酸(LFampin)和17~30位氨基酸(LFcin)合成驼乳源LFA-LFC嵌合肽,纯度≥98%。通过PreCHemPeptide软件对驼乳源LFA-LFC嵌合肽进行分子特性的预测。使用质谱仪、高效液相色谱以及圆二色谱(circular dichroism, CD)法进行鉴定分析。
1.3.2 驼乳源LFA-LFC嵌合肽抗菌特性的测定
1.3.2.1 驼乳源LFA-LFC嵌合肽最低抑菌浓度、最低杀菌浓度的测定
按照美国试验室标准微量肉汤稀释法测定驼乳源LFA-LFC嵌合肽对S.mutans、S.salivarius和S.sobrinus 3株菌的最低抑菌浓度(minimum inhibitory concentration, MIC)和最低杀菌浓度(minimum bactericidal concentration, MBC)。最低抑菌浓度是指肉眼观察没有细菌生长和OD600值无变化状态时嵌合肽的浓度,最低杀菌浓度是指99.9%的细菌被抑制时的嵌合肽浓度。
将处于对数生长期的菌悬液用培养基稀释至2×106 CFU/mL。将嵌合肽浓度进行二倍梯度稀释为2、4、8、16、32、64、128、256、512 μmol/L。试验组每孔加入嵌合肽100 μL和菌悬液10 μL混合;阴性组为培养基100 μL和菌悬液10 μL混合;阳性组为0.2%(质量分数)氯己定100 μL和菌悬液10 μL混合;空白对照组为培养基100 μL和无菌水10 μL混合。将96孔板置于振荡培养箱,37 ℃,50 r/min,培养24 h。培养结束后使用酶标仪在600 nm处测定混合液光密度值(OD600)。
以嵌合肽最低抑菌浓度为依据,配制1~8倍的MIC嵌合肽浓度,与稀释至2×106 CFU/mL的细菌菌悬液在37 ℃,50 r/min条件下共培养24 h。每孔取10 μL混合液涂布于琼脂平板,倒置于恒温培养箱,37 ℃,培养24 h。
1.3.2.2 不同pH培养基对驼乳源LFA-LFC嵌合肽抗菌效果的影响
参考杜鹃[9]的研究方法,使用1 mol/L HCl或1 mol/L NaOH调节液体培养基pH值分别为6.3、6.6、6.8、7.0、7.3、8.3 6个梯度。参照1.3.2.1测定MIC。
1.3.2.3 菌体时间-致死曲线的测定
将处于对数生长期的菌悬液用培养基稀释至2×106 CFU/mL。根据1.3.2.1试验结果,选择嵌合肽浓度为MIC、2×MIC。试验组加入菌悬液与嵌合肽1∶1比例混合,阴性对照组加入菌悬液与无菌水混合。分别在0、1、2、5、15、30、60、120、240 min时移取菌悬液于0.85%(质量分数)无菌生理盐水中,稀释104倍,振荡混匀后立即置于冰面,使菌体停止生长。之后取100 μL细菌稀释液涂布平板,并标注日期、菌种,放进恒温培养箱,37 ℃,培养24 h。培养结束后,计算菌落数,以时间为横坐标,菌落数的对数值为纵坐标绘制时间-致死曲线。
1.3.3 驼乳源LFA-LFC嵌合肽杀菌作用机制的研究
1.3.3.1 预防菌体生物膜生成试验
采用结晶紫染色法测定生物膜。将处于对数生长期的菌悬液用培养基稀释至2×106CFU/mL。二倍梯度稀释嵌合肽浓度为2、4、8、16、32、64、128 μmol/L。将菌悬液与不同浓度嵌合肽按照10∶1的比例混合于96孔板中,阴性对照组加入培养基与菌悬液混合,空白对照组加入无菌水和培养基混合。吹打混匀后,标注日期、菌种,置于恒温培养箱,37 ℃,培养24 h。培养结束,轻轻吸去培养基上清液,每孔加入200 μL无菌0.85%生理盐水,温和冲洗3次,室温晾干后加入200 μL 10%(体积分数)甲醇固定10 min,使附着的生物膜更牢固。吸去甲醇,加入100 μL 0.1%(质量分数)结晶紫,进行30 min染色,然后吸去结晶紫染色液,使用0.85%无菌生理盐水温和冲洗3次,室温晾干。最后每孔加入150 μL 33%(体积分数)乙酸,反应10 min以溶解生物膜。将孔内溶液移至新的96孔酶标板中测定OD600值。生物膜形成量的计算如公式(1)所示:
生物膜形成量![]()
(1)
1.3.3.2 消除菌体生物膜生成试验
将处于对数生长期的菌悬液用培养基稀释至2×106CFU/mL。二倍梯度稀释嵌合肽浓度至8、16、32、64、128、256、512 μmol/L。使用96孔酶标板,试验组、阴性组每孔加入200 μL菌悬液,空白组加入200 μL培养基,置于恒温培养箱,37 ℃,培养24 h,使菌体形成生物膜。培养结束后,轻轻吸去96孔板中的悬浊液,加入不同浓度嵌合肽100 μL,阴性组和空白对照组分别加入培养基和无菌水代替嵌合肽。37 ℃,过夜培养。参照1.3.3.1测定生物膜剩余量。
1.3.3.3 透射电子显微镜观察
将处于对数生长期的菌悬液用培养基稀释至2×106 CFU/mL。加入128 μmol/L驼乳源LFA-LFC嵌合肽和菌悬液以1∶1的比例混匀,阴性对照组加入无菌水和菌悬液混合。37 ℃,过夜培养。然后在4 500 r/min的条件下,离心5 min。弃掉上清液,加入PBS溶液清洗沉淀物,再次离心。重复冲洗过程2次后,加入2.5%(体积分数)戊二醛固定液后,至4 ℃冰箱固定12 h以上。将样品送至迈斯普生物科技有限公司使用JEM1230型透射电镜(transmission electron microscope, TEM)观察,采集图像进行分析。
1.3.3.4 激光共聚焦电子显微镜观察
使用异硫氰酸荧光素(fluorescein isothiocyanate isomer, FITC)作为荧光探针标记驼乳源LFA-LFC嵌合肽(FITC-嵌合肽)委托上海楚肽生物科技有限公司合成。将处于对数生长期的菌悬液用培养基稀释至2×106 CFU/mL。将无菌PBS溶液与菌悬液以1∶1的比例混匀,在1 000 r/min,4 ℃条件下,离心30 s,弃掉上清液后,重悬于无菌PBS溶液中。使用Hoechst 33258(10 μg/mL,30 min)和尼罗红(1 μmol/L,30 min)染料连续染色细菌细胞。冲洗后加入128 μmol/L FITC-嵌合肽作用30 min。然后加入100 μL 2.5%戊二醛,固定20 min。再次轻轻冲洗样品,并将细菌沉淀物重悬于无菌PBS溶液中。取样品置于盖玻片,通过激光共聚焦电子显微镜(confocal laser scanning microscope, CLSM)观察。
1.3.3.5 菌体DNA电泳迁移率的测定
将处于对数生长期的菌悬液用培养基稀释至2×106 CFU/mL。使用细菌基因组DNA提取试剂盒提取菌体DNA,通过微量分光光度计测定DNA纯度和浓度,冻存于-20 ℃冰箱备用。二倍梯度稀释嵌合肽浓度为2、4、8、16、32、64、128 μmol/L。将不同浓度的嵌合肽和菌体DNA以1∶4的比例混匀,阴性对照组加入无菌水和菌体DNA。37 ℃,孵育5 min后,加入2 μL 6×loading buffer染料,然后在120 V,30 min条件下,进行1%琼脂糖凝胶核酸电泳检测。电泳结束后,利用UV凝胶成像系统观察菌体DNA迁移率,分析其在凝胶中的阻滞情况。
1.3.4 驼乳源LFA-LFC嵌合肽溶血性的测定
参照文献[10]对驼乳源LFA-LFC嵌合肽溶血性进行测定。取适量无菌绵羊血于无菌离心管中,在4 ℃、4 000 r/min的条件下,离心10 min。弃掉上清液,将绵羊血红细胞沉淀与无菌PBS溶液以1∶1比例混匀,在4 ℃、4 000 r/min条件下,离心10 min。重复冲洗过程4次后,红细胞于4 ℃冰箱低温贮存备用。
将嵌合肽与绵羊血红细胞以9∶1的比例混匀,阳性组加入SDS溶液和绵羊血红细胞混匀,空白组加入PBS溶液和绵羊血红细胞混匀。分别置于恒温培养箱,在37 ℃条件下,反应3 h。反应结束后,在4 ℃、4 000 r/min条件下,离心10 min。取上清液100 μL加入96孔酶标板中,通过酶标仪测定OD540值。溶血率的计算如公式(2)所示:
溶血率![]()
(2)
1.4 数据处理与分析
本研究中所有试验均重复3次。试验数据采用IBM SPSS Statistic 26软件和Microsoft Office Excel 2020软件进行统计分析,以平均值±标准差进行表示,P<0.05代表差异具有统计学意义。
2 结果与分析
2.1 驼乳源LFA-LFC嵌合肽的合成及理化性质
本研究采用高效液相色谱鉴定嵌合肽纯度达到98%以上。通过质谱仪和软件分析对嵌合肽的分子特性进行检测。结果表明,驼乳源LFA-LFC嵌合肽分子质量为4 357.26 g/mol,等电点为11.60,净电荷值为10.9,亲水残基比达到25%。研究发现抗菌肽主要通过自身所带正电荷与细菌细胞膜所带负电荷区域发生静电作用,进而发挥抑菌效果[11]。由此可以看出抗菌肽的净电荷值与疏水性影响其抗菌特性。嵌合肽的净电荷值与亲水残基比越高,其抗菌性能越强。天然阳离子抗菌肽所带正电荷数一般为2~9个[1]。梁东升等[12]设计筛选得到的抗变异链球菌多肽AT-7净电荷值为5,已经具有良好的抗菌效果。与之相比,驼乳源LFA-LFC嵌合肽所带正电荷更多。
抗菌肽中存在不同的二级构象,影响抗菌肽的空间结构进而影响其功能稳定性。为了进一步探究驼乳源LFA-LFC嵌合肽的功能特性,本研究通过CD测定其二级结构,分别包含:12.38%的α-螺旋结构、40.66%的β-折叠结构、15.24%的β-转角结构和31.65%的无规则卷曲。其中α-螺旋和β-折叠占比达到50%以上。与TU等[13]对合成肽GH12进行二级结构的鉴定结果相似。鉴于上述研究结果发现驼乳源LFA-LFC嵌合肽具有一定的抗菌特性潜能,具备进一步探究的价值。
2.2 驼乳源LFA-LFC嵌合肽的合成及理化性质
2.2.1 驼乳源LFA-LFC嵌合肽MIC、MBC的测定
MIC试验结果显示嵌合肽对S.mutans、S.salivariu的抑菌效果更强,MIC值达到32 μmol/L,比S.sobrinus的MIC值低2倍。MBC试验结果与上述结果一致,S.mutans、S.salivariu的MBC值较小,均为128 μmol/L,而S.sobrinus的MBC值达到256 μmol/L(表1)。由此可知,该嵌合肽对3株致病菌均表现出抑菌活性。
钟亨任[14]研究表明抗菌肽GHc和GHd对变异链球菌的MIC值分别为12.6、13.1 μmol/L。其MIC值较低可能与抗菌肽的二级结构有关,α-螺旋含量较高,可以更有效地发挥抗菌作用。而何佳宁等[15]合成得到的短链抗菌肽KR-1对S.sobrinus菌的MIC值为51.2 μmol/L,与本研究中嵌合肽的抗菌效果相似。
表1 驼乳源LFA-LFC嵌合肽MIC、MBC的测定
Table 1 Determination of the LFA-LFC chimeric peptide MIC、MBC

菌株MIC/(μmol·L-1)MBC/(μmol·L-1)S.mutans32128S.salivarius32128S.sobrinus64256
2.2.2 不同pH培养基对驼乳源LFA-LFC嵌合肽抗菌效果的影响
口腔是复杂的动态环境,正常生理条件下口腔唾液的pH值维持在6.6~7.1[16]。因此本研究以口腔环境酸碱度为依据,测定不同pH培养环境下嵌合肽对S.mutans、S.salivariu、S.sobrinus MIC值的变化。结果发现不同pH值对嵌合肽的MIC值有较为显著的影响(表2)。pH值为6.3~7.1时,各细菌的MIC值没有发生变化,均为64 μmol/L。随着pH值增大,嵌合肽对3株菌均呈现出更强的抗菌效果。当pH值降低为8.3时,3株菌的MIC值全部缩小4倍。这一结果符合链球菌产酸耐酸的生理特性。同时说明碱性环境更有利于嵌合肽发挥对口腔致龋菌的抑制作用。杜鹃[9]研究结果表明,pH上升有利于抗菌肽抗菌活性的增强,与本研究结果一致。营秀[17]研究唾液对抗菌肽pm11抗菌作用的影响,发现pm11溶解在唾液或超纯水中抑菌效果在统计学上无差异。而驼乳源LFA-LFC嵌合肽在pH值6.3~7.1时,MIC值无变化。当pH值达到7.3及以上,其抑菌效果增强。这可能是相较于培养基,口腔环境中唾液成分更复杂,对抗菌肽的抑菌效果产生干扰。
表2 不同pH值驼乳源LFA-LFC嵌合肽MIC的测定
Table 2 Determination of the LFA-LFC chimeric peptide MIC at different pH
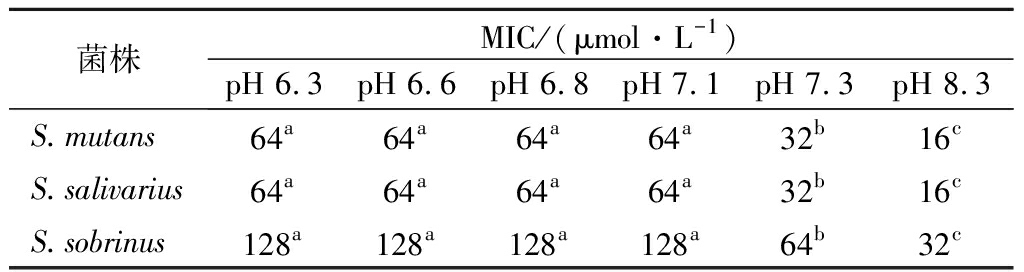
菌株MIC/(μmol·L-1)pH 6.3pH 6.6pH 6.8pH 7.1pH 7.3pH 8.3S.mutans64a64a64a64a32b16cS.salivarius64a64a64a64a32b16cS.sobrinus128a128a128a128a64b32c
注:同一菌株不同嵌合肽浓度标注小写字母不同表示差异显著(P<0.05)
2.2.3 菌体时间-致死曲线的测定
驼乳源LFA-LFC嵌合肽对S.mutans、S.salivariu和S.sobrinus 3株菌均表现出显著的杀菌效果(图1)。纵向比较嵌合肽浓度对3株菌的抑菌效果,可以发现1×MIC浓度嵌合肽对S.mutans、S.salivariu和S.sobrinus在30 min时,菌体全部到达致死状态。而2×MIC浓度嵌合肽对S.mutans、S.salivariu和S.sobrinus分别为5、2、15 min时,菌体已经到达完全致死状态。嵌合肽浓度越高,其对细菌的抑制作用越明显。横向比较嵌合肽对3株菌的抑菌效果亦存在强弱差,其中嵌合肽对S.salivariu的抑制作用最强,对S.sobrinus的抑制作用最弱。该结果与2.2.1对嵌合肽的MIC、MBC的测定结果一致。
魏诗[18]研究发现,抗菌肽浓度对S.mutans杀菌时间及程度呈浓度依赖现象。同时TU等[13]研究结果表明2×MIC抗菌肽GH12在60 min内将S.mutans全部杀死,4×MIC只需要20 min即可使S.mutans致死。这与本研究结果一致,高浓度驼乳源LFA-LFC嵌合肽对细菌的抑制效果更迅速。
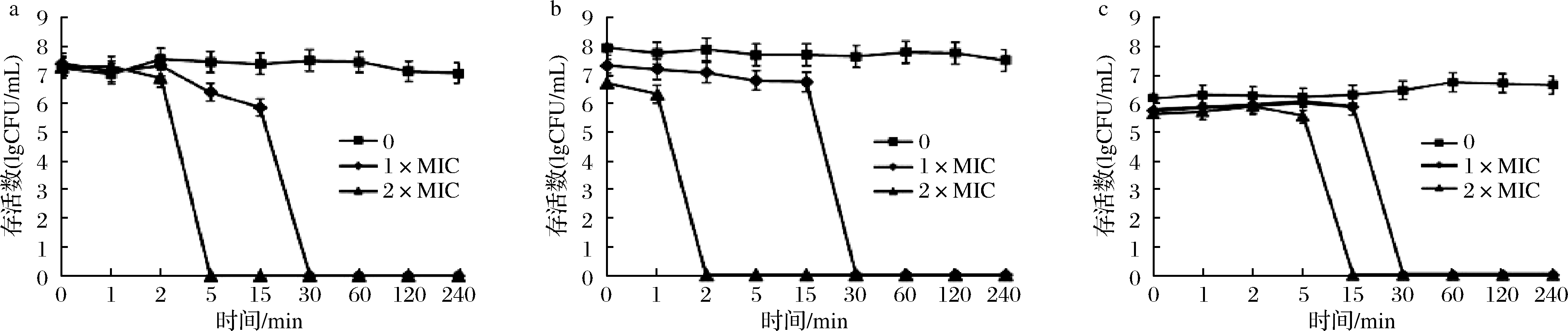
a-S.mutans;b-S.salivariu;c-S.sobrinus
图1 时间-致死曲线
Fig.1 Time-Killing curves
2.3 驼乳源LFA-LFC嵌合肽杀菌作用机制的研究
2.3.1 预防菌体生物膜生成试验
人体口腔内的病原菌可在口腔内形成生物膜使病原微生物在牙齿表面附着,且生物膜的酸化现象可导致牙齿脱矿,加速口腔疾病的发展。因此破坏口腔内生物膜的生成是预防龋齿的重要环节。本研究将嵌合肽与口腔致龋菌共培养探究嵌合肽对口腔内生物膜形成的影响。研究发现,当嵌合肽浓度达到16 μmol/L时,生物膜生成量开始有所减少。在嵌合肽浓度达到128 μmol/L时,S.mutans、S.salivariu的生物膜生成量减少约80%,几乎被完全抑制;虽然嵌合肽对预防S.sobrinus生物膜生成作用较弱,但减少量也较为显著,达到70%以上(图2)。由此可知,高浓度嵌合肽有效预防生物膜的生成。这是由于嵌合肽带正电荷,与革兰氏阳性菌细胞表面带负电荷的磷壁酸发生静电作用,抑制细菌生长繁殖。进一步损害生物膜的完整性,破坏细菌的生存环境。

a-S.mutans;b-S.salivariu;c-S.sobrinus
图2 预防变异链球菌、唾液链球菌、远缘链球菌生物膜的形成
Fig.2 Inhibition of biofilm formation of S.mutans, S.salivariu, and S.sobrinus
ZHANG等[19]通过扫描电子显微镜观察牙釉质表面生物膜的生成发现,抗菌肽DPS-PI处理后的切片表面菌体稀疏分布,表明DPS-PI可以有效抑制牙釉质生物膜的形成。李欣蔚等[20]研究发现抗菌肽GH12对口腔致龋菌生物膜同样表现出一定的损伤作用。这与本研究的试验结果一致,证明驼乳源LFA-LFC嵌合肽对预防生物膜生成发挥较为显著的作用,具备维护口腔健康的潜能。
2.3.2 消除菌体生物膜试验
驼乳源LFA-LFC嵌合肽对口腔致龋菌已形成的生物膜表现出一定的消除作用(图3)。随着嵌合肽浓度增大,生物膜剩余量逐渐减少。当嵌合肽浓度达到512 μmol/L时,嵌合肽对S.mutans、S.salivariu已形成的生物膜消除率可达到约50%,对S.sobrinus已形成的生物膜消除率可达到约40%。本研究结果虽然表明嵌合肽可以减缓已形成的生物膜发展,但是消除效果并不理想。
LEIVA-SABADINI等[21]研究发现从蜂蜜中获得的抗菌肽Hec-Evs尽管对变异链球菌生物膜表现出一定程度的抑制,但仍然可以黏附在表面并建立暴露于较低浓度抗菌肽时的早期生物膜。而贾丽丽[22]的研究也表明抗菌肽对生物膜的消除作用较弱,需要机械作用辅助进行清理。因此我们推测这可能与嵌合肽的抗菌机制有关。针对已形成的生物膜,需要寻找另外一种高效率的方法代替。
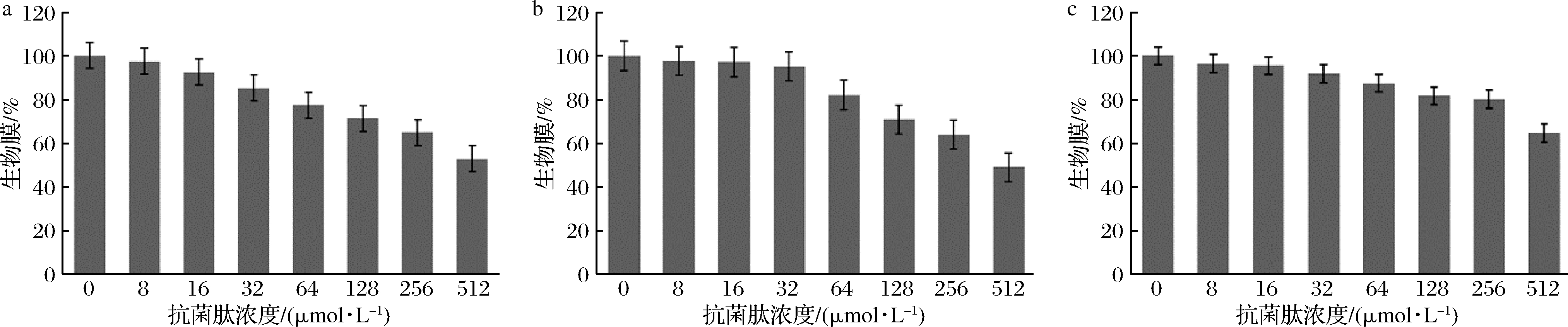
a-S.mutans;b-S.salivariu;c-S.sobrinus
图3 消除生物膜试验
Fig.3 Eradication of preformed biofilm
2.3.3 TEM观察
通过TEM观察驼乳源LFA-LFC嵌合肽对不同菌体的作用效果(图4)。未经嵌合肽处理的细菌细胞结构完整,细胞膜清晰可见,尤其是细胞质区域的电子密度致密均匀。与之相比,经128 μmol/L嵌合肽处理后,3株细菌的细胞均呈现不同程度的结构变化。S.mutans细胞膜已经完全溶解,细胞内部开始出现孔洞。S.salivariu细胞膜明显出现泡沫状裂解,细胞质区域的电子密度减小且不均匀。S.sobrinus细胞膜丧失完整性,出现细胞质壁分离现象,细胞质内容物大量泄漏。TEM结果表明驼乳源LFA-LFC嵌合肽可能通过作用于细胞膜发挥抑菌或杀菌的作用。这与耿红娟[23]探究双功能嵌合肽(TBP-1-GGG-hBD3-3)对口腔链球菌抗菌机制的研究结果一致。
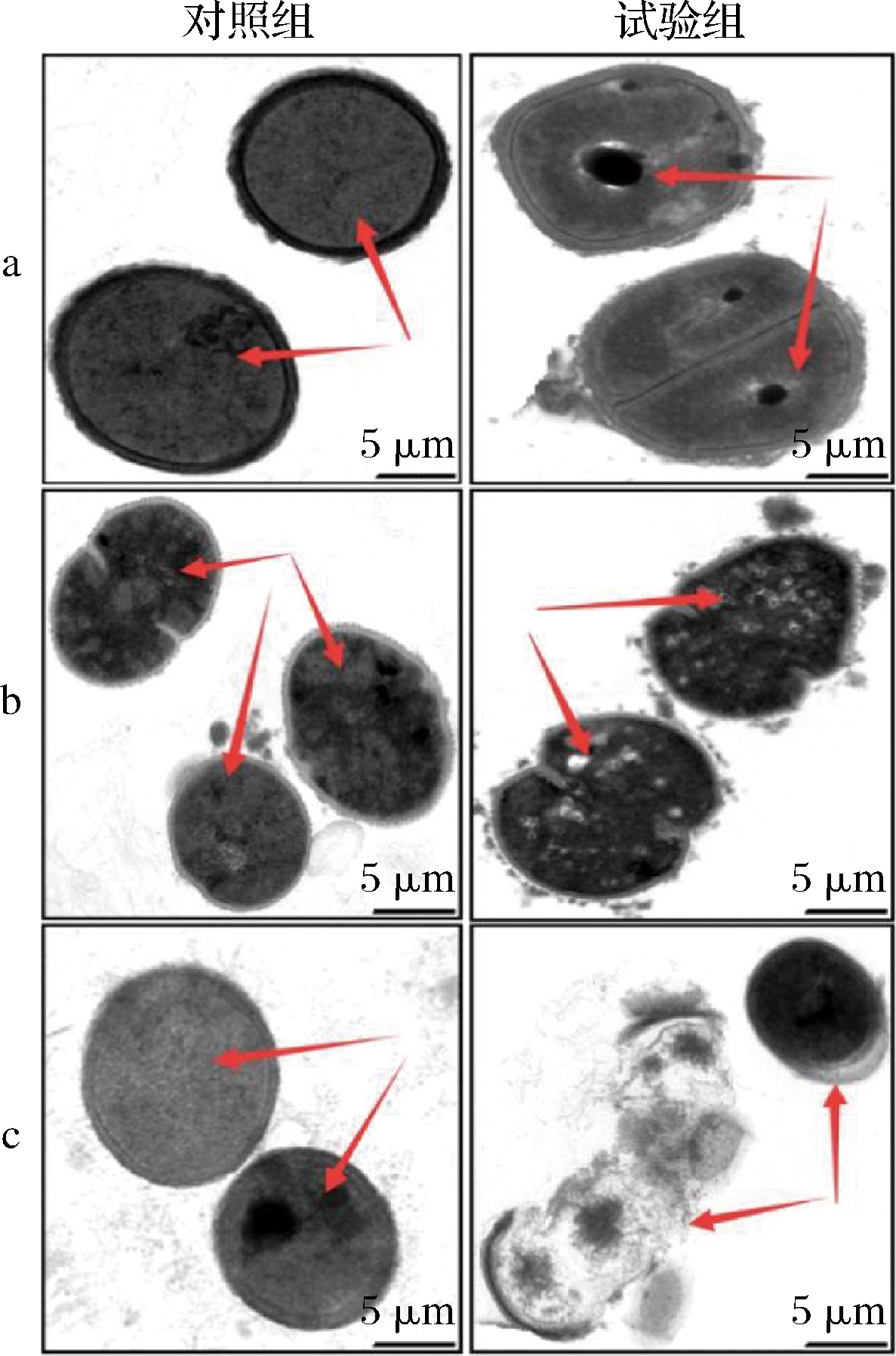
a-S.mutans;b-S.salivariu;c-S.sobrinus
图4 菌体TEM图像
Fig.4 TEM images of bacterial cells
2.3.4 CLSM观察
Hoechst 33258和尼罗红在荧光染色过程中,Hoechst 33258可以进入细胞内部与DNA结合,在CLSM下观察可看到蓝色荧光;尼罗红作为一种亲脂性染料,可以与细胞膜中的脂质成分结合,在CLSM下观察可看到红色荧光;FITC是生物学应用广泛的绿色荧光素衍生物,常用作蛋白标记。FITC-嵌合肽在CLSM下观察可看到绿色荧光。通过CLSM成像进一步定位驼乳源LFA-LFC嵌合肽在细菌细胞内部的位置(图5)。可以看到,未经处理的细菌细胞周围被带有红色荧光的细胞膜完整环绕,细胞内部存在大量带有蓝色荧光的核酸物质。经128 μmol/L FITC-嵌合肽处理后,细胞膜被破坏,红色荧光逐渐消失,大部分绿色荧光在细胞质中累积,而蓝色荧光减少。CLSM结果表明驼乳源LFA-LFC嵌合肽可以穿过细胞膜障碍并渗透到细胞内部。
WANG等[24]使用FITC作为荧光探针标记抗菌肽F1(绿色),FM-4-64(红色)标记细胞膜,并使用CLSM观察FITC-F1在细胞中的位置变化。结果发现FITC-F1渗入细胞,随着时间的延长在细胞质中累积,最终细胞膜消失,FITC-F1覆盖全部细胞质。这与本研究结果一致。
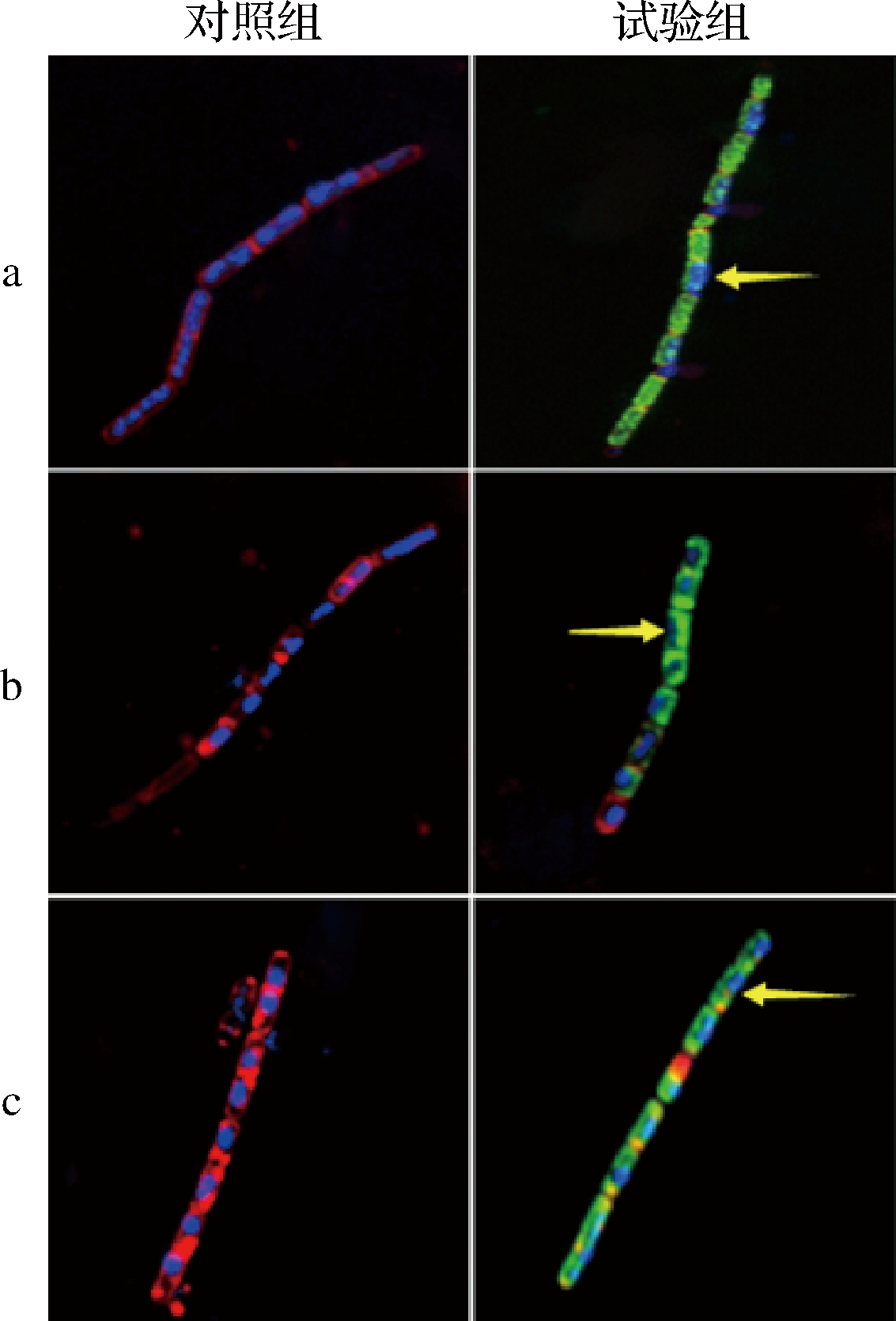
a-S.mutans;b-S.salivariu;c-S.sobrinus
图5 菌体CLSM图像
Fig.5 CLSM images of bacterial cells
2.3.5 菌体DNA电泳迁移率的测定
由图6可知,在嵌合肽的作用下DNA发生不同程度的迁移。当嵌合肽浓度分别在0~8、0~8、0~16 μmol/L时,S.mutans、S.salivariu和S.sobrinus菌体DNA迁移几乎没有受到阻滞,在泳道中出现明亮条带。S.mutans和S.salivariu菌体DNA在嵌合肽浓度达到16 μmol/L时,迁移逐渐受到阻滞;在32 μmol/L嵌合肽浓度时,S.sobrinus菌体DNA迁移开始受到阻滞,部分DNA阻滞在凝胶孔中,泳道条带亮度减弱。在64 μmol/L时,S.salivariu菌体DNA被全部阻滞在凝胶孔中,未在泳道中发现迁移条带;而S.mutans和S.sobrinus菌体DNA在128 μmol/L嵌合肽浓度时被全部阻滞。已有文献报道,菌体DNA是大多数阳离子抗菌肽的理想结合位点[25]。这主要是由于DNA带负电,阳离子抗菌肽与DNA结合,使DNA受到损伤。DNA作为生命活动重要的遗传物质,其完整性是生命发育和运转的必要条件。由此可知,驼乳源LFA-LFC嵌合肽作用于细菌DNA,使之在迁移过程中出现阻滞现象,抑制DNA遗传复制,影响细菌正常的生长繁殖。
杜鹃[9]研究表明高浓度抗菌肽P26才能与细菌DNA完全结合,发挥抑制生长的作用。这也能证明驼乳源LFA-LFC嵌合肽可以通过进入细菌内部与DNA结合发挥良好的抑菌作用。
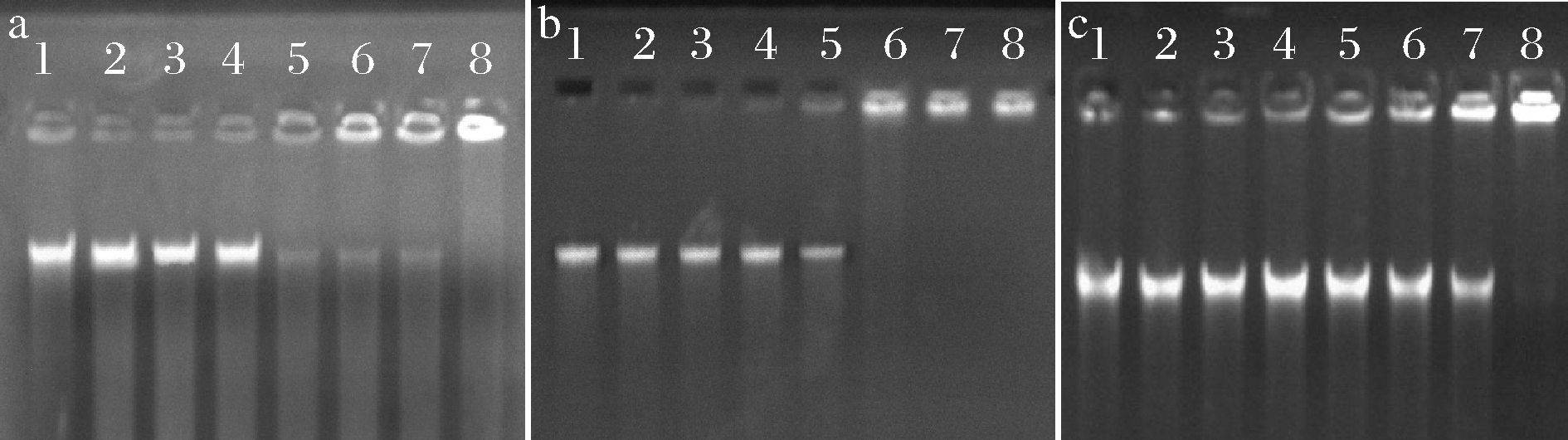
泳道1~8分别为嵌合肽浓度0、2、4、8、16、32、64、128 μmol/L的试验组 a-S.mutans;b-S.salivariu;c-S.sobrinus
图6 菌体DNA电泳迁移率
Fig.6 Electrophoretic mobility of bacterial DNA
2.4 驼乳源LFA-LFC嵌合肽溶血性的测定
本研究通过测定绵羊血红细胞溶血率评估驼乳源LFA-LFC嵌合肽对哺乳动物细胞的损伤性。结果发现,嵌合肽浓度对溶血率存在一定影响(图7)。当嵌合肽浓度达到32 μmol/L时,作用3 h,嵌合肽的溶血率仅达到约20%,之后溶血率上升趋势减缓。练家惠等[10]通过改造溶血率较高的天然抗菌肽Temporin-1Dra,得到新的合成肽溶血率在2~4×MIC下仍低于10%,明显低于驼乳源LFA-LFC嵌合肽。有文献表示,抗菌肽所带电荷数对其溶血率产生影响,正电荷数越高,溶血现象越严重[10]。因此我们猜测驼乳源LFA-LFC嵌合肽溶血率相对较高可能是因为其所带正电荷数过高。口腔属于动态环境,复杂多变,目前市面上漱口水作用时间一般为30 s,由此可以推测,当嵌合肽被应用于口腔产品时,作用时间减少,溶血率也会相应降低。
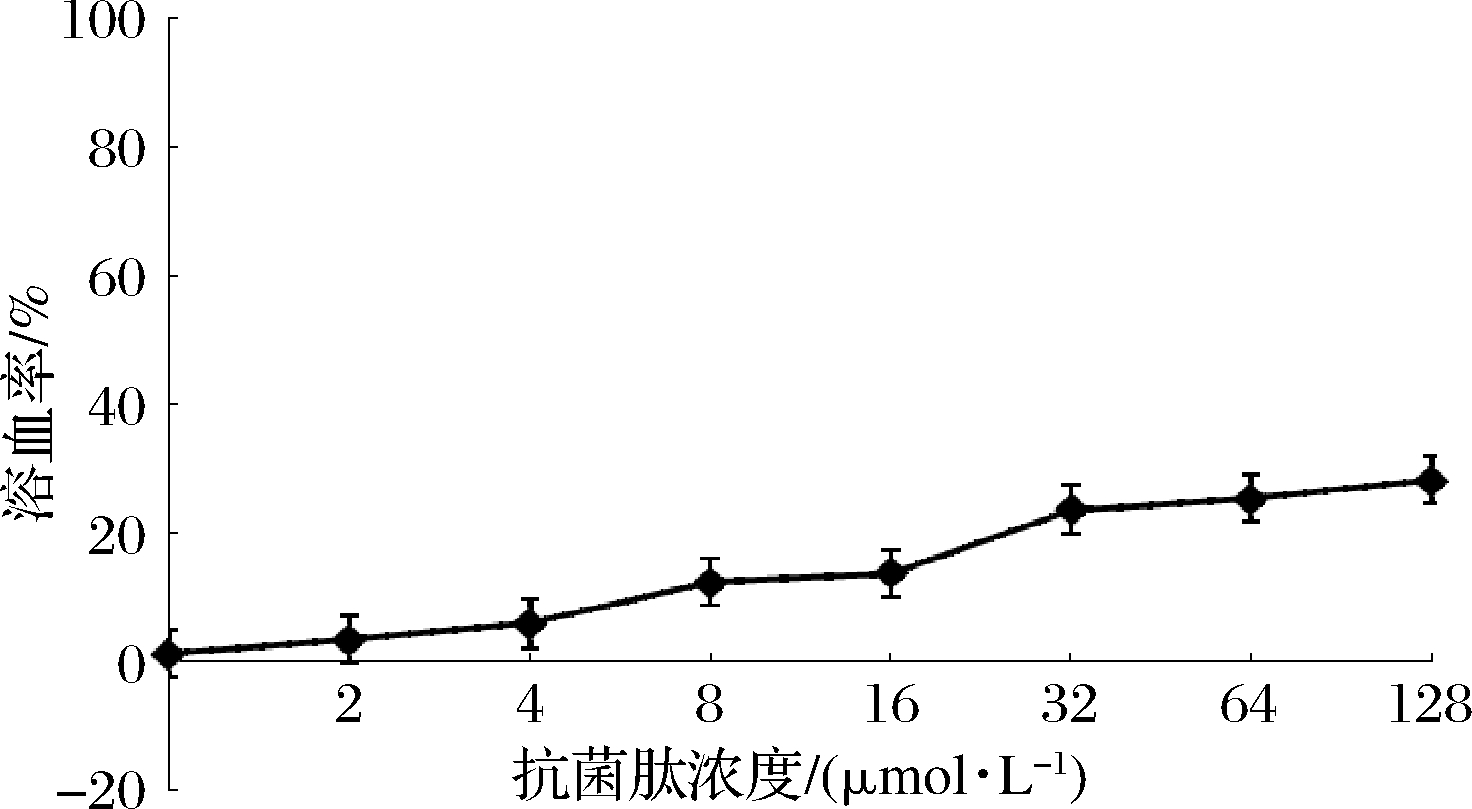
图7 驼乳源LFA-LFC嵌合肽溶血率
Fig.7 Hemolysis rate of LFA-LFC chimeric peptide
3 结论
本研究通过增加阳离子数,嵌入1个赖氨酸连接LFampin265-284和驼乳LFcin17-30获得驼乳源LFA-LFC嵌合肽,对S.mutans、S.salivariu和S.sobrinus具有快速高效的抑制杀灭作用;可以穿过细胞膜进入细胞内部,与菌体DNA相互作用,破坏细胞的遗传物质,阻碍细菌生长繁殖。这为优化抗菌肽结构,深入探究抗菌肽的作用机制,维护人体口腔环境健康提供新思路。
[1] NIUJ Y, YIN I X, WU W K K, et al.Antimicrobial peptides for the prevention and treatment of dental caries:A concise review[J].Archives of Oral Biology, 2021, 122:105022.
[2] SELWITZ R H, ISMAIL A I, PITTS N B.Dental caries[J].Lancet, 2007, 369(9 555):51-59.
[3] 王雨霏, 陈相书, 张凌琳.细菌抗菌肽耐药机制研究进展[J].微生物学报, 2019, 59(8):1 419-1 428.
WANG Y F, CHEN X S, ZHANG L L.Advances in studying bacterial resistance to antimicrobial peptides[J].Acta Microbiologica Sinica, 2019, 59(8):1 419-1 428.
[4] TAO R C, JUREVIC R J, COULTON K K, et al.Salivary antimicrobial peptide expression and dental caries experience in children[J].Antimicrobial Agents and Chemotherapy, 2005, 49(9):3 883-3 888.
[5] MAI S, MAUGER M T,NIU L N, et al.Potential applications of antimicrobial peptides and their mimics in combating caries and pulpal infections[J].Acta Biomaterialia, 2017, 49:16-35.
[6] DIAZ P I, CHALMERS N I, RICKARD A H, et al.Molecular characterization of subject specific oral microflora during initial colonization of enamel[J].Applied and Environmental Microbiology, 2006, 72(4):2 837-2 848.
[7] BERLUTTI F, AJELLO M, BOSSO P, et al.Both lactoferrin and iron influence aggregation and biofilm formation in Streptococcus mutans[J].Biometals, 2004, 17(3):271-278.
[8] 冯梦雅, 崔莉, 刘健康, 等. 骆驼乳的营养价值及在预防疾病中的应用与作用机制研究进展[J]. 食品科学, 2022, 43(11):392-401.
FENG M Y, CUI L, LIU J K, et al. Progress in understanding the nutritional value of camel milk and its application and mechanism of action in preventing diseases[J]. Food Science, 2022, 43(11):392-401.
[9] 杜娟. P26抗菌肽的抗菌活性及作用机制研究[D].合肥:安徽农业大学, 2020.
DU J.Study on antibacterial activity and mechanism of antibacterial peptide P26[D].Hefei:Anhui Agricultural University, 2020.
[10] 练家惠, 陈向东, 汪辉, 等.人工合成抗菌肽生物信息学分析及其抑菌活性研究[J].药学与临床研究, 2020, 28(4):251-254.
LIAN J H, CHEN X D, WANG H, et al.Bioinformatics and antimicrobial activity of a remoulded antimicrobial peptide[J].Pharmaceutical and Clinical Research, 2020, 28(4):251-254.
[11] LAZZARO B P, ZASLOFF M, ROLFF J.Antimicrobial peptides:Application informed by evolution[J].Science, 2020, 368(6 490):eaau5480.
[12] 梁东生, 李焕影, 许晓虎, 等.抗变异链球菌多肽的设计、筛选及抗菌效果评价[J].南方医科大学学报, 2019, 39(7):823-829.
LIANG D S, LI H Y, XU X H, et al.Design, screening and antimicrobial activity of novel peptides against Streptococcus mutans[J].Journal of Southern Medical University, 2019, 39(7):823-829.
[13] TU H X, FAN Y Y, LU X P, et al.Activity of synthetic antimicrobial peptide GH12 against oral streptococci[J].Caries Research, 2016, 50(1):48-61.
[14] 钟亨任. 海南沼蛙Temporin及Brevinin抗菌肽对革兰氏阳性菌生物被膜的抑制作用[D].海口:海南大学, 2019.
ZHONG H R. Inhibition of gram-positive bacterial biofilm by antibacterial peptides Temporin and Brevinin from Hylarana guentheri skin of Hainan[D].Haikou:Hainan University, 2019.
[15] 何佳宁, 梁东生, 梁悦娥, 等.新型抗菌肽KR-1的设计、筛选及抗菌活性评价[J].南方医科大学学报, 2021, 41(6):923-930.
HE J N, LIANG D S, LIANG Y E, et al.Design,screening and antibacterial activity evaluation of the novel antibacterial peptide KR-1[J].Journal of Southern Medical University, 2021, 41(6):923-930.
[16] 罗瑞平, 李杏崧, 方滨.加强护理干预对重症患者口腔pH值的影响与预防口腔异味及呼吸机相关性肺炎的效果分析[J].中国现代药物应用, 2020, 14(22):243-244.
LUO R P, LI X S, FANG B.Effects of intensive nursing intervention on oral pH value and prevention of oral odor and ventilator-associated pneumonia in severe patients[J].Chinese Journal of Modern Drug Application, 2020, 14(22):243-244.
[17] 营秀. 新型优化多肽pm11对口腔常见微生物杀菌作用的初步研究[D].合肥:安徽医科大学, 2016.
YING X.The preliminary study of antimicrobial effect of pm11 peptide on oral microorganisms[D].Hefei:Anhui Medical University, 2016.
[18] 魏诗. 抗菌肽对口腔常见致病菌及biofilm的抑制作用以及抗炎活性的研究[D].大连:辽宁师范大学, 2013.
WEI S. Effect of antimicrobial peptides on the growth of oral pathogens and Streptococcus mutans biofilm and anti-inflammatory activity[D].Dalian:Liaoning Normal University, 2013.
[19] ZHANG L Y, FANG Z H, LI Q L, et al.A tooth-binding antimicrobial peptide to prevent the formation of dental biofilm[J].Journal of Materials Science:Materials in Medicine, 2019, 30(4):45.
[20] 李欣蔚, 王雨霏, 姜文韬, 等.抗菌肽GH12对龋相关三菌种生物膜形貌及菌种构成的影响[J].华西口腔医学杂志, 2021, 39(2):188-194.
LI X W, WANG Y F, JIANG W T, et al.Effects of antimicrobial peptide GH12 on the morphology and composition of cariogenic three-species biofilm[J].West China Journal of Stomatology, 2021, 39(2):188-194.
[21] LEIVA-SABADINI C, ALVAREZ S, BARRERA N P, et al.Antibacterial effect of honey-derived exosomes containing antimicrobial peptides against oral streptococci[J].International Journal of Nanomedicine, 2021, 16:4 891-4 900.
[22] 贾丽丽. 新型抗菌肽对口腔细菌及其生物膜的抑制作用和应用研究[D].北京:北京化工大学, 2016.
JIA L L. The inhibition and application of a novel antibacterial peptide against oral pathogens and biofilm[D].Beijing:Beijing University of Chemical Technology, 2016.
[23] 耿红娟. 应用双功能嵌合肽修饰钛种植体表面抑制生物膜形成的研究[D].天津:天津医科大学, 2018.
GENG H J.Engineered chimeric peptides with antimicrobial and titanium-binding functions to inhibit biofilm formation on Ti implants[D].Tianjin:Tianjin Medical University, 2018.
[24] WANG Q, MIAO J Y, FENG K L, et al.Antibacterial action of peptide F1 against colistin resistance E.coli SHP45 (mcr-1)[J].Food & Function, 2020, 11(11):10 231-10 241.
[25] LAN Y, YE J, KOZLOWSKA J, et al.Structural contributions to the intracellular targeting strategies of antimicrobial peptides[J].Biochimica et Biophysica Acta (BBA)-Biomembranes, 2010, 1 798(10):1 934-1 943.