无籽刺梨(Rosa sterilis)属蔷薇科蔷薇属植物,广泛分布于四川、湖南、贵州等亚热带及暖温带地区,别名缫丝花、刺梨蔷薇。果实中含有丰富的营养物质,其中黄酮含量约为8 000 mg/kg,是银杏的11~12倍,堪称“黄酮之王”[1],具有预防心血管疾病、抗氧化、抗癌、抗疲劳及延缓衰老等生理功能[2-3]。无籽刺梨的黄酮类化合物主要以黄酮糖苷形式存在[4],溶解性低,稳定性差,易受pH、温度、光照及添加剂影响氧化分解,限制了其应用范围。PEREZ-MORAL等[5]、ELEGBEDE等[6]研究发现植物黄酮在胃肠道消化中易被降解,导致生物利用率及稳定性降低,限制了其生物活性的发挥。因此,如何保证黄酮提取物的稳定性对无籽刺梨黄酮的应用具有极其重要的价值。
微胶囊技术是利用高分子材料将固体、液体或气体包封形成微小粒子的保护技术,可以在保留芯材原有特性前提下实现缓释或持久保存[7]。但单一的高分子材料存在机械性能差、热稳定性较低等缺点。采用新型材料改性微胶囊壁材,强化壁材性能,提高微胶囊稳定性成为本领域的研究热点[8]。纳米SiO2作为一种常用的高分子材料改良剂,具有较高的比表面积、表面活性、热稳定性以及良好的生物相容性,其自身基团如硅氧键(—Si—O—Si—)、羟基(—OH),以及含有空的成键轨道的硅原子等,可与大豆分离蛋白的氨基等基团结合形成氢键和配位键,使分子间结构更致密,空间缩小,赋予高分子材料特殊性能,提高复合材料的机械性,降低透水、透气性等[9]。
基于此,本文利用纳米SiO2对大豆分离蛋白(soy protein isolate, SPI)进行修饰改性,以改性后的SPI为微胶囊的壁材、无籽刺梨果渣黄酮为芯材制备黄酮微胶囊,通过分析纳米SiO2添加量对黄酮微胶囊性能的影响,为纳米SiO2改性微胶囊壁材制备黄酮微胶囊技术提供理论基础。
1 材料与方法
1.1 材料与试剂
无籽刺梨果渣黄酮(实验室自制)。
SPI,广东广雅食品有限公司;纳米SiO2(20~30 nm),舟山明日公司;芦丁标准品(色谱级,98%),上海源叶生物科技公司;三羟甲基氨基甲烷,北京鼎国昌盛生物技术有限责任公司;纤维素酶(CAS 9012-54-8,酶活力35 U/mg,BR级别),南京都南生物公司;DPPH,上海麦克林生化科技有限公司;胃蛋白酶(猪胃黏膜)、胰蛋白酶(牛胰),南京都莱生物技术有限公司;单甘脂(食品级),佳力士添加剂有限公司。
1.2 仪器与设备
BUCHIB-290喷雾干燥设备,瑞士Buchi公司;HSP-80B恒温恒湿箱,上海坤天实验室仪器;SB25-12DTDS超声波清洗仪,宁波新艺超声设备有限公司;FJ200-SH高速剪切分散机,上海沪析实业有限公司;Sigma3 K15离心机,德国Sigma离心机有限公司;DSC204差示热量扫描仪,德国Netzsch仪器制造有限公司;TERRA XRD衍射仪,美国Innov-X公司;650傅立叶变换红外光谱仪,天津港东科技有限公司;TM3000扫描电镜,日本Hitachi高新技术公司;SHZ-82恒温振荡器,常州智博瑞仪器制造有限公司。
1.3 无籽刺梨黄酮的纯化
无籽刺梨黄酮粗提物的制备参照杨宗玲等[10]的方法。参照张汇慧[11]纯化无籽刺梨黄酮粗提物。以1 mL无水乙醇溶解0.5 g黄酮粗提物,加蒸馏水至其质量浓度为5 mg/mL。50 ℃搅拌60 min使黄酮充分溶解。样液加入AB-8大孔树脂,37 ℃振荡24 h。抽滤,用蒸馏水洗去树脂表面杂质。加入体积分数80%的乙醇(pH=6),37 ℃振荡6 h以解吸吸附于树脂中的黄酮。抽滤,滤液采用旋转蒸发仪浓缩至浸膏,真空冷冻干燥,研磨即得纯化黄酮,纯度为(82.2±1.5)%。
1.4 纳米SiO2改性黄酮微胶囊的制备
1.4.1 改性纳米SiO2的制备
取1.00 g纳米SiO2(20~30 nm)加入到200 mL、质量分数0.7%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液,用10%(体积分数)醋酸溶液调pH值至4.0,80 ℃下搅拌6 h,5 500 r/min离心10 min,然后用70~80 ℃蒸馏水反复离心洗涤纳米SiO2至中性。60 ℃干燥12 h,研磨,将研磨所得粉末保存于装有干燥剂的干燥器中备用。本文中分析的SiO2性质均为改性后的SiO2。
1.4.2 纳米SiO2/SPI为壁材的黄酮微胶囊的制备
以芯壁比1∶7,固形物含量5%,单甘脂添加量0.1%,纳米SiO2添加量为SPI的0%、5%、7%(质量分数)制备纳米SiO2改性黄酮微胶囊。具体方法如下:
(1)芯材溶液制备:称取一定量纯化后的黄酮粉末,加入体积分数为55%的乙醇50 mL、单甘脂于60 ℃搅拌(500 r/min)10 min,使黄酮和单甘脂充分溶解,用1 mol/L的NaOH调节芯材溶液pH为7.0,降温至35 ℃得到芯材溶液。
(2)纳米SiO2改性黄酮微胶囊的制备:不同添加量的纳米SiO2分散到187.5 mL去离子水中,570 W超声破碎2 h,得纳米SiO2分散液。加入SPI到分散液,80 ℃、500 r/min搅拌30 min,使SPI充分溶解得壁材溶液。将制备好的芯材溶液,在500 r/min条件下缓慢加入到制备好的壁材溶液中,35 ℃搅拌30 min。搅拌结束后,以14 000 r/min高速分散4 min,所得溶液进行喷雾干燥。喷雾干燥条件为进风温度140 ℃,出风温度为60~70 ℃,进料流量为9 mL/min。喷雾干燥所得样品即为纳米SiO2改性黄酮微胶囊样品。为方便后期描述,将制备好的微胶囊样品根据纳米SiO2的添加量命名为MIC-0(0%)、MIC-5(5%)和MIC-7(7%)。
1.5 微胶囊物理性质测定
1.5.1 包埋率测定
黄酮微胶囊包埋率的测定参考曹侃[12]的方法稍作修改。表面黄酮含量(m1)测定:取0.1 g黄酮微胶囊,用15 mL无水乙醇反复洗涤抽滤,合并滤液。采用刘畅等[13]黄酮含量的测定方法测滤液黄酮含量。
总黄酮含量(m2)测定:取0.1 g黄酮微胶囊,加4 mL蒸馏水溶解后,加入6 mL无水乙醇,超声20 min得待测液。取2.5 mL待测样液,以60%乙醇定容至25 mL。取1 mL于10 mL容量瓶,根据刘畅等[13]的方法向容量瓶中依次加入质量分数为5%的NaNO2溶液0.3 mL,摇匀,静置6 min;加入质量分数为10%的Al(NO3)3溶液0.3 mL,摇匀,静置6 min;再加入1 mol/L 的NaOH溶液4 mL后用60%(体积分数)乙醇定容至10 mL,摇匀后静置15 min,波长510 nm下测量溶液吸光值。计算待测液中总黄酮含量,按照公式(1)计算微胶囊包埋率:
包埋率![]()
(1)
1.5.2 水分含量测定
采用直接干燥法,参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》。
1.5.3 堆积密度测定
参考黄珊等[14]的方法测定样品的堆积密度。分别称取2 g的MIC-0、MIC-5和MIC-7黄酮微胶囊样品倒入带有刻度的量筒中,反复振动使微胶囊粉末自然下沉,直至样品不能被压缩,计算单位体积微胶囊的质量,重复3次。按照公式(2)计算单位体积微胶囊质量:
堆积密度![]()
(2)
1.6 微胶囊抗氧化活性及还原性测定
1.6.1 微胶囊DPPH自由基清除率测定
取MIC-0、MIC-5和MIC-7样品各0.06 g,加入24 mL蒸馏水,60 ℃、500 r/min条件下搅拌20 min,使微胶囊壁材充分溶解。加入36 mL无水乙醇,继续搅拌10 min,60%乙醇定容至60 mL,得1 mg/mL黄酮微胶囊溶液。用60%的乙醇分别稀释得到质量浓度为0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40 mg/mL的黄酮微胶囊溶液作为待测样液。根据黄酮微胶囊中黄酮的含量配制具有相同质量浓度的黄酮溶液作为对照组(HT),对照组质量浓度为0.01、0.02、0.04、0.05、0.06、0.07、0.08、0.09 mg/mL。参照谭钦铎[15]DPPH自由基清除率测定方法测定黄酮微胶囊DPPH自由基清除率。
1.6.2 微胶囊羟自由基(·OH)清除率测定
根据1.6.1方法,配制质量浓度为2.0、3.5、5.0、6.5、8、9.5、11、12.5 mg/mL的黄酮微胶囊溶液作为待测样液,对照组黄酮质量浓度为0.5、0.8、1.2、1.5、1.9、2.2、2.6、2.9 mg/mL。参考张倩茹[16]·OH清除率的测定方法测定黄酮微胶囊的·OH清除率。
1.6.3 微胶囊还原能力测定
根据1.6.1方法配制质量浓度为0.5、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0 mg/mL的黄酮微胶囊溶液,对照组黄酮质量浓度为0.1、0.2、0.5、0.7、0.9、1.2、1.4、1.6、1.9 mg/mL。参照孟娜等[17]的方法测定黄酮微胶囊的还原力。
1.7 微胶囊模拟体外释放性能
(1)模拟胃液配制:取800 mL去离子水于1 000 mL烧杯中,缓慢加入9 mL浓盐酸,混匀,加入10 g胃蛋白酶。充分溶解混匀,移入1 000 mL容量瓶并用去离子水定容,所得模拟胃液于4 ℃保存备用。
(2)模拟肠液配制:取6.8 g磷酸二氢钾于500 mL去离子水中,充分溶解,采用质量分数为0.4%的NaOH调节溶液pH为6.8。另取10 g胰蛋白酶溶解于水中,将两溶液合并移入1 000 mL的容量瓶,于4 ℃保存备用。
(3)微胶囊缓释性能的测定:取0.5 g微胶囊样品于锥形瓶中,分别加入20 mL模拟胃液/肠液,37 ℃摇床110 r/min振荡。期间每15 min取1 mL样液在10 000 r/min离心15 min。取上清液测黄酮的浓度。黄酮的测定参照刘畅等[13]的方法测定,按照公式(3)计算黄酮释放率:
黄酮释放率![]()
(3)
1.8 微胶囊性能表征
1.8.1 热稳定性分析
采用差示扫描量热仪(differential scanning calorimeter, DSC)分析黄酮微胶囊热稳定性。取3~5 mg样品于铝制坩埚中,空铝坩埚为空白对照,扫描温度为30~250 ℃,升温速度为10 ℃/min,氮气流速为20 mL/min。
1.8.2 X射线衍射分析
分别取0.5 g的黄酮微胶囊样品于X射线衍射仪(X-ray diffractogram, XRD)样品盒中,采用步进扫描法测得。扫描速率10°/min,扫描范围为5°~80°。
1.8.3 红外光谱分析
取少量黄酮微胶囊粉末和溴化钾研磨,压片。用红外光谱仪(Fourier transform infrared spectroscopy, FTIR)扫描样品在400~4 000 cm-1的变化。
1.8.4 扫描电镜分析
取少量微胶囊粉末产品,用双面胶固定在样品台上,利用扫描电子显微镜在15 kV加速电压下观察MIC-0、MIC-5和MIC-7表面形貌,放大倍数4 000。
1.9 数据处理
图表中数据为3次实验数据的平均值,采用软件Origin 8.0和GraphPad Prism 5对实验数据进行绘图,软件IBM SPSS Statistics 20对实验数据进行显著性分析。
2 结果与分析
2.1 微胶囊物理性质分析
黄酮微胶囊的包埋率、水分含量和堆积密度如表1所示。样品MIC-0、MIC-5、MIC-7的包埋率均大于90%,分别为90.96%、95.44%、92.55%,MIC-5和MIC-7的包埋率略高。水分含量是影响粉末产品货架期的重要因素,粉末产品水分含量不能超过10%[18]。本研究中,MIC-0、MIC-5和MIC-7的水分含量分别为6.28%、4.55%、6.58%,当纳米SiO2添加量为5%时,水分含量最小,有利于样品的长期贮存。根据TONON等[19]的研究,粉末密度主要与分子质量有关,分子质量越高,材料越重越有利于样品容纳到颗粒之间的空隙中,从而占用较少的空间,具有较高的堆积密度。在微胶囊中,堆积密度是微胶囊材料发生氧化的重要因素,较高的堆积密度可使其贮存于更小的容器中,减少粉末空隙中的空气量,防止微胶囊氧化[20]。本研究中,MIC-0、MIC-5、MIC-7的堆积密度分别为0.29、0.22、0.28 g/cm3,相比于BOONCHU等[21]的研究,本研究制备的微胶囊堆积密度略低,这可能与微胶囊粒径分布、表面粗糙度以及微胶囊形貌的差异有关。
表1 纳米SiO2添加量对黄酮微胶囊性质的影响
Table 1 Effect of nano-SiO2addition on the properties of flavonoid microcapsules

样品A(包埋率)/%B(水分含量)/%C(堆积密度)/[g·(cm3)-1]MIC-090.96±1.25a6.28±0.28b0.29±0.02bMIC-595.44±1.16c4.55±0.33a0.22±0.01aMIC-792.55±1.21b6.58±0.23b0.28±0.02b
注:同列不同字母表示差异显著(P<0.05)
2.2 微胶囊抗氧化活性及还原性分析
2.2.1 微胶囊清除DPPH自由基能力分析
纳米SiO2改性黄酮微胶囊对DPPH自由基清除率如图1所示。随着浓度的升高,对照组和样品组(MIC-0、MIC-5和MIC-7)对DPPH自由基清除率逐渐升高,当质量浓度为0.40 mg/mL时,MIC-0、MIC-5、MIC-7和对照组对DPPH自由基的清除率分别为77.05%、76.36%、75.74%、91.5%。结果表明以纳米SiO2改性为微胶囊壁材制备黄酮微胶囊,不会影响黄酮对DPPH自由基的清除率。相比对照组,样品组DPPH自由基清除率略低,可能是微胶囊中黄酮因包埋作用,测定其DPPH自由基清除率时,黄酮未完全从微胶囊中释放。谭钦铎等[15]采用喷雾干燥法制备葛根异黄酮微胶囊,也发现了类似现象,微胶囊化后的葛根异黄酮微胶囊对DPPH自由基清除率与对照组相比下降了41.1%。本研究中,MIC-0、MIC-5和MIC-7对DPPH自由基清除率分别下降了14.15%、15.14%、15.76%。谭钦铎[15]采用研磨法,先用水对微胶囊进行破壁处理,再用醇溶解暴露出的黄酮,测得样品活性有所提高。本研究中,测定微胶囊样品活性的方法还需进一步探索。

图1 纳米SiO2改性黄酮微胶囊对DPPH自由基清除作用
Fig.1 Scavenging effect of nano-SiO2 modified flavonoid microcapsules on DPPH radicals
2.2.2 微胶囊清除·OH能力分析
MIC-0、MIC-5、MIC-7和对照组对·OH清除作用如图2所示。随着微胶囊质量浓度的升高,MIC-0、MIC-5和MIC-7对·OH清除率均呈现逐渐上升的趋势。在浓度2.0~12.5 mg/mL范围内,MIC-0、MIC-5、MIC-7和对照组对·OH清除率分别从39.35%、33.63%、35.90%、32.00%上升到84.04%、83.51%、84.51%、85.94%,样品组与对照组对·OH清除率差异不大,结果表明制备的微胶囊具有较高的清除·OH的活性,同时也表明采用喷雾干燥法制备纳米SiO2改性黄酮微胶囊对黄酮清除·OH的活性影响小。
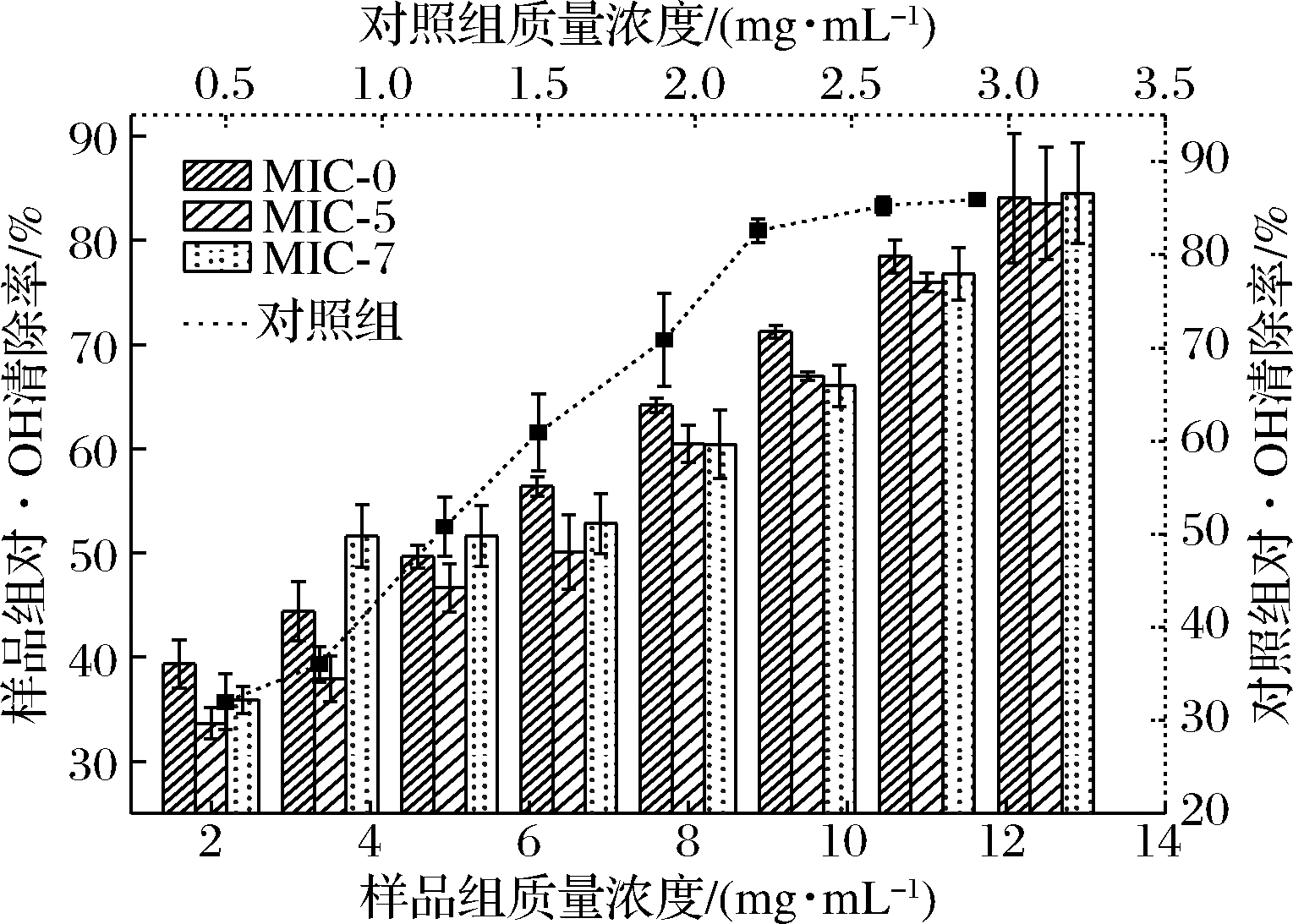
图2 纳米SiO2改性黄酮微胶囊对·OH清除作用
Fig.2 Scavenging effect of nano-SiO2 modified flavonoid microcapsules on ·OH
2.2.3 微胶囊还原能力分析
MIC-0、MIC-5、MIC-7和对照组在不同质量浓度下的还原力如图3所示。质量浓度1 mg/mL增加至7 mg/mL时,MIC-0、MIC-5、MIC-7和对照组的还原力逐渐增强,从0.519、0.514、0.565、0.554上升至5.045、4.863、4.795、4.712。当质量浓度为7 mg/mL时,继续增大微胶囊质量浓度,样品还原力无变化,组间差异小。结果表明加入纳米SiO2改性黄酮微胶囊壁材,并采用喷雾干燥法制备黄酮微胶囊对微胶囊的还原力无显著影响(P<0.05)。
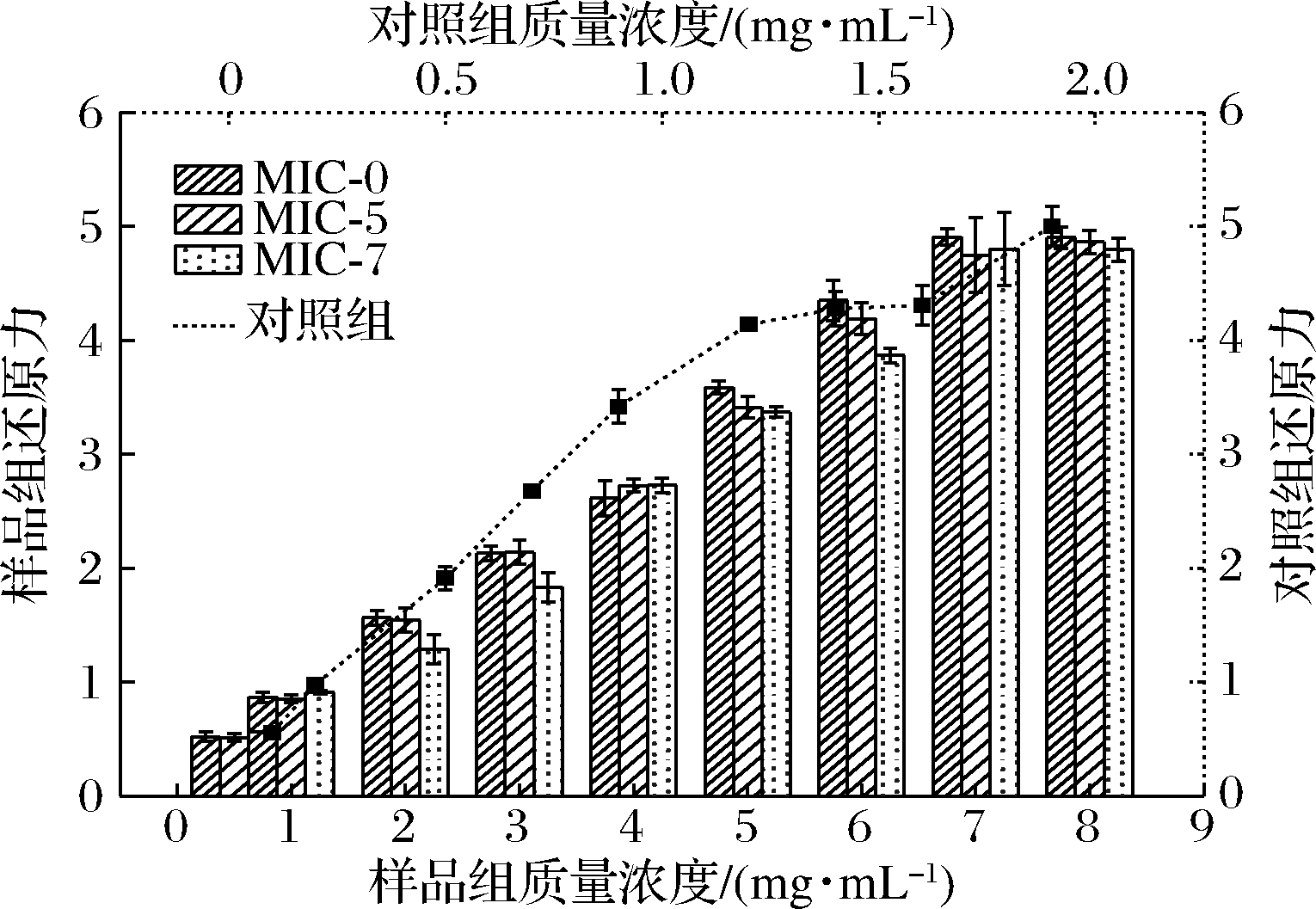
图3 纳米SiO2改性黄酮微胶囊的还原力
Fig.3 Reducing power of nano-SiO2 modified flavonoid microcapsules
2.3 微胶囊在模拟胃液和肠液中的缓释性能分析
微胶囊化可使物质具有缓慢释放的效果,同时由于壁材的保护作用,芯材在被人体吸收前不易被破坏。纳米SiO2改性黄酮微胶囊在模拟胃液和肠液中的缓释性能如图4所示。MIC-0、MIC-5和MIC-7在整个模拟胃液释放过程中累计释放量差异不大,说明加入纳米SiO2不影响黄酮微胶囊在模拟胃液中的释放。释放时间为150 min时,MIC-0、MIC-5和MIC-7的累计释放率分别为20.16%、20.16%、21.22%。黄酮微胶囊在模拟肠液中的累计释放率如图4-b所示,在整个释放过程中MIC-5和MIC-7的释放率低于MIC-0,这可能与纳米SiO2在碱性环境中结构变化有关。释放时间为150 min时,MIC-0、MIC-5和MIC-7的累计释放率分别为61.76%、60.25%、61.25%,微胶囊在模拟肠液中的释放远高于在模拟胃液中的释放,该结果说明微胶囊化能有效促进黄酮在肠道内的生物转化与吸收,提高其利用率,具有较好的缓释性能。
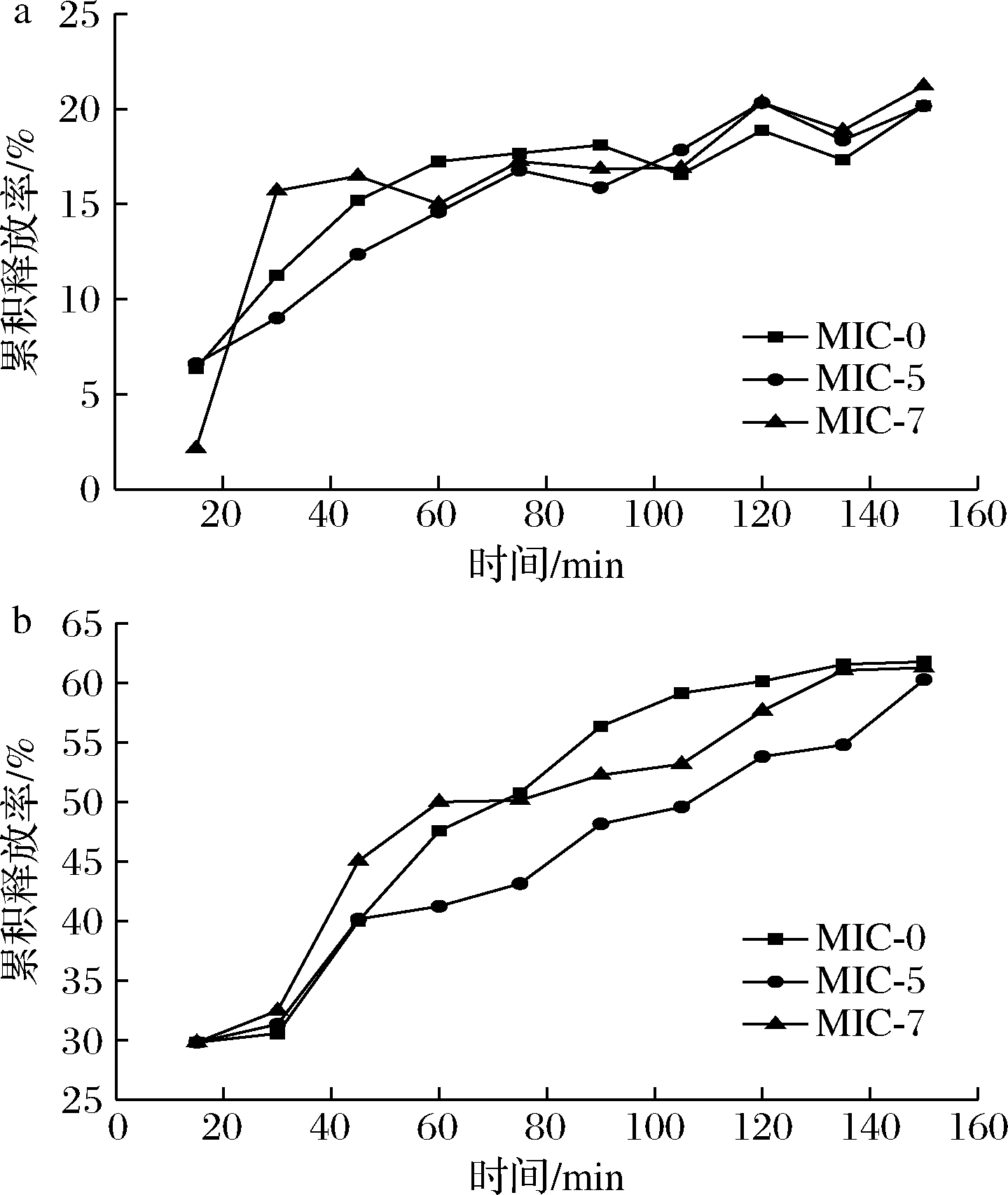
a-模拟胃液;b-模拟肠液
图4 纳米SiO2改性黄酮微胶囊在模拟胃液和 肠液中的缓释性能
Fig.4 Sustained release properties of nano-SiO2 modified flavonoid microcapsules in simulated gastric and intestinal juice
2.4 微胶囊性能表征
2.4.1 微胶囊热稳定性分析
由图5可知,SPI、纳米SiO2、HT、MIC-0、MIC-5和MIC-7对应的熔融温度分别为106.7、127.2、97.1、101.2、120.7、114.2 ℃。微胶囊化后的MIC-0、MIC-5和MIC-7的熔融温度分别比HT高出4、23.6、17.1 ℃。MIC-5和MIC-7的熔融温度分别比MIC-0高出19.5、3.0 ℃。结果表明,添加纳米SiO2显著提高了黄酮微胶囊的热稳定性,在纳米SiO2添加量超过5%后,熔融温度降低,这主要是由于纳米SiO2与SPI产生氢键,破坏氢键需要更多的外部能量,当增加纳米SiO2添加量时,纳米SiO2易团聚,不易均匀分散在壁材中,壁材结构减弱,熔融温度降低。张云峰等[22]以石蜡为芯材、三聚氰胺树脂为壁材,纳米SiO2为改性剂制备相变微胶囊,结果表明纳米SiO2用量为5%的改性相变微胶囊有最大的相变潜热,改性后复合涂料的储热性能增强。
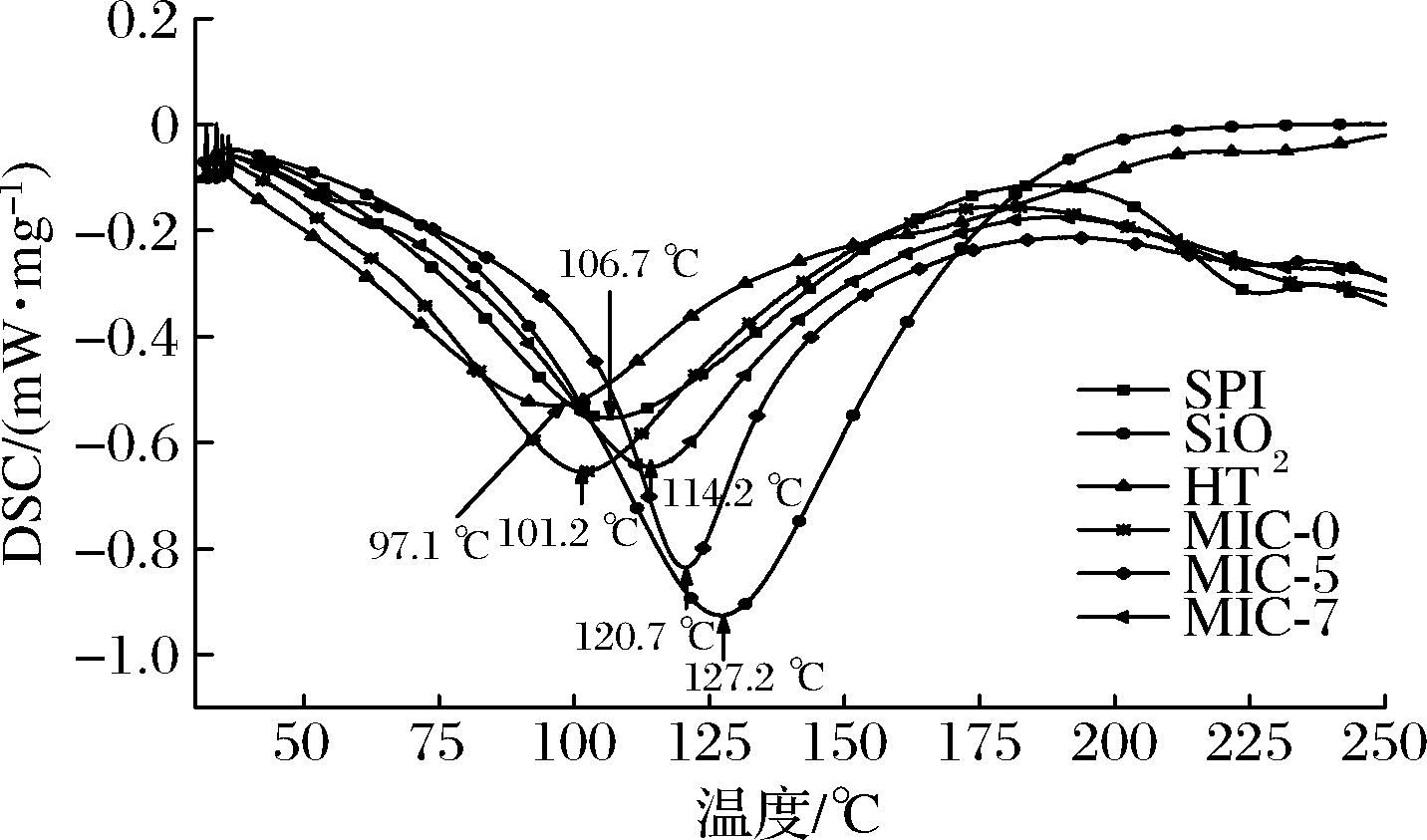
图5 纳米SiO2添加量对黄酮微胶囊热稳定的影响
Fig.5 Effect of nano-SiO2 addition on thermal stability of flavonoid microcapsules
2.4.2 微胶囊衍射图谱分析
纳米SiO2、HT、SPI、MIC-0、MIC-5、MIC-7的XRD谱图如图6所示。SPI在2θ=8.8°和2θ=19.4°出现结晶峰,为SPI二级构象的α螺旋和β-折叠结构,其中2θ=19.4°的峰形较宽,为SPI中7S与11S无定形球蛋白2种主要成分的特征衍射峰。纳米SiO2和HT分别在2θ=23.1°和2θ=21.0°出现特征衍射峰,说明纳米SiO2和HT为非晶态结构。根据XRD的结果,MIC-5和MIC-7的XRD谱图与MIC-0的XRD谱图相似,说明纳米SiO2的加入不影响黄酮微胶囊的结晶度。略有不同的是相比SPI的XRD衍射图谱,样品MIC-5、MIC-7在2θ约为8.8°处的衍射峰强度微弱,LIU等[23]将其解释为纳米SiO2与高分子化合物表面的羟基结合使羟基与氢键结合的数量减少,导致结晶度降低。
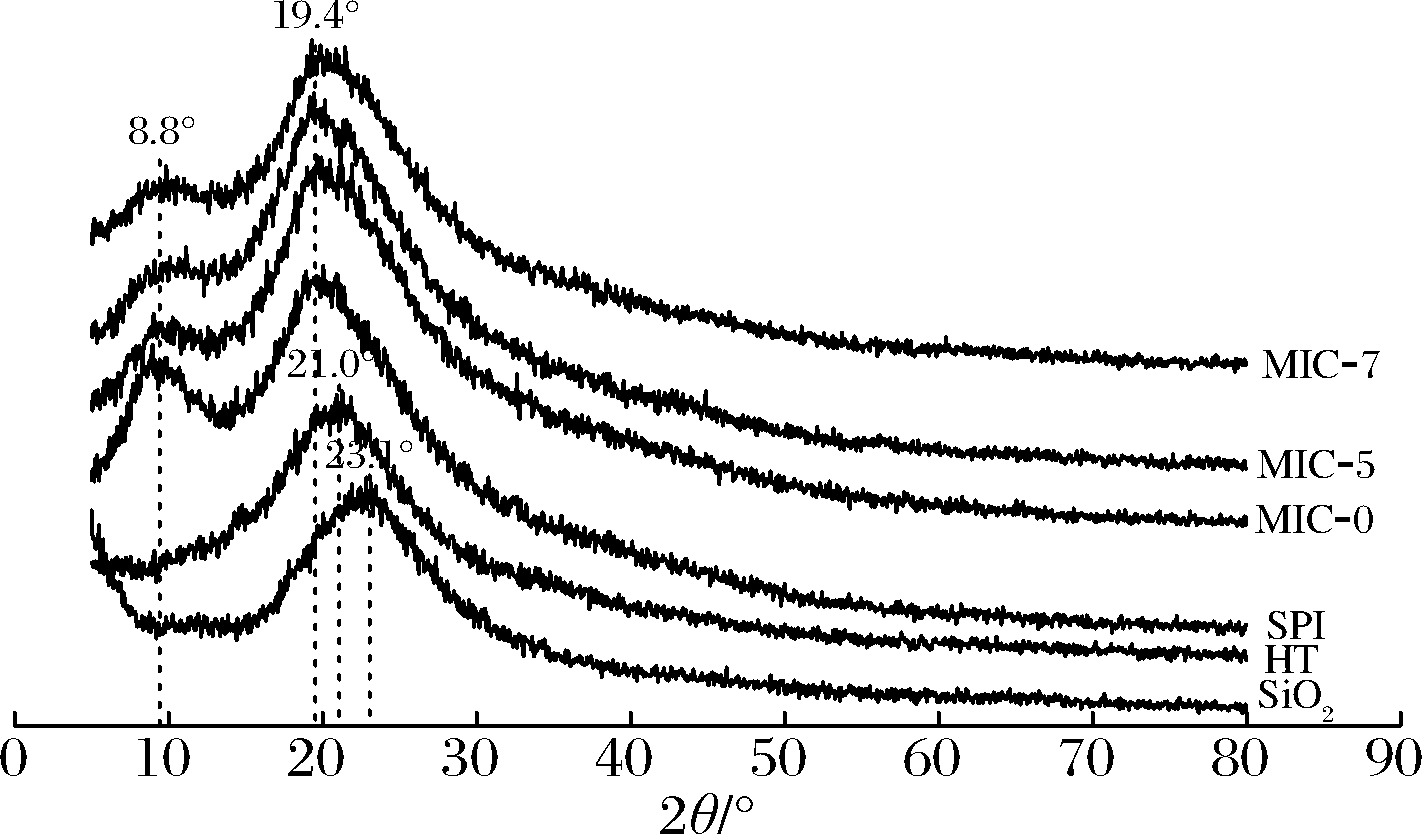
图6 纳米SiO2添加量对黄酮微胶囊XRD谱图的影响
Fig.6 Effect of nano-SiO2 addition on XRD spectra of flavonoid microcapsules
2.4.3 微胶囊红外光谱分析
HT、SPI、MIC-0、MIC-5和MIC-7 4 000~400 cm-1的红外光谱如图7所示。SPI光谱曲线中,波数3 200~3 400 cm-1的吸收峰对应SPI薄膜中的游离N—H拉伸和O—H拉伸带,1 640 cm-1处为SPI薄膜中酰胺I带(—C![]() O拉伸),1 540 cm-1和1 240 cm-1处的吸收峰为SPI中的酰胺Ⅱ(N—H弯曲)和酰胺Ⅲ带(C—N拉伸)[24]。纳米SiO2红外光谱曲线对应波数在3 430 cm-1处出现的吸收峰为纳米SiO2表面—OH的吸收峰,1 090 cm-1和793 cm-1处的吸收峰为Si—O—Si的反对称伸缩振动和对称伸缩振动,950 cm-1对应为Si—OH的Si—O引起的吸收峰[23]。由于黄酮本身含有大量的酚羟基,在波数3 420 cm-1处有由—OH缔合而成的宽而强的特征峰,在2 920、1 400 cm-1出现的峰为—CH2和—CH3的伸缩振动,1 620 cm-1处为C
O拉伸),1 540 cm-1和1 240 cm-1处的吸收峰为SPI中的酰胺Ⅱ(N—H弯曲)和酰胺Ⅲ带(C—N拉伸)[24]。纳米SiO2红外光谱曲线对应波数在3 430 cm-1处出现的吸收峰为纳米SiO2表面—OH的吸收峰,1 090 cm-1和793 cm-1处的吸收峰为Si—O—Si的反对称伸缩振动和对称伸缩振动,950 cm-1对应为Si—OH的Si—O引起的吸收峰[23]。由于黄酮本身含有大量的酚羟基,在波数3 420 cm-1处有由—OH缔合而成的宽而强的特征峰,在2 920、1 400 cm-1出现的峰为—CH2和—CH3的伸缩振动,1 620 cm-1处为C![]() C的伸缩振动[25]。MIC-0、MIC-5 和MIC-7中出现了HT的特征峰,未观察新的特征峰,表明包埋过程中无新化学键形成,纳米SiO2表面的羟基与SPI的活性基团通过氢键产生相互作用,未发生化学反应。加入纳米SiO2改性黄酮微胶囊壁材后,与HT和SPI相比,可观察到样品MIC-0、MIC-5和MIC-7在波数约为3 400、2 920、1 090、600 cm-1处的峰强度被增强,说明纳米SiO2的加入增强了壁材对芯材的包埋效果。
C的伸缩振动[25]。MIC-0、MIC-5 和MIC-7中出现了HT的特征峰,未观察新的特征峰,表明包埋过程中无新化学键形成,纳米SiO2表面的羟基与SPI的活性基团通过氢键产生相互作用,未发生化学反应。加入纳米SiO2改性黄酮微胶囊壁材后,与HT和SPI相比,可观察到样品MIC-0、MIC-5和MIC-7在波数约为3 400、2 920、1 090、600 cm-1处的峰强度被增强,说明纳米SiO2的加入增强了壁材对芯材的包埋效果。

图7 纳米SiO2添加量对黄酮微胶囊红外光谱图的影响
Fig.7 Effect of nano-SiO2 addition on infrared spectra of flavonoid microcapsules
2.4.4 微胶囊微观结构分析
利用扫描电镜对样品进行了表征,图8为MIC-0、MIC-5、MIC-7放大4 000倍的形貌图。与采用喷雾干燥法制备其它微胶囊一样,MIC-0、MIC-5和MIC-7具有球形结构,但部分微胶囊表面存在凹陷结构。主要原因喷雾干燥过程中,水分蒸发,微胶囊表面快速失水所致。然而,MIC-5、MIC-7样品相比于MIC-0样品表面更光滑,微胶囊形貌接近球形颗粒。纳米SiO2改性微胶囊壁材提高了微胶囊壁材的机械强度和热稳定性,在采用喷雾干燥法制备微胶囊的过程中,具有较高机械强度和热稳定的微胶囊壁材可有效阻止由于微胶囊表面快速失水而引起的凹陷结构,因此,微胶囊发生形变量较小,颗粒较光滑。3种样品的微胶囊表面未观察到明显裂痕和孔隙结构。

a-MIC-0;b-MIC-5;c-MIC-7
图8 纳米SiO2添加量对黄酮微胶囊形态的影响
Fig.8 Effect of nano-SiO2 addition on morphology of flavonoid microcapsules
3 结论
本文以纳米SiO2改性大豆分离蛋白(SPI)为壁材,无籽刺梨果渣黄酮为芯材,采用喷雾干燥法制备黄酮微胶囊,对不同纳米SiO2添加量(0%、5%、7%,质量分数)制备的黄酮微胶囊性能进行分析。添加纳米SiO2的微胶囊物理性质得到改善,结构形态更加稳定。当纳米SiO2添加量为5%时黄酮微胶囊的性能较好,此时包埋率最高为(95.44±1.16)%,水分含量最低为(4.55±0.33)%,热稳定性最好,熔融温度为120.7 ℃,有利于微胶囊的长期贮藏。体外抗氧化活性及还原性试验表明,纳米SiO2的加入和微胶囊化对黄酮的抗氧化活性及还原性没有显著影响,所制备的黄酮微胶囊依然具有较高的抗氧化活性。体外模拟胃肠道消化缓释试验表明,纳米SiO2的加入对黄酮微胶囊在模拟胃液中的释放没有显著影响,但微胶囊在模拟肠液中的释放远高于在模拟胃液中的释放。XRD、FTIR、SEM分析表明黄酮微胶囊制备成功,所得微胶囊颗粒完整,大小均匀,纳米SiO2的加入可增强壁材对芯材的包埋效果,提高壁材的机械强度和热稳定性。
[1] 院慧芳, 张永春, 蔡新华, 等.刺梨黄酮对阿霉素所致心肌细胞毒性的保护作用[J].解剖学报, 2019, 50(1):49-55.
YUAN H F, ZHANG Y C, CAI X H, et al.Protective effect of flavonoids of Rosa roxburghii tratt on myocardial cytotoxicity induced by doxorubicin[J].Acta Anatomica Sinica, 2019, 50(1):49-55.
[2] 刘思彤, 尹日凤, 韦玥吟, 等.刺梨预防D-半乳糖诱发小鼠皮肤衰老的作用研究[J].食品研究与开发, 2020, 41(9):1-5.
LIU S T, YIN R F, WEI Y Y, et al.Study on the effect of Rosa roxburghii tratt on preventing skin aging induced by D-galactose in mice[J].Food Research and Development, 2020, 41(9):1-5.
[3] 赵湖冰, 黎华, 田野, 等.一株刺梨非酿酒酵母的分离鉴定、生理特性及混菌发酵研究[J].食品工业科技, 2020, 41(16):114-120.
ZHAO H B, LI H, TIAN Y, et al.Isolation, identification, physiological characteristics and mixed fermentation of a non-Saccharomyces cerevisiae from Rosa roxburghii[J].Science and Technology of Food Industry, 2020, 41(16):114-120.
[4] 余奕宏, 顾苑婷, 丁筑红, 等.β-葡萄糖苷酶生物转化刺梨槲皮素糖苷的工艺优化[J].食品科学技术学报, 2020, 38(5):109-118.
YU Y H, GU Y T, DING Z H, et al.Optimization on biotransformation of quercetin glycosides in Rosa roxburghii by β-glucosidase[J].Journal of Food Science and Technology, 2020, 38(5):109-118.
[5] PEREZ-MORAL N, SAHA S, PHILO M, et al.Comparative bio-accessibility, bioavailability and bioequivalence of quercetin, apigenin, glucoraphanin and carotenoids from freeze-dried vegetables incorporated into a baked snack versus minimally processed vegetables:evidence from in vitro models and a human bioavailability study[J].Journal of Functional Foods, 2018, 48:410-419.
[6] ELEGBEDE J L, LI M, JONES O G, et al.Interactions between flavonoid-rich extracts and sodium caseinate modulate protein functionality and flavonoid bioaccessibility in model food systems[J].Journal of Food Science, 2018, 83(5):1 229-1 236.
[7] 汤虎, 张浩, 栾倩, 等.微胶囊的研究进展与展望[J].农产品加工, 2016(21):43-47.
TANG H, ZHANG H, LUAN Q, et al.Research progress and prospect of microencapsulation[J].Farm Products Processing, 2016(21):43-47.
[8] 毕会敏, 范方宇, 杨宗玲, 等, 纳米SiO2/大豆分离蛋白为壁材的核桃油微胶囊特性[J].食品与发酵工业, 2020, 46(21):147-153.
BI H M, FAN F Y, YANG Z L, et al.Characteristics of walnut oil microcapsules with nano-SiO2/soy protein isolate as wall material[J].Food and Fermentation Industries, 2020, 46(21):147-153.
[9] 范方宇, 张蕊, 杨宗玲, 等, 纳米SiO2/阿拉伯胶复合膜的制备与性质研究[J].食品与发酵工业, 2020, 46(12):147-152.
FAN F Y, ZHANG R, YANG Z L, et al.Preparation and characterization of nano-SiO2/ gum Arabic film[J].Food and Fermentation Industries, 2020, 46(12):147-152.
[10] 杨宗玲, 李晗, 范方宇, 等.超声辅助酶法提取无籽刺梨果渣中黄酮的工艺优化及其抗氧化活性[J].食品工业科技, 2021, 42(13):184-192.
YANG Z L, LI H, FAN F Y, et al.Ultrasound-assisted enzymatic extraction of flavonoids from Rosa sterilis pomace and its antioxidant activity[J].Science and Technology of Food Industry, 2021, 42(13):184-192.
[11] 张汇慧. 刺梨黄酮的提取、分离及抗氧化活性研究[D].南京:南京林业大学, 2015.
ZHANG H H.Study on extraction, separation and antioxidant activity of flavonoids from Rosa roxburghii Tratt[D].Nanjing:Nanjing Forestry University, 2015.
[12] 曹侃. 松针总黄酮微胶囊工艺优化及对帕金森的辅助改善[J].武汉轻工大学学报, 2020, 39(6):17-22.
CAO K.Research on the optimization of total flavonoids of pine needles microcapsule process and the assistant therapeutic effect on Parkinson′s Disease[J].Journal of Wuhan Polytechnic University, 2020, 39(6):17-22.
[13] 刘畅, 王秋红, 方波, 等.刺梨黄酮提取工艺研究[J].食品工业, 2010, 31(1):52-54.
LIU C, WANG Q H, FANG B, et al.Study on extraction of flavonoids from Rosa roxburghii Tratt[J].The Food Industry, 2010, 31(1):52-54.
[14] 黄珊, 刘嘉, 李贵华, 等.壁材对方竹叶黄酮微胶囊结构及抗氧化性能的影响[J].食品工业科技, 2021, 42(22):55-61.
HUANG S, LIU J, LI G H, et al.Effects of wall materials on the structure and antioxidant activities of the bamboo leaves flavonoids microcapsules[J].Science and Technology of Food Industry, 2021, 42(22):55-61.
[15] 谭钦铎. 葛根异黄酮的提取及微胶囊制备的研究[D].长春:吉林大学, 2018.
TANG Q D.Study on extraction of isoflavones from puerariae Lobata and it's preparation for microcapsules[D].Changchun:Jilin University, 2018.
[16] 张倩茹. 玉米芯多糖的菌酶协同发酵工艺及其体外活性研究[D].呼和浩特:内蒙古农业大学, 2018.
ZHANG Q R.Fermentation of corncob by microorganism and enzyme to produce polysaccharides and its in vitro activity[D].Hohhot:Inner Mongolia Agricultural University, 2018.
[17] 孟娜, 魏胜华, 陶玉贵, 等.超声波-酶法联合提取绞股蓝总黄酮及其抗氧化活性的研究[J].食品工业科技, 2014, 35(3):138-141.
MENG N, WEI S H, TAO Y G, et al.Study on the extraction of total flavonoids from Gynostemma pentaphyllum by enzymatic-ultrasonic method and the flavonoids antioxidation activities[J].Science and Technology of Food Industry, 2014, 35(3):138-141.
[18] TRAN N, TRAN M, TRUONG H, et al.Spray-drying microencapsulation of high concentration of bioactive compounds fragments from Euphorbia hirta L.extract and their effect on diabetes mellitus[J].Foods(Basel,Switzerland), 2020, 9(7):881.
[19] TONON R V, BRABET C, HUBINGER M D.Anthocyanin stability and antioxidant activity of spray-dried açai (Euterpe oleracea Mart.) juice produced with different carrier agents[J].Food Research International, 2010, 43(3):907-914.
[20] 李斌, 许彬, 程爽, 等.光皮梾木籽油微胶囊化及其制品的理化性质[J].中国粮油学报, 2018, 33(10):58-62.
LI B, XU B, CHENG S, et al.Physical and chemical properties of Cornus wilsoniana seed oil microcapsules and its product[J].Journal of the Chinese Cereals and Oils Association, 2018, 33(10):58-62.
[21] BOONCHU T, UTAMA-ANG N.Optimization of extraction and microencapsulation of bioactive compounds from red grape (Vitis vinifera L.) pomace[J].Journal of Food Science and Technology, 2015, 52(2):783-792.
[22] 张云峰, 张璐, 刘鹏, 等.纳米SiO2改性石蜡相变微胶囊涂料的制备及性能表征[J].涂料工业, 2021, 51(1):34-39.
ZHANG Y F, ZHANG L, LIU P, et al.Preparation and characterization of nano SiO2 modified paraffin phase change microcapsule-based coatings[J].Paint & Coarings Industry, 2021, 51(1):34-39.
[23] LIU X X, CHEN X F, REN J L, et al.Effects of nano-ZnO and nano-SiO2 particles on properties of PVA/xylan composite films[J].International Journal of Biological Macromolecules, 2019, 132:978-986.
[24] HAN Y Y, WANG L J.Improved water barrier and mechanical properties of soy protein isolate films by incorporation of SiO2 nanoparticles[J].RSC Advances, 2016, 6(113):112 317-112 324.
[25] 孙亚利, 周文美, 黄永光, 等.以聚合乳清蛋白为壁材的苦荞黄酮微胶囊化及其品质分析[J].食品科学, 2020, 41(12):259-266.
SUN Y L, ZHOU W M, HUANG Y G, et al.Microencapsulation and quality analysis of tartary buckwheat flavonoids using polymerized whey protein as wall material[J].Food Science, 2020, 41(12):259-266.