三七[Panax notoginseng (Burk.) F.H.Chen]是有超过400年药用历史的五加科人参植物,享有“南国神草”、“金不换”等美誉。三七的干燥块根的药用成分以四环三萜类皂苷为主,总皂苷含量为11.24%,具有抗炎、抗动脉粥样硬化、止血、抗肿瘤、提高免疫力及改善心脑血管等药理作用[1-2],此外,习峰敏等[3]研究表明三七地上茎叶部分总皂苷含量为12.98%,比块根高出1.74个百分点,同样具有较大产量和利用价值。CAI等[4]报道,截止2017年,三七茎叶的年产量超过2 000 kg,但有效利用率不足5%,大部分依旧被抛弃在田间地头,造成资源的极大浪费。百合科黄精属植物滇黄精(Polygonatum kingianum Coll.et Hemsl)的干燥块根是中国传统中药材,也是重要的药食同源物品之一,以滇黄精为原料开发出的食品主要有滇黄精饮片、滇黄精面条、滇黄精糕点、滇黄精日用品[5]等,但精深加工及综合开发利用的工艺技术还需要进一步挖掘。
韩凌[6]研究表明,人参皂苷Rb1、Rb3等原二醇型人参皂苷[20(S)-protopanaxadiol type, PPD]是三七茎叶中主要活性成分,还含有类黄酮、三七素、挥发油及γ-氨基丁酸(γ-aminobutyric acid, GABA)等成分,具有活血化瘀,舒缓神经等多种功效。目前已开发出“七叶神安滴丸”等药品,随着云南食品安全地方标准DBS 53024—2017 干制三七茎叶的发布,已开发了“三七茎叶茶”、“三七茎叶颗粒饮片”相关食品。滇黄精主要成分为甾体皂苷、三萜皂苷、异黄酮、多糖、苯丙素类、生物碱及挥发油等多种活性成分,具有降血糖、抗炎等功能[7-8]。研究表明,经九蒸九晒炮制后的滇黄精多糖含量下降分解为单糖、二糖或寡糖,皂苷含量增加,挥发性成分的组成和含量降低,药性变得平和,麻味消失,提升了其抗氧化、抗疲劳、抗菌、提高免疫的能力[9]。
三七茎叶提取液可通过喷雾干燥顺利制取速溶粉,但由于其中的皂苷等成分具有一定的苦味,在农产品及食品开发领域还存在一定的局限性,而经九蒸九晒炮制后的滇黄精甜味得以提升,口感柔和,性味温和,但由于糖类的存在,以喷雾干燥法制取滇黄精速溶粉较为困难。
为提升三七茎叶的食用口感,同时改善滇黄精的喷雾干燥性能,开发出质地均匀、溶解性好、组成成分丰富的复合提取物速溶粉,本实验以三七茎叶-九蒸九晒滇黄精片为原料,以单因素-响应面模型优化其浸提工艺,将所得提取液喷雾干燥制取三七茎叶-滇黄精速溶粉,HPLC进一步检测速溶粉中皂苷、可溶性总糖、多酚的组成及含量,同时以对ABTS阳离子自由基、DPPH自由基、超氧阴离子自由基、羟自由基的清除能力考察该速溶粉的抗氧化活性,为三七茎叶及滇黄精的开发利用提供基础方案。
1 材料与方法
1.1 材料与试剂
三七茎叶,西南中药材种质创新与利用国家地方联合工程研究中心提供,并鉴定为五加科植物三七[Panax notoginseng (Burk.) F.H.Chen]的干燥茎叶部分;九蒸九制滇黄精片,西南中药材种质创新与利用国家地方联合工程研究中心提供,并鉴定为百合科植物滇黄精[Polygonatum kingianum Coll.et Hemsl]经过九蒸九晒后的干燥块根切片。
色谱甲醇、乙腈、甲酸,MREDA公司;98%浓硫酸(分析纯)、蒽酮(分析纯)、甲醇(分析纯)、99.7%(体积分数)食用乙醇、超纯水(电阻率18.25 MΩ·cm)、正丁醇(分析纯)、石油醚(分析纯)、氯仿(分析纯),西陇化工股份有限公司;人参皂苷Rb3、Rb1、Ra3、三七皂苷Fa、Fc、Fe、Fd、没食子酸(gallic acid, GA)、咖啡酸(caffeic acid, CA)、表没食子儿茶素没食子酸酯(epigallocahechin-3-gallate, EGCG)、表儿茶素没食子酸酯(epicatechin-3-gallate, ECG)、茶碱(theophylline)等标准品,成都曼斯特生物技术有限公司;D101(0.3~1.25 mm)大孔树脂,北京索莱宝科技有限公司;MCI GEL CHP 20P(75~150 μm)小孔树脂,日本三菱公司;ABTS阳离子自由基清除能力试剂盒、DPPH自由基清除能力试剂盒、超氧阴离子自由基清除能力试剂盒、羟自由基清除能力试剂盒,苏州格瑞思生物科技有限公司。
1.2 仪器与设备
DHG-9070 A型台式鼓风干燥箱,上海东麓仪器设备有限公司;JMF-320 G多级闪蒸器,河南智晶生物科技股份有限公司;YM-3000 Y型喷雾干燥机,上海豫明仪器有限公司;K6600-A全波长酶标仪,北京凯奥科技发展有限公司;Agilent LC-1290 indentify Ⅱ 超高效液相色谱系统、Agilent LC-1200 高效液相色谱系统、色谱柱Agilent poroshell EC-C18(4.6 mm×150 mm, 4 μm)、色谱柱Agilent Poroshell 120(4.6 mm×100 mm, 2.7 μm),美国安捷伦公司;岛津M0C63U快速水分测定仪,日本岛津公司。
1.3 实验方法
1.3.1 喷雾干燥优化实验
三七茎叶-滇黄精配比:先前实验表明,滇黄精提取液富含多糖,喷雾干燥热融化现象导致无法顺利获取速溶粉,本实验以三七茎叶代替糊精以改善喷雾干燥效率,分别设置三七茎叶-滇黄精的质量比为8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8共6个梯度,每个梯度物料质量合计100 g,重复3次,以50%(体积分数)乙醇为浸提溶剂,料液比(g∶mL)为1∶20,浸提2次,合并过滤液,减压浓缩至原体积1/3,于YM-3000 Y型喷雾干燥机制取速溶粉,以得粉率考察三七茎叶-滇黄精的最佳配比。
1.3.2 浸提工艺优化实验
单因素实验:根据上述优化的配比结果制备三七茎叶-滇黄精混合物2 000 g,粉碎后过200目标准筛,备用。准确称取三七茎叶-滇黄精混合粉末1.00 g,分别以乙醇体积分数、料液比(g∶mL)和浸提时间为考察因素,确定不同单因素条件下的最佳浸提率。
乙醇体积分数:分别设置5个梯度的乙醇体积分数20%、30%、40%、50%、60%,以料液比(g∶mL)1∶10,浸提48 h,重复2次,以浸出率考察最佳乙醇体积分数。
料液比:依据上述结果,分别设置料液比(g∶mL)1∶5、1∶10、1∶15、1∶20、1∶25,以50%体积分数的乙醇,浸提48 h,重复浸提2次,以浸出率考察最佳料液比。
浸提时间:分别设置浸提时间24、36、48、60、72 h,以料液比1∶20,50%(体积分数)乙醇浸提2次,以浸出率考察最佳浸提时间。
响应面优化实验:根据上述单因素实验结果,以浸出率为指标:以乙醇体积分数(A)、料液比(B)、浸提时间(C)为变量,根据WANG等[10]报道的响应面原理设计Box-Behnken中心组合试验数学模型优化三七茎叶-滇黄精的最佳浸提工艺浸出率的计算如公式(1)所示:
浸出率![]()
(1)
式中:M0,三七茎叶-滇黄精的质量,g;M1,发皿的质量,g;M2,干燥后蒸发皿及三七茎叶-滇黄精浸膏的总质量,g;C,三七茎叶-滇黄精的含水率,%。
1.3.3 感官审评
参照WEN等[11]报道的有关速溶茶的审评方法,设置感官审评表,邀请10位具有评茶员资质的专家对三七茎叶-滇黄精速溶粉进行感官审评,以百分制计总分。
1.3.4 成分分析及抗氧化活性分析
皂苷标准溶液配制:以70%(体积分数)甲醇为溶剂,分别配制成1 mg/mL的人参皂苷Rb3、Rb1、Ra3、三七皂苷Fa、Fc、Fe、Fd单体标准品及0.1 mg/mL的混合标准品溶液。
速溶粉样品制备:参照GUO等[12]报道的三七茎叶皂苷的纯化方法,准确称取三七茎叶-滇黄精速溶粉1.00 g,加入70%甲醇溶液50 mL,振荡10 min,转入D101大孔树脂及MCI小孔树脂反复层析至淡黄色溶液,离心取上清液,定容至50 mL,0.45 μm微孔滤膜过滤,4 ℃保存待测。
色谱条件:Agilent LC-1290 indentify Ⅱ 超高效液相色谱系统,色谱柱:Agilent poroshell EC-C18(4.6 mm×150 mm, 4 μm)。分析条件:流动相由H2O(A)和乙腈(B)组成,洗脱梯度为0~20 min,24%~25%B;20~45 min,25%~45%B;45~55 min,45%~50%B;55~60 min,50%~55%B;60~65 min,55%~60%B;65~75 min,60%B;75~75.5 min,60%~80%B;75.5~78 min,80%B。流速0.5 mL/min;进样体积10 μL;柱温30 ℃,检测波长203 nm。由保留时间确定化合物,使用外标法根据峰面积定量。
可溶性总糖待测液:配制0.1 mg/mL的三七茎叶-滇黄精速溶粉溶液,参照KANG等[13]报道的0.2%蒽酮-硫酸法测定人参中可溶性总糖,于全波长酶标仪624 nm下检测吸光度值,并通过回归方程曲线计算可溶性总糖的含量。
多酚检测:参照NIAN等[14]报道的儿茶素高效液相色谱分析法,制备2 mg/mL的三七茎叶-滇黄精速溶粉待测液,于Agilent LC-1200 高效液相色谱系统280 nm下检测分析多酚组成及含量。
抗氧化活性分析:根据XIA等[15]报道的黄精抗氧化活性测定方法,测定三七茎叶-滇黄精速溶粉的抗氧化活性,且以IC50值考察其抗氧化能力。
1.3.5 数据分析
采用SPSS 26.0、Excel 2010进行统计分析和数据处理,Design-Expert 12进行响应面试验设计及结果进行分析,GraphPad Prism 8.3, Adobe Illustrator 2020进行图像处理,每个处理重复3次,以平均值 ![]() N=3)表示实验结果。
N=3)表示实验结果。
2 结果与分析
2.1 三七茎叶-滇黄精配比优化
根据三七茎叶-滇黄精质量比为8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8 六个不同条件下的喷雾干燥实验,所得速溶粉百分比可知(图1),当三七茎叶与滇黄精的质量比为6∶4、含水率为10.42%时显著高于质量比5∶5、4∶6、3∶7、2∶8条件下的得粉率(P<0.05),与质量比为8∶2、7∶3的得粉率无显著性差异(P>0.05),通过初步的感官审评,质量比为6∶4所得速溶粉在口感、甜味及香味优于其他组分,因此,本实验拟以三七茎叶-滇黄精质量比为6∶4展开浸提工艺优化实验。
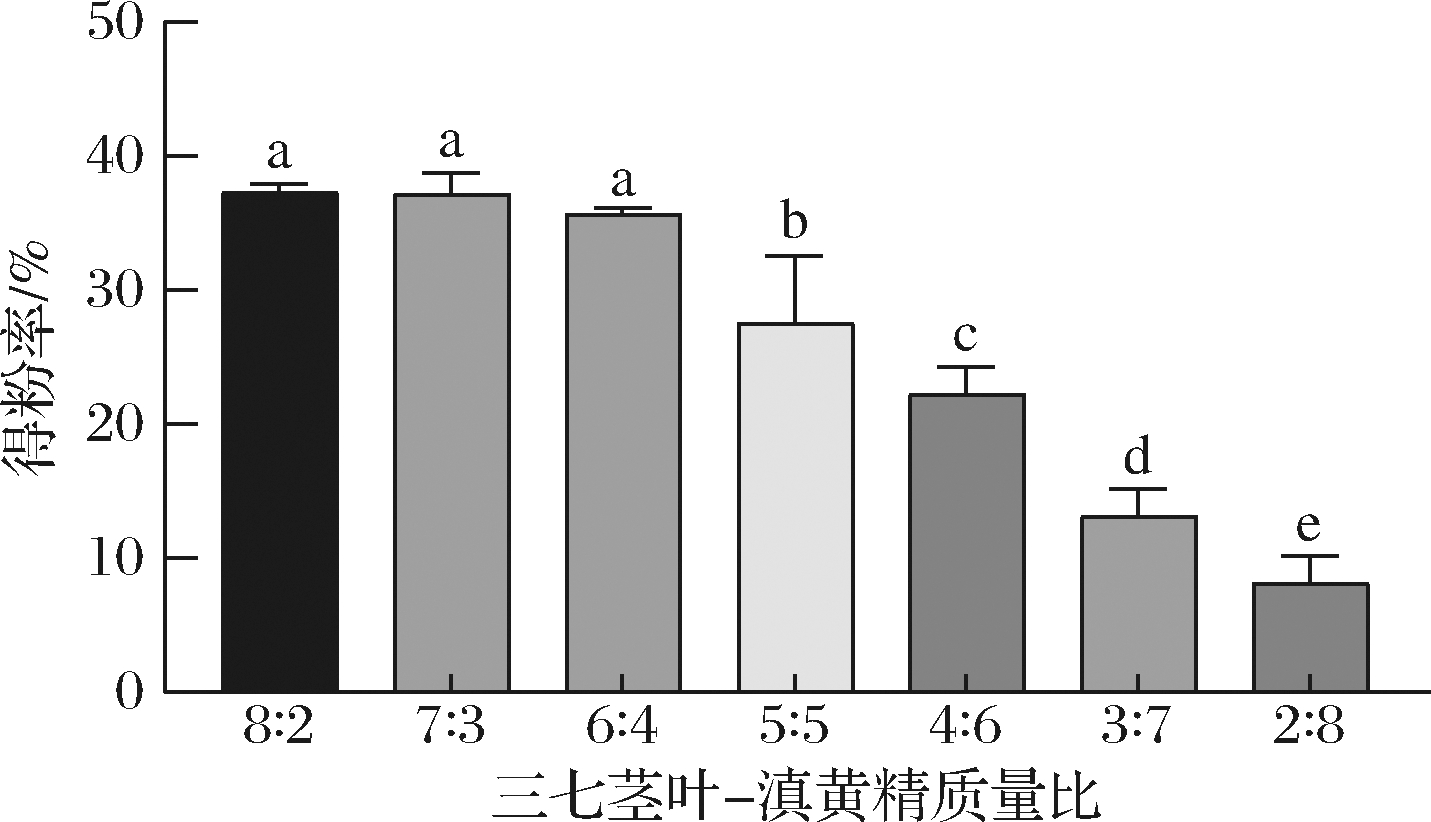
图1 不同质量比条件下三七茎叶-滇黄精浸提液喷雾 干燥得粉率
Fig.1 Rate of stems and leaves of Panax notoginseng- Polygonatum kingianum extract by spray drying at different mass ratios 注:不同小写字母表示存在统计学上的显著性差异(下同)
2.2 单因素优化实验
设置乙醇体积分数为20%、30%、40%、50%、60%,料液比(g∶mL)为1∶10,浸提48 h,浸提2次。如图2所示,在乙醇体积分数为30%积分数时,浸提率达到(49.83±0.02)%,显著高于体积分数20%时47.56%的浸出率(P<0.05),随着乙醇体积分数增加至40%、50%、60%,浸出率呈下降趋势且与体积分数为30%时的浸出率存在显著性差异(P<0.05),表明在此浓度下,三七茎叶-滇黄精的浸提率达到较理想的浸出率。
根据乙醇单因素试验结果,以30%(体积分数)乙醇为溶剂,设置料液比(g∶mL)为1∶5、1∶10、1∶15、1∶20、1∶25共5个梯度,浸提三七茎叶-滇黄精48 h,浸提2次。如图3所示,浸出率随着料液比增加而呈上升趋势,当料液比为1∶20时,均与料液比1∶15、1∶10、1∶5的浸出率存在显著性差异(P<0.05),但与1∶25时的浸出率差异不显著 (P>0.05),说明在料液比为1∶20时,可溶性成分已被大部分浸出,因此,最佳料液比将确定为1∶20。
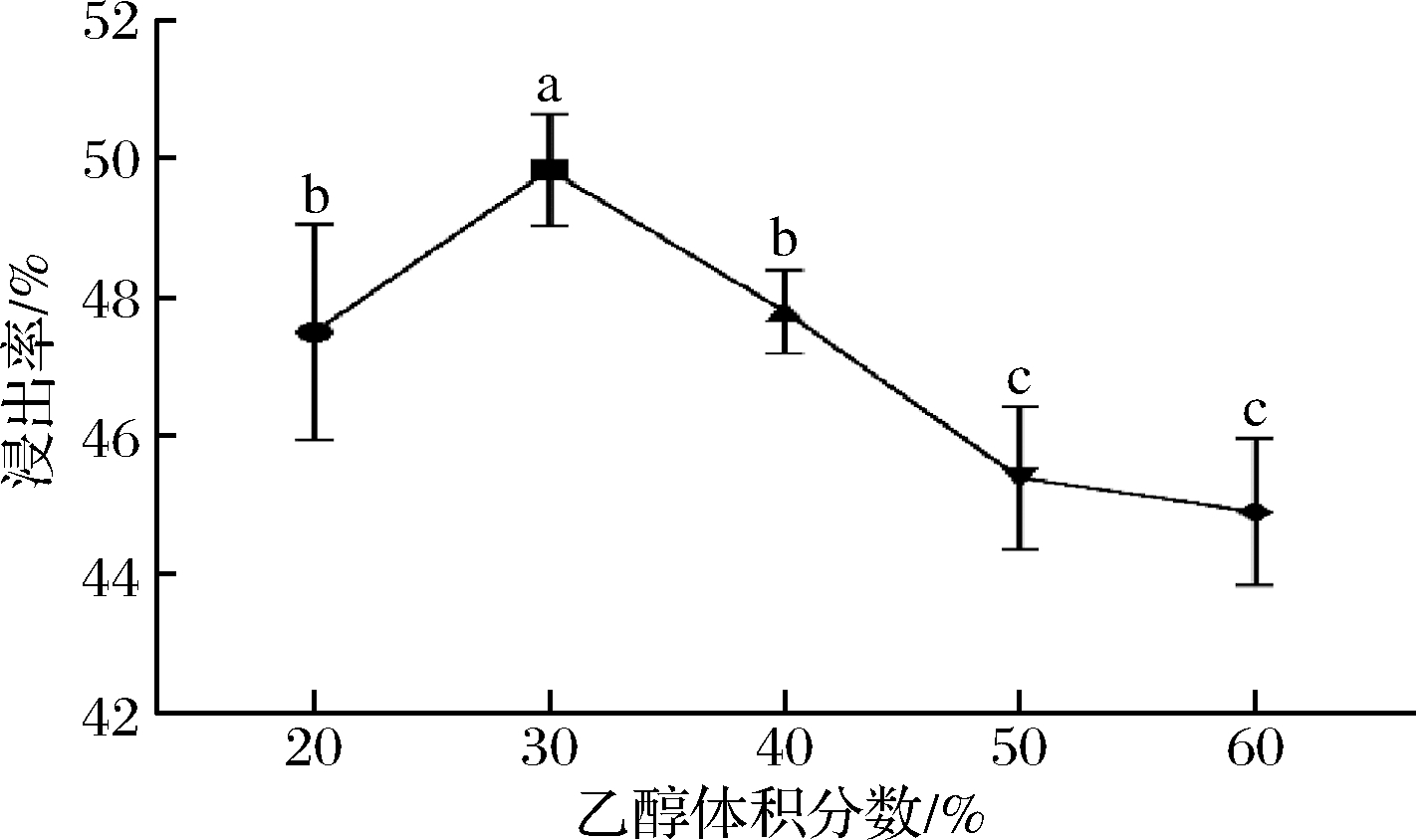
图2 不同体积分数的乙醇中三七茎叶-滇黄精浸出率
Fig.2 Leaching rate of stems and leaves of Panax notoginseng- Polygonatum kingianum with different ethanol volume fraction

图3 不同料液比三七茎叶-滇黄精浸出率
Fig.3 Leaching rate of stem and leaves of Panax notoginseng- Polygonatum kingianum with different solid-liquid ratio
根据上述单因素结果,以30%(体积分数)乙醇、料液比(g∶mL) 1∶20,分别设置24、36、48、60、72 h浸提三七茎叶-滇黄精,浸提2次。如图4 所示,浸提36 h时浸出率达到(49.5±0.01)%,显著高于其他时间条件下的浸出率,因此,以浸提36 h为最佳结果。

图4 不同浸提时间三七茎叶 - 滇黄精浸出率
Fig.4 Leaching rate of stems and leaves of Panax notoginseng-Polygonatum kingianum in different times
2.3 响应面优化实验
为进一步确定三七茎叶-滇黄精的最佳浸提工艺,参照WANG等[10]报道的Box-Behnken中心组合设计模型,以乙醇体积分数(A,20%、30%、40%),料液比(B,1∶15、1∶20、1∶25)和浸提时间(C,24、36、48 h)的交互作用对三七茎叶-滇黄精浸出率进行响应面优化试验,结果如表1所示。
表1 三七茎叶-滇黄精响应面优化结果
Table 1 Response surface optimization results of stems and leaves of Panax notoginseng-Polygonatum kingianum
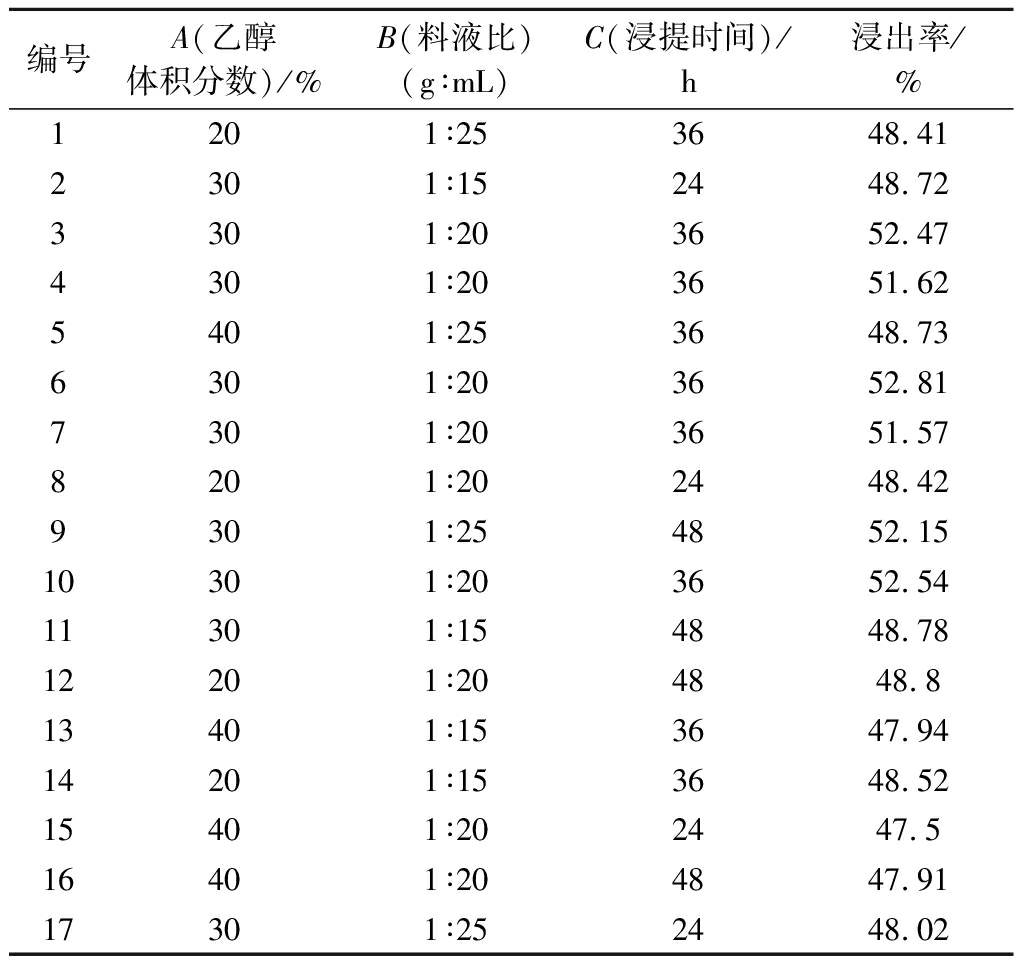
编号A(乙醇体积分数)/%B(料液比)(g∶mL)C(浸提时间)/h浸出率/%1201∶253648.412301∶152448.723301∶203652.474301∶203651.625401∶253648.736301∶203652.817301∶203651.578201∶202448.429301∶254852.1510301∶203652.5411301∶154848.7812201∶204848.813401∶153647.9414201∶153648.5215401∶202447.516401∶204847.9117301∶252448.02
由表1可知,在乙醇体积分数30%、料液比(g∶mL)1∶20、浸提36 h的组合条件下,三七茎叶-滇黄精的浸出率均≥51.57%,且大于其他条件下的浸出率,说明该组合条件对三七茎叶-滇黄精具有良好的浸出效果。但为了检验该模型的稳定性和可行性,对该响应面结果进行方差分析,并以响应面3D曲面模型分析该条件下的最佳浸提方案,结果如表2 所示,乙醇体积分数和料液比对三七茎叶-滇黄精的浸出率均有极显著的影响,应当充分考虑这两者所带来的波动。该模型中预测值R2=0.942 3,与调整后的![]() 绝对值│d│<0.2,是合理一致的,此外,AdeqPre(13.895 7)>4,说明该模型的精密度高,具有较高的可靠性。
绝对值│d│<0.2,是合理一致的,此外,AdeqPre(13.895 7)>4,说明该模型的精密度高,具有较高的可靠性。
分析对各因素对本实验结果的影响,经回归拟合得到相应的二次回归方程模型:浸出率(%)=52.2-0.383 8 A+0.418 7 B+0.245 C-0.025 AB+0.007 5 AC+0.267 5 BC-2.28 A2-1.27 B2-1.76 C2,为进一步确证三七茎叶-滇黄精提取工艺最佳响应值,对回归方程取一阶偏导为0,求解方程得A=29.16%,B=20.87,C=37.00,理论浸出率52.27%,即理论优化条件为29.16%(体积分数)乙醇,料液比(g∶mL)为1∶20.87,浸提37.00 h,重复浸提2次。
表2 回归模型方差分析表
Table 2 Variance analysis of regression model
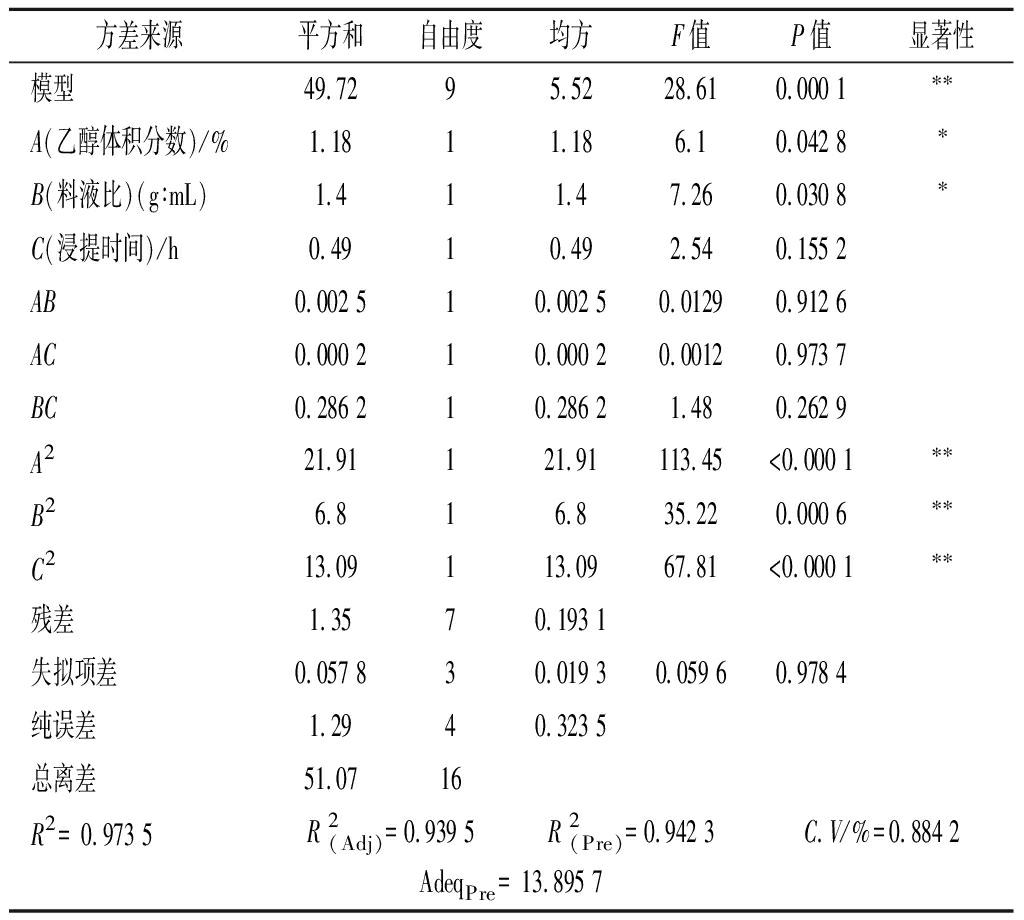
方差来源平方和自由度均方F值P值显著性模型49.7295.5228.610.000 1∗∗A(乙醇体积分数)/%1.1811.186.10.042 8∗B(料液比)(g∶mL)1.411.47.260.030 8∗C(浸提时间)/h0.4910.492.540.155 2AB0.002 510.002 50.01290.912 6AC0.000 210.000 20.00120.973 7BC0.286 210.286 21.480.262 9A221.91121.91113.45<0.000 1∗∗B26.816.835.220.000 6∗∗C213.09113.0967.81<0.000 1∗∗残差 1.3570.193 1失拟项差0.057 830.019 30.059 60.978 4纯误差 1.2940.323 5总离差 51.0716R2= 0.973 5R 2(Adj)=0.939 5R 2(Pre)=0.942 3C.V/%=0.884 2AdeqPre = 13.895 7
注:*表示所有方法之间具有显著性差异(P<0.05),**表示所有方法之间具有极显著差异(P<0.01)
根据响应3D 曲面分析各因素交互作用对三七茎叶-滇黄精浸出率的影响,图5-C的坡度最为陡峭,斜率最大,因而料液比(B)和浸提时间(C)对三七茎叶-滇黄精的浸出率有极显著影响,这与方差分析结果相吻合(P<0.01);由图5-A可知,乙醇体积分数(A)和料液比(B)对三七茎叶-滇黄精浸出率也具有显著性影响(P<0.05),因此,料液比也决定着浸出率的高低。总之,在常温条件下,适宜的乙醇体积分数、料液比及浸提时间均影响三七茎叶-滇黄精的浸出率,本响应面模型能较大限度地提取其中的内含物成分。
为了验证本模型的可靠性和准确性,称取1.00 g三七茎叶-滇黄精样品,根据实际操作的可行性,将上述条件优化为29%(体积分数)乙醇,料液比(g∶mL)1∶21,浸提37 h,重复浸提2次,测得实际浸出率为(46.34±0.01)%,与理论浸出率52.27%存在微小波动,但是差异不大,具有一定的可用性。
为进一步将该工艺技术推广应用,在本实验基础上放大1 000倍进行,即准确称取制备好的三七茎叶-滇黄精1 kg(质量比为6∶4)作为物料(图6-A),以上述方法得到三七茎叶-滇黄精提取液,经90 ℃减压浓缩至原体积的1/3,在温度120 ℃、风速75%、进料速度8 mL/min条件下喷雾干燥,得到黄色至棕黄色的三七茎叶-滇黄精速溶粉(图6-B)。每1 kg物料可得到(374.23±6.81) g速溶粉,得粉率37.42%,较上述优化结果偏低,根据SOBULSKA等[16]报道的有关富糖原料喷雾干燥原理,一方面可能是喷雾干燥过程中一部分粉末随着气流排出,另一方面可能是速溶粉挂在干燥缸壁、管道壁等部位,造成了一定的损失。

图5 三七茎叶-滇黄精响应面优化等高线及3D曲面
Fig.5 Response surface optimization contour and 3D surface of stems and leaves of Panax notoginseng- Polygonatum kingianum
2.4 感官审评
根据WEN等[11]报道的方法对三七茎叶-滇黄精速溶粉进行感官审评,棕黄色酥松粉末,质地均匀,冷热水溶解性好,滋味微苦带甜,入口滋味微苦回甘,香味浓郁饱满,具有三七的特殊微苦味和九晒滇黄精的焦糖甜味,感官评分80.24分(图6-C)。由于滇黄精富含可溶性糖、多糖等成分,该提取物久置有吸潮现象,因此需要注意干燥保存。
A-三七茎叶-滇黄精;B-三七茎叶-滇黄精速溶粉; C-三七茎叶-滇黄精速溶饮料
图6 三七茎叶-滇黄精及其速溶粉
Fig.6 Stems and leaves of Panax notoginseng- Polygonatum kingianum and its instant powder
2.5 成分检测及抗氧化活性分析
由图7-A可知,从三七茎叶-滇黄精速溶粉中定量分析出7种皂苷化合物,含量较高的分别是三七皂苷Fa、Fd、Fc等四环三萜类皂苷,累计含量为(13.73±0.04) mg/g。
通过全波长酶标仪检测经0.2%硫酸-蒽酮法处理后的三七茎叶-滇黄精速溶粉待测液,回归方程为Y=3.009 5X+0.231 6, R2=0.980 6,通过吸光度计算出可溶性总糖含量为(55.44±3.21) mg/g。HPLC检测分析到5种酚类化合物,含量最高的是CA[(3.6±0.44) mg/g],ECG[(2.94±0.59) mg/g]及EGCG[(1.67±0.15) mg/g](图7-B)。
通过抗氧化能力实验及其IC 50值计算结果,发现三七茎叶-滇黄精速溶粉对自由基的清除能力随着浓度上升而增加,对ABTS阳离子自由基、超氧阴离子自由基及DPPH自由基均具有较强的清除能力,其中对ABTS阳离子自由基的清除能力最佳,其IC50值为0.41 mg/mL,与阳性对照Trolox的0.23 mg/mL较为接近(图7-C)。
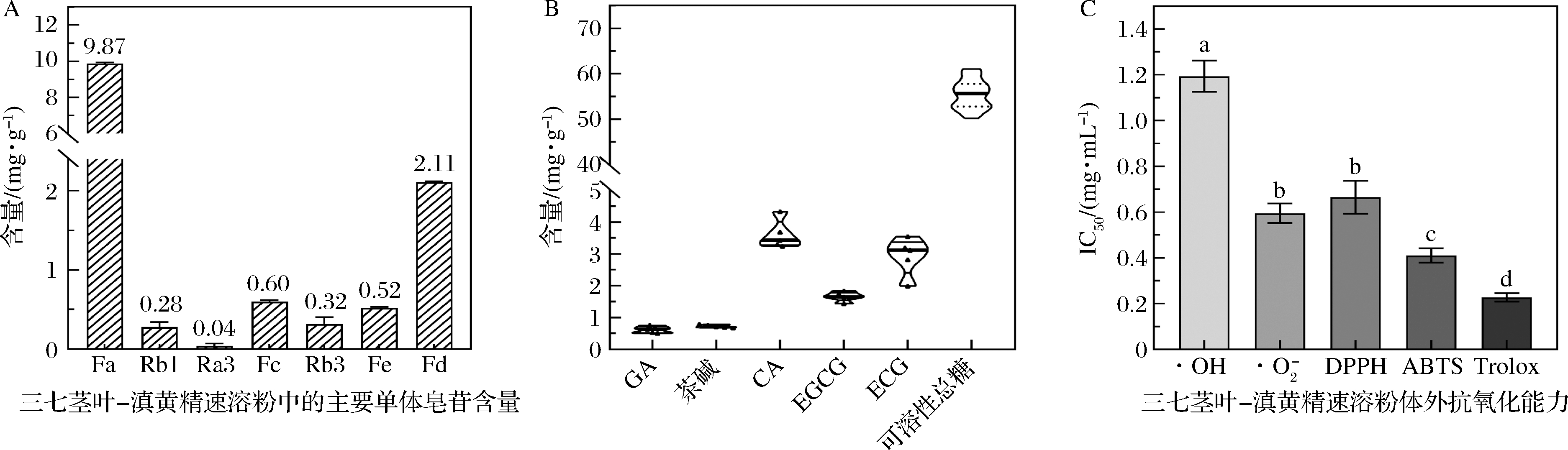
A-速溶粉中6种单体皂苷的含量;B-速溶粉中5种多酚单体含量;C-速溶粉抗氧化活性检测,Trolox为阳性对照
图7 三七茎叶-滇黄精速溶粉成分及抗氧化活性分析
Fig.7 Analysis of component and antioxidant activity in stems and leaves of Panax notoginseng-Polygonatum kingianum instant powder
3 讨论
3.1 工艺优化
三七茎叶作为云南地方特色食品,深受广大消费者的追捧,但其多功能的精深加工产品开发还不足。滇黄精作为药食同源产品,富含多糖、薯蓣皂苷、甾体皂苷等活性成分,具有降血糖、改善身体机能等多重功效[17-18],目前已有一些的开发利用案例,如滇黄精茶、滇黄精超微粉等。本实验以三七茎叶-滇黄精 (质量比6∶4)为原料,通过单因素-响应面模型优化出乙醇体积分数(%)、料液比(g∶mL)及浸提时间(h)对物料浸出率的工艺,进一步在80~90 ℃条件下经减压所得浓缩提取液,可较好地实现喷雾干燥,得到质地均匀、口味独特、易于存储的提取物,即三七茎叶-滇黄精速溶粉,但得粉率较理论值偏低,今后需要对喷雾干燥工艺进一步优化调整。
3.2 成分分析
三七茎叶-滇黄精速溶粉中定量分析出三七皂苷Fa等7种皂苷,TOHDA等[19]报道,Fa对退化后的脑功能可能具有一定的激活和恢复潜能,但对其功能的研究报道还较少,在今后的研究中需要进一步探索其功能和作用机制。据WANG等[20]研究表明,三七皂苷Fd通过抑制Akt/p38MAPK/NF-κB信号通路,改善反应性星形胶质细胞增生导致的神经炎症性疾病。LIU等[21]揭示了三七皂苷Fc通过PPAR-γ途经对糖尿病引起的心血管损伤具有一定改善作用;LAI等[22]报道,人参皂苷Rb1通过抑制脂肪变性等途经减轻酒精性肝损伤。LI等[8]研究表明,滇黄精多糖通过增加小鼠胰岛素受体底物-1 (insulin receptor substrate, IRS-1)、磷脂酰肌醇3激酶 (phosphatidylin-ositol-3-kinase, PI3K)和蛋白激酶B(Akt)的表达,改善糖尿病症状和脂质代谢,具有降血压、提高机体免疫力、恢复身体机能的功效。本实验未对这些标志成分进行相应分析,这在今后的实验中需要进一步完善。
3.3 抗氧化活性分析
利用自由基试剂盒测定三七茎叶-滇黄精速溶粉的抗氧化能力,对ABTS阳离子自由基和超氧阴离子自由基的清除能力优于对羟自由基自由基的清除能力。朱玉昌等[23]报道,ABTS阳离子自由基与抗氧化剂的生物活性相关性强,表明三七茎叶-滇黄精速溶粉具有较好的生物活性。JIE等[24]表明,超氧阴离子自由基是机体内寿命最长的自由基,与许多炎症性疾病密切相关,而三七茎叶-滇黄精速溶粉对其具有较好的清除能力,表明其抗氧化效果是较为理想的。
4 结论
以三七茎叶-滇黄精(质量比6∶4)为原料进行开发工艺研究,最佳浸提工艺为:29%(体积分数)乙醇,料液比(g∶mL) 1∶21,浸提37 h,重复浸提2次,每1 kg物料所得提取液经喷雾干燥可得三七茎叶-滇黄精速溶粉374.23 g,得粉率37.42%。速溶粉中富含皂苷、多酚、可溶性糖等活性成分,其中三七皂苷Fa、Fd、Fc、Rb3,CA、ECG、EGCG等含量较为丰富,通过抗氧化实验反映了本实验所得速溶粉具有较好的抗氧化能力。本研究三七茎叶-滇黄精浸提工艺为食品开发提供了基础模型支持,所得速溶粉活性成分丰富,具有较好的食用保健价值,为三七及滇黄精的产业发展提供了科学依据。
[1] WANG T, GUO R X, ZHOU G H, et al.Traditional uses, botany, phytochemistry, pharmacology and toxicology of Panax notoginseng (Burk.) F.H.Chen:A review[J].Journal of Ethnopharmacology, 2016,188:234-258.
[2] CHEN W, KUI L, ZHANG G H, et al.Whole-genome sequencing and analysis of the Chinese herbal plant Panax notoginseng[J].Molecular Plant, 2017, 10(6):899-902.
[3] 习峰敏, 刘昌铭, 李付名, 等.双液相萃取法测定三七块根与茎叶中三七总皂苷含量[J].吉林医药学院学报, 2010, 31(1):24-27.
XI F M, LIU C M, LI F M, et al.Determination of content of total saponins in Panpax notoginseng roots and leaves by aqueous two-phase system[J].Journal of Jilin Medical College, 2010, 31(1):24-27.
[4] CAI S X, LIN J Y.Forgotten treasure-Panax notoginseng stems and leaves[J].Pharmacy Information, 2018, 7(6):141-143.
[5] 施扬, 王力川, 马占林, 等.滇黄精提取物成分与活性测定及细胞毒性评价[J].日用化学工业, 2020, 50(11):788-792;798.
SHI Y, WANG L C, MA Z L, et al.Determination of components and activity of extractions of Polygonatum kingianum and evaluation of its cytotoxicity[J].China Surfactant Detergent & Cosmetics, 2020, 50(11):788-792;798.
[6] 韩凌. 三七叶皂苷活性成分的化学研究[D].沈阳:辽宁中医药大学, 2007.
HAN L.Chemical analysis of saponins active components of stems and leaves of Panax notoginseng[D]. Shenyang:Liaoning University of Traditional Chinese Medicine, 2007.
[7] LE MINH H, DO THI THANH H, NFO THI P, et al.Polygonatum kingianum rhizome extract alleviates collagen antibody-induced arthritis by modulating proinflammatory cytokine production in mice[J].Asian Pacific Journal of Tropical Biomedicine, 2020, 10(11):490-495.
[8] LI R S, TAO A E, YANG R M, et al.Structural characterization, hypoglycemic effects and antidiabetic mechanism of a novel polysaccharides from Polygonatum kingianum Coll.et Hemsl[J].Biomedicine & Pharmacotherapy, 2020,131:110687.
[9] GU W, WANG Y F, ZENG L X, et al.Polysaccharides from Polygonatum kingianum improve glucose and lipid metabolism in rats fed a high fat diet[J].Biomedicine & Pharmacotherapy, 2020, 125:109910.
[10] WANG Q Y, DONG X, YANG J, et al.Vesicle based ultrasonic-assisted extraction of saponins in Panax notoginseng[J].Food Chemistry, 2020, 303:125394.
[11] WEN M C, HAN Z S, CUI Y Q, et al.Identification of 4-O-p-coumaroylquinic acid as astringent compound of Keemun black tea by efficient integrated approaches of mass spectrometry, turbidity analysis and sensory evaluation[J].Food Chemistry, 2022, 368:130803.
[12] GUO X J, ZHANG X L, FENG J T, et al.Purification of saponins from leaves of Panax notoginseng using preparative two-dimensional reversed-phase liquid chromatography/hydrophilic interaction chromatography[J].Analytical and Bioanalytical Chemistry, 2013, 405(10):3 413-3 421.
[13] KANG J P, HUO Y, YANG D U, et al.Influence of the plant growth promoting Rhizobium panacihumi on aluminum resistance in Panax ginseng[J].Journal of Ginseng Research, 2021,45(3):442-449.
[14] NIAN B, CHEN L J, YI C, et al.A high-performance liquid chromatography method for simultaneous detection of 20 bioactive components in tea extracts[J].Electrophoresis, 2019, 40(21):2 837-2 844.
[15] XIA G H, LI X H, ZHANG Z, et al.Effects of fermentation treatments on Polygonatum odoratum flavones' antioxidant activities[J].Saudi Journal of Biological Sciences, 2021,28(9):5 011-5 016.
[16] SOBULSKA M, ZBICINSKI I.Advances in spray drying of sugar-rich products[J].Drying Technology, 2021, 39(12):1 774- 1 799.
[17] YANG X X, WEI J D, MU J K, et al.Integrated metabolomic profiling for analysis of antilipidemic effects of Polygonatum kingianum extract on dyslipidemia in rats[J].World Journal of Gastroenterology, 2018, 24(48):5 505-5 524.
[18] YANG X X, WANG X, SHI T T, et al.Mitochondrial dysfunction in high-fat diet-induced nonalcoholic fatty liver disease:The alleviating effect and its mechanism of Polygonatum kingianum[J].Biomedicine & Pharmacotherapy, 2019,117:109083.
[19] TOHDA C, MATSUMOTO N, ZOU K, et al.Abeta (25-35)-induced memory impairment, axonal atrophy, and synaptic loss are ameliorated by M1, A metabolite of protopanaxadiol-type saponins[J].Neuropsychopharmacology: Official Publication of the American College of Neuropsychopharmacology, 2004,29(5):860-868.
[20] WANG X S, YANG L, YANG L, et al.Gypenoside IX suppresses p38 MAPK/Akt/NFκB signaling pathway activation and inflammatory responses in astrocytes stimulated by proinflammatory mediators[J].Inflammation, 2017, 40(6):2 137-2 150.
[21] LIU J J, JIANG C Y, MA X, et al.Notoginsenoside Fc attenuates high glucose-induced vascular endothelial cell injury via upregulation of PPAR-γ in diabetic Sprague-Dawley rats[J].Vascular Pharmacology, 2018, 109:27-35.
[22] LAI Y Q, TAN Q X, XV S, et al.Ginsenoside Rb1 alleviates alcohol-induced liver injury by inhibiting steatosis, oxidative stress, and inflammation[J].Frontiers in Pharmacology, 2021, 12:616409.
[23] 朱玉昌,焦必宁.ABTS法体外测定果蔬类总抗氧化能力的研究进展[J].食品与发酵工业, 2005, 31(8):77-80.
ZHU Y C, JIAO B N.Research progress on ABTS assay in determination of TAA in fruits and vegetables in vitro[J].Food and Fermentation Industries, 2005, 31(8):77-80.
[24] JIE Z S, LIU J, SHU M C, et al.Detection strategies for superoxide anion:A review[J].Talanta, 2022, 236:122892.