谷氨酸棒杆菌(Corynebacterium glutamicum)是高GC含量的革兰氏阳性菌,由于其无内毒素,胞外蛋白酶活性低以及有完善的分泌系统可用于分泌生产重组医药蛋白,被认为是很有潜力的外源蛋白表达宿主。目前,为提高外源蛋白表达产量,主要从表达元件、宿主细胞以及发酵过程等方面开展C.glutamicum蛋白表达系统的优化[1],并取得了一定的进展。例如,表达元件方面开发的双顺反子表达结构[2]和3A(three assembly)元件库[3],基于蛋白酶敲除和常压室温等离子体(atmospheric and room temperature plasma, ARTP)技术[4]获得的高效蛋白分泌菌株以及以OmlA抗原为模式蛋白开发的高通量菌株筛选和发酵流程[5]。
尽管取得了以上成果,但依然存在外源蛋白分泌表达过高造成宿主细胞生长代谢负担,进而影响蛋白产量的问题。已有研究表明,外源蛋白合成和运输的每一过程都需要能量驱动[6],比如肽链延伸、氨酰-tRNA合成、外源蛋白转运等。合成人生长激素(human growth hormone, hGH)每单位需要消耗267个单位ATP及420个单位的NADPH[7]。辅因子工程与传统代谢工程和合成生物学策略相结合,通过控制ATP水解降低其总量,提高糖酵解的通量到野生型通量的1.7倍[8],有效增加了目的代谢物产量及微生物细胞工厂的效率。NAD+激酶基因ppnk和NADH激酶基因pos5的共表达显着改善了NADPH的供应,这种NADPH再生策略简单有效,不伴有碳损失,可用于生产需要NADPH消耗的其他天然产物[9]从而提高产量。同时,氨基酸是直接参与蛋白质翻译的特殊代谢物,外源蛋白高表达对菌体内氨基酸量提出新的要求。过量生产氨基酸的菌株和外源添加氨基酸都由于能提供足够的相应氨基酸,加速了报告蛋白的翻译[10]。氨基酸需求增长导致各类氨基酸合成代谢活跃,氨基酸基础代谢途径产物如乙酰CoA进入三羧酸循环反作用于生长代谢,从而组成复杂的蛋白表达和能量代谢系统。因此从代谢水平解析外源蛋白分泌表达过程中的关键代谢物及代谢网络,有助于挖掘宿主细胞改造的靶点进而优化宿主细胞提高目的蛋白产量。
本文以C.glutamicum CGMCC1.15647菌株为研究对象,以来源于骆驼血清的抗体重链可变区(variable domain of heavy chain of heavy chain antibody, VHH)为模式蛋白[11],通过非靶向代谢组学检测培养液上清的代谢产物的差异,并结合生物信息学分析,从代谢水平上对C.glutamicum CGMCC1.15647株分泌外源蛋白过程中的关键代谢物及代谢调控网络进行了分析,为后续改造C.glutamicum菌株提高其外源蛋白表达产量提供重要的理论支撑。
1 材料与方法
1.1 菌株与培养基
本文使用C.glutamicum BZH001菌株,中国普通微生物菌种保藏管理中心,保藏号为CGMCC 1.15647,在本实验室保藏。所用培养基种类及配方见表1。
表1 培养基种类及配方
Table 1 Type and formula of culture medium

种类配方/(g/L)LBB蛋白胨 10;酵母膏 5;氯化钠 10;脑心浸出液 10LBHIS酵母膏 2.5,蛋白胨 5,氯化钠 5,脑心浸出液 18.5,D-山梨醇 91EPO酵母膏 5,蛋白胨 10,氯化钠 10,异烟肼 4,甘氨酸 2.5,吐温 80 1 mL,
1.2 仪器与设备
Vanquish UHPLC超高效液相、Q ExactiveTM HF-X高分辨质谱,Thermo Fisher(USA)公司。其余仪器与设备见附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.034392)。
附表1 设备与仪器
Table S1 Testing devices and instruments

仪器厂家电子天平梅特勒-托利多仪器(上海)有限公司PCR仪杭州朗基科学仪器有限公司凝胶成像电泳系统Bio-Rad(USA)公司蛋白纯化仪ÄKTA purifier UPC10GE(USA)公司低温高速离心机Thermo(USA)公司蛋白质电泳系统北京六一仪器厂核酸凝胶电泳系统北京六一仪器厂pH计Delta 320梅特勒-托利多仪器(上海)有限公司紫外可见分光光度计 759S上海棱光技术有限公司涡旋震荡仪海门市其林贝尔仪器制造有限公司高通量破碎仪Bertin Technologies台式冷冻离心机CT15REHITACHI微量分光光度计Q5000Quawell(USA)公司
1.3 实验方法
1.3.1 质粒构建与转化
使用引物对VHH_F/VHH_R,以实验室前期构建的质粒扩增基因VHH[4],用plasmid_F/plasmid_R引物对使pXMJ19-control质粒线性化并在两端添加20 bp同源序列,使用同源重组连接插入基因片段,得到质粒pXMJ19-Ptac-0949-VHH。
将pXMJ19-control和pXMJ19-Ptac-0949-VHH质粒转化至谷氨酸棒杆菌BZH001中。平板上随机挑选3个菌落PCR验证为阳性的克隆,接种至LBB种子培养基于30 ℃,220 r/min恒温振荡培养箱过夜培养。次日以初始OD600=0.2转接至培养基LBB中,培养2 h时添加1 mmol/L异丙基β-D-1-硫代吡喃半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)诱导VHH蛋白分泌表达。培养5 h后取样并进行检测。
1.3.2 蛋白表达及验证
取培养5 h后的BZH001和VHH菌液,12 000 r/min离心1 min,吸取80 μL上清液,加入5×loading buffer,沸水煮10 min。使用翌圣15%预制胶,10 μL上样,90 V,15 min;120 V,45 min。加热5 min使用考马斯亮蓝对蛋白胶进行染色,脱色液加热15 min,重复3次,直至底色从蓝色变为透明。
1.3.3 样品制备
胞外代谢物收集要求菌处于对数生长期,选取培养5 h的菌液快速从培养瓶中取出一定量的培养液,4 ℃条件下离心(1 000×g,10 min)。移取上清液500 μL至新的离心管中,迅速放入液氮中淬灭30 s;淬灭后放入-80 ℃中保存。共取3份样品以满足后续检测需要及运输损耗。
1.3.4 代谢物提取
取1 mL样本于冻干机中冻干,加入100 μL的80%甲醇/水溶液;涡旋振荡均匀后在冰水混合物中静置5 min;在低温高速离心机中保持4 ℃,15 000×g转速离心15 min;使用LC-MS级别的水稀释上清液至甲醇含量为53%;以15 000×g转速在离心机中4 ℃离心15 min,吸取上清液,进样LC-MS进行分析。
质控(quality control, QC)样本:从每个实验样本中取等体积样本混匀作为QC样本,检测时利用QC样本进行质控,本文中所有原始数据的质量控制均基于QC样本进行。
1.3.5 色谱及质谱条件
色谱条件:搭载Hypesil Gold column(C18)色谱柱(100 mm×2.1 mm,1.9 μm)。正离子电离模式:流动相A:0.1%甲酸;流动相B:甲醇。负离子电离模式:流动相A:5 mmol/L醋酸铵,pH 9.0,流动相B:甲醇。洗脱条件:0~1.5 min,2% B;1.5~3 min,85% B;3~10 min,100% B;10~10.1 min,2% B;10.1~12.0 min,2% B;流速0.2 mL/min,柱温为40 ℃。
质谱条件:扫描范围选择m/z为100~1 500;ESI源的设置如下:喷雾电压3.5 kV;鞘气流速35 arb;辅助气流速10 arb;离子传输管温度320 ℃;离子导入射频电平(S-lens RF level)60;辅助气加热器温度350 ℃;极性:positive,negative;MS/MS二级扫描为数据依赖性扫描(datadependent scans)。
1.3.6 差异代谢物分析
采用有监督的正交偏最小二乘判别分析(orthogonal partial least squares discrimination analysis, OPLS-DA)模型对G1和G2组进行区分以展示其组间代谢总体差异特性。其中以变量投影重要性(variable importance projection, VIP)>1,P<0.05为标准对代谢物进行筛选并将符合标准的代谢物认为是表达显著差异的代谢物,可能是潜在的生物标志物。将差异代谢物通过KEGG数据库(https://www.kegg.jpkeggpathway.html/)中的谷氨酸棒杆菌数据库(Select prefix:cgl,cgm)进行代谢通路注释,获得差异代谢物参与的通路。使用R软件包ggplot2(Version 4.2.1)进行主成分分析(principal component analysis, PCA)和可视化,MetaboAnalyst 5.0数据库(https://www.metaboanalyst.ca)和Omicshare(https://www.omicshare.com/)进行KEGG通路富集分析。
2 结果与分析
2.1 样品制备
谷氨酸棒杆菌重组菌株构建及其外源蛋白表达验证如下。将pXMJ19-control和pXMJ19-Ptac-0949-VHH质粒分别转入C.glutamicum,并命名为G1和G2,对其进行生长曲线测定,以探究表达外源蛋白对C.glutamicum生长的影响。由图1-a可知,2组均在发酵4 h进入对数生长期,10 h进入稳定期;发酵2 h后添加了IPTG诱导VHH表达,G2组OD600值略低于G1说明表达外源蛋白对菌株生长有轻微影响,但总体趋势与对照组一致且稳定期菌体密度差异小。培养5、6、7 h的G2组如图1-b中7~9条带所示,结合生长曲线认为5 h处于对数生长期并已有蛋白分泌故选择5 h 作为合适的取样时间。选取发酵5 h的菌液上清作为分析样品,与对照组G1(图1-b,条带1)相比G2组在15 kDa处有明显条带(图1-b,条带2~6)。
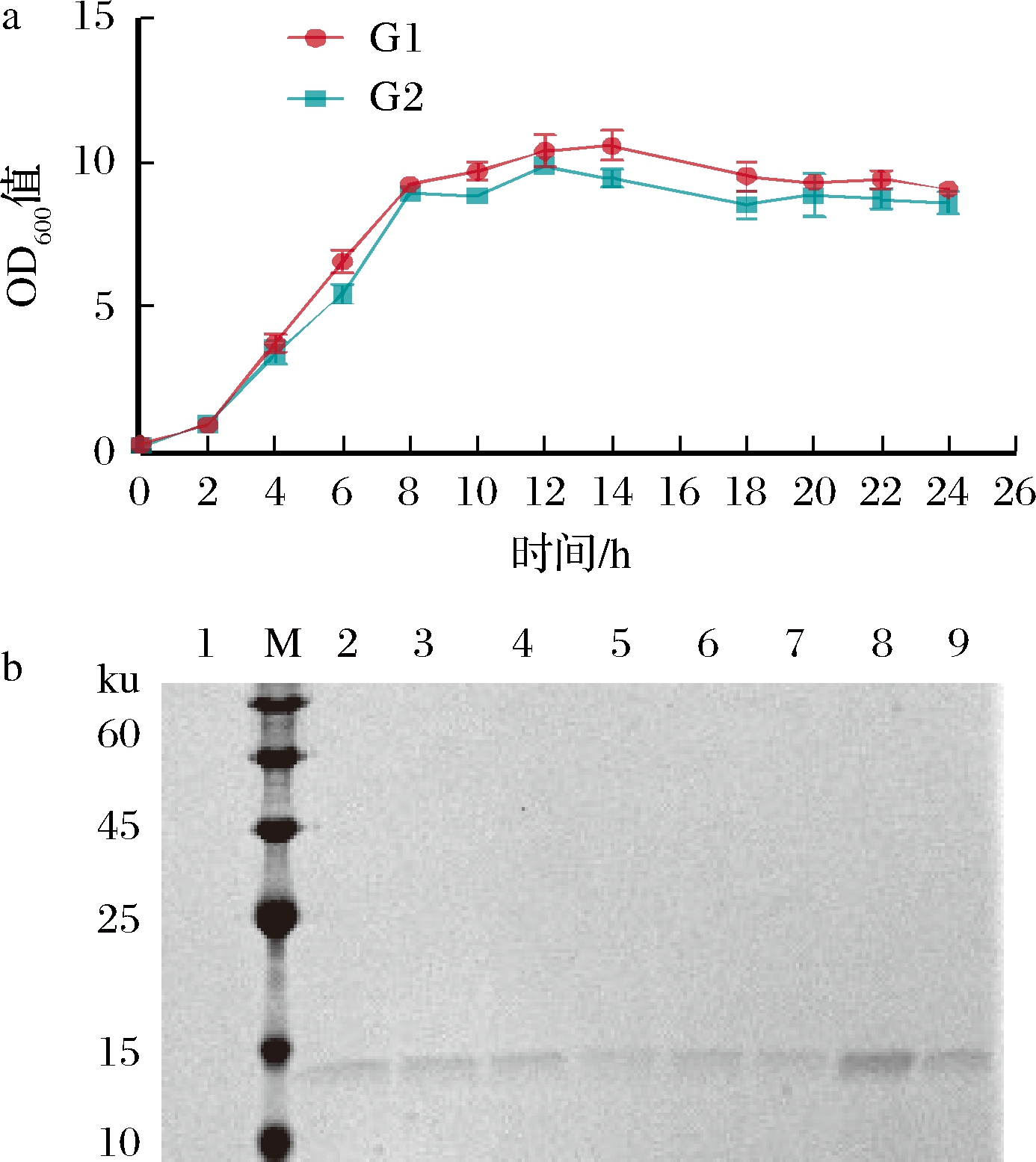
a-G1和G2的4 h生长曲线;b-菌液上清SDS-PAGE验证
(M-三色预染Marker;条带1-携带pXMJ19-control的G1的发酵5 h的上清液;条带2~6-携带pXMJ19-Ptac-0949-VHH的G2发酵5 h的上清液;条带7~8-G2发酵5 、6 、7 h的取样上清液)
图1 生长曲线和外源蛋白表达验证
Fig.1 Growth curves and validation of exogenous protein expression
2.2 代谢组学结果分析
2.2.1 差异代谢物分析
采用非靶向代谢组学手段,鉴定G1和G2两组发酵液中代谢物并分析其变化规律。对代谢组结果进行可视化处理,结果显示如图2-a和图2-c所示,组间PCA分离明显,R2X均>0.5(附表2,https://doi.org/10.13995/j.cnki.11-1802/ts.034392)判断组内样本聚集良好。对2组代谢物进行了OPLS-DA分析,结果显示R2X>0.5,R2Y和Q2值均接近于1(附表2),表明模型愈为稳定可信性高。进一步采用置换检验来验证模型的预测能力和鲁棒性,经过200次排列,正负离子电离模式下R2Y和Q2建模值与真实值组成的回归线截距分别如图2-b、图2-d所示。R2在正负离子中分别为0.936和0.699,Q2回归线截距在正负离子中分别为-0.15和-0.417,表明OPLS-DA模型拟合处于正常状态,后续分析的数据可靠、结果可信。
附表2 PCA和OPLS-DA模型参数
Table S2 PCA and OPLS-DA model parameters
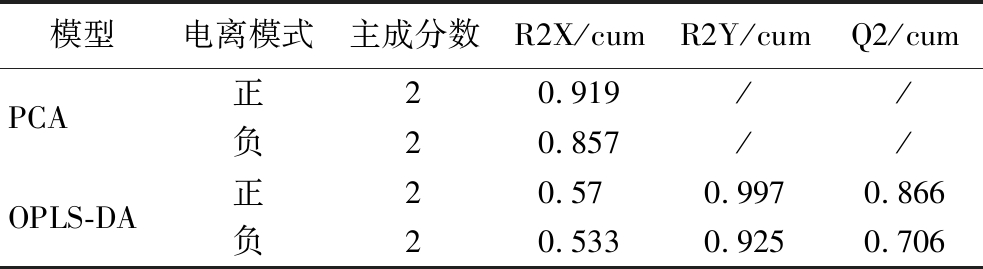
模型电离模式主成分数R2X/cumR2Y/cumQ2/cumPCA正20.919//负20.857//OPLS-DA正20.570.9970.866负20.5330.9250.706
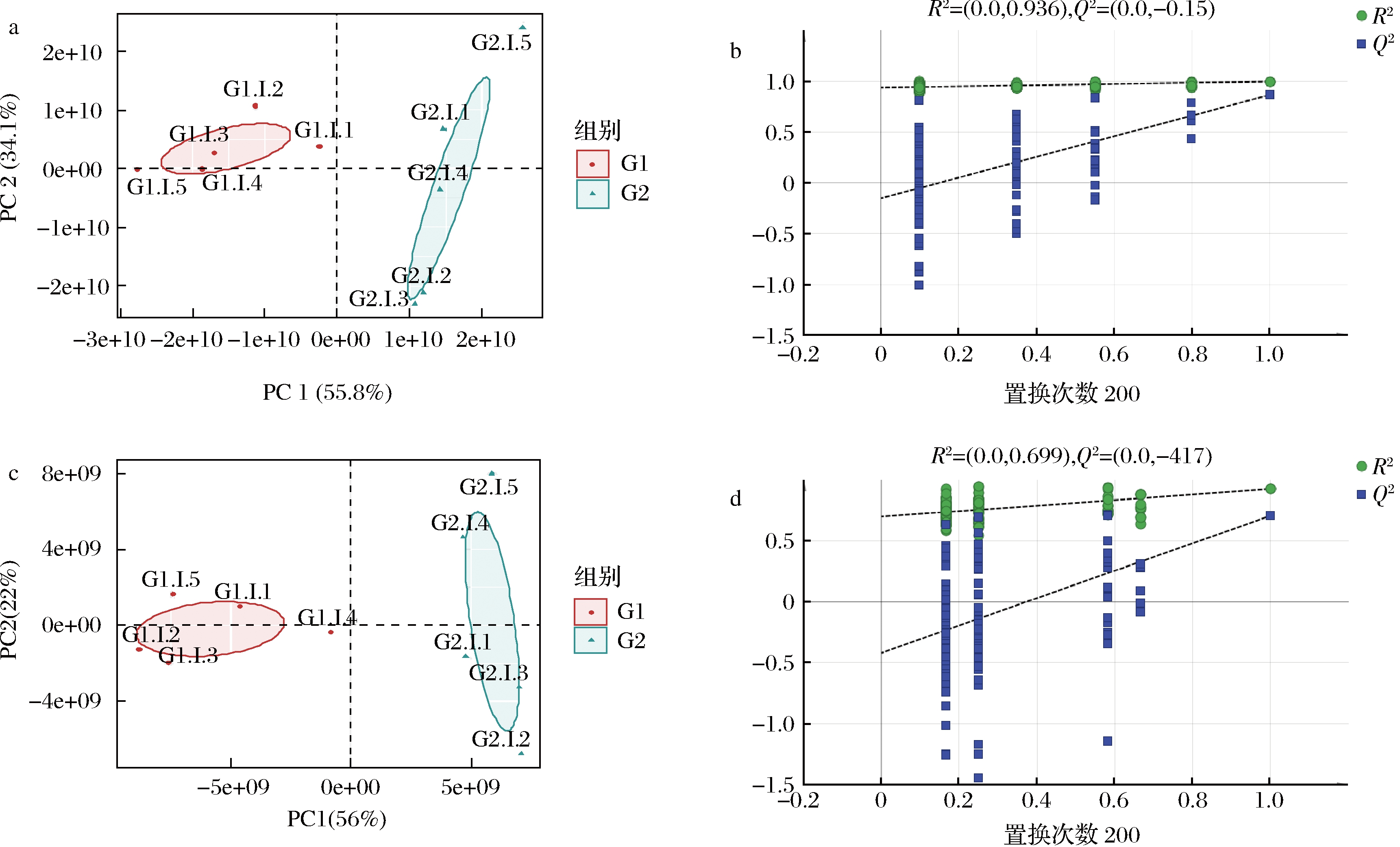
a-正离子电离模式下PCA得分散点图;b-正离子电离模式下OPLS-DA模型的置换检验结果;c-负离子电离模式下PCA得分散点图;d-负离子电离模式下OPLS-DA模型的置换检验结果
图2 正离子和负离子电离模式下G1和G2的PCA模型和置换检验。
Fig.2 PCA model and permutation test results of G1 and G2
表2 本实验所用引物
Table 2 Primes used in this study

引物名称引物序列(5′-3′)plasmid_FCTCTTCATAAGAATTCAGCTTGGCTGTTTTGGplasmid_RTAGTTGTCCTCCTTTAAGCTAAGCTTAAVHH_FAGCTTAAAGGAGGACAACTAATGCAAATAAACCGCCGAGGVHH_RAGCTGAATTCTTATGAAGAGACGGTCACCTGGGT
2.2.2 差异代谢物筛选
在正负离子电离模式下,共检测到933个代谢物,其中正离子631个,负离子302个。根据t检验得到的P值、OPLS-DA模型计算出的VIP值和代谢物浓度倍数值(fold change, FC),绘制火山图以展示代谢物丰度差异(图3)。以VIP>1和P<0.05为标准筛选出BZH001菌株中分泌表达VHH蛋白导致产生差异浓度的代谢物,共176个代谢物,其中正离子100个,负离子76个。

a-正离子下代谢物火山图;b-负离子下代谢物火山图
图3 正离子和负离子电离模式下G1和G2的代谢物筛选火山图
Fig.3 Volcano plots of screening metabolites
取代谢物丰度log转化值并绘制差异代谢物聚类热图,可以直观地看出各差异代谢物相对浓度的变化。如图4所示,差异代谢物2组样本中可明显区分,说明分泌表达外源蛋白导致菌株代谢发生了显著变化。分泌表达外源蛋白VHH导致其中79个代谢物在VHH组中显著增加,其中正离子电离模式72个,负离子电离模式7个;97个代谢物显著降低,其中正离子电离模式28个,负离子电离模式69个。

a-正离子电离模式;b-负离子电离模式
图4 正、负离子电离模式下G1和G2的差异代谢物聚类热图
Fig.4 Heat map visualization of differential metabolites
|log2(FC)|值越大,说明谷氨酸棒杆菌培养液上清中的代谢物浓度变化越大。因此选取|log2(FC)|排序前25的差异代谢物构建代谢物差异倍数条形图(附图1,https://doi.org/10.13995/j.cnki.11-1802/ts.034392),其中17个代谢物显著下降,仅8个代谢物上升,D-mannose 6-phosphate和5′-S-methyl-5′-thioadenosine分别为浓度下降和上升中最显著的代谢物。

附图1 代谢物差异倍数条形图
Fig.S1 Differential metabolites fold change bar chart
2.2.3 差异代谢物KEGG通路富集分析
以筛选得出的176种差异性代谢物为对象通过MetaboAnalyst 5.0数据库进行生物信息学分析,匹配KEGG的数据库获得代谢物参与的通路信息(图5-a)。97个下调代谢物中,34个富集到了KEGG代谢途径,上调共79个代谢物有18个富集到了KEGG代谢途径。KEGG通路富集表明分泌表达外源蛋白引发了代谢紊乱,特别是新陈代谢途径(metabolic pathways)和氨基酸代谢途径(amino acid metabolism pathways)受到影响最大,分别有39个和21个代谢物发生了显著性变化,这些代谢通路可能在谷氨酸棒杆菌表达外源蛋白的研究中有重要意义。

a-差异代谢物KEGG富集通路图;b-显著差异代谢物代谢通路分析
图5 差异代谢物通路分析
Fig.5 Differential metabolite pathway analysis
对|log2(FC)|数值最大的5个显著差异代谢物进行代谢通路富集分析,除了对新陈代谢途径产生的影响,其余主要涉及代谢通路均在表3中显示,5个显著差异代谢物共涉及11个代谢途径包括碳水化合物代谢、聚糖的生物合成和代谢、核苷酸代谢及跨膜运输等。
表3 部分显著差异代谢物
Table 3 Top5 differentially expressed metabolites in BZH001and VHH

名称参与代谢途径VIPP值FClog2FCD-甘露糖-6-磷酸D-mannose 6-phosphatefructose and mannose metabolismO-antigen nucleotide sugar biosynthesisbiosynthesis of secondary metabolitesphosphotransferase system (PTS)amino sugar and nucleotide sugar metabolism1.361 50.0040.235-2.0915′-S-甲基-5′-硫代腺苷5′-S-methyl-5′-thioadenosinecysteine and methionine metabolism1.681 650.0013.6221.857鸟嘌呤二核苷酸磷酸GDPpurine metabolism1.429 580.0180.289-1.793叶酸folic acidone carbon pool by folatefolate biosynthesis1.430 060.0180.291-1.781肌苷inosinepurine metabolismABC transporters1.265 340.0180.318-1.650
获得不同途径代谢物通路的匹配信息后,根据相应的通路数据库对系统进行检索分析和代谢产物通路的富集分析(图5-b),富集因子(rich factor)和对应途径的富集程度呈正相关。P值越小,富集因子越大,表明对该通路的影响越强。通路富集分析的前5名分别是色氨酸代谢、甲烷代谢、双组分系统、苯丙氨酸,酪氨酸和色氨酸的生物合成及酪氨酸代谢(附表3,https://doi.org/10.13995/j.cnki.11-1802/ts.034392),说明分泌表达外源蛋白导致芳香族氨基酸代谢在菌株中发生显著变化。
附表3 芳香族氨基酸代谢相关差异代谢物
Table S3 Aromatic amino acid metabolism related differential metabolites
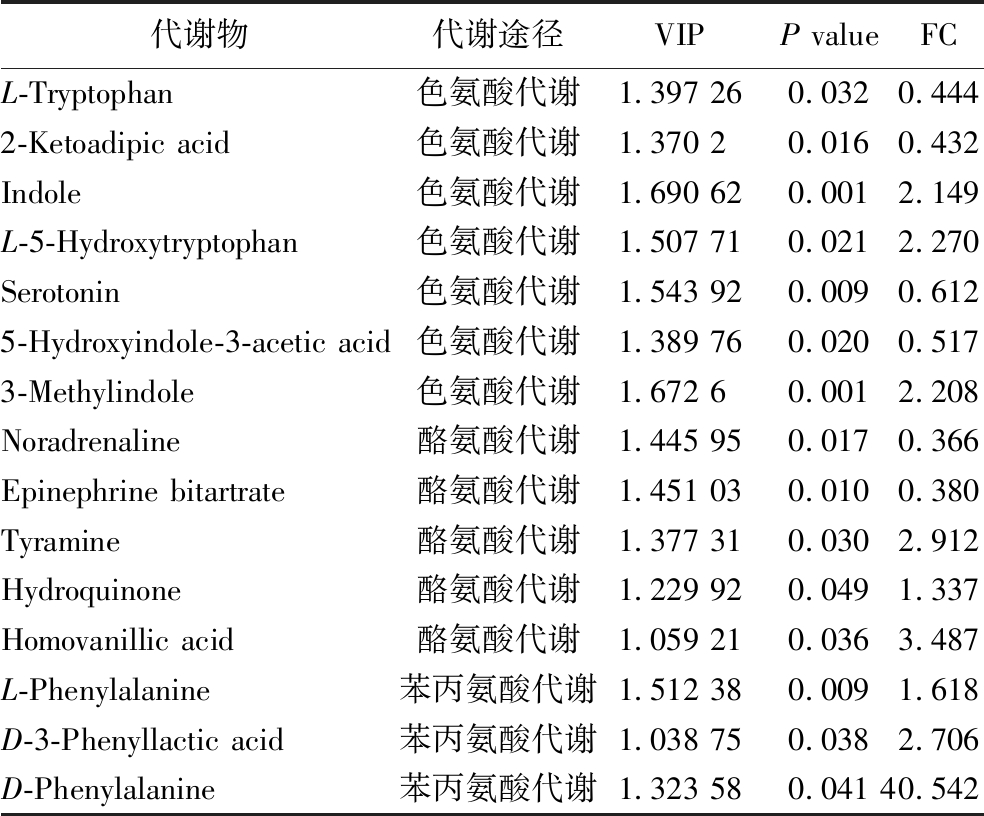
代谢物代谢途径VIPP valueFCL-Tryptophan色氨酸代谢1.397 260.0320.4442-Ketoadipic acid色氨酸代谢1.370 20.0160.432Indole色氨酸代谢1.690 620.0012.149L-5-Hydroxytryptophan色氨酸代谢1.507 710.0212.270Serotonin色氨酸代谢1.543 920.0090.6125-Hydroxyindole-3-acetic acid色氨酸代谢1.389 760.0200.5173-Methylindole色氨酸代谢1.672 60.0012.208Noradrenaline酪氨酸代谢1.445 950.0170.366Epinephrine bitartrate酪氨酸代谢1.451 030.0100.380Tyramine酪氨酸代谢1.377 310.0302.912Hydroquinone酪氨酸代谢1.229 920.0491.337Homovanillic acid酪氨酸代谢1.059 210.0363.487L-Phenylalanine苯丙氨酸代谢1.512 380.0091.618D-3-Phenyllactic acid苯丙氨酸代谢1.038 750.0382.706D-Phenylalanine苯丙氨酸代谢1.323 580.041 40.542
3 讨论
本研究采用非靶向代谢组学技术对分泌表达外源蛋白VHH的C.glutamicum BZH001(CGMCC1.15647)中代谢物进行比对和筛选,获得关键差异代谢物,研究分泌表达外源蛋白对BZH001菌株自身代谢的影响,为优化其作为优良的外源蛋白表达宿主提供理论依据。
依据VIP>1和P<0.05标准,本次分析共筛选到176个差异代谢物,其中下调97个代谢物,上调79个代谢物。下调代谢物34个富集到了KEGG代谢途径,上调代谢物中有18个富集到了KEGG代谢途径。通过代谢通路分析发现差异表达的代谢物主要与氨基酸代谢、核苷酸代谢及碳代谢相关(附图2,https://doi.org/10.13995/j.cnki.11-1802/ts.034392)。
D-甘露糖-6-磷酸是变化最显著的代谢物,为对照组的0.235倍,共参与谷氨酸棒杆菌中的5条代谢通路(表3)。在氨基糖和核苷酸糖代谢、O-抗原核苷酸糖生物合成途径中,D-甘露糖-6-磷酸在磷酸甘露糖异构酶催化的可逆作用下转化为果糖6-磷酸,进入糖酵解后为表达外源蛋白提供能量[12]。在果糖和甘露糖代谢中,Cgl0687、Cgl0746基因编码的磷酸甘露糖变位酶(phosphomannomutase, PMM)催化变位反应,合成鸟苷二磷酸甘露糖的前提。鸟苷二磷酸甘露糖用于多萜醇磷酸甘露糖的合成,之后参与N-糖基化[13]。在革兰氏阴性菌空肠弯曲菌(Campylobacter jejuni)已证明N-糖基化途径影响蛋白质稳定性、营养转运、应激反应和抗菌素耐药性等。分泌表达外源蛋白可能需要促进N-糖基化从而稳定胞内蛋白质同时构建适合转运的细胞膜结构。
叶酸作为显著差异排名前五的代谢物,其含量下降超70%,主要参与叶酸一碳库(one carbon pool by folate)和叶酸合成(folate biosynthesis)途径。进入机体的叶酸在经Cgl0848基因编码的二氢叶酸还原酶(EC:1.5.1.3)作用下转变为二氢叶酸,再经该酶转化为5,6,7,8-四氢叶酸(5,6,7,8-tetrahydrofolate, THF)。THF是活跃的可以传递一碳基团的必需辅酶,参与例如甲烷代谢、氨酰tRNA生物合成等生物体内的各种反应。通过map00679分析,在C.glutamicum中THF可多路径间接或直接转化为5,10-亚甲基四氢叶酸,并多数为可逆反应以保障体内叶酸库的稳定。

附图2 差异代谢物代谢网络分析
Fig.S2 metabolic network analysis of differential metabolites
肌苷和GDP均参与嘌呤代谢途径。肌苷减少为对照组的0.32,首先在产生路径中次黄嘌呤核苷酸(inosinemonphosphate, IMP)减少向肌苷转化并且转向AMP,更易转为ATP为菌株提供能量。其次,肌苷增加向次黄嘌呤的消耗,经Cgl2697基因所编码的酶被催化为IMP,最终促进腺苷的生成。GDP涌向dGTP方向,用于DNA合成,同时转化为GMP释放高能磷酸基团和能量,供菌株使用。
5′-S-甲基-5′-硫代腺苷在G2组中上升至3.6倍。在由Cgl1603编码的S-腺苷甲硫氨酸合成酶催化下,甲硫氨酸获得来自ATP的能量形成拥有高能甲硫键的S-腺苷甲硫氨酸(S-adenosyl methionine, SAM),再经亚精胺合成酶(Cgl2702)转化为5′-S-甲基-5′-硫代腺苷。分析认为甲硫氨酸合成酶催化同型半胱氨酸(L-homocysteine, Hcy),在5-甲基四氢叶酸提供甲基条件下,可形成甲硫氨酸用于菌株代谢和满足蛋白表达需要。结合叶酸含量显著降低,大量甲硫氨酸合成,由于总量上升导致甲硫氨酸降解途径加剧从而积累5′-S-甲基-5′-硫代腺苷[14]。
富集显著性分析中多条氨基酸相关路径得分靠前,说明外源表达分泌蛋白不仅影响C.glutamicum BZH001能量代谢还与氨基酸合成、利用紧密相关。其中最主要的是芳香族氨基酸的代谢[15],包括色氨酸代谢、酪氨酸代谢及苯丙氨酸、酪氨酸和色氨酸的生物合成[16]。
在苯丙氨酸、酪氨酸和色氨酸的生物合成途径中,分支酸处流向色氨酸途径或被催化生成预苯酸,后者作为前体参与L-苯丙氨酸及L-酪氨酸的合成。有研究表明表达异源蛋白可以使生物体内产生D型氨基酸[17],G1和G2组中均有异源质粒的导入,故可检测到D-苯丙氨酸的存在。D-苯丙氨酸经D-氨基酸脱氢酶氧化为苯丙酮酸,D-3-苯乳酸可逆转化为苯丙酮酸,苯丙酮酸作为前体经组氨醇磷酸氨基转移酶反应为L-苯丙氨酸。L-苯丙氨酸量增加60%有助于氨基酸累积[18-19],形成疏水区保护胞内蛋白质[20]从而稳定细胞内环境以抵抗表达外源蛋白造成的胁迫。
在色氨酸代谢中,L-色氨酸、2-氧代己二酸、5-羟色胺、5-羟基吲哚-3-乙酸4个代谢物下降,吲哚、L-5-羟基色氨酸和3-甲基吲哚3个代谢物显著上升,说明色氨酸代谢途径在分泌外源蛋白过程中发挥重要作用。其中L-色氨酸下降[21]影响细胞膜的通透性,从而加快物质吸收及蛋白分泌。2-氧代己二酸(2-ketoadipic acid)与未表达外源蛋白菌株相比下调57%,从代谢通路map00380分析,此步骤所消耗的2-氧代己二酸明显增多,经过5步反应生成乙酰辅酶A参与糖酵解进而参与能量代谢。同时,三羧酸循环途径中L-苹果酸下调,说明三羧酸循环活跃,为菌株提供更多能量。分泌表达外源蛋白导致BZH001菌株能量消耗大量增加,需要上调中心代谢以满足菌株生长和生产的需要。
与核苷酸代谢相关的7个差异代谢物中,在嘧啶代谢相关3个差异代谢物中,L-二氢乳清酸(L-dihydroorotic acid)和甲基丙二酸(methylmalonate)均显著下降。在嘧啶生物合成过程中有多种嘧啶环中间产物生成,L-二氢乳清酸作为最先生成的物质在脱氢后转化为乳清酸。通过路径分析(map00240)其与精氨酸代谢、丙氨酸、天冬氨酸和谷氨酰胺代谢以及缬氨酸、亮氨酸和异亮氨酸代谢相关[22],菌株大量表达外源蛋白时大量氨基酸流向蛋白合成路径导致相关水解产物下降。在嘌呤代谢中,脱氧尿苷(2-deoxyuridine)两倍上升,dUMP在5′-核苷酸酶和2′,3′-环腺苷酸-3′-磷酸二酯酶等酶簇催化下释放磷酸基团和能量,同时尿苷转化为脱氧尿苷。在N-乙酰葡萄糖胺-1-磷酸尿苷酰转移酶(N-acetylglucosamine-1-phosphate uridyltransferase, GlmU)作用下尿苷被催化成为尿苷二磷酸-N-乙酰葡萄糖胺(UDP-N-acetylglucosamine, UDP-GlcNAc),此物质在革兰氏阳性菌中有重要作用,主要涉及肽聚糖生物合成[23],肽聚糖是谷氨酸棒杆菌细胞壁的主要成分之一,推测蛋白分泌影响细胞壁的生物合成,改变肽聚糖层交联网络的孔隙进而造成细胞壁通透性的变化。
综上分析,分泌表达外源蛋白影响C.glutamicum BZH001的代谢,特别是能量的代谢通路和氨基酸的代谢通路。糖酵解和三羧酸循环加剧以提供能量满足BZH001表达外源蛋白的需求以及胁迫下的自身生长。氨基酸代谢的改变在满足提供外源蛋白合成原料之外还影响胞内环境稳定性和细胞壁合成,有利于外源蛋白的分泌。
4 结论
本研究代谢组分析结果表示,当C.glutamicum BZH001分泌表达外源蛋白VHH时需要大量的能量同时吸引氨基酸前往合成路径,具体表现为中心代谢加剧以满足生产和生长的双向要求,氨基酸大量流向蛋白合成方向导致嘧啶代谢中与氨基酸相关的代谢物显著下调。C.glutamicum BZH001菌株通过调节体内三羧酸循环、核苷酸代谢和氨基酸代谢等提高能量供给以应对外源蛋白合成及分泌造成的细胞应激反应,利用其他组学联合分析,理清关键性差异代谢物并进行验证性研究,为后续改造BZH001菌株成为更好的外源蛋白表达宿主提供理论支持。
[1] CHAI M, DENG C, CHEN Q, et al.Synthetic biology toolkits and metabolic engineering applied in Corynebacterium glutamicum for biomanufacturing[J].ACS Synthetic Biology, 2021, 10(12):3237-3250.
[2] SUN M M, GAO A X, LI A, et al.Bicistronic design as recombinant expression enhancer:Characteristics, applications, and structural optimization[J].Applied Microbiology and Biotechnology, 2021, 105(20):7709-7720.
[3] WANG Y L, GAO X, LIU X X, et al.Construction of a 3A system from BioBrick parts for expression of recombinant hirudin variants Ⅲ in Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology, 2020, 104(19):8257-8266.
[4] MENG L H, GAO X, LIU X X, et al.Enhancement of heterologous protein production in Corynebacterium glutamicum via atmospheric and room temperature plasma mutagenesis and high-throughput screening[J].Journal of Biotechnology, 2021, 339:22-31.
[5] YU X Y, LIU X X, GAO X, et al.Development of a novel platform for recombinant protein production in Corynebacterium glutamicum on ethanol[J].Synthetic and Systems Biotechnology, 2022, 7(2):765-774.
[6] LARSSON C, PÅHLMAN I L, GUSTAFSSON L.The importance of ATP as a regulator of glycolytic flux in Saccharomyces cerevisiae[J].Yeast, 2000, 16(9):797-809.
[7] UNREAN P.Pathway analysis of Pichia pastoris to elucidate methanol metabolism and its regulation for production of recombinant proteins[J].Biotechnology Progress, 2014, 30(1):28-37.
[8] KOEBMANN B J, WESTERHOFF H V, SNOEP J L, et al.The glycolytic flux in Escherichia coli is controlled by the demand for ATP[J].Journal of Bacteriology, 2002, 184(14):3909-3916.
[9] ZOU S P, ZHANG Z, ZHAO K, et al.Metabolic engineering of Escherichia coli for improved D-pantothenic acid biosynthesis by enhancing NADPH availability[J].Biochemical Engineering Journal, 2022, 187:108603.
[10] SUN X, LI Q G, WANG Y, et al.Isoleucyl-tRNA synthetase mutant based whole-cell biosensor for high-throughput selection of isoleucine overproducers[J].Biosensors and Bioelectronics, 2021, 172:112783.
[11] MUYLDERMANS S.Nanobodies:Natural single-domain antibodies[J].Annual Review of Biochemistry, 2013, 82:775-797.
[12] YU G, XU C F, ZHANG D N, et al.MetOrigin:Discriminating the origins of microbial metabolites for integrative analysis of the gut microbiome and metabolome[J].iMeta, 2022, 1(1):e10.
[13] XIE S S, TAN Y H, SONG W X, et al.N-glycosylation of a cargo protein C-terminal domain recognized by the type IX secretion system in Cytophaga hutchinsonii affects protein secretion and localization[J].Applied and Environmental Microbiology, 2022, 88(1):e01606-21.
[14] STACK T M M, GERLT J A.Discovery of novel pathways for carbohydrate metabolism[J].Current Opinion in Chemical Biology, 2021, 61:63-70.
[15] ZAHOOR A, LINDNER S N, WENDISCH V F.Metabolic engineering of Corynebacterium glutamicum aimed at alternative carbon sources and new products[J].Computational and Structural Biotechnology Journal, 2012, 3:e201210004.
[16] WU X Y, GUO X Y, ZHANG B, et al.Recent advances of L-ornithine biosynthesis in metabolically engineered Corynebacterium glutamicum[J].Frontiers in Bioengineering and Biotechnology, 2020, 7:440.
[17] ST BLER N, OIKAWA T, BOTT M, et al.Corynebacterium glutamicum as a host for synthesis and export of D-amino acids[J].Journal of Bacteriology, 2011, 193(7):1702-1709.
BLER N, OIKAWA T, BOTT M, et al.Corynebacterium glutamicum as a host for synthesis and export of D-amino acids[J].Journal of Bacteriology, 2011, 193(7):1702-1709.
[18] LIU Y, LI X Y, LU S H, et al.Comparative metabolic responses induced by pyridine and imidazole in Blakeslea trispora[J].Frontiers in Bioengineering and Biotechnology, 2019, 7:347.
[19] DING M Z, CHENG J S, XIAO W H, et al.Comparative metabolomic analysis on industrial continuous and batch ethanol fermentation processes by GC-TOF-MS[J].Metabolomics, 2009, 5(2):229-238.
[20] LV L X, YAN R, SHI H Y, et al.Integrated transcriptomic and proteomic analysis of the bile stress response in probiotic Lactobacillus salivarius LI01[J].Journal of Proteomics, 2017, 150:216-229.
[21] CHEN Y N, CHI W C, TRINH N N, et al.Transcriptome profiling and physiological studies reveal a major role for aromatic amino acids in mercury stress tolerance in rice seedlings[J].PLoS One, 2014, 9(5):e95163.
[22] WOO H M, NOACK S, SEIBOLD G M, et al.Link between phosphate starvation and glycogen metabolism in Corynebacterium glutamicum, revealed by metabolomics[J].Applied and Environmental Microbiology, 2010, 76(20):6910-6919.
[23] SUMAN E, D′SOUZA S, JACOB P, et al.Anti-biofilm and anti-adherence activity of Glm-U inhibitors[J].Indian Journal of Medical Sciences, 2011, 65(9):387-392.