我国传统发酵食品泡椒因含有丰富的有机酸,具有维持人类肠道菌群平衡、降低胆固醇、增强免疫力和抗氧化性等多种益生作用,深受人们的喜爱[1]。目前,工业生产泡椒大多还是依靠原料自身携带的菌群和环境微生物进行自然发酵。由于自然发酵过程参与的菌株种类复杂多样,发酵过程难以控制,导致各批次的泡椒质量与风味不同,很难获得稳定的品质[2]。因此,在发酵时人工接入具有发酵优势的益生菌株进行强化发酵,取代传统的自然发酵,可以开发出质量更稳定的产品也更适宜于规模化、标准化生产,而具有发酵优势菌株的获得则是实现强化发酵的前提条件。曾维友等[3]从泡菜中筛选出优异乳酸菌株,但适合泡椒发酵的优异乳酸菌却鲜有报道。这是由于泡菜所组成的微生物菌群与泡椒的区别较大,泡菜中对微生物的生长起抑制作用的主要因素是高盐环境,而泡椒中除了高盐外还有由辣椒素所构成的辣度体系会对相关微生物的生长产生抑制作用[4]。泡椒中分离的乳酸菌除了产酸耐盐以外,推测其还具有一定程度的耐辣椒素或辣椒碱的特性。因此,从泡椒资源丰富的地区分离筛选出产酸强、耐盐、耐辣椒素的发酵特性好的优异菌株,对泡椒生产行业的具有重要理论和现实意义。
针对以上问题,本研究从四川农家自制不同年份的泡椒老卤水中分离乳酸菌,以总酸、耐辣椒素及耐盐程度为指标,再结合发酵泡椒的理化特性,筛选出发酵性能优异的乳酸菌。同时通过人工胃肠液、自聚性、抗生素敏感性以及抗氧化能力测试初步评价所筛的菌株益生性能,为后续应用于泡椒强化发酵提供候选菌种资源和科学依据。
1 材料与方法
1.1 材料与试剂
试验菌株分别来自于四川成都市金堂县、成都青羊区、德阳广汉市、绵阳市农家自制泡椒卤水,卤水年限分别为1年、2年、5年和6年。商用专用泡菜发酵菌株短乳杆菌CICC6239,中国工业微生物菌种保藏管理中心;MRS肉汤培养基及琼脂培养基、胰蛋白酶、胃蛋白酶,北京索莱宝科技有限公司;碳酸钙、NaCl、HCl、1,10-菲啰啉,国药集团化学试剂有限公司;抗生素药敏片,南京全隆生物技术有限公司;辣椒素,华天生物科技有限公司;DPPH和ABST试剂,福州飞净生物有限公司。
1.2 仪器与设备
电子天平,上海梅特勒托利多科技(中国)有限公司;pH计、YJ-840超净工作台、UV-2100分光光度计、恒温培养箱,上海-精宏实验设备有限公司;GR60DA高压蒸汽灭菌锅、赛默飞离心机,苏州赛恩斯仪器有限公司等。
1.3 实验方法
1.3.1 发酵性能好乳酸菌的筛选
1.3.1.1 产酸能力
取1 mL泡椒老卤水,按梯度稀释取稀释液0.1 mL涂布于MRS固体培养基上,放置37 ℃培养箱中培养约36 h。以融钙圈及生理生化特性选出10株乳酸菌并活化,按体积比2%的接种量接种至MRS液体培养基振荡培养24 h后,以总酸作为筛选指标来初筛出产酸能力强的菌株。
1.3.1.2 耐辣椒素及耐盐能力
将分离菌株的活菌数调整为1.0×108 CFU/mL,取其菌悬液0.1 mL分别涂布至含辣椒素1.1、2.2、3.3、4.4 g/L的MRS固体培养基中,37 ℃恒温培养48 h后计算活菌数。按2%的接种量分别接种至含NaCl 0、20、40、60、80、100 g/L的MRS肉汤培养基中,37 ℃恒温培养24 h,测定其发酵液的OD600 nm值。
1.3.2 泡椒理化指标
1.3.2.1 感官评价
将菌株活化2代并将活菌数稀释至1.0×108 CFU/mL,再按料液比的1%的接种量、8%食盐、2%冰糖接种在预处理好的辣椒样品中,室温发酵15 d 后参考张楠笛等[5]的风味评分标准来评价产品的色泽、酸度、脆度、形态、滋味、涩味和香气。
1.3.2.2 总酸及亚硝酸盐含量
总酸测定参考GB 12456—2021中的酸碱滴定法,将发酵15 d的泡椒液低温离心取其上清液,参照GB 5009.33—2016中的方法,测定亚硝酸盐含量。
1.3.3 菌种鉴定
1.3.3.1 形态及分子生物学鉴定
将菌株活化培养18 h后,提取基因组DNA[6]。以27 F、1492 R为引物对菌株16S rDNA进行PCR扩增,PCR扩增体系(50 μL):上和下游引物各为2 μL、dNTPMix 4 μL、Taq酶0.5 μL,10×ExTaq Buffer 5 μL,模板DNA 2.5 μL,无菌ddH2O 34 μL。将PCR产物送上海生工进行测序,测序结果与NCBI的GenBank数据库进行BLAST同源性序列比对,选取并下载同源性大于99%的乳酸菌,然后使用MEGA 7.0软件中的邻近法构建亲缘关系系统树[7]。
1.3.4 益生特性
1.3.4.1 人工胃肠液的耐受性
参照陈明等[8]的方法并略作修改,菌株培养16 h后,4 ℃、4 500 r/min离心,用0.01 mol/L的PBS(pH值7.2)缓冲液洗涤菌体2次,然后用1 mL PBS重悬菌体并混于9 mL的模拟胃液中37 ℃孵育0 h和2 h后取出0.1 mL培养液涂布于MRS培养基,再取胃液处理2 h的培养液1 mL重悬于9 mL的模拟肠液中并在3 h和8 h分别取样涂布MRS培养基计算活菌数,存活率按公式(1)、公式(2)计算:
胃液中存活率![]()
(1)
肠液中存活率![]()
(2)
式中:N0为胃液中0 h的活菌数;N1为胃液中2 h的活菌数;N2分别为肠液中3 h或8 h的活菌数,CFU/mL。
1.3.4.2 自聚性
自聚率参考杨振泉等[9]的方法并作修改,取调整浓度的菌悬液4 mL置于试管中室温静置分层,分别在静置1、3、5 h时吸取1 mL上层溶液测OD600nm值,分别记作OD1、OD3和OD5,每组重复3次。自聚率按公式(3)计算:
自聚率![]()
(3)
式中:ODo和ODt分别代表自凝聚前、后上层悬液的OD600nm值。
1.3.4.3 抗生素敏感性
采用K-药敏纸片琼脂扩散法[10]测定菌株对6种不同抗生素的药敏性。将活菌数稀释至1×108CFU/mL,取0.1 mL涂布于MRS培养基上,37 ℃培养24 h后测抑菌圈直径,根据韩慧玲等[11]的判定标准来测定并将结果以抗性(R)、中性(I)和敏感(S)表示。
1.3.4.4 抗氧化活性
按照参考文献[12]中的方法测定DPPH自由基清除率及参考文献[13]中的方法测定羟自由基清除率及参考文献[14]测定ABST阳离子自由基清除率。
1.4 数据分析与处理
本试验数据以3次重复的平均值±标准差表示,数据Excel软件进行整理和分析,用SPSS 21进行显著性分析,使用Origin 2021软件绘图。
2 结果与分析
2.1 乳酸菌筛选
2.1.1 产酸能力初筛
以泡菜专用发酵的商用菌株(CICC 6239)为标准,根据融钙圈、生理生化特性以及24 h后的总酸含量,本研究分别从4罐不同年份的泡椒老卤水中初分离出7株总酸含量高于商用菌株6239的产酸菌株,并将这些菌株作进一步研究。
2.1.2 耐辣椒素及耐盐复筛
将初筛出的7株菌进行不同辣椒素质量浓度耐受实验和耐盐实验。随着辣椒素质量浓度和盐质量浓度的增加,各菌株的存活率逐渐降低,其中1Y-17、1Y-35、1Y-42、6Y-15、6Y-23在4.4 g/L辣椒素浓度下活菌数均大于1×108CFU/mL(表1),当NaCl质量浓度为80 g/L时,只有1Y-17、1Y-35和6Y-15仍具有生长能力,其中1Y-35的耐辣椒素和耐盐能力最强。
表1 分离菌株在不同质量浓度辣椒素下的活菌数 单位:lgCFU/mL
Table 1 The number of viable strains isolated at different capsaicin mass concentrations
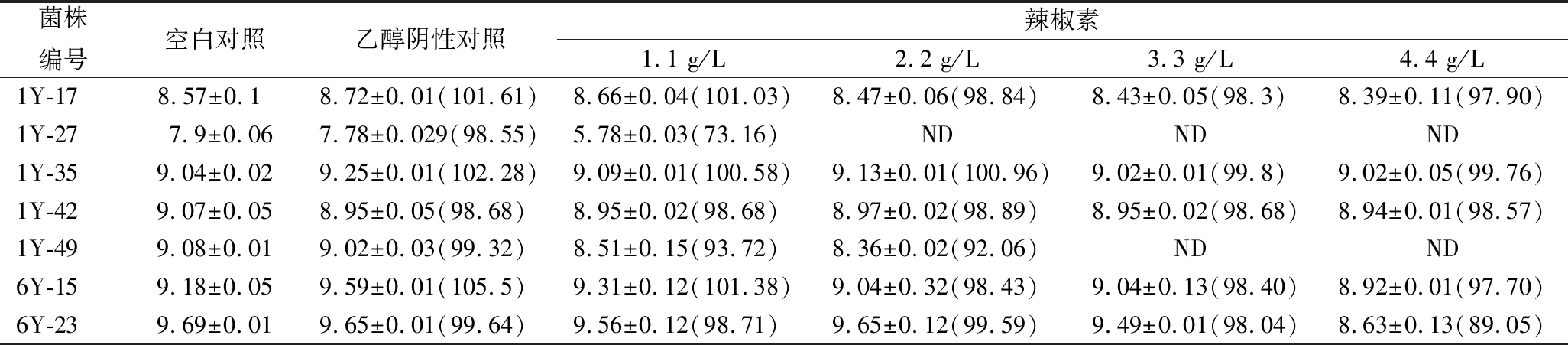
菌株编号空白对照乙醇阴性对照辣椒素1.1 g/L2.2 g/L3.3 g/L4.4 g/L1Y-178.57±0.1 8.72±0.01(101.61)8.66±0.04(101.03)8.47±0.06(98.84)8.43±0.05(98.3)8.39±0.11(97.90)1Y-27 7.9±0.067.78±0.029(98.55)5.78±0.03(73.16)NDNDND1Y-359.04±0.029.25±0.01(102.28)9.09±0.01(100.58)9.13±0.01(100.96)9.02±0.01(99.8)9.02±0.05(99.76)1Y-429.07±0.058.95±0.05(98.68)8.95±0.02(98.68)8.97±0.02(98.89)8.95±0.02(98.68)8.94±0.01(98.57)1Y-499.08±0.019.02±0.03(99.32)8.51±0.15(93.72)8.36±0.02(92.06)NDND6Y-159.18±0.059.59±0.01(105.5)9.31±0.12(101.38)9.04±0.32(98.43)9.04±0.13(98.40)8.92±0.01(97.70)6Y-239.69±0.019.65±0.01(99.64)9.56±0.12(98.71)9.65±0.12(99.59)9.49±0.01(98.04)8.63±0.13(89.05)
注:ND表示活菌数小于1×102 CFU/mL,括号内为相应处理条件下的存活率(%)。
2.1.3 泡椒的理化指标
2.1.3.1 感官评价
将以上筛出的3株乳酸菌和商用菌株6239进行泡椒发酵并做自然发酵对照,样品及感官评价图分别如图1和图2所示,3株自筛菌强化发酵泡椒的感官评价得分均高于商用菌株和自然发酵组,其中6Y-15整体评分最高,为51.5分,自然发酵组色泽氧化程度高于菌株强化发酵组。

a-自然发酵;b-6239;c-1Y-17;d-1Y-35;e-6Y-15
图1 不同菌株发酵泡椒的样品图
Fig.1 Sample diagram of fermented pickled chilli with different strains
注:6239商用菌株(下同)。

图2 泡椒发酵感官风味评价
Fig.2 Evaluation of sensory flavor of pickled chilli fermentation
2.1.3.2 总酸及亚硝酸盐含量
3株自筛菌、1株商用菌和自然发酵泡椒发酵15 d后的总酸及亚硝酸盐含量如图3所示,3株自筛菌发酵泡椒后总酸含量均高于商用菌株[(7.13±0.25) g/kg]和自然发酵组[(6.05±0.15) g/kg],其中1Y-17总酸含量最高,为[(9.07±0.17) g/kg]。菌株1Y-17、1Y-35和6Y-15强化发酵泡椒15 d后的亚硝酸含量均显著低于自然发酵[(4.18±0.25) mg/kg]和商用菌株发酵组[(2.82±0.15) mg/kg](P<0.05),分别为(2.21±0.15)、(1.76±0.24)、(2.06±0.20) mg/kg。
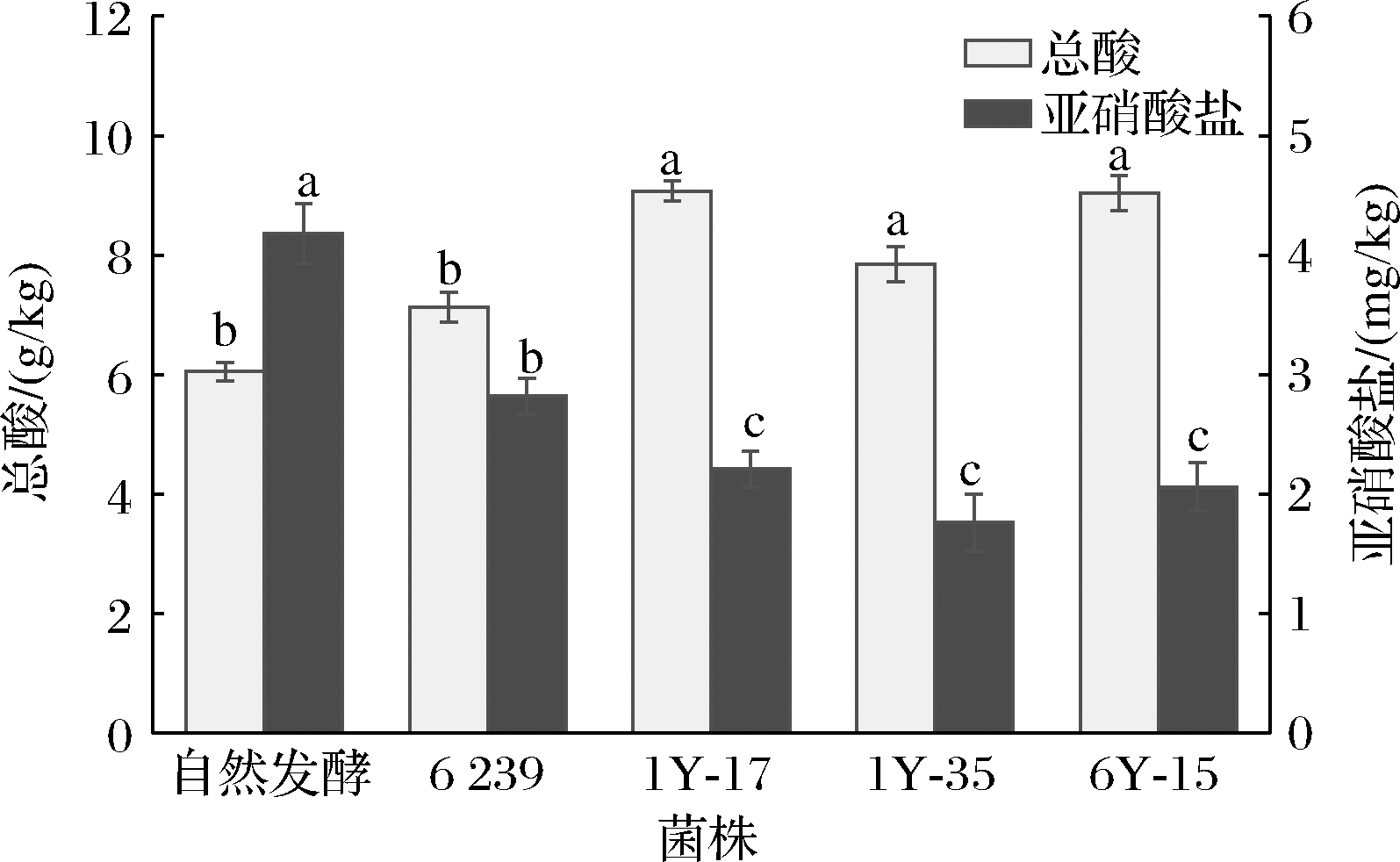
图3 不同处理组泡椒总酸及亚硝酸含量
Fig.3 Total acid and nitrite content of pickled chilli in different treatment groups
注:不同小写字母表示差异显著(P<0.05)。
2.2 菌株鉴定
2.2.1 形态学鉴定
对筛选出的3株菌进行菌落和菌体观察,3株菌的菌落均为白色圆形,单个、成对或成短链排列,其中菌株1Y-17菌落较大且表面黏稠;3株菌革兰氏染色均为阳性;电镜图显示3株菌的菌体均呈短杆状,其中6Y-15菌体表面相对粗糙(图4)。

a-菌落形态;b-光学显微镜下细胞形态;c-扫描电子显微镜下细胞形态
图4 菌株形态学特征
Fig.4 Morphologyical characteristic of strains
2.2.2 分子生物学鉴定
对3株菌进行16S rDNA 扩增测序并与GenBank数据库中已知序列构建亲缘关系树后(图5),发现菌株1Y-17、1Y-35、6Y-15与Lactobacillus plantarum NBRC 1589属于同一分支,从16S rDNA序列比对结果表明这3株菌均属于植物乳杆菌。

图5 分离菌株与相关种的系统发育树
Fig.5 The phylogenetic trees of isolated strains and other related species
2.3 益生性能评价
2.3.1 人工胃肠液耐受性
3株菌经过模拟胃液2 h处理后,所有菌株的活菌数均保持在1×108 CFU/mL以上,存活率在96%以上。经模拟胃液处理再转运至模拟肠液中8 h后,3株菌的活菌数均大于4×106 CFU/mL,说明这3株菌具有一定的人工胃肠液耐受性。
2.3.2 自聚性
通过测定3株菌株的自凝聚率反映其在肠道黏附和定植能力。在放置5 h时,菌株6Y-15的自凝聚率最高,达到51.58%,其次为1Y-17,为49.14%,1Y-35最低,仅为33.54%。
2.3.3 抗生素药敏性
通过对抗生素的敏感性评估菌株是否具有安全性。由图6可知,3株自筛菌对6种抗生素均敏感,其中1Y-35对红霉素最敏感,抑菌圈为(29.75±0.43) mm,6Y-15对氨苄西林最敏感,抑菌圈为(29±0.71) mm,3株菌对四环素的敏感性均较弱。

CFZ-头孢唑林;E-红霉素;P-青霉素;C-氯霉素;AMP-氨苄西林;TE-四环素
图6 菌株对不同抗生素敏感性试验
Fig.6 Susceptibility test of bacterial strains to different antibiotics
2.3.4 体外抗氧化活性
通过测定自由基清除率评估3株菌的抗氧化能力。由表2可知,菌株6Y-15的DPPH自由基清除率和羟自由基清除率最高,分别为42.69%和65.78%,而1Y-17对ABST阳离子自由基清除率最高,为69.72%(P<0.05)。
表2 不同菌株发酵液的抗氧化活性
Table 2 Antioxidant activity of fermentation broth from different strains
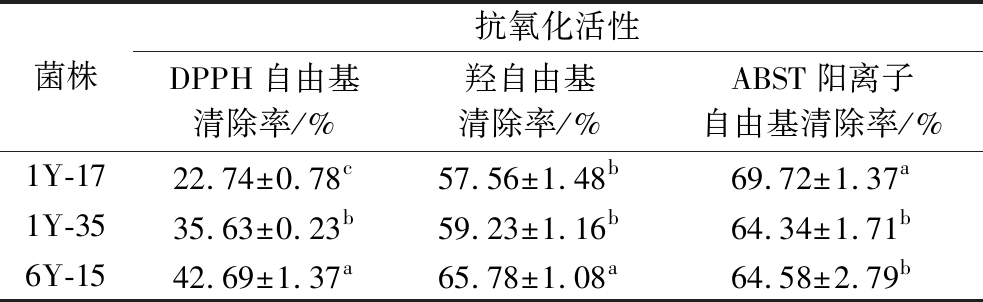
菌株抗氧化活性DPPH自由基清除率/%羟自由基清除率/%ABST阳离子自由基清除率/%1Y-1722.74±0.78c57.56±1.48b69.72±1.37a1Y-3535.63±0.23b59.23±1.16b64.34±1.71b6Y-1542.69±1.37a65.78±1.08a64.58±2.79b
注:不同的小写字母代表每列数据之间差异显著(P<0.05)。
3 结论与讨论
本研究从四川不同地区农家自制泡椒老卤水中分离筛选出产酸强、耐辣椒素及耐盐强的3株植物乳杆菌,将这3株菌用作强化发酵制作泡椒后,相比于自然发酵和商业菌株发酵,色泽及口感更好,总酸产量高,亚硝酸盐含量低。分离的3株菌还具有一定的耐人工胃肠液能力、自聚性且对多种抗生素敏感,其中菌株6Y-15的DPPH自由基和羟自由基清除能力显著,而菌株1Y-17的ABST阳离子自由基清除能力强。研究结果表明分离的3株植物乳杆菌可作为泡椒强化发酵的候选菌株。
已有研究显示泡椒、泡菜、酸菜均是以乳酸菌为主导发酵而成,在发酵时人工添加具有优异发酵特性的乳酸菌进行强化发酵取代自然发酵,可以使发酵过程中细菌群落结构更加稳定,更易实现工业化生产中品质把控[15-16]。考虑到年代久远的泡椒液中菌群更稳定,更有代表性,所以本研究选择从民间泡椒老卤水中进行菌株的分离。老卤水由于被反复使用,一般辣度和含盐量均较高,有研究发现辣椒素和食盐对乳酸菌的生长有明显抑制作用[17]。本研究分离出的3株乳杆菌不仅产酸水平高且具有一定耐辣椒素和耐盐特性,表明分离的菌株中存在一定的抗逆机制来适应辣度和高盐度体系。汪姣玲等[18]报道称以多叶、多茎蔬菜为主要原料的泡菜中产酸快的主要是肠膜明串珠菌,而本研究筛选到的3株优势菌均为植物乳杆菌,推测可能是因为肠膜明串珠菌相对植物乳杆菌对辣椒素不耐受,所以泡椒中产酸强的乳酸菌以植物乳杆菌为主[19]。研究结果提示以纯辣椒为主要原料发酵的泡椒,其菌群存在一定的特异性,在泡椒工业生产中应合理运用。对筛选出的菌株进行小试发酵泡椒后,风味优于商用菌株发酵组和自然发酵组,吴凯等[20]研究发现高盐浓度腌渍的辣椒挥发性成分较多且香气成分高,因此推测在高辣高盐环境中相关微生物代谢活动更为活跃,产生的有机酸种类和挥发性风味物质更多,带来的口感和滋味更丰富。
本研究筛选到的3株乳杆菌均显示出一定的益生特性,如对人工胃肠液的耐受性、自聚性、药敏性及抗氧活性。DI CAGNO等[21]报道了从菠萝中筛选出的乳酸菌应用于菠萝发酵后,与同属外来菌株相比,抗氧化活性最高;张婷等[22]研究发现,辣椒中的辣椒素质量浓度与其抗氧化活性呈正相关,本研究筛到的菌株6Y-15的抗氧活性比杨旭洲等[23]筛选出的最高抗氧活性菌株Z12高出1.24%,这表明从泡椒卤水中筛选出的乳酸菌株在辣椒刺激下具有较高的抗氧活性,结论可以为进一步研究发酵泡椒中的辣椒素与乳酸菌的生化代谢关系提供更多科学依据。综上所述,菌株1Y-17、1Y-35和6Y-15的发酵性能优良对高辣度高盐环境具有一定适应性,可作为工业生产泡椒时进行强化发酵的候选菌株,具有广阔的应用前景。
[1] 王思轩, 付雪, 朱雪梅, 等.乳酸菌发酵果蔬研究进展[J].乳业科学与技术, 2020, 43(2):56-59.
WANG S X, FU X, ZHU X M, et al.Recent progress in Lactobacillus-fermented fruits and vegetables[J].Journal of Dairy Science and Technology, 2020, 43(2):56-59.
[2] 徐园园, 李静, 王敏, 等.自然发酵三樱椒中乳酸菌的分离及鉴定[J].中国酿造, 2022, 41(4):147-151.
XU Y Y, LI J, WANG M, et al.Isolation and identification of lactic acid bacteria from naturally fermented Capsicum annuum[J].China Brewing, 2022, 41(4):147-151.
[3] 曾维友, 周於强, 池浩.泡菜中乳酸菌的分离鉴定及抗性筛选[J].中国酿造, 2021, 40(10):163-167.
ZENG W Y, ZHOU Y Q, CHI H.Isolation, identification and resistance screening of lactic acid bacteria in Paocai[J].China Brewing, 2021, 40(10):163-167.
[4] 王梦, 赵佩霞, 张鹏, 等.辣椒碱单体、二氢辣椒碱单体和降二氢辣椒碱单体抑菌效果研究[J].北京化工大学学报(自然科学版), 2019, 46(3):61-65.
WANG M, ZHAO P X, ZHANG P, et al.Comparison of antibacterial effects of capsaicin monomer, dihydrocapsaicin monomer and nordihydrocapsaicin monomer[J].Journal of Beijing University of Chemical Technology(Natural Science Edition), 2019, 46(3):61-65.
[5] 张楠笛, 祝林, 许琴, 等.食窦魏斯氏菌协同植物乳杆菌改善四川泡菜风味[J].食品科学, 2020, 41(14):102-108.
ZHANG N D, ZHU L, XU Q, et al.Improvement of the flavor of Sichuan pickle by co-fermentation with Weissella cibaria and Lactobacillus plantarum[J].Food Science, 2020, 41(14):102-108.
[6] 张汝京, 胡亚凡, 海丹, 等.具有抑制肠道致病菌和黏附Caco-2细胞作用的益生性乳酸菌的筛选及鉴定[J].食品工业科技, 2019, 40(20):133-139;153.
ZHANG R J, HU Y F, HAI D, et al.Screening and identification of probiotic Lactobacillus strains inhibiting intestinal pathogens and adhering to Caco-2 cells[J].Science and Technology of Food Industry, 2019, 40(20):133-139;153.
[7] 赵翊, 王艳, 肖积兰, 等.甘肃省益母草斑枯病病原鉴定[J].中药材, 2017, 40(1):29-31.
ZHAO Y, WANG Y, XIAO J L, et al.Identification of pathogen of of motherwort leaf blight in Gansu province[J].Journal of Chinese Medicinal Materials, 2017, 40(1):29-31.
[8] 陈明, 柯文灿, 张娟, 等.青藏高原牦牛酸奶中具有抗氧化活性乳酸菌的体内外益生特性[J].食品科学, 2017, 38(23):178-183.
CHEN M, KE W C, ZHANG J, et al.Probiotic properties in vitro and in vivo of antioxidative lactic acid bacteria from yak yogurt in Tibetan Plateau[J].Food Science, 2017, 38(23):178-183.
[9] 杨振泉, 靳彩娟, 张咪, 等.高粘附性戊糖片球菌的筛选、标记及其表面疏水与自凝聚性特征[J].食品与生物技术学报, 2015, 34(9):926-934.
YANG Z Q, JIN C J, ZHANG M, et al. Screening, labeling and surface hydrophobicity and self-agglutination of Pediococcus pentosaceus with high adhesion[J]. Journal of Food Science and Biotechnology, 2015, 34(9): 926-934.
[10] 党乔, 孔令聪, 刘洁, 等.泡菜发酵乳酸菌的分离鉴定及耐药性分析[J].食品科学, 2019, 40(20):166-170.
DANG Q, KONG L C, LIU J, et al.Isolation, identification and antimicrobial resistance analysis of lactic acid bacteria from kimchi[J].Food Science, 2019, 40(20):166-170.
[11] 韩慧玲, 李华, 包振江, 等.内蒙古传统发酵乳制品中乳酸菌的分离及其耐药性研究[J].中国酿造, 2022, 41(2):40-47.
HAN H L, LI H, BAO Z J, et al.Isolation and drug resistance of lactic acid bacteria from traditional fermented dairy products in Inner Mongolia[J].China Brewing, 2022, 41(2):40-47.
[12] 李晓军, 马跃英, 龚虹, 等.具高抗氧化能力乳酸菌菌株的筛选与鉴定[J].中国微生态学杂志, 2018, 30(6):663-666.
LI X J, MA Y Y, GONG H, et al.Screening and identification of lactic acid bacteria with high antioxidant capacity[J].Chinese Journal of Microecology, 2018, 30(6):663-666.
[13] 陈漪汶, 方若楠, 朱剑锋, 等.5 种乳酸菌及其灭活态体外抗氧化能力的比较研究[J].食品工业科技, 2019, 40(11):85-90, 97.
CHEN Y W, FANG R N, ZHU J F, et al.Comparative studies on antioxidant activity in vitro of five species of active and inactived lactic acid bacteria[J].Science and Technology of Food Industry, 2019, 40(11):85-90, 97.
[14] SLAVOVA-KAZAKOVA A, JANIAK M A, SULEWSKA K, et al.Synergistic, additive, and antagonistic antioxidant effects in the mixtures of curcumin with(-)-epicatechin and with a green tea fraction containing (-)-epicatechin[J].Food Chemistry, 2021, 360:129994.
[15] 熊蝶, 袁岚玉, 李媛媛, 等.陕西泡菜中降解亚硝酸盐乳酸菌的筛选及其发酵特性与耐受性研究[J].食品与发酵工业, 2021, 47(6):139-144.
XIONG D, YUAN L Y, LI Y Y, et al.Screening, fermentation characteristics and tolerance of nitrite-degrading lactic acid bacteria in Shaanxi Paocai[J].Food and Fermentation Industries, 2021, 47(6):139-144.
[16] 邓维琴, 伍亚龙, 陈功, 等.多代发酵泡菜母水微生物多样性及其理化指标动态研究[J].食品与发酵工业, 2018, 44(8):49-56.
DENG W Q, WU Y L, CHEN G, et al.Study on microbial diversity and physiochemical index of multi-generational fermented Paocai brine[J].Food and Fermentation Industries, 2018, 44(8):49-56.
[17] 刘嘉, 蒋芳芳, 范琳, 等.辣椒素对辣椒发酵中乳酸菌的影响[J].食品科学, 2012, 33(3):190-193.
LIU J, JIANG F F, FAN L, et al.Effect of capsaicinoid on the growth of lactic acid bacteria during fermentation of chili pepper[J].Food Science, 2012, 33(3):190-193.
[18] 汪姣玲, 李加兴, 岳元媛. 植物乳杆菌和肠膜明串珠菌混合发酵泡萝卜的工艺优化[J]. 食品工业科技, 2023, 44(3): 172-182.
WANG J L, LI J X, YUE Y Y. Optimization of mixed fermentation of Lactobacillus plantarum and Leuconostoc mesenteroides for pickled radish[J]. Science and Technology of Food Industry, 2023, 44(3): 172-182.
[19] 沙漠, 逄焕明, 古丽娜孜, 等.自然发酵辣椒酱中乳酸菌的分离与鉴定[J].食品与机械, 2012, 28(1):35-37;143.
SHA M, PANG H M, GU L, et al.Isolation and identification of lactic acid bacteria from natural fermentation peppers[J].Food and Machinery, 2012, 28(1):35-37;143.
[20] 吴凯, 覃业优, 蒋立文, 等.不同质量分数食盐腌渍艳红辣椒的风味物质分析[J].食品科学, 2021, 42(24):175-182.
WU K, QIN Y Y, JIANG L W, et al.Analysis of flavor substances in pickled peppers(Capsicum annuum L.cv.Yanhong)with different salt contents[J].Food Science, 2021, 42(24):175-182.
[21] DI CAGNO R, CODA R, DE ANGELIS M, et al.Exploitation of vegetables and fruits through lactic acid fermentation[J].Food Microbiology, 2013, 33(1):1-10.
[22] 张婷, 王玮媛, 彭澳, 等. 辣椒素和辣椒水提物的抗氧化特性及对人粪便微生物体外培养特性的影响[J]. 食品工业科技, 2023, 44(6): 146-154.
ZHANG T, WANG W Y, PENG A, et al. Antioxidant properties of capsaicin and capsicum aqueous extracts and their effects on the culture characteristics of human fecal microorganisms in vitro[J]. Science and Technology of Food Industry, 2023, 44(6):146-154.
[23] 杨旭洲, 陈佩瑶, 张富新. 抗氧化乳酸菌的筛选及其益生特性评价[J]. 食品与发酵工业, 2023, 49(10): 17-23.
YANG X Z, CHEN P Y, ZHANG F X. Screening of antioxidant lactic acid bacteria and evaluation of their probiotic properties[J]. Food and Fermentation Industries, 2023, 49(10): 17-23.