大鲵为我国特有的两栖动物,具有丰富的营养价值和药用价值[1]。大鲵肉富含优质蛋白,必需氨基酸含量高,不饱和脂肪酸含量高,通过酶解后的大鲵肽具有抗氧化、免疫调节的功能[2],具有较大开发利用潜力。活性氧能够攻击蛋白质,致使细胞膜脂质过氧化,使蛋白质交联变性、酶活性丧失、细胞老化甚至死亡[3]。D-半乳糖(D-galactosidase,D-gal)能够导致氧化应激,进而导致表观上和生理上的退行性衰老。近年来,开发具有抗衰老作用的多肽类物质成为研究热点。ZHANG等[4]对D-半乳糖诱导的衰老小鼠分别灌胃Na2SeO3、SeMet、大豆肽和含硒大豆肽,发现含硒大豆肽可以提高小鼠肝脏超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶-1(glutathione peroxidase, GSH-Px)的活力,降低天冬氨酸转氨酶、谷丙转氨酶和核因子(nuclear factor kappa-B,NF-κB)含量,可通过调节丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/NF-κB通路抑制脑的氧化应激,且含硒肽在抗氧化活性方面优于其他硒补充剂。YU等[5]采用D-半乳糖诱导建立衰老大鼠模型,通过灌胃大鼠堇叶碎米荠富硒肽,发现富硒肽可增加衰老大鼠血清中的SOD、GSH-Px、过氧化氢酶(catalase, CAT)、总抗氧化能力(total antioxidant capacity, T-AOC),降低活性氧(reactive oxigen species, ROS)和丙二醛(malondialdehyde, MDA)水平,并激活Nrf2(调控抗氧化应激的一种关键转录因子)/血红素氧合酶1(heme oxygenase-1,HO-1)/醌氧化还原酶1(quinone oxidoreductase 1,QO1)通路,抑制衰老大鼠NF-κB通路来减轻神经炎症。ZHU等[6]通过分离纯化获得堇叶碎米荠富硒肽,并利用堇叶碎米荠富硒肽灌胃D-半乳糖诱导氧化应激损伤小鼠,研究结果发现堇叶碎米荠富硒肽可提高小鼠血清和心脏、肝脏组织中的抗氧化酶活力,降低MDA和蛋白质羰基含量。
课题组前期优化制备了大鲵肽-硒螯合物,并比较了多肽和肽硒螯合物的结构特征和抗氧化活性[7],发现大鲵肽-硒螯合物具有更强的体外抗氧化活性。已有研究报道了大鲵肽对D-半乳糖致小鼠机体氧化损伤的修复作用[8],然而有关大鲵肽-硒螯合物的体内抗氧化活性,尚未见报道。为此,本研究通过D-半乳糖诱导建立小鼠氧化应激损伤模型,探究大鲵肽硒螯合物对氧化损伤小鼠不同组织抗氧化指标的影响,旨在为大鲵活性肽高值产品开发提供理论和技术参考。
1 材料与方法
1.1 材料与试剂
冻干大鲵肽(giant salamander peptides, GSP)(分子质量低于3 000 Da)和大鲵肽-硒螯合物(giant salamander peptide-selenium chelate, Se-GSP),由陕西省资源生物重点实验室提供,制备方法和部分性质详见文献[7]。昆明种小鼠[CKX(陕)2018-001],由西安交通大学医学部实验动物中心提供。
亚硒酸钠,天津市大茂化学试剂厂;D-半乳糖,上海麦克林生化科技有限公司;BCA试剂盒、T-SOD试剂盒、MDA试剂盒、GSH-Px试剂盒、T-AOC试剂盒、GSH试剂盒、蛋白质羰基测试盒,南京建成生物工程研究所;4%多聚甲醛,阿拉丁公司;二甲苯,国药集团化学试剂有限公司;石蜡切片,上海华灵康复器械厂。
1.2 仪器与设备
Evolution 201紫外-可见分光光度计,赛默飞世尔科技公司;Spectra Max M3 全波长多功能酶标仪,美国Molecular Devices公司;DSX-18L高压蒸汽灭菌锅,上海博讯医疗生物仪器有限公司;F10高速匀浆机,天津恒奥科技发展有限公司;Allegra X-30R型离心机,Beckman coulter有限公司;HistoCore Arcadia生物组织包埋机、RM2015组织摊片机、HistoCore AUTOCUT 切片机、DM3000光学显微镜,德国Leica公司。
1.3 实验方法
1.3.1 模型建立及分组给药
取6周龄,体重18~22 g的雄性昆明小鼠,在温度(22±2) ℃,相对湿度50%~70%,12 h光照周期的条件进行适应性喂养,期间自由饮食饮水,每天同一时间段测定体重,观察小鼠的活动并记录。适应性喂养1周后,采用随机抽样的方法,将小鼠分为8组,每组10只,分别是正常对照组(Normal)、模型对照组(Model)、阳性对照组(AA)、大鲵肽低剂量组(GSP-L)、大鲵肽高剂量组(GSP-H)、大鲵肽-硒螯合物低剂量组(Se-GSP-L)、大鲵肽-硒螯合物高剂量组(Se-GSP-H)、亚硒酸钠组(Na2SeO3)。除正常对照组外,对其余7组小鼠进行腹腔注射600 mg/(kg·bw)D-半乳糖构建氧化应激损伤模型。正常对照组小鼠腹腔注射等体积的生理盐水,每日一次,持续注射9周。建模4周后,7个试验组分别给予对应的干预,分组及给药情况见图1。其中正常对照组小鼠给予L-抗坏血酸(L-ascorbicacid,AA)100 mg/(kg·bw)[8],GSP的低剂量和高剂量分别为100 mg/(kg·bw)、400 mg/(kg·bw)[9],Se-GSP的低剂量组和亚硒酸钠剂量组是根据《中国居民膳食指南》中的硒每日推荐摄入量60 μg/d换算而得。连续灌胃4周,每天根据每只小鼠的体重进而调整灌胃体积。本研究中相关动物实验内容符合实验动物伦理委员会的基本要求并经过审批(批准号:DLPU2022103)。
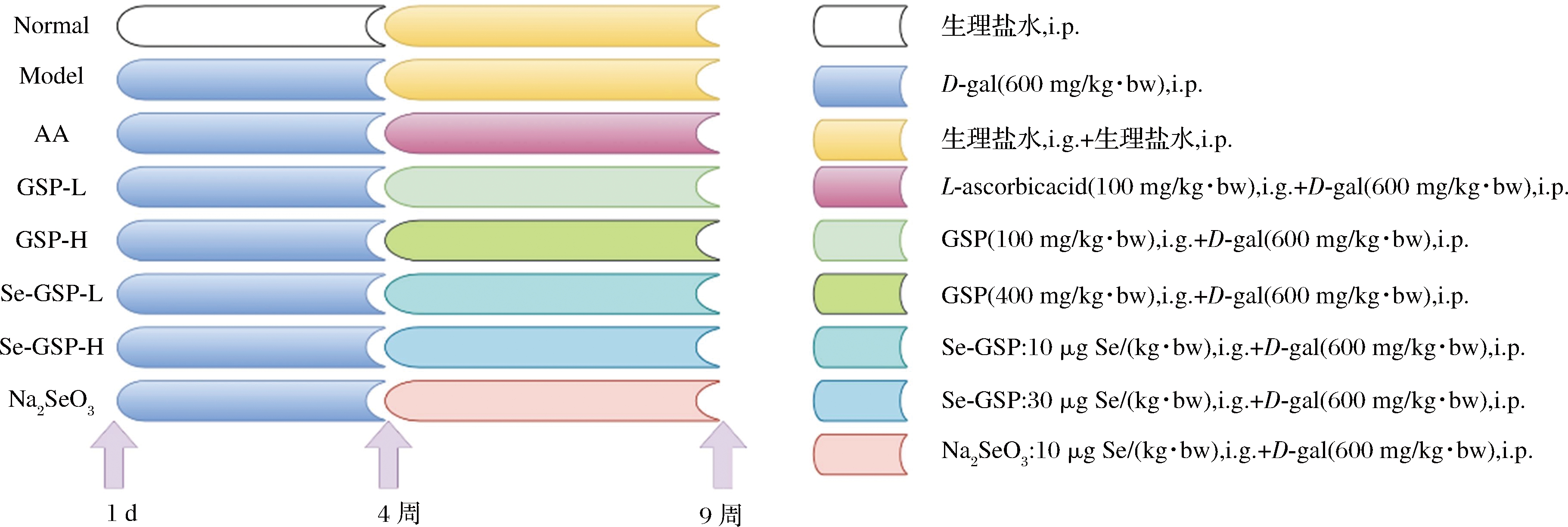
图1 各组小鼠分组、建模及给药情况
Fig.1 Classification, modelling, and administration of mice in each group
1.3.2 体重和脏器指数的测定
观察小鼠的外观和形态变化,定期检测并记录小鼠的体重,并对小鼠的体重变化进行分析。试验结束后,用乙醚致小鼠昏迷,眼球取血,取血后将小鼠脱臼处死。解剖小鼠并取出小鼠的肝脏、心脏、脾脏、肾脏、胸腺等组织器官,用预冷的生理盐水冲洗,滤纸吸干水分,对其进行称重并计算脏器指数。组织称重结束后,将不同的器官分开存放于-80 ℃冰箱中保存备用。脏器指数的计算如公式(1)所示:
脏器指数![]()
1.3.3 血清及组织匀浆的制备
试验结束后,小鼠乙醚麻醉后进行眼球取血,将收集的血液在37 ℃条件下静置1 h,后在4 ℃冰箱中放置12 h,2 500 r/min条件下离心10 min,用移液器吸取上层液体,获取血清样本,将各组小鼠血清进行抗氧化指标的检测。
准确称取组织,用预冷的生理盐水对组织进行漂洗,滤纸擦干,称重,用剪刀将组织剪碎后放入高速匀浆器中,加入9倍体积(料液比)预冷的生理盐水,在冰水浴条件下充分匀浆,并将匀浆于4 ℃,3 000 r/min的条件下离心10 min,取上清液备用。
1.3.4 抗氧化指标测定
根据ELISA试剂盒说明书,测定各组小鼠的血清、肝、脑、心脏中T-AOC活力、SOD活力、GSH活力、GSH-Px活力、MDA含量、蛋白质羰基含量;其中肝、脑、心脏组织的总蛋白含量均按照试剂盒说明书测定。
1.3.5 组织器官病理学观察
将小鼠解剖后,取小鼠脑组织、肝组织固定,石蜡包埋切片进行苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,按照以下步骤操作,光学显微镜下观察组织的病理学形态并记录:
1.4 数据分析
每个试验重复3次,取平均值。利用SPSS 26.0 统计分析软件对试验数据进行t检验、单因素方差分析和邓肯多重比较,以P<0.05表示差异显著,使用Origin 2021和GraphPad Prism 9软件绘图。
2 结果与分析
2.1 Se-GSP对D-半乳糖诱导氧化损伤小鼠体重、脏器指数影响
通过颈背部皮下注射和腹腔注射D-半乳糖是目前公认的构建氧化应激损伤模型的方法之一[10],半乳糖在醛糖还原酶的催化下,可还原为半乳糖醇,造成线粒体老化、自由基损伤、非酶糖基化反应和免疫功能障碍等问题[11]。连续4周腹腔注射600 mg/(kg·bw)的D-半乳糖后,小鼠毛色变得没有光泽,毛发易脱落,行动迟缓,消瘦,易倦怠,体重增加缓慢,出现明显的衰老体征。小鼠的体重变化是反映机体生长发育的一个重要指标,试验期间各组小鼠平均体重呈缓慢增加趋势。图2为建模期间和建模后小鼠体重变化,氧化损伤模型形成初期,各组小鼠体重基本一致,组间无显著差异(P>0.05)。建模期间各组小鼠平均体重逐渐增加,最后模型组小鼠体重极显著低于正常对照组小鼠(P<0.01),表明建模成功。通过灌胃5周的受试物,导致小鼠体重增加。其中空白对照组、模型对照组以及阳性对照组小鼠体重增量分别为(17.28±1.72) g,(10.5±0.83) g和(15.48±2.14) g。空白对照组和阳性对照组小鼠体重增量显著高于模型对照组(P<0.05)。但Se-GSP-L组、Se-GSP-H组和亚硒酸钠组小鼠的体重增量与模型对照组无显著差异(P>0.05)。阳性对照组、Se-GSP-L和Se-GSP-H组小鼠体重分别为(43.86±3.73) g、(42.7±4.11) g和(42.86±6.14) g,与模型组小鼠体重(40.62±2.29) g相比显著增加(P<0.05)。GSP-L和GSP-H组小鼠体重与模型组相比显著增加(P<0.05)。灌胃亚硒酸钠小鼠体重为(41.57±0.35) g与模型组小鼠体重无明显差异(P>0.05),说明灌胃GSP、Se-GSP可以提高氧化应激损伤小鼠的体重,低剂量的GSP、Se-GSP具有促进衰老小鼠恢复生长的作用。关百婷等[9]

A-体重变化;B-体重增量
图2 不同受试物对小鼠的影响
Fig.2 Effect of different subjects of mice
注:同一指标上标注字母不同表示差异显著(P<0.05),下同。
报道的灌胃大鲵活性肽能显著增加D-半乳糖衰老小鼠体重,大鲵活性肽的低、中、高剂量组小鼠体重均高于模型组,并十分接近正常对照组小鼠的体重。
脏器指数可以间接揭示动物体内因氧化作用而导致的损伤程度,脾脏和胸腺在机体中有着重要的免疫功能,其体积的减小可表明机体存在一定程度上的衰老[12]。各组SPF级雄性昆明小鼠灌胃相应受试物5周后,其脏器指数变化如图3所示。正常对照组的心脏指数、肝脏指数、肾脏指数、脾脏指数以及胸腺指数分别为(8.89±4.14)%、(41.30±6.93)%、(17.68±7.29)%、(5.12±0.96)%、(2.51±0.39)%。模型对照组的心脏指数、肝脏指数、肾脏指数、脾脏指数和胸腺指数分别为(6.50±1.59)%、(49.47±8.44)%、(16.04±1.41)%、(3.52±0.43)%和(1.92±0.23)%。阳性对照组的心脏指数、肝脏指数、肾脏指数、脾脏指数以及胸腺指数分别为(8.44±1.50)%、(43.27±5.05)%、(18.05±2.98)%、(5.04±1.43)%和(2.20±0.73)%。正常对照组的各脏器指数与模型对照组的脏器指数均具有显著性差异(P<0.05),表明小鼠氧化应激损伤模型建立成功。阳性对照组所有脏器指数均与空白对照组无显著差异(P>0.05)。亚硒酸钠组小鼠的脏器指数除心脏指数外,其他脏器显著高于模型组(P<0.05)(图3)。GSP-L组、GSP-H组、Se-GSP-L组和Se-GSP-H组小鼠的心脏、肝脏、肾脏、脾脏和胸腺指数介于模型对照组与空白对照组之间。以上结果表明,GSP和Se-GSP均可在一定程度上减轻器官的萎缩,这与关百婷等[9]研究结果相符。
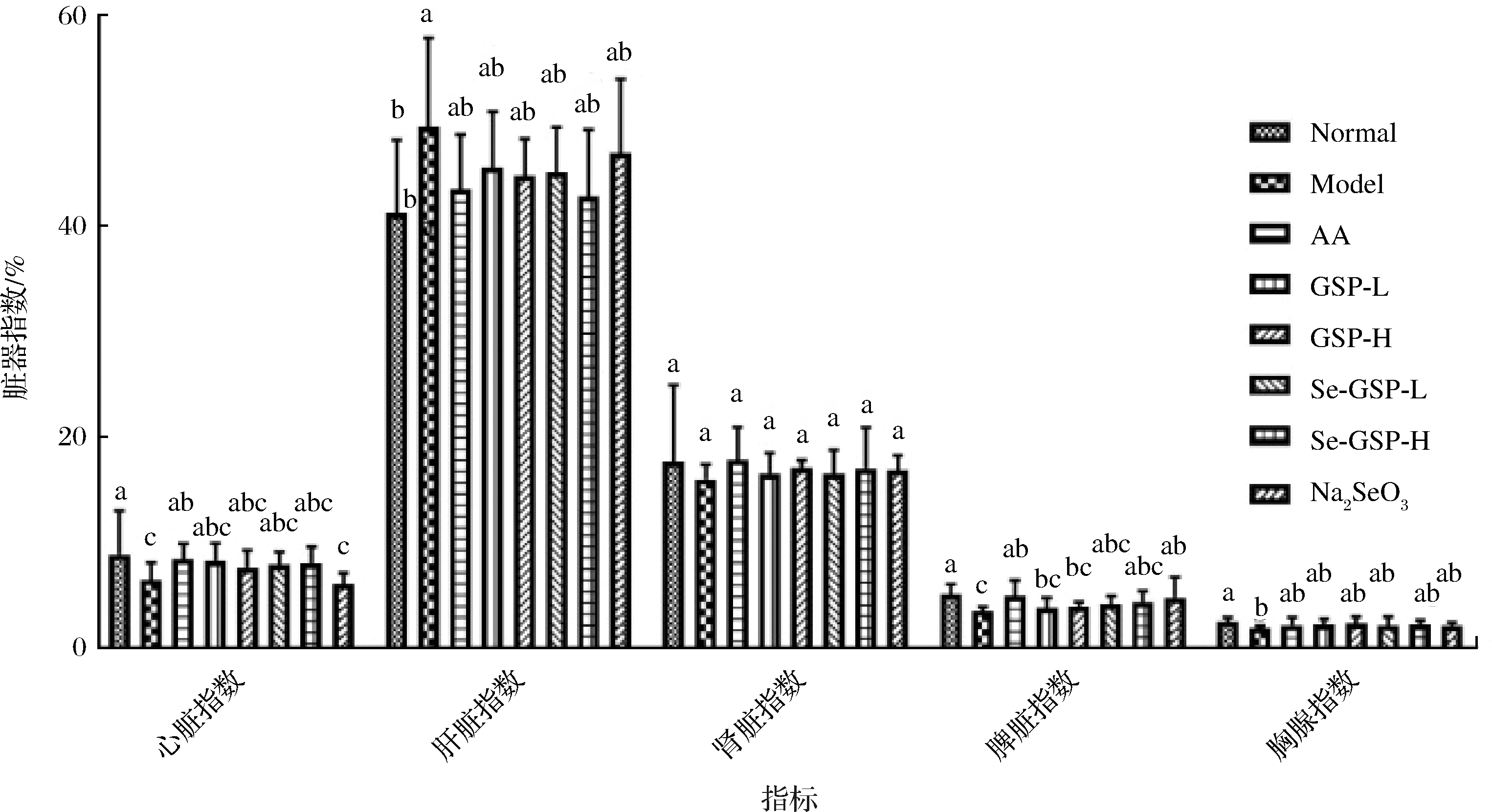
图3 不同剂量组对小鼠器官指数的影响
Fig.3 Effects of different dose groups on mouse organ index
2.2 Se-GSP对D-半乳糖诱导氧化损伤小鼠血清中抗氧化指标的影响
当D-半乳糖浓度过高时,在半乳糖氧化酶的作用下,D-半乳糖会转变为醛糖、氢过氧化物,进而生成超氧阴离子自由基和氧衍生自由基[13]。另一方面,D-半乳糖与游离氨基酸发生反应形成糖基化终产物,促进活性氧的产生,降低线粒体呼吸链复合物的活性并引起氧化应激损伤[14]。大量研究表明,抗氧化活性在机体衰老过程中有着至关重要的作用,机体内存在清除自由基的防御系统,其中包括SOD、GSH-Px等抗氧化酶系[15]。T-AOC代表机体内酶类抗氧化物质、非酶类抗氧化物质的综合[16],可反映出体系的各种抗氧化大分子、小分子和酶的总体水平。SOD是机体内一种有重要作用的抗氧化酶,能够有效清除超氧阴离子自由基并将其歧化为水和氧气,降低MDA和自由基代谢产物的产生[17]。GSH是机体内重要的非酶抗氧化物质,具有清除超氧阴离子自由基和过氧化氢、维持脱氧核糖核苷酸的生物合成以及维持细胞的正常发育等生理功能[18]。GSH-Px能特异地催化GSH还原过氧化物的还原反应,可阻断过氧化物引发的自由基对机体的损害[15]。MDA是机体内自由基产生脂质过氧化的产物,常被作为评价衰老的指标之一[19],其含量随着衰老而增加[20]。蛋白质的氧化损伤程度可由蛋白质羰基含量来表达,过氧化氢和超氧阴离子自由基对蛋白质氨基酸侧链的氧化可进一步导致羰基产物的累积,其含量随着年龄的增长而增加。
不同受试物对小鼠血清中SOD活力、GSH-Px活力、T-AOC含量、GSH含量、MDA含量和蛋白质羰基含量的影响见表1。
表1 GSP和Se-GSP对小鼠血清中抗氧化指标的影响
Table 1 Effects of GSP and Se-GSP on antioxidant indexes in mouse serum
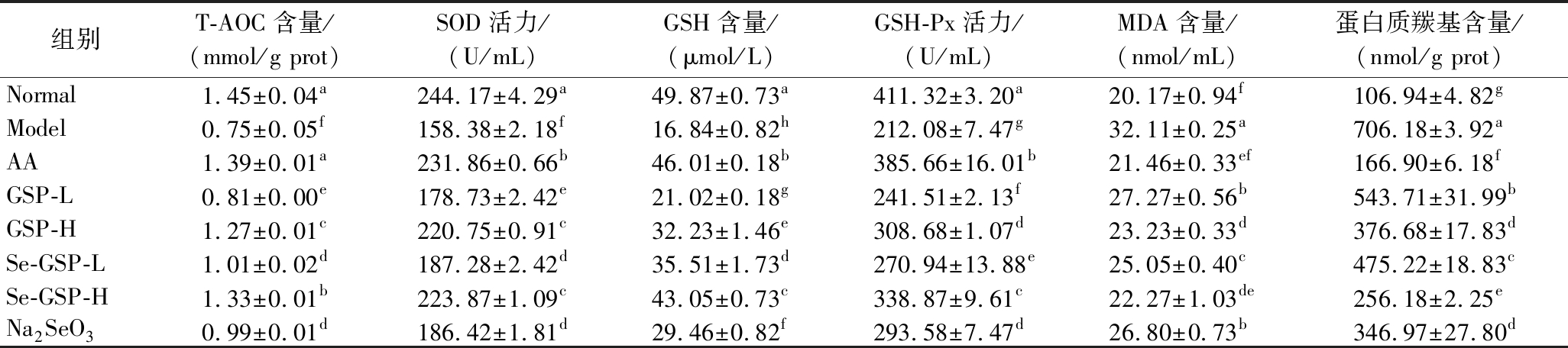
组别T-AOC含量/(mmol/g prot)SOD活力/(U/mL)GSH含量/(μmol/L)GSH-Px活力/(U/mL)MDA含量/(nmol/mL)蛋白质羰基含量/(nmol/g prot)Normal1.45±0.04a244.17±4.29a49.87±0.73a411.32±3.20a20.17±0.94f106.94±4.82gModel0.75±0.05f158.38±2.18f16.84±0.82h212.08±7.47g32.11±0.25a706.18±3.92aAA1.39±0.01a231.86±0.66b46.01±0.18b385.66±16.01b21.46±0.33ef166.90±6.18fGSP-L0.81±0.00e178.73±2.42e21.02±0.18g241.51±2.13f27.27±0.56b543.71±31.99bGSP-H1.27±0.01c220.75±0.91c32.23±1.46e308.68±1.07d23.23±0.33d376.68±17.83dSe-GSP-L1.01±0.02d187.28±2.42d35.51±1.73d270.94±13.88e25.05±0.40c475.22±18.83cSe-GSP-H1.33±0.01b223.87±1.09c43.05±0.73c338.87±9.61c22.27±1.03de256.18±2.25eNa2SeO30.99±0.01d186.42±1.81d29.46±0.82f293.58±7.47d26.80±0.73b346.97±27.80d
注:同一列上标注字母不同表示差异显著(P<0.05),下同。
由表1可知,与正常对照组相比,模型对照组血清中SOD活力、GSH-Px活力、GSH含量和T-AOC含量显著降低(P<0.05),而MDA和蛋白质羰基含量显著升高(P<0.05),说明建模成功。正常对照组小鼠血清中T-AOC和MDA含量与阳性对照组无显著差异(P>0.05),SOD活力、GSH-Px活力、GSH含量和蛋白质羰基含量与阳性对照组有显著差异(P<0.05)。与模型对照组相比,GSP-L小鼠血清中的T-AOC含量、SOD活力、GSH含量、GSH-Px活力以及MDA、蛋白质羰基含量均有显著差异(P<0.05)。与模型组相比,Se-GSP-L组小鼠血清中的SOD、GSH-Px活力和GSH、T-AOC含量显著升高(P<0.05),MDA、蛋白质羰基含量均显著降低(P<0.05),随着剂量的增加,各指标与模型对照组差异逐渐增大。与阳性对照组相比,Se-GSP-H组小鼠血清中SOD活力、GSH-Px活力、GSH含量、T-AOC含量及MDA、蛋白质羰基含量与模型相比均有显著差异(P<0.05)。Se-GSP-H组小鼠中T-AOC含量、SOD活力和GSH-Px活力较模型对照组分别提高了77.33%、41.35%和59.78%;MDA和蛋白质羰基含量较模型对照组分别降低了30.64%和63.72%。灌胃亚硒酸钠的小鼠血清中T-AOC含量、SOD活力、GSH含量、GSH-Px活力及MDA、蛋白质羰基含量与模型相比均有显著差异(P<0.05)。说明低、高剂量的GSP、Se-GSP均可以提高体内抗氧化酶类和非酶类的活性。关百婷等[9]采用D-半乳糖构建衰老小鼠模型,与正常对照组相比,衰老模型小鼠血清中的MDA含量极显著上升,SOD活力和T-AOC含量极显著降低,灌胃大鲵活性肽后小鼠血清中MDA含量极显著降低,SOD活力和T-AOC含量显著升高。蔡佳佳等[21]用大鲵肉喂养D-半乳糖诱发亚急性衰老小鼠8周,与模型组相比,大鲵肉各剂量组小鼠血清SOD活性升高,MDA含量减少。翟兴月等[22]采用鲟鱼肽灌胃衰老模型小鼠,灌胃鲟鱼肽的低、中、高剂量组均能极显著降低血清中MDA含量,极显著升高了小鼠血清中T-AOC含量和SOD活性,这些结论与本试验结论一致。
2.3 Se-GSP对D-半乳糖诱导氧化损伤小鼠肝脏中抗氧化指标的影响
按照“1.3.3节”组织匀浆的制备方法,进行肝组织匀浆的制备,按照SOD活力、GSH-Px活力、GSH含量、T-AOC含量、MDA含量和蛋白质羰基含量的检测方法对肝组织匀浆中的相关指标进行检测,结果如表2 所示。肝脏在机体内具有解毒、代谢等功能。研究表明,D-半乳糖能够导致肝脏的损伤[23]。由表2可知,与正常对照组相比,腹腔注射D-半乳糖的模型对照组肝脏的SOD活力、GSH含量、GSH-Px活力和T-AOC含量显著下降(P<0.05),MDA和蛋白质羰基含量显著上升(P<0.05)。阳性对照组与正常对照组相比,SOD活力、GSH-Px活力、T-AOC含量、MDA和蛋白质羰基含量有显著差异(P<0.05),而GSH含量无显著差异(P>0.05)。GSP-L组小鼠肝脏中的SOD活力、GSH含量、GSH-Px活力、T-AOC含量显著增加(P<0.05),MDA、蛋白质羰基含量显著下降(P<0.05),并随着GSP剂量的增加差异逐渐增大。Se-GSP-L组小鼠肝脏中的SOD活力、GSH含量、GSH-Px活力、T-AOC含量显著增加(P<0.05),MDA、蛋白质羰基含量显著下降(P<0.05),随着剂量的增加差异逐渐增大。灌胃低、高剂量的GSP组的SOD活力、GSH含量、GSH-Px活力、T-AOC含量分别显著低于灌胃低、高剂量的Se-GSP组(P<0.05),MDA和蛋白质羰基含量分别显著高于灌胃低、高剂量Se-GSP组(P<0.05)。Se-GSP-H组小鼠肝脏中MDA和蛋白质羰基含量较模型对照组分别降低了70.59%和71.63%。灌胃亚硒酸钠的小鼠肝脏中各指标居于GSP-L组和Se-GSP-L组之间。张昱等[24]用蓝点马鲛鱼皮抗氧化肽Fraction Ⅱ 灌胃D-半乳糖诱导氧化损伤大鼠,各剂量组的Fraction Ⅱ 能显著提高肝脏组织的SOD、GSH-Px活性和T-AOC能力,降低MDA含量,与本试验结果一致。
表2 GSP和Se-GSP对小鼠肝脏中抗氧化指标的影响
Table 2 Effect of GSP and Se-GSP on antioxidant indexes in mouse liver

组别T-AOC含量/(mmol/g prot)SOD活力/(U/mg prot)GSH含量/(μmol/g prot)GSH-Px活力/(U/mg prot)MDA含量/(nmol/g prot)蛋白质羰基含量/(nmol/g prot)Normal0.57±0.01a455.57±10.48a9.23±0.14a842.26±4.27a0.30±0.01f146.57±6.80gModel0.13±0.01g165.36±2.77e3.28±0.75d179.62±0.00f1.36±0.05a930.25±23.93aAA0.51±0.02b404.82±14.60b8.74±0.12a729.06±6.40b0.43±0.03e191.10±5.86fGSP-L0.25±0.02f276.35±1.89d4.76±0.73bc338.11±10.67e0.96±0.03b686.25±17.90bGSP-H0.38±0.03d360.69±24.62c5.98±0.90c600.00±26.68c0.58±0.03d321.42±22.96dSe-GSP-L0.31±0.01e294.93±7.25d5.73±0.29bc433.21±14.94d0.80±0.06c617.45±17.41cSe-GSP-H0.46±0.01c371.88±5.53c6.54±0.38b624.15±20.28c0.40±0.01e263.89±12.94eNa2SeO30.30±0.01e276.11±3.02d5.54±0.04bc449.06±26.68d0.87±0.07bc329.07±7.13d
2.4 Se-GSP对D-半乳糖诱导氧化损伤小鼠心脏中抗氧化指标的影响
按照“1.3.4节”组织匀浆的制备方法,进行心脏组织匀浆的制备,按照SOD活力、GSH-Px活力、T-AOC含量、GSH含量、MDA含量和蛋白质羰基含量的检测方法对心脏组织匀浆中的相关指标进行检测,结果如表3所示。
表3 GSP和Se-GSP对小鼠心脏中抗氧化指标的影响
Table 3 Effects of GSP and Se-GSP on antioxidant indexes in mouse heart

组别T-AOC含量/(mmol/g prot)SOD活力/(U/mg prot)GSH含量/(μmol/g prot)GSH-Px活力/(U/mg prot)MDA含量/(nmol/g prot)蛋白质羰基含量/(nmol/g prot)Normal1.78±0.10a177.28±9.93a24.02±1.29a865.66±11.74a2.13±0.06h311.22±2.84gModel0.77±0.05f19.08±2.80g6.82±0.14g286.04±18.14g5.32±0.10a917.04±2.70aAA1.64±0.03b155.16±8.10b20.33±0.64b698.87±10.67b2.37±0.04g380.77±14.45fGSP-L1.03±0.06e94.55±2.19f8.74±0.16ef329.81±1.07f4.27±0.08b675.33±9.63bGSP-H1.22±0.04d124.81±4.26d12.84±0.12d477.74±28.82d3.14±0.05e471.60±4.20dSe-GSP-L1.14±0.02de115.09±5.70de9.45±0.46e390.19±7.47e3.48±0.06d633.72±2.28cSe-GSP-H1.38±0.03c141.51±2.35c14.44±0.55c655.85±3.20c2.79±0.10f426.62±10.58eNa2SeO31.13±0.02de111.12±3.88e7.87±0.32fg378.87±21.35e3.72±0.10c671.42±9.79b
与正常对照组相比,腹腔注射D-半乳糖的模型对照组心脏的SOD活力、GSH含量、GSH-Px活力和T-AOC含量显著下降(P<0.05),MDA、蛋白质羰基含量显著上升(P<0.05),说明建模成功。阳性对照组与正常对照组相比,SOD活力、GSH含量、GSH-Px活力、T-AOC、MDA和蛋白质羰基含量有显著差异(P<0.05)。灌胃亚硒酸钠小鼠的心脏中T-AOC含量、SOD活力、GSH含量、GSH-Px活力与MDA含量与Se-GSP-L组无显著差异(P<0.05)。Se-GSP-H组的各项指标均与正常对照组有显著差异(P<0.05),表明高剂量Se-GSP的效果不如阳性对照药物L-抗坏血酸。与模型对照组相比,灌胃GSP后,心脏中的SOD活力、GSH含量、GSH-Px活力、T-AOC含量显著增加(P<0.05),MDA、蛋白质羰基含量显著下降(P<0.05),并随着剂量的增加差异逐渐增大,表明GSP可提高衰老小鼠心脏组织的SOD、GSH、GSH-Px活力,且对D-半乳糖诱导的小鼠心脏的脂质过氧化有较好的抑制作用。与模型对照组相比,灌胃Se-GSP后,心脏中的SOD活力、GSH含量、GSH-Px活力、T-AOC含量显著增加(P<0.05),MDA和蛋白质羰基含量显著下降(P<0.05),并随着剂量的增加差异逐渐增大,其中Se-GSP-H组小鼠心脏中T-AOC含量较模型对照组小鼠增加了79.22%,MDA和蛋白质羰基含量较模型对照组降低了47.56%和53.48%。表明Se-GSP可提高衰老小鼠心脏组织的SOD活力、GSH含量、GSH-Px活力,且对D-半乳糖诱导的小鼠心脏的脂质过氧化有较好的抑制作用。且Se-GSP-H组小鼠心脏中各指标均与GSP-H组具有显著差异性(P<0.05)。
2.5 Se-GSP对D-半乳糖诱导氧化损伤小鼠脑中抗氧化指标的影响
按照“1.3.4节”组织匀浆的制备方法,进行脑组织匀浆的制备,按照SOD活力、GSH-Px活力、T-AOC含量、GSH含量、MDA含量和蛋白质羰基含量的检测方法对脑组织匀浆中的相关指标进行检测,结果如表4所示。脑是机体中结构最复杂、功能完备、且能调节人体生理活动的器官[25],氧化应激会诱导急性脑卒中、脑缺血和衰老等疾病的发生,脑组织若长期受到损伤,会造成不可逆转的后果。因此,抑制并修复脑组织的氧化损伤十分重要。D-半乳糖能够加速大脑组织衰老。与正常对照组比较,其余7组小鼠脑组织的SOD活力、GSH含量、GSH-Px活力和T-AOC显著降低(P<0.05),MDA和蛋白质羰基含量显著增加(P<0.05)。与模型对照组比较,亚硒酸钠组和GSP、Se-GSP的低、高剂量组小鼠脑组织中的SOD活力、GSH含量、GSH-Px活力和T-AOC都升高,MDA和蛋白质羰基含量降低,且亚硒酸钠组、GSP-L、GSP-H、Se-GSP-L和Se-GSP-H组的各指标与模型对照组有显著性差异(P<0.05)。阳性对照组与正常对照组相比,除T-AOC含量无显著差异(P>0.05)之外,其余各指标均与正常对照组有显著性差异(P<0.05),表明D-半乳糖对小鼠大脑的损伤在抗坏血酸的作用下不可逆转。Se-GSP-L组和Se-GSP-H组的各项指标均呈现显著性差异(P<0.05),其中Se-GSP-L组小鼠的脑组织中的SOD、GSH、GSH-Px活力和T-AOC含量较Se-GSP-H组显著下降(P<0.05),MDA含量、蛋白质羰基含量较Se-GSP-H组显著上升(P<0.05)。Se-GSP-H组小鼠脑中T-AOC含量较模型对照组小鼠增加了80.00%,MDA和蛋白质羰基含量较模型对照组降低了62.47%和52.68%。表明Se-GSP和GSP均能提高D-半乳糖诱导氧化应激损伤小鼠脑组织中的SOD活力、GSH含量、GSH-Px活力和T-AOC含量,同时能够降低脑组织中的MDA和蛋白质羰基含量。
表4 GSP和Se-GSP对小鼠脑中抗氧化指标的影响
Table 4 Effects of GSP and Se-GSP on antioxidant indexes in mouse brain
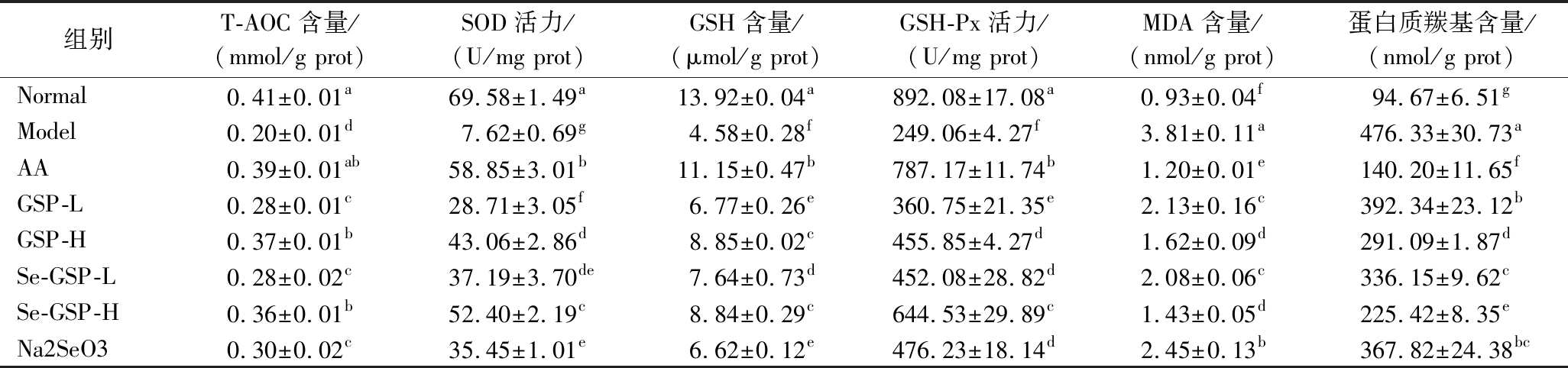
组别T-AOC含量/(mmol/g prot)SOD活力/(U/mg prot)GSH含量/(μmol/g prot)GSH-Px活力/(U/mg prot)MDA含量/(nmol/g prot)蛋白质羰基含量/(nmol/g prot)Normal0.41±0.01a69.58±1.49a13.92±0.04a892.08±17.08a0.93±0.04f94.67±6.51gModel0.20±0.01d7.62±0.69g4.58±0.28f249.06±4.27f3.81±0.11a476.33±30.73aAA0.39±0.01ab58.85±3.01b11.15±0.47b787.17±11.74b1.20±0.01e140.20±11.65fGSP-L0.28±0.01c28.71±3.05f6.77±0.26e360.75±21.35e2.13±0.16c392.34±23.12bGSP-H0.37±0.01b43.06±2.86d8.85±0.02c455.85±4.27d1.62±0.09d291.09±1.87dSe-GSP-L0.28±0.02c37.19±3.70de7.64±0.73d452.08±28.82d2.08±0.06c336.15±9.62cSe-GSP-H0.36±0.01b52.40±2.19c8.84±0.29c644.53±29.89c1.43±0.05d225.42±8.35eNa2SeO30.30±0.02c35.45±1.01e6.62±0.12e476.23±18.14d2.45±0.13b367.82±24.38bc
2.6 Se-GSP对D-半乳糖诱导氧化损伤小鼠肝、脑组织的影响
HE染色是观察形态最常用的染色方法之一[26],本研究利用HE染色对组织病理学观察,进一步确认Se-GSP和GSP对D-半乳糖诱导氧化应激损伤小鼠的保护作用。D-半乳糖可致氧化应激损伤模型小鼠中央静脉结构紊乱,肝细胞排列杂乱,肝索和肝窦排列不规则,胞质疏松、肿胀[27]。肝脏的HE染色结果如图4所示,正常对照组小鼠的肝小叶完整,肝细胞群排列在中央静脉周围,肝细胞结构清晰完整、细胞核正常,无明显病理变化。模型对照组小鼠肝细胞排列杂乱、胞浆内出现大量脂肪样变性空泡,肝血窦扩张明显。阳性对照组小鼠的肝细胞排列有序,其形态发生了略微的变化,胞内脂肪样变性空泡减少,肝损伤减轻。低剂量Se-GSP对氧化应激小鼠肝脏的修复能力弱于高剂量Se-GSP。GSP-L组小鼠肝细胞内仍有脂肪样空泡,肝索呈放射状排列。亚硒酸钠组部分肝细胞体积增大,肝索排列紊乱。高剂量Se-GSP能改善氧化应激小鼠肝细胞形态,减少中性脂肪聚集,修复部分肝脏损伤。由此可见,高剂量的Se-GSP和GSP可缓解肝细胞的破坏,维护组织功能正常,进一步延缓衰老。

图4 小鼠肝脏组织病理切片图(×200)
Fig.4 Mouse liver histopathological section(×200)
大脑的耗氧量较大,由此导致的自由基蓄积损伤尤为明显。随着年龄的增加,机体的老化状态也越发严重,大脑各部位的神经元细胞都在减少。其中最主要的病理改变发生在大脑皮质和海马区[28]。GSP、Se-GSP对半乳糖诱导氧化应激损伤模型小鼠脑组织的影响如图5所示,脑组织经HE染色后,神经细胞胞浆表现为紫红色,细胞核呈紫蓝色。空白对照组小鼠的脑组织整体结构正常,脑组织海马区的神经元细胞排列有序,细胞核和胞浆清晰可见。模型对照组小鼠的脑组织整体结构异常,组织海马区神经元排列紊乱,数量减少,可见大量神经元明显固缩深染坏死,组织间质未见血管明显地充血扩张,组织未见明显的炎症细胞浸润。GSP-H组和Se-GSP-H组仍有不同程度的神经元细胞变性,但是变性细胞显著减少,表明高剂量GSP和Se-GSP可改善D-半乳糖诱导的脑组织病理变化。
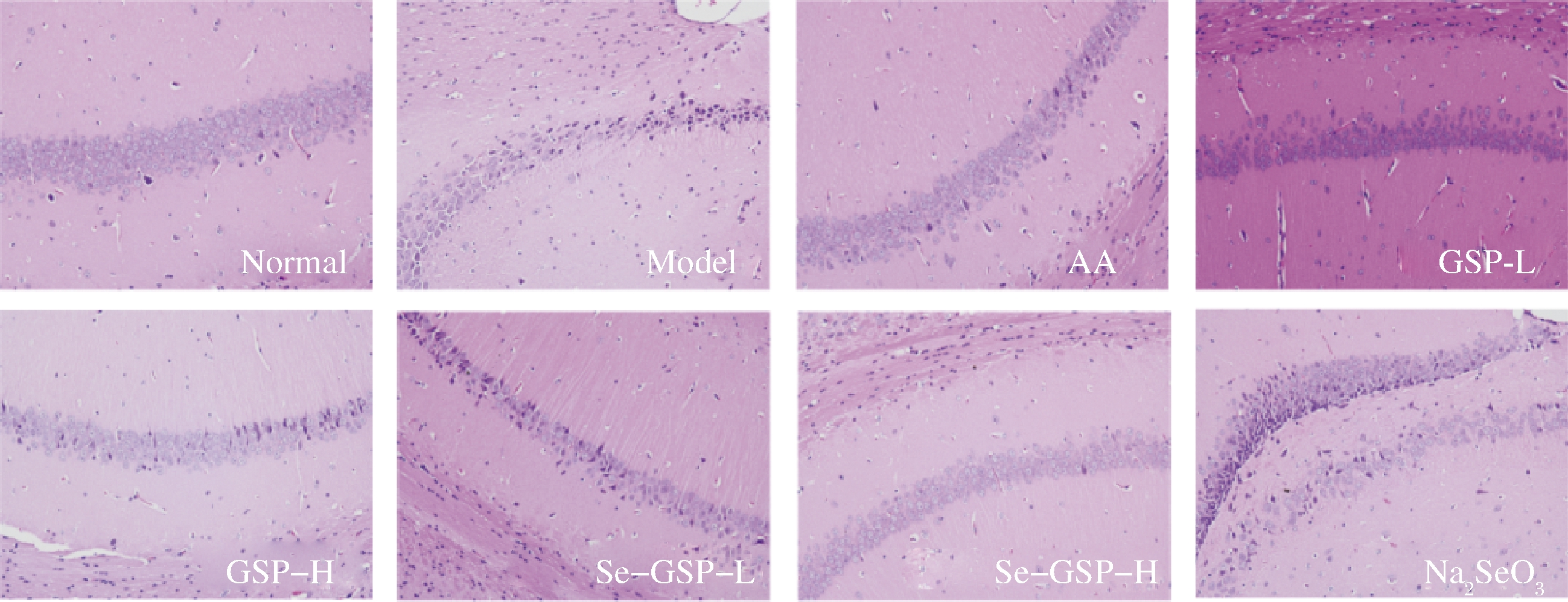
图5 小鼠脑组织病理切片图(×200)
Fig.5 Mouse brain histopathological section(×200)
3 结论
采用D-半乳糖诱导建立氧化应激损伤小鼠模型,通过大鲵肽和大鲵肽硒螯合物干预后均显示出了较好的拮抗肝脏、脾脏和胸腺萎缩的作用,能显著提高小鼠血清、肝脏、心脏、脑组织中T-AOC含量、SOD活力、GSH含量和GSH-Px活力(P<0.05),同时降低MDA和蛋白质羰基含量(P<0.05)。组织病理学切片结果显示,大鲵肽和大鲵肽硒螯合物对氧化应激损伤小鼠肝脏和脑具有较好的保护作用。与大鲵肽相比,大鲵肽硒螯合物对D-半乳糖诱导的氧化应激损伤小鼠的保护和修复作用更强,显示出更好的体内抗氧化活性。今后还需要进一步对其进行安全性评价、胃肠道消化稳定性以及免疫调节功能进行探究,以期为大鲵肽硒螯合物相关衍生产品研发提供参考数据。
[1] JIN W G, PEI J J, DU Y N, et al.Characterization and functional properties of gelatin extracted from Chinese giant salamander (Andrias davidianus) skin[J].Journal of Aquatic Food Product Technology, 2019, 28(8):861-876.
[2] 贺屹潮. 大鲵肉酶解肽制备及抗氧化与免疫调节活性研究[D].汉中, 陕西理工大学, 2020.
HE Y C. Preparation of enzymatic hydrolysate peptide from giant salamander (Andrias davidiauns) meat and its antioxidant and immunomodulatory activity[D]. Hanzhong: Shaanxi University of Technology, 2020.
[3] ALI T, BADSHAH H, KIM T H, et al.Melatonin attenuates D-galactose-induced memory impairment, neuroinflammation and neurodegeneration via RAGE/NF-κB/JNK signaling pathway in aging mouse model[J].Journal of Pineal Research, 2015, 58(1):71-85.
[4] ZHANG X, HE H, XIANG J Q, et al.Selenium-containing soybean antioxidant peptides:Preparation and comprehensive comparison of different selenium supplements[J].Food Chemistry, 2021, 358:129888.
[5] YU T A, GUO J A, ZHU S, et al.Protective effects of selenium-enriched peptides from Cardamine violifolia on D-galactose-induced brain aging by alleviating oxidative stress, neuroinflammation, and neuron apoptosis[J].Journal of Functional Foods, 2020, 75:104277.
[6] ZHU S, YANG W, LIN Y, et al.Antioxidant and anti-fatigue activities of selenium-enriched peptides isolated from Cardamine violifolia protein hydrolysate[J].Journal of Functional Foods, 2021, 79:104412.
[7] 刘俊霞, 吴艳, 赵世博, 等.响应面法优化大鲵肽-硒螯合物制备工艺及其性质研究[J/OL].食品与发酵工业, 2023, DOI:10.13995/j.cnki.1-1802/ts.035888.
LIU J, WU Y, ZHAO SB, et al.Optimization of preparation process and properties of giant salamander peptide-selenium chelates using response surface methodology[J/OL].Food and Fermentation Industry, 2023, DOI:10.13995 /j.cnki.1-1802/ts.035888.
[8] 付媛, 张美莉, 高韶辉, 等.裸燕麦球蛋白源多肽对D-半乳糖致衰老小鼠抗氧化能力的影响[J].食品科学, 2019, 40(23):137-141.
FU Y, ZHANG M L, GAO S H, et al. Effect of peptide derived from naked oat globulin on antioxidant capacity in D-galactose-induced aging mice[J]. Food Science, 2019, 40(23): 137-141.
[9] 关百婷, 李伟, 赵菲, 等.大鲵活性肽对D-半乳糖致小鼠机体氧化损伤的修复作用[J].食品工业科技, 2021, 42(16):344-352.
GUAN B T, LI W, ZHAO F, et al.Protective effects of giant salamander bioactive peptides on D-galactose induced oxidative damage in mice[J].Science and Technology of Food Industry, 2021, 42(16):344-352.
[10] 贺燕, 黄先智, 韦峥, 等.桑叶生物碱对D-半乳糖诱导小鼠肠道菌群紊乱的调节作用[J].食品科学, 2022, 43(5):118-126.
HE Y, HUANG X Z, WEI Z, et al.Regulatory effect of mulberry leaf alkaloid on D-galactose-induced intestinal flora disturbance in mice[J].Food Science, 2022, 43(5):118-126.
[11] 邢秋娟, 施杞, 王拥军.D-半乳糖诱导衰老动物模型的机制及其在中医药方面的应用[J].上海中医药大学学报, 2010, 24(3):93-98.
XING Q J, SHI Q, WANG Y J. Mechanism of establishing aging model with D-galactose and its application in research of traditional Chinese medicine[J]. Acta Universitatis Traditionis Medicalis Sinensis Pharmacologiaeque Shanghai, 2010, 24(3): 93-98.
[12] 星萍, 陈晓平, 邢钰彬, 等.紫苏迷迭香酸对D-半乳糖衰老模型小鼠的抗氧化作用[J].食品科技, 2021, 46(4):222-227.
XING P, CHEN X P, XING Y B, et al.Antioxidant effect of Perilla rosemary acid on D-galactose-induced aging mice[J].Food Science and Technology, 2021, 46(4):222-227.
[13] WU D M, LU J, ZHENG Y L, et al.Purple sweet potato color repairs D-galactose-induced spatial learning and memory impairment by regulating the expression of synaptic proteins[J].Neurobiology of Learning and Memory, 2008, 90(1):19-27.
[14] PARK S, KIM C S, LEE J, et al.Effect of regular exercise on the histochemical changes of D-galactose-induced oxidative renal injury in high-fat diet-fed rats[J].Acta Histochemica et Cytochemica, 2013, 46(4):111-119.
[15] KONG Y Q, DING Z L, ZHANG Y X, et al.Dietary selenium requirement of juvenile oriental river prawn Macrobrachium nipponense[J].Aquaculture, 2017,476:72-78.
[16] WANG M, MENG X Y, YANG R L, et al.Cordyceps militaris polysaccharides can enhance the immunity and antioxidation activity in immunosuppressed mice[J].Carbohydrate Polymers, 2012, 89(2):461-466.
[17] 孙玉军, 江昌俊, 任四海.秀珍菇多糖对D-半乳糖致衰老小鼠的保护作用[J].食品科学, 2017, 38(5):251-256.
SUN Y J,JIANG C J, REN S H.Protective effect of polysaccharides from the fruiting body of Pleurotus geesteranus against D-galactose-induced aging mice[J].Food Science, 2017, 38(5):251-256.
[18] QU J B, ZHANG X F, ZHANG Y B, et al.Galactosylated core-shell nanoparticles with pH/GSH dual sensitivity for targeting hepatocellular carcinoma[J].ACS Macro Letters, 2023, 12(2):201-207.
[19] MAS-BARGUES C, ESCRIV C, DROMANT M, et al.Lipid peroxidation as measured by chromatographic determination of malondialdehyde.Human plasma reference values in health and disease[J].Archives of Biochemistry and Biophysics, 2021, 709:108941.
C, DROMANT M, et al.Lipid peroxidation as measured by chromatographic determination of malondialdehyde.Human plasma reference values in health and disease[J].Archives of Biochemistry and Biophysics, 2021, 709:108941.
[20] HUANG Y Y, WU C C, YE Y B, et al.The increase of ROS caused by the interference of DEHP with JNK/p38/p53 pathway as the reason for hepatotoxicity[J].International Journal of Environmental Research and Public Health, 2019, 16(3):356.
[21] 蔡佳佳, 刘振珂, 李吉华, 等. 大鲵肉对D-半乳糖诱发小鼠衰老相关指标的影响[J]. 西部中医药, 2015, 28(7): 4-7.
CAI J J, LIU Z K, LI J H, et al. Effects of giant salamander meat on physiological indexes of D-galactose induced aging mice models[J]. Western Journal of Traditional Chinese Medicine, 2015, 28(7): 4-7.
[22] 翟兴月, 王庆辉, 赵冠华, 等.非标记定量蛋白质组方法分析鲟鱼肽抗D-半乳糖导致的小鼠衰老作用的研究[J].食品工业科技, 2019, 40(3):290-295.
ZHAI X Y, WANG Q H, ZHAO G H, et al.Label-free quantitative proteomic analysis of Acipenser schrenki Brandt peptides on aging mice induced by D-galactose[J].Science and Technology of Food Industry, 2019, 40(3):290-295.
[23] 刘建亚, 冯文静, 王仁萍, 等.D-半乳糖致衰老动物模型及其机制研究进展[J].中华老年多器官疾病杂志, 2018.17(3):224-227.
LIU J Y, FENG W J, WANG R P, et al.Research progress in D-galactose-induced aging animal model and its mechanisms[J].Chinese Journal of Multiple Organ Diseases in the Elderly, 2018, 17(3):224-227.
[24] 张昱, 彭新颜, 黄萍萍, 等.蓝点马鲛鱼皮抗氧化肽FractionⅡ对D-Gal诱导氧化损伤大鼠肝脏的保护作用[J].水产学报, 2017.41(6):944-951.
ZHANG Y, PENG X Y, HUANG P P, et al.Protective effects of Spanish mackerel (Scomberomorous niphonius) skin peptides against D-Gal-induced liver damage in rats[J].Journal of Fisheries of China, 2017, 41(6):944-951.
[25] FRACASSO M, DUTRA DA SILVA A, BOTTARI N B, et al.Resveratrol impacts in oxidative stress in liver during Trypanosoma cruzi infection[J].Microbial Pathogenesis, 2021, 153:104800.
[26] ZHOU B H, ZHAO J, LIU J, et al.Fluoride-induced oxidative stress is involved in the morphological damage and dysfunction of liver in female mice[J].Chemosphere, 2015, 139:504-511.
[27] 鞠文博, 于春艳, 陈建光.D-半乳糖致衰老小鼠模型的实验研究[J].北华大学学报(自然科学版), 2015,16(2):199-202.
JU W B,YU C Y, CHEN J G.Experimental study of aging mice model induced by D-galactose[J].Journal of Beihua University (Natural Science), 2015, 16(2):199-202.
[28] 王玉倩. 大米活性肽对D-半乳糖致衰老小鼠氧化应激的保护作用[D].长沙:中南林业科技大学, 2019.
WANG Y Q.The protective effect of rice active peptide on oxidative stress in D-galactose-induced aging mice[D].Changsha:Central South University of Forestry and Technology, 2019.