颜色是决定葡萄酒品质的重要因素之一,可以反应葡萄原料和葡萄酒的状况,对品尝者的感官偏好有重要影响。花色素及其衍生物是葡萄酒呈色的主要物质,其核心结构是3,5,7 -三羟基-2-苯基苯并吡喃阳离子,花色素由于缺乏电子而不稳定,导致其在自然界中通常以糖基化的花色苷形式存在[1]。
我国酿酒葡萄品种多样,主要以赤霞珠、霞多丽等欧亚种葡萄(Vitis vinifera)为主。黑珍珠(又名藏葡萄)是西藏芒康地区广泛种植的特色葡萄品种,由法国传教士于18世纪中叶引入该地区,经过100多年的自然驯化,已十分适应当地的风土条件。黑珍珠葡萄产量高,抗性强,不易感染真菌病害,用其为原料酿制的葡萄酒具有颜色绚丽、呈紫红色的特点。但在研究过程中发现,黑珍珠葡萄酒的颜色在陈酿过程中容易氧化降解,对其色泽品质有较大影响。我们推测黑珍珠葡萄酒颜色容易氧化降解与其花色苷组成有关。
不同品种的葡萄花色苷组成不同,欧亚葡萄品种中5-O-葡萄糖苷转移酶失活[2],无法合成3,5-O-双糖花色苷,葡萄酒颜色主要由单糖花色苷提供;但该酶在美洲葡萄(Vitis labrusca)、山葡萄(Vitis amurensis)[3]、河岸葡萄(Vitis riparia)[4]、圆叶葡萄(Vitis rotundifolia)[5]、刺葡萄Vitis davidii[6]等非欧亚种葡萄中成功表达,因此山葡萄V.amurensis[3]等通常含有较多的双糖花色苷。李贝贝等[7]通过微卫星技术分析认为西藏黑珍珠可能为‘巴柯’(欧美杂交种,原产地法国,由‘Folle Blanche’与‘Grand Glabre’杂交)的同物异名品种。作为欧美杂交种,黑珍珠葡萄中可能含有大量的双糖花色苷。近年来关于双糖花色苷的研究主要集中在检测不同品种葡萄及葡萄酒花色苷含量的差异[8-10],以及探究模拟体系中双糖苷的辅色效率[11]和聚合能力[12]方面,我国鲜有研究者关注双糖花色苷对红葡萄酒颜色稳定性的影响。
因此,本研究利用CIELab参数法对比在与氧气接触过程中黑珍珠葡萄酒与赤霞珠葡萄酒的颜色变化情况,并利用高效液相色谱-质谱联用技术(ultra-high performance liquid chromatography-mass spectrometry,UPLC-MS/MS)分析葡萄酒花色苷的组成及含量,以期进一步探究双糖花色苷在葡萄酒中的稳定性,并为黑珍珠葡萄酒的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
葡萄酒样品由西藏芒康藏东珍宝酒业有限公司提供,2021年西藏盐井产区黑珍珠原酒[酒精度(15.54±0.17)%,残糖(2.77±0.03) g/L]和赤霞珠原酒[酒精度(15.7±0.43)%,残糖(1.84±0.07) g/L]。
花青素-3-O-葡萄糖苷(色谱纯),成都曼斯特生物技术有限公司;乙腈(色谱纯),阿拉丁生物技术公司;浓HCl、氯化钠、醋酸、醋酸钠,均为分析纯,上海麦克林生化科技有限公司。
1.2 仪器与设备
V1800可见分光光度计,尤尼科(上海)仪器有限公司;ACQUITY UPLC I-class/Xevo TQS高效液相色谱质谱联用美国,Waters公司。
1.3 实验方法
1.3.1 葡萄酒氧化
将150 mL黑珍珠和赤霞珠葡萄酒分别置于200 mL 锥形瓶中,覆盖3层纱布,置于20 ℃培养箱控温保藏,进行氧化。每天取样,分析测定,每组酒样设置3组平行。
1.3.2 色度和色差测定
参照李运奎等[13]的方法进行测定。
1.3.3 CIELab参数的测定
参照PÉREZ-CABALLERO等[14]方法进行测定。酒样经0.45 μm滤膜过滤,置于0.2 cm光程石英比色皿中(用蒸馏水作为参比),测定供试酒样在450、520、570、630 nm的吸光度,计算出三色值X、Y、Z值,继而得CIELab参数L*、a*、b*。
1.3.4 总花色苷的测定
采用pH示差法对葡萄酒中总花色苷的含量进行测定[15]。
1.3.5 单体花色苷的测定
采用UPLC-MS/MS进行葡萄酒花色苷的检测,BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),柱温40 ℃,进样体积5 μL,流速0.2 mL/min。流动相A:1%甲酸的水,流动相B:1%甲酸的乙腈。洗脱梯度:0~0.5 min 5% B;0.5~10 min 5%~23% B,10~13 min 46% B,13~13.5 min 5% B;13.5~15 min 5% B。
质谱采用电喷雾离子源(ESI),正离子模式,离子扫描范围:100~1 000 m/z;雾化器压力:35 psi;干燥气流速:10 L/min;干燥气温度:325 ℃。葡萄酒样品过0.22 μm滤膜后直接上样。花色苷的定性定量分析参照中国农业大学葡萄酒研究中心建立的“葡萄与葡萄酒花色苷HPLC-UV-MS/MS指纹谱库”[16]。
1.4 数据处理
采用Microsoft Office Excel 2003统计数据,SPSS 24.0进行显著性数据分析,Origin 2021软件绘图,Adobe Photoshop软件进行颜色匹配。
2 结果与分析
2.1 饱和度和色差值的变化
饱和度![]() 表示葡萄酒颜色的集中程度,饱和度值越高表示葡萄酒颜色越集中。由图1-a可知,黑珍珠葡萄的色度值显著高于赤霞珠葡萄酒,在与氧气接触的过程中,黑珍珠葡萄酒的色度值先下降后逐渐上升;赤霞珠葡萄酒的色度值一直呈现上升趋势。
表示葡萄酒颜色的集中程度,饱和度值越高表示葡萄酒颜色越集中。由图1-a可知,黑珍珠葡萄的色度值显著高于赤霞珠葡萄酒,在与氧气接触的过程中,黑珍珠葡萄酒的色度值先下降后逐渐上升;赤霞珠葡萄酒的色度值一直呈现上升趋势。

a-饱和度;b-色差值
图1 黑珍珠和赤霞珠葡萄酒暴露在氧气条件下6 d色度和
色差值的变化
Fig.1 Changes in saturation and chromatic aberration of Black Pearl and Cabernet Sauvignon wine exposed to oxygen for 6 days
注:不同小写字母代表差异显著(P<0.05)(下同)。
色差值(ΔEab)表示不同颜色产生的视觉差异,与样品间颜色的整体差别有关。图1-b表示以第0天葡萄酒的颜色为参照,在1~6 d放置过程中,随着与氧气接触时间的增长,葡萄酒颜色的差异逐渐增大。与氧气接触第6天时,黑珍珠的色差值为17.51±0.15,赤霞珠色差值为6.81±0.82,在葡萄酒的颜色评价体系中,![]() 样品间的差异即可通过肉眼辨识[17],但黑珍珠氧化后与原酒的颜色差异视觉感知更明显。
样品间的差异即可通过肉眼辨识[17],但黑珍珠氧化后与原酒的颜色差异视觉感知更明显。
2.2 CIELab参数的变化
在CIELab体系中,颜色参数(L*)代表物质明暗程度,L*数值越大,表示颜色亮度越高,颜色越浅。图2显示,黑珍珠葡萄酒的亮度值低于赤霞珠,在接触氧气的过程中,黑珍珠的亮度值逐渐上升,颜色变浅;而赤霞珠的亮度值逐渐下降,颜色加深。

a-L*,亮度;b-a*,红色色调;c-b*,黄色色调
图2 黑珍珠和赤霞珠葡萄酒暴露在氧气条件下6 d CIELab参数的变化
Fig.2 CIELab changes in Black Pearl and Cabernet Sauvignon wine exposed to oxygen for 6 days
a*代表葡萄酒的红绿参数,a*>0时,颜色偏红,a*<0颜色偏绿。黑珍珠葡萄原酒的红色色调值高于赤霞珠葡萄酒,在接触氧气过程中,黑珍珠葡萄酒的红色色调值在0~3 d逐渐下降,在3~6 d趋于稳定,下降24.62%;赤霞珠葡萄酒的红色色调值在0~6 d逐渐上升,上升24.62%。
b*代表葡萄酒的黄蓝程度,b*>0时,颜色偏黄,b*<0时,颜色偏蓝。黑珍珠葡萄原酒的黄色色调值高于赤霞珠葡萄酒,在接触氧气0~6 d的过程中,黑珍珠葡萄酒的黄色色调值显著上升,上升64.15%;而赤霞珠葡萄酒的黄色色调值变化不大。
2.3 总花色苷含量的变化
黑珍珠和赤霞珠葡萄酒在与氧气接触的过程中总花色苷的变化情况如图3所示,随接触时间的延长,黑珍珠葡萄酒的总花色苷含量持续下降,从初始的297.49 mg/L下降至158.86 mg/L,下降了46.51%;赤霞珠葡萄酒的总花色苷含量变化不大,从初始的142.42 mg/L下降至135.64 mg/L,下降了4.76%。氧气对黑珍珠葡萄酒总花色苷的降解作用显著大于赤霞珠葡萄酒。
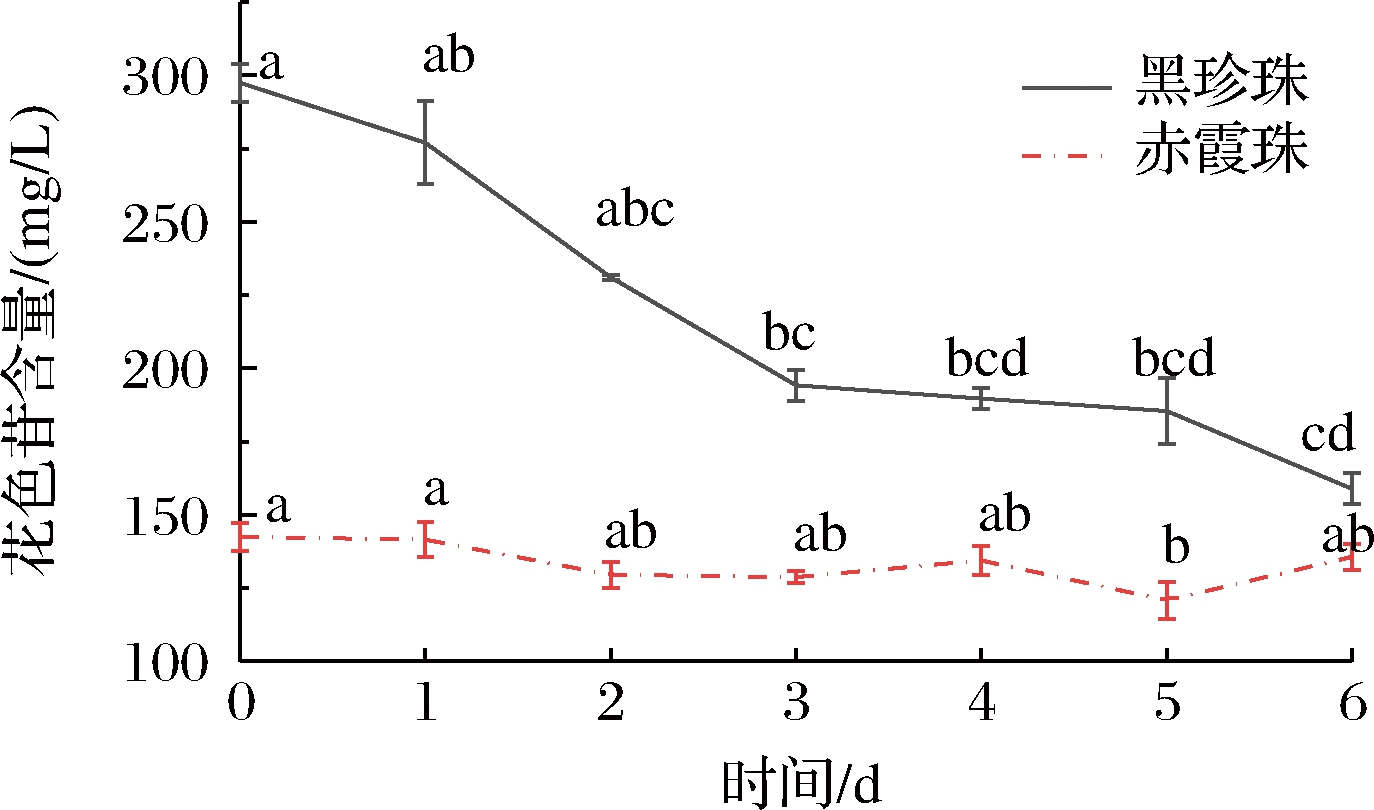
图3 黑珍珠和赤霞珠葡萄酒暴露在氧气条件下6 d
总花色苷含量的变化
Fig.3 The changes of total anthocyanins in Black Pearl and Cabernet Sauvignon during the 6 days oxygen explosion
2.4 赤霞珠和黑珍珠葡萄酒中花色苷的组成
在黑珍珠和赤霞珠葡萄酒中共检测到28种花色苷,其中黑珍珠葡萄酒中检测到21种花色苷,包括5种未酰化的双糖花色苷,7种酰化的双糖花色苷,5种未酰化的单糖花色苷,4种酰化的单糖花色苷;赤霞珠葡萄酒检测到19种花色苷,包括3种未酰化的双糖花色苷,5种未酰化的单糖花色苷,11种酰化的单糖花色苷,未检测到酰化的双糖苷。
赤霞珠葡萄酒的颜色主要由单糖花色苷提供,占花色苷总量的99.37%,但也检测到了少量的甲基花青素-3,5-O-葡萄糖苷(0.35 mg/L)和二甲基花翠素-3,5-O-葡萄糖苷(1.89 mg/L),此前,欧亚种葡萄中含有少量的双糖花色苷的现象已被研究者证实[18]。黑珍珠葡萄酒中花色苷总量更高,花色苷组成主要以双糖花色苷为主(646.89 mg/L),占花色苷总量的85.47%,尤其以甲基花青素-3,5-O-葡萄糖苷(322.97 mg/L)和二甲基花翠素-3,5-O-葡萄糖苷(153.21 mg/L)含量丰富。这主要与葡萄的品种有关,黑珍珠葡萄为欧美杂交种[7],美洲葡萄和欧美杂交种葡萄酒通常含有较高比例的双糖花色苷[4-5]。
由表1和图4可知,赤霞珠葡萄酒中含有较高比例的酰化单糖花色苷,特别是二甲花翠素-3-O-(6-O-乙酰化)-葡萄糖苷(123.91 mg/L),花色苷的酰化比例高达36.31%,而黑珍珠葡萄酒中的花色苷主要以非酰化形式存在,仅含有6.91%的酰化双糖花色苷和0.76%的酰化单糖花色苷,其中主要以二甲基花翠素3-O-(6-O-香豆酰化)-葡萄糖苷-5-O-葡萄糖苷(30.77 mg/L)为主。这主要是因为美洲种和欧美杂交种的葡萄中大部分酰基转移酶失活,造成葡萄酒中花色苷的酰化程度一般低于赤霞珠等欧亚种葡萄[19]。
表1 葡萄酒中单体花色苷的组成情况 单位:mg/L
Table 1 The composition of monomeric anthocyanins in wine

编号花色苷黑珍珠原始黑珍珠氧化赤霞珠原始赤霞珠氧化1花青素-3,5-O-葡萄糖苷11.26±2.841.39±0.040.47±0.01-2花翠素-3,5-O-葡萄糖苷 39.74±0.1111.44±0.12--3甲基花青素-3,5-O-葡萄糖苷 67.71±1.713.36±0.08--4甲基花翠素-3,5-O-葡萄糖苷 153.21±4.8356.59±1.620.41±0.110.35±0.045二甲花翠素-3,5-O-葡萄糖苷322.97±7.08165.36±0.662.48±01.89±0.046二甲花翠素-3-O-(6-O-乙酰化) -葡萄糖苷-5-O-葡萄糖苷7.82±0.642.49±0.02--7花青素-3-O-(6-O-咖啡酰化) -葡萄糖苷-5-O-葡萄糖苷1.25±0.010.48±0.13--8花翠素-3-O-(6-O-咖啡酰化) -葡萄糖苷-5-O-葡萄糖苷6.78±0.652.91±0.11--9花翠素-3-O-(6-O-香豆酰化) -葡萄糖苷-5-O-葡萄糖苷1.14±0.08---10甲基花青素-3-O-(6-O-香豆酰化) -葡萄糖苷-5-O-葡萄糖苷1.05±0.1---11甲基花翠素3-O -(6-O-香豆酰化)-葡萄糖苷-5-O-葡萄糖苷3.6±0.450.46±0.09--12二甲基花翠素3-O-(6-O-香豆酰化)-葡萄糖苷-5-O-葡萄糖苷30.77±1.6720.1±0.1--13花青素-3-O-葡萄糖苷 3.78±0.330.51±0.0421.86±1.4118.83±2.0314花翠素-3-O-葡萄糖苷 0.92±0.140.72±0.052.03±0.082.03±0.2615甲基花青素-3-O-葡萄糖苷 14.72±0.96.96±0.0426.72±0.5524.14±2.8816甲基花翠素-3-O-葡萄糖苷 3.22±0.722.93±0.0418.94±0.2317.01±0.9617二甲花翠素-3-O-葡萄糖苷81.56±0.3964.82±0.42263.04±0.43256.56±4.718花青素-3-O-(6-O-乙酰化)-葡萄糖苷 --9.04±0.198.79±0.6519花翠素-3-O-(6-O-乙酰化)-葡萄糖苷 --1.52±0.051.47±0.0820甲基花青素-3-O-(6-O-乙酰化)-葡萄糖苷 0.8±0.01-9.93±0.059.14±0.7221甲基花翠素-3-O-(6-O-乙酰化)-葡萄糖苷 -0.12±0.0110.83±0.229.93±0.7622二甲花翠素-3-O-(6-O-乙酰化)-葡萄糖苷3.78±0.321.1±0.04130.13±1.34123.91±4.623二甲花翠素-3-O-(6-O-咖啡酸)-葡萄糖苷--0.88±0.130.77±0.1124花青素-3-O-(6-O-香豆酰化)-葡萄糖苷 --0.96±0.170.81±0.225花翠素-3-O-(6-O-香豆酰化)-葡萄糖苷 --0.19±0.130.3±0.0626甲基花青素-3-O-(6-O-香豆酰化)-葡萄糖苷 --1.14±0.130.88±0.1827甲基花翠素-3-O-(6-O-香豆酰化)-葡萄糖苷 --2.99±0.462.44±0.4828二甲花翠素-3-O-(6-O-香豆酰化)-葡萄糖苷1.18±0.220.5±0.1528.01±1.6224.48±4.12
注:-表示未检出。

图4 黑珍珠与赤霞珠葡萄酒酰化花色苷的比例
Fig.4 The proportion of acetylated anthocyanins in Black Pearl and Cabernet Sauvignon
葡萄酒与氧气接触后,单体花色苷的变化情况与图3总花色苷的变化趋势大体一致,都呈现下降趋势。氧化6 d后,与赤霞珠葡萄酒相比(总花色苷下降5.24%,双糖花色苷下降33.3%,单糖花色苷下降5.06%),黑珍珠葡萄酒的花色苷总量减少54.78%,其中双糖花色苷降低59.10%,单糖花色苷降低29.39%,花色苷的降解率明显高于赤霞珠葡萄酒。黑珍珠和赤霞珠葡萄酒中双糖花色苷的降解率都显著高于单糖花色苷,这与葡萄酒中双糖花色苷易氧化降解并产生棕色物质[20-21]的报道一致,因此黑珍珠葡萄酒中高比例的双糖花色苷是导致氧化过程中花色苷含量迅速下降的重要原因。此外,酰化率较低也是黑珍珠颜色不稳定的原因之一,经过氧化黑珍珠葡萄酒未酰化双糖花色苷的占比由78.56%下降至69.59%,而酰化双糖花色苷的占比略有上升,由6.91%上升至7.73%。
3 讨论
取代基、糖苷化和酰化等结构是影响单体花色苷稳定性的重要因素。其中,双糖苷取代可以抑制查尔酮形式花色苷开环裂解成醛和酚酸,因此,模拟葡萄酒[22]和花色苷的提取液[23]中双糖花色苷的稳定性高于单糖花色苷,然而在葡萄酒中双糖花色苷容易与酒中的物质发生褐化反应,加速葡萄酒颜色的老化,但该双糖花色苷氧化物的具体结构尚不清晰[5, 21]。
在葡萄酒与氧气的接触过程中,单体花色苷易与葡萄酒中的黄烷-3-醇等多酚类物质反应,形成聚合花色苷[12, 24],除Portisin型以外的吡喃花色苷为橙红色,非吡喃聚合花色苷大多表现出紫红色的色调[25],稳定性均显著高于相应的单体花色苷。本研究中,赤霞珠的总花色苷下降,但红色色调上升,可能正是因为生成了聚合花色苷。然而,黑珍珠葡萄酒中存在的大量双糖花色苷由于5号碳位被糖苷取代,不仅无法环化形成吡喃花色苷,也极大的降低了非吡喃花色苷的聚合效率[26],因此,双糖花色苷在葡萄酒中难以形成稳定的聚合花色苷也是其稳定性弱于单糖花色苷的重要原因。然而,根据本试验结果,单糖花色苷在黑珍珠葡萄酒中的降解率也高于赤霞珠葡萄酒,这可能是因为双糖花色苷的降解产物具有强还原性[27],加速了单糖花色苷的氧化。
酰化也是影响花色苷稳定性的重要因素,酰化花色苷可以形成分子内辅色(intramolecular copigmentation)和自缔合(self-association),保护花色苷的烊盐离子免受亲核攻击[28]。由于葡萄品种和葡萄生长环境等因素的影响,欧亚种葡萄中花色苷的酰化率分布在0%~53.5%[29-30]。LAGO-VANZELA等[31]发现巴西杂交葡萄品种Violeta含有大量香豆酰化双糖花色苷(非酰化双糖花色苷1 146.45 mg/L和对香豆酰化双糖花色苷408.87 mg/L,酰化率26.24%),在25 ℃和35 ℃下陈酿120 d,表现出较好的颜色稳定性[31]。本研究发现,赤霞珠葡萄酒中花色苷的总酰化率高达36.8%,而黑珍珠葡萄酒只有7.67%,因此花色苷的酰化率较低可能也是导致黑珍珠葡萄酒颜色不稳定的因素之一。
针对非欧亚种葡萄双糖花色苷含量高,颜色不稳定的问题,主要的改良思路有:a)与欧亚种葡萄杂交,降低5-O-葡萄糖苷酶的表达量,从而减少杂交葡萄中双糖花色苷的比例[32];b)修饰双糖花色苷的结构,添加黄烷-3-醇或酚酸,与双糖花色苷形成辅色[11]和酰化作用[31, 33],在结构上增强其稳定性。然而,采用杂交育种的方法周期长,对葡萄酒花色苷组成的改良作用有限;而采用化学方法修饰,目前仅在模拟体系中进行试验,尚未应用于葡萄酒体系中,关于提高双糖苷稳定性的方法仍有待进一步探索。
4 结论
本研究对氧化过程中葡萄酒的颜色和花色苷组成进行分析,结果表明,与赤霞珠葡萄酒相比,黑珍珠葡萄酒的颜色衰退迅速,在较短时间内葡萄酒红色色调减弱,黄色色调上升,色差值变化速度明显快于赤霞珠葡萄酒。这可能是因为赤霞珠葡萄酒中花色苷主要以单糖苷取代的形式存在,且36.8%的花色苷发生酰化作用;而黑珍珠葡萄酒中单糖花色苷仅占14.53%,葡萄酒颜色主要由未酰化的双糖花色苷提供,鉴于未酰化双糖花色苷易氧化的特点,导致黑珍珠葡萄酒花色苷的降解和颜色的衰退。本研究为葡萄酒中双糖花色苷易发生褐化反应而降低葡萄酒的陈酿潜力,提供了进一步的试验依据;同时也为黑珍珠葡萄酒的开发和颜色品质的改良奠定了基础。
[1] ESCRIBANO-BAIL N M T, RIVAS-GONZALO J C, GARC
N M T, RIVAS-GONZALO J C, GARC A-ESTÉVEZ I. Wine Color Evolution and Stability[M]//Red Wine Technology. Amsterdam: Elsevier, 2019:195-205.
A-ESTÉVEZ I. Wine Color Evolution and Stability[M]//Red Wine Technology. Amsterdam: Elsevier, 2019:195-205.
[2] YANG Y Z, LABATE J A, LIANG Z C, et al.Multiple loss-of-function 5-O-glucosyltransferase alleles revealed in Vitis vinifera, but not in other Vitis species[J].Theoretical and Applied Genetics, 2014, 127(11):2433-2451.
[3] ZHAO Q, DUAN C Q, WANG J.Anthocyanins profile of grape berries of Vitis amurensis, its hybrids and their wines[J].International Journal of Molecular Sciences, 2010,11(5):2212-2228.
[4] LIANG Z C, WU B H, FAN P G, et al.Anthocyanin composition and content in grape berry skin in Vitis germplasm[J].Food Chemistry, 2008, 111(4):837-844.
[5] YUZUAK S, XIE D Y.Anthocyanins from muscadine (Vitis rotundifolia) grape fruit[J].Current Plant Biology, 2022, 30:100243.
[6] JU Y L, YANG L, YUE X F, et al.Anthocyanin profiles and color properties of red wines made from Vitis davidii and Vitis vinifera grapes[J].Food Science and Human Wellness, 2021, 10(3):335-344.
[7] 李贝贝, 张颖, 樊秀彩, 等.‘巴柯’和‘尼加拉’葡萄疑似同物异名品种的SSR及形态学分析[J].果树学报, 2019, 36(4):393-400.
LI B B, ZHANG Y, FAN X C, et al.Analysis of suspected synonyms of ‘Baco Noir’ and ‘Niagara’by SSR markers and morphology[J].Journal of Fruit Science, 2019, 36(4):393-400.
[8] HAN F L, JU Y L, RUAN X R, et al.Color, anthocyanin, and antioxidant characteristics of young wines produced from spine grapes (Vitis davidii Foex) in China[J].Food &Nutrition, 2017, 61(1):1339552.
[9] LI S Y, HE F, ZHU B Q, et al.Comparison of phenolic and chromatic characteristics of dry red wines made from native Chinese grape species and Vitis vinifera[J].International Journal of Food Properties, 2017, 20(9):2134-2146.
[10] 孙磊, 樊秀彩, 张颖, 等.部分中国野生葡萄果皮花色苷组分分析[J].果树学报, 2015, 32(6):1143-1151.
SUN L, FAN X C, ZHANG Y, et al.Analysis of anthocyanin composition in berry skin of Chinese wild grape[J].Journal of Fruit Science, 2015, 32(6):1143-1151.
[11] ZHAO X, ZHANG N, WU G F, et al.Intermolecular copigmentation between anthocyanidin-3, 5-O-diglucosides and three phenolic compounds:Insights from experimental and theoretical studies[J].Food Chemistry Advances, 2022, 1:100111.
[12] LIU Y, ZHANG X K, SHI Y, et al.Reaction kinetics of the acetaldehyde-mediated condensation between (-)-epicatechin and anthocyanins and their effects on the color in model wine solutions[J].Food Chemistry, 2019, 283:315-323.
[13] 李运奎, 韩富亮, 张予林, 等. 基于CIELAB色空间的红葡萄酒颜色直观表征[J].农业机械学报, 2017, 48(6):296-301.
LI Y K, HAN F L, ZHANG Y L, et al.Visualization for representation of red wine color based on CIELAB color space[J].Transactions of the Chinese society for Agricultural Machinery, 2017, 48(6):296-301.
[14] PÉREZ-CABALLERO V, AYALA F, ECH VARRI J F, et al.Proposal for a new standard OIV method for determination of chromatic characteristics of wine[J].American Journal of Enology and Viticulture, 2003, 54(1):59-62.
VARRI J F, et al.Proposal for a new standard OIV method for determination of chromatic characteristics of wine[J].American Journal of Enology and Viticulture, 2003, 54(1):59-62.
[15] 翦祎, 韩舜愈, 张波, 等.单一pH法、pH示差法和差减法快速测定干红葡萄酒中总花色苷含量的比较[J].食品工业科技, 2012, 33(23):323-325;423.
JIAN Y, HAN S Y, ZHANG B, et al.Comparison of single pH method,pH-differential method and substraction method for determining content of anthocyanins from red wine[J].Science and Technology of Food Industry, 2012, 33(23):323-325;423.
[16] LI S Y, HE F, ZHU B Q, et al.A systematic analysis strategy for accurate detection of anthocyanin pigments in red wines[J].Rapid Communications in Mass Spectrometry, 2016, 30(13):1619-1626.
[17] WU Z Q, LI X S, ZENG Y Y, et al.Color stability enhancement and antioxidation improvement of Sanhua plum wine under circulating ultrasound[J].Foods, 2022, 11(16):2435.
[18] XING R R, LI S Y, HE F, et al.Mass spectrometric and enzymatic evidence confirm the existence of anthocyanidin 3,5-O-diglucosides in cabernet sauvignon (Vitis vinifera L.) grape berries[J].Journal of Agricultural and Food Chemistry, 2015, 63(12):3251-3260.
[19] ![]() I, MUCALO A, LJUBENKOV I, et al.Anthocyanin profile of wild grape Vitis vinifera in the eastern Adriatic region[J].Scientia Horticulturae, 2018, 238:32-37.
I, MUCALO A, LJUBENKOV I, et al.Anthocyanin profile of wild grape Vitis vinifera in the eastern Adriatic region[J].Scientia Horticulturae, 2018, 238:32-37.
[20] TALCOTT S T, LEE J H.Ellagic acid and flavonoid antioxidant content of muscadine wine and juice[J].Journal of Agricultural and Food Chemistry, 2002, 50(11):3186-3192.
[21] HE F, LIANG N N, MU L, et al.Anthocyanins and their variation in red wines i.monomeric anthocyanins and their color expression[J].Molecules, 2012, 17(2):1571-1601.
[22] GARC A-VIGUERA C, BRIDLE P.Influence of structure on color stability of anthocyanins and flavylium salts with ascorbic acid[J].Food Chemistry, 1999, 64(1):21-26.
A-VIGUERA C, BRIDLE P.Influence of structure on color stability of anthocyanins and flavylium salts with ascorbic acid[J].Food Chemistry, 1999, 64(1):21-26.
[23] KIM M, YOON S H, JUNG M, et al.Stability of meoru (Vitis coignetiea) anthocyanins under photochemically produced singlet oxygen by riboflavin[J].New Biotechnology, 2010, 27(4):435-439.
[24] BERRUETA L A, RASINES-PEREA Z, PRIETO-PEREA N, et al.Formation and evolution profiles of anthocyanin derivatives and tannins during fermentations and aging of red wines[J].European Food Research and Technology, 2020, 246(1):149-165.
[25] PISSARRA J, MATEUS N, RIVAS-GONZALO J, et al.Reaction between malvidin 3-glucoside and (+)-catechin in model solutions containing different aldehydes[J].Journal of Food Science, 2003, 68(2):476-481.
[26] BURTCH C E, MANSFIELD A K, MANNS D C.Reaction kinetics of monomeric anthocyanin conversion to polymeric pigments and their significance to color in interspecific hybrid wines[J].Journal of Agricultural and Food Chemistry, 2017, 65(31):6379-6386.
[27] ELIAS R J, ANDERSEN M L, SKIBSTED L H, et al.Identification of free radical intermediates in oxidized wine using electron paramagnetic resonance spin trapping[J].Journal of Agricultural and Food Chemistry, 2009, 57(10):4359-4365.
[28] VIDANA GAMAGE G C, LIM Y Y, CHOO W S.Sources and relative stabilities of acylated and nonacylated anthocyanins in beverage systems[J].Journal of Food Science and Technology, 2022, 59(3):831-845.
[29] POMAR F, NOVO M, MASA A.Varietal differences among the anthocyanin profiles of 50 red table grape cultivars studied by high performance liquid chromatography[J].Journal of Chromatography A, 2005, 1094(1-2):34-41.
[30] ![]() I, RADEKA S,
I, RADEKA S, ![]() I, et al.Targeted UPLC-QqQ-MS/MS profiling of phenolic compounds for differentiation of monovarietal wines and corroboration of particular varietal typicity concepts[J].Food Chemistry, 2019, 300:125251.
I, et al.Targeted UPLC-QqQ-MS/MS profiling of phenolic compounds for differentiation of monovarietal wines and corroboration of particular varietal typicity concepts[J].Food Chemistry, 2019, 300:125251.
[31] LAGO-VANZELA E S, PROC PIO D P, FONTES E A F, et al.Aging of red wines made from hybrid grape cv.BRS Violeta:Effects of accelerated aging conditions on phenolic composition, color and antioxidant activity[J].Food Research International, 2014, 56:182-189.
PIO D P, FONTES E A F, et al.Aging of red wines made from hybrid grape cv.BRS Violeta:Effects of accelerated aging conditions on phenolic composition, color and antioxidant activity[J].Food Research International, 2014, 56:182-189.
[32] YANG Y, LABATE J A, LIANG Z, et al.Multiple loss-of-function 5-O-glucosyltransferase alleles revealed in Vitis vinifera, but not in other Vitis species[J].Theoretical and applied genetics, 2014, 127(1):2433-2451.
[33] LIU J N, ZHUANG Y H, HU Y H, et al.Improving the color stability and antioxidation activity of blueberry anthocyanins by enzymatic acylation with p-coumaric acid and caffeic acid[J].LWT, 2020, 130:109673.