木聚糖(xylan)是半纤维素的重要组成成分,是一种可再生生物资源[1-2]。由于木聚糖的复杂性,完全水解需要主链和侧基裂解酶的协同作用。木聚糖酶主要包括:内切β-1,4-木聚糖酶和β-木糖苷酶。其中内切-β-1,4-木聚糖酶是所有木聚糖酶中最重要的一种,能够水解木聚糖分子主链内部的β-1,4-糖苷键,随机切割生成木糖、低聚木糖和阿拉伯木聚糖等功能性还原糖[3-4]。目前为止,已有许多方法可提高酶的活性,通过对蛋白结构进行生物信息学分析,利用分子改造或化学修饰等方法,从而提高酶的活性[5]。研究发现,GH10、11、2、6、5、7、8、16、43、62家族的部分糖苷水解酶具有木聚糖酶活性,然而,根据催化特性、氨基酸序列以及空间结构不同,木聚糖酶主要分布于GH10和GH11家族[6]。近几年研究发现,GH43家族的木聚糖酶有较高的催化效率和底物选择性等。
木聚糖酶作为一种重要的工业酶制剂,在食品、造纸与饲料领域被广泛应用[7-9]。不同来源的木聚糖酶的酶学性质有所不同,研究发现天然存在的木聚糖酶极少可以兼具耐热性和高活性[10-13]。目前对于木聚糖酶的分子改造研究主要集中在对酶的耐热性改造方面。然而,大多数改造后的木聚糖酶在耐热性提高的同时伴随着活性的下降,这在一定程度上限制了耐热木聚糖酶在工业中的应用。因此,越来越多的研究者对木聚糖酶进行分子改造以期获得酶学性质优良的工业化木聚糖酶[14]。前期本实验室已从山东烟台近海区域分离得到麦氏交替单胞菌,并从该菌克隆出了GH43家族木聚糖酶基因XynZT-2(Genbank NO.:MT814836),酶学性质分析发现,该酶的酶活力较低,不利于后期的酶学特性研究。本研究旨在利用计算机辅助设计,将第49位点的氨基酸由Glu突变为Phe,以期获得酶活力提高的突变木聚糖酶,探讨该酶的催化分子机制,为后期催化活性分子改造奠定基础。
1 材料与方法
1.1 材料与试剂
麦氏交替单胞菌(Alteromonas macleodii)HY35由实验室保存,克隆宿主大肠杆菌(Escherichia coli)DH5α购自Novagen公司,表达宿主E.coli BL21(DE3)、质粒pET28a购于Invitrogen公司。
桦木木聚糖,Sigma公司;制性内切酶EcoRⅠ、Hind Ⅲ、E×Taq DNA聚合酶、T4DNA连接酶、DNA Marker,宝日医生物技术(北京)有限公司;异丙基-β-D-硫代半乳糖糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、卡那霉素,天津希恩思生化科技有限公司;SanPrep柱式DNA小量抽提试剂盒,上海生工生物工程有限公司;琼脂糖凝胶胶回收试剂盒,北京索莱宝科技有限公司;磷酸氢二钠-柠檬酸缓冲液(pH 3.0~5.0)、磷酸氢二钠-磷酸二氢钠缓冲液(pH 6.0~7.0),天津市德恩化学试剂有限公司;Tris-盐酸缓冲液(pH 8.0)、甘氨酸-氢氧化钠(pH 9.0),北京索莱宝科技有限公司。
1.2 突变位点的筛选
根据Alteromonas macleodii木聚糖酶XynZT-2基因序列,利用DNAMAN6.0及BLAST同源氨基酸序列比对分析XynZT-2,通过SWISS-MODEL(https://swissmodel.expasy.org/)进行三维结构建模。利用Discovery Studio 3.0软件的LibDock程序的默认参数将重组木聚糖酶与底物木三糖进行分子对接,并利用Discovery Studio 3.0和PyMOL(http://pymol.org/)分析木聚糖酶结构与底物之间的相互作用。
1.3 引物设计
送至苏州金唯智生物科技有限公司合成,如表1所示。
表1 定点突变的引物设计
Table 1 Design of primers for the site-specificed mutagenesis

引物名称引物序列(5′-3′)长度/bp酶切位点ZT-2-FGGAAGAATTCATGCCGGAGAAACAGT26EcoR ⅠZT-2-RCCCAAGAAGCTTTTATTCAACGCGGAC27Hind ⅢE49F-FATATCTTTGCCGGAATCCCG20E49F-RGGCAAAGATATCGTGGCTCG20
注:下划线为在xynZT-2基因序列中筛选的突变位点。
1.4 重组工程菌的构建
从麦氏交替单胞菌基因组克隆得到木聚糖酶基因xynZT-2,并以木聚糖酶基因xynZT-2为模板,利用重叠延伸PCR技术,PCR扩增条件:94 ℃预变性2 min;94 ℃变性30 s,52 ℃退火45 s,72 ℃延伸1 min;经30个循环后72 ℃延伸10 min。扩增产物由限制性内切酶EcoRⅠ和Hind Ⅲ酶切后与载体pET28a连接,转化至E.coli BL21(DE3),通过测序确定得到重组质粒pET28a-xynEF。
1.5 重组工程菌的诱导及表达
将重组菌BL21(DE3)/pET-28a-xynEF接种于3 mL LB抗性培养基中,37 ℃,220 r/min培养12 h,以1%的接种量转接至100 mL LB培养基,培养至菌浓度OD600值至0.6~0.8,加入0.4 mmol/L IPTG,24 ℃诱导12 h;诱导结束后离心(8 000 r/min,5 min),收集菌体,加入5 mL pH 6.0的磷酸氢二钠-磷酸二氢钠缓冲液悬浮菌体,通过细胞破碎法释放胞内物质,高速离心(8 000 r/min,20 min),上清液即为粗酶液。
1.6 重组木聚糖酶活力测定
将纯化所得的酶液稀释至0.5 mg/mL;二硝基水杨酸(dinitrosalicylic acid,DNS)法[15]测酶活力,取1.5 mL 0.5 mg/mL的桦木木聚糖底物与1 mL酶液在最适温度水浴中反应15 min。在pH 6.0磷酸氢二钠-磷酸二氢钠缓冲液的条件下,以1 min产生1 μmol木糖所需要的酶量定义为1个酶活力单位(U)。
1.7 蛋白纯化与SDS-PAGE
采用His TrapTM HP-5 mL对含His标签蛋白进行分离纯化[16]。将5×SDS蛋白上样缓冲液加入到处理好的酶液中,混匀后煮沸10 min,将其变性,8 000 r/min离心10 min,取上清液进行SDS-PAGE电泳检测,染色40 min,脱色至底色透明,观察蛋白条带。
1.8 木聚糖酶酶学性质测定
1.8.1 最适温度及温度稳定性
将纯化所得的酶液稀释至0.5 mg/mL;在35~80 ℃与底物反应15 min,分别测定突变酶与原酶的酶活力,以最高酶活力为100%,计算相对酶活力,以此得到突变酶与原酶的最适温度。将纯化后的酶液在最适温度保温0~60 min,每隔5 min取样,测定各个时间段保温后残余酶活力,以未保温酶的活力为100%,由此得到酶的热稳定性。
1.8.2 最适pH及pH稳定性
在最适温度的条件下,将0.5 mg/mL酶液与不同的pH 3~9缓冲液配制的木聚糖底物反应15 min,以不同pH的酶液为对照,测定酶活力后以最高者为100%,作pH与相对酶活力的曲线。将酶液与不同pH值的缓冲液混合使质量浓度为0.5 mg/mL于40 ℃保温60 min,在最适温度下测定残余酶活力,与不保温的酶活力比,计算出相对酶活力,得出pH稳定性。
1.9 动力学参数的测定
最适条件下测定木聚糖酶的酶活性,以不同质量浓度的木聚糖溶液(1.0~10.0 mg/mL)为底物,在pH 7.0的磷酸氢二钠-磷酸二氢钠缓冲液的条件下,通过Origin 2018软件进行非线性拟合,计算酶的kcat及kcat/Km值。
2 结果与分析
2.1 木聚糖酶XynZT-2同源建模及突变位点选择
将木聚糖酶XynZT-2的氨基酸序列提交至SWISS-MODEL同源建模。XynZT-2与来源于Xanthomonas citri的GH43家族木聚糖酶(PDB No.6xn0.1.A)模板之间的序列同源性为60.36%。XynZT-2预测模型的“GMQM”评分为0.85,“QMEAN”评分为-2.07,达到了高质量模型的标准[17]。由预测模型可知(图1),XynZT-2主要由5组β-折叠片层围绕中心轴腔形成桶状,属于GH43家族典型结构[18],其催化残基由Asp30、Asp150和Glu237构成(图1-a)。研究表明,底物进出口通道正面和背面的氨基酸残基进行疏水性取代可提高酶的催化活性[19],任蕊蕊等[20]将谷氨酰胺转氨酶TGase底物进出口通道背面的Glu300替换成疏水性的色氨酸(Trp),酶的催化活性明显提高。结合以上报道,通过分析XynZT-2结构发现,Glu49位于底物进出口通道的背面,且其空间邻近区域有以小的α-螺旋结构,刚性较强,不利于底物的进出(图1-b)。因此,尝试将Glu49突变成疏水性氨基酸Phe,以分析其对酶活性的影响。

图1 木聚糖酶XynZT-2三维结构模型及其
催化活性口袋
Fig.1 Three-dimensional structure model of the xylanase XynZT-2 and its catalytic activity pocket
注:棒状结构表示氨基酸残基,表面溶剂区域表示催化活性口袋。
2.2 重组工程菌的构建
通过重叠延伸PCR方法获得目的基因(图2),将获得突变后的基因序列xynZT-2EF与载体pET28a进行双酶切,经T4 DNA连接酶连接,构建重组表达质粒。将重组质粒转化至E.coli BL21(DE3),通过抗性筛选,获得目的基因阳性克隆子BL21(DE3)/pET28a/xynEF。

M-Marker;a1-基因xynZT-2;b1~3-突变基因上段;b4~5-突变基因下段;c1-基因xynZT-2E49F
图2 突变基因片段
Fig.2 The fragments of the mutant gene
2.3 重组菌的验证与表达
从阳性克隆子提取重组质粒。将载体与突变酶重组质粒BL21(DE3)/pET28a和xynEF在37 ℃同时进行双酶切5 h,结果显示,在5 369 bp和1 029 bp处均有目的条带,测序验证正确且与突变后的序列一致,表明重组工程菌构建成功(图3-a)。
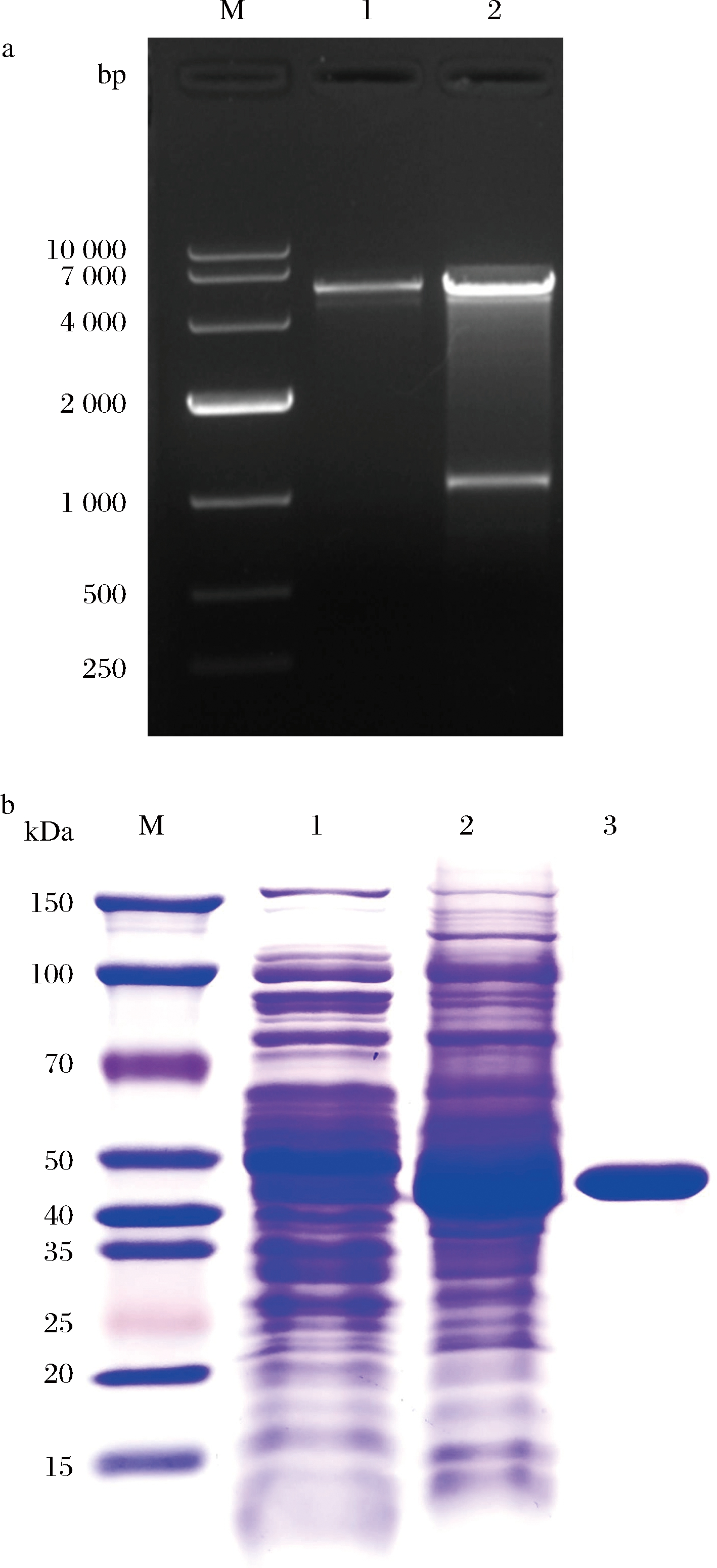
M-Marker;a1-pET28a质粒;a2-重组菌XynEF;b1-pET28a质粒;b2-BL21(DE3)/pET28a/XynEF粗酶液;b3-BL21(DE3)/pET28a/XynEF纯酶液
图3 双酶切验证及SDS-PAGE凝胶电泳检测
Fig.3 Identified by restriction enzyme digestion and the SDS-PAGE gel electrophoresis
将粗酶液进行蛋白纯化,通过SDS-PAGE凝胶电泳结果显示,在大约42 kDa出现目的条带,与该酶预测分子质量38.9 kDa相接近。该结果表明重组木聚糖酶蛋白成功表达(图3-b)。
2.4 酶学性质分析
2.4.1 温度稳定性与酶活性的分析
原酶XynZT-2与突变酶XynEF都呈现出先升高后降低的趋势。原酶XynZT-2最适温度为45 ℃,与原酶相比突变酶XynEF的最适温度提高了25 ℃,当温度达到70 ℃以上时相对酶活力明显降低,温度升高至80 ℃后相对酶活力降低至20%以下(图4-a)。在60 ℃保温60 min,原酶XynZT-2相对酶活力损失在20%左右,突变酶XynEF相对酶活力损失在40%左右。由此可见,突变酶XynEF的热稳定性明显低于原酶XynZT-2。另外,原酶XynZT-2与突变酶XynEF在保温10 min后,热稳定性迅速下降,相对酶活力分别下降到79.65%和64.75%,之后逐渐趋向平衡,热稳定性没有明显变化(图4-b)。推测可能是原酶XynZT-2与突变酶XynEF热处理时,一开始酶分子对温度较为敏感,结构发生明显变化,酶热稳定性下降速度快。随着热处理时间的延长,酶分子结构趋于稳定,导致热稳定性变化不太明显。

a-酶的最适温度;b-酶的温度稳定性;c-酶温度的稳定性实验的酶活力变化
图4 温度对酶活力及稳定性的影响
Fig.4 Effect of temperature on the enzyme activities and stabilities
在各自最适温度下测定原酶和突变酶的酶活力发现,原酶XynZT-2的酶活力为0.083 U/mL,突变酶XynEF的为0.530 U/mL,相比原酶XynZT-2提高了6.4倍。另外,在60 ℃保温60 min,比酶活力的下降趋势与热稳定性基本保持一致。在保温60 min后,原酶XynZT-2仅保留0.065 U/mL的酶活力,而突变酶XynEF仍保留高于原酶5倍的酶活力(0.324 U/mL)(图4-c)。由此可见,E49F突变使得突变酶XynEF的热稳定性下降,而突变酶XynEF的最适温度和酶活力明显提高。
2.4.2 最适pH与pH稳定性的分析
原酶XynZT-2最适pH值为6.0,突变酶XynEF最适pH值为7.0,因此,木聚糖酶在最适pH值方面上升了1个pH单位(图5-a)。突变酶XynEF在pH 3.0~5.0时相对酶活力低于20%;在pH 6.0~9.0时,与原酶XynZT-2相比突变酶XynEF相对酶活力没有显著下降。在pH 3.0~6.0的稳定性与原酶XynZT-2相比,可知突变酶XynEF的相对酶活力降低了37%;在pH 7.0~8.0相对酶活力大于80%且略高于原酶XynZT-2(图5-b)。由此可以得出,该突变对木聚糖酶XynEF pH稳定性没有明显改善。
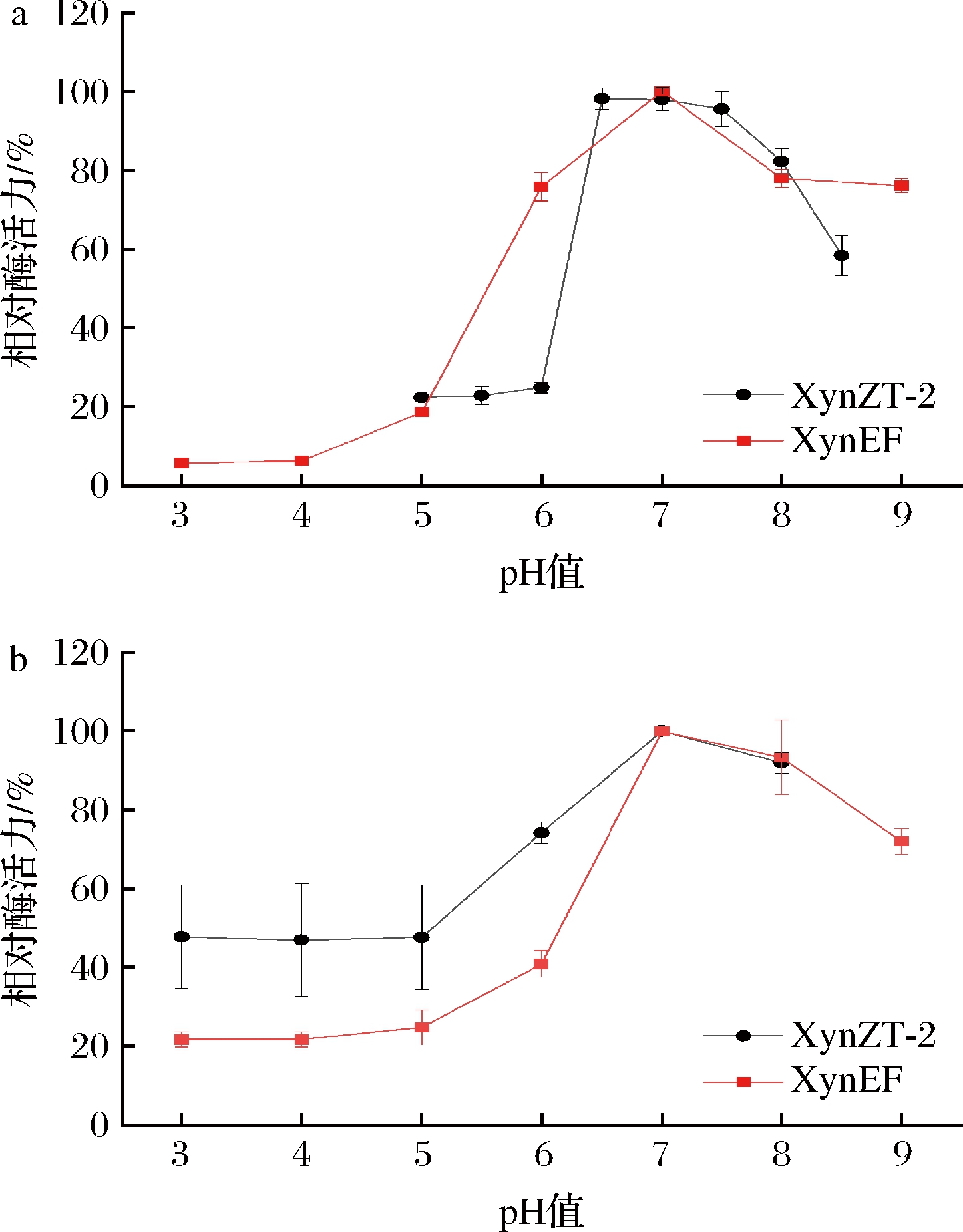
a-最适pH;b-酶的pH稳定性
图5 pH对酶活力及稳定性的影响
Fig.5 Effect of pH on the enzyme activities and stabilities
2.4.3 酶动力学分析
XynZT-2与XynEF的动力学参数如表2所示。突变酶的Km值为1.078 mmol/L,相比原酶(15.120 mmol/L)明显下降,由此表明,突变酶对底物的亲和力增强。突变酶的催化效率kcat/Km值为115.636 L/(mmol·min),原酶的催化效率值kcat/Km为11.446 L/(mmol·min)。突变酶的kcat/Km值相比原酶提高了10.1倍,催化效率明显提高。
表2 木聚糖酶的动力学分析
Table 2 Dynamics analysis of the xylanases
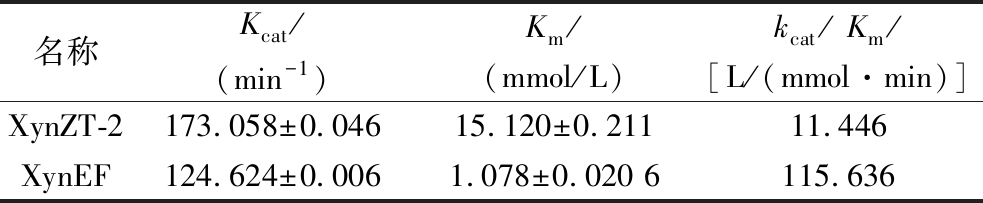
名称Kcat/(min-1)Km/(mmol/L)kcat/ Km/[L/(mmol·min)]XynZT-2173.058±0.04615.120±0.21111.446XynEF124.624±0.0061.078±0.020 6115.636
2.5 催化效率和稳定性机制分析
针对突变酶XynEF酶活力提高的原因进行分析,以原酶XynZT-2的空间模型为模板,利用SWISS-MODE同源建模。所构建的XynEF模型“GMQM”评分为0.89,“QMEAN”评分为-1.79,同样达到高质量模型的标准。分析原酶XynZT-2和突变酶XynEF结构发现,在原酶XynZT-2中的Glu49与周围氨基酸残基没有发生相互作用(图6-a)。而在突变酶XynEF的结构模型中,由于第49位点谷氨酸(Glu)突变为苯丙氨酸(Phe),Phe49与空间邻近氨基酸Pro53和Leu314分别形成疏水作用(图6-b),稳定了Phe49与周围残基的局部结构。同时,由于E49F突变,使得第49位点邻近区域的小片段α-螺旋变短,由原酶的6个氨基酸残基(50-AGIPFN-55)变为3个氨基酸残基(51-GIP-53),而相应的第49位点所在的Loop结构变长,柔韧性增强。

a-XynZT-2三维结构;b-XynEF三维结构
图6 重组木聚糖酶XynZT-2与突变酶XynEF结构分析
Fig.6 Structural analysis of the recombinant XynZT-2 and the mutant XynEF
注:棒状结构表示氨基酸残基,紫色虚线表示疏水作用,黄色方框表示突变位点空间邻近结构。
结构分析发现,第49位点所在的Loop区域位于酶催化活性口袋的进出通道。研究表明,酶的进出通道的柔韧性改变会影响酶的催化活力[21]。为分析突变酶XynEF酶活力提高的原因,利用Discovery Studio 3.0软件,以木三糖为模式底物与原酶XynZT-2和突变酶XynEF分别进行分子对接。底物木三糖无法与原酶XynZT-2的催化活性口袋结合,推测可能是原酶XynZT-2底物进出口通道较窄,同时通道口α-螺旋刚性较强、灵活性低,底物无法进入所致。这可能也是原酶XynZT-2酶活力较低的原因。突变酶XynEF可与底物木三糖有效结合,结果如图7所示,底物平躺在催化口袋内部,3个催化残基Asp30、Asp150和Glu237邻近木三糖分子,Asp150和Glu237与底物木三糖形成氢键,Asp30没有直接和木三糖形成氢键,而是通过水分子与木三糖间接形成氢键,以氢键形式实现质子或电子在催化残基和木三糖分子间的传递(图7-a)。同时,底物木三糖与催化口袋内的Ala99、Arg315、Thr286以及周围水分子形成氢键,稳定底物木三糖的结合构象,从而有利于电子和质子的传递,促进酶的催化效率(图7-b)。

图7 突变酶XynEF与木三糖分子对接结果
Fig.7 Molecular docking results of the mutant XynEF with xylotriose
注:图a中紫色棒状结构表示木三糖分子,线性结构表示氨基酸残基,橙色虚线表示氢键,绿色球状表示水分子。
3 讨论
在工业应用方面对酶的活性要求较高,需要通过蛋白质工程对酶进行改造。定点突变是酶改造的常用方法,该方法通过比较该酶的氨基酸序列,改变一个或多个氨基酸位点,从而改变酶的性质。通过针对性地改变一个或多个氨基酸位点,避免不必要的氨基酸突变,对突变结果也更具准确性和高效性[22-23]。目前,已有很多研究者通过对木聚糖酶进行分子改造并取得了一定的成果,但仍未能达到工业化的水平,因此改善木聚糖酶催化特性研究还有待进行。
本研究Alteromonas macleodii木聚糖酶xynZT-2基因,通过大肠杆菌实现了高效表达。利用同源建模及酶底物进出通道、催化活性口袋分析,识别了影响木聚糖酶XynZT-2催化活性的关键氨基酸残基Glu49,通过定点突变,构建例如突变酶XynEF。分析酶学特性发现,突变酶XynEF的最适温度为70 ℃,相比原酶提高了25 ℃;在60 ℃保温60 min,测定热稳定性发现,突变酶的热稳定性明显低于原酶,这可能是由于突变酶中突变残基Phe49邻近区域的小片段α-螺旋变短,Loop结构变长,酶的柔性增加,结构稳定性降低所致。在最适温度下,突变酶的酶活力相比原酶提高了6.4倍,酶活力明显改善。突变酶的Km值相比原酶明显下降,对底物的亲和力增强,且突变酶的kcat/Km值相比原酶提高了10.1倍,催化效率明显提高。通过分子对接分析发现,原酶酶活力较低可能是因为底物难以在催化活性口袋有效结合所致,而E49F突变导致突变酶的进出通道口发生改变,使得底物较易通过通道口在催化活性口袋内催化还原,从而提高了酶的活力和催化效率。本研究通过计算机模拟以及定点突变等技术获得了催化性能明显改善的突变木聚糖酶XynEF,丰富了GH43家族木聚糖酶的催化分子机制,并为GH43家族木聚糖酶分子改造研究提供了基础。
[1] LONG L F, ZHANG Y B, REN H Y, et al.Recombinant expression of Aspergillus niger GH10 endo-xylanase in Pichia pastoris by constructing a double-plasmid co-expression system[J].Journal of Chemical Technology &Biotechnology, 2020, 95(3):535-543.
[2] TILL M, GOLDSTONE D, CARD G, et al.Structural analysis of the GH43 enzyme Xsa43E from Butyrivibrio proteoclasticus[J].Acta Crystallographica, Section F, Structural Biology Communications, 2014, 70(Pt9):1193-1198.
[3] NOROUZI S, BIRGANI N H, MAGHAMI P, et al.Improvement of PersiXyn2 activity and stability in presence of trehalose and proline as a natural osmolyte[J].International Journal of Biological Macromolecules, 2020, 163:348-357.
[4] 刘国锋. 大肠杆菌工程菌产木聚糖酶工艺优化及酶学性质研究[J].食品与机械, 2018, 34(2):25-30.
LIU G F.Study on technology and enzymatic property of xylanase produced from engineered Escherichia coli[J].Food and Machinery, 2018, 34(2):25-30.
[5] 张燕青, 张超群, 王浩猛.木聚糖酶的分子改造方法及其工业应用研究现状[J].中国酿造, 2018, 37(1):25-29.
ZHANG Y Q, ZHANG C Q, WANG H M.Research status of xylanase molecular modification and industrial application[J].China Brewing, 2018, 37(1):25-29.
[6] DILEEPA M S, EUNYOUNG J, AMARIN H S, et al.Characterization of glycoside hydrolase family 11 xylanase from Streptomyces sp.strain J103;its synergetic effect with acetyl xylan esterase and enhancement of enzymatic hydrolysis of lignocellulosic biomass[J].Microbial Cell Factories, 2021, 20(1):129.
[7] KONG H Y, JIANG X, WANG Y, et al.Fusion expression of β-mannanaseman5A and xylanase Tlxyn11B in Pichia pastoris[J].Chinese Journal of Biotechnology, 2020, 36(9):1849-1858.
[8] YANG S, YANG B, DUAN C, et al.Applications of enzymatic technologies to the production of high-quality dissolving pulp:A review[J].Bioresource Technology, 2019, 281:440-448.
[9] 任春霖, 董红丽, 王风芹, 等.低聚木糖生产技术及其对动物益生作用研究进展[J].食品与发酵工业, 2021, 47(9):293-298.
REN C L, DONG H L, WANG F Q, et al.Research progress of xylooligosaccharides production technology and its prebiotic effect on animals[J].Food and Fermentation Industries, 2021, 47(9):293-298.
[10] 李青飞, 刘越, 言行, 等.高温木聚糖酶Pthxyn酶学性质及其在啤酒酿造中的应用[J].食品科学, 2023,44(10): 181-187.
LI Q F, LIU Y, YAN X, et al.Enzymatic properties of thermophilic xylanase Pthxyn and its application in beer brewing[J].Food Science, 2023,44(10): 181-187.
[11] CAYETANO-CRUZ M, CARO-G MEZ L A, PLASCENCIA-ESPINOSA M, et al.Effect of the single mutation N9Y on the catalytical properties of xylanase Xyn11A from Cellulomonas uda:A biochemical and molecular dynamic simulation analysis[J].Bioscience, Biotechnology, and Biochemistry, 2021, 85(9):1971-1985.
MEZ L A, PLASCENCIA-ESPINOSA M, et al.Effect of the single mutation N9Y on the catalytical properties of xylanase Xyn11A from Cellulomonas uda:A biochemical and molecular dynamic simulation analysis[J].Bioscience, Biotechnology, and Biochemistry, 2021, 85(9):1971-1985.
[12] SUZUKI M, TAKITA T, KUWATA K, et al.Insight into the mechanism of thermostabilization of GH10 xylanase from Bacillus sp.strain TAR-1 by the mutation of S92 to E[J].Bioscience, Biotechnology, and Biochemistry, 2021, 85(2):386-390.
[13] ZHENG H C, LIU Y H, SUN M Z, et al.Improvement of alkali stability and thermostability of Paenibacillus campinasensis Family-11 xylanase by directed evolution and site-directed mutagenesis[J].Journal of Industrial Microbiology &Biotechnology, 2014, 41(1):153-162.
[14] 李秀婷, 朱唯嘉, 吴秋华, 等.二硫键影响GH11木聚糖酶稳定性研究进展[J].食品科学技术学报, 2022, 40(5):14-27.
LI X T, ZHU W J, WU Q H, et al. Research progress on the effect of disulfide bonds on the stability of GH11 xylanase[J]. Journal of Food Science and Technology, 2022, 40(5):14-27.
[15] SAMBROOK J,RUSSELL D W.分子克隆实验指南[M]. 黄培堂等译. 北京: 科学出版社, 2002: 622-666.
SAMBROOK J,RUSSELL D W. Guidelines for Molecular Cloning Experiments[M]. HUANG P T translate. The third edition. Beijing: Science Press, 2002: 622-666.
[16] ZOUARI AYADI D, HMIDA SAYARI A, BEN HLIMA H, et al.Improvement of Trichoderma reesei xylanase Ⅱ thermal stability by serine to threonine surface mutations[J].International Journal of Biological Macromolecules, 2015, 72:163-170.
[17] BIASINI M, BIENERT S, WATERHOUSE A, et al.SWISS-MODEL:Modelling protein tertiary and quaternary structure using evolutionary information[J].Nucleic Acids Research, 2014, 42(W1):W252-W258.
[18] MROUEH M, ARUANNO M, BORNE R, et al.The xyl-doc gene cluster of Ruminiclostridium cellulolyticum encodes GH43- and GH62-α-l-arabinofuranosidases with complementary modes of action[J].Biotechnology for Biofuels, 2019, 12:144.
[19] YOKOYAMA K, UTSUMI H, NAKAMURA T, et al.Screening for improved activity of a transglutaminase from Streptomyces mobaraensis created by a novel rational mutagenesis and random mutagenesis[J].Applied Microbiology and Biotechnology, 2010, 87(6):2087-2096.
[20] 任蕊蕊, 刘松, 李江华, 等.分子改造提高谷氨酰胺转氨酶的催化活性[J].食品与发酵工业, 2018, 44(9):9-14.
REN R R, LIU S, LI J H, et al.Improved catalytic activity of transglutaminase through molecular modification[J].Food and Fermentation Industries, 2018, 44(9):9-14.
[21] NOEY E L, TIBREWAL N, JIMÉNEZ-OSÉS G, et al.Origins of stereoselectivity in evolved ketoreductases[J].Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(51):E7065-E7072.
[22] ZHANG X, LI W, PAN L X, et al.Improving the thermostability of alginate lyase FlAlyA with high expression by computer-aided rational design for industrial preparation of alginate oligosaccharides[J].Frontiers in Bioengineering and Biotechnology, 2022, 10:1011273.
[23] LIU Z Z, WANG Y F, LIU S H, et al.Boosting the heterologous expression of d-allulose 3-epimerase in Bacillus subtilis through protein engineering and catabolite-responsive element box engineering[J].Journal of Agricultural and Food Chemistry, 2022, 70(38):12128-12134.