黄酒采用“双边发酵”工艺酿造而成,因酒体柔和、口感醇厚且营养丰富而受到众多消费者喜爱[1]。经过几千年的历史传承,我国形成了众多具有地域特色的黄酒品类。如使用麦曲发酵的浙江绍兴黄酒,具有澄黄清亮和醇厚鲜甜的特点[2];使用红曲与小曲共同发酵的福建红曲黄酒,具有色泽鲜红和醇厚香浓的特点[3];使用小曲发酵的湖北房县黄酒,具有甘冽爽净和米香浓郁的特点[4]。由此可见,除了地域环境和工艺的不同,这些黄酒的不同风格特征还源于用曲差异。通过提供所必须的菌系和酶系,酒曲直接影响了黄酒酒体风格的形成,这也就是所谓的“曲定酒型”[5]。
湖北地区虽以房县黄酒最为出名,但产自襄阳市的鹿头黄酒亦受到较多消费者的喜爱,其酿造用曲和工艺均与房县黄酒有较大区别。鹿头黄酒采用的是小曲和高温大曲共同发酵,讲究“两次下曲,三次发酵,地封贮存”,酒体芳香馥郁、绵柔甜美而回味带苦。由此可见,鹿头黄酒独特风格特征的形成与其酿造所使用的高温大曲有一定关联。鹿头黄酒酿造用高温大曲在培菌阶段并无“翻曲”工艺,因而其受到空间异质性的影响较大[6],不同位置的大曲所发生的褐变程度并不完全一致,位于大曲堆上部和下部的大曲通常呈黄色,而位于大曲堆中部的大曲通常呈黑色。不同颜色的高温大曲所酿造的黄酒酒体风格往往也存在差异,黑色高温大曲酿造出的黄酒酒体颜色偏红褐色,香气浓郁,但苦味较之黄色高温大曲酿造出的黄酒更加突出,这或许和不同颜色高温大曲所富集的微生物类群不同有关[7]。在鹿头黄酒的实际生产过程中两类高温大曲往往会混合使用,二者的投入比例通常根据酿酒师的经验而定。然而,目前有关鹿头黄酒酿造用高温大曲的微生物类群及其感官特性等相关研究还鲜见报道。以Illumina MiSeq为代表的第二代高通量测序技术是目前食品微生物学研究中相对成熟和广泛应用的技术手段,其不仅可以研究发酵食品中微生物类群的组成、结构和动态,还可用于探索复杂微生物群落与样本质量的关系[8]。相较于复杂的色谱分析,电子鼻和电子舌具有简单快速、无损和无污染的特点,被认为是耗时且昂贵的经典分析技术的替代方案,已被广泛应用于制药和食品行业[9]。
本研究首先采用MiSeq高通量测序技术对黑色和黄色高温大曲的细菌类群结构及其基因功能进行解析,再结合电子鼻和电子舌对其感官特性进行分析,并探究两类酒曲的差异性,最后将细菌类群与感官特性展开关联性分析,以期揭示鹿头黄酒酿造用高温大曲的微生物群系及感官特征,为后续鹿头黄酒的工艺改良和品质提升提供一定的理论参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
高温大曲:于2021年8月在湖北省襄阳市枣阳市某黄酒生产企业采集黑色高温大曲(简称黑曲)和黄色高温大曲(简称黄曲)样品各10份,黑曲编号为B1~B10,黄曲编号为Y1~Y10,共计20份。所有高温大曲样品均为该黄酒生产企业自制,以整粒小麦主要原料,同时辅有益母草(Leonurus japonicus)、青蒿(Artemisia apiacea Hance)、红花(Carthamus tinctorius L.)、茜草(Rubia cordifolin Linn.)、当归(Angelica sinensis Diels)、陈皮(Pericarpium citri Reticulatae)和辣蓼草(Polygonum hydropiper L.)等中药材,采集的样品被装入无菌采样袋中常温下运回实验室,回到实验室后使用打粉机将样品打成粉状并装入自封袋中置于-40 ℃备用。
1.1.2 试剂
DNeasy mericon Food Kit DNA基因组提取试剂盒,德国QIAGEN公司;Axygen清洁试剂盒,康宁生命科学吴江有限公司;Buffer、dNTP缓冲液、rTaq聚合酶和正/反向引物338F/806R(338F:5′-ACTCCTACGGGAGGCAGCA-3′;806R:5′-GGACTACHVGGGTWTCTAAT-3′),上海桑尼生物科技有限公司;Illumina MiSeq测序试剂盒v3,美国Illumina公司;阴离子溶液、阳离子溶液、内溶液和参比溶液,日本INSENT公司。
1.2 仪器与设备
164-5050基础电泳仪,美国Bio-Rad公司;Vetiri梯度基因扩增仪,美国AB公司;MiSeq PE300高通量测序平台,美国Illumina公司;R930机架式服务器,美国DELL公司;PEN3电子鼻(配备10个传感器),德国Airsense公司;SA402B电子舌(配备5个传感器和2个参比电极),日本INSENT公司。
1.3 实验方法
1.3.1 宏基因组DNA提取、PCR扩增和高通量测序
每份样品均称取2.0 g进行宏基因组DNA提取,提取方法参照试剂盒说明。使用琼脂糖凝胶电泳对提取到的宏基因组DNA质量进行检测,质量检测合格的DNA用含有barcode(核苷酸标签)的引物338F/806R对细菌16S rRNA V3~V4区域进行PCR扩增,扩增成功的PCR产物被送至上海美吉生物医药科技有限公司完成测序。
1.3.2 序列质控和生物信息学分析
本研究采用QIIME平台(v1.9.0)进行生物信息学分析。首先参照郭壮的方法对下机数据进行质控[10],删除接头序列和barcode序列后根据双端关系将序列进行拼接和归并;剔除错配率≥0.2、引物碱基错配数≥2 bp或barcode碱基有错配的低质量序列;采用UCLUST两步法对有效序列按照100%和97%相似度构建分类操作单元(operational taxonomic units,OTU)[11],并对其进行嵌合体检查[12],选取代表性序列在数据库[13-15]中进行同源性比对并确立分类学地位;计算细菌类群的α多样性指数,基于OTU加权UniFrac距离解析鹿头黄酒酿造用黑色和黄色高温大曲细菌群落结构的β多样性;采用PICRUSt(phylogenetic investigation of communities by reconstruction of unobserved states)软件对高温大曲的细菌基因功能进行预测[16]。
1.3.3 基于电子鼻技术高温大曲的气味特征解析
称取7.0 g高温大曲样品置于电子鼻检测顶空瓶中,样品体积约占到顶空瓶体积的1/3左右,每份样品设置3组平行。将已装样的顶空瓶于25 ℃室温静置1 h达到平衡后进行顶空进样,进样条件:样品测试时间60 s,采样间隔1 s,清洗时间90 s,归零时间10 s,样品流速300 mL/min,内部流速300 mL/min[17]。后续选取第49、50、51 s时传感器响应值的平均值作为分析数据。
1.3.4 基于电子舌技术高温大曲的滋味特征解析
称取30.0 g高温大曲样品于250 mL烧杯中并加入120 mL纯水,搅拌均匀后转移至200 mL离心杯,10 000 r/min离心10 min,取上清液进行抽滤,收集到的滤液参照王玉荣的方法使用电子舌检测酸、苦、涩、咸、鲜、后味A(苦的回味)、后味B(涩的回味)和丰度(鲜的回味)8项滋味指标[18]。
1.3.5 数据处理
使用R(v4.1.0)软件绘制小提琴图、普氏分析图和相关性热图;采用Origin 2021软件绘制主坐标、柱形图和多因子箱型图;采用STAMP软件绘制不同类型高温大曲细菌蛋白质直系同源簇(clusters of orthologous groups of proteins,COG)功能差异图;使用Past3软件中的Mann-Whitney检验法进行差异性分析。
2 结果与分析
2.1 鹿头黄酒酿造用黑色和黄色高温大曲细菌类群α和β多样性分析
本研究首先计算了鹿头黄酒酿造用黑色和黄色高温大曲细菌类群的超1指数和香农指数,并进行了基于加权UniFrac距离的主坐标分析,同时计算了95%置信区间,如图1所示。

a-超1指数;b-香农指数;c-基于加权UniFrac距离的主坐标分析
图1 鹿头黄酒酿造用黑色和黄色高温大曲细菌α多样性和β多样性分析
Fig.1 Analysis of α-diversity and β-diversity of the bacterial taxa in black and yellow high-temperature Daqu for Lutou yellow rice wine brewing
注:超1指数和香农指数均在测序深度为34 010条序列时进行计算;**代表P<0.01,差异非常显著;NS代表P>0.05,差异不显著(下同)。
由图1-a和图1-b可知,黑色和黄色高温大曲细菌类群的平均超1指数分别为3 460和4 390,平均香农指数分别为6.56和7.20,其中黑色高温大曲的超1指数显著偏低(P<0.01),而香农指数两者差异不显著(P>0.05),这表明黑色高温大曲细菌的丰度要显著低于黄色高温大曲,但二者的多样性差异并不显著。由图1-c可知,黑色高温大曲的置信区间要明显大于黄色高温大曲,且大面积覆盖了黄色高温大曲的置信区间,但两者在空间排布中仍有明显的分离趋势。由此可见,鹿头黄酒酿造用黑色和黄色高温大曲的细菌群落结构存在明显差异,且黑色高温大曲细菌类群的组间差异偏大。值得关注的是,黑色高温大曲的细菌丰度显著偏低这一现象或许和导致它们形成不同颜色的机制有关,究其原因在于前期升温较快导致水分不足[19],从而抑制了部分菌群的生长繁殖。
2.2 鹿头黄酒酿造用黑色和黄色高温大曲细菌类群结构及其功能解析
20个鹿头黄酒酿造用高温大曲样品经过MiSeq高通量测序共得到942 742条序列,经过质量控制删除18 248条低质量序列,余下924 494条有效序列,按照97%序列相似度被划分为13 027个OTU。经序列同源性比对,20个高温大曲共鉴定到了30个门和632个属,优势细菌门(平均相对含量>1.0%)组成及其在样品中的分布情况见图2。
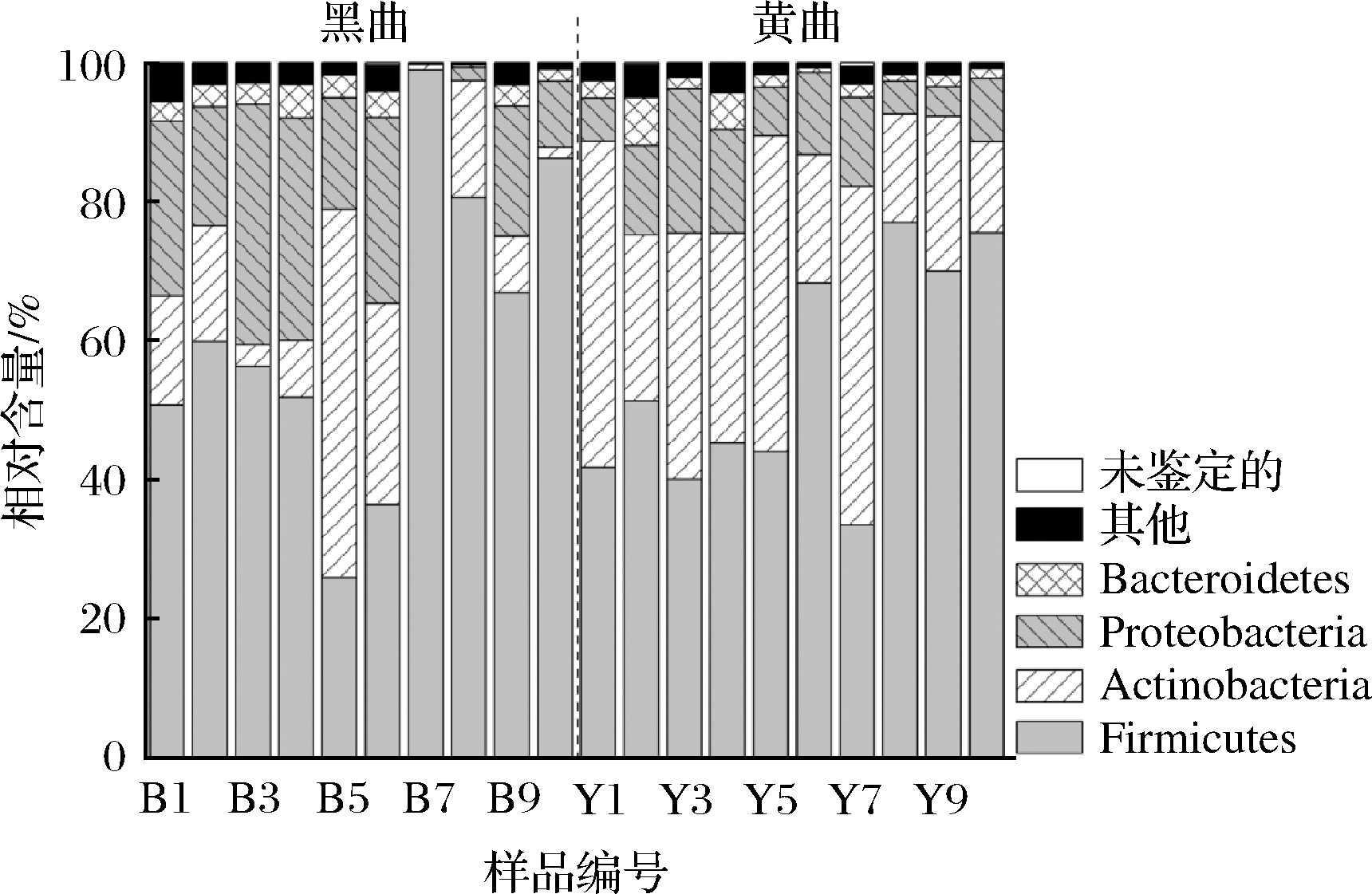
图2 鹿头黄酒酿造用黑色和黄色高温大曲优势细菌门及其相对含量
Fig.2 The dominant bacterial phylum and their relative content in black and yellow high-temperature Daqu for Lutou yellow rice wine brewing
由图2可知,所有鹿头黄酒酿造用高温大曲细菌共隶属于4个优势门,分别为硬壁菌门(Firmicutes,58.04%)、放线菌门(Actinobacteria,22.63%)、变形菌门(Proteobacteria,14.33%)和拟杆菌门(Bacteroidetes,2.54%)。通过Mann-Whitnay检验发现,黑色高温大曲中Actinobacteria的相对含量要显著偏低(P<0.05),平均相对含量为15.29%,而在黄色高温大曲中为29.98%。优势细菌属(平均相对含量>1.0%)的组成及其在各个样品中的分布情况见图3。

图3 鹿头黄酒酿造用黑色和黄色高温大曲优势细菌属及其相对含量
Fig.3 The dominant bacterial genera and their relative content in black and yellow high-temperature Daqu for Lutou yellow rice wine brewing
由图3可知,优势细菌属共有11个,分别为隶属于Firmicutes的乳酸杆菌属(Lactobacillus,28.04%)、高温放线菌属(Thermoactinomyces,10.73%)、芽孢杆菌属(Bacillus,4.67%)、葡萄球菌属(Staphylococcus,3.02%)、地芽孢杆菌属(Geobacillus,2.74%)和梭菌属(Clostridium,1.38%);隶属于Actinobacteria的糖多孢菌属(Saccharopolyspora,11.38%)和链霉菌属(Streptomyces,8.81%);隶属于Proteobacteria的不动杆菌属(Acinetobacter,2.01%)、代尔夫特菌属(Delftia,1.97%)和假单胞菌属(Pseudomonas,1.79%)。经Mann-Whitnay检验发现,黑色高温大曲中的Saccharopolyspora、Streptomyces和Bacillus相对含量均显著偏低(P<0.05),相对含量分别为7.50%、5.15%和2.20%,而在黄色高温大曲中分别为15.26%、12.46%和7.13%。
在解析鹿头黄酒酿造用高温大曲细菌群落结构差异的基础上,本研究进一步对其细菌基因功能进行了比较分析。所有序列通过注释被预测到4 792个COG,分别被归类到23个功能大类。除了一般功能和未知功能以外,黑色和黄色高温大曲中的细菌在氨基酸运输与代谢、碳水化合物运输与代谢以及转录功能上的表达量均较高,均超过8%,而黑曲和黄曲细菌在多数功能的表达量上表现出了一定的显著差异(P<0.05),见图4。

图4 鹿头黄酒酿造用黑色和黄色高温大曲细菌COG功能差异分析
Fig.4 Analysis of the functional differences between black and yellow high-temperature Daqu for Lutou yellow rice wine brewing
注:U-细胞内运输,分泌和囊泡运输;R-一般功能预测;K-转录;L-复制、重组和修复;P-无机离子运输与代谢;O-翻译后修饰,蛋白质周转,伴侣;B-染色质结构与动力学;M-细胞壁/膜/包膜生物发生;Q-次生代谢产物的合成、转运和分解代谢;A-RNA的加工与修饰;N-细胞运动;D-细胞周期控制、细胞分裂、染色体分割;J-翻译、核糖体结构与生物发生;G-碳水化合物运输和代谢。
由图4可知,经过Mann-Whitnay检验发现,黑色和黄色高温大曲中细菌类群在14个功能上存在显著差异,其中黑色高温大曲中细菌在U(细胞内运输,分泌和囊泡运输)、L(复制、重组和修复)、P(无机离子运输与代谢)、O(翻译后修饰,蛋白质周转,伴侣)、M(细胞壁/膜/包膜生物发生)、N(细胞运动)、D(细胞周期控制、细胞分裂、染色体分割)和J(翻译、核糖体结构与生物发生)功能上的表达量显著偏高(P<0.05),而在R(一般功能)、K(转录)、B(复制、重组和修复)、Q(次生代谢产物的合成)、A(RNA的加工与修饰)和G(碳水化合物运输和代谢)功能上的表达量要显著偏低(P<0.05)。由此可见,鹿头黄酒酿造用黑色和黄色高温大曲不仅细菌群落结构存在差异,其细菌类群的基因功能表达亦存在显著差异,而这种差异可能会对鹿头黄酒酒体品质的形成产生一定影响。
2.3 基于电子鼻和电子舌技术鹿头黄酒酿造用黑色和黄色高温大曲感官品质解析
高温发酵赋予了高温大曲特殊的风味,使曲中含有丰富的挥发性香气成分和呈味物质,奠定了酒体风味的基础[20],对其感官特性进行解析为后续了解鹿头黄酒风味的形成具有重要意义。因而,本研究采用电子鼻和电子舌分别对其气味和滋味特征进行了解析,其气味特征见图5。

图5 鹿头黄酒酿造用黑色和黄色高温大曲气味特征比较分析
Fig.5 Comparative analysis of odor characteristics of black and yellow high-temperature Daqu for Lutou yellow rice wine brewing
注:空心点代表平均值,实心点代表异常值; ***代表P<0.001,差异极显著;没有标注则代表差异不显著(P>0.05)(下同)。
由图5-a可知,虽然传感器W5S(对氢氧化物灵敏)、W1S(对甲烷类灵敏)、W1W(对有机硫化物、萜类物质灵敏)和W2S(对乙醇灵敏)对高温大曲的响应值比较高,但其在两类高温大曲间差异并不显著(P>0.05)。由图5-b亦可知,感器W1C(对芳香类物质灵敏)、W3C(对芳香类物质灵敏)和W5C(对芳香类物质灵敏)、W2W(对有机硫化物灵敏)和W3S(对烷烃类物质灵敏)响应值虽然比较低,但在两类高温大曲间差异显著(P<0.05),除W3S传感器外,其他4组传感器对黑色高温大曲的响应值均显著偏高(P<0.05)。由此可见,鹿头黄酒酿造用黑色和黄色高温大曲的气味差异主要体现在丰度较低的芳香类化合物上,且其含量在黑色高温大曲中明显偏高。
因传感器W2W对有机硫化物灵敏,这说明鹿头黄酒酿造用高温大曲中存在一定的挥发性硫化物,该物质是食品中常见的风味物质,在葡萄酒、白酒和啤酒中亦广泛存在[21]。有研究表明,美拉德反应是导致食品中产生硫化物的主要原因[22]。鹿头黄酒酿造用高温大曲在拌料阶段需添加40%左右的水,培菌时温度需达到60~70 ℃[23],适宜的水分和温度恰好为美拉德反应的发生提供了良好条件,从而使曲中产生了丰富的挥发性硫化物。基于电子舌技术鹿头黄酒酿造用高温大曲的滋味特征见图6。

图6 鹿头黄酒酿造用黑色和黄色高温大曲滋味特征比较分析
Fig.6 Comparative analysis of taste characteristics of black and yellow high-temperature Daqu for Lutou yellow rice wine brewing
注:*代表P<0.05,差异显著(下同)。
由图6可知,黑色高温大曲的酸味和涩味显著偏低(P<0.05),而咸味、鲜味和丰度(鲜的回味)显著偏高(P<0.05)。由此可见,鹿头黄酒酿造用黑色和黄色高温大曲的风味和滋味均存在较大差异。发酵食品中的香气成分和呈味物质大多由微生物降解原料产生,例如酯类、醇类、有机酸、氨基酸和苦味肽等[24-26],因而可以推断高温大曲优势菌群与感官特性是存在一定关联性的。
2.4 鹿头黄酒酿造用高温大曲优势菌群与感官特性的关联性分析
本研究进一步对微生物类群结构和感官特征之间的关联性进行了探讨,高温大曲优势细菌类群与感官特性间的普氏分析及两者相关性如图7所示。

a-普氏分析;b-相关性热图
图7 优势细菌类群与感官特性间的普氏分析和相关性热图
Fig.7 Procrustes analysis and correlation analysis between dominant bacterial taxa and sensory indicators
由图7-a可知,通过对原始数据进行降维,样品叠加分布在了一个低维空间中,本研究在此基础上对微生物类群结构和感官特性展开了普氏分析,分别计算了点坐标之间的M2值(偏差平方和)和显著性P值,结果表明高温大曲的细菌类群结构与其感官特性之间具有非常显著的关联性(P<0.01)。在赋予发酵体系酶系和菌系的同时,高温大曲在制曲过程中产生的代谢产物亦可对黄酒酒体的风味和滋味产生影响。鹿头黄酒酒体微苦且酸味较弱,因而本研究更为关注酒曲的酸味、苦味及后味A(苦的回味)。由图7-b可知,Lactobacillus与酒曲的后味A(苦的回味)呈显著负相关(P<0.05);Saccharopolyspora、Streptomyces和Bacillus均与酸味呈显著正相关(P<0.05),而Staphylococcus呈现出相反的趋势(P<0.01)。此外,鹿头黄酒酒体芳香馥郁,而传感器W1C、W3C和W5C主要对芳香成分比较敏感,但本研究并未发现上述传感器的响应值与某一细菌类群相对含量具有相关性(P>0.05)。
由图7-b亦可知,鹿头黄酒酿造用高温大曲细菌类群与滋味指标之间的关联性要明显高于其与气味指标之间的关联性,究其原因可能在于以下两点,一方面,制曲温度对酒曲中微生物的类群及其代谢产物具有重要影响,例如低温阶段时,霉菌、酵母和部分细菌大量富集并产生较多的酶和氨基酸等代谢产物,而这部分代谢产物可能对酒曲的滋味产生重要影响;另一方面,酒曲在低温阶段产生的代谢物在高温阶段会相互发生美拉德反应[27],从而产生有助于形成独特焦香风味的化合物[7],例如WANG等[28]在高温大曲中就发现了许多与美拉德反应产物相同的代谢产物,因而酒曲的气味一方面来源于微生物自身的代谢,但更多的可能是受到高温条件下的美拉德反应影响。
3 结论
鹿头黄酒酿造用黑色和黄色高温大曲的细菌类群存在明显差异。相较于黄色高温大曲来看,黑色高温大曲细菌类群的丰度、Saccharopolyspora、Streptomyces和Bacillus的相对含量、氨基酸运输与代谢功能、酸味和涩味明显偏低,而挥发性芳香类化合物含量、咸味、鲜味和丰度(鲜的回味)相对强度显著偏高。酿造用高温大曲优势菌群与其感官特性存在一定关联性,其中Lactobacillus与酒曲的后味A(苦的回味)呈显著负相关,Saccharopolyspora、Streptomyces和Bacillus均与酸味呈显著正相关,且细菌类群与滋味指标之间的关联性要明显高于其与气味指标之间的关联性。
[1] 陈双. 中国黄酒挥发性组分及香气特征研究[D].无锡:江南大学, 2013.
CHEN S.Study on volatile components and aroma characteristics of China yellow rice wine[D].Wuxi:Jiangnan University, 2013.
[2] 曹钰, 陆健, 方华, 等.绍兴黄酒麦曲中真菌多样性的研究[J].食品科学, 2008, 29(3):277-282.
CAO Y, LU J, FANG H, et al.Fungal diversity of wheat Qu of Shaoxing rice wine[J].Food Science, 2008, 29(3):277-282.
[3] 李路, 郭伟灵, 周文斌, 等.红曲和药白曲对红曲黄酒挥发性风味物质形成的影响[J].中国食品学报, 2020, 20(2):205-211.
LI L, GUO W L, ZHOU W B, et al.The effects of Hongqu and Baiqu on the formation of aroma components in Hongqu rice wine[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(2):205-211.
[4] 刘慧杰, 王娟, 王忠朝, 等.全二维气相色谱-质谱联用技术解析房县黄酒的挥发性成分[J].食品与发酵工业, 2022, 48(17):249-255.
LIU H J, WANG J, WANG Z C, et al.Analysis of volatile components in Fangxian yellow rice wine by full two-dimensional gas chromatography-mass spectrometry[J].Food and Fermentation Industries, 2022, 48(17):249-255.
[5] 王震, 叶宏, 朱婷婷, 等.清香型白酒风味成分的研究进展[J].食品科学, 2022, 43(7):232-244.
WANG Z, YE H, ZHU T T, et al.Progress in research on the flavor components of light-flavor Baijiu[J].Food Science, 2022, 43(7):232-244.
[6] SHI W, CHAI L J, FANG G Y, et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Research International, 2022, 156:111298.
[7] DENG L, MAO X, LIU D, et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Frontiers in Microbiology, 2020, 11:588117.
[8] HE G Q, LIU T J, SADIQ F A, et al.Insights into the microbial diversity and community dynamics of Chinese traditional fermented foods from using high-throughput sequencing approaches[J].Journal of Zhejiang University-SCIENCE B, 2017, 18(4):289-302.
[9] CHEN L L, NING F J, ZHAO L, et al.Quality assessment of royal jelly based on physicochemical properties and flavor profiles using HS-SPME-GC/MS combined with electronic nose and electronic tongue analyses[J].Food Chemistry, 2023, 403:134392.
[10] 向凡舒, 折米娜, 何萌, 等.基于DGGE和Illumina MiSeq技术解析恩施地区米酒细菌多样性[J].食品与发酵工业, 2019, 45(14):41-46;62.
XIANG F S, SHE M N, HE M, et al.Bacterial community in Enshi rice wines analyzed by DGGE and Illumina MiSeq high-throughput sequencing[J].Food and Fermentation Industries, 2019, 45(14):41-46;62.
[11] WEI Z G, ZHANG X D, CAO M, et al.Comparison of methods for picking the operational taxonomic units from amplicon sequences[J].Frontiers in Microbiology, 2021, 12:644012.
[12] POLLOCK J, GLENDINNING L, WISEDCHANWET T, et al.The madness of microbiome:Attempting to find consensus “best practice” for 16S microbiome studies[J].Applied and Environmental Microbiology, 2018, 84(7):1-12.
[13] MIODUCHOWSKA M, NITKIEWICZ B, ROSZKOWSKA M, et al.Taxonomic classification of the bacterial endosymbiont Wolbachia based on next-generation sequencing:Is there molecular evidence for its presence in tardigrades?[J].Genome, 2021, 64(10):951-958.
[14] BRANDT M I, TROUCHE B, QUINTRIC L, et al.Bioinformatic pipelines combining denoising and clustering tools allow for more comprehensive prokaryotic and eukaryotic metabarcoding[J].Molecular Ecology Resources, 2021, 21(6):1904-1921.
[15] ROBESON M S, O’ROURKE D R, KAEHLER B D, et al.RESCRIPt:Reproducible sequence taxonomy reference database management[J].PLoS Computational Biology, 2021, 17(11):e1009581.
[16] AGRAWAL S, KINH C T, SCHWARTZ T, et al.Determining uncertainties in PICRUSt analysis-An easy approach for autotrophic nitrogen removal[J].Biochemical Engineering Journal, 2019, 152(12):107328.
[17] HUANG M Z, LI T T, HARDIE W J, et al.Comparative characterization and sensory significance of volatile compounds in Rosa roxburghii Tratt fruit from five geographic locations in Guizhou, China[J].Flavour and Fragrance Journal, 2022, 37(3):163-180.
[18] 孙文佳, 方毅斐, 汪廷彩, 等.基于电子舌技术的豉香型白酒分类识别研究[J].中国酿造, 2020, 39(9):182-185.
SUN W J, FANG Y F, WANG T C, et al.Classification and recognition of Chi-flavor Baijiu based on electronic tongue technology[J].China Brewing, 2020, 39(9):182-185.
[19] GAN S H, YANG F, SAHU S K, et al.Deciphering the composition and functional profile of the microbial communities in Chinese Moutai liquor starters[J].Frontiers in Microbiology, 2019, 10(7):1540.
[20] 杨理章, 倪德让, 杨玉波, 等.液液微萃取结合气质联用技术分析高温大曲中风味物质[J].中国酿造, 2022, 41(8):223-228.
YANG L Z, NI D R, YANG Y B, et al.Analysis of flavor compounds in high-temperature Daqu by liquid-liquid microextraction combined with gas chromatography-mass spectrometry[J].China Brewing, 2022, 41(8):223-228.
[21] 程玉娇, 李贵节, 翟雨淋, 等.食品中挥发性硫化物的研究进展[J].食品与发酵工业, 2019, 45(4):229-235.
CHENG Y J, LI G J, ZHAI Y L, et al.Research progress on volatile sulfur compounds in foods[J].Food and Fermentation Industries, 2019, 45(4):229-235.
[22] REN G R, ZHAO L J, SUN Q, et al.Explore the reaction mechanism of the Maillard reaction:A density functional theory study[J].Journal of Molecular Modeling, 2015, 21(5):132.
[23] WANG Y R, CAI W C, WANG W P, et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Science &Nutrition, 2020, 9(2):1003-1016.
[24] WANG J, YUAN C J, GAO X L, et al.Characterization of key aroma compounds in Huangjiu from Northern China by sensory-directed flavor analysis[J].Food Research International, 2020, 134(8):109238.
[25] 许伟. 镇江香醋醋酸发酵过程微生物群落及其功能分析[D].无锡:江南大学, 2011:1-10.
XU W.Microbial community and its function analysis during acetic acid fermentation of Zhenjiang aromatic vinegar[D].Wuxi:Jiangnan University, 2011:1-10.
[26] SAWADA K, KOYANO H, YAMAMOTO N, et al.The relationships between microbiota and the amino acids and organic acids in commercial vegetable pickle fermented in rice-bran beds[J].Scientific Reports, 2021, 11:1791.
[27] MARTINS S I F S, JONGEN W M F, VAN BOEKEL M A J S.A review of Maillard reaction in food and implications to kinetic modelling[J].Trends in Food Science &Technology, 2000, 11(9-10):364-373.
[28] WANG W Y, LIU R L, SHEN Y, et al.The potential correlation between bacterial sporulation and the characteristic flavor of Chinese Maotai liquor[J].Frontiers in Microbiology,2018, 9(7):1435.