冷库是食品长期存放的主要制冷设备之一,其库内流场分布的均匀性对食品品质产生影响[1-2],通过计算流体力学(computational fluid dynamics,CFD)分析流场(温度、流速)分布能实现冻品所处的贮藏环境的可视化模拟。食品在不同堆码方式下冷库流场分布存在差异,合理的食品堆码能使库内流场分布均匀、减小货物表面的流速和温度波动[3],从而起到延缓食品腐败变质、降低冷库能耗的作用。
冷库由于空间规模大,传统实验难以准确获得冷库内的流场变化[4],因此大量国内外学者采用CFD对冷库内的流场进行了研究,通过建立物理数学模型、设定相关参数等模拟库内不同堆码方式导致的温度和气流分布变化规律,从而找到最佳的食品堆码方式,节省了大量人力、财力[5-6]。目前有关冷库内食品堆码方式对品质的研究仅在模拟阶段,孙海亭等[7]分析了苹果摆放方式对冷库内的流场影响,CHOURASIA等[8]通过数值模拟研究了不同堆码方式下马铃薯周围流场变化,结果发现与堆码宽度、体积相比,马铃薯的堆码高度对产品的冷却时间和冷却温度影响更大,胡耀华等[9]通过研究猕猴桃的堆码方式对冷库流场的影响,发现货箱堆码越密集,越不利于猕猴桃保鲜。上述的研究仅能对食品贮藏环境的流场进行描述,不能准确表示冷库内不同位置处的品质变化,缺乏实际货物受冷库流场变化引起的品质劣变规律研究,因此研究货物堆码方式对品质的影响有重要意义。
鲐鱼属于远洋暖水中上层的回游鱼类,是我国重要的经济鱼种之一,鲐鱼由于组氨酸含量较高,在捕捞后极易腐坏变质[10],因此鲐鱼通常在捕捞后立即进行保鲜处理,之后置于冷库内进行冻藏。在冷库冻藏过程中,鲐鱼受流场影响,鱼体内部冰晶升华、水分分布状态发生改变,鱼肉产生干耗、品质发生劣变。因此本文以鲐鱼为研究对象,分析了3种不同堆码方式下冷库的流场差异对鲐鱼贮藏品质的影响;实验通过测定3组鱼肉的理化指标(干耗率、蛋白变性、脂肪氧化、鱼肉微观组织结构和水分分布等)分析了不同位置处鱼肉品质随贮藏时间变化的差异,并对3组的理化指标进行了主成分分析。本研究旨在通过CFD分析不同堆码方式下的流场变化,从冷库温度场和气流场角度揭示堆码方式对鱼肉品质的影响机制,以期为冷库内合理堆码货物、延长货架期提供理论依据。
1 材料与方法
1.1 材料与试剂
实验鲐鱼由舟山汇丰冷库提供,2021年8月捕捞自东海,经船载冻结后以每箱10 kg装箱,并于汇丰冷库(-22 ℃)暂存,10月经运冷藏车运送至浙江工业大学食品学院,贮藏于(-18±2) ℃小型冷库内。
硼酸、氧化镁、溴甲酚绿、甲基红、盐酸、乙醇、三氯乙酸、2-硫代巴比妥酸(thiobarbituric acid, TBA)、氯化钠、尿素、5,5’-二硫代双(2-硝基苯甲酸)、乙二胺四乙酸、三羟甲基氨基甲烷、酒石酸钾钠、硫酸铜等均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
TU-19双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;Bechman高速冷冻台式离心机,美国Beckman-Coulter公司;T25高速分散机,德国IKA公司;K9840凯氏定氮仪,海能未来技术集团股份有限公司;HTS-XT傅立叶红外光谱仪,德国布鲁克仪器公司;MZsoMR23-60H-I岩心核磁共振成像仪,苏州纽迈分析仪器股份有限公司。
1.3 实验方法
1.3.1 冷库货物堆码方式
冷库尺寸为3.269 m×1.950 m×2.600 m,库内安有一台风机,尺寸为1.810 m×0.385 m×0.650 m,出风方式为直吹式通风,风速为6.0 m/s,温度为-18 ℃。库内鲐鱼用纸箱包装置于货架上,货箱尺寸为0.515 m×0.315 m×0.120 m,货物具体堆码方式见图1。
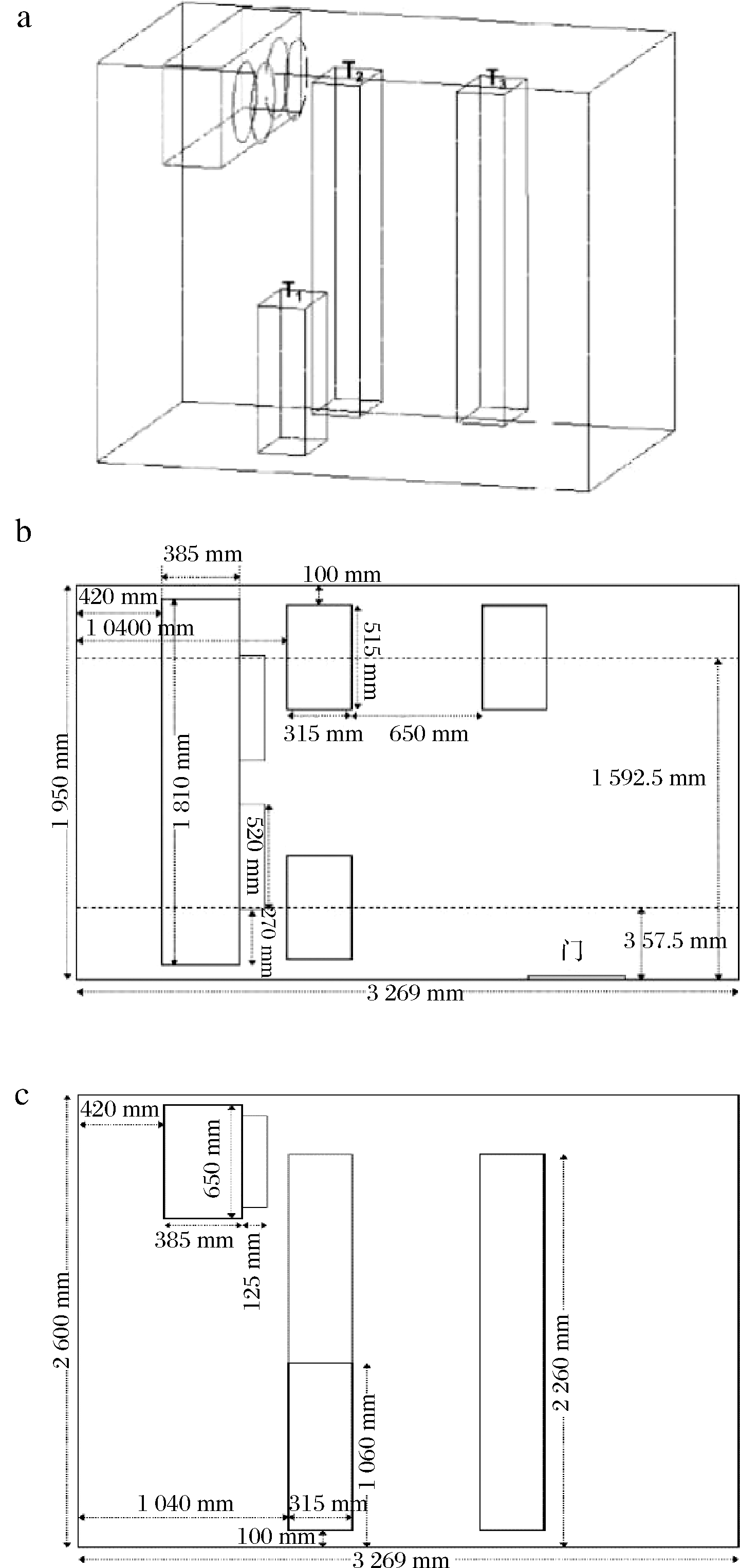
a-冷库三维示意图;b-俯视图;c-侧视图
图1 冷库货物堆放示意图
Fig.1 Schematic diagram of stacking mackerel in cold storage
1.3.2 数值模拟
模拟采用软件ANSYS 19.0分析,货架对气流的影响忽略不计,数学模型选择k-ε紊流模型,算法为Simple。风机出风口风速为6.0 m/s,温度为-18 ℃,风机背面为回风口,库壁选择HEAT FLUX项,冷风机外壳选择第一类边界条件,冷风机壁面无滑移,各个方向的速度v=0 m/s。库壁材料为聚氨酯泡沫,传热系数KW=0.295 W/(m2·K),库外壁温度取20 ℃;库壁热流密度为q=12.685 W/m2,货物材料属性为密度964.889 kg/m3、比热容2.558 kJ/(kg·K)、热导率1.492 W/(m·K)。
1.3.3 取样方式
将货物按1.3.1节进行堆码后进行贮藏实验,选择每堆货物的第一层随机取样,取样点如图1所示,分别为T1(堆码高度1.060 m距后壁1.040 m)、T2(堆码高度2.260 m距后壁1.040 m)、T3(堆码高度2.260 m距后壁2.005 m)3种堆码方式下的第一层货物。实验周期为6个月,每月取一次样,鱼肉采用随机取样,每次从3个位置的第一层货箱中各随机取3条鲐鱼,鱼肉取出后均至于4 ℃冰箱中解冻6 h,取背部肉进行理化指标测定。
1.3.4 干耗率
干耗率参考AOAC方法测定,按照公式(1)计算:
(1)
式中:WL为冷冻干耗率,%;m0为冻鱼初始质量,g;m1为贮藏期间的冻结质量,g。
1.3.5 挥发性盐基氮(total volatile base nitrogen,TVB-N)值
参考GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》。
1.3.6 TBA值
参考GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》。
1.3.7 肌原纤维蛋白提取及含量测定
参考汪经邦等[11]的方法提取肌原纤维蛋白,蛋白浓度用双缩脲法测定。
1.3.8 总巯基含量测定
参考李秀霞等[12]方法,总巯基(—SH)含量计算如公式(2)所示:
(2)
式中:a表示吸光值,b表示待测液蛋白质量浓度,mg/mL,c表示分子吸光系数,为13 600 mol/(cm·L),d表示稀释倍数11.25。
1.3.9 Ca2+-ATPase活性
参考SRIKET等[13]的方法,将肌原纤维蛋白质量浓度稀释至4 mg/mL,取3.5 mL蛋白稀释液,加入0.3 mL 0.5 mol/L Tris-马来酸溶液和0.5 mL 0.1 mol/L CaCl2溶液,加入0.25 mL 20 mmol/L ATP溶液混匀,25 ℃水浴10 min,加入2.5 mL预冷15%三氯乙酸溶液,5 000 r/min离心5 min,取0.5 mL上清液,加入2.5 mL蒸馏水,2 mL硫酸亚铁-钼酸铵,25 ℃静置1 min,660 nm测吸光值。
1.3.10 傅里叶变换红外光谱测定
参考SHANG等[14]的方法,将搅碎的鱼肉冻干,按1∶100(质量比)与干燥后的溴化钾充分研磨,测定范围为400~4 000 cm-1。
1.3.11 组织微观结构
参考KAALE等[15]的方法测定,样品切成0.5 cm×0.5 cm×0.5 cm大小,浸没在Clarke溶液(无水乙醇∶冰醋酸=3∶1,体积比)中固定24 h,之后用乙醇进行梯度脱水,石蜡包埋,切片机切成4 μm薄片,进行HE染色,光学显微镜下放大100倍观察。
1.3.12 水分分布
采用MZsoMR23-60H-I核磁共振仪测定样品并成像,选择CPMG序列,分析参数设置:SF1=12 MHz、O1=559 029.1 Hz、P1 =6 μs、P2=10 μs、TD=61 874、SW=250 kHz、TW=3 000 ms、RFD=0.08 ms、RG1=20、DRG1=2、NS=8、TE=0.20 ms、NECH=3 300。
1.3.13 数据分析
实验数据采用Microsoft Excel分析,Origin 2021绘图,采用SPSS 26.0对测定数据进行主成分分析。
2 结果与分析
2.1 CFD模拟流场结果分析
为比较不同堆码方式下库内流场分布变化,实验选择标准k-ε模型进行稳态模拟,分析稳定状态时冷库内的气流和温度分布情况。
2.1.1 温度场分析
冷库整体温度分布如图2-a所示,整体温度维持在-16~-18 ℃,仅库后壁、风机回风口和冷库边缘区域的温度较高,但整体温差小于2 ℃。图2-b、图2-c为3堆货物的中间位置温度分布切面图,从2个切面的分布图可以看出,T1处的温度略高于T2和T3,但3个位置处的温度差异小于1 ℃,说明在本冷库内温度场的分布较均匀,不同位置处鱼肉的贮藏温度差异不显著。
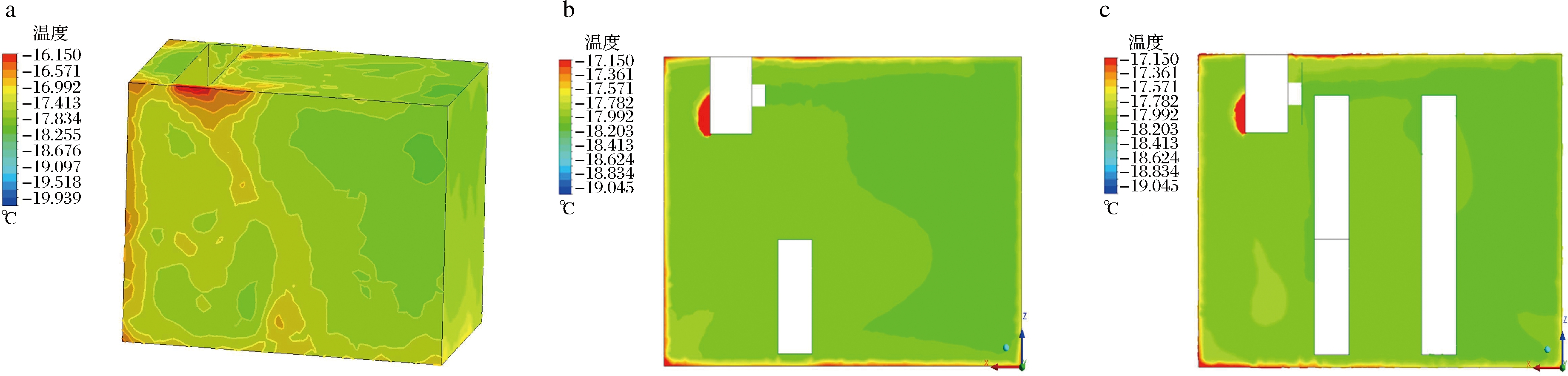
a-冷库整体温度分布;b-Y=357.5 mm温度分布图;c-Y=1 592.5 mm温度分布图
图2 冷库不同位置温度场分布情况
Fig.2 Distribution of temperature field in different positions of cold storage
2.1.2 气流场分析
货物存在时冷库的气流场分布情况如图3所示,空气从出风口吹出沿库壁流动,流速逐渐变小。由图3-a可知,在无货物大面积遮挡时,库前壁形成一个大回流区,后壁存在局部小涡流,而图3-b中,由于货物堆放过高阻挡了气流的流动,气流回流受到阻碍,导致冷库前中后部位均出现小涡流,图3-a的气流分布均匀性更好。从流速分布图可看出,图中2.260 m堆放高度的顶层流速明显高于1.060 m的顶层流速,而靠近风机处的流速也大于远离风机处的流速,3个位置的流速大小为T2>T3>T1。说明货物堆码高度及堆码位置对冷库内的气流分布产生影响,不同位置处气流流速差异大,并且对货物区的表层位置影响最显著,堆码过高的T2位置气流集中,流速可达到6 m/s,而堆码低的T1流速小于0.7 m/s,表明3组贮藏环境中的气流场存在显著差异。
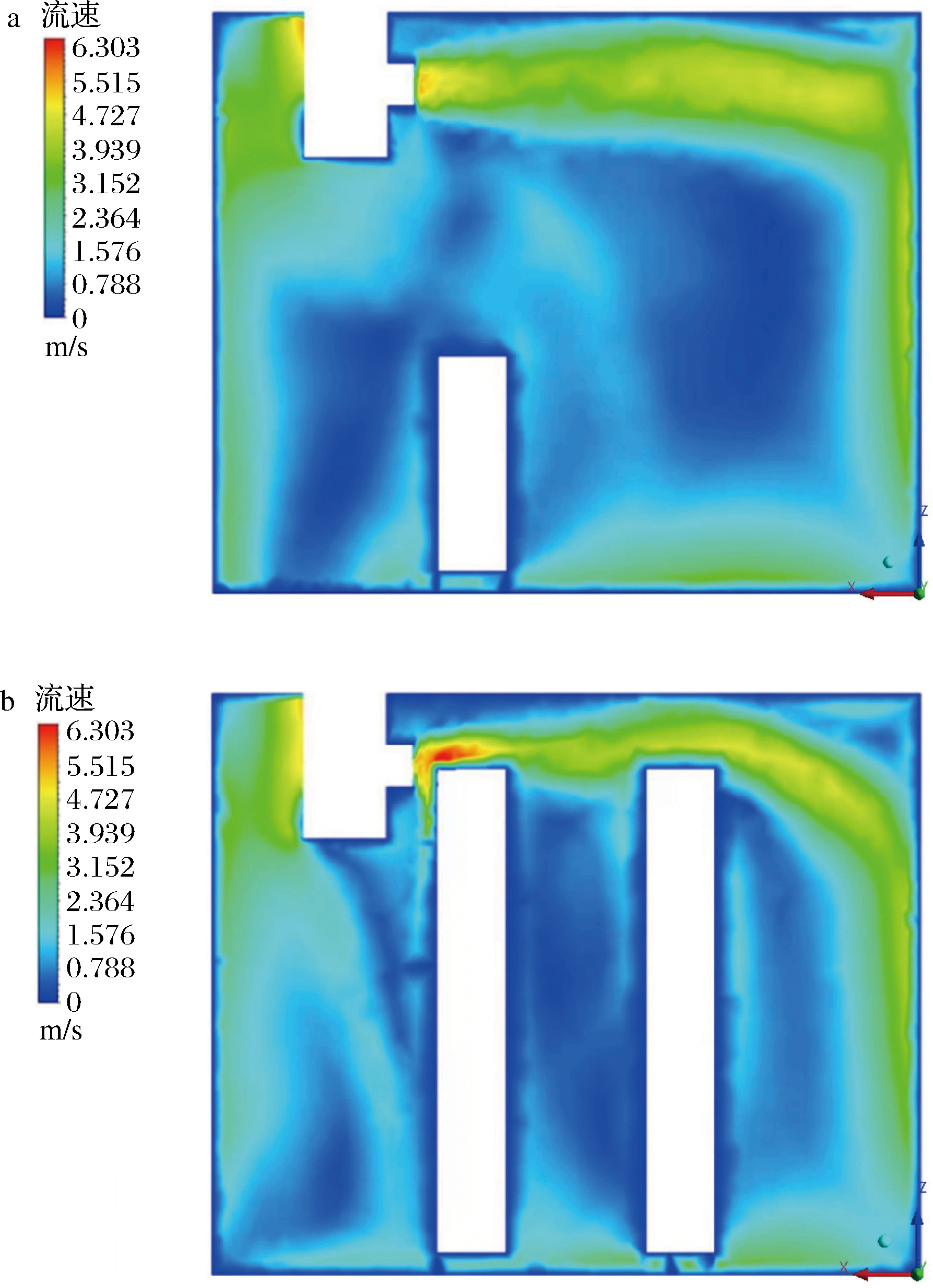
a-Y=357.5 mm气流分布图;b-Y=1 592.5 mm气流分布图
图3 冷库Y=357.5 mm和Y=1 592.5 mm切面
气流场分布情况
Fig.3 Distribution of airflow field in the sections of cold storage with Y=357.5 mm and Y=1 592.5 mm
2.2 贮藏过程中鲐鱼干耗率
食品干耗的本质是由食品内的水分与外界湿空气的热湿交换引起,影响热湿交换的主要因素为食品自身特性和外界贮藏环境(温度、湿度、流速等)[16],PHIMOLSIRIPOL等[17]和EMRAGI等[18]的研究表明温度波动和出风速度对食品干耗产生影响。不同位置处鱼肉干耗损失情况如图4所示,3组鲐鱼的干耗率均随冻藏时间延长而上升,在贮藏末期,T1、T2、T3组鱼肉的干耗率分别为1.3%、3.1%、2.5%,T2组的干耗最严重。这是因为当货物堆码方式不同时,鱼肉表面的热湿交换程度产生差异,高流速区的冷空气快速流动加速了鱼肉表面的水分升华,导致干耗损失严重,干耗的发生会导致鱼肉表面孔隙增多,加速鱼肉的氧化变质,因此流速大的位置更不利于鲐鱼的贮藏。

图4 贮藏期间不同位置鲐鱼干耗率的影响
Fig.4 The effect of different positions on weight loss of mackerel during storage
2.3 脂肪氧化
脂肪氧化是鱼肉产生酸臭味或哈喇味、营养价值下降的主要原因之一,鲐鱼属于多脂鱼,因此脂肪氧化对冷冻鲐鱼的品质起重要作用,通过测定TBA值可反映鲐鱼脂肪氧化程度,TBA值越高表示鱼肉脂肪氧化越严重[19]。由图5可知,鲐鱼初始TBA值为0.44 mg/kg,3组鲐鱼的TBA值随贮藏时间上升,在冻藏阶段,T1组鱼肉的TBA值始终低于T2、T3,贮藏末期,鲐鱼脂肪氧化程度为T2>T3>T1。说明在冻藏过程中,不同堆码方式对上层鱼肉的脂肪氧化程度产生差异性影响,流速越大的位置鱼肉脂肪氧化程度越大。
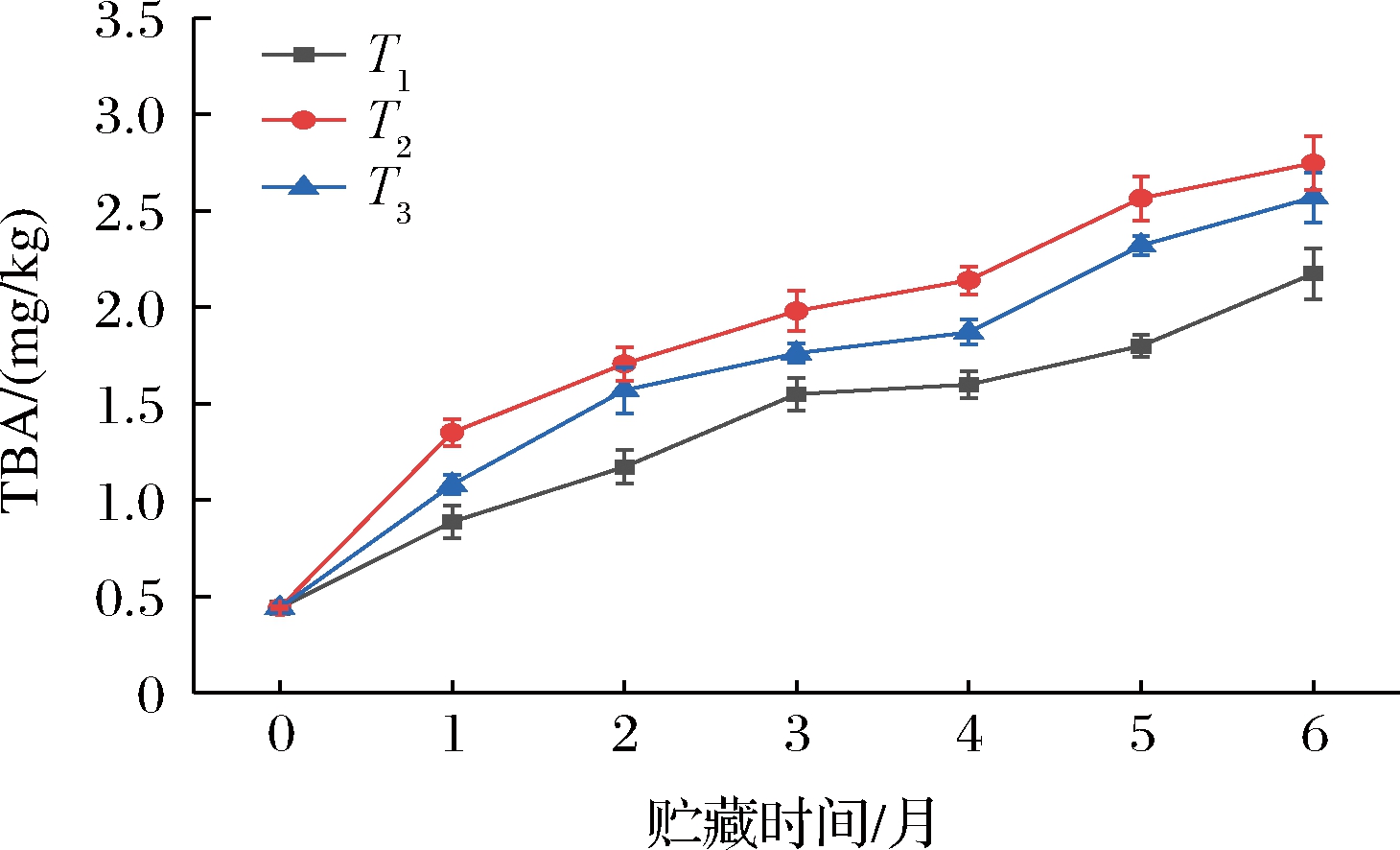
图5 贮藏期间不同位置处鲐鱼TBA值
Fig.5 TBA value of mackerel at different positions during storage
2.4 蛋白质的降解和变性
鱼肉在贮藏过程中受内源酶和微生物等生化作用的影响,蛋白质会发生降解并产生多种含氮物质,导致TVB-N值升高。图6-a显示,贮藏期间,3组的TVB-N值持续上升,第2个月时,仅T1组的TVB-N值小于15 mg/100 g,处于一级鲜度,另外两组均为二级鲜度;在末期,3组的TVB-N含量为T2>T3>T1,表明T1的鲜度最佳。图6-b为鲐鱼肌原纤维蛋白中总巯基含量的变化,当鱼肉与空气接触时,肌原纤维蛋白中的活性巯基被氧化成二硫键,内部巯基裸露并继续发生氧化反应,导致总巯基含量下降、蛋白稳定性降低 [20-21];由图6-b可知,冻藏期间3组的总巯基含量下降,贮藏末期T1、T2、T3组的总巯基含量分别为29.1、25.3、26.7 nmol/mg,各阶段含量为T1>T3>T2,表明T1的蛋白稳定性最好。Ca2+-ATPase活性则反映了鱼肉肌球蛋白的变性程度[22],图6-c为贮藏期间鲐鱼的Ca2+-ATPase活性变化,可以看出Ca2+-ATPase活性大小为T1>T3>T2组,结果与总巯基含量变化一致。由图6可以看出T2的蛋白降解和氧化变性程度最大,其次为T3、T1,说明流速大的位置放置的食品中蛋白降解变性程度也越大。
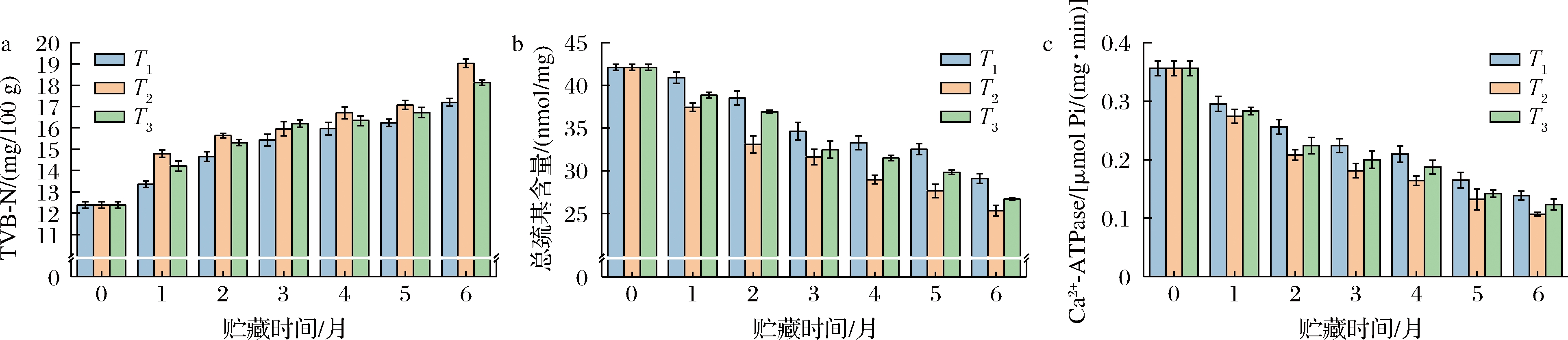
a-TVB-N值;b-总巯基含量;c-Ca2+-ATPase活性
图6 贮藏期间不同位置处鲐鱼蛋白降解变性程度
Fig.6 The degree of protein degradation and denaturation of mackerel at different positions during storage
2.5 蛋白二级结构
图7为贮藏期间鲐鱼红外图谱,图中显示出多个吸收峰:1 600~1 700 cm-1酰胺Ⅰ带、1 500~1 600 cm-1酰胺Ⅱ带、1 220~1 350 cm-1酰胺Ⅲ带、3 300 cm-1附近的N—H伸缩振动、1 440~1 470 cm-1的C—H弯曲振动等。图中3组的酰胺Ⅰ、Ⅱ、Ⅲ带的峰信号强度均随时间下降,贮藏末期酰胺Ⅱ、Ⅲ带的峰逐渐平缓,峰位置变化不明显;酰胺Ⅰ带在60 d时吸收峰在1 658 cm-1附近,120 d时T1组处于1 630~1 640 cm-1,T2、T3组在1 640~1 650 cm-1,180 d时,3组峰位在1 642 cm-1附近,表明蛋白结构随贮藏时间不断发生改变,二级结构发生了从α-螺旋(1 650~1 660 cm-1)向β折叠(1 630~1 640 cm-1)、无规则卷曲(1 640~1 650 cm-1)转化。
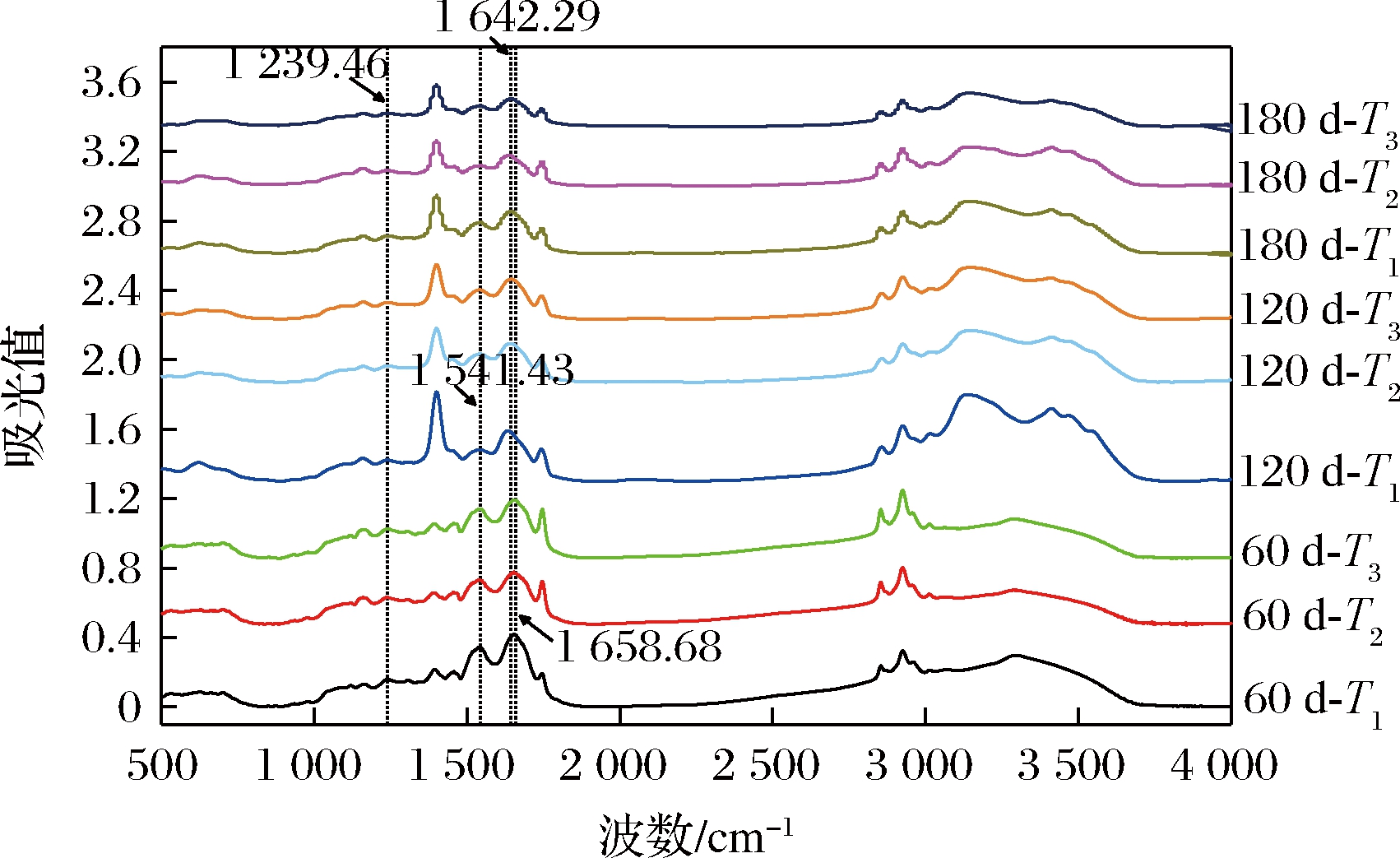
图7 不同位置处鲐鱼随时间变化的FTIR图谱
Fig.7 FTIR spectra of mackerel at different positions with time
研究表明酰胺Ⅰ带与肽链之间的交联程度有关,交联越紧密则振动频率越大[23],而α-螺旋结构与维持蛋白结构稳定的氢键有关,蛋白变性使氢键断裂,α-螺旋向β折叠、β转角(1 660~1 700 cm-1)转化,并继续向无规则卷曲转变,其中β转角和无规则卷曲属于无序结构,因此α-螺旋展开会导致蛋白有序结构减少、稳定性下降[24-25]。由图7可知,各周期内T1组的酰胺Ⅰ带峰强均最大,且120 d时峰位在β折叠范围,T2、T3组在无规则卷曲范围,表明T1的肽链结合更紧密,具有更稳定的蛋白结构。
2.6 组织微观结构
鲐鱼肌肉组织微观结构直观反映了鱼肉组织的破碎程度。由图8可知,第90天时,T1组的肌肉结构致密,大部分细胞保持完整,细胞间间隙小,其次为T3组;而T2组细胞间间隙大,肌肉破碎,组织结构松散,品质最差。随贮藏时间延长,第180天时,3组对应的肌肉纤维完整性与90 d相比均受到不同程度的破坏,肌纤维间隙和断裂程度增加。从3组的鱼肉组织结构破坏程度可看出T1的鱼肉组织破坏程度较低,品质保持最好,T2的细胞组织破碎程度最大,品质最差。实验结果表明鱼肉在不同堆码方式下,其肌肉组织结构的破碎程度存在差异,表面流速小的T1组鱼肉肌纤维间隙小,细胞完整性好,而流速大的T2组细胞损伤程度明显增大。

a-90 d; b-180 d
图8 贮藏期间不同位置处鲐鱼微观结构
Fig.8 Microstructure of mackerel at different positions during storage
2.7 水分分布
低场核磁可检测水分迁移情况,通过横向弛豫时间T2和峰面积占比能表征鱼肉内的水分分布状态[26]。图9-a可观察到,第0天时T2图谱为4个波峰,而90 d时T2、T3组为3个波峰,第180天时3组均变为3个波峰,说明在贮藏过程中鱼肉水分状态发生了改变[27]。水分分布状态分为结合水(T2a强结合水、T2b弱结合水,0~10 ms)、不易流动水(T22,10~100 ms)和自由水(T23,>100 ms),图9-a可知,与第0天相比3组T22的峰面积下降,T23的峰面积上升。图9-b中,第90天时,T1、T2和T3组自由水占比为1.834%、3.297%、3.177%,说明随贮藏时间延长鱼肉组织结构被破坏,持水力下降,膜内部分水分向膜外流动,自由水含量上升[28]。180 d时T1、T2和T3组自由水占比为2.507%、1.527%、1.867%,贮藏过程中T2组和T3组的鱼肉自由水含量呈先上升后下降趋势,这可能是由于贮藏后期蛋白质降解、自由水增加的同时,鱼肉内的自由水受流速影响升华速度大于自由水的转化速度,导致自由水相对含量下降,而T1组由于流速较小,水分升华速度慢,自由水相对含量也更大。

a-T2弛豫时间;b-不同状态的水分相对含量
图9 贮藏期间不同位置处水分分布状态
Fig.9 Water distribution at different positions during storage
图10为核磁成像伪彩图,红色表示质子密度高,蓝色表示质子密度低,红色越深表明水质子信号越强,即水分含量越高[29]。从伪彩图可知第0天时鲐鱼呈现大范围红色,贮藏180 d后,信号明显下降,表明在贮藏期间鱼肉水分含量显著下降。第180天时,T1组红色信号最多,T2组的红色信号最少,说明T2组鱼肉水分流失最严重,表明流速大的位置鱼肉水分损失也更大。

图10 不同位置处鲐鱼的MRI伪彩图
Fig.10 Different positions on pseudo color of 1H MRI of mackerel
2.8 不同堆码方式下表层位置鱼肉主成分分析
将3个位置处的理化指标进行主成分分析。由表1可知,前2个主成分累计贡献率达86.473%,说明这2个主成分能反映鲐鱼品质的大部分信息,可作为数据分析的有效成分。因此提取这2个因子进行分析,主成分1方差贡献率为55.121%,其中载荷量较大的变量为干耗率、TVB-N含量、TBA值、Ca2+-ATPase活性和总巯基含量,主成分2方差贡献率为31.352%,载荷量较大的变量为自由水、不易流动水及结合水,说明主成分1和主成分2的指标对不同位置处鲐鱼品质的响应显著。
表1 主成分特征值和方差贡献率
Table 1 Principal component eigenvalue and variance contribution rate
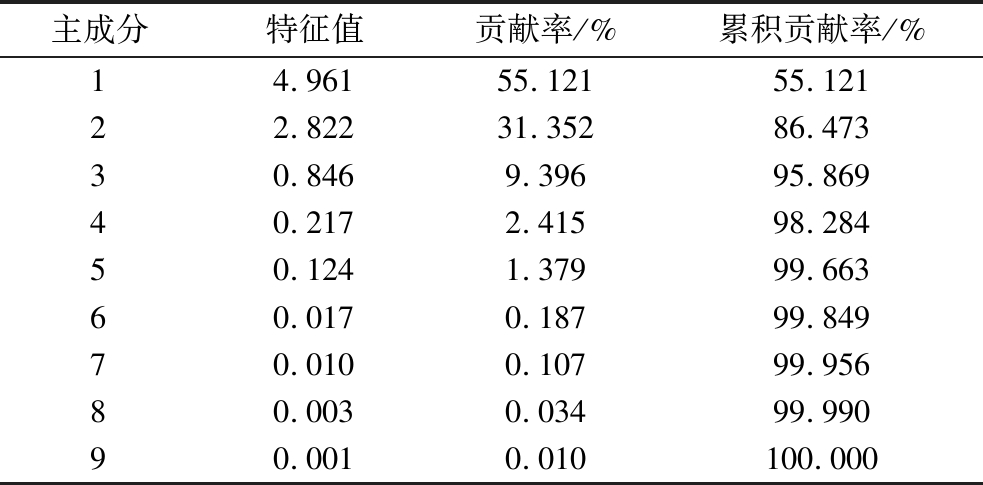
主成分特征值贡献率/%累积贡献率/%14.96155.12155.12122.82231.35286.47330.8469.39695.86940.2172.41598.28450.1241.37999.66360.0170.18799.84970.0100.10799.95680.0030.03499.99090.0010.010100.000
根据表2的主成分特征向量建立鱼肉品质评价数学模型,计算公式如下:
表2 主成分载荷矩阵和特征向量
Table 2 Principal component load matrix and eigenvector

指标主成分1(F1)主成分2(F2)载荷系数特征向量载荷系数特征向量干耗率(X1)0.9130.410-0.01-0.006TVB-N(X2)0.9870.4430.0140.008TBA(X3)0.9920.445-0.018-0.011总巯基(X4)-0.991-0.445-0.064-0.038酶活(X5)-0.985-0.4420.0340.020α-螺旋(X6)0.3680.165-0.325-0.193自由水(X7)0.250.1120.8990.535不易流动水(X8)-0.06-0.0270.980.583结合水(X9)-0.109-0.0490.9710.578
F1=0.410X1+0.443 1X2+0.445X3-0.445X4-0.442X5+0.165X6+0.112X7-0.027X8-0.049X9
F2=-0.006X1+0.008X2-0.011X3-0.038X4+0.020X5-0.193X6+0.535X7+0.583X8+0.578X9
综合得分=0.551 21F1+0.313 53F2
将3个位置处鲐鱼贮藏期间各指标的标准值代入综合得分计算方程,得到不同位置处鱼肉各阶段的综合得分,分值越高表示综合品质越好。由图11可知,贮藏期间3个位置处的鲐鱼综合得分均下降,说明鱼肉品质不断劣变,3组的综合得分排序为T1>T3>T2,表明T1的总体品质最好,与实测结果相吻合,证明堆码位置与鱼肉的品质变化有强相关性,流速小的位置更有利于鱼肉的保藏。

图11 不同位置处鲐鱼在贮藏期间的品质综合得分
Fig.11 Comprehensive quality score of mackerel in different positions during storage
3 结论
冷库内鲐鱼的堆码方式对鱼肉贮藏品质产生影响,当鱼肉处于流速越大的位置,其品质劣变越严重。T2组鱼肉表面流速大、流场分布不均匀,受流场影响鲐鱼表面水分升华速度快于另外两组,水分升华导致鱼肉表面形成孔洞、干耗损失严重,加速了鱼肉脂肪氧化和蛋白的变性,使维持蛋白质稳定的氢键断裂,肌原纤维结构破坏,鱼肉持水力下降,品质劣变加剧,而T1组鱼肉表面流场分布最均匀,因此品质劣变也最缓慢。主成分分析建立的鱼肉综合评价模型同样显示T1综合品质最佳,T2品质最差,表明冷库中流速小的位置更有利于鱼肉贮藏。堆码方式不同引起的品质差异根本原因在于流场的变化,即不同位置处鱼肉的贮藏环境不同,越靠近风机或堆放越高的位置其气流场和温度场分布越不均匀,鱼肉鲜度也越差。本研究结果可为合理摆放货物、延长食品的货架期提供理论依据。但本实验中由于冷库空间的局限性,货物与风机之间距离的设置比实际冷库中偏小,在实际操作过程中可根据冷库的实际情况进行流场分析以确定最优化的堆码方式。
[1] CHEN M, ZHAO J, ZHANG Z B, et al.Influencing factors of thermal performance of small-size vaccine cold storage:An experiment-based parametric study[J].Journal of Energy Storage, 2022, 51:104496.
[2] PRAEGER U, JEDERMANN R, SELLWIG M, et al.Airflow distribution in an apple storage room[J].Journal of Food Engineering, 2020, 269:109746.
[3] JAMES S, JAMES C.Chilled Foods[M].Amsterdam:Elsevier, 2008:375-403.
[4] 谢晶, 王金锋, 缪晨, 等.基于三维CFD预测大型冷库内不同货物摆设方式对气流的影响[C].第八届全国食品冷藏链大会论文集.北京, 2012: 140-145.
[5] 曾晰. 火龙果堆码方式对冷藏库内气体流场分布的影响[J].农技服务, 2019, 36(1):37-40;42.
ZENG X.Influence of pitaya stacking method on gas flow field distribution in cold storage[J].Agricultural Technology Service, 2019, 36(1):37-40;42.
[6] HAO X H, JU Y L.Simulation and analysis on the flow field of the low temperature mini-type cold store[J].Heat and Mass Transfer, 2011, 47(7):771-775.
[7] 孙海亭, 周轲, 杨艳青, 等.利用CFD模型研究苹果冷藏库内的空气流动[J].保鲜与加工, 2014, 14(4):27-33;39.
SUN H T, ZHOU K, YANG Y Q, et al.Airflow simulation in apple cold storage using CFD model[J].Storage and Process, 2014, 14(4):27-33;39.
[8] CHOURASIA M K, GOSWAMI T K.Simulation of effect of stack dimensions and stacking arrangement on cool-down characteristics of potato in a cold store by computational fluid dynamics[J].Biosystems Engineering, 2007, 96(4):503-515.
[9] 胡耀华, 蒋国振, 熊来怡, 等.猕猴桃冷库内流场的CFD模拟[J].农机化研究, 2012, 34(5):155-159.
HU Y H, JIANG G Z, XIONG L Y, et al.Flow field simulation of cold storehouse for kiwi fruit based on CFD[J].Journal of Agricultural Mechanization Research, 2012, 34(5):155-159.
[10] 王钰, 倪继龙, 李敏杰, 等.鲐鱼低温冻藏过程中脂肪氧化特性[J].肉类研究, 2021, 35(6):63-68.
WANG Y, NI J L, LI M J, et al.Oxidation characteristics of lipids in mackerel during cryopreservation[J].Meat Research, 2021, 35(6):63-68.
[11] 汪经邦, 谢晶, 刘大勇.暗纹东方鲀低温贮藏期间水分、质地和蛋白质的变化规律[J].食品科学, 2020, 41(21):213-221.
WANG J B, XIE J, LIU D Y.Changes in water mobility, texture and protein structure in Takifugu obscurus during low temperature storage[J].Food Science, 2020, 41(21):213-221.
[12] 李秀霞, 刘孝芳, 刘宏影, 等.超声波辅助冷冻与低温速冻对海鲈鱼冰晶形态及冻藏期间鱼肉肌原纤维蛋白结构的影响[J].中国食品学报,2021, 21(10):169-176.
LI X X, LIU X F, LIU H Y, et al.Effects of ultrasound-assisted freezing and cryogenic quick freezing on ice crystal morphology and myofibrin structure of sea bass (Lateolabrax japonicus) during frozen storage[J].Journal of Chinese Institute of Food Science and Technology,2021, 21(10):169-176.
[13] SRIKET P, LA-ONGNUAL T.Quality changes and discoloration of basa (Pangasius bocourti) fillet during frozen storage[J].Journal of Chemistry, 2018, 2018:1-7.
[14] SHANG S, WU B C, FU B S, et al.Enzyme treatment-induced tenderization of puffer fish meat and its relation to physicochemical changes of myofibril protein[J].LWT, 2022, 155:112891.
[15] KAALE L D, EIKEVIK T M.A histological study of the microstructure sizes of the red and white muscles of Atlantic salmon (Salmo salar) fillets during superchilling process and storage[J].Journal of Food Engineering, 2013, 114(2):242-248.
[16] 霍晓娜. 低温贮藏过程中食品干耗问题的研究[J].肉类研究, 2009, 23(4):10-12;34.
HUO X N.Research on the weight loss of foods in refrigerated condition[J].Meat Research, 2009, 23(4):10-12;34.
[17] PHIMOLSIRIPOL Y, SIRIPATRAWAN U, CLELAND D J.Weight loss of frozen bread dough under isothermal and fluctuating temperature storage conditions[J].Journal of Food Engineering, 2011, 106(2):134-143.
[18] EMRAGI E, SATHUVALLI V, JAYANTY S S.The impact of ventilation conditions on the quality of Rio Grande Russet tubers during long-term cold storage[J].Journal of Agriculture and Food Research, 2021, 3:100095.
[19] KHOSHNOUDI-NIA S, MOOSAVI-NASAB M.Comparison of various chemometric analysis for rapid prediction of thiobarbituric acid reactive substances in rainbow trout fillets by hyperspectral imaging technique[J].Food Science &Nutrition, 2019, 7(5):1875-1883.
[20] MA T T, WANG Q, WEI P Y, et al.EGCG-gelatin biofilm improved the protein degradation, flavor and micromolecule metabolites of tilapia fillets during chilled storage[J].Food Chemistry, 2022, 375:131662.
[21] 陈晓楠, 赵金丽, 张宾, 等.低温冻藏过程中鲐鱼肌肉蛋白质氧化特性研究[J].包装工程, 2020, 41(17):38-45.
CHEN X N, ZHAO J L, ZHANG B, et al.Oxidation of muscle protein in mackerel during cryopreservation[J].Packaging Engineering, 2020, 41(17):38-45.
[22] RAMIAREZ J A, MARTIAN-POLO M O, BANDMAN E.Fish myosin aggregation as affected by freezing and initial physical state[J].Journal of Food Science, 2000, 65(4):556-560.
[23] 胡远辉, 廖慧琦, 陆益钡, 等.液氮冻结对养殖大黄鱼肌原纤维蛋白结构的影响[J].食品安全质量检测学报, 2020, 11(22):8260-8266.
HU Y H, LIAO H Q, LU Y B, et al.Effects of liquid nitrogen freezing nitrogen on the structure of myofibrillar protein in cultured large yellow croaker (Pseudosciaena crocea)[J].Journal of Food Safety &Quality Inspection, 2020, 11(22):8260-8266.
[24] LI F F, DU X, REN Y M, et al.Impact of ice structuring protein on myofibrillar protein aggregation behaviour and structural property of quick-frozen patty during frozen storage[J].International Journal of Biological Macromolecules, 2021, 178:136-142.
[25] 孙圳, 杨方威, 李侠, 等.ATR-FTIR分析冻结—解冻后的牛肉蛋白二级结构变化[J].光谱学与光谱分析, 2016, 36(11):3542-3546.
SUN Z, YANG F W, LI X, et al.Effects of freezing and thawing treatments on beef protein secondary structure analyzed with ATR-FTIR[J].Spectroscopy and Spectral Analysis, 2016, 36(11):3542-3546.
[26] AURSAND I G, VELIYULIN E, BÖCKER U, et al.Water and salt distribution in Atlantic salmon (Salmo salar) studied by low-field 1H NMR, 1H and 23Na MRI and light microscopy:Effects of raw material quality and brine salting[J].Journal of Agricultural and Food Chemistry, 2009, 57(1):46-54.
[27] 孙慧琳, 代媛媛, 孟兰奇, 等.牛肉低温储藏过程中水分迁移与蛋白质氧化的相关性研究[J].保鲜与加工, 2021, 21(5):28-33;46.
SUN H L, DAI Y Y, MENG L Q, et al.Correlation research between water migration and protein oxidation of beef under cryopreservation[J].Storage and Process, 2021, 21(5):28-33;46.
[28] 汪经邦, 李沛韵, 谢晶, 等.不同贮藏温度对暗纹东方鲀水分迁移、质构和色泽的影响及其货架期预测[J].食品与发酵工业, 2020, 46(6):73-81.
WANG J B, LI P Y, XIE J, et al.Effects of different temperatures on moisture migration,texture and color of Takifugu obscures during storage and the prediction of shelf-life[J].Food and Fermentation Industries, 2020, 46(6):73-81.
[29] WANG X, XIE X R, ZHANG T, et al.Effect of edible coating on the whole large yellow croaker (Pseudosciaena crocea) after a 3-day storage at -18 ℃:With emphasis on the correlation between water status and classical quality indices[J].LWT, 2022, 163:113514.