花生是油脂和蛋白质的主要来源,是世界上第二大重要的谷类豆类作物,也是第四大食用油料作物。花生红衣是花生加工业的副产品,约占整个花生种子质量的3%,全世界每年生产约100万t花生红衣。但目前花生红衣利用率较低,除了一部分用于提取花生衣红作为食品着色剂,大部分用于饲料或被舍弃,经济价值很低[1]。大量研究表明,花生红衣中多酚数量丰富、种类繁多,含量约为90~150 mg/g(以花生红衣干重记)[2],主要包括酚酸类(如咖啡酸、阿魏酸、香豆酸)、黄烷-3-醇单体及其聚合物(如儿茶素、表没食子儿茶素、原花青素)、二苯乙烯类(如白藜芦醇)和类黄酮[2-3]。研究发现,花生红衣多酚具有抑菌、抗氧化、降血脂等生理功能[4]。
动脉粥样硬化是大动脉中脂质和纤维元素积累的一种慢性进行性疾病,是大多数心血管疾病的主要发病机制[5]。动脉粥样硬化的致病因素多样,如内皮细胞受损、细胞外脂质堆积、慢性炎症、氧化应激损伤以及泡沫细胞的形成和死亡[6]。动脉粥样硬化早期症状不明显,然而一旦斑块破裂进入到血液,则会对生命健康造成威胁。近年来,植物源膳食多酚对心血管疾病的预防作用及其机制引起了人们的广泛关注[7-8]。通过改变饮食提高多酚等物质的摄入或可成为预防和控制动脉粥样硬化发展的途径之一。TOOMER等[9]的研究表明添加花生红衣多酚至小鼠饮食后,小鼠的肝脏胆固醇和脂质贮存减少。XU等[10]发现花生红衣提取物可显著降低高脂饮食诱导的ApoE-/-小鼠动脉粥样硬化斑块,降低血清中甘油三酯和低密度脂蛋白胆固醇含量,缓解脂质代谢紊乱,并通过降低促炎细胞因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)表达水平、增加抗炎细胞因子IL-10表达水平发挥抗炎作用。然而,动脉粥样硬化的致病因素多样,花生红衣多酚抗动脉粥样硬化的活性成分及其机制尚未完全阐明。
网络药理学以广泛的数据库为基础,已成为系统揭示复杂生物系统功能和行为的有力工具,可全面揭示多成分药物植物中多成分-多靶点-多通路的作用机制[11-12]。本研究为进一步探索花生红衣多酚抗动脉粥样硬化的作用机制,基于网络药理分析预测了花生红衣多酚抗动脉粥样硬化的活性成分、靶点和通路,然后将花生红衣多酚的活性成分与筛选的核心靶点进行分子对接模拟,从而为花生红衣抗动脉粥样硬化功能健康食品的开发提供科学依据。
1 材料与方法
1.1 花生红衣多酚活性成分与靶点的获取
在TCMSP平台中以“花生衣”进行搜索以及相关文献检索,得到花生红衣所含的多酚类物质(表1)。利用TCMSP平台根据口服生物利用度(oral bioavailability,OB)≥30%、类药性指数(drug-likeness, DL)≥0.18筛选花生红衣的活性成分[12],并利用PubChem数据库得到活性成分的2D结构的SDF文件。根据活性成分的名称在TCMSP平台中进行靶点收集[12],利用Uniprot数据库得到靶点的基因名称,同时在SwissTargetPridiction数据库进行靶点预测,设置可能性>0.1[11];将3个数据库得到的靶点合并,去重,得到花生红衣多酚类活性成分的关键作用靶点。
表1 花生红衣多酚成分[1,3-4,10]
Table 1 Chemical constituents of peanut skin polyphenols

编号中文名编号中文名1儿茶素21漆黄素2表儿茶素22杨梅素3表没食子儿茶素没食子酸酯23白杨素4表儿茶素没食子酸酯24木犀草素5儿茶素没食子酸酯25染料木素6原花青素A126芹菜素7原花青素A227橙皮素8原花青素B128异鼠李素9原花青素B229槲皮素4-葡萄糖苷10原花青素B330山奈酚3-O-葡萄糖苷11原花青素B431芦丁12原花青素C132白藜芦醇13矢车菊素33香草酸14矢车菊素3-O-葡萄糖苷34咖啡酸15矮牵牛素3-O-葡糖苷35对香豆酸16芍药素3-半乳糖苷36奎宁酸17红车轴草素37没食子酸18飞燕草素38原儿茶酸19槲皮素39阿魏酸20山奈酚
1.2 动脉粥样硬化靶点的获取
通过OMIM、Disgenet和Genecards 数据库,输入 “atherosclerosis”检索相关靶点,去重汇总后得到动脉粥样硬化的相关作用靶点。将花生红衣多酚活性成分作用靶点和动脉粥样硬化的作用靶点利用Venny 2.1.0 作韦恩图[12],获得交集靶点。
1.3 蛋白-蛋白互作网络(protein-protein interaction networks,PPI)构建
利用STRING数据库对交集靶点作蛋白互作网络。设置high confidence(0.700)。在Cytoscape 3.9.1构建靶点蛋白的互作网络。使用CytoNCA插件分析,计算靶点的连接度(degreecentrality,DC)、介度(betweenness,BC)和紧密度(closeness,CC)筛选关键靶点[11]。
1.4 GO和KEGG富集分析
采用DAVID平台,将交集靶点导入进行GO和KEGG富集分析,设置P<0.05。将结果利用微生信在线绘图软件制作条形图和气泡图。利用Cytoscape 3.9.1软件,构建“花生红衣酚类活性成分-作用靶点-通路”网络图。
1.5 分子对接
利用PubChem数据库得到活性成分的2D结构的SDF文件,并通过PDB数据库得到靶点的.pdb格式结构。使用Pymol和AutoDockTools 1.5.7软件对活性成分和蛋白质进行去水、加氢、分子对接、计算结合能以及对接结果可视化操作[11]。
1.6 所用数据库平台地址
本文研究所用数据库及在线绘图软件网址如参考文献[11]中所论述。
2 结果与分析
2.1 花生红衣多酚活性成分与靶点
经在TCMSP平台和文献搜索共获得39种花生红衣多酚成分(表1)。按1.1节所述,经筛选后得到13个活性成分,如表2所示,编号分别为P1~P13。且获得花生红衣酚类活性成分作用靶点384个。
表2 花生红衣多酚活性成分
Table 2 The main active components of peanut skin polyphenols
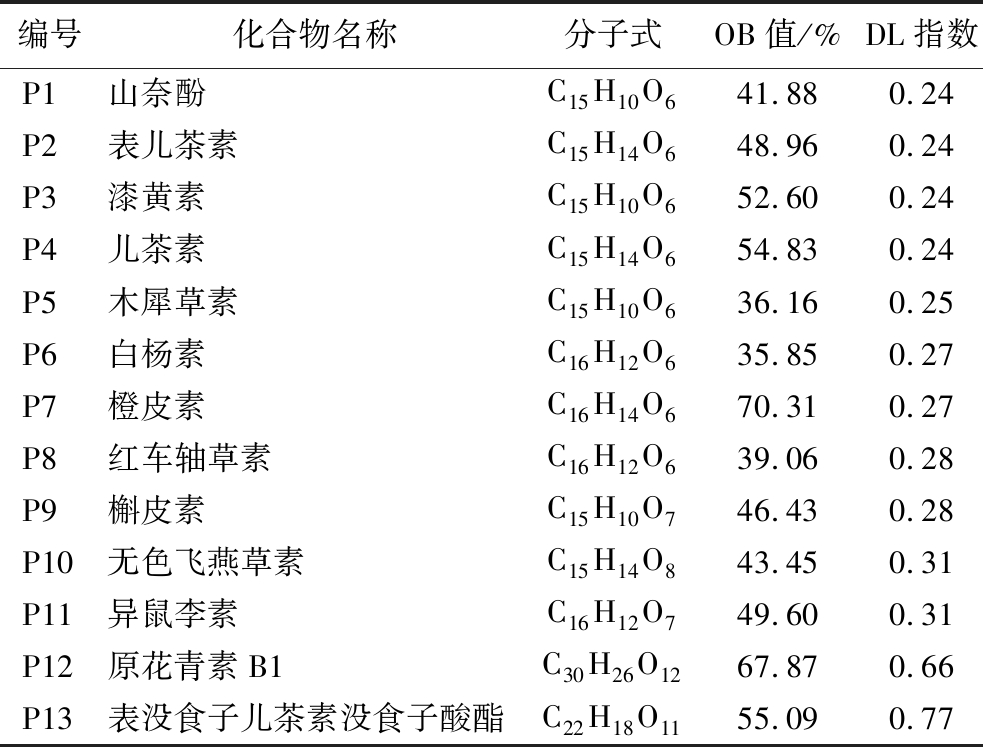
编号化合物名称分子式OB值/%DL指数P1山奈酚C15H10O641.880.24P2表儿茶素C15H14O648.960.24P3漆黄素C15H10O652.600.24P4儿茶素C15H14O654.830.24P5木犀草素C15H10O636.160.25P6白杨素C16H12O635.850.27P7橙皮素C16H14O670.310.27P8红车轴草素C16H12O639.060.28P9槲皮素C15H10O746.430.28P10无色飞燕草素C15H14O843.450.31P11异鼠李素C16H12O749.600.31P12原花青素B1C30H26O1267.870.66P13表没食子儿茶素没食子酸酯C22H18O1155.090.77
2.2 动脉粥样硬化靶点获取结果
以“atherosclerosis”为关键词,在OMIM、Disgenet和Genecards 数据库检索相关靶点,经合并去重后,得到疾病靶点5 317个。将其与384个活性成分的作用靶点构建韦恩图取交集(图1),得到304个交集靶点。

图1 花生红衣多酚活性成分和动脉粥样硬化相关靶点的韦恩图
Fig.1 Venn diagrams of active components of peanut skin polyphenols and atherosclerosis targets
2.3 花生红衣多酚抗动脉粥样硬化的作用靶点蛋白互作网络
运用String平台,对304个交集靶点进行蛋白-蛋白相互作用分析(图2)。隐藏10个断开无连接节点,经分析共涉及到294个节点,2 791条边,平均节点度为18.4。靶点之间的大量相互作用说明它们可能具有生物学上的相关性,并且花生红衣多酚活性成分抗动脉粥样硬化可能涉及多个靶点。经Cytoscape可视化分析,PPI网络中DC、BC、CC均值分别为18.99、460.46、0.22。以三者均大于均值作为筛选条件,得到TP53、AKT1等核心靶点共65个,根据DC排名前15的靶点如表3所示。

图2 蛋白-蛋白互作网络图
Fig.2 Network diagram of protein-protein interaction
表3 花生红衣多酚活性成分抗动脉粥样硬化的关键靶点
Table 3 Key targets of peanut skin polyphenol in anti-atherosclerosis

序号靶点名DCBCCC1肿瘤蛋白p53(tumor protein p53,TP53)966 876.02 0.26 2信号传导及转录激活因子3(signal transducer and activator of transcription-3,STAT3)913 122.30 0.26 3丝氨酸/苏氨酸激酶1(alpha serine/threonine-protein kinase,AKT1)864 243.81 0.26 4原癌基因酪氨酸蛋白激酶(proto-oncogene tyrosine-protein kinase,SRC)844 166.33 0.26 5丝裂原活化蛋白激酶3(mitogen-activated protein kinase-3,MAPK3)843 566.40 0.26 6热休克蛋白90α家族A类成员1(heat shock protein 90 alpha family class A member 1,HSP90AA1)803 999.59 0.26 7连环蛋白β1(catenin beta-1,CTNNB1)754 108.85 0.26 8丝裂原活化蛋白激酶1(mitogen-activated protein kinase-1,MAPK1)722 056.77 0.26 9表皮生长因子受体(epithelial growth factor receptor,EGFR)703 565.85 0.26 10肿瘤坏死因子(tumor necrosis factor,TNF)692 683.24 0.25 11Myc原癌基因(Myc proto-oncogene protein, MYC)681 863.510.2512IL-6641 934.640.25 13血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)621 523.110.2514半胱氨酸天冬氨酸蛋白酶3(Caspase-3,CASP3)611 448.730.25 15磷脂酰肌醇-3-激酶调节亚基1(phosphatidylinositol 3-kinase regulatory subunit 1,PIK3R1)58880.900.25
2.4 GO和KEGG通路富集分析
以“P<0.05”为标准,对304个交集靶点进行GO富集分析。GO包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组成(cell component, CC)。结果表明共得到GO功能富集条目1 205条,其中917个条目与生物过程方面相关,194个条目与分子功能方面相关,其余的94个条目与细胞组成相关。P值越小表征富集程度越高,对GO富集条目根据P值进行排序,分别选取BP、MF和CC排名前10的条目绘制条形图,如图3所示。在生物过程方面,花生红衣多酚主要参与RNA聚合酶Ⅱ启动子转录的正向调控、DNA为模板转录的正向调控、基因表达的正向调控、凋亡过程的负向调控、对药物的反应、蛋白磷酸化等过程。在细胞组成方面,花生红衣多酚主要作用于细胞液、细胞质、细胞核、核浆、细胞外间隙、胞外区等。同时,分子功能结果表明,花生红衣多酚的靶点主要富集于蛋白质结合、相同蛋白结合、酶结合、蛋白同质二聚体活性、蛋白激酶结合、蛋白激酶活性等。综上可知,花生红衣多酚可能通过以上众多生物过程而起到抗动脉粥样硬化的作用。

图3 GO功能富集分析图
Fig.3 GO function enrichment analysis
注:response to drug:对药物的反应;positive regulation of gene expression:基因表达的正向调控;negative regulation of apoptotic process:凋亡过程的负向调控;response to xenobiotic stimulus:对外源性刺激的反应;positive regulation of transcription, DNA-templated:DNA为模板转录的正向调控;positive regulation of transcription from RNA polymerase II promoter:RNA聚合酶II启动子转录的正向调控;protein phosphorylation:蛋白磷酸化;aging:老化;response to estradiol:对雌二醇的反应;peptidyl-serine phosphorylation:肽基-丝氨酸磷酸化;extracellular space:细胞外间隙;cytosol:细胞液;extracellular region:胞外区;cytoplasm:细胞质;cell surface:细胞表面;macromolecular complex:大分子配合物;nucleoplasm:核浆;membrane raft:膜筏;nucleus:细胞核;extracellular exosome:细胞外外泌体;enzyme binding:酶结合;identical protein binding:相同蛋白结合;protein binding:蛋白结合;protein kinase activity:蛋白激酶活性;protein homodimerization activity:蛋白同质二聚体活性;protein kinase binding:蛋白激酶结合;protein serine/threonine kinase activity:蛋白质丝氨酸/苏氨酸激酶活性;transcription factor binding:转录因子结合;protein tyrosine kinase activity:蛋白质酪氨酸激酶活性;RNA polymerase II transcription factor activity, ligand-activated sequence-specific DNA binding:RNA聚合酶II转录因子活性,配体激活序列特异性DNA结合。
KEGG通路富集分析结果显示,304个交集靶点共富集到相关通路176条。按照p值筛选排名前20的通路[11],并将其绘制成气泡图(图4)。其中气泡越大表示此信号通路富集的基因数目越多,气泡颜色越红表示此信号通路越显著。结果显示,花生红衣多酚抗动脉粥样硬化的作用靶点主要富集在癌症通路(101个靶点)、磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信号通路(61个靶点)、脂质与动脉粥样硬化(56个靶点)、卡波济肉瘤相关疱疹病毒感染(48个靶点)、人巨细胞病毒感染(48个靶点)、化学致癌-受体激活(45个靶点)、糖尿病并发症中的AGE-RAGE信号通路(40个靶点)、流体剪切应力和动脉粥样硬化(39个靶点)、IL-17信号通路(33个靶点)等。其中PI3K-Akt信号通路、脂质与动脉粥样硬化、流体剪切应力和动脉粥样硬化、IL-17信号通路、EGFR酪氨酸激酶抑制剂通路与动脉粥样硬化较为密切[13]。

图4 KEGG通路富集分析图
Fig.4 KEGG pathway enrichment analysis
注:Pathways in cancer:癌症通路;Prostate cancer:前列腺癌;Lipid and atherosclerosis:脂质与动脉粥样硬化;AGE-RAGE signaling pathway in diabetic complications:糖尿病并发症中的晚期糖基化终末产物(advanced glycosylation end products,AGE)-糖基化终末产物受体(receptor of AGEs,RAGE)信号通路;Hepatitis B:乙型肝炎;Kaposi sarcoma-associated herpesvirus infection:卡波济肉瘤相关疱疹病毒感染;PI3K-Akt signaling pathway:磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路;Human cytomegalovirus infection:人巨细胞病毒感染;Fluid shear stress and atherosclerosis:流体剪切应力和动脉粥样硬化;IL-17 signaling pathway:白细胞介素-17(Interleukin-17,IL-17)信号通路;Pancreatic cancer:胰腺癌;Chemical carcinogenesis-receptor activation:化学致癌-受体激活;Hepatitis C:丙型肝炎;Bladder cancer:膀胱癌;Proteoglycans in cancer:癌症蛋白多糖;EGFR tyrosine kinase inhibitor resistance:EGFR 酪氨酸激酶抑制剂;Non-small cell lung cancer:非小细胞肺癌;Melanoma:黑色素瘤;Hepatocellular carcinoma:肝细胞癌(下同)。
2.5 花生红衣多酚活性成分-靶点-通路关系网络
为了系统的阐述作用机制,利用Cytoscape软件,构建“花生红衣多酚活性成分-靶点-通路”网络图(图5)。其中红色正方形代表花生红衣多酚活性成分,绿色圆形代表靶点,橙色三角形代表通路。每条边代表花生红衣多酚活性成分与靶点、靶点与通路之间的相互作用关系。结果表明,度值较高(高于平均值)的活性成分有槲皮素、表没食子儿茶素没食子酸酯、木犀草素、山奈酚、漆黄素、异鼠李素、白杨素,为花生红衣多酚的主要活性成分。靶点AKT1、PIK3R1、MAPK1、EGFR和TP53显示出较高的关联度,是此关系网络的关键节点。由图5可知,花生红衣多酚中每个活性成分均作用于多靶点,如槲皮素作用于191个靶点,表没食子儿茶素没食子酸酯作用于141个靶点。此外,结果还表明,绝大部分靶点可与多个组分相互作用,且参与多条通路。如靶点HSP90AA1可与山奈酚、表儿茶素、儿茶素、原花青素B1、木犀草素、白杨素、漆黄素等多成分作用,参与PI3K-Akt信号通路、脂质与动脉粥样硬化、流体剪切应力和动脉粥样硬化以及IL-17信号通路。靶点AKT1能与山奈酚、漆黄素、木犀草素、白杨素、槲皮素、异鼠李素、表没食子儿茶素没食子酸酯作用,参与PI3K-Akt信号通路、脂质与动脉粥样硬化、流体剪切应力和动脉粥样硬化信号通路。表明花生红衣多酚是通过多成分、多靶点、多通路对动脉粥样硬化进行干预。

图5 花生红衣多酚活性成分-靶点-通路网络图
Fig.5 The network of “active components of peanut skin polyphenols-target-pathway”
3 分子对接
为进一步明确花生红衣多酚抗动脉粥样硬化的活性成分与关键靶点之间的结合效能,选取花生红衣酚类主要7个活性成分与“活性成分-靶点-通路”网络中前5个关键靶点进行分子对接。5个关键靶点分别为:AKT1(4EKL)、PIK3R1(4WAF)、MAPK1(4G6 N)、EGFR(2ITX)、TP53(5AOJ)。通常认为,分子对接结合能<0时说明两分子具有自发结合能力,分子对接结合能<-5.0 kJ/mol(-1.2 kcal/mol)时则表明两分子结合良好[14]。分子对接结合能越低,表明两分子结合活性越好。分子对接结果如表4所示,所有的花生红衣多酚活性成分与靶点都能良好的结合。山奈酚与靶点AKT1的结合能最低,为-8.52 kcal/mol;其次为表没食子儿茶素没食子酸酯与靶点EGFR,为-8.46 kcal/mol。将每个靶点结合最稳定的对接结果进行可视化,分别为山奈酚-AKT1、漆黄素-PIK3R1、木犀草素-MAPK1、表没食子儿茶素没食子酸酯-EGFR、木犀草素-TP53。由图6可看出,所选活性成分与靶点均可通过氢键结合,如山奈酚与AKT1于GLU228、ALA230、ASP439处共形成4个氢键,其中作为氢键供体与GLU228形成2个氢键。漆黄素与PIK3R1在GLY451、LEU452和ARG574处形成氢键。表儿茶素没食子酸酯则与EGFR于ARG776、VAL774、VAL769、ASP770、ASN771、LYS852、ASP1014、GLU1015、ILE1018多处形成氢键。

a-山奈酚-AKT1;b-漆黄素-PIK3R1;c-木犀草素-MAPK1;d-表没食子儿茶素没食子酸酯-EGFR;e-木犀草素-TP53
图6 花生红衣多酚部分活性成分和关键靶点的分子对接图
Fig.6 Molecular docking map of some active components of peanut skin polyphenols and key targets
注:淡紫色为靶点蛋白,绿色为活性成分,深紫色为形成氢键的氨基酸残基,黄色为氢键,数值为氢键长度。
表4 花生红衣多酚主要活性成分与关键靶点分子
对接结合能
Table 4 Binding energies of main active components of peanut skin polyphenols and key targets
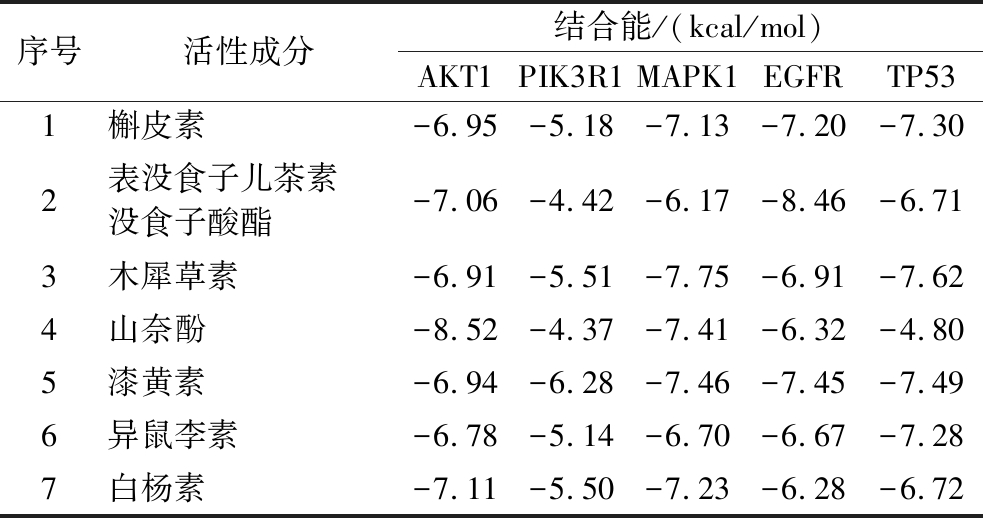
序号活性成分结合能/(kcal/mol)AKT1PIK3R1MAPK1EGFRTP531槲皮素-6.95-5.18-7.13-7.20-7.302表没食子儿茶素没食子酸酯-7.06-4.42-6.17-8.46-6.713木犀草素-6.91-5.51-7.75-6.91-7.624山奈酚-8.52-4.37-7.41-6.32-4.805漆黄素-6.94-6.28-7.46-7.45-7.496异鼠李素-6.78-5.14-6.70-6.67-7.287白杨素-7.11-5.50-7.23-6.28-6.72
4 讨论
作为花生加工业的副产物,花生红衣含有多种酚类物质,可作为多酚化合物的膳食来源。花生红衣多酚具有抑菌、抗氧化、降血脂等生理功能。近年来,花生红衣多酚类物质的抗动脉粥样硬化作用引起了广泛研究关注,但其活性成分及机制尚未完全阐明。为系统了解花生红衣多酚抗动脉粥样硬化的作用机制,本文采用网络药理学和分子对接技术对其进行研究。
通过数据库检索及筛选后,共获得13个花生红衣多酚活性成分,分别为山奈酚、表儿茶素、漆黄素、儿茶素、木犀草素、槲皮素、原花青素B1、表没食子儿茶素没食子酸酯等。其中槲皮素具有广泛的药理学作用,如抗炎、抗氧化和抗增殖,可通过调节氧化应激、细胞凋亡和炎症反应抑制高果糖喂养导致小鼠的动脉粥样硬化程度,降低动脉粥样硬化斑块的大小[7]。表儿茶素可使ApoE*3-Leiden小鼠的动脉粥样硬化病变面积减少,且可减弱主动脉中由核因子κB(nuclear factor-κB,NF-κB)调节的饮食诱导致动脉粥样硬化性的炎症过程(如细胞趋化性、基质重塑)[8]。在巨噬细胞模型中,木犀草素通过抑制活性氧(reactive oxygen species,ROS)的产生、促炎细胞因子(TNF-α、IL-6、IL-18和IL-1β)的表达、脂质积累和NACHT-LRR-PYD结构域蛋白3(nacht,lrr and pyd domains-containing protein3,NLRP3)炎性小体的激活,从而减轻巨噬细胞极化、泡沫细胞的形成、凋亡和炎症[15]。在巨噬细胞模型中,原花青素B1通过降低ROS水平,下调细胞表面膜分子中低亲和力免疫球蛋白-γFc区受体Ⅲ/Ⅱ、肿瘤坏死因子受体超家族成员5、T淋巴细胞活化抗原CD86和Toll样受体4的表达,发挥抗炎作用和抑制巨噬细胞凋亡[16]。由此可推测,花生红衣多酚通过多成分共同对动脉粥样硬化进行干预。
通过蛋白互作网络拓扑分析,获得花生红衣多酚活性成分抗动脉粥样硬化的65个核心靶点。这些靶点主要包括TP53、STAT3、AKT1、EGFR、MAPK1、MAPK3、TNF等。EGFR属于酪氨酸激酶型受体。研究发现EGFR参与血管病理生理过程和巨噬细胞氧化应激的调节,在动脉粥样硬化发病机制中起着关键作用。在高脂饮食喂养的ApoE-/-小鼠模型中,小鼠血浆中EGFR磷酸化水平及其活性显著增加;EGFR抑制剂能够抑制氧化应激、促炎细胞因子的诱导产生、泡沫细胞的形成以及平滑肌细胞增殖,从而抑制动脉粥样硬化斑块的生成[17]。骨髓细胞EGFR的缺失能够下调IL-6、TNF-α的表达,减少脂质的摄取和炎症反应,从而抑制动脉粥样硬化的发展[18]。SRC是SRC激酶家族中的一员,它在调节血管平滑肌细胞中内皮素-1诱导的MAPK磷酸化和早期生长反应蛋白-1的表达起着关键作用[19]。TAO等[20]的研究表明,SRC参与了形成泡沫细胞的信号通路Src/PI3K/Ras相关C3肉毒毒素底物1(ras-related C3 botulinum toxin substrate 1,Rac1),抑制SRC可降低PI3K的表达水平、Rac1的磷酸化和泡沫细胞的生成。作为PI3K-Akt信号通路的核心因子,AKT在葡萄糖转运、糖酵解、蛋白质合成、脂肪生成、细胞增殖和凋亡等多种生物过程中发挥关键作用。它可通过胰岛素样生长因子-1受体的信号传导调节平滑肌细胞凋亡[21]。在脂肪代谢过程中,活化AKT通过调控一系列与脂肪酸合成相关的基因表达,增加细胞中脂肪酸和磷酸甘油酯的浓度[22]。MAPK1、MAPK3均属于MAPKs家族,MAPKs调节基本的生物过程以及细胞对外部应激信号的反应,并能够调节炎症介质和凋亡介质的合成[23]。TNF、IL-6与炎症有关,TNF可调节细胞炎症、分化、增殖和凋亡等各种细胞过程[24]。IL-6通过增加内皮细胞中的低密度脂蛋白受体和氧化脂蛋白受体-1的信使核糖核酸表达,而促进动脉粥样硬化斑块的形成[25]。HSP90AA1属于热休克蛋白家族,可调节蛋白质的折叠、信号转导、易位和转录[26]。有研究显示,HSP90在动脉粥样硬化患者的斑块中高度表达,与斑块不稳定有关。HSP90也可通过抑制血管平滑肌细胞的迁移和增殖来减弱动脉粥样硬化斑块的形成[27]。
KEGG富集的前20条通路中,与动脉粥样硬化相关的通路主要有 PI3K-Akt信号通路、脂质与动脉粥样硬化、流体剪切应力和动脉粥样硬化、IL-17信号通路、EGFR 酪氨酸激酶抑制剂通路。脂质与动脉粥样硬化是主要的富集通路之一,共涉及56个靶点。通过活性成分-靶点-通路图筛选的关键靶点TP53、PIK3R1、MAPK1、AKT1均富集于此通路中。PI3K-Akt信号通路参与细胞凋亡和炎症反应[7]。研究表明槲皮素能够通过激活PI3K-Akt信号通路,使B细胞淋巴瘤因子2/半胱氨酸天冬氨酸蛋白酶-3信号通路失活,从而改善高果糖喂养引起的动脉粥样硬化[7]。流体剪切应力是流动血液与血管壁内皮表面之间的一种摩擦力。动脉粥样硬化在一些特定区域形成病变,此区域的剪切应力受到干扰[13]。内皮细胞暴露受干扰的血流中时,将激活MAPKs和NF-κB信号通路,进而上调内皮细胞中血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)、CC类趋化因子配体2(C-C motif chemokine 2,CCL2)、细胞间黏附因子-1(intercellular adhesion molecule 1,ICAM1)、TNF-α、IL-6的表达,从而促进内皮细胞损伤、白细胞聚集和动脉粥样硬化[28-29]。IL-17信号通路在炎症反应中发挥重要作用。近年来的研究表明,虽然IL-17在不同情况下可能起到促进或抗动脉粥样硬化作用,但可以肯定的是IL-17与动脉粥样硬化的发生有着密切联系[30]。因此,花生红衣多酚可能是通过干预炎症、细胞增殖和凋亡、脂质代谢等过程而发挥抗动脉粥样硬化作用。
综上所述,本研究通过运用网络药理学和分子对接方法,对花生红衣多酚抗动脉粥样硬化的核心靶点和主要信号通路进行了预测。其中核心靶点有TP53、PIK3R1、MAPK1、AKT1、EGFR等,主要信号通路涉及PI3K-Akt信号通路、脂质与动脉粥样硬化、流体剪切应力和动脉粥样硬化、IL-17信号通路、EGFR 酪氨酸激酶抑制剂通路。花生红衣多酚是通过多成分、多靶点、多通路干预脂质代谢、炎症、细胞增殖和凋亡等多个生理过程而发挥抗动脉粥样硬化作用,从而为下一步实验验证花生红衣抗动脉粥样硬化的作用机制提供思路,同时也为花生红衣抗动脉粥样硬化功能健康食品的开发提供新的方向,后续还需进一步开展体内实验验证等研究。
[1] 高锦鸿, 芦鑫, 孙强, 等.不同品种花生红衣中八种酚类物质成分分析[J].食品与发酵工业, 2022,48(14):218-225.
GAO J H, LU X, SUN Q, et al.Analysis of eight phenolic contents in peanuts skin from different cultivars[J].Food and Fermentation Industries, 2022,48(14):218-225.
[2] YU J M, AHMEDNA M, GOKTEPE I.Effects of processing methods and extraction solvents on concentration and antioxidant activity of peanut skin phenolics[J].Food Chemistry, 2005,90(1-2):199-206.
[3] MA Y Y, ![]() A, KERR W L, et al.Separation and characterization of phenolic compounds from dry-blanched peanut skins by liquid chromatography-electrospray ionization mass spectrometry[J].Journal of Chromatography A, 2014,1356:64-81.
A, KERR W L, et al.Separation and characterization of phenolic compounds from dry-blanched peanut skins by liquid chromatography-electrospray ionization mass spectrometry[J].Journal of Chromatography A, 2014,1356:64-81.
[4] BODOIRA R, CECILIA CITTADINI M, VELEZ A, et al.An overview on extraction, composition, bioactivity and food applications of peanut phenolics[J].Food Chemistry, 2022,381:132250.
[5] AHMADI A, JAMIALAHMADI T, SAHEBKAR A.Polyphenols and atherosclerosis:A critical review of clinical effects on LDL oxidation[J].Pharmacological Research, 2022,184:106414.
[6] CHENG X B, ZHAO C L, JIN Z W, et al.Natural products:potential therapeutic agents for atherosclerosis[J].Chinese Journal of Natural Medicines, 2022,20(11):830-845.
[7] LU X L, ZHAO C H, YAO X L, et al.Quercetin attenuates high fructose feeding-induced atherosclerosis by suppressing inflammation and apoptosis via ROS-regulated PI3K/AKT signaling pathway[J].Biomedicine &Pharmacotherapy, 2017,85:658-671.
[8] MORRISON M, VAN DER HEIJDEN R, HEERINGA P, et al.Epicatechin attenuates atherosclerosis and exerts anti-inflammatory effects on diet-induced human-CRP and NFκB in vivo[J].Atherosclerosis, 2014,233(1):149-156.
[9] TOOMER O T, VU T, PEREIRA M, et al.Dietary supplementation with peanut skin polyphenolic extracts (PSPE) reduces hepatic lipid and glycogen stores in mice fed an atherogenic diet[J].Journal of Functional Foods, 2019,55:362-370.
[10] XU M J, LV C, WANG H X, et al.Peanut skin extract ameliorates high-fat diet-induced atherosclerosis by regulating lipid metabolism, inflammation reaction and gut microbiota in ApoE-/-mice[J].Food Research International, 2022,154:111014.
[11] 王腾飞, 段瑞斌, 杨佳丽, 等.基于网络药理学和分子对接探讨毛建茶干预高脂血症的作用机制[J].食品科学, 2023,44(9):7-14.
WANG T F, DUAN R B, YANG J L, et al.Using network pharmacology and molecular docking to explore the mechanism by which Dracocephalum rupestre hance tea intervenes in hyperlipidemia[J]. Food Science, 2023, 44(9):7-14.
[12] 杨娟, 豆佳红, 孙悦龙, 等.基于网络药理学与分子对接和实验验证探讨费菜抗炎作用的分子机制[J].食品工业科技, 2023, 44(4):12-21.
YANG J, DOU J H, SUN Y L, et al.Molecular mechanism of Phedimus aizoon (Linnaeus)’t hart.on anti-inflammatory effect based on network pharmacology and molecular docking and experiment research[J].Science and Technology of Food Industry, 2023, 44(4):12-21.
[13] BI Y M, HAN X, LAI Y G, et al.Systems pharmacological study based on UHPLC-Q-Orbitrap-HRMS, network pharmacology and experimental validation to explore the potential mechanisms of Danggui-Shaoyao-San against atherosclerosis[J].Journal of Ethnopharmacology, 2021,278:114278.
[14] DUAN H, KHAN G J, SHANG L J, et al.Computational pharmacology and bioinformatics to explore the potential mechanism of Schisandra against atherosclerosis[J].Food and Chemical Toxicology, 2021,150:112058.
[15] ZHANG B C, LI Z, XU W, et al.Luteolin alleviates NLRP3 inflammasome activation and directs macrophage polarization in lipopolysaccharide-stimulated RAW264.7 cells[J].American Journal of Translational Research, 2018,10(1):265-273.
[16] 张宸豪, 李瑶, 李正祎, 等.原花青素B1对LPS诱导小鼠巨噬细胞RAW264.7损伤的保护作用及其机制[J].吉林大学学报(医学版), 2019,45(6):1243-1247;1481.
ZHANG C H, LI Y, LI Z Y, et al.Protective effect of procyanidine B1 on LPS-induced injury of mouse macrophages RAW264.7 and its mechanism[J].Journal of Jilin University(Medicine Edition), 2019,45(6):1243-1247;1481.
[17] WANG L T, HUANG Z Q, HUANG W J, et al.Inhibition of epidermal growth factor receptor attenuates atherosclerosis via decreasing inflammation and oxidative stress[J].Scientific Reports, 2017,7:45917.
[18] ZEBOUDJ L, GIRAUD A, GUYONNET L, et al.Selective EGFR (epidermal growth factor receptor) deletion in myeloid cells limits atherosclerosis—brief report[J].Arteriosclerosis, Thrombosis, and Vascular Biology, 2018,38(1):114-119.
[19] SIMO-CHEYOU E R, VARDATSIKOS G, SRIVASTAVA A K.Src tyrosine kinase mediates endothelin-1-induced early growth response protein-1 expression via MAP kinase-dependent pathways in vascular smooth muscle cells[J].International Journal of Molecular Medicine, 2016,38(6):1879-1886.
[20] TAO H, YANCEY P G, BABAEV V R, et al.Macrophage SR-BI mediates efferocytosis via Src/PI3K/Rac1 signaling and reduces atherosclerotic lesion necrosis[J].Journal of Lipid Research, 2015,56(8):1449-1460.
[21] ABEYRATHNA P, SU Y C.The critical role of Akt in cardiovascular function[J].Vascular Pharmacology, 2015,74:38-48.
[22] ZHANG T Y, HUANG J T, YI Y Q, et al.Akt serine/threonine kinase 1 regulatede Novo fatty acid synthesis through the mammalian target of rapamycin/sterol regulatory element binding protein 1 axis in dairy goat mammary epithelial cells[J].Journal of Agricultural and Food Chemistry, 2018,66(5):1197-1205.
[23] REN Q, GUO F, TAO S B, et al.Flavonoid fisetin alleviates kidney inflammation and apoptosis via inhibiting Src-mediated NF-κB p65 and MAPK signaling pathways in septic AKI mice[J].Biomedicine &Pharmacotherapy, 2020,122:109772.
[24] XU T, WANG Q G, LIU M.A network pharmacology approach to explore the potential mechanisms of huangqin-baishao herb pair in treatment of cancer[J].Medical Science Monitor: International Medical Journal of Experimental and Clinical Research, 2020,26:e923199.
[25] VALTER L, MORENA G, RITA P M, et al.Relationship among IL-6, LDL cholesterol and lipid peroxidation[J].Cellular and Molecular Biology Letters, 2015,20(2):310-322.
[26] ZHOU C Y, CHEN J, ZHANG H Z, et al.Investigation of the chemical profile and anti-inflammatory mechanisms of flavonoids from Artemisia vestita Wall.ex Besser via targeted metabolomics, zebrafish model, and network pharmacology[J].Journal of Ethnopharmacology, 2023,302:115932.
[27] KIM J, JANG S, PARK E, et al.The role of heat shock protein 90 in migration and proliferation of vascular smooth muscle cells in the development of atherosclerosis[J].Journal of Molecular and Cellular Cardiology, 2014,72:157-167.
[28] NAKAYAMA A, ALBARR N-JU
N-JU REZ J, LIANG G Z, et al.Disturbed flow-induced Gs-mediated signaling protects against endothelial inflammation and atherosclerosis[J].JCI Insight, 2020,5(23):e140485.
REZ J, LIANG G Z, et al.Disturbed flow-induced Gs-mediated signaling protects against endothelial inflammation and atherosclerosis[J].JCI Insight, 2020,5(23):e140485.
[29] ZHOU J, LI Y S, CHIEN S.Shear stress-initiated signaling and its regulation of endothelial function[J].Arteriosclerosis, Thrombosis, and Vascular Biology, 2014,34(10):2191-2198.
[30] MOEINAFSHAR A, RAZI S, REZAEI N.Interleukin 17, the double-edged sword in atherosclerosis[J].Immunobiology, 2022,227(3):152220.