姜(Zingiber officinale Rosc.)是我国中部、南部地区常见的药食同源植物,其未成熟的根茎又称为仔姜,仔姜脆嫩、香味浓郁、辛辣适中,含有姜辣素、姜烯酚、姜酮等多种生物活性物质,具有止吐健脾、抗氧化、抗肿瘤、保肝利胆、杀菌等功效[1]。仔姜因为水分含量高,外皮幼嫩,采后易萎蔫、褐变,使仔姜的商品性严重降低。
目前,部分农户采用沙藏的方式来保存仔姜,沙藏具有保湿、控制透气的功能,但因耗时耗力,占地面积大、脏乱难管理等原因无法应用于现代化冷藏库中,并不适合大规模贮藏。包装技术作为一种非化学、绿色保鲜手段,易被消费者接受。一方面包装建立了空气对流的屏障,最大限度地减少气流将水分从果蔬周围带走的速率,抑制果蔬蒸腾作用[2];另一方面,包装密封性的特点结合果蔬自身的呼吸作用有助于达到低氧高二氧化碳的贮藏环境,实现包装的自发气调,从而抑制果蔬呼吸作用,减缓新陈代谢[3]。研究表明,短时间超低氧处理能提高抗氧化酶活性,减慢超氧阴离子自由基![]() 产生速率,减缓活性氧(reactive oxygen species,ROS)对细胞的伤害,保证了细胞膜的完整性,进一步抑制多酚氧化酶和酚类物质的结合,减缓酶促褐变进程,维持果蔬的品质[4]。向包装袋或贮藏库中充入惰性气体是果蔬保鲜中形成超低氧的常见方法,其在控制果蔬酶促褐变、维持良好视觉感官品质和延长保质期方面的有效性已在菠萝[5]、苹果[6]、火龙果[7]等果蔬中得到较好的实践。
产生速率,减缓活性氧(reactive oxygen species,ROS)对细胞的伤害,保证了细胞膜的完整性,进一步抑制多酚氧化酶和酚类物质的结合,减缓酶促褐变进程,维持果蔬的品质[4]。向包装袋或贮藏库中充入惰性气体是果蔬保鲜中形成超低氧的常见方法,其在控制果蔬酶促褐变、维持良好视觉感官品质和延长保质期方面的有效性已在菠萝[5]、苹果[6]、火龙果[7]等果蔬中得到较好的实践。
然而长时间超低氧处理将果蔬暴露在低氧水平下,会引发无氧呼吸,导致乙醛和乙醇含量增加,进而导致异味的产生,影响果蔬的风味和品质。有文献表明,果蔬中异味的产生主要与果蔬组织厌氧呼吸相关[8],在无氧呼吸过程中,丙酮酸脱羧酶(pyruvate decarboxylase,PDC)和乙醇脱氢酶(alcohol dehydrogenase,ADH)是乙醇发酵的2个关键酶,负责植物组织中厌氧产物的积累,PDC催化丙酮酸转化为乙醛,而ADH将乙醛转化为乙醇[9]。微孔膜技术在果蔬采后保鲜的应用已比较广泛,它能根据生鲜食品的生理代谢特点,灵活调节包装内CO2和O2的体积和相对湿度,使薄膜渗透性与产品的呼吸频率相匹配,让果蔬维持微弱的有氧呼吸,避免果蔬水分流失、无氧呼吸以及过量的CO2引起的生理紊乱[10]。微孔膜技术操作简易,贮藏过程中在进行了一定时间的超低氧处理后再打孔,避免出现长期超低氧造成的无氧呼吸问题。
目前,果蔬中常使用的商业薄膜多为氧气透过率较大的低密度聚乙烯(low density polyethylene,LDPE)或双向拉伸聚丙烯(biaxially oriented polypropylene,BOPP)材质,如LDPE氧气透过率为3 900~25 000 cm3/(m2·24 h·0.1 MPa),BOPP氧气透过率为2 000~4 000 cm3/(m2·24 h·0.1 MPa),较大透气率膜通过自发气调不易形成超低氧环境[11]。本实验摒弃传统果蔬包装中使用高透气性包装材料的方法,选用高阻隔性的PET12/PE15/CPP30[氧气透过率为116 cm3/(m2·24 h·0.1 MPa)]复合材质为包装材料,并与微孔包装相结合,探究高阻隔包装构建的超低氧环境短期处理及其与微孔包装的协同技术对仔姜贮藏保鲜的影响,为仔姜贮藏保鲜寻找另外一种可行的方法。
1 材料与方法
1.1 材料与试剂
仔姜,天生农贸市场,在采购商从种植农户手中收购后立即送到实验室。
PET12/PE15/CPP30膜[氧气透过率:116 cm3/(m2·24 h·0.1 MPa),23 ℃],顶新集团(康师傅)重庆顶正包材有限公司。化学试剂均为分析纯。
1.2 仪器与设备
RXZ-8000智能人工气候箱,宁波东南仪器有限公司;H1650R台式高速冷冻离心机,湖南湘仪公司;UV-2450PC紫外可见分光光度计、GC-2010 plus气相色谱仪,日本岛津公司SHIMADZU;DDS-307A电导率仪,上海雷磁公司;WR-18色差仪,深圳威福光电科技有限公司。
1.3 实验方法
1.3.1 样品准备
将挑选好的仔姜表面附着物及泥土清理干净,晾干备用。采用PET12/PE15/CPP30包装袋进行包装,每袋放入(130±5) g仔姜,将仔姜随机分为4组处理:a)CK组:包装密封后马上打1个微孔,微孔的孔径为0.35 mm(以下打孔孔径均为0.35 mm),形成无超低氧环境贮藏;b)A组:直接包装密封,形成长期超低氧环境贮藏;c)B组:密封包装形成超低氧环境达到3 d后,再打1个微孔贮藏;d)C组:密封包装形成超低氧环境达到3 d后,再打2个微孔贮藏。各组处理好后置于人工气候箱中,贮藏环境设置为12 ℃、相对湿度95%,试验周期设置20 d,每个处理设置3个重复。每4 d随机取样一次,进行各项指标测定。
1.3.2 指标检测
1.3.2.1 感官评价
参考邓青芳等[12]的方法,略有改动,感官评定标准见表1。每项指标最高分为10分,最低分为1分,最终用比例加权法计算总分。果皮、质地、气味、褐斑程度占总分比例分别为25%、25%、25%、25%,根据总分评定仔姜的品质。结果取平均值,本实验中以6分及以上为具有商品性。
表1 仔姜感官评分表
Table 1 Evaluation standard of sensory properties of baby ginger

分值果皮质地气味褐斑程度8~10白色,无褶皱 脆性大,饱满 浓郁的姜气味 无褐斑现象 5~7黄白色,光泽暗淡,稍有褶皱脆性较弱,稍有失水稍有姜气味 轻微褐斑现象2~4淡黄色,无光泽,褶皱较严重脆性弱、失水较严重无姜味、稍有异味褐斑较严重 ≤2黄色,无光泽,褶皱严重 无脆性、失水严重 异味严重 褐斑严重
1.3.2.2 顶空气体成分
采用丹麦膜康公司的CheckMate 3顶空气体分析仪进行检测。测定前先用顶空气体分析仪检测大气中的O2和CO2浓度,进行仪器校准核查。然后将检测针头通过防雾膜上的硅胶片插入包装中,直接检测包装内的O2和CO2浓度,每个平行重复测定3次,测试过程中注意避免针头与仔姜的接触。
1.3.2.3 超氧阴离子自由基![]() 产生速率
产生速率
参照曹建康等[13]的方法并稍作修改,测定仔姜![]() 产生速率,结果以nmol/(min·g)表示。
产生速率,结果以nmol/(min·g)表示。
1.3.2.4 超氧化物歧化酶(superoxide dismutase,SOD)活性
参照曹建康等[13]的方法并稍作修改,测定仔姜SOD活性,结果以U/g表示。
1.3.2.5 过氧化氢酶(catalase,CAT)活性
参照曹建康等[13]的方法并稍作修改,测定仔姜CAT活性,CAT的活性单位为:0.01ΔOD240/(min·g),记为U/g。
1.3.2.6 相对电导率
参照游玉明等[14]的方法并稍作修改,测定仔姜的相对电导率,计算如公式(1)所示:
(1)
式中:γe,相对电导率,%;γ1,煮沸前电导率,μs/cm;γ0,煮沸后电导率,μs/cm。
1.3.2.7 丙二醛(malondialdehyde,MDA)含量
参照唐先谱等[15]的方法并进行稍作修改,测定仔姜MDA含量,结果以μmol/g表示。
1.3.2.8 色差值
参考付云云等[1]的方法使用色差仪测定,测定L*、a*、b*值,贮藏后与贮藏前的颜色变化用ΔE表示,按公式(2)计算:
(2)
式中:![]() 果实在贮藏一定时间和贮藏0天时的亮度;
果实在贮藏一定时间和贮藏0天时的亮度;![]() 果实贮藏一定时间和贮藏0天时的红绿偏向;
果实贮藏一定时间和贮藏0天时的红绿偏向;![]() 果实在贮藏一定时间和贮藏0天时的黄蓝偏向。
果实在贮藏一定时间和贮藏0天时的黄蓝偏向。
1.3.2.9 总酚含量
参考曹建康等[13]的方法并稍作修改,测量仔姜的总酚含量,单位以OD280/g表示。
1.3.2.10 多酚氧化酶(polyphenol oxidase,PPO)活性
参考曹建康等[13]的方法并稍作修改,测定仔姜PPO活性,结果以ΔOD420/(min·g)表示。
1.3.2.11 PDC、ADH活性
参照曹建康等[13]的方法,测量仔姜的PDC、ADH活性,PDC或ADH的活性单位为:0.01ΔOD340/(min·g),记为U/g。
1.3.2.12 乙醛含量、乙醇含量
参照程曦等[16]的方法进行修改,色谱柱:DB-WAX毛细管柱(30 m,0.25 mm,25 μm);FID检测器温度200 ℃,氢气流速为40 mL/min,空气流速400 mL/min,尾吹(N2)流速30 mL/min;进样口温度200 ℃,分流比为20∶1;柱流速为1 mL/min;柱温平衡时间1 min,程序升温40 ℃(保持3 min),以6 ℃/min升至110 ℃;进样量1 μL。
1.4 数据统计分析
使用Microsoft Excel 2018对实验数据进行数据计算;用IBM SPSS Statistics 21对指标进行显著性分析,P<0.05表示有显著差异,P<0.01表示有极显著差异,P>0.05表示差异不显著;最后用Origin 2018制图。
2 结果与分析
2.1 短期超低氧处理对仔姜感官评价的影响
如图1所示,在贮藏期间,所有处理组的感官评价随着时间的延长而逐渐下降。其中,CK组(无超低氧组)的感官评分下降最快,在第16天丧失商品性,感官评分仅为5.6分;A组(长期超低氧组)在贮藏前期感官评价维持较好,在第12天前与C组差异不显著(P>0.05),但在贮藏后期由于超低氧处理时间过长,加剧了仔姜感官品质的下降,到贮藏结束(第20天)只有5.74分,丧失了商品价值;而B(超低氧3 d-1微孔)、C(超低氧3 d-2微孔)2组分别有6.46分、6.03分,与CK组呈现差异极显著(P<0.01),其原因可能是前期超低氧处理有利于减缓仔姜呼吸,后期通过维持低氧状态,更好地维持了仔姜的感官品质。

图1 短期超低氧处理对仔姜感官评价的影响
Fig.1 Effects of short-term ultra-hypoxic treatment on sensory evaluation of baby ginger
2.2 短期超低氧处理对仔姜顶空气体成分的影响
2.2.1 短期超低氧处理对仔姜O2含量的影响
果蔬在采摘后,仍会进行一系列代谢活动,如呼吸作用,会导致O2消耗,CO2产生。如图2所示,在第1天时,A、B、C 3组的O2浓度大幅度下降,分别由20.1%下降至5.84%、6.08%、5.94%,第2天时O2就被消耗殆尽,而CK组由于初期就在包装膜表面打微孔,所以O2含量一直维持在10%左右,与A、B、C组差异极显著(P<0.01)。在贮藏第4天时,因为B、C 2组进行了不同微孔数处理,B、C 2组的O2含量从0%左右开始上升,至贮藏结束时,B、C 2组的O2含量分别上升到9.87%、15.93%左右。在贮藏后期,C组和CK组差异不显著(P>0.05),A组和CK、B、C 3组呈现差异极显著(P<0.01)。

图2 短期超低氧处理对仔姜O2含量的影响
Fig.2 Effects of short-term ultra-hypoxic treatment on O2 content of baby ginger
2.2.2 短期超低氧处理对仔姜CO2含量的影响
如图3所示,在第4天前,A组、B组、C组的CO2含量都在20%左右,与CK组呈现差异极显著(P<0.01),随着贮藏时间的延长,A组的CO2含量持续上升,至贮藏结束时,A组的CO2含量到达了50.1%,有文献表明,当CO2浓度过高时会导致无氧呼吸,加速乙醛积累和颜色变化,对果蔬品质产生负面影响,引发果蔬CO2中毒现象[17]。在贮藏中后期时,B组的CO2的含量一直维持在13%左右,CK、C 2组的CO2的含量一直维持在10%左右,B组与CK、A、C 3组差异极显著(P<0.01)。结合感官评价分析可以说明,进行长期的超低氧处理不利于果蔬贮藏,并且CK组的处理方式(O2浓度维持在中等浓度水平)也会加快呼吸速率,不利于仔姜品质的维持,所以先进行短期超低氧处理,再在低O2高CO2的气体环境中贮藏可以更好地维持仔姜生命活力,以延长保鲜期。
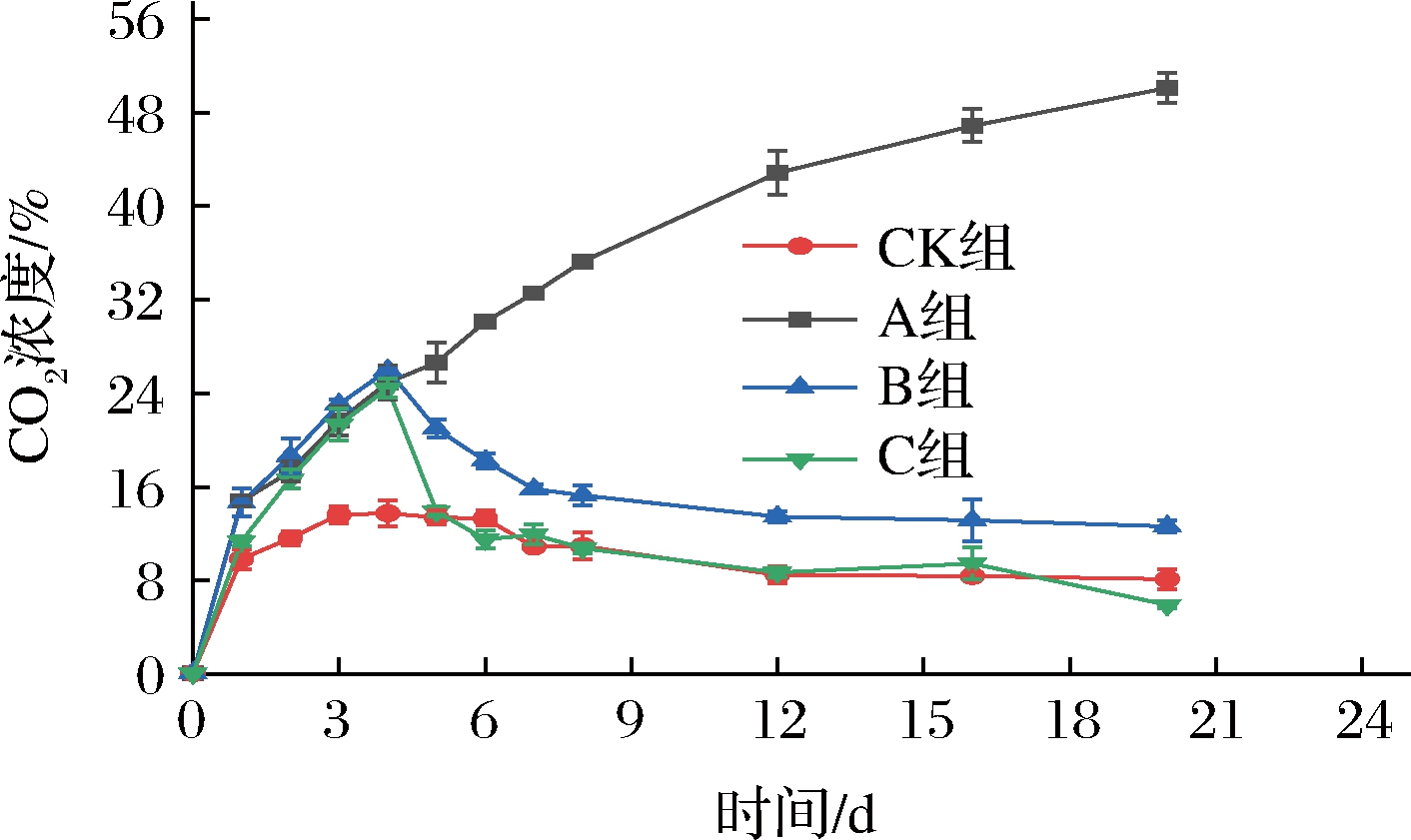
图3 短期超低氧处理对仔姜CO2含量的影响
Fig.3 Effects of short-term ultra-hypoxic treatment on CO2 content of baby ginger
2.3 短期超低氧处理对仔姜超氧阴离子产生速率的影响
![]() 在果蔬膜脂过氧化、膜损伤和衰老中起着重要作用。如图4所示,各组的
在果蔬膜脂过氧化、膜损伤和衰老中起着重要作用。如图4所示,各组的![]() 产生速率随贮藏时间的延长呈先上升后下降的趋势。在第4天时,CK组的
产生速率随贮藏时间的延长呈先上升后下降的趋势。在第4天时,CK组的![]() 产生速率是最快的,与A、B、C 3组形成差异极显著(P<0.01),可能是因为CK组的O2含量较高,呼吸作用导致
产生速率是最快的,与A、B、C 3组形成差异极显著(P<0.01),可能是因为CK组的O2含量较高,呼吸作用导致![]() 产生速率加快,第8天时,各组的
产生速率加快,第8天时,各组的![]() 产生速率都达到了最高值,
产生速率都达到了最高值,![]() 产生的速度依次为:A组>CK组>C组>B组,其中CK、A、B、C四组的
产生的速度依次为:A组>CK组>C组>B组,其中CK、A、B、C四组的![]() 产生速率分别为0.120、0.122、0.116、0.119 nmol/(min·g),其原因可能是A组发生无氧呼吸,加剧了
产生速率分别为0.120、0.122、0.116、0.119 nmol/(min·g),其原因可能是A组发生无氧呼吸,加剧了![]() 的产生速率。第8天后,各组
的产生速率。第8天后,各组![]() 产生速率呈现下降趋势,在贮藏末期,B组、C组和A组、CK组形成差异极显著(P<0.01),说明短期超低氧处理更有利于抑制
产生速率呈现下降趋势,在贮藏末期,B组、C组和A组、CK组形成差异极显著(P<0.01),说明短期超低氧处理更有利于抑制![]() 的产生,但B组的
的产生,但B组的![]() 产生速率低于C组,说明短期超低氧处理后维持在低氧的状态更有利于保护细胞膜。
产生速率低于C组,说明短期超低氧处理后维持在低氧的状态更有利于保护细胞膜。
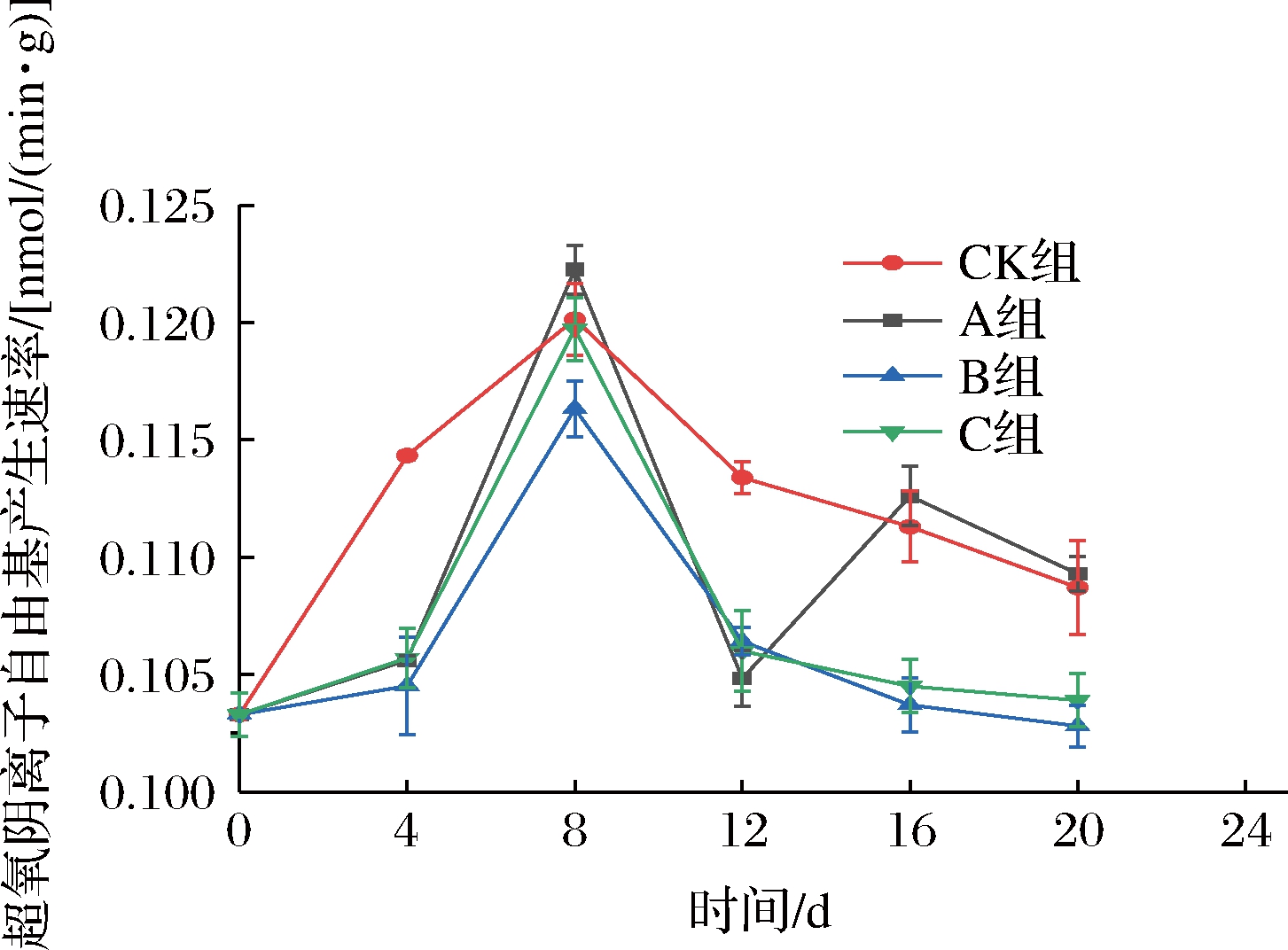
图4 短期超低氧处理对仔姜![]() 产生速率的影响
产生速率的影响
Fig.4 Effects of short-term ultra-hypoxic treatment on ![]() production rate of baby ginger
production rate of baby ginger
2.4 短期超低氧处理对仔姜SOD活性的影响
SOD是ROS酶促清除系统中重要的清除酶,主要功能是通过歧化作用清除超氧自由基,生成H2O2和O2,而H2O2再被CAT和POD进一步催化生成H2O和O2清除植物体内超氧自由基,其活性大小可以反映细胞对逆境的适应能力[18]。如图5所示,各组SOD活性整体呈现下降的趋势。在0~4 d时,各组SOD活性变化不明显,但是在贮藏第4天后,各组呈现差异性变化,其中CK组SOD活性下降最快,到贮藏结束时,CK组的SOD活性仅有0.58 U/g,比贮藏初期减少了1.23 U/g。从8 d开始,CK组与B组呈现差异极显著(P<0.01),在12~20 d时,CK组和C组呈现差异极显著(P<0.01)。在整个贮藏过程中,除第8天外,B组和C组差异不显著(P>0.05)。在贮藏末期时,A组和B组呈现差异显著(P<0.05),它们的SOD活性分别为0.64、0.70 U/g。由此可知,短期超低氧处理能更好地抑制SOD活性下降。

图5 短期超低氧处理对仔姜SOD活性的影响
Fig.5 Effects of short-term ultra-hypoxic treatment on SOD activity of baby ginger
2.5 短期超低氧处理对仔姜CAT活性的影响
CAT是重要的抗氧化酶之一,在ROS清除中起着关键作用,特别是对于H2O2的清除。如图6所示,各组的CAT活性呈先升后降的趋势。在第12天时,A、B、C 3组的CAT活性才达到最大值,分别为63.78、73.67、66.33 U/g,而CK组在第8天已经达到了最大值,为49.11 U/g,且CK组的CAT活性最大值小于A、B、C 3组的最大值,说明超低氧处理能够提升CAT活性,同时还能推迟CAT活性到达最大值的时间。除第20天外,CK组和A、B、C 3组差异显著(P<0.05);除CK组的CAT活性在第8天后开始下降,其余各组CAT活性均在贮藏第12天后开始下降,至贮藏结束时各组CAT活性分别为初始值的0.84倍、0.73倍、1.81倍、1.22倍;在贮藏末期,A组与B、C 2组差异极显著(P<0.01),在第20天时,B、C 2组差异显著(P<0.05)。由此可知,超低氧处理能够有效保护仔姜细胞的品质,延缓CAT的活性,但是在延缓CAT活性的降低上,短期超低氧处理和维持低氧状态更有效。

图6 短期超低氧处理对仔姜CAT活性的影响
Fig.6 Effects of short-term ultra-hypoxic treatment on CAT activity of baby ginger
2.6 短期超低氧处理对仔姜相对电导率的影响
膜通透性可用于反映细胞膜结构和功能的完整性,由于内部各种代谢物和不利的外部因素引起的膜损伤总是导致膜通透性的增加,所以测量电导率可评估膜渗透率[18]。如图7所示,各组相对电导率随贮藏时间的延长而增大,其中在0~4 d时,CK组电导率上升最快,数值为57.66%,并且与A组、B、C三组差异显著(P<0.05),原因是CK组的贮藏环境一直处于O2浓度较高的环境中,细胞呼吸加快,加快了自由基的积累,导致细胞膜完整性遭到了破坏;在贮藏后期,A组的上升速度最快,可能是因为A组出现了无氧呼吸,产生的乙醛和乙醇会增加膜流动性和电解质泄漏[19],与CK、B、C 3组出现差异极显著(P<0.01)。B、C 2组的相对电导率上升速度相对较小,原因可能B、C 2组经过了短期超低氧处理,减弱了呼吸强度,从而仔姜代谢速率降低,在贮藏结束时数值分别为67.05%、69.92%。综合而言,长期超低氧处理对仔姜的细胞膜造成严重损伤,而短期的超低氧处理更有利于贮藏过程中仔姜细胞膜的保护,可以有效抑制相对电导率增大。因此,为抑制仔姜相对电导率的增大,应该将仔姜进行短期超低氧处理。
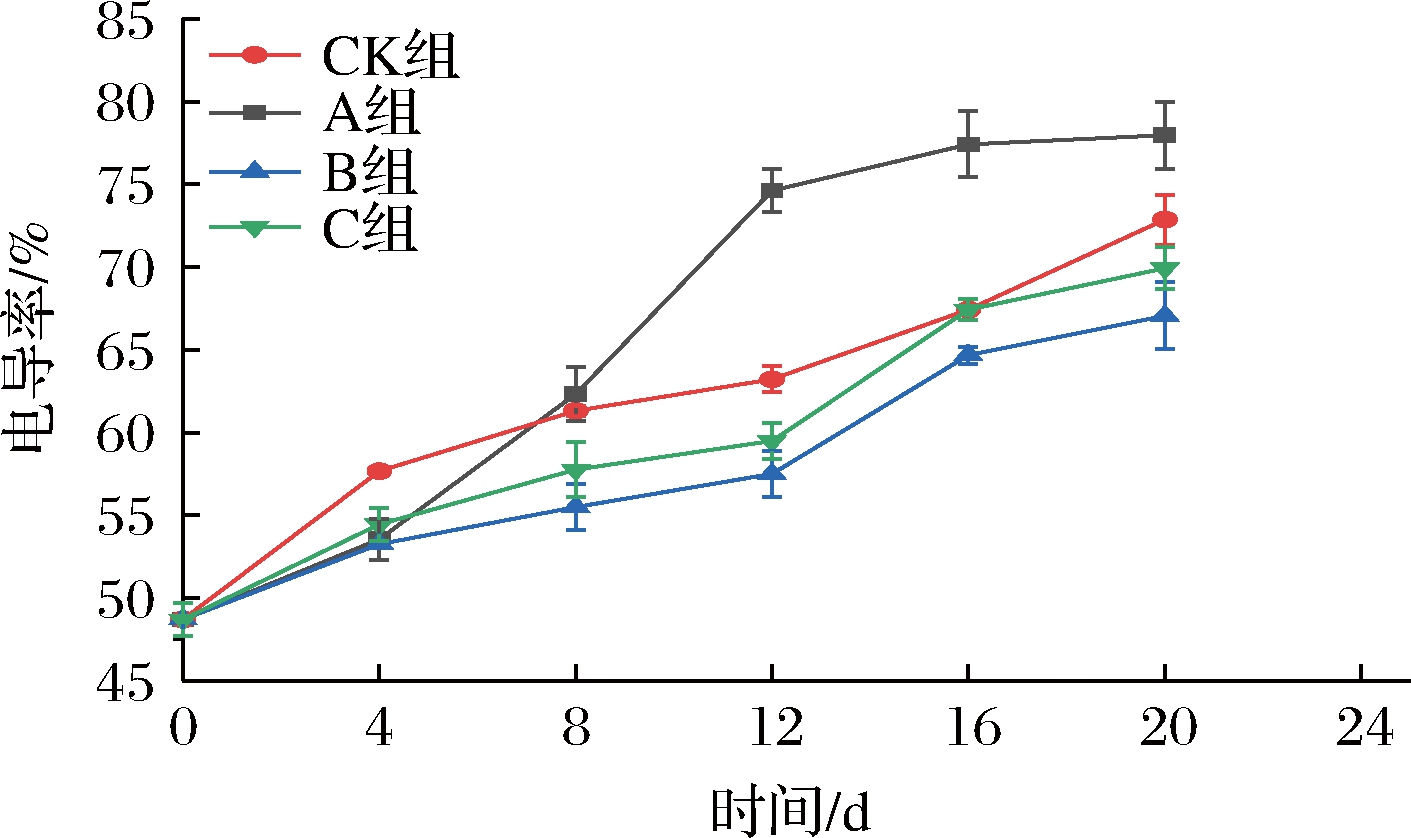
图7 短期超低氧处理对仔姜相对电导率的影响
Fig.7 Effects of short-term ultra-hypoxic treatment on the relative conductivity of content of baby ginger
2.7 短期超低氧处理对仔姜MDA含量的影响
MDA是由机械损伤和果蔬衰老引起的脂质过氧化的特征反应产物。如图8所示,各组MDA含量随贮藏时间的延长而增大,其中CK组在0~8 d内上升最快,可能是因为O2含量高,呼吸强度加强,导致ROS加剧,细胞膜结构遭到破坏,至贮藏期结束MDA含量达到0.82 μmol/g,与B、C 2组产生极显著差异(P<0.01),与A组差异不显著(P>0.05),原因可能是A组在贮藏后期受到无氧呼吸伤害,导致细胞膜结构遭到破坏;至贮藏期结束时,B、C 2组MDA含量增至0.74、0.76 μmol/g,并且在贮藏期间两组无显著差异(P>0.05),原因可能是2组均进行了短期的超低氧处理方式,抑制了呼吸代谢。综合而言,B、C 2组均能够显著抑制仔姜MDA含量的上升。

图8 短期超低氧处理对仔姜MDA含量的影响
Fig.8 Effects of short-term ultra-hypoxic treatment on MDA content of baby ginger
2.8 短期超低氧处理对仔姜色差值的影响
如图9所示,各处理组的色泽随着时间的延长而呈现上升趋势,在贮藏过程中,CK组与B、C两组呈现显著差异(P<0.05),B组和C组差异不显著(P>0.05),但B组的色泽优于C组,可能因为B组的O2含量低于C组,在贮藏0~16 d时,A组与CK组呈现差异显著(P<0.05),说明超低氧16 d都能将颜色保持在可接受水平,而在第20天,A组与CK组呈现差异不显著(P>0.05),可能是因为A组的超低氧状态维持时间过长,能量供应不足导致变色,以及过度的厌氧发酵产生的有毒代谢产物导致细胞损伤严重,使得PPO和总酚密切接触,褐变严重,色泽变差[20]。因此,短期超低氧更利于维持仔姜的色泽。
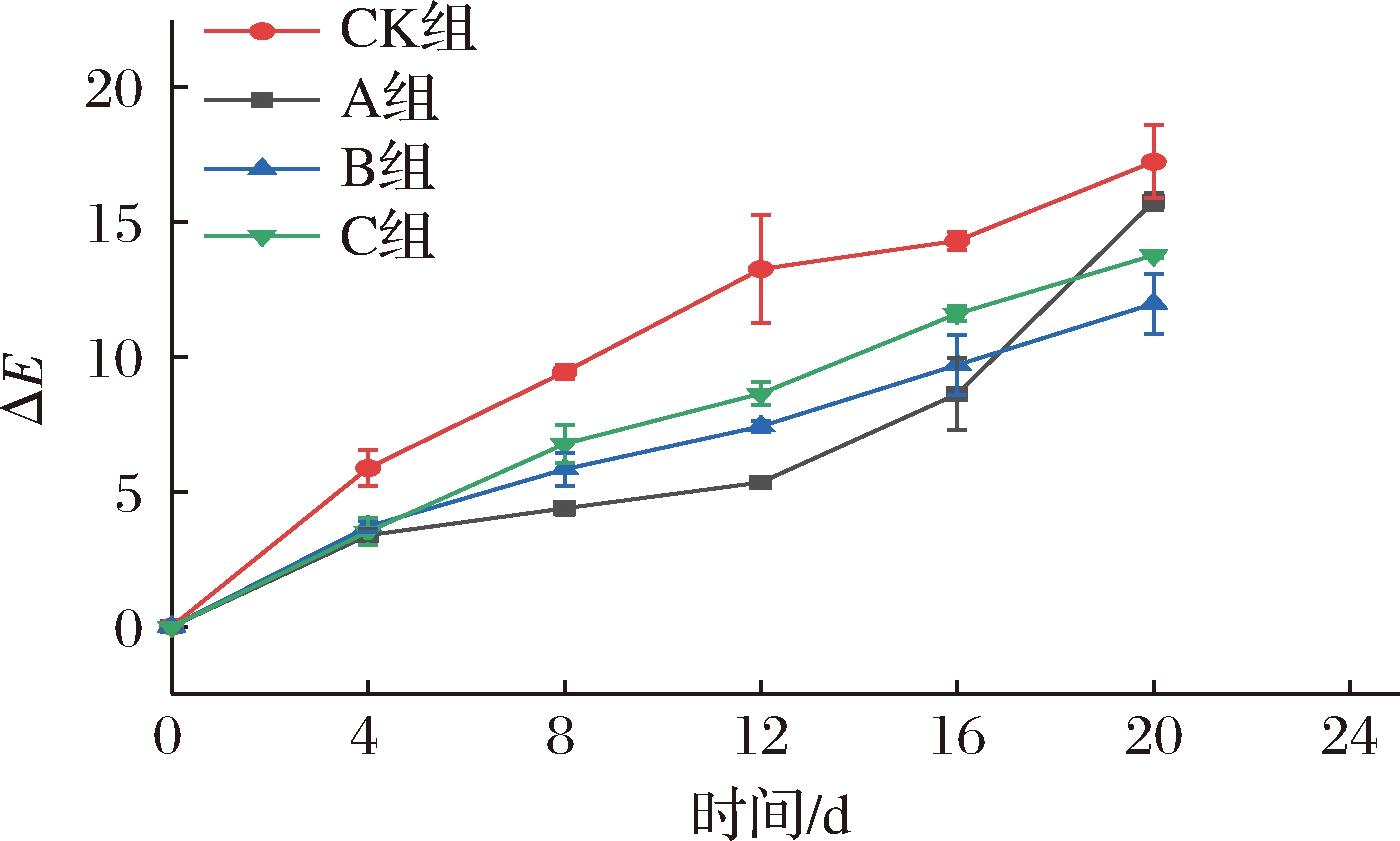
图9 短期超低氧处理对仔姜色差的影响
Fig.9 Effects of short-term ultra-hypoxic treatment on color of baby ginger
2.9 短期超低氧处理对仔姜总酚含量的影响
酚类物质关系着果蔬的色泽,因为果蔬中的酶促褐变通常是由于酚类化合物转化为醌类物质,然后再进一步聚合成棕色聚合物[21]。如图10所示,各组总酚含量随贮藏时间的延长呈现下降的趋势,其中CK组的总酚含量始终低于A、B、C 3组。贮藏在第4天时,CK组与A、B、C 3组差异显著(P<0.05),CK组的总酚含量下降为2.09 OD280/g。在贮藏末期,CK、A、B、C 4组相互间都呈现了差异极显著(P<0.01),A、CK、B、C 4组的总酚含量下降到了1.35、1.31、1.42 g、1.38 OD280/g,其中B、C 2组含量维持在较高水平,说明B、C 2组的处理方式更有利于抑制总酚含量的下降。由此可知,超低氧处理能有效减缓仔姜总酚含量的下降,但长期超低氧处理,对于后期总酚含量的维持效果较差。因而,为维持仔姜中的总酚含量,应选择短期超低氧处理方式。

图10 短期超低氧处理对仔姜总酚含量的影响
Fig.10 Effects of short-term ultra-hypoxic treatment on the content of total phenols of baby ginger
2.10 短期超低氧处理对仔姜PPO活性的影响
果蔬内PPO活性提高会加速酚类物质氧化为醌类物质,生成棕色物质,导致果蔬褐变[22]。如图11所示,各组PPO活性随贮藏时间的延长整体呈现上升的趋势,CK组的PPO活性基本是最高的,在8 d时,CK组与A、B、C 3组差异极显著(P<0.01),在12 d时,CK组与A、B、C 3组差异显著(P<0.05)。到贮藏末期时,CK组的PPO活性上升到最大值,数值为1.61。在第20天时,各组间的PPO活性差异不显著(P>0.05),说明长期超低氧处理更有利于抑制PPO活性[23],但到后期效果也并不显著。

图11 短期超低氧处理对仔姜PPO活性的影响
Fig.11 Effects of short-term ultra-hypoxic treatment on PPO activity of baby ginger
2.11 短期超低氧处理对仔姜PDC活性、ADH活性的影响
PDC和ADH是果蔬体内乙醇发酵特别需要的2种酶。PDC催化丙酮酸不可逆地转化为乙醛,ADH随后将乙醛还原为乙醇[9]。如图12所示,在0~4 d时,CK组与A组、B组、C组呈现差异显著(P<0.05),在贮藏4~20 d,A组与CK组、B组、C组呈现差异极显著(P<0.01),可能是因为A组处于超低氧的时间较久,发生无氧呼吸,导致PDC活性升高。在贮藏中后期时,CK组、B组、C组差异不显著(P>0.05),可能因为3组都保持了有氧状态,没有发生无氧呼吸,导致PDC活性较低。因此,果蔬贮藏不能长期处于超低氧状态,容易引发无氧呼吸,诱导PDC活性上升,使丙酮酸转化为乙醛,导致细胞损伤。

图12 短期超低氧处理对仔姜PDC活性的影响
Fig.12 Effects of short-term ultra-hypoxic treatment on PDC activity of baby ginger
ADH活性的变化如图13所示,A组随着贮藏时间的延长而不断上升的趋势,CK组随着贮藏时间的延长保持着比较平稳的趋势。在第20天时,A组的ADH活性到达52.11 U/g,是初始ADH活性的4.88倍。在贮藏4~20 d,A组与CK、B、C 3组呈现差异极显著(P<0.01),可能是因为A组在贮藏后期,发生了无氧呼吸,导致ADH活性上升。因此,若长期处于超低氧状态,不利于果蔬品质的维持。
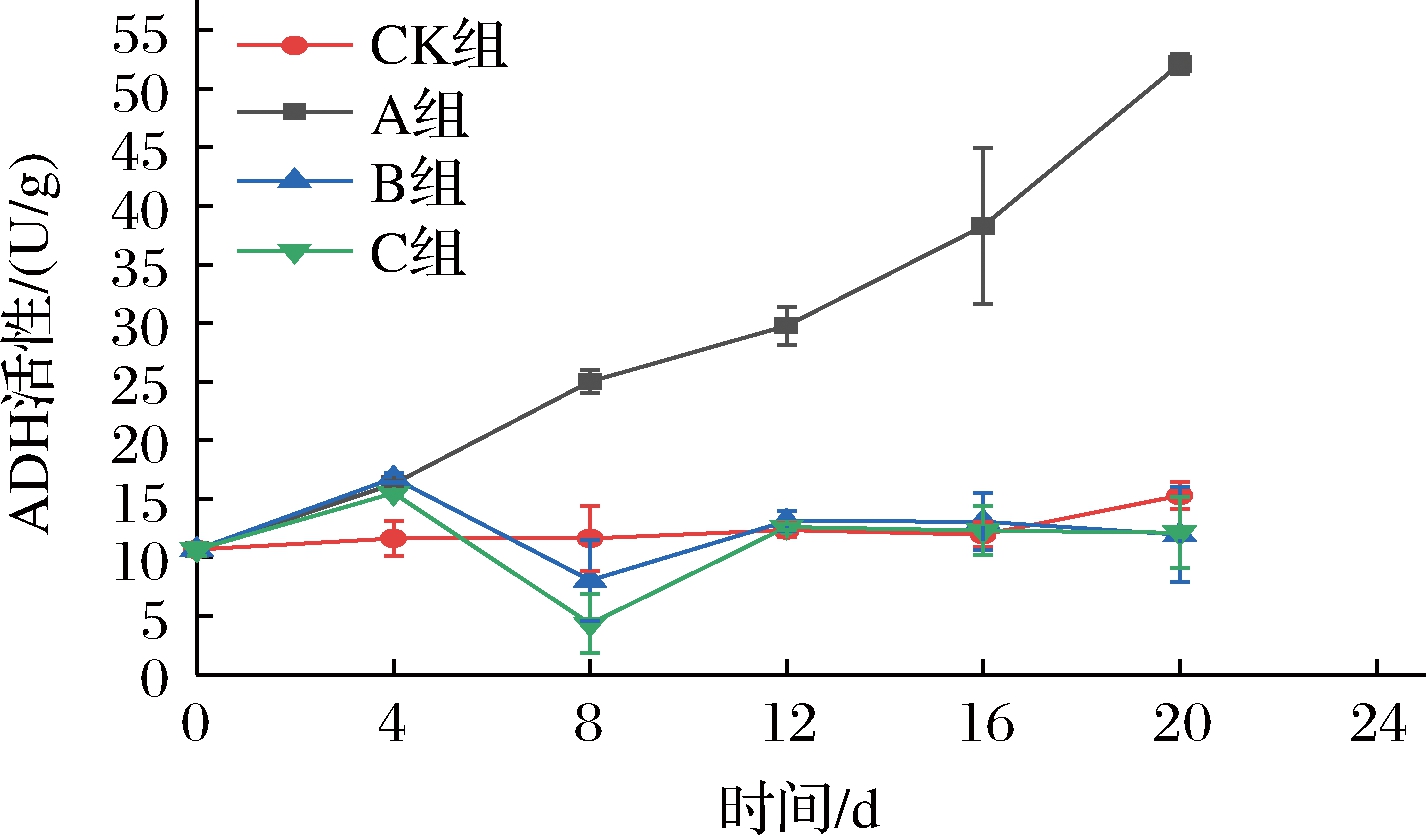
图13 短期超低氧处理对仔姜ADH活性的影响
Fig.13 Effects of short-term ultra-hypoxic treatment on ADH activity of baby ginger
2.12 短期超低氧处理对仔姜乙醛含量、乙醇含量的影响
乙醛的植物毒性会加强对果蔬细胞和组织的氧化损伤[20]。如图14所示,A组的乙醛含量随着贮藏时间的延长而呈现不断上升的趋势,在0~4 d时,A组、B组、C组和CK组差异显著(P<0.05),尤其在贮藏中后期,A组的上升速度最快,与CK、B、C 3组呈现差异极显著(P<0.01),可能是因为A组处于超低氧状态的时间相对较长,导致A组出现了无氧呼吸,同时PDC的活性也被提高,从而乙醛含量升高,导致仔姜出现异味,与TELES等[24]结论一致。在整个贮藏过程中,CK、B、C 3组的差异不显著(P>0.05),可能是因为3组未出现无氧呼吸。因此,长期超低氧不适合仔姜的贮藏,会导致仔姜出现不良气味。

图14 短期超低氧处理对仔姜乙醛含量的影响
Fig.14 Effects of short-term ultra-hypoxic treatment on acetaldehyde content of baby ginger
如图15所示,在整个贮藏过程中,A组的乙醇含量始终是最高的,到贮藏末期,A组的乙醇含量为57.53 mg/kg,是CK组的46.10倍、B组的35.16倍、C组的53.77倍,与A、B、C 3组差异极显著(P<0.01)。在贮藏0~4 d时,CK组与A、B、C 3组差异显著(P<0.05),可能是因为CK组一直保持在有氧状态,抑制了ADH活性,同时乙醛含量低,减弱了乙醛向乙醇的转化,降低乙醇含量低。在贮藏中后期,CK、B、C 3组差异不显著(P>0.05),因乙醇含量低,仔姜未产生异味。因此,在保持仔姜气味上,长期超低氧处理方式不可取。
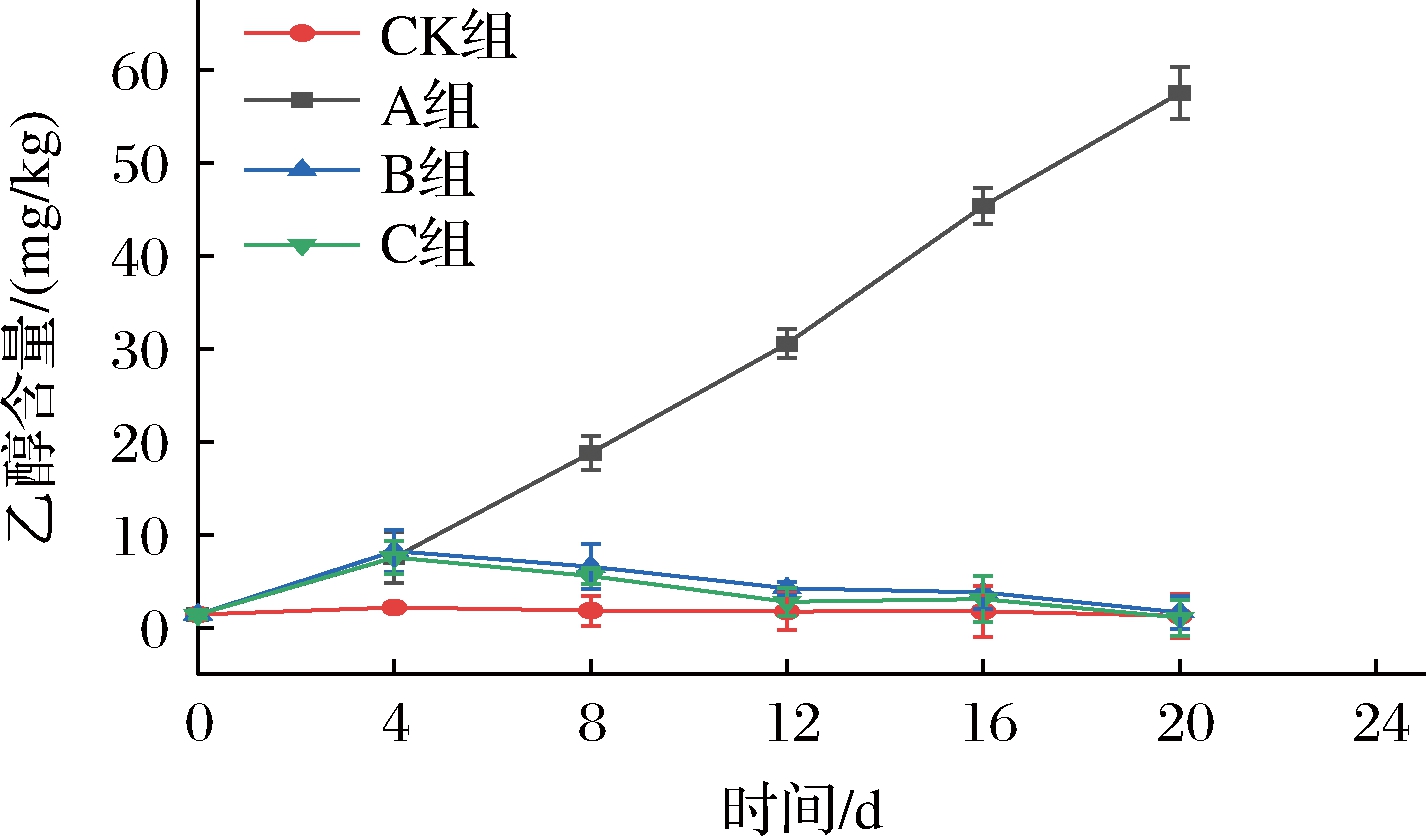
图15 短期超低氧处理对仔姜乙醇含量的影响
Fig.15 Effects of short-term ultra-hypoxic treatment on ethanol content of baby ginger
3 结论与讨论
本文选择高阻隔性的PET12/PE15/CPP30材料对仔姜进行包装处理,通过仔姜自身呼吸作用形成超低氧环境,探究超低氧协同微孔技术对仔姜贮藏品质的影响。实验结果表明,密封包装后的仔姜在第2天时O2含量降为1%以下,形成超低氧环境。其中,长期超低氧组在贮藏前期(0~4 d)维持较高的感官,而无超低氧组的感官品质迅速下降至最低,并在整个贮藏期间始终保持在最低水平。但长期超低氧组的超氧阴离子产生速率在第8天达到最高,MDA和相对电导率自第8天后均高于其他处理组,表明长期超低氧环境会对细胞膜产生严重损伤,促使其色泽在第16~20天显著变差,总酚含量迅速下降,PPO活性显著提高,并且PDC和ADH活性显著上升,导致乙醇、乙醛含量的积累,产生异味。
与无超低氧和长期超低氧相比,短期超低氧环境则可以更好地维持仔姜的颜色、感官评分和气味,不仅降低了膜脂过氧化水平,还避免了厌氧代谢物如乙醛和乙醇的积累。结果表明,短期超低氧协同微孔处理组均能提高SOD和CAT活性,抑制![]() 的生成,从而降低电导率和MDA含量的上升,减轻细胞膜的氧化损伤,更好地抑制PPO、PDC、ADH活性,使仔姜在贮藏期内维持较好的色泽和气味。其原因可能是短期超低氧避免了高浓度CO2环境的形成以及乙醛等毒性产物的积累,从而更好地维持了呼吸过程中膜的完整性以及减少了活性氧化物的生成,进而减缓了酚类化合物酶促氧化为棕色聚合物[25]。其中,超低氧3 d-1微孔组能将包装内的氧气含量控制在更低的范围(<10%),保鲜效果最佳。
的生成,从而降低电导率和MDA含量的上升,减轻细胞膜的氧化损伤,更好地抑制PPO、PDC、ADH活性,使仔姜在贮藏期内维持较好的色泽和气味。其原因可能是短期超低氧避免了高浓度CO2环境的形成以及乙醛等毒性产物的积累,从而更好地维持了呼吸过程中膜的完整性以及减少了活性氧化物的生成,进而减缓了酚类化合物酶促氧化为棕色聚合物[25]。其中,超低氧3 d-1微孔组能将包装内的氧气含量控制在更低的范围(<10%),保鲜效果最佳。
综上所述,超低氧状态不能处理时间过长,否则容易导致果蔬发生无氧呼吸,加剧仔姜品质的劣变,而短期超低氧处理在维持细胞膜完整性、抑制仔姜褐变和延长保质期方面有重要意义。而且由高阻隔性包装材料实现的超低氧自发气调环境,无需气调包装机设备的投入及高纯气体的消耗,极大节约了成本,为超低氧技术的大面积推广应用提供了可行性。
[1] 付云云. 贮藏温度和保鲜剂处理对仔姜品质的影响[D].雅安:四川农业大学, 2020.
FU Y Y.Effect of storage temperature and preservative treatment on the quality of baby ginger[D].Ya′an:Sichuan Agricultural University, 2020.
[2] LUFU R, AMBAW A, OPARA U L.Water loss of fresh fruit:Influencing pre-harvest, harvest and postharvest factors[J].Scientia Horticulturae, 2020, 272: 109519.
[3] GHIDELLI C, PÉREZ-GAGO M B.Recent advances in modified atmosphere packaging and edible coatings to maintain quality of fresh-cut fruits and vegetables[J].Critical Reviews in Food Science and Nutrition, 2018, 58(4):662-679.
[4] ZHAO X Y, ZHANG Y Q, MA Y, et al.Inhibitory mechanism of low-oxygen-storage treatment in postharvest internal bluing of radish (Raphanus sativus) roots[J].Food Chemistry, 2021,364:130423.
[5] TECHAVUTHIPORN C, BOONYARITTHONGCHAI P, SUPABVANICH S.Physicochemical changes of ‘Phulae’ pineapple fruit treated with short-term anoxia during ambient storage[J].Food Chemistry, 2017, 228(1):388-393.
[6] BOTH V, BRACKMANN A, THEWES F R, et al.Effect of storage under extremely low oxygen on the volatile composition of ‘Royal Gala’ apples[J].Food Chemistry, 2014, 156(1):50-57.
[7] HO P L, TRAN D T, HERTOG M L A T M, et al.Effect of controlled atmosphere storage on the quality attributes and volatile organic compounds profile of dragon fruit (Hylocereus undatus)[J].Postharvest Biology and Technology, 2021, 173:111406.
[8] 吕凤艳. AsA-GSH循环对西兰花高O2/CO2气调过程中呼吸异味调控研究[D].淄博:山东理工大学, 2017.
LYU F Y.Regulation of ASA-GSH cycle on the respiration off-flavor of broccoli under high O2/CO2 controlled atmospheres[D].Zibo:Shandong University of Technology, 2017.
[9] BOECKX J, HERTOG M, GEERAERD A, et al.Regulation of the fermentative metabolism in apple fruit exposed to low-oxygen stress reveals a high flexibility[J].Postharvest Biology and Technology, 2019, 149:118-128.
[10] QU P, ZHANG M, FAN K, et al.Microporous modified atmosphere packaging to extend shelf life of fresh foods:A review[J].Critical Reviews in Food Science and Nutrition, 2022, 62(1):51-65.
[11] 王建清, 陈金周.包装材料学[M].第二版.北京:中国轻工业出版社, 2017.
WANG J Q, CHEN J Z.Packaging Materials[M].Second Edition.Beijing:China Light Industry Press, 2017.
[12] 邓青芳, 马风伟, 许粟, 等.1-MCP处理对低温贮藏鲜姜品质和活性成分的影响[J].食品工业科技, 2020, 41(12):281-285.
DENG Q F, MA F W, XU S, et al.Effect of 1-MCP treatment on the quality and active ingredient of ginger during low temperature storage[J].Science and Technology of Food Industry, 2020, 41(12):281-285.
[13] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Guidance for Postharvest Physiological and Biochemical Experiments of Fruits and Vegetables[M].Beijing: China Light Industry Press, 2007.
[14] 游玉明, 汤洁, 张美霞, 等.外源24-表油菜素内酯调控仔姜活性氧及酚类代谢减轻冷害[J].食品科学, 2021, 42(3):273-280.
YOU Y M, TANG J, ZHANG M X, et al.24-epibrassinolide alleviates chilling injury in baby ginger rhizome by regulating active oxygen and phenolic metabolism[J].Food Science, 2021, 42(3):273-280.
[15] 唐先谱, 李喜宏, 张彪, 等.不同贮藏温度对四川仔姜采后贮藏品质的影响[J].食品工业, 2018, 39(9):90-93.
TANG X P, LI X H, ZHANG B, et al.Effect of different storage temperatures on postharvest storage quality of baby ginger in Sichuan[J].The Food Industry, 2018, 39(9):90-93.
[16] 程曦. 控温包装在莴笋尖常温物流过程中的保鲜机理及优化研究[D].重庆:西南大学, 2017.
CHENG X.Study on the preservation mechanism and optimization of insulating package in course of normal temperature-logistics of lettuce tip[D].Chongqing:Southwest University, 2017.
[17] DONG Y, LIU L Q, ZHAO Z, et al.Effects of 1-MCP on reactive oxygen species, polyphenol oxidase activity, and cellular ultra-structure of core tissue in ‘Yali’ pear (Pyrus bretschneideri Rehd.) during Storage[J].Horticulture, Environment, and Biotechnology, 2015, 56(2):207-215.
[18] XU F X, LIU S Y, LIU Y F, et al.Effect of mechanical vibration on postharvest quality and volatile compounds of blueberry fruit[J].Food Chemistry, 2021, 349:129216.
[19] WEBER A, THEWES F R, SELLWIG M, et al.Dynamic controlled atmosphere:Impact of elevated storage temperature on anaerobic metabolism and quality of ‘Nicoter’ apples[J].Food Chemistry, 2019, 298:125017.
[20] TANG J X, REN H, CHEN X, et al.Effects of short-term N2 anaerobic treatment on respiratory metabolism and oxidation status of Agaricus bisporus[J].Postharvest Biology and Technology, 2021, 181:111692.
[21] TANG J X, CHEN X, ZHANG Y H, et al.The ultra-low O2 environment after anaerobic treatment enhanced the antioxidant properties of Agaricus bisporus mushroom[J].Scientia Horticulturae, 2022, 303:111192.
[22] LYU J Y, BAI L, HAN X Z, et al.Effects of 1-MCP treatment on sprouting and preservation of ginger rhizomes during storage at room temperature[J].Food Chemistry, 2021, 349:129004.
[23] ALI S, KHAN A S, ULLAH MALIK A, et al.Modified atmosphere packaging delays enzymatic browning and maintains quality of harvested litchi fruit during low temperature storage[J].Scientia Horticulturae, 2019, 254:14-20.
[24] TELES C S, BENEDETTI B C, GUBLER W D, et al.Prestorage application of high carbon dioxide combined with controlled atmosphere storage as a dual approach to control Botrytis cinerea in organic ‘Flame Seedless’ and ‘Crimson Seedless’ table grapes[J].Postharvest Biology and Technology, 2014, 89:32-39.
[25] LUM G B, SHELP B, DEELL J, et al.Oxidative metabolism is associated with physiological disorders in fruits stored under multiple environmental stresses[J].Plant Science:An International Journal of Experimental Plant Biology, 2016, 245:143-152.