在造酒工业蓬勃发展的影响下,饮酒已成为当今人们普遍的一种社交娱乐的方式。根据调查显示,我国酒精性肝病的发病率正在逐年增长[1]。长期酗酒不仅会导致脂肪肝、酒精性肝炎、肝纤维化,严重的甚至还会发展成肝硬化和肝癌,严重危害人们的身体健康[2]。急性酒精性肝损伤是指在短期内大量饮酒,肝脏无法及时分解的酒精在体内经一系列反应产生大量活性氧(reactive oxygen species,ROS),破坏肝脏氧化还原平衡,从而造成氧化损伤[3]。目前临床上对急性酒精性肝损伤的治疗方法主要为戒酒、营养支持和药物辅助治疗,疗效一般,并且药物介入后往往会产生不良反应[4]。近年来,人们对药食两用天然活性成分的研究越来越深入,其具有的抗氧化活性的天然成分在酒精性肝病的治疗中起到越来越重要的作用。
药食同源成分指的是既可以作为食品供人们日常食用,又能够当作药品用于预防和治疗疾病的活性成分,是保健食品开发的重要原料[5]。这些成分通常具有多种药理活性,日常食用有助于人们的身体健康。药食同源成分具有安全性高、来源广泛的优点,因此具有开发成新型药品的潜力。
基于实验室前期调研,本研究将蓝莓花青素、杜仲雄花茶、米糠脂肪烷醇以及γ-氨基丁酸这4种成分作为研究对象。已有大量研究指出这4种成分具有降血压[6]、降血脂[7]、改善睡眠[8]等多种药理功效,也有文献指出这4种活性成分均具有保护肝脏、增进肝脏功能的作用[9],已被列为新资源食品。蓝莓花青素、杜仲雄花茶粉和γ-氨基丁酸还具有良好的抗氧化活性[10]。米糠脂肪烷虽不具有抗氧化活性[11],但作为一种膳食添加剂,具有缓解疲劳、恢复体力的功效[12],有利于醉酒后的醒酒,与其他3种天然活性成分联合使用时,起到协同作用。因此推测这4种成分的联合服用,具有较好的急性酒精性肝损伤保护作用。
本研究首先通过体外抗氧化实验进行了处方优化,随后构建急性酒精性肝损伤小鼠模型,通过计算肝脏指数,测定血清中谷草转氨酶(aspartate aminotransferase, AST)和谷丙转氨酶(alanine aminotransferase, ALT)的含量,检测肝脏组织中丙二醛(malondialdehyde, MDA)含量、超氧化物歧化酶(superoxide dismutase, SOD)活性、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX)活性,结合HE染色等指标共同说明了该复方对于急性酒精性肝损伤的保护作用。
1 材料与方法
1.1 材料与试剂
γ-氨基丁酸、蓝美1号蓝莓花青素、杜仲雄花茶粉、米糠脂肪烷醇,浙江蓝美生物技术有限公司;SOD测定试剂盒、MDA测定试剂盒、GSH-PX测定试剂盒,南京建成有限公司;52°红星二锅头,北京某物美超市、DPPH、ABTS,美国GLPBIO;抗坏血酸,国药集团化学试剂有限公司;过硫酸钾,北京试剂。
1.2 仪器与设备
Spectra MAX190酶标仪,美国Molecular Devices公司;日立7180全自动生化分析仪,日本日立公司;3K15低温高速离心机,美国Sigma公司;Milli-Q超纯水系统A10,美国Millipore公司;恒温培养箱,公私合营国光医疗器械厂。
1.3 实验方法
1.3.1 实验动物
8周龄Balb/c小鼠,雄,体重20~22 g,北京科宇动物养殖中心,合格证号:SCXK(京)2017-0005。饲养在军事医学研究院动物房中,饲养温度(20±5) ℃,湿度(50±5)%,12 h光暗交替,在此期间,小鼠自由饮水和摄食。动物饲养条件符合实验动物伦理委员会的要求。
1.3.2 处方优化
样品的配制:分别称取一定质量的蓝美1号蓝莓花青素、杜仲雄花茶粉、γ-氨基丁酸,蓝莓花青素、γ-氨基丁酸和杜仲雄花茶粉按照质量浓度比例(下同)A:1∶1∶1、B:1∶2∶1、C:1∶1∶2、D:1∶2∶2、E:2∶1∶1、F:2∶1∶2、G:2∶2∶1配制成1 mg/mL 的储备液备用,蓝莓花青素(H)、γ-氨基丁酸(I)和杜仲雄花茶粉(K)同样配制成1 mg/mL的储备液备用。
DPPH自由基清除能力的测定:将各比例的样品储备液用超纯水稀释成50 μg/mL的工作液。将抗坏血酸配制成10、15、20、25、30、35、40 μg/mL的梯度溶液,作为阳性对照。100 μL 0.5 mmol/L DPPH溶液和100 μL样品混匀后,37 ℃避光孵育30 min。在517 nm处测吸光度,记为A1;超纯水作为空白对照,测吸光度记为A0;用超纯水代替DPPH溶液,测吸光度记为A2,按照公式(1)计算DPPH自由基清除率:
DPPH自由基清除率![]()
(1)
ABTS阳离子自由基清除能力的测定:将各比例的样品储备液稀释成100 μg/mL的工作液。用0.1 mmol/L PBS缓冲溶液配制7 mmol/L的ABTS阳离子自由基溶液和4.9 mmol/L的过硫酸钾溶液。将ABTS阳离子自由基溶液与过硫酸钾溶液等体积混合避光反应14 h后,得ABTS阳离子自由基溶液母液。将抗坏血酸配制成50、60、70、80、90、100 μg/mL的梯度溶液,作为阳性对照。
用0.1 mmol/L PBS缓冲液稀释ABTS阳离子自由基母液20倍,得ABTS阳离子自由基工作液。20 μL的样品溶液与200 μL ABTS阳离子自由基工作液混匀后,在734 nm波长处测吸光度,记为A1;用20 μL超纯水代替样品测吸光度,记为A0;用0.1 mmol/L PBS缓冲溶液代替ABTS阳离子自由基工作液测吸光度值,记为A2,按照公式(2)计算ABTS阳离子自由基清除率:
ABTS阳离子自由基清除率![]()
(2)
1.3.3 酒精致大鼠肝损伤模型的建立
所有小鼠适应性喂养1周后,随机分为4组(n=6),空白对照组、模型组、低剂量组(蓝莓花青素:110 mg/kg;γ-氨基丁酸:52.5 mg/kg;杜仲雄花茶粉:52.5 mg/kg;米糠脂肪烷醇:52.5 mg/kg)、高剂量组(蓝莓花青素:175 mg/kg;γ-氨基丁酸:87.5 mg/kg;杜仲雄花茶粉:87.5 mg/kg;米糠脂肪烷醇:87.5 mg/kg)。给药组按照给药剂量进行一日2次的灌胃,每隔12 h灌胃一次,空白对照组和模型组在同一时间灌相同体积的水,连续给药7 d。从第8天开始,模型组和给药组开始造模。造模方法为:给各小鼠灌52°的白酒,灌胃剂量为12 mL/kg,一日灌胃2次,每隔12 h灌胃1次,空白对照组继续灌水,连续造模3 d。在最后一次灌胃结束过夜后,将小鼠处死。
1.3.4 肝脏指数的测定
称量小鼠的体重后颈椎脱臼法处死,处死后将完整的肝脏取出,于生理盐水中清洗,用吸水纸擦干水分后进行称重,按公式(3)计算肝脏指数:
肝脏指数![]()
(3)
1.3.5 血清血生化指标检测
小鼠摘眼球取血于离心管中静置后,4 000 r/min、4 ℃,离心10 min取上清液,用于血清中AST和ALT的检测。
1.3.6 肝脏组织病理切片及氧化指标检测
取各小鼠左下肝叶的同一部位的肝脏放在4%组织固定液中进行固定,经洗涤脱水,石蜡包埋并切片,HE染色后制成切片置于显微镜下观察。将剩余的肝脏制成10%(质量分数)的肝脏匀浆,4 000 r/min、4 ℃,离心10 min后,取上清液,-20 ℃保存备用。
SOD活性检测:根据说明书一次加入待测的组织匀浆上清与相应的试剂,混匀后于37 ℃反应20 min,于450 nm处按照公式(4)和公式(5)测吸光度:
SOD抑制率![]()
(4)
式中:A对照,对照品的吸光度;A对照空白,空白对照品的吸光度;A测定,待测样品的吸光度;A测定对照,待测样品对照品的吸光度。
SOD活力/(U/mg prot)=
(5)
MDA含量的检测:根据试剂盒的说明书,依次加入相应的试剂和待测样品,于95 ℃水浴锅中加热40 min,冷却后4 ℃,4 000 r/min离心。取上清液测532 nm处的吸光度值。按照公式(6)计算MDA含量:
MDA含量![]()
(6)
式中:待测OD,待测样品的吸光度;标准OD,标准品的吸光度;空白OD,空白对照的吸光度;C,标准品浓度,nmol/mL。
GSH-PX活性检测:根据试剂盒的说明书,将待测样品与相应的试剂混合均匀后于37 ℃反应5 min,离心取上清液后再按照说明书中步骤依此加入相应的试剂混匀,室温静置15 min后,于412 nm处测吸光度。
按照公式(7)计算GSH-PX活力:
GSH-PX活力/(U/mL)=
(7)
式中:对照OD,对照品的吸光度;待测OD,待测样品的吸光度;标准OD,标准品的吸光度;空白OD,空白对照的吸光度;n,稀释倍数;t,反应时间,h;V,取样量,mL;C1,标准品浓度,μmol/mL;C2,肝脏组织蛋白浓度,mg prot/mL。
1.4 数据处理
所有数据均用平均值±标准差![]() 表示,采用单因素方差分析(one-way analysis of variance,ANOVA)评估两组间的差异,P<0.05、P<0.01或P<0.001表示具有统计学意义。
表示,采用单因素方差分析(one-way analysis of variance,ANOVA)评估两组间的差异,P<0.05、P<0.01或P<0.001表示具有统计学意义。
2 结果与分析
2.1 处方优化
DPPH自由基清除能力:通过抗坏血酸的吸光度计算出标准曲线,将样品的吸光值带入抗坏血酸的标准曲线中,即可得到各样品的维生素C当量值,结果如图1所示。

图1 各比例样品DPPH自由基清除能力的维生素C当量值
Fig.1 Vitamin C equivalent value of DPPH radical scavenging ability in various proportions of samples
注: A组与其他组相比,*表示P<0.05,**表示P<0.01,***表示P<0.001,图2同。
结果显示,当蓝莓花青素∶γ-氨基丁酸∶杜仲雄花茶粉为2∶1∶1时,DPPH自由基的清除率最高。
ABTS阳离子自由基清除能力:通过抗坏血酸的吸光度计算出标准曲线,将各比例样品的吸光度带入抗坏血酸的标准曲线中,即可得到各样品的维生素C当量值,结果如图2所示。

图2 各比例样品ABTS阳离子自由基清除能力的维生素C当量值
Fig.2 Vitamin C equivalent value of ABTS cationic free radical scavenging ability in various proportions of samples
结果显示,当蓝莓花青素∶γ-氨基丁酸∶杜仲雄花茶粉为2∶1∶1时,对ABTS阳离子自由基的清除率最高。
因此,选择蓝莓花青素∶γ-氨基丁酸∶杜仲雄花茶粉为2∶1∶1作为后续动物实验的处方比例。同时在处方中再加入一定比例的米糠脂肪烷醇,目的是与其他3种成分联合使用以达到协同作用。
2.2 肝脏指数
各组小鼠的肝脏指数如图3所示,模型组小鼠的肝脏指数较空白组相比显著升高(P<0.001),给药组的肝脏指数较模型组显著下降(P<0.001)。
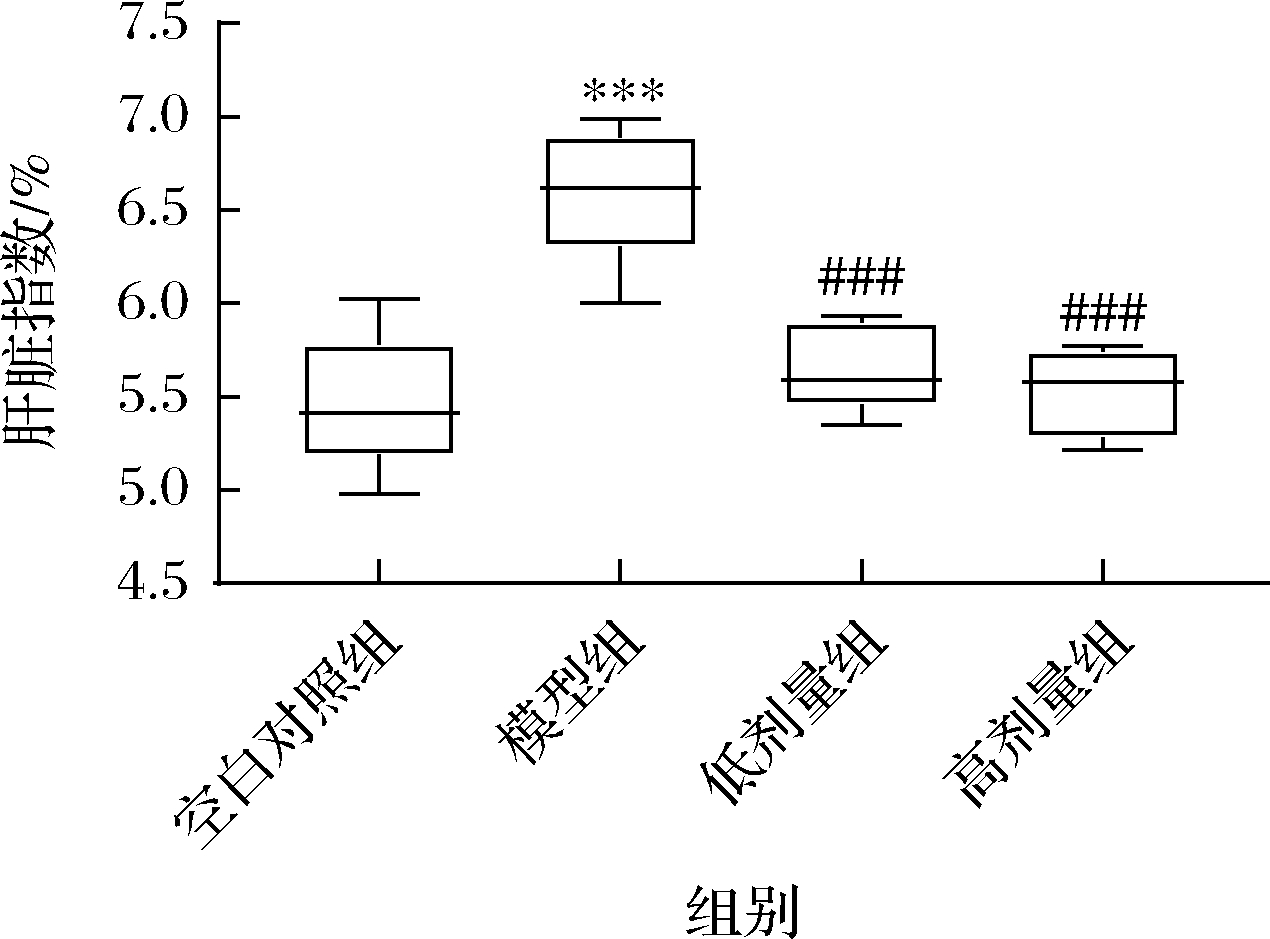
图3 四种药食同源组合物对各组小鼠的肝脏指数的影响
Fig.3 Effects of four medicine food homologous compositions on liver index in each group of mice
注:模型组与空白组相比,*表示P<0.05,**表示P<0.01,***表示P<0.001;给药组与模型组相比,#表示P<0.05,##表示P<0.01,###表示P<0.001,下同。
2.3 血清中血生化指标
图4为4种药食同源天然活性成分对各组小鼠血清中AST和ALT的含量影响。与空白对照组相比,模型组小鼠的AST、ALT含量都显著增加(P<0.001),给药组的2种酶含量显著低于模型组,高剂量组降低更为明显(P<0.001)。

A-AST;B-ALT
图4 四种药食同源组合物对各组小鼠血清中AST和
ALT含量的影响
Fig.4 Effects of four medicine food homologous compositions on serum AST and ALT contents in each group of mice
2.4 肝脏组织中氧化指标
肝脏中氧化程度指标的结果如图5所示,模型组小鼠肝脏组织中的SOD和GSH-PX的活性较空白组小鼠肝脏组织中的显著降低(P<0.001),MDA含量显著上升(P<0.001)。与模型组相比,给药组小鼠肝脏组织中的MDA含量较模型组显著下降(P<0.001),SOD活性和GSH-PX活性显著上升(P<0.001),高剂量组更为明显。
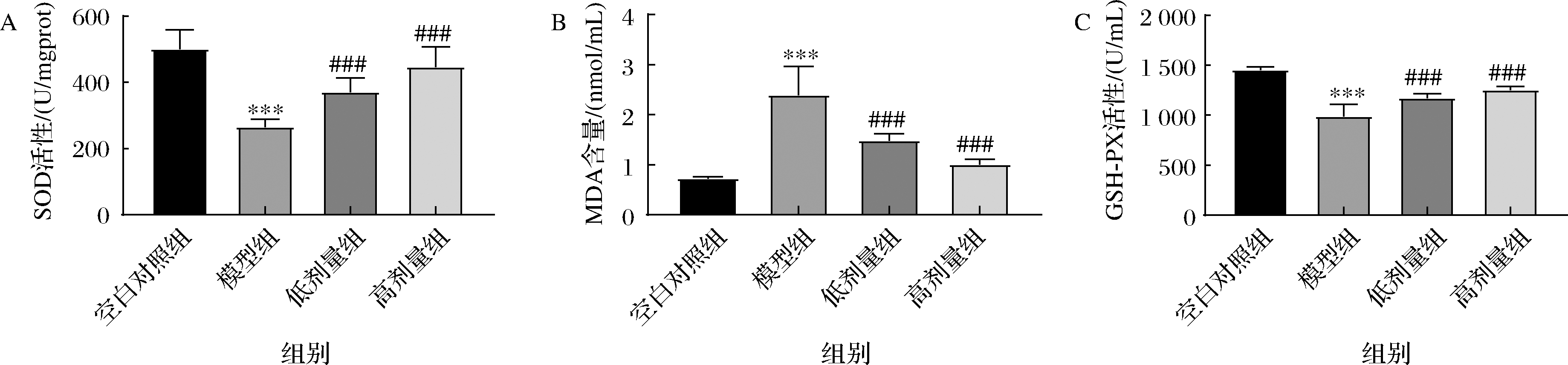
A-SOD活性;B-MDA含量;C-GSH-PX活性
图5 四种药食同源组合物对各组小鼠肝脏组织中SOD活性、MDA含量和GSH-PX活性的影响
Fig.5 Effects of four medicine food homologous compositions on SOD activity, MDA content, and GSH-PX activity in liver tissues of mice in each group
2.5 肝脏病理切片结果
病理学检测可通过HE染色直接观察肝脏组织受损的具体情况。结果如图6所示,空白对照组小鼠肝细胞大小未见改变,肝脏组织未见异常,而模型组小鼠肝细胞间排列紊乱,出现了大量空泡变性的肝细胞,局部可见炎性细胞灶性浸润,部分肝细胞出现了轻度脂肪变性。相对于模型组,低剂量组小鼠肝脏组织内肝细胞内可见空泡,但并没有观察到炎性细胞灶性浸润,高剂量组小鼠肝组织的受损情况极大好转。

A-空白对照组;B-模型组;C-低剂量组;D-高剂量组
图6 四种药食同源组合物对急性酒精性肝损伤小鼠肝组织结构的影响
Fig.6 Effects of four medicine food homologous compositions on liver tissue structure in mice with acute alcoholic liver injury
3 结论与讨论
本研究首先通过体外抗氧化实验进行处方优化,结果显示,当蓝莓花青素∶γ-氨基丁酸∶杜仲雄花茶粉比例为2∶1∶1时,在体外具有最好的抗氧化效果。此外,米糠脂肪烷醇虽不具有抗氧化的活性,但可调节肝脏中氧化应激反应的相关酶[13],从而达到保护肝脏的作用。并且,米糠脂肪烷还具有缓解疲劳、恢复体力的作用[14],将其作为膳食添加剂加入到复方中,更有助于醉酒后的醒酒及体力恢复、缓解宿醉带来的不适感,与其他3种成分联合服用可以起到协同作用。
本研究构建了急性酒精性肝损伤小鼠模型,通过多指标来评估该复方的肝保护效果。肝脏指数是用于反映肝脏肿大程度的指标[15]。模型组肝脏指数较空白组明显升高,表明造模成功。给药组肝脏指数与模型组相比显著降低,表明该复方可以减轻短期内大量饮酒引起的肝水肿。当肝脏受到损伤时,肝细胞的线粒体和细胞膜结构被破坏,细胞通透性增加,存在于肝细胞中的AST和ALT释放到血液中,血清中这2种酶的含量激增,因而2种酶是临床上用于评价肝脏损伤及损伤程度的标志性酶[16]。模型组AST和ALT含量与空白对照相比,显著增高,表明模型组小鼠肝脏受到了损伤,建模成功;给药组2种酶指标降低,说明该复方可以缓解酒精引起的肝脏AST和ALT的含量升高现象。MDA是体内重要的脂质过氧化物之一[17],是由机体产生的ROS攻击生物膜中的多不饱和脂肪酸,从而引起脂质过氧化作用,最终形成的脂质过氧化物。检测MDA含量可反映机体脂质过氧化程度,间接反映机体细胞受自由基攻击的严重程度。SOD能够清除体内的超氧阴离子自由基,其活力高低可间接反映机体清除氧自由基的能力[18]。GSH-PX是机体广泛存在一种重要的催化过氧化氢分解的酶,可特异催化还原性谷胱甘肽对过氧化氢的还原反应,起到保护细胞膜结构和功能完整的作用[19]。本研究中采用这3项指标来评价肝脏的氧化程度。模型组肝脏组织中这3项指标的结果说明模型组的小鼠肝脏组织受到了氧化损伤,给药组结果显示该复方可以通过抗氧化途径缓解肝脏的氧化损伤。HE染色的结果显示,相较于模型组,给药组的肝脏受损情况得到极大改善。进一步说明复方中这4种药食同源天然活性成分的联合预防服用对于急性酒精性肝损伤具有良好的保护作用。
以上结果共同说明了该复方对急性酒精性肝损伤具有较好的保护作用。因此,服用药食同源天然活性成分用于急性酒精性肝损伤的治疗与预防是一种新的研究方向,为酒精性肝病的治疗提供了新的思路,同时也为药食同源天然活性成分的广泛应用奠定了一定的基础。
[1] 王秋艳, 丁慧敏, 朱亚男, 等.多汁乳菇多糖对小鼠急性酒精性肝损伤的保护作用[J].食品工业科技, 2021, 42(24):313-319.
WANG Q Y, DING H M, ZHU Y N, et al. Protective effect of polysaccharide from Lactarius volemus Fr on acute alcoholic liver injury in mice[J]. Science and Technology of Food Industry, 2021, 42(24): 313-319.
[2] LIU X, HOU R L, YAN J J, et al.Purification and characterization of Inonotus hispidus exopolysaccharide and its protective effect on acute alcoholic liver injury in mice[J].International Journal of Biological Macromolecules, 2019, 129:41-49.
[3] MASSEY V L, ARTEEL G E.Acute alcohol-induced liver injury[J].Frontiers in Physiology, 2012, 3:193.
[4] YUAN R S, TAO X, LIANG S, et al.Protective effect of acidic polysaccharide from Schisandra chinensis on acute ethanol-induced liver injury through reducing CYP2E1-dependent oxidative stress[J].Biomedicine &Pharmacotherapy, 2018, 99:537-542.
[5] ZHAO H J, LI H P, LAI Q Q, et al.Antioxidant and hepatoprotective activities of modified polysaccharides from Coprinus comatus in mice with alcohol-induced liver injury[J].International Journal of Biological Macromolecules, 2019, 127:476-485.
[6] TIAN J D, DANG H, KAUFMAN D L.Combining antigen-based therapy with GABA treatment synergistically prolongs survival of transplanted ß-cells in diabetic NOD mice[J].PLoS One, 2011, 6(9):e25337.
[7] OH S H, SOH J R, CHA Y S.Germinated brown rice extract shows a nutraceutical effect in the recovery of chronic alcohol-related symptoms[J].Journal of Medicinal Food, 2003, 6(2):115-121.
[8] 莫小叶, 骆鹏飞, 俞兰秀, 等.富含γ-氨基丁酸酸奶对小鼠睡眠的促进作用[J].现代食品科技, 2020, 36(11):29-35;129.
MO X Y, LUO P F, YU L X, et al.Study on the effect of high γ-aminobutyric acid-enriched yoghurt on sleep and its mechanism on insomnia in mice[J].Modern Food Science &Technology, 2020, 36(11):29-35;129.
[9] HATA T, REHMAN F, HORI T, et al.GABA, γ-aminobutyric acid, protects against severe liver injury[J].The Journal of Surgical Research, 2019, 236:172-183.
[10] NGO D H, VO T S.An updated review on pharmaceutical properties of gamma-aminobutyric acid[J].Molecules, 2019, 24(15):2678.
[11] PANG Y H, AHMED S, XU Y J, et al.Bound phenolic compounds and antioxidant properties of whole grain and bran of white, red and black rice[J].Food Chemistry, 2018, 240:212-221.
[12] ZHOU Y P, CAO F L, WU Q A, et al.Dietary supplementation of octacosanol improves exercise-induced fatigue and its molecular mechanism[J].Journal of Agricultural and Food Chemistry, 2021, 69(27):7603-7618.
[13] NG C H, LEUNG K Y, HUANG Y, et al.Policosanol has no antioxidant activity in human low-density lipoprotein but increases excretion of bile acids in hamsters[J].Journal of Agricultural and Food Chemistry, 2005, 53(16):6289-6293.
[14] 艾青, 葛璞, 代洁, 等.过氧化氢酶抑制剂氨基三唑减轻急性酒精性肝损伤[J].生理学报, 2015, 67(1):97-102.
AI Q, GE P, DAI J, et al.The catalase inhibitor aminotriazole alleviates acute alcoholic liver injury[J].Acta Physiologica Sinica, 2015, 67(1):97-102.
[15] WU D F, CEDERBAUM A.Oxidative stress and alcoholic liver disease[J].Seminars in Liver Disease, 2009, 29(2):141-154.
[16] WANG S L, SUI S F, LIU Z Y, et al.Protective roles of hepatic gamma-aminobutyric acid signaling in acute ethanol exposure-induced liver injury[J].Journal of Applied Toxicology, 2018, 38(3):341-350.
[17] ZHAO M, DU Y Q, YUAN L, et al.Protective effect of puerarin on acute alcoholic liver injury[J].The American Journal of Chinese Medicine, 2010, 38(2):241-249.
[18] HOSSEINI N, SHOR J, SZABO G.Alcoholic hepatitis:A review[J].Alcohol and Alcoholism, 2019, 54(4):408-416.
[19] 魏芳, 许瑞杰, 蔡诗怡, 等.石榴多酚对小鼠急性酒精性肝损伤的保护作用[J].中国中药杂志, 2014, 39(14):2721-2725.
WEI F, XU R J, CAI S Y, et al.Effects and mechanisms of punicosides on acute alcoholic liver damage in mice[J].China Journal of Chinese Materia Medica, 2014, 39(14):2721-2725.