青花椒(Zanthoxylum schinifolium Sieb.et Zucc)是芸香科花椒属植物,广泛种植在云南、重庆等西南地区,果皮呈青绿色,具有清新浓郁的的香味,纯正浓烈的麻味,是我国西部地区常用的香辛调味料,是中国传统“八大调味品”之一[1]。青花椒内含有丰富的叶绿素、黄酮、麻味物质、挥发油等物质[2],不仅能赋予食物独特的香味,还具有较强的生理保健效果,可以起到抗氧化、麻醉镇痛、降血脂、杀虫止痒等功效[3-4]。因极强的经济价值与药用价值,青花椒已被广泛地应用到食品、医药等行业。
青花椒的成熟具有较强的季节性,新鲜的青花椒不耐贮藏,所以干燥技术在青花椒的加工与贮藏方面有广泛的应用[5]。干青花椒作为调味料通常分为颗粒状和粉末状,颗粒状的花椒通常需要在高温油爆的条件下才能充分释放出香味和麻味,且食用时需要单独挑出,在一定程度上限制了使用范围,而花椒粉可以与菜肴融合在一起,可以直接食用,使用范围比较广泛[6]。青花椒粉是将花椒干燥去籽后利用粉碎技术制成的,粉末的粒度是影响花椒粉品质的关键因素,粉碎度过低即花椒粉颗粒度大,可能会产生明显的残渣以及影响产品的颜色等感官品质[6],粉碎度过高会导致投入的人力、物力成本增加,难以得到广泛推广,所以在实际工业生产中选择合适的粉碎度具有重要的意义。
有研究发现市售的青花椒粉香气淡,挥发油含量低[7],推测青花椒粉的颗粒度可能会影响花椒的理化性质;张晓旭等[8]指出青花椒粉的粒度会影响色素的提取率,并最终确定了最佳工艺的花椒粉末为100目;ZHU等[9]研究表明花椒粉末的颗粒度会影响挥发油的含量,通过40目筛网建立的模型最佳;彭彰智等[10]发现粉末的颗粒度会对花椒调味油感官品质造成一定的影响,感官评分随着花椒粉碎度的增加先提高后下降,并在花椒粉碎粒度达到60目时达到最高。此类研究证明原料颗粒度会对花椒的某种理化性质造成影响,而对青花椒粉多维度品质影响的研究未见报道,且在此类研究中对青花椒粉碎后产生的副产物利用度小,容易造成资源浪费。
基于此,本实验将干制的青花椒颗粒去籽粉碎后筛分成不同颗粒度大小的粉末,对样品的色泽、含水量、叶绿素含量、麻味物质、挥发性香气物质等理化性质和感官指标进行研究,并利用电子显微镜和扫描电子显微镜观察青花椒粉的大小分布和表观形态。旨在针对不同的产品及工业生产条件提供不同的粒度推荐,提高青花椒粉的利用率,有望为青花椒的干燥技术以及青花椒在食品工业中的应用提供一定的理论依据和技术指导,促进花椒产业的发展。
1 材料与方法
1.1 材料与试剂
重庆江津干青花椒,重庆北碚天生市场。
甲醇(色谱纯),上海阿拉丁生化科技股份有限公司;丙酮、乙醇,成都市科隆化学品有限公司;标准品羟基-α-山椒素、羟基-β-山椒素、羟基-ε-山椒素,成都麦德生科技有限公司。
1.2 仪器与设备
FA1004A电子分析天平,上海精天电子仪器有限公司;FW100高速万能粉碎机,北京科伟永兴仪器有限公司;DHG-9070A电热鼓风干燥箱,上海一恒科学仪器有限公司;HZ-ZK8型数显恒温水浴锅,巩义市予华仪器有限责任公司;WR-18精密手持测色仪,深圳市威福光电科技有限公司;SF-756P紫外可见分光光度计,上海光谱仪器有限公司;KQ-600KDE超声清洗机,昆山超声仪器有限公司;LC-10AT型分析型高效液相色谱仪,日本岛津公司;HC-C18型色谱柱、7890B/5977b气相色谱-质谱仪,美国安捷伦公司;BX43生物显微镜,日本OLYMPUS公司;Phenom Pro型扫描电镜,荷兰Phenom World公司。
1.3 实验方法
1.3.1 样品制备
首先用粉碎机将所购的干青花椒去籽后进行粉碎,将得到的青花椒粉依次用20、40、60、80、100、120目的样品筛过筛,分别得到<20、20~40、40~60、60~80、80~100、100~120、>120目的青花椒粉,去籽未粉碎的干青花椒粒为对照,将各样品分别放入密封袋中于干燥环境下贮存备用。
1.3.2 外观
将筛分后的各样品在同一时间、同一条件下进行外观拍照。
1.3.3 光学显微镜
使用光学显微镜对各样品的大小分布及形态结构进行观察,将适量的样品粉末固定在载玻片上,用显微镜观察,选择有代表性的区域进行拍摄,拍摄倍数为40×。
1.3.4 扫描电子显微镜(scanning electron microscope, SEM)
使用扫描电子显微镜对各样品的微观结构进行观察,将适量的样品粉末固定在样品铜台上,选择真空度1.0×10-3 Pa,溅射电压1.2 kV,镀膜时间3 min进行镀金,放置10 min后送入电镜观察[11],选择有代表性的区域进行拍摄,拍摄倍数为200×。
1.3.5 色泽
将不同颗粒度的各样品分别分装在底部直径为9 cm的塑料平板里,样品高度为0.5 cm,用色度仪测量各样品的色泽,记录各样品的L*值、a*值、b*值。各样品色差ΔE的计算如公式(1)所示:
![]()
(1)
式中:L*、a*、b*,不同颗粒度青花椒粉的色度测量值;![]() 青花椒粒的色度测量值。
青花椒粒的色度测量值。
1.3.6 含水量
用质量法测定青花椒粉的水分含量,分别称取不同颗粒度的青花椒粉约1.0 g(精确到0.000 1 g)放入带盖的铝盒里,并在120 ℃的真空烘箱中干燥4 h[12],样品含水量的计算如公式(2)所示:
(2)
式中:m1,干燥前样品质量,g;m2,空铝盒质量,g;m3,干燥后样品和铝盒总质量,g。
1.3.7 叶绿素含量
分别称取不同颗粒度的青花椒粉样品约0.5 g于三角瓶中,以2∶1(体积比)的比例加入10 mL 80%(体积分数)丙酮与95%(体积分数)乙醇混合液,三角瓶用封口膜密封后于室温下避光静置提取24 h,抽滤得上清液待测,用1 cm比色皿分别于663、645 nm下测定吸光度,以丙酮和乙醇的混合提取液为对照[13],试样中叶绿素a含量、叶绿素b含量和叶绿素总含量均以质量分数W表示(mg/g),叶绿素a含量、叶绿素b含量和叶绿素总含量的计算分别如公式(3)、公式(4)和公式(5)所示:
(3)
(4)
(5)
式中:W1,叶绿素a含量,mg/g;W2,叶绿素b含量,mg/g;W3,叶绿素总含量,mg/g;A1,试液在663 nm处的吸光度值;A2,试液在645 nm处的吸光度值;v,试液体积,mL;m,试样质量,g。
1.3.8 麻味物质含量
供试品溶液准备:参照ZHUO等[14]的提取方法并略作改动,分别称取约2.5 g不同颗粒度的样品,转移至100 mL锥形瓶中,按料液比1∶20(g∶mL)加入甲醇(色谱纯)50 mL,室温振荡提取4 h,将浸提液移入离心管中,以2 500 r/min离心10 min,上清液置于100 mL容量瓶,甲醇(色谱纯)定容后经0.22 μm有机系微孔滤膜过滤,即得供试品溶液,放入4 ℃冰箱冷藏备用。
标准曲线绘制:分别准确称取0.001 0 g羟基-α-山椒素、羟基-β-山椒素和羟基-ε-山椒素标准品,将其溶解于甲醇(色谱纯)中并用甲醇定容至10 mL,配成质量浓度为100 μg/mL的标准品储备液。分别准确吸取0.01、0.02、0.05、0.1、0.2、0.5 mL标准品储备液并用甲醇定容至100 mL,配成质量浓度分别为0.01、0.02、0.05、0.1、0.2、0.5 μg/mL得标准品溶液,经0.22 μm有机系微孔滤膜过滤后注入HPLC中分析,以标准品质量浓度为横坐标,吸收峰面积为纵坐标绘制标准曲线。
HPLC检测条件:色谱柱为Agilent XDB-C18柱(250 mm×4.6 mm,5 μm);柱温40 ℃,检测波长270 nm;流动相为甲醇水溶液;进样量10 μL;流速1.0 mL/min。采用梯度洗脱,洗脱条件为0~25 min:纯水40%,甲醇60%;25~36 min:纯水20%,甲醇80%;36~40 min:纯水40%,甲醇60%[14-15]。
样品中花椒麻味物质的含量(X)的计算如公式(6)所示:
(6)
式中:X,待测样中麻味物质的含量,mg/g;c,在工作曲线上查出或回归方程或采用同等条件下峰面积比值法计算求出的花椒麻味物质的含量,μg/mL;m,样品的质量,g;V,待测液的定容体积,mL;k,样品提取液稀释倍数;1 000,单位换算系数。
1.3.9 挥发性香气成分含量
称取0.1 g青花椒粉样品于顶空瓶,立即密封顶空瓶。将样品瓶置于加热的磁力搅拌器中,萃取温度50 ℃,萃取时间40 min,将萃取好的吸附头取出,迅速将针管插入GC进样口,解吸附3.5 min,同时启动仪器收集数据。
GC-MS检测条件:GC检测条件:色谱柱为DB-5MS柱(30 m×0.25 mm×0.25 μm);进样口温度250 ℃;检测器温度280 ℃;载气He;升温梯度:以5 ℃/min升至150 ℃,再以4 ℃/min升至250 ℃。MS检测条件:EI离子源;离子源温度230 ℃;前进样口温度250 ℃;四极杆温度150 ℃;扫描范围35~450 m/z;电离方式为EI;电离电压70 eV;检索谱库为NIST[16-17]。
1.4 数据分析
所有实验进行3次平行,结果表示为“平均值±标准差”。采用Excel 2010进行基础数据收集与处理,采用SPSS 22.0进行数据分析,显著性分析以Duncan′stest进行方差分析(ANOVA),P<0.05被认为存在显著差异;采用Origin 2019进行图形绘制。
2 结果与分析
2.1 颗粒度对干制青花椒粉外观的影响
不同颗粒度的青花椒粉样品如图1所示。由图1-a中可以看出,青花椒粒颗粒大而均匀,油腺突出,呈自然开口状态,呈现出较深的墨绿色,有光泽;粉碎后的青花椒粉呈现出鲜亮的黄绿色色泽,随着原料颗粒度的改变,样品的粒径和颜色也发生相应的改变。粒径随着青花椒粉筛选目数的增大逐渐变小,当原料颗粒度小于40目时(图1-b、图1-c),样品呈现偏黄色碎片状;当粒度大于80目时(图1-f~图1-h)样品呈黄绿色较细粉末状,且色泽较为均匀;当粒度为40~80目时(图1-d、图1-e),样品为绿色粉末与黄色较小碎片的混合物。产生以上现象的原因是因为青花椒粒由黄色内壳和绿色果皮组成,内壳部分较难粉碎,果皮部分较易粉碎,粉碎后的花椒粉经不同目过筛后,内壳部分多以碎片的形式存在于小于40目的样品中,果皮多以较细粉末的形式存在于大于80目的样品中,40~80目的样品为内壳中较小碎片与果皮中粒径相对较大粉末的混合物,且随着筛选目数的增大粉末部分的比例增大。

a-整粒花椒;b-<20目;c-20~40目;d-40~60目;e-60~80目;f-80~100目;g-100~120目;h->120目
图1 原料颗粒度对干制青花椒外观的影响
Fig.1 Effect of different particle sizes on the appearance of dried Zanthoxylum schinifolium Sieb.et Zucc
2.2 不同颗粒度的干制青花椒粉样品光学显微镜观测图
不同颗粒度的青花椒粉样品光学显微镜观测如图2所示,可以看出青花椒粒及粉碎后的青花椒粉组织结构完整,青花椒粒(图2-a)在显微镜下呈立体的弧形,粉碎后的样品随着粉末目数的增加,样品的粒度显著降低,形态发生变化,其中小于40目的样品(图2-b、图2-c)呈现明显的碎片状,大于80目的样品(图2-f~图2-h)呈粉末状且观察到粉末的团聚物,40~80目的样品呈碎片与粉末状的混合物,与2.1节中肉眼观察得出结论一致。根据光学显微镜观察测量结果,在“CellSens Entry”实时观测系统内用“测量标尺”测定样品的粒径,结果如表1所示。由表1可以看出,随着筛选目数的增大,青花椒粉的粒径逐渐减小,不同样品间均呈现出显著性差异(P<0.05),与2.1节及图2观察结果一致。
表1 原料颗粒度对青花椒粒径大小的影响
Table 1 Effects of different particle sizes on the particle size of Zanthoxylum schinifolium Sieb.et Zucc

青花椒颗粒度粒径/μm青花椒颗粒度粒径/μm整粒花椒2 012.73±67.04a60~80目226.71±9.75e<20目936.65±33.29b80~100目165.36±5.91f20~40目519.04±22.38c100~120目125.91±2.92g40~60目327.23±14.84d>120目84.35±2.15h
注:表中每一列数字右上角标注的不同小写字母表示具有显著性差异(P<0.05)(下同)。

a-整粒花椒;b-<20目;c-20~40目;d-40~60目;e-60~80目;f-80~100目;g-100~120目;h->120目
图2 原料颗粒度青花椒光学显微镜观测图
Fig.2 Optical microscope observation of Zanthoxylum schinifolium Sieb.et Zucc with different particle sizes
2.3 不同颗粒度的青花椒粉样品SEM观测图
青花椒颗粒体积较大,无法在SEM下成像,对粉碎后的青花椒粉表面进行SEM表征分析,不同颗粒度的青花椒粉SEM观测如图3所示。当筛选目数大于40目时(图3-a、图3-b),观察到体积较大、表面结构清晰的块状样品,且样品表面有破损,是因为这部分样品的主要成分是硬度较大、较难粉碎的内壳部分,破损是由粉碎所导致;随着样品颗粒度的减小(图3-c、图3-d),观察到块状样品与粉末颗粒的混合物,且随着目数的增大粉末颗粒所占比例越大,筛选目数大于80目时(图3-e~图3-g),观察到粒径较小的粉末样品,随着筛选目数的增大越来越均匀,且观察到粉末颗粒聚集而成的团聚物,是因为青花椒粉颗粒度减小至一定程度后,粉末表面的吸附性增强,相互之间的作用力增大[18],更容易发生分子间聚集。

a-<20目;b-20~40目;c-40~60目;d-60~80目;e-80~100目;f-100~120目;g->120目
图3 原料颗粒度青花椒粉扫描电子显微镜观测图
Fig.3 Scanning electron microscope observation of Zanthoxylum schinifolium Sieb.et Zucc powder with different particle sizes
2.4 原料颗粒度对干制青花椒粉色泽的影响
原料颗粒度对青花椒色泽的影响如图4所示,采用Lab法表示结果,其中L*值代表亮度,L*值越大表示亮度越大,a*值代表红绿,a+表示偏红,其值越大表示越红,b*值代表黄蓝,b+表示偏黄,其值越大代表越黄。可以看出,青花椒粒和粉末色泽都为a+、b+,表示所测的青花椒色泽是偏向红、黄的,a*是评价青花椒干燥后是否仍为绿色的一个重要指标,干燥条件及花椒表面油胞的完整性都可能会对干燥过程中青花椒的色泽造成影响,干燥过程中会逐渐由绿色向褐色转变[19],即为a+,张艺等[20]在干燥方式对青花椒色泽的研究中也测定出青花椒的色泽为a+,同时GH/T 1284—2020《青花椒》中规定,九成熟的花椒表皮由青色转为黄红色,完全成熟的花椒表皮由黄色变成红色,a+的结果也有可能是所用青花椒成熟度较高所导致。与青花椒粒相比,粉碎后的青花椒粉L*值升高(P<0.05),随着青花椒粉目数的增大,L*值逐渐降低(P<0.05),表明粉碎可以使花椒粉末的亮度增加,但是随着样品粉末目数的提高,亮度增加的程度减少,杨沫等[18]在对不同粒度花椒籽黑种皮粉的色泽的研究中发现粉碎可以明显增加样品的亮度;粉碎后的青花椒粉a*值和b*值都升高(P<0.05),且随着青花椒粉目数的增加先降低后升高,在大于120目时达到最高值,a*值和b*值分别提高了53.85%、81.49%,在20~40目时a*值最小,与对照组相比提高了15.66%,在80~100目时b*值最小,与对照组相比提高了66.67%。
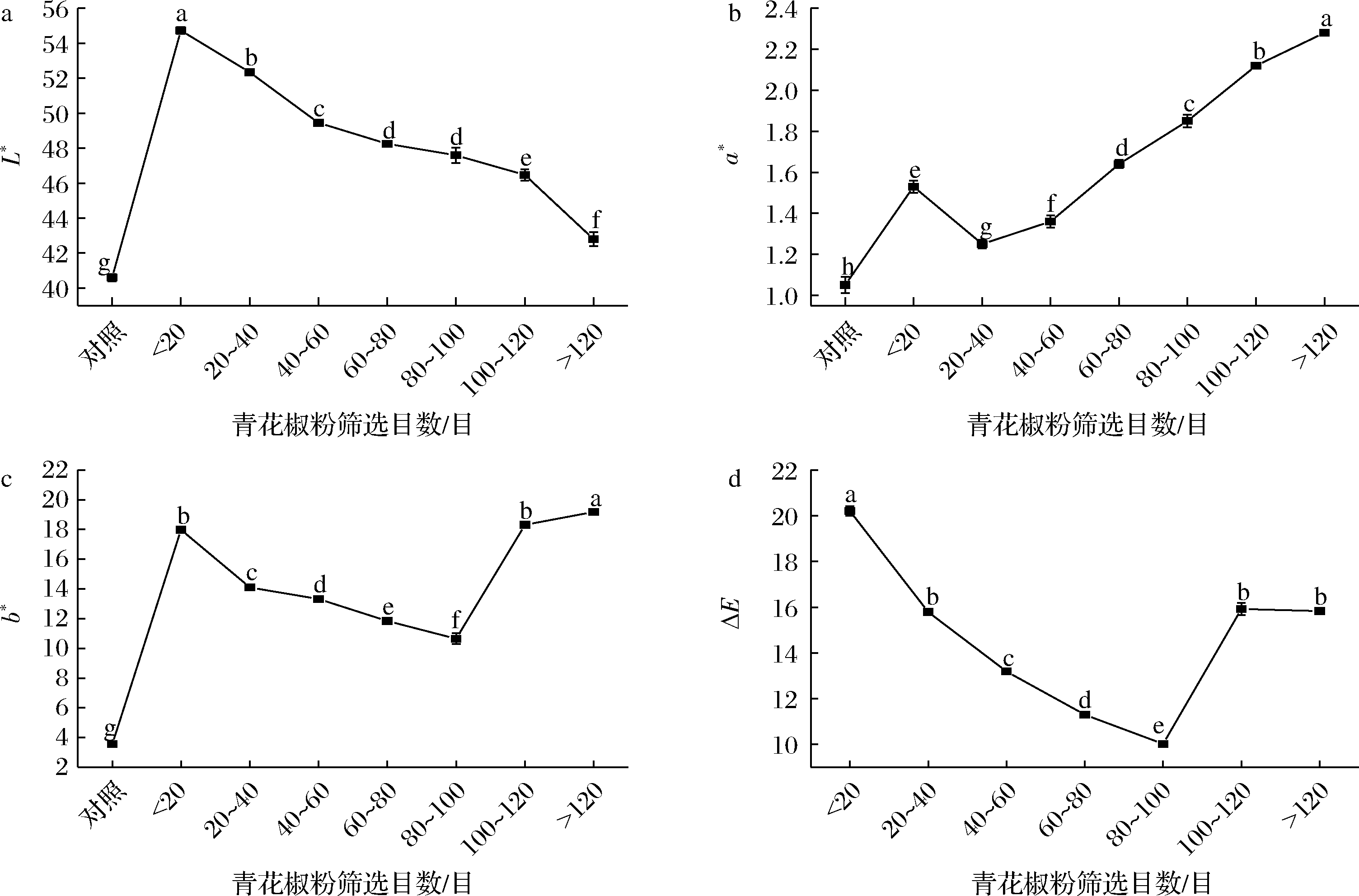
a-亮度L*;b-红绿值a*;c-黄蓝值b*;d-色差ΔE
图4 原料颗粒度对青花椒色泽的影响
Fig.4 Effect of different particle sizes on the color of Zanthoxylum schinifolium Sieb.et Zucc
注:图内组间不同小写字母表示具有显著性差异(P<0.05)(下同)。
以青花椒粒的色泽为对比,计算不同粒度青花椒粉的色差值ΔE,ΔE代表样品的可接受度,其值越小代表接受度越高。可以看出随着青花椒粉颗粒度的减小,样品的ΔE先减小后增大(P<0.05),在其粒度为80~100目时达到最小值。综上,与青花椒粒相比,粉碎可以提高样品的色泽,样品色泽的变化主要是由于不同粒度的粉末样品是由青花椒不同部位的结构组成及其粒径的减小、混合均匀度提高等原因所导致[21],其中在粉末目数为80~100目时样品的色泽接受度最高。
2.5 颗粒度对干制青花椒粉含水量的影响
水分含量是直接影响干燥产品的货架期及品质的指标,通常来说,样品水分含量越低,品质越好[22]。原料颗粒度对青花椒粉含水量的影响如图5所示。可以看出,所有样品的含水量都在12%以下,符合GH/T 1284—2020《青花椒》中青花椒理化指标—干花椒水分含量的规定标准(干青花椒含水量≤13%)。与青花椒颗粒相比,随着青花椒粉粒度的减小,样品的含水量先降低后增加至稳定;当青花椒粉小于40目时,样品的含水量低于青花椒颗粒的含水量,与花椒颗粒相比分别降低了1.83%、0.97%;当粉末大于80目时,样品的含水量达到最高并维持稳定,此时与花椒颗粒相比样品的含水量上升了约1.37%。产生此结果的原因可能是小于40目的部分主要为青花椒粒内壳较难粉碎的部分,此部分样品的含水量较低,大于80目的部分主要为果皮较易粉碎的部分,40~80目的部分主要为内壳与果皮的混合物且随着目数的增大果皮部分占比越大,粉碎后样品会因接触面积增大而吸水[7],即与青花椒粒相比含水量上升,当粉末颗粒大于80目时样品较均匀,含水量不再随着目数的增加而升高。

图5 原料颗粒度对青花椒含水量的影响
Fig.5 Effect of different particle sizes on water content of Zanthoxylum schinifolium Sieb.et Zucc
2.6 颗粒度对干制青花椒粉叶绿素含量的影响
叶绿素含量是青花椒的营养参数之一,也是评价产品色泽变化的重要参数[21],原料颗粒度对青花椒粉叶绿素含量的影响如表2所示。可以看出,在青花椒粒及其粉末中,以叶绿素a为主,其含量占叶绿素总含量的60%~70%。与青花椒粒相比,除小于40目的2组样品,其他样品的叶绿素a含量、叶绿素b含量和叶绿素总含量都显著增加(P<0.05),且叶绿素b含量和叶绿素总含量随着样品颗粒度的减小而增加,最终在大于80目时含量达到稳定,此时与青花椒粒相比叶绿素a含量、叶绿素b含量和总含量分别提高了16.95%、25.47%、20.17%。产生以上变化的主要原因是由于青花椒的叶绿素主要存在于果皮部分[23],内壳黄绿色部分所含叶绿素含量较低,所以叶绿素含量会随着粉末中果皮所研磨得细粉比例的增大而增加,当大于80目时,样品中全为青花椒果皮部分所粉碎而得的细粉且颗粒较为均匀,所以叶绿素含量不再变化。
表2 原料颗粒度对青花椒叶绿素含量的影响
Table 2 Effects of different particle sizes on chlorophyll content of Zanthoxylum schinifolium Sieb.et Zucc
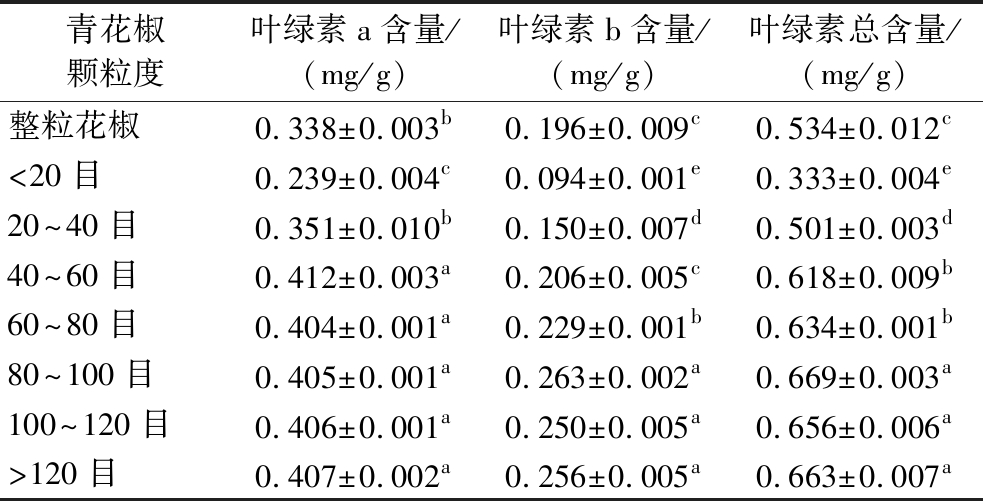
青花椒颗粒度叶绿素a含量/(mg/g)叶绿素b含量/(mg/g)叶绿素总含量/(mg/g)整粒花椒0.338±0.003b0.196±0.009c0.534±0.012c<20目0.239±0.004c0.094±0.001e0.333±0.004e20~40目0.351±0.010b0.150±0.007d0.501±0.003d40~60目0.412±0.003a0.206±0.005c0.618±0.009b60~80目0.404±0.001a0.229±0.001b0.634±0.001b80~100目0.405±0.001a0.263±0.002a0.669±0.003a100~120目0.406±0.001a0.250±0.005a0.656±0.006a>120目0.407±0.002a0.256±0.005a0.663±0.007a
2.7 颗粒度对干制青花椒粉麻味物质含量的影响
麻味是花椒特有的感官,麻味物质含量是青花椒重要的内部质量指标之一,目前在青花椒中共分离得到25种麻味物质,主要来源为羟基-α-山椒素、羟基-β-山椒素和羟基-ε-山椒素,其中羟基-α-山椒素会产生刺痛感,羟基-β-山椒素产生麻木感,羟基-ε-山椒素产生灼烧感[24]。本研究以这3种物质的含量及其总含量随着青花椒粉粒度的变化为研究对象,原料颗粒度对青花椒麻味物质含量的影响如表3所示。
表3 原料颗粒度对青花椒麻味物质含量的影响
Table 3 Effects of different particle sizes on the content of numb-taste substances in Zanthoxylum schinifolium Sieb.et Zucc

青花椒颗粒度麻味物质总含量/(mg/g)羟基-α-山椒素/(mg/g)羟基-β-山椒素/(mg/g)羟基-ε-山椒素/(mg/g)整粒花椒4.76±0.05f3.50±0.06f1.18±0.01f0.07±0.01f<20目16.49±0.03e12.34±0.08e3.14±0.01e0.98±0.03e20~40目29.69±0.08d24.09±0.03d3.94±0.02d1.66±0.02d40~60目38.15±0.01c31.27±0.02c4.45±0.02c2.43±0.01c60~80目61.33±0.91b52.80±0.78b5.85±0.02b2.68±0.15b80~100目86.00±0.50a76.46±0.74a7.19±0.30a2.36±0.07c100~120目86.31±0.62a76.48±0.33a6.98±0.23a2.86±0.06ab>120目86.87±0.09a77.02±0.06a6.89±0.14a2.97±0.01a
由表3可以看出,在青花椒粒和青花椒粉中,羟基-α-山椒素都是最主要的麻味物质,其含量为羟基-β-山椒素的3~15倍,羟基-ε-山椒素的10倍以上。粉碎后的样品花椒麻素含量显著高于青花椒粒的含量(P<0.05),是因为在室温提取条件下,青花椒粒中的花椒麻素不易释放;随着样品粒度的减小,麻味物质总含量及3种山椒素的含量都呈现出先上升后稳定的趋势,羟基-α-山椒素的变化率高于羟基-β-山椒素和羟基-ε-山椒素的变化率,最终在粉末颗粒大于80目时达到稳定,此时样品中麻味物质的含量是青花椒粒的20倍,且显著高于其他颗粒度青花椒粉样品中麻味物质的含量(P<0.05),与60~80目的样品相比,麻味物质含量提高了近30%,说明青花椒的麻味物质主要集中在果皮的细粉部分,粉碎有助于麻味物质的溶出,是因为粉碎会使花椒细胞组织的破壁较充分、样品表面积和孔隙率增大[7]。
2.8 颗粒度对干制青花椒粉香气物质的影响
原料颗粒度对青花椒粉香气物质的影响如附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.032804)所示,青花椒粒及其粉末水提物中共定性出118种挥发性香气物质,主要包括烯烃47种、醇类25种、酯类14种、醛类13种、酮类10种、烷烃7种、酸类2种,其中含量最高的前五类挥发性化合物分别为醇类、烷烃类、酯类、酮类和醛类,醇类和烷烃类的相对含量占总含量的90%以上。醇类化合物主要呈现清新、香甜和木香的气味,烃类物质具有强烈的药草香气,酯类化合物主要体现果香、木香等香气,酮类化合物呈现出清凉的天然药材的气味,醛类化合物提供清香、木香等植物性香气[25],花椒粒及花椒粉的香气是由各挥发性香气成分共同决定的,本研究鉴定出的青花椒粉主要挥发性香气成分与王娟等[26]、FEI等[27]等关于青花椒香气成分的分析基本一致。
附表1 原料颗粒度对青花椒挥发性成分相对含量的影响
Addendum 1 Effects of different particle sizes on the content of volatile components in Zanthoxylum schinifolium Sieb. et Zucc

序号成分相对含量/%整粒<20目20~40目40~60目60~80目80~100目100~120目>120目醇类63.5772.7973.8775.7577.3682.1082.0182.231芳樟醇54.6462.5560.0463.4064.8969.1567.5567.9824-四氢呋喃醇3.042.123.222.992.812.052.952.583(-)-萜品-4-醇2.18-2.682.482.381.953.172.944(+)-α-松油醇1.872.192.942.452.422.092.922.775反式橙花醇1.42.452.573.333.595.234.524.136反-2-十三烯醇0.130.13-0.060.060.04--7桉油烯醇0.12-0.180.350.410.68-0.658对-2-薄荷-1-醇0.090.12-0.120.130.100.250.159环癸醇0.060.05-----105α,6β-环氧树脂-4,8α,7α-锕-11(13)-烯-8,12-醇0.04-------114-叔丁烯醇-2.59------122-癸炔-1-醇-0.06-0.15----131,6-二甲基-4-丙烷-2-基-3,4,4a,7,8,8a-六氢-2H-萘-1-醇-0.05-0.09----14(E)-芳樟醇氧化物-0.23----0.26152-[(1R,3S,4S)-4-乙烯基-4-甲基-3-丙基-1-烯-2-基环己基]丙烷-2-醇---0.070.130.080.130.14163α-乙烯基-3-甲基-2β-(1-甲基乙烯基)-6β-异丙基环己烷-1β-醇---0.26----17桉叶油醇----0.12-0.120.11181-甲基-4-(1-甲基乙基)-2-环己烯-1-醇----0.130.10-0.14193-四癸炔-1-醇----0.210.260.07-20蒲公英醇----0.080.14-0.11212-(4-甲基苯基)丙-2-醇------0.04222-(4-甲基环己烯-1-基)丙-1-醇-----0.060.080.0623α-红没药醇------0.130.0724反式-2-癸烯-1-醇-------0.07254(15),5,10(14)-亚麦曲三烯-1-醇-----0.070.080.07烯烃类29.6519.9617.6815.7213.5010.4310.739.97264-2-己烯双环0.320.470.150.130.170.100.050.1027(±)-2-蒎烯0.490.08-0.240.310.04--28桧烯4.481.081.351.26-0.280.260.2429β-蒎烯0.470.05-0.273.51---30侧柏烯---0.120.11-0.04-31罗勒烯-0.400.290.51--0.230.2132月桂烯2.191.321.191.33-0.420.440.3933水芹烯0.24---1.90---34(+)-2-蒈烯0.550.34-0.420.38---35邻伞花烃0.740.64---0.26--36柠檬烯-7.34------37(R)-(+)-苎烯9.19-3.37--1.661.481.2738(±)-2-蒎烯0.19-0.11-----393,7-二甲基-1,3,7-辛三烯0.57----0.03-40γ-萜品烯1.161.050.95--0.370.470.5941萜品油烯0.45-0.22--0.220.290.40422-对甲苯基-1-丙烯0.18-------43茴香烯0.401.510.47--0.330.41442,5,6-三甲基庚基-1,3,6-三烯0.03-------45β-烯丙烯0.690.290.770.810.870.670.500.4546(-)-反式石竹烯1.631.800.69--1.101.291.0147γ-紫穗槐烯2.510.171.073.320.520.470.580.5248α-石竹烯1.55-1.63-1.201.311.341.1849β-石竹烯--1.571.852.07---50(-)-石竹烯氧化物--0.350.43--0.520.55512-异丙烯基-4a,8-二甲基-1,2,3,4,4a,5,6,7-八氢萘0.10-------52(-)-β-花柏烯1.140.501.180.98-0.950.85-534,7-二甲基-1-丙-2-基-1,2,3,5,6,8a-六氢萘0.250.10---0.30--541,5,5,8-四甲基-12-氧杂双环[9.1.0]十二烷-3,7-二烯0.050.140.16---0.240.2855β-辛烯-0.10--0.460.30--56松油烯-0.28-1.331.00---571-甲基-5-亚甲基-8-甲基-1,6-环十二烯-0.782.55--1.351.110.88584,11,11-三甲基-8-亚甲基双环[7.2.0]十一烷基-3-烯-0.37---0.59-0.5459α-古尔酮烯--0.06--0.04-0.05
续附表1

序号成分相对含量/%整粒<20目20~40目40~60目60~80目80~100目100~120目>120目603,7,7-三甲基-1,3,5-环庚三烯---0.53----613-甲基-6-(1-甲基亚乙基)环己烯---0.280.22---621,6-环十二烯---0.150.12---63α-柏木烯---1.69----64γ-广藿烯---0.07----65右旋大根香叶烯---0.04----66异戊烯---0.220.16---67γ-广藿烯------0.08-68佛术烯------0.6269(+)-普雷齐扎烯-------0.0670γ-依兰油烯-------0.1171顺式-β-愈创木烯-------0.73酯类3.404.095.015.115.604.614.344.07722-甲基-2-壬烯酸甲酯0.140.060.060.050.150.110.100.1273苯乙酸甲酯0.060.100.10-0.05--0.0574水杨酸甲酯0.110.250.100.080.100.07-0.0775乙酸芳樟酯2.732.613.763.854.453.623.523.11766,6-二甲基双环庚-2-烯-2-乙酸甲酯0.100.130.190.230.250.220.200.2077乙酸松油酯0.140.140.250.290.310.260.240.2478乙酸橙花酯0.03--0.050.060.080.060.0679乙酸香叶酯0.090.100.200.190.190.180.160.16802-苯基乙酸乙酯-0.700.230.28----81乙酸冰片酯--0.06--0.060.060.06827-壬烯酸甲酯--0.06-----832-氨基丙酸乙酯---0.04----843-辛烯酸乙酯---0.05---85穿心莲内酯----0.04---酮类1.481.501.421.441.461.431.541.5587α-侧柏酮1.201.080.900.950.850.740.790.7888(1S)-4-亚甲基-1-丙烷-2-基双环[3.1.0]己-3-酮0.070.120.120.140.100.090.090.0989(S)-(+)-香芹酮0.040.080.090.050.060.050.060.07902-十二酮0.170.22-0.260.300.340.20-91甲基(2,2,3-三甲基环戊基)酮--0.11-----922-癸酮--0.20----0.23938α-羟基-11-烯-9-酮---0.04----942-十九烷酮----0.150.210.11-95哌啶酮------0.290.42962-十三烷酮-------0.11醛类0.790.710.720.740.710.780.730.76972,4-己二烯醛0.120.140.130.220.160.240.320.34982-亚甲基己醛0.23----0.07--99(+)-香茅醛0.120.110.110.120.150.160.140.17100枯名醛0.070.15-0.11-0.090.07-1011-辛醛0.070.060.05-0.05--0.02102反-2-壬烯醛0.180.200.150.190.22-0.13-103异柠檬醛---0.10----1043-环己烯-1-甲醛-----0.22--105正己醛------0.03-106正壬醛----0.04-0.04-107孜然醛--0.11-0.09--0.12108桃金娘烯醛------0.11109水芹醛-0.050.17-----烷烃类0.720.650.430.580.520.480.450.51110邻伞花烃0.540.450.290.310.260.240.230.241112,2,3-三甲基双环庚烷0.080.090.060.06----1122,6,10,15-四甲基十七烷0.05--0.110.100.120.110.091132-氨基-N-乙基丙酰胺0.05-------1141-甲基-4-(2-甲基环氧乙烷基)-7-氧杂双环[4.1.0]庚烷-0.050.040.060.040.050.040.05115十二烷-0.060.040.040.040.040.030.04116异莰烷-----0.030.040.09酸类0.030.030.030.050.050.060.170.14117(R)-(+)-香茅酸0.030.030.030.050.050.060.030.04118对2-羟基-1-羟基苯甲酸------0.140.10总计99.6499.7399.1699.3999.1299.8999.9799.23
本研究在青花椒粒中检测出2-氨基-N-乙基丙酰胺、2-对甲苯基-1-丙烯、2,5,6-三甲基庚基-1,3,6-三烯等5种化合物未在青花椒粉中检测到,可能是由于粉碎破坏了青花椒的结构,使得这些成分在粉碎的过程中挥发[7]。3-四癸炔-1-醇、罗勒烯、2-苯基乙酸乙酯、2-十九烷酮、水芹醛、十二烷等50余种化合物只在青花椒粉中检测到,其中水芹醛和1-甲基-5-亚甲基-8-甲基-1,6-环十二烯2种挥发性物质大于40目的样品中检测到,2-(4-甲基环己烯-1-基)丙-1-醇、4(15),5,10(14)-亚麦曲三烯-1-醇、异莰烷3种挥发性物质只在大于80目的样品中检测到,与张国琳等[7]关于常规粉碎对青花椒香气成分的影响结果类似,产生以上变化是因为粉碎会使花椒组织内部的挥发性成分充分暴露,从而更多的香气成分被释放出来,水芹醛等香气成分主要存在于花椒内壳较难粉碎部分,异莰烷等挥发性物主要位于青花椒的果皮部分,所以导致原料颗粒度的样品挥发性香气成分的差异。
可以看出与青花椒粒相比,青花椒粉中的醇类物质和酯类物质相对含量显著增加(P<0.05),烯烃类物质相对含量显著减少(P<0.05);随着样品筛选目数的增加,醇类物质相对含量呈现先增加后稳定的趋势,最终在大于80目时达到稳定,与对照组相比醇类物质含量增加了18.53%;烯烃类物质相对含量随着样品筛选目数的增加逐渐减少,在大于80目时达到稳定,与对照组相比相对含量降低了19.22%;酯类物质相对含量随着目数的增加呈现先增加后减少趋势,可能是因为酯类物质多存在于青花椒的内壳部分或果皮中酯类物质在研磨过程中发生了降解。综上,粉碎能更好地使花椒中的醇类、酯类等特征性香气释放出来,而由于烃类物质极易挥发,所以在研磨的过程中会导致烯烃类香气的降解[28],当青花椒粉粒度大于80目时香气不再随着粒度的变化而变化。
3 结论
本文研究了原料颗粒度对干制青花椒粉大小形态、理化性质和感官性质的影响。结果表明,粉碎可以促进青花椒麻味物质和挥发性香气物质的释放,与青花椒粒相比,粉碎后的青花椒粉色泽提升,叶绿素含量、麻味物质含量显著增加,挥发性香气成分种类增加;青花椒粉的性质会因颗粒度的不同而有所变化,主要是由于不同粒度的粉末样品是由青花椒不同部位的结构组成所导致,且粉碎会使花椒细胞组织的细胞壁充分破坏,有利于麻味物质、挥发性香气成分等的释放。在实际工业生产及日常膳食使用中,若使用颗粒状的干制青花椒,为使麻味和香味充分释放,需先在高温油爆条件下处理;若使用青花椒粉末,为了节约人力、物力成本以及提高原料利用率,针对不同的产品性质可以选择合适的粉碎度:大于80目的青花椒粉末可以作为中高档餐厅品质较高的调味品,或用于对麻味、添加调味料颗粒度要求较高的产品生产;大于40目(40~80目)的样品可以用作家庭膳食调味品或用于中麻中香的产品生产;大于20目(20~40目)的样品可用于辣条等对麻味要求较低、允许添加调味料残渣残留的产品生产。该研究有望为青花椒的干燥技术以及青花椒在食品工业中的应用提供一定的理论依据和技术指导,促进花椒产业的发展,未来的研究可着重于探讨青花椒粉末在特定食品中的最适粉碎度及添加量。
[1] ZHANG M M, WANG J L, ZHU L, et al.Zanthoxylum bungeanum Maxim.(Rutaceae):A systematic review of its traditional uses, botany, phytochemistry, pharmacology, pharmacokinetics, and toxicology[J].International Journal of Molecular Sciences, 2017, 18(10):2172.
[2] WANG Z J, ZHOU Y, SHI X L, et al.Comparison of chemical constituents in diverse zanthoxylum herbs, and evaluation of their relative antibacterial and nematicidal activity[J].Food Bioscience, 2021, 42:101206.
[3] JIANG L, ZHAO X Y, PEI J J, et al.Daily chemical evodiamine from Chinese prickly ash attenuates osteoclast differentiation through RANKL induced NFAT pathways[J].Journal of Functional Foods, 2017, 37:594-602.
[4] CHEN L, HU M B, CHEN Z Y, et al.Preparation, structural characterization and neuroprotective effects of polysaccharides from the pericarp of Zanthoxylum bungeanum Maxim against H2O2-induced oxidative damage in PC12 cells[J].South African Journal of Botany, 2021, 142:165-174.
[5] CHENG J X, KE J X, HOU X Y, et al.Changes in qualities of dried Zanthoxylum armatum DC.at different storage methods[J].Food Packaging and Shelf Life, 2021, 29:100716.
[6] 胡丽丽. 花椒调味油制备的研究[D].成都:西华大学, 2013.
HU L L.Study on the processing technology of Zanthoxylum oil[D].Chengdu:Xihua University, 2013.
[7] 张国琳, 胡星麟, 张卫明, 等.常规粉碎对青花椒挥发油含量与成分的影响[J].食品工业科技, 2014, 35(11):112-116.
ZHANG G L, HU X L, ZHANG W M, et al.Effect of conventional pulverization on content and components of volatile oil from Zanthoxylum armatum v.novemfolius[J].Science and Technology of Food Industry, 2014, 35(11):112-116.
[8] 张晓旭, 周锡钦, 胡思齐, 等.超声辅助有机溶剂法提取青花椒色素的工艺研究[J].中国调味品, 2019, 44(8):185-188.
ZHANG X X, ZHOU X Q, HU S Q, et al.Extraction of pigments from Zanthoxylum schinifolium by ultrasonic-assisted organic solvent method[J].China Condiment, 2019, 44(8):185-188.
[9] ZHU S P, WANG G, YANG F, et al.Effect of powder's particle size on the quantitative prediction of volatile oil content in Zanthoxylum bungeagum by NIR technique[J].Spectroscopy and Spectral Analysis, 2008, 28(4):775-779.
[10] 彭彰智, 彭超, 潘军辉, 等.响应面法优化棕榈油基花椒调味油的生产工艺及其贮藏稳定性研究[J].中国调味品, 2021, 46(9):58-64.
PENG Z Z, PENG C, PAN J H, et al.Optimization of the production process of palm oil-based Zanthoxylum flavoring oil by response surface methodology and its storage stability[J].China Condiment, 2021, 46(9):58-64.
[11] SOLVAL K M, SUNDARARAJAN S, ALFARO L, et al.Development of cantaloupe (Cucumis melo) juice powders using spray drying technology[J].LWT, 2012, 46(1):287-293.
[12] FERRARI C C, GERMER S P M, DE AGUIRRE J M.Effects of spray-drying conditions on the physicochemical properties of blackberry powder[J].Drying Technology, 2012, 30(2):154-163.
[13] HE Y J, CHEN H, ZHOU L, et al.Comparative transcription analysis of photosensitive and non-photosensitive eggplants to identify genes involved in dark regulated anthocyanin synthesis[J].BMC Genomics, 2019, 20(1):1-14.
[14] ZHUO Z H, XU D P, LI Y P, et al. Fingerprint analysis of Zanthoxylum armatum DC. by HPLC[J]. Journal of Food Composition and Analysis,2021,96:103736.
[15] FAYOS O, SAVIR N M, ORDUNA J, et al.Quantitation of capsiate and dihydrocapsiate and tentative identification of minor capsinoids in pepper fruits (Capsicum spp.) by HPLC-ESI-MS/MS(QTOF)[J].Food Chemistry, 2019, 270:264-272.
N M, ORDUNA J, et al.Quantitation of capsiate and dihydrocapsiate and tentative identification of minor capsinoids in pepper fruits (Capsicum spp.) by HPLC-ESI-MS/MS(QTOF)[J].Food Chemistry, 2019, 270:264-272.
[16] LIU Y J, QIAN Y Y, SHU B, et al.Effects of four drying methods on Ganoderma lucidum volatile organic compounds analyzed via headspace solid-phase microextraction and comprehensive two-dimensional chromatography-time-of-flight mass spectrometry[J].Microchemical Journal, 2021, 166:106258.
[17] HWANG Y S, YANG J S, LEE H W, et al.Optimization and comparison of headspace hot injection and trapping, headspace solid-phase microextraction, and static headspace sampling techniques with gas chromatography-mass spectrometry for the analysis of volatile compounds in kimchi[J].LWT, 2020, 134:110155.
[18] 杨沫, 薛媛, 任璐, 等.不同粒度花椒籽黑种皮粉理化特性[J].食品科学, 2018, 39(9):47-52.
YANG M, XUE Y, REN L, et al.Physicochemical characteristics of black seed coat powders with different particle sizes of pepper (Zanthoxylum bungeanum)[J].Food Science, 2018, 39(9):47-52.
[19] 马尧. 不同种质资源花椒主要品质性状差异及其影响因素研究[D].杨凌:西北农林科技大学, 2021.
MA Y.Differences and influence factors for pericarp quality of different Zanthoxylum germplasm resources[D].Yangling:Northwest A&F University, 2021.
[20] 张艺, 张甫生, 宋莹莹, 等.干燥条件对青花椒色泽的影响[J].食品科学, 2014, 35(5):23-27.
ZHANG Y, ZHANG F S, SONG Y Y, et al.Effects of different drying conditions on color change of green prickleyashes (Zanthoxylum schinifolium Zucc.)[J].Food Science, 2014, 35(5):23-27.
[21] GAO D H, LI M Z, ZHANG J Y, et al.Improvement of chlorophyll content estimation on maize leaf by vein removal in hyperspectral image[J].Computers and Electronics in Agriculture, 2021, 184:106077.
[22] 周志帅, 李娇, 徐礼明, 等.不同产地青花椒浸提前后品质的比较[J].食品工业科技, 2022,43(12):299-309.
ZHOU Z S, LI J, XU L M, et al.Comparative study on the green Sichuan pepper (Zanthoxylum schinifolium) and their leaching residue with different origins[J].Science and Technology of Food Industry, 2022,43(12):299-309.
[23] LUO J J, KE J X, HOU X Y, et al.Composition, structure and flavor mechanism of numbing substances in Chinese prickly ash in the genus Zanthoxylum:A review[J].Food Chemistry, 2022, 373:131454.
[24] 杨娴, 曾钦朦, 罗红, 等.贵州高海拔地区花椒优良单株麻味物质测试分析[J].粮食与油脂, 2021, 34(12):153-157.
YANG X, ZENG Q M, LUO H, et al.Detection and analysis of hemp flavor substances of Zanthoxylum bungeanum in high altitude area of Guizhou[J].Cereals &Oils, 2021, 34(12):153-157.
[25] WANG L, WANG Z M, LI X Y, et al.Analysis of volatile compounds in the pericarp of Zanthoxylum bungeanum Maxim-by ultrasonic nebulization extraction coupled with headspace single-drop microextraction and GC-MS[J].Chromatographia, 2010, 71(5):455-459.
[26] 王娟, 杜静怡, 贾雪颖, 等.花椒精油及其水提物的香气活性成分分析[J].食品工业科技, 2021, 42(20):229-241.
WANG J, DU J Y, JIA X Y, et al.Characterization of the aroma-active compounds in essential oil and water extract of Zanthoxylum bungeanum pericarp[J].Science and Technology of Food Industry, 2021, 42(20):229-241.
[27] FEI X T, QI Y C, LEI Y, et al.Transcriptome and metabolome dynamics explain aroma differences between green and red prickly ash fruit[J].Foods, 2021, 10(2):391.
[28] LIU Y F, ZHANG Y L, WEI X Y, et al.Effect of radio frequency-assisted hot-air drying on drying kinetics and quality of Sichuan pepper (Zanthoxylum bungeanum Maxim.)[J].LWT, 2021, 147:111572.