植物油在人们生活中所占的比例日益增加,其质量安全至关重要。目前,国内植物油产量增长缓慢,需依靠国外进口来弥补植物油产需的缺口。国内外对植物油中农药残留问题的关注程度日益增加,各个国家对其最高残留限量要求也有所不同。我国国家标准GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》规定在食用植物油及油料作物中允许使用敌敌畏、甲基对硫磷等有机磷农药,禁止使用嘧啶磷、抑草磷等农药。对于我国已经禁止使用的部分有机磷农药,其他国家及组织对其制定了最高残留限量。比如韩国制定了嘧啶磷在花生中的最高残留限量,欧盟制定了灭蚜磷在芝麻籽、大豆等农作物中的最高残留限量。
植物油基质复杂,对其农药残留检测时需进行一定的样品前处理以减少基质干扰。现有前处理技术主要为固相萃取法、液液萃取法、凝胶渗透色谱法、分散固相萃取和QuEChERS[1-6]。这些前处理方式普遍存在溶剂消耗量大、分析时间长、成本高、对环境不友好等弊端。随着绿色化学理念的推广,2006年,REZAEE等[7]创造性发明了分散液液微萃取技术(dispersive liquid-liquid microextraction,DLLME)。该技术使用微量有机试剂就可实现对分析物的高效提取和富集,绿色环保、简单快捷、节约成本。目前,DLLME技术已被成功应用于邻苯二甲酸酯[8-9]、农药残留[10-13]、多环芳烃[14-15]以及食品添加剂[16]的测定。
农药残留常规前处理技术有气相色谱法、气相色谱-质谱法和液相色谱-串联质谱法[17-21]。气相色谱-质谱法和液相色谱-串联质谱法虽然定性定量准确,但存在仪器造价高、耗材昂贵等问题,在一般生产企业及基层实验室推广比较困难。气相色谱仪的配套设备价格低,普适性强,有利于食品质量安全监测的常规应用。
本研究拟结合DLLME新型前处理技术和气相色谱-火焰光度检测器(gas chromatography-flame photometric detector, GC-FPD)专一性的优势,建立测定植物油中有机磷农药残留的分析方法。该方法可以精确、快速地分析植物油中有机磷农药残留含量,对保障食用者的安全有着重要意义。
1 材料与方法
1.1 材料与试剂
敌敌畏、甲基对硫磷、嘧啶磷、灭蚜磷、乙拌磷、丙虫磷、灭菌磷、毒死蜱、抑草磷、三唑磷、硫丙磷(质量浓度均为100 mg/L),北京曼哈格生物科技有限公司;甲醇、正己烷、三氯甲烷、丙酮、甲苯、乙腈、二氯甲烷(dichloromethane, CH2Cl2)、1,1,2-三氯乙烷、N,N-二甲基甲酰胺(N, N-dimethylformamide,DMF)(均为色谱纯),德国Merck公司;氯化钠(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
GC-2030气相色谱仪配置火焰光度检测器系统,日本岛津公司;冷冻离心机,德国Sigma公司;涡旋混合器,德国IKA公司;Milli-Q去离子水制备器,美国Millipore公司;电子天平,美国塞多利斯科学仪器有限公司。
1.3 实验方法
1.3.1 标准溶液的配制
分别用刻度吸量管移取0.1 mL的11种有机磷农药标准品于同一10 mL容量瓶,用CH2Cl2定容至刻度。配制成质量浓度为1 mg/L的混合标准储备液,4 ℃保存。使用时根据实际工作稀释成不同浓度的混合工作标液。
1.3.2 样品前处理
1.3.2.1 样品提取
选取玉米油样品进行分析测定。称取样品1 g(精确至0.01 g),加入2 mL正己烷,涡旋2 min。加入2 mL DMF进行提取,涡旋2 min,将DMF层移入15 mL离心管中备用。
1.3.2.2 DLLME
将样品提取中的0.9 mL DMF提取液和260 μL CH2Cl2混合,加入到含有1 mL去离子水的15 mL离心管中。将离心管涡旋60 s,然后离心2 min(6 000 r/min),用微量注射器取出CH2Cl2层于进样瓶中,进行GC-FPD分析。
1.3.3 基质效应
称取空白样品,按1.3.2节前处理过程制备空白基质溶液。基质效应(matrix effects,ME)的计算如公式(1)所示。基质效应结果为负值、0、正值分别表示基质抑制效应、无基质效应、基质增强效应,且绝对值越大表明基质效应越强[22]。
(1)
1.3.4 色谱条件
色谱柱:DB-1(30 m×0.53 mm, 1.50 μm);柱流量:1.0 mL/min;进样量:1 μL;不分流进样;升温程序:起始温度为100 ℃,保持2 min,以6 ℃/min升至210 ℃,不保持,以5 ℃/min升至250 ℃,保持10 min;载气:氮气;进样口温度:250 ℃;检测器温度:300 ℃。
1.4 数据统计
实验结果采用Origin 9.0软件分析。
2 结果与分析
由于植物油样品脂肪含量高,基体干扰大,对有机磷农药残留检测必须除去干扰才能获得高的灵敏度和准确性。本文为了避免油脂对检测的干扰,先将样品中的目标物提取到有机试剂中,再结合DLLME来进一步净化分析。
2.1 样品提取条件优化
2.1.1 溶解试剂的选择
正己烷对油脂含量高的样品溶解度较大,本文选其作为溶解试剂。为了更好地溶解样品,需要对正己烷体积进行优化,研究了1~5 mL体积正己烷对提取效率的影响。结果表明,当选择正己烷体积为2 mL时,所有目标物的提取效率最高。
2.1.2 提取剂的选择
本研究样品提取步骤中的提取剂起到承上启下的作用,一方面从植物油中提取出目标物,另一方面作为下一步DLLME中的分散剂,所以它的选择尤为重要。提取试剂的选择有以下原则:a)对目标物有较强的提取能力;b)与目标物有良好的分离能力;c)能使DLLME中的萃取剂均匀分散在样品溶液中。综合考虑,本研究分别选取乙腈、DMF、丙酮和甲醇作为提取剂。结果表明(图1-a),当选用丙酮时,它能与正己烷混溶,无法分层;选择甲醇作为提取剂时,基线波动比较大,并且目标物回收率相对不高;选择DMF和乙腈作为提取剂时,基线都较稳定,DMF组目标物的回收率高于乙腈组,另外,DMF在DLLME步骤与萃取剂和水的混溶性更好,更易形成稳定的乳浊液体系,因此选择DMF作为样品提取步骤的提取试剂。

a-提取剂种类;b-提取剂体积
图1 样品提取步骤中提取剂对目标物回收率的影响
Fig.1 Effect of extractant on recovery of target substance in sample extraction step
为了研究DMF体积对提取结果的影响,分别使用不同体积(1、2、3、4 mL)的DMF进行提取实验。研究结果表明(图1-b),当DMF体积小于2 mL时,样品中有机磷农药的提取率随提取试剂体积的增大而逐渐增大,其原因为DMF体积太小时不能将有机磷农药充分提取。当DMF体积大于2 mL时,不同体积的DMF对提取效率的影响相差不大。选取DMF的提取体积为2 mL。
2.2 DLLME萃取条件的优化
2.2.1 萃取剂的选择
萃取剂需满足:a)对目标物有较强的萃取能力;b)不易溶于水;c)易溶于分散剂[23]。本研究分别选取甲苯、1,1,2-三氯乙烷、CH2Cl2、三氯甲烷作为萃取剂。研究表明(图2-a),CH2Cl2对有机磷农药的萃取效果最好,主要原因是CH2Cl2的极性较大,对极性相对较大的有机磷农药的选择性强,因此选择CH2Cl2为萃取剂。

a-萃取剂种类;b-萃取剂体积
图2 DLLME中萃取剂对回收率的影响
Fig.2 Effects of extraction solvent in the DLLME step
萃取剂体积直接决定了DLLME的萃取效率,研究了不同体积(60、100、140、180、220、260、280、300、320 μL)的CH2Cl2对有机磷农药的萃取效率。实验结果如图2-b所示,当CH2Cl2体积小于260 μL时,有机磷农药的回收率与CH2Cl2的体积成正相关,但当CH2Cl2体积逐渐增大到320 μL时,各分析物的回收率与其成负相关,因此CH2Cl2的体积选择260 μL。
2.2.2 分散剂的选择
由2.1.2节实验结果可知,DMF在样品提取步骤对目标物有较强的提取能力,在DLLME中又能使CH2Cl2在样品溶液中很好的分散。因此,选择DMF作为DLLME中的分散剂。
DMF体积决定了CH2Cl2在样品水溶液中的分散及萃取效率,在0.7~1.1 mL DMF内研究了DMF体积对萃取效率的影响。实验结果如图3所示,在0.7~0.9 mL时,萃取效率与DMF体积呈正相关,反映出CH2Cl2在样品水溶液中的分散性更好,更易形成均匀的小液滴,提取更充分;而在0.9~1.1 mL时,萃取效率与DMF体积呈负相关,这是因为当DMF体积过大时,有机磷农药可能在分散剂中的溶解度会增大,进而导致CH2Cl2的萃取效率降低。因此选择DMF体积为0.9 mL。
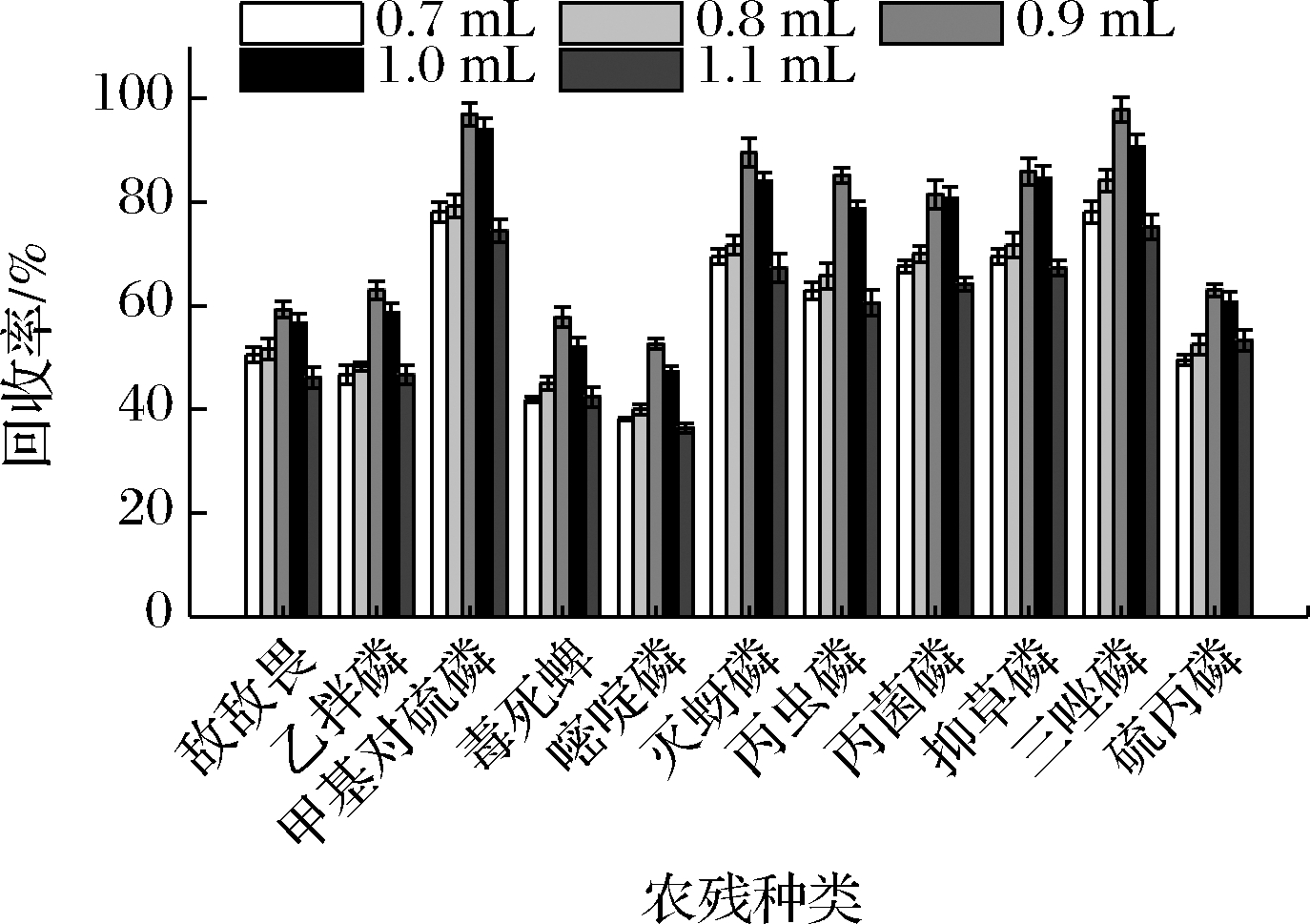
图3 DLLME中DMF体积对回收率的影响
Fig.3 Effect of the volume of DMF on the recovery of pesticides obtained from DLLME
2.2.3 盐效应的选择
由于离子强度作用,在提取溶液中加入适量的无机盐会有利于增大目标物在有机相中的溶解度。本研究考察了不同质量分数(0%、5%、10%、15%、20%)的氯化钠对有机磷农药萃取效率的影响。实验现象发现:随着氯化钠质量分数的增加,最后取出的萃取剂体积会逐渐增大,而且分散剂、水、萃取剂三者形成的浑浊体系也逐渐变澄清。结果表明,盐浓度的增大并不一定能增大目标物在有机相中的溶解度,有机磷农药的萃取效率与盐浓度呈负相关,原因可能是盐效应使目标物和萃取剂在水中的溶解度同时减小,使得萃取剂与水形成的小液滴减少,因此导致萃取效率降低[24]。另外,盐效应还有可能会增大水的黏度,不利于目标物在水中的传质[25]。综合以上原因,氯化钠对提高萃取效率无积极作用,因此选择不添加氯化钠。
2.3 方法学考察
2.3.1 线性范围、检出限和定量限
由表1中基质效应的结果可知,植物油基质会对实验的萃取回收率产生一定影响。为降低植物油基质对分析结果的干扰,用空白基质溶液将标准储备液稀释成系列标准工作溶液(质量浓度分别为0.01、0.02、0.10、0.20、0.50、1.00 μg/mL),按1.3.4节色谱分析条件进行测定。采用空白基质加标的方法,分别以信噪比为3和10得到方法的检出限(limits of detection,LOD)和定量限(limits of quantification,LOQ)[22]。结果如表1所示,在0.01~1.00 μg/mL内,所有目标物线性关系均良好,相关系数为0.999 1~0.999 7,表明所建立方法适合分析植物油中的11种有机磷农药残留。
表1 11种农药的线性范围、相关系数、方法检出限、定量限及基质效应
Table 1 Linear ranges, correlation coefficients, limits of detection, limits of quantification, and matrix effects for 11 pesticides
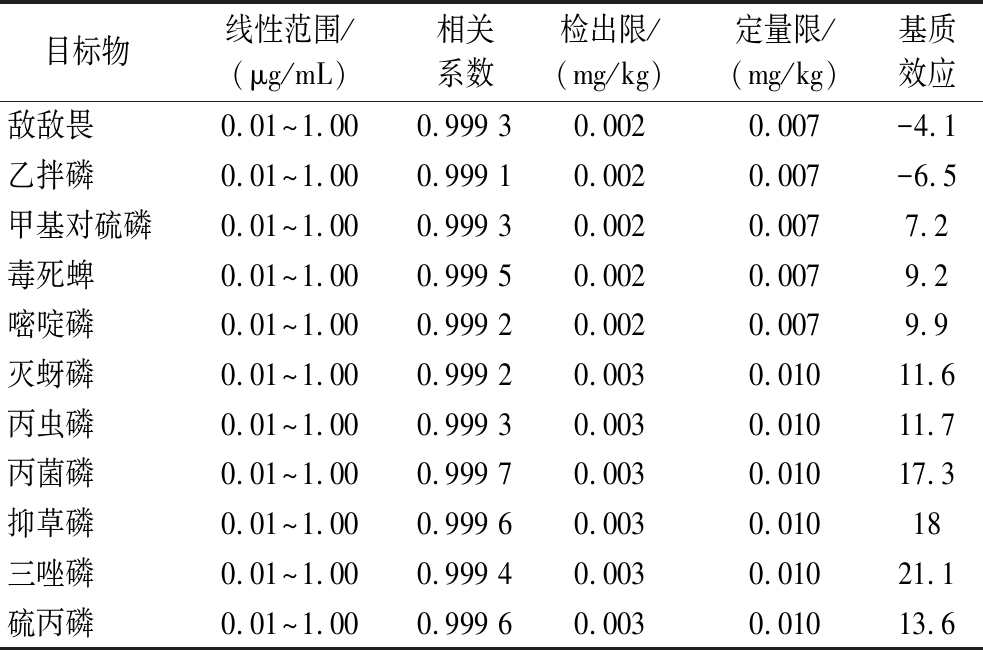
目标物线性范围/(μg/mL)相关系数检出限/(mg/kg)定量限/(mg/kg)基质效应敌敌畏0.01~1.000.999 30.0020.007-4.1乙拌磷0.01~1.000.999 10.0020.007-6.5甲基对硫磷0.01~1.000.999 30.0020.0077.2毒死蜱0.01~1.000.999 50.0020.0079.2嘧啶磷0.01~1.000.999 20.0020.0079.9灭蚜磷0.01~1.000.999 20.0030.01011.6丙虫磷0.01~1.000.999 30.0030.01011.7丙菌磷0.01~1.000.999 70.0030.01017.3抑草磷0.01~1.000.999 60.0030.01018三唑磷0.01~1.000.999 40.0030.01021.1硫丙磷0.01~1.000.999 60.0030.01013.6
2.3.2 方法准确度和精密度
在空白玉米油样品中添加目标物进行回收率实验,分别添加0.01、0.10、0.50 mg/kg 3个浓度水平,每个水平重复测定6次。结果如表2所示。11种有机磷农药的回收率为75.6%~116.2%,相对标准偏差(relative standard deviation,RSD)为1.6%~8.7%。
表2 方法的回收率和精密度 (n=6)
Table 2 Recoveries and RSDs for the developed method (n=6)

目标物0.01 mg/kg0.10 mg/kg0.50 mg/kg回收率/%RSD/% 回收率/%RSD/% 回收率/%RSD/% 敌敌畏81.64.386.63.187.32.0乙拌磷91.88.585.62.078.91.6甲基对硫磷115.36.1103.12.293.82.5毒死蜱81.33.785.82.386.82.3嘧啶磷76.04.876.02.275.62.5灭蚜磷113.87.2100.42.588.32.9丙虫磷84.08.775.62.476.13.2丙菌磷103.17.789.92.778.33.3抑草磷110.96.295.62.984.13.0三唑磷116.25.6100.13.786.74.2硫丙磷77.38.476.73.679.23.7
2.4 实际样品测定和方法验证
采用本实验建立的方法对17批植物油(玉米油、花生油、大豆油)实际样品进行分析测定,在所有样品中均未检出有机磷农药。花生油和大豆油中0.01 mg/kg和0.10 mg/kg浓度的回收率和RSD结果如表3 所示,回收率为78.2%~112.3%,相对标准偏差为1.8%~6.8%。结果表明,该方法对实际样品中有机磷农药的测定具有适用性和有效性,花生油空白基质和其加标的色谱图如图4。
表3 十一种有机磷农药在花生油和大豆油中的回收率和
相对标准偏差(n=3)
Table 3 Recoveries and RSDs of peanut oil and soybean oil spiked with 11 organophosphorus pesticides at different concentrations (n=3)

植物油目标物0.01 mg/kg0.10 mg/kg回收率/%RSD/%回收率/%RSD/%敌敌畏82.34.088.92.5乙拌磷87.22.190.51.8甲基对硫磷110.24.0102.32.2毒死蜱82.12.887.64.9嘧啶磷79.24.080.53.1花生油灭蚜磷110.36.1100.85.4丙虫磷85.34.987.22.1丙菌磷101.36.194.24.5抑草磷103.25.8106.25.6三唑磷104.24.6110.36.8硫丙磷78.92.680.23.7敌敌畏85.25.187.53.5乙拌磷89.23.491.34.2甲基对硫磷112.35.6107.36.8毒死蜱84.34.187.53.7嘧啶磷78.23.684.32.8大豆油灭蚜磷105.64.6103.24.0丙虫磷80.64.789.22.4丙菌磷104.34.8100.32.8抑草磷98.74.9104.36.4三唑磷105.23.6104.24.1硫丙磷79.24.782.43.9
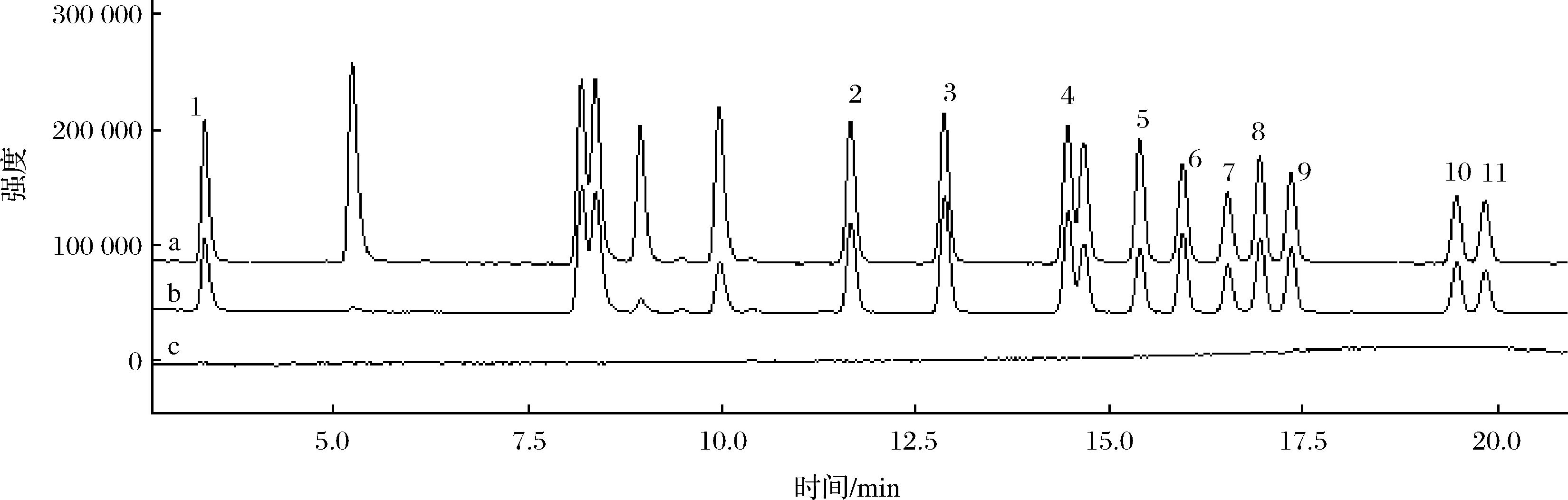
1-敌敌畏;2-乙拌磷;3-甲基对硫磷;4-毒死蜱;5-嘧啶磷;6-灭蚜磷;7-丙虫磷;8-丙菌磷;9-抑草磷;10-三唑磷;11-硫丙磷
a-质量浓度为0.02 μg/mL的混合标准溶液;b-加标水平为0.01 mg/kg空白花生油样品;c-空白花生油样品
图4 混合标准溶液、空白花生油样品及空白花生油样品的GC-FPD色谱图
Fig.4 Chromatograms of GC/FPD from mix standards, blank peanut oil spiked with mix standards and blank peanut oil
3 结论
本研究系统考察了前处理过程中样品提取条件和DLLME条件对回收率的影响,建立了分散液液微萃取技术与气相色谱-火焰光度检测器相结合测定植物油中11种有机磷农药残留的分析方法。该方法检测灵敏度和准确度较高,并且简单快捷、有机试剂用量低以及对环境绿色环保,有利于在基层实验室展开工作,为市场监管部门对植物油中有机磷等农药的快速监测分析提供技术支持。
[1] 颜鸿飞, 张帆, 陈练, 等.在线凝胶渗透色谱-三重四极杆气质联用法同时测定橄榄油中72种农药残留[J].食品安全质量检测学报, 2016, 7(1):166-176.
YAN H F, ZHANG F, CHEN L, et al.Determination of 72 pesticide residues in olive oil by online gel permeation chromatography gas chromatography-tandem mass spectrometry[J].Journal of Food Safety and Quality, 2016, 7(1):166-176.
[2] FANG Y, TIAN W, PEI F, et al.Simultaneous determination of pesticide residues and antioxidants in blended oil using a liquid-liquid extraction combined with dispersive solid phase extraction method[J].Food Chemistry, 2017, 229:347-353.
[3] 史晓梅, 陈士恒, 章晴, 等.分散固相萃取-气相色谱法快速测定食用植物油中66种农药残留[J].中国粮油学报, 2016, 31(7):132-137.
SHI X M, CHEN S H, ZHANG Q, et al.Rapid determination of 66 pesticides residues in edible vegetable oil by dispersive solid phase extraction method-gas chromatography[J].Journal of the Chinese Cereals and Oils Association, 2016, 31(7):132-137.
[4] MORENO-GONZ LEZ D, ALC
LEZ D, ALC NTARA-DUR
NTARA-DUR N J, ADDONA S M, et al.Multi-residue pesticide analysis in virgin olive oil by nanoflow liquid chromatography high resolution mass spectrometry[J].Journal of Chromatography A, 2018, 1562:27-35.
N J, ADDONA S M, et al.Multi-residue pesticide analysis in virgin olive oil by nanoflow liquid chromatography high resolution mass spectrometry[J].Journal of Chromatography A, 2018, 1562:27-35.
[5] CUI Y, KE R H, GAO W, et al.Analysis of organochlorine pesticide residues in various vegetable oils collected in Chinese markets[J].Journal of Agricultural and Food Chemistry, 2020, 68(49):14594-14602.
[6] 徐芷怡, 陈梦婷, 侯锡爱, 等.QuEChERS-高效液相色谱-串联质谱法同时测定芝麻油中7种农药残留[J].分析化学, 2020, 48(7):928-936.
XU Z Y,CHEN M T,HOU X A,et al.Simultaneous determination of seven pesticide residues in sesame oil using QuEChERS-high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry, 2020, 48(7):928-936.
[7] REZAEE M, ASSADI Y, MILANI HOSSEINI M R, et al.Determination of organic compounds in water using dispersive liquid-liquid microextraction[J].Journal of Chromatography A, 2006, 1116(1-2):1-9.
[8] ORTEGA-ZAMORA C, JIMÉNEZ-SKRZYPEK G, GONZ LEZ-S
LEZ-S LAMO J, et al.Extraction of phthalic acid esters from soft drinks and infusions by dispersive liquid-liquid microextraction based on the solidification of the floating organic drop using a menthol-based natural deep eutectic solvent[J].Journal of Chromatography A, 2021, 1646:46132.
LAMO J, et al.Extraction of phthalic acid esters from soft drinks and infusions by dispersive liquid-liquid microextraction based on the solidification of the floating organic drop using a menthol-based natural deep eutectic solvent[J].Journal of Chromatography A, 2021, 1646:46132.
[9] ORTEGA-ZAMORA C, GONZ LEZ-S
LEZ-S LAMO J, HERN
LAMO J, HERN NDEZ-S
NDEZ-S NCHEZ C, et al.Menthol-based deep eutectic solvent dispersive liquid-liquid microextraction:A simple and quick approach for the analysis of phthalic acid esters from water and beverage samples[J].ACS Sustainable Chemistry& Engineering, 2020, 8(23):8783-8794.
NCHEZ C, et al.Menthol-based deep eutectic solvent dispersive liquid-liquid microextraction:A simple and quick approach for the analysis of phthalic acid esters from water and beverage samples[J].ACS Sustainable Chemistry& Engineering, 2020, 8(23):8783-8794.
[10] FARAJZADEH M A, FAZLI N, PEZHHANFAR S, et al.Combination of a dispersive solid phase extraction method based on octadecylamine modified magnetic nanoparticles with dispersive liquid-liquid microextraction for the extraction and preconcentration of pesticides[J].Analytical Methods: Advancing Methods and Applications, 2022, 14(24):2376-2388.
[11] MARDANI A, AFSHAR MOGADDAM M R, FARAJZADEH M A, et al.A three-phase solvent extraction system combined with deep eutectic solvent-based dispersive liquid-liquid microextraction for extraction of some organochlorine pesticides in cocoa samples prior to gas chromatography with electron capture detection[J].Journal of Separation Science, 2020, 43(18):3674-3682.
[12] ABDALLAH O I, AHMED N S.Development of a vortex-assisted dispersive liquid-liquid microextraction (VA-DLLME) and LC-MS/MS procedure for simultaneous determination of fipronil and its metabolite fipronil sulfone in tomato fruits[J].Food Analytical Methods.2019, 12(10):2314-2325.
[13] 曹小云, 陈树干, 曾楚莹, 等.QuEChERS-分散液液微萃取/气相色谱-串联质谱法高通量快速检测蔬果中152种农药残留[J].分析测试学报, 2019, 38(8):920-930.
CAO X Y, CHEN S G, ZENG C Y, et al.High-throughput rapid detection of multi-pesticide residues in vegetables and fruits by gas chromatography-tandem mass spectrometry combined with QuEChERS-dispersed liquid-liquid microextraction[J].Journal of Instrumental Analysis, 2019, 38(8):775-778.
[14] ERCAN M S F, AYY LD
LD Z M F, YAZ
Z M F, YAZ C
C E, et al.Development and validation of dispersive liquid-liquid microextraction method for the determination of 15 polycyclic aromatic hydrocarbons in 200 Antarctica samples by gas chromatography mass spectrometry[J].Environmental Monitoring and Assessment, 2022, 194(5):1-12.
E, et al.Development and validation of dispersive liquid-liquid microextraction method for the determination of 15 polycyclic aromatic hydrocarbons in 200 Antarctica samples by gas chromatography mass spectrometry[J].Environmental Monitoring and Assessment, 2022, 194(5):1-12.
[15] CALDEIR O L, FERNANDES J O, GONZALEZ M H, et al.A novel dispersive liquid-liquid microextraction using a low density deep eutectic solvent-gas chromatography tandem mass spectrometry for the determination of polycyclic aromatic hydrocarbons in soft drinks[J].Journal of Chromatography A, 2021, 1 635:461736.
O L, FERNANDES J O, GONZALEZ M H, et al.A novel dispersive liquid-liquid microextraction using a low density deep eutectic solvent-gas chromatography tandem mass spectrometry for the determination of polycyclic aromatic hydrocarbons in soft drinks[J].Journal of Chromatography A, 2021, 1 635:461736.
[16] DING M Z, LIU W X, PENG J, et al.Simultaneous determination of seven preservatives in food by dispersive liquid-liquid microextraction coupled with gas chromatography-mass spectrometry[J].Food Chemistry, 2018, 269:187-192.
[17] 王晓春, 梁丽, 周焕英.基于QuEChERS净化/气相色谱法测定蔬菜及水果中16种有机氯农药残留[J].分析测试学报, 2021, 40(3):401-405.
WANG X C,LIANG L,ZHOU H Y.Determination of 16 organochlorine pesticides residues in vegetables and fruits by gas chromatography with QuEChERS purification[J].Journal of Instrumental Analysis, 2021, 40(3):401-405.
[18] 杨志敏, 常巧英, 李坚, 等.羟基多壁碳纳米管分散固相萃取/气相色谱-串联质谱法测定党参中75种农药残留[J].分析测试学报, 2022, 41(6):827-834.
YANG Z M,CHANG Q Y,LI J,et al.Determination of 75 pesticide residues in Codonopsis radix by gas chromatography-tandem mass spectrometry with dispersive solid phase extraction based on hydroxylated multi-walled carbon nanotubes[J].Journal of Instrumental Analysis, 2022, 41(6):827-834.
[19] 许芮菡, 谢倩文, 李旭军, 等.基于多壁碳纳米管改进QuEChERS法结合气相色谱-串联质谱检测茶叶中10种拟除虫菊酯类农药残留[J].色谱, 2022, 40(5):469-476.
XU R H,XIE Q W,LI X J,et al.Modified QuEChERS method based on multi-walled carbon nanotubes coupled with gas chromatography-tandem mass spectrometry for the detection of 10 pyrethroid pesticide residues in tea[J].Chinese Journal of Chromatography, 2022, 40(5):469-476.
[20] HIDALGO-RUIZ J L, ROMERO-GONZ LEZ R, MART
LEZ R, MART NEZ VIDAL J L, et al.Monitoring of polar pesticides and contaminants in edible oils and nuts by liquid chromatography-tandem mass spectrometry[J].Food Chemistry, 2021, 343:128495.
NEZ VIDAL J L, et al.Monitoring of polar pesticides and contaminants in edible oils and nuts by liquid chromatography-tandem mass spectrometry[J].Food Chemistry, 2021, 343:128495.
[21] 宋伟, 周典兵, 郭春丽, 等.磁性富勒烯分散固相萃取-液相色谱-串联质谱法测定菊花中农药残留[J].分析化学, 2021, 49(9):1587-1596.
SONG W,ZHOU D B,GUO C L,et al.Determination of multiresidue of pesticide in chrysanthemum by magnetic fullerene dispersive solid phase extraction with liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry, 2021, 49(9):1587-1596.
[22] 张艳侠, 赵慧男, 孙珊珊, 等.通过式SPE-UPLC-MS/MS测定植物油中的9种酚类抗氧化剂[J].食品科学, 2021, 42(10):322-329.
ZHANG Y X,ZHAO H N,SUN S S,et al.Simultaneous determination of nine phenolic antioxidants in vegetable oil by pass-through solid phase extraction cleanup and ultra-high performance liquid chromatography-tandem mass spectrometry[J].Food Science, 2021, 42(10):322-329.
[23] CUSTODIO-MENDOZA J A, AJA-MACAYA J, VALENTE I M, et al.Determination of malondialdehyde, acrolein and four other products of lipid peroxidation in edible oils by gas-diffusion microextraction combined with dispersive liquid-liquid microextraction[J].Journal of Chromatography A, 2020, 1627:461397.
[24] KHALILIAN F, REZAEE M.Ultrasound-assisted extraction followed by solid-phase extraction followed by dispersive liquid-liquid microextraction for the sensitive determination of diazinon and chlorpyrifos in rice[J].Food Analytical Methods, 2017, 10(4):885-891.
[25] 夏英, 张澜, 赵尔成, 等.分散固相萃取/分散液液微萃取-气相色谱法测定甘蓝中的拟除虫菊酯类农药残留[J].分析测试学报, 2014, 33(2):192-196.
XIA Y,ZHANG L,ZHAO E C,et al.Determination of pyrethroid residue in cabbage by gas chromatography combined with dispersive solid-phase extraction and dispersive liquid-liquid extraction[J].Journal of Instrumental Analysis, 2014, 33(2):192-196.