邻苯二甲酸酯(phthalic acid esters,PAEs)又称酞酸酯,主要作为增塑剂用于聚氯乙烯、聚乙烯等塑料制品的生产,以改进其可塑性和柔韧性[1]。研究表明PAEs是一种环境污染物,含有雌激素成分,可通过呼吸、饮食和皮肤接触等进入生物体内,严重影响生物体的生殖、发育行为[2]。此外,由于PAEs与聚合物之间是通过氢键和范德华力相连接,在塑料中呈游离状态,且属于脂溶性物质,因此在与油脂类物质接触时极易发生迁移[3]。我国是食用油消费大国,从销售市场来看,食用油的包装以塑料制品为主,存在PAEs从塑料包装转移至食用油中的风险[4],因此测定食用油中PAEs迁移含量对监控食用油等食品安全具有重要意义。
市场上,使用最广泛的PAEs类增塑剂主要为:邻苯二甲酸二正丁酯(dibutyl phthalate, DBP)、邻苯二甲酸二辛酯(dioctyl phthalate, DOP)、邻苯二甲酸丁苄酯(butyl benzyl phthalate, BBP)、邻苯二甲酸二乙酯(diethyl phthalate, DEP)和邻苯二甲酸二异丁酯(diisobutyl phthalate, DIBP)等[5]。目前PAEs的检测方法主要有:高效液相色谱法[6]、高效液相色谱-质谱联用法[7]、气相色谱-质谱联用法[8]、气相色谱法[9]等,存在方法操作复杂、运行成本高、测定及分析时间长等缺点[10],且许多有测定需求的企事业单位无法获得上述高端测试仪器,对于PAEs的分析检测存在局限,因此有必要探讨一种简易、快速且成本低廉的PAEs分光光度检测方法。通过实验得知,PAEs在紫外区190~300 nm内具有特征吸收光谱峰[11],且线性关系良好,可用于对PAEs进行测定分析。分光光度法设备投资小、分析过程简单可靠[12],但因一种塑料制品中通常添加有多种PAEs类增塑剂,以确保其产品性能,且PAEs结构相似测定时会产生相互干扰,普通分光光度法无法对其准确定性[11]。
为解决上述多组分相互干扰的问题,近年来研究者提出了许多用化学计量学方法代替普通化学分离来同时测定相互干扰组分的方法,如:偏最小二乘法(partial least-square, PLS)[13]、主成分分析(principal component analysis, PCA)[14]、主成分回归(principal components regression, PCR)[15]和多元线性回归分析(multiple linear regression, MLR)[16]等。其中,多元线性回归以数据降维为目的,根据历史实验数据的变化规律,探究多个自变量对计算结果的影响,寻找自变量与因变量之间的回归方程式,从而确定模型参数[16]。较PLS、PCA、PCR而言,MLR具有原理简单、准确性高、适用范围广等优点,能够克服组分间相互干扰的问题[17]。本文通过多元线性回归分析,结合线性拟合多个自变量和因变量的关系,从而确定回归模型的各个参数,建立可靠的预报模型[18]。目前,依据光具有加和性的特点把MLR与分光光度法结合的方法已被广泛用于多组分含量的同时测定中,但对于PAEs类增塑剂的同时测定未见报道。
本研究建立了MLR联合紫外-可见分光光度法,采用波段连续检测,结合有机溶剂溶解并提取、固相萃取柱净化等前处理方法,建立同时测定DBP、DOP、BBP 3种物质的模型A和同时测定DBP、DOP 2种物质的模型B两个模型,分别对应不同类型食用油样品及不同测定需求。该方法为实际食用油样品中PAEs的快速测定和筛查提供了可行的解决办法。
1 材料与方法
1.1 材料与试剂
DOP标准溶液(纯度≥98%)、DBP标准溶液(纯度≥98%)、BBP标准溶液(纯度≥98%)、甲醇、乙腈、正己烷、丙酮、二氯甲烷(均为色谱纯),上海阿拉丁化学试剂。实验用水为超纯水。
为避免实验过程中PAEs污染,实验均采用玻璃器皿。玻璃器皿使用前用丙酮浸泡12 h,200 ℃烘干,冷却备用。
1.2 仪器与设备
UV-2600i紫外-可见分光光度计,日本岛津公司;ME204E电子分析天平,梅特勒托利多科技(中国)有限公司;SPD-16高效液相色谱仪紫外-可见检测器、C18色谱柱,岛津仪器(苏州)有限公司;Silica/乙二胺-N-丙基硅烷(primary-secondary amine,PSA)玻璃混合型固相萃取柱(1.0 g/6 mL),北京恩加壹科技有限公司;USE-12S 12位手动固相萃取装置、UGC-12C 12位旋转式水浴氮吹仪,北京优晟联合科技有限公司;TD5M 多管架自动平衡离心机,上海卢湘仪离心机仪器有限公司。
1.3 实验方法
1.3.1 标准溶液配制
精密移取20 μL的DOP、DBP、BBP标准溶液至100 mL容量瓶中,用甲醇定容配成质量浓度为200 mg/L 的DBP、DOP、BBP标准溶液,置于4 ℃冰箱中保存备用。
1.3.2 MLR模型建立
PAEs预报模型A和PAEs预报模型B标准物质混合溶液浓度设置见表1。依据表格取适量DBP、DOP、BBP标准溶液置于50 mL容量瓶,以甲醇为溶剂配制一定浓度的标准溶液,充分混合均匀后,用1 cm比色皿,以试剂空白做参比,用紫外-可见分光光度计测定190~260 nm波长范围内的吸收光谱。将吸光度、波长等光谱数据导入MATLAB中,MLR基于Regress 函数软件包编程实现,预测混合溶液中各组分的含量。
表1 PAEs预报模型A、B标准物质混合溶液浓度配比
Table 1 Standard substance mixture concentration ratios of PAEs prediction model A and B
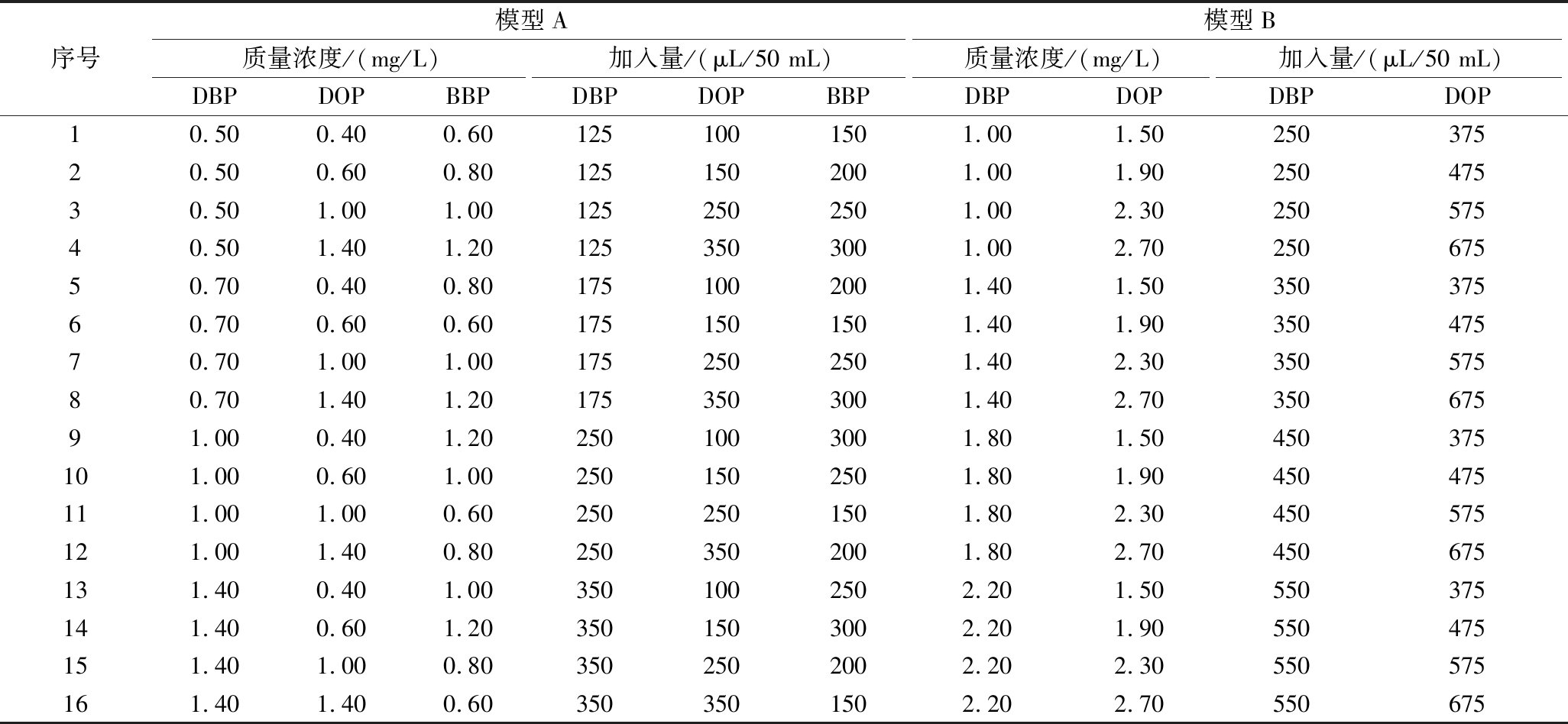
序号模型A模型B质量浓度/(mg/L)加入量/(μL/50 mL)质量浓度/(mg/L)加入量/(μL/50 mL)DBPDOPBBPDBPDOPBBPDBPDOPDBPDOP10.500.400.601251001501.001.5025037520.500.600.801251502001.001.9025047530.501.001.001252502501.002.3025057540.501.401.201253503001.002.7025067550.700.400.801751002001.401.5035037560.700.600.601751501501.401.9035047570.701.001.001752502501.402.3035057580.701.401.201753503001.402.7035067591.000.401.202501003001.801.50450375101.000.601.002501502501.801.90450475111.001.000.602502501501.802.30450575121.001.400.802503502001.802.70450675131.400.401.003501002502.201.50550375141.400.601.203501503002.201.90550475151.401.000.803502502002.202.30550575161.401.400.603503501502.202.70550675
1.3.3 标准工作模型实验方法
取适量DBP、DOP、BBP标准溶液置于50 mL容量瓶,以甲醇为溶剂配制一定浓度的标准溶液并充分混匀。后续步骤同1.3.2节。
1.3.4 实际样品实验方法
分别采集市场上销售的不同品牌和不同出厂日期的塑料桶装大豆油、花生油和菜籽油。准确称取20.00 g(精确到0.01 g),加入5 mL乙腈,涡旋3 min,超声提取10 min,3 500 r/min离心5 min,移取上层清液,重复上述提取步骤3次。合并3次提取的上清液待净化。
Silica/PSA固相萃取柱净化,活化:依次使用5 mL二氯甲烷、5 mL乙腈进行活化,弃去流出液;上样:将上述待净化液加入SPE柱,流速不超过1 mL/min,收集流出液;洗脱:加入5 mL乙腈,收集流出液。
合并2次流出液,加入1 mL丙酮,40 ℃氮吹至近干,甲醇准确定容至5 mL,用1 cm比色皿,紫外-可见分光光度计测定190~260 nm内的吸收光谱。空白实验用超纯水代替食用油样品,其他操作同上。将吸光度、波长等光谱数据导入MATLAB中,通过模型A或模型B预测实际样品中各组分的含量,MLR基于Regress 函数软件包编程实现。
2 结果与分析
2.1 MLR模型的建立方法及原理
2.1.1 待测PAEs物质的选择
根据资料收集可知[8,19-25],对不同类型食用油中PAEs检测发现,DBP、DOP、BBP、DEP、DIBP、邻苯二甲酸二甲酯(dimethyl phthalate,DMP)、邻苯二甲酸二正辛酯(di-n-octyl phthalate,DNOP)等物质均有不同程度的检出,每种物质的平均检出量见图1。其中以DBP、DOP、BBP概率最大,在不同种类食用油中的平均检出量分别为0.107~1.03、0.193~1.140、0.083~0.906 mg/kg,分别占总检出量的21.35%、28.59%、20.38%,因此选择DBP、DOP、BBP为目标待测物。
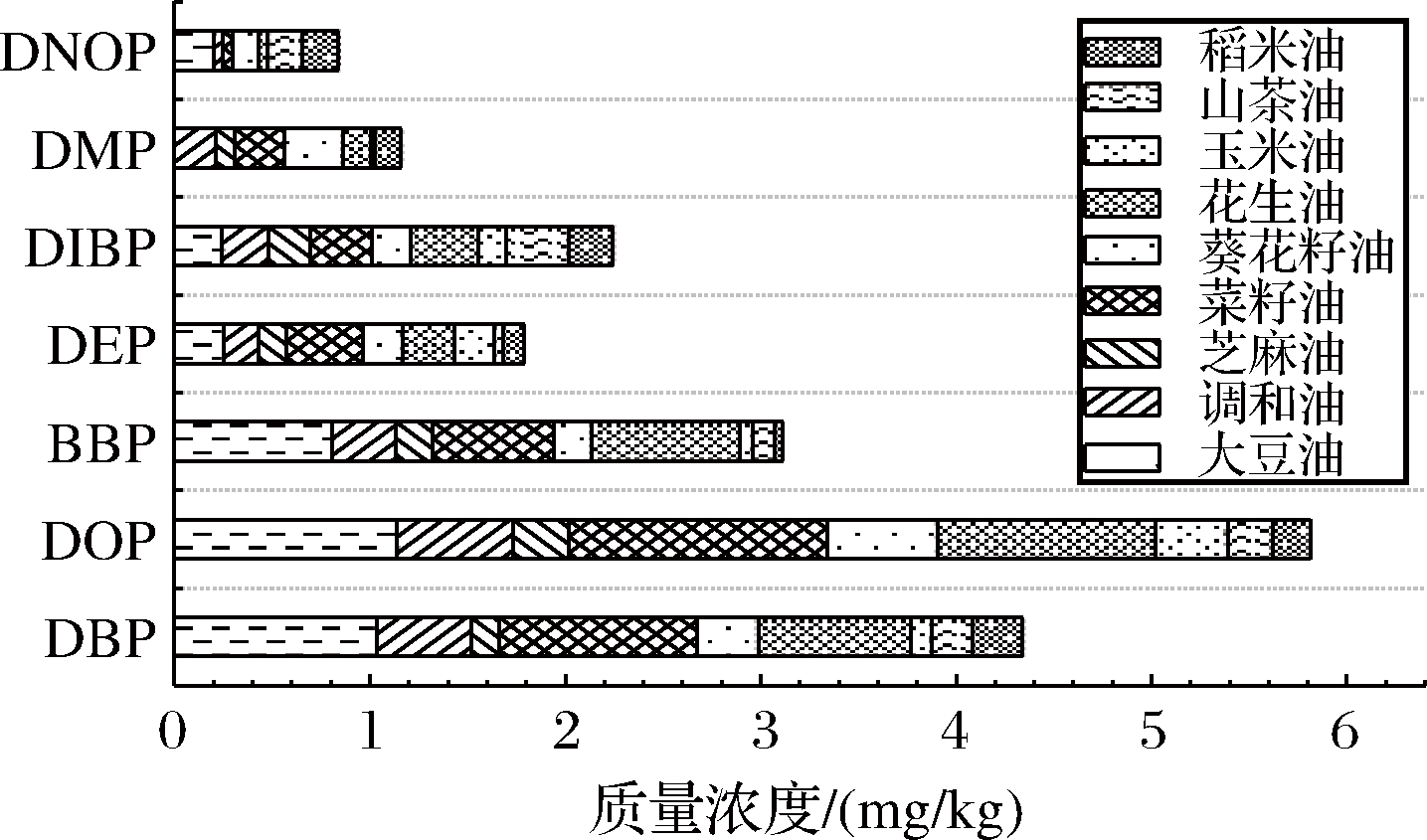
图1 不同种类食用油中PAEs的平均检出情况
Fig.1 Average detection of PAEs in different types of edible oils
2.1.2 标准曲线及其线性相关性
取适量1.3.1节部分标准溶液于10 mL容量瓶中,用甲醇定容配制成质量浓度为0.2、0.5、1.0、1.7、2.7 mg/L的系列标准溶液。在最大吸收波长处进行吸光度测定,得到标准曲线并计算出线性方程,如表2所示,在0.2~2.7 mg/L内,3种物质浓度与吸光度均呈现良好的线性关系,相关系数R2≥0.999。
表2 DBP、DOP和BBP标准曲线的回归方程及其线性相关性
Table 2 Regression equations of DBP, DOP, and BBP, standard curves and their linear correlations

PAEs波长/nm标准曲线检测范围/(mg/L)线性相关性DBP201y=0.118 1x-0.048 10.2~2.70.999 2DOP201y=0.197 9x-0.044 80.2~2.70.999 3BBP190y=0.313x+0.071 5 0.2~2.70.999 1
2.1.3 MLR模型PAEs物质混合体系浓度设置
由资料收集[8,19-25]得,DBP、DOP、BBP三种物质在食用油中的检出量分布情况见图2。由图2可知,DBP、DOP、BBP三种物质在食用油中的检出量分别集中于0.15~1.14、0.75~1.40、0.13~0.80 mg/kg。

图2 三种PAEs物质在食用油中的检出量分布
Fig.2 Distribution of three PAEs substances detected in edible oils
根据卫办监督函[2011]551号通告《卫生部办公厅关于通报食品及食品添加剂中邻苯二甲酸酯类物质最大残留量的函》规定,食品及食品添加剂中DBP和DOP的最大残留量分别为0.3 mg/kg和1.5 mg/kg。
因此,参考图2检出量分布及上述通告规定这2个因素设置预报模型中DBP、DOP、BBP 3种混合标准物质浓度配比(表1),用于测定市场上大多数食用油样品。
2.1.4 MLR-分光光度预报模型建立原理
依照本文1.3.2节部分,以试剂空白做参比,进行紫外-可见分光光度测定。通过MATLAB运行MLR程序自动进行计算,可利用溶液选定波段范围下的吸光度数据集合和混合溶液中目标物质的浓度已知参数求得回归方程中aw、bw、cw、dw等未知参数,得到回归方程组,从而建立同时测定溶液中DBP、DOP、BBP三种物质浓度的预报模型。
具体分析的流程为(以预报模型A为例):输入自变量X1、X2、X3(16组标准物质混合溶液DBP、DOP、BBP的浓度)、因变量QW(16组标准物质混合溶液在190~260 nm波段下16×71吸光度值矩阵)→通过回归方程,进行多元线性回归分析(71次),得到aw、bw、cw、dw等系数→得出回归方程组(71个)→建立预报模型→未知浓度溶液测定[17]。
所得回归方程(以模型A为例)如公式(1)所示:
awX1+bw X2 +cw X3 +dwW=Qw
(1)
式中:aw、bw、cw、dw为回归系数;Qw为W波长下的溶液吸光度。
当使用已建立的MLR模型测定未知浓度溶液时,只需要将该溶液在190~260 nm波段下吸光度数组输入至模型,即可得出溶液中目标污染物的浓度(通过拟合方程的相关性R2优化数据组,模型自动计算R2,并选择R2最高时的数据输出,作为测定结果)。由于数据量较大,故使用MATLAB软件运行程序实现自动计算。
2.2 实验条件的优化
2.2.1 提取试剂的选择
提取剂的选择对提取效率至关重要。合适的提取剂应具有与水不混溶、对分析物具有良好的提取效果、低毒性等特点[26]。据已有文献,PAEs测定可用正己烷、乙腈、二氯甲烷和甲醇等作为提取剂[20]。取某种经测定未检出PAEs化合物的食用油,向其中加入对应标准溶液,按照本文1.3.4节部分方法,分别采用正己烷、乙腈、二氯甲烷和甲醇作为提取剂,比较不同提取溶液对3种PAEs回收率的影响。由图3可知,当提取试剂为乙腈时,DBP、DOP、BBP的回收率均达到80%以上,提取效果较好。这可能是由于脂肪物在乙腈中的溶解度低,故实验过程中两者互溶和分离的效果均较好[27]。因此选择乙腈为食用油中PAEs的提取试剂。

图3 提取试剂对3种PAEs回收率的影响
Fig.3 Effect of extraction reagents on the recovery of three PAEs
2.2.2 提取次数的选择
根据分配定律,若不考虑其他因素如:溶液中被提取物剩余量、提取试剂使用总量等时,当提取试剂用量不变时,提取次数越多,效果越好[27]。取某种经测定未检出PAEs化合物的食用油,向其中加入对应标准溶液,按照本文1.3.4节部分方法,分别用5 mL乙腈提取1、2、3、4次,比较不同提取次数对3种PAEs回收率的影响。由图4可知,当提取次数为1时,3种PAEs的回收率均较低。提取第2次时,3种PAEs回收率均有较大提高,平均在79%左右。提取次数为3时,DBP、DOP、BBP的回收率均超过85%,且提取次数增加到4次时,3种物质的回收率基本不变,无明显提高。故综合考虑实验整体效率及试剂使用成本,选择提取次数为3次。
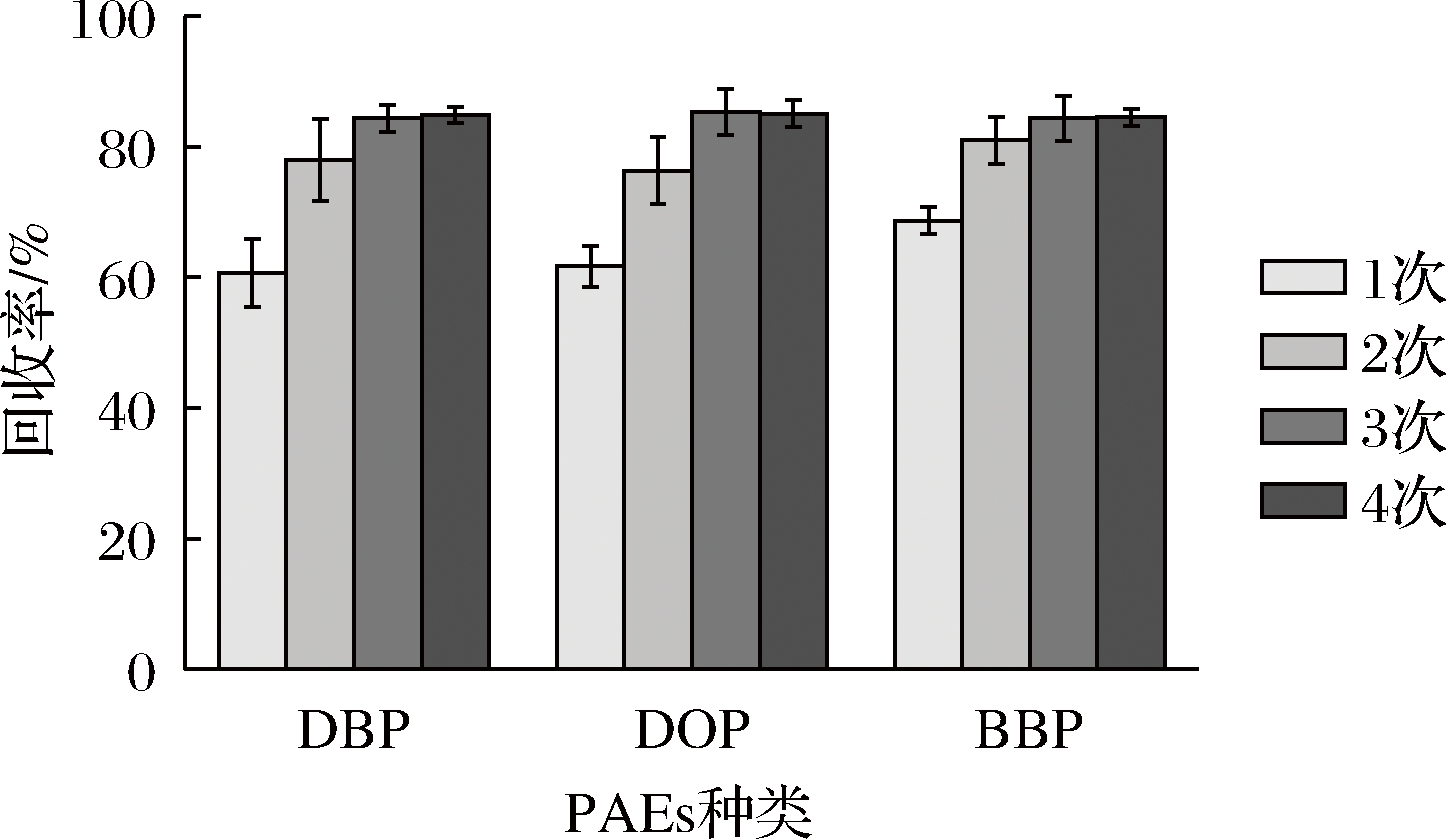
图4 提取次数对3种PAEs回收率的影响
Fig.4 Effect of number of extractions on the recovery of three PAEs
2.2.3 扫描波段的选择
为保证测试体系的灵敏度,选择入射波长时应依据吸收最大、干扰最小的原则[11]。本研究以试剂空白为参比溶液,在185~300 nm对DBP、DOP、BBP标准储备液进行光谱扫描,结果如图5所示。DBP、DOP、BBP的最大吸收波长分别为201、200、190 nm,波谱重叠严重,此时若使用常规分光光度法对混合体系中的这3种物质浓度单独测定时,必然会相互干扰而影响测定结果。此外,由图可知,在260 nm之后,DBP、DOP、BBP三物质波段变化趋势一致,无明显吸收,不宜作为MLR模型选择数据[16]。故本实验采用MLR-分光光度法对混合体系中的DBP、DOP、BBP 3种物质浓度进行同时测定,并选择190~260 nm作为测定波长范围。
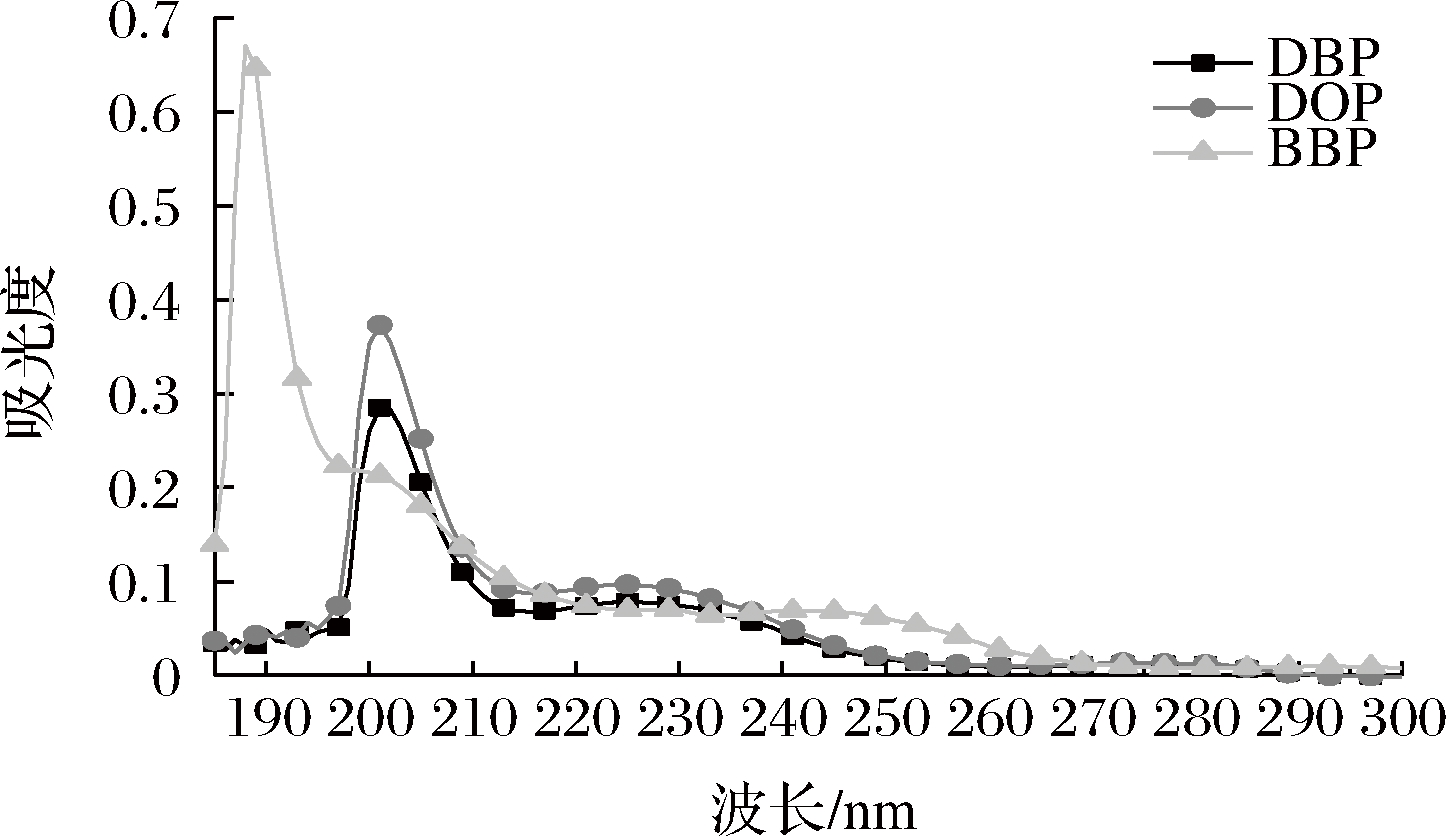
图5 DBP、DOP、BBP物质的吸收光谱
Fig.5 Absorption spectra of DBP, DOP, and BBP
注:图中DBP、DOP、BBP质量浓度均为1.0 mg/L,图上所示为扣除空白溶液的吸光度值。
2.3 方法评价
2.3.1 标准工作模型、方法定量限
按本文1.3.2节部分建立预报模型A、预报模型B,为了验证预报模型的准确性,随机配制含DBP、DOP、BBP或含DBP、DOP的混合溶液共16组(编号A1~A8、B1~B8),分别对应预报模型A与预报模型B。按照本文1.3.3节部分测定A1~A8、B1~B8混合溶液在190~260 nm波段下的吸光度,将所得的吸光度数据导入MATLAB中,并使用已调试好的模型A和模型B进行计算,得到浓度输出值,计算其回收率、相对误差(relative error, RE)和平均相对误差(mean relative error, MRE)。具体结果如表3、表4所示。该方法模型A中DBP、DOP、BBP 3种物质的定量限分别为:0.125、0.100、0.150 mg/kg,模型B中DBP、DOP的定量限分别为:0.250、0.375 mg/kg。
表3 预报模型A模拟试样分析预测
Table 3 Analysis and prediction of simulation sample of prediction model A

序号DBPDOPBBP加入量/(mg/L)检测量/(mg/L)回收率/%RE/%加入量/(mg/L)检测量/(mg/L)回收率/%RE/%加入量/(mg/L)检测量/(mg/L)回收率/%RE/%A10.6000.6321055.331.1001.21011010.000.7000.79211313.14A20.8500.76089-10.590.9500.91196-4.111.0000.92492-7.60A30.9000.9421054.670.8000.8361054.501.2001.10092-8.33A41.0500.99094-5.711.4001.37898-1.570.9000.99511110.56A51.1001.1641065.820.7500.68091-9.331.1001.02093-7.27A61.2501.20897-3.360.5500.49590-10.001.0500.89886-14.48A71.3001.3701055.381.3501.4001043.700.8500.82096-3.53A81.4001.4001000.001.2001.2911087.580.6500.72011110.77MRE/%5.116.359.46
表4 预报模型B模拟试样分析预测
Table 4 Analysis and prediction of simulation sample of prediction model B
序号DBPDOP加入量/(mg/L)检测量/(mg/L)回收率/%RE/%加入量/(mg/L)检测量/(mg/L)回收率/%RE/%A11.0001.11211111.201.5001.41594-5.67A21.2001.2201021.672.5002.5761033.04A31.3501.3891032.892.2502.20298-2.13A41.4501.33292-8.142.7002.61297-3.26A51.6001.54597-3.442.1002.2801098.57A61.8001.70895-5.111.8001.71495-4.78A71.9501.9701011.032.4002.28995-4.62A82.1002.1781043.711.9501.9971022.41MRE/%4.654.31
与模型A相比,模型B的MRE较小,为4.31%~4.65%,主要原因是两者待测物质的数量不同。预报模型的误差主要来源于2个方面:测定误差和模型误差[18]。首先测定误差方面:本研究的测定误差主要由前期实验操作引入,由于模型A测定3种物质,模型B测定2种物质,故与模型B相比,模型A具有较高的测定误差。其次模型误差方面:MLR数学模型误差受多种因素影响,如:自变量个数、数据相关性、样本总数等[19],由2.1.2节部分表2中DBP、DOP和BBP标准曲线可知,一定波长下,3种物质浓度与吸光度均具有较好的相关性。此外,当模型样品整体数量不变而减少自变量的个数时,会使体系噪声比重减小,增强模型通用能力、提高其准确度。同时,随着自变量个数的减少,回归平方和会减小,使得模型在运行过程中进行数据取舍时不易遗漏重要变量,确保其准确度[28]。因此,在模型A测定DBP、DOP、BBP 3种物质的基础上,舍去检出量相对较低的BBP可得到精度更高的模型B。
除准确度这点不同外,模型A同模型B还有其他方面的差异。例如,模型B较模型A的工作量更少。由于模型B只测定2种物质浓度,故在前期标准物质混合溶液配制和后期模型计算运行方面工作量均少于模型A,更不用需要大量实验和数据来优化模型时的中期参数调控阶段,因此,模型B简单、便捷的优点就更加明显。
虽然据调查[8,19-25]BBP是食用油中检出量排名第三的PAEs物质,但是在卫办监督函[2011]551号通告中,规定食品及食品添加剂中 DBP 和 DOP 的最大残留量分别为0.3 mg/kg和1.5 mg/kg,并未提及BBP的污染。反过来,BBP同多数PAEs相同,对生物体具有严重危害[24],故有些情况下(待测样品中大量含有、母婴用品/食品、儿童用品/食品)对BBP的检测是十分必要的。因此,模型A与模型B均有各自的明显优势,且可适用于不同的场合。
综合两模型在准确度、工作量等方面的差异,同时考虑到PAEs的测定需求,可得到模型A、B的推荐使用场合:模型A可能更多用于市面上销售的中低端食用油,理论上其含有PAEs种类和量较多,使用模型A可以让消费者对其消费产品有更加全面、清晰的认识,更好地保护消费者。而模型B则多适合一些高端食用油品的检测,因为这类食用油在生产、制造、销售等各方面都有完善的措施以减少PAEs危害的发生,调查显示[27],高端食用油中PAEs检出率很低。此时就可以选择使用模型B测定DBP和DOP的量,以确保其达到国家相关要求,同时简化实验步骤和缩短运算时间,提高样品测定速率。
2.3.2 回收率和精密度
对某一种经测定未检出PAEs化合物的食用油进行加标回收率实验,共设置8种添加水平,按本文1.3.4节部分进行6次平行实验,分别使用模型A、B测定其浓度。同时通过普通紫外-可见分光光度法对加标样品进行测定,样品按1.3.4节部分进行提取、净化、浓缩等预处理,并根据2.1.2节部分测定分析,结果见表5。模型A、B加标回收率和相对标准偏差(relative standard deviation,RSD),见表6。
表5 普通紫外-可见分光光度法加标试样测定结果(n=6)
Table 5 Results of ordinary UV-vis spectrophotometry spiked specimens (n=6)
序号DBPDOPBBP加入量/(mg/kg)检出量/(mg/kg)加入量/(mg/kg)检出量/(mg/kg)加入量/(mg/kg)检出量/(mg/kg)11.3002.7540.6603.0501.1002.14221.1002.2810.9202.4790.7002.09730.8002.6851.2003.1721.0402.25140.6502.0411.3502.4170.6301.83251.1002.3741.6002.766//61.5003.2261.9003.094//71.9003.0852.3003.822//82.1004.4982.6004.028//
注:“/”表示不在研究范围内,无需测定(下同)。
表6 预报模型A、B 加标试样预测结果分析(n=6)
Table 6 Analysis of prediction results of prediction models A and B spiked specimens (n=6)
序号模型加入量/(mg/kg)检出量/(mg/kg)回收率/%RSD/%DBPDOPBBPDBPDOPBBPDBPDOPBBPDBPDOPBBP11.3000.6601.1001.3400.6831.018103103934.793.866.632A1.1000.9200.7001.1400.8840.748104961074.665.136.4630.8001.2001.0400.8451.1301.114106941074.054.586.640.6501.3500.6300.6101.4090.699941041114.14.457.0951.1001.600/1.1211.648/102103/2.562.99/6B1.5001.900/1.4621.948/97103/2.892.22/71.9002.300/1.9252.342/101102/2.754.17/82.1002.600/1.9982.499/9596/3.993.33/
虽然普通紫外-可见分光光度法在相应的波长下对多种PAEs物质有吸收,且吸光度与浓度有较好的线性相关性(表2),但是如先前研究[11]所示,PAEs大多结构相似,最适吸收波长相近,测定时会相互干扰,故普通分光光度法不仅无法对其准确定性,且当样品中多种PAEs并存时,测定准确度会大幅下降(表5)。而在多元线性回归分析结合紫外-可见分光光度法测定中,对于模型A,其回收率分别为:DBP 94%~106%,DOP 94%~104%,BBP 93%~111%,RSD分别为:DBP 4.05%~4.79%,DOP 3.86%~5.13%,BBP 6.46%~7.09%;模型B的回收率分别为:DBP 95%~102%,DOP 96%~103%,RSD分别为DBP 2.56%~3.99%,DOP 2.22%~4.17%。
2.4 实际样品测试分析
按照步骤1.3.4节对实际食用油样品进行测定,经过模型A、B计算可分别得到样品中DBP、DOP、BBP三物质的含量,测定结果与高效液相色谱法比较,结果见表7、表8。
表7 模型A与高效液相色谱法测定结果比较(n=6)
Table 7 Comparison of model A and high performance liquid chromatography determination results (n=6)

序号DBPDOPBBPHPLC/(mg/kg)MLR/(mg/kg)回收率/%RSD/%HPLC/(mg/kg)MLR/(mg/kg)回收率/%RSD/%HPLC/(mg/kg)MLR/(mg/kg)回收率/%RSD/%10.7240.700972.880.8440.8621022.060.6300.594942.7620.5690.5871032.100.7880.8211042.910.4580.4771043.4630.7570.732973.480.9270.9491022.690.5880.555943.53
注:此处使用的高效液相色谱法参考自文献[6]色谱实验条件部分。
表8 模型B与高效液相色谱法测定结果比较(n=6)
Table 8 Comparison of model B and high performance liquid chromatography determination results (n=6)

序号DBPDOPHPLC/(mg/kg)MLR/(mg/kg)回收率/%RSD/%HPLC/(mg/kg)MLR/(mg/kg)回收率/%RSD/%10.7240.716992.520.8440.8551012.3820.5690.5731010.890.7880.7971011.6030.7570.746991.400.9270.912980.66
注:此处使用的高效液相色谱法参考自文献[6]色谱实验条件部分。
由表7、表8可知,MLR-分光光度法与高效液相色谱法测得样品中DBP、DOP、BBP的含量基本相近。同时,预报模型B对于油脂样品中PAEs的测定具有更高的准确性,RSD均不超过3%,但该模型只能测定DBP、DOP 2种物质,故适用于所含PAEs类增塑剂主要为DBP、DOP且对准确性要求较高的样品测定。预报模型A虽精度稍差于模型B,但其可同时测定DBP、DOP、BBP 3种物质,适用于同时含有DBP、DOP、BBP 3种增塑剂的样品测定。
3 结论
a)经乙腈提取后,过Silica/PSA玻璃混合型固相萃取小柱净化,采用多元线性回归方法建立的同时测定DBP、DOP、BBP 3种物质的模型A和测定DBP、DOP两种物质的模型B,结合紫外-可见分光光度法,同时测定食用油中邻苯二甲酸酯类物质。该方法简便、快速、成本低,适用于不具备液相、气相、气质联用等较高端仪器的实验室的样品PAEs测定。
b)预报模型A加标回收率为93%~111%,可同时预测DBP、DOP、BBP;预报模型B加标回收率在95%~103%,可同时预测DBP、DOP且准确度较高。方法检出限满足食用油中邻苯二甲酸酯类物质测试分析的相关要求。通过实验分析探讨得出,通过扩充前期实验和改变模型相关参数可用于测定其他种类邻苯二甲酸酯类物质。但预报模型的准确程度与待测物质数量、待测物质浓度范围和数据相关性等有关,故在建立模型时需同时考虑以上多个因素。
c)该方法操作方便,且具有一定准确性,可为实际食用油样品中DBP、DOP、BBP等PAEs的同时测定提供一种成本低廉、快速便捷的途径,为食用油中塑化剂的基层监管工作提供技术支持。
[1] ZHU Q Q, XU L Y, WANG W Y, et al.Occurrence, spatial distribution and ecological risk assessment of phthalate esters in water, soil and sediment from Yangtze River Delta, China[J].Science of the Total Environment, 2022, 806:150966.
[2] LI C, CHEN J Y, WANG J H, et al.Phthalate esters in soil, plastic film, and vegetable from greenhouse vegetable production bases in Beijing, China:Concentrations, sources, and risk assessment[J].Science of the Total Environment, 2016, 568:1037-1043.
[3] BRIDSON J H, GAUGLER E C, SMITH D A, et al.Leaching and extraction of additives from plastic pollution to inform environmental risk:A multidisciplinary review of analytical approaches[J].Journal of Hazardous Materials, 2021, 414:125571.
[4] PALUSELLI A, AMINOT Y, GALGANI F, et al.Occurrence of phthalate acid esters (PAEs) in the northwestern Mediterranean Sea and the Rhone River[J].Progress in Oceanography, 2018, 163:221-231.
[5] BILLINGS A, JONES K C, PEREIRA M G, et al.Plasticisers in the terrestrial environment:Sources, occurrence and fate[J].Environmental Chemistry, 2021, 18(3):111-130.
[6] YIN S, YANG Y, YANG D N, et al.Determination of 11 phthalate esters in beverages by magnetic solid-phase extraction combined with high-performance liquid chromatography[J].Journal of AOAC International, 2019, 102(5):1624-1631.
[7] SINHA P, ANSHU A K, TIWARI M, et al.Determination of PAEs in soil of municipal wards of Patna, India by microwave assisted extraction and LC-MS/MS[J].Soil &Sediment Contamination, 2019, 28(2):162-170.
[8] 刘笑笑, 张菁菁, 李晨曦, 等.低温微萃取-GCMS/MS联用技术检测食用油中20种持久性污染物[J].食品与发酵工业, 2020, 46(5):292-298.
LIU X X, ZHANG J J, LI C X, et al.Determination of 20 persistent pollutants in edible oil by freeze-degreasing- GCMS/MS[J].Food and Fermentation Industries, 2020, 46(5):292-298.
[9] NOTARDONATO I, PASSARELLA S, IANNONE A, et al.Comparison of two extraction procedures, SPE and DLLME, for determining plasticizer residues in hot drinks at vending machines[J].Processes, 2021, 9(9):1588.
[10] 王笑妍, 薛燕波, 者东梅, 等.邻苯二甲酸酯类增塑剂概况及法规标准现状[J].中国塑料, 2019, 33(6):95-105.
WANG X Y, XUE Y B, SHI D M, et al.Overview of phthalate plasticizers, current regulations and standards[J].China Plastics, 2019, 33(6):95-105.
[11] MOLLAHOSSEINI A, ELYASI Y, RASTEGARI M.Flat membrane-based electromembrane extraction coupled with UV-visible spectrophotometry for the determination of diethylhexyl phthalate in water samples[J].Microchemical Journal, 2019, 151:104191.
[12] DEHGHANI MOHAMMAD ABADI M, ASHRAF N, CHAMSAZ M, et al.An overview of liquid phase microextraction approaches combined with UV-Vis spectrophotometry[J].Talanta, 2012, 99:1-12.
[13] AI N, JIANG Y B, OMAR S, et al.Rapid measurement of cellulose, hemicellulose, and lignin content in Sargassum horneri by near-infrared spectroscopy and characteristic variables selection methods[J].Molecules, 2022, 27(2):335.
[14] PHAM T T, NGUYEN T H, THI T V, et al.Investigation of chitosan nanoparticles loaded with protocatechuic acid (PCA) for the resistance of Pyricularia oryzae fungus against rice blast[J].Polymers, 2019, 11(1):177.
[15] SAAD A S, HAMDY A M, SALAMA F M, et al.Enhancing prediction power of chemometric models through manipulation of the fed spectrophotometric data:A comparative study[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2016, 167:12-18.
[16] XU Y, WU Y H, WU J F, et al.Multiwavelength regression algorithm for eliminating chamber surface effects of microfluidic chips[J].Applied Spectroscopy, 2019, 73(1):40-46.
[17] DE CARVALHO T C L, NUNES C A.Smartphone-based method for the determination of chlorophyll and carotenoid contents in olive and avocado oils:An approach with calibration transfer[J].Journal of Food Composition and Analysis, 2021, 104:104164.
[18] SHARMA V, KUMAR R.Dating of ballpoint pen writing inks via spectroscopic and multiple linear regression analysis:A novel approach[J].Microchemical Journal, 2017, 134:104-113.
[19] K RALAN S S, TOPTANC
RALAN S S, TOPTANC
![]() ÖNCÜL ABAC
ÖNCÜL ABAC GIL T, et al.Phthalates levels in olive oils and olive pomace oils marketed in Turkey[J].Food Additives and Contaminants.Part A,Chemistry, Analysis, Control, Exposure &Risk Assessment, 2020, 37(8):1332-1338.
GIL T, et al.Phthalates levels in olive oils and olive pomace oils marketed in Turkey[J].Food Additives and Contaminants.Part A,Chemistry, Analysis, Control, Exposure &Risk Assessment, 2020, 37(8):1332-1338.
[20] HARUNARASHID N Z I H, LIM L H, HARUNSANI M H.Phthalate sample preparation methods and analysis in food and food packaging:A review[J].Food Analytical Methods, 2017, 10(12):3790-3814.
[21] 吴雪. 同位素稀释气相色谱-质谱法测定食用油中的增塑剂[D].北京:北京化工大学, 2018.
WU X.Determination of plasticizers in edible oils by isotope dilution gas chromatography-mass spectrometry[D].Beijing:Beijing University of Chemical Technology, 2018.
[22] HE F, TIAN Y X, XU Z L, et al.Development of an immunochromatographic assay as a screen for detection of total phthalate acid esters in cooking oil[J].Journal of Toxicology and Environmental Health.Part A, 2018, 81(4):80-88.
[23] 易守福, 李莎, 陈同强, 等.食品包装材料中邻苯二甲酸酯的迁移规律研究[J].食品安全质量检测学报, 2017, 8(2):500-505.
YI S F, LI S, CHEN T Q, et al.Migration of phthalate esters in food packaging materials[J].Journal of Food Safety and Quality, 2017, 8(2):500-505.
[24] HUANG L, ZHU X Z, ZHOU S X, et al.Phthalic acid esters:Natural sources and biological activities[J].Toxins, 2021, 13(7):495.
[25] JI J M, LIU Y L, WANG D M.Comparison of de-skin pretreatment and oil extraction on aflatoxins, phthalate esters, and polycyclic aromatic hydrocarbons in peanut oil[J].Food Control, 2020, 118:107365.
[26] TSENG W C, CHEN P S, HUANG S D.Optimization of two different dispersive liquid-liquid microextraction methods followed by gas chromatography-mass spectrometry determination for polycyclic aromatic hydrocarbons (PAHs) analysis in water[J].Talanta, 2014, 120:425-432.
[27] SHI L K, ZHENG L, LIU R J, et al.Quantification of polycyclic aromatic hydrocarbons and phthalic acid esters in deodorizer distillates obtained from soybean, rapeseed, corn and rice bran oils[J].Food Chemistry, 2019, 275:206-213.
[28] LONGO R, DAMBERGS R G, WESTMORE H, et al.A feasibility study on monitoring total phenolic content in sparkling wine press juice fractions using a new in-line system and predictive models[J].Food Control, 2021, 123:106810.