硝基呋喃是一类具有明显杀菌消毒作用的广谱抗生素药物,广泛用于畜禽和养殖水产品的卫生消毒处理[1]。呋喃西林 (nitrofurazon, NFZ) 是硝基呋喃的一种,其在动物体内代谢迅速,主要代谢物氨基脲 (semicarbazide, SEM) 与动物体内的蛋白质结合后形成稳定的化合物长时间存在于体内,具有潜在的致畸、致癌和致突变性[2-3]。欧盟于1995年禁止NFZ用于动物源食品[4],随后中国、日本、美国等国家发布相同禁令,中国于2003年公布动物源性食品中SEM的最大残留量是1.0 μg/kg,一些国家残留限量是0.5 μg/kg[5-6]。水产品养殖过程中NFZ的违规使用通常通过检测SEM来确定。研究发现,甲壳类水产品中SEM的检出不仅是外源物质NFZ的代谢产生,还与加工过程及甲壳类水产品自身某些内源性物质有关[7-8]。2003年,SAARI等[9]在野生克氏原螯虾 (Procambarus clarkii) 中检测到SEM的存在,最高检测量达12 μg/kg,首次提出甲壳类水生动物内源产生SEM这一观点。MCCRACKEN等[10]对孟加拉国野生淡水明虾 (Macrobrachium agwi) 研究发现,不同水域虾体中SEM普遍存在,并且虾壳中的SEM检出量是虾肉中SEM检出量的几十倍不等,这与VAN等[11]、王鼎南等[12]、倪永付等[13]检测结果一致。彭婕等[14]在中华绒螯蟹 (Eriocheir sinensis) 脱壳后新长出的软壳中检测到了SEM而蟹肉中未检出SEM,推测水生动物甲壳可能是其内源性SEM的主要来源。甲壳类水产品中内源性SEM的存在得到了大量研究的证实,但其生成机理缺乏直接有效的科学实验依据。
近年来研究发现中华绒螯蟹(E.sinensis) 蟹壳中的内源性SEM的残留水平与蟹壳中的蛋白质含量及水解氨基酸组成有关[15]。同时有学者研究发现甲壳类水产品在高温下更容易生成SEM,温度的高低与SEM的检出量成正比关系[16]。深入探讨甲壳类水产品中SEM的检出与结合氨基酸的关系发现,精氨酸酶可将精氨酸水解为鸟氨酸和尿素进入尿素循环,而尿素和SEM在结构上有一定的相似性。NOONAN等[17]证实甲壳类水产品中含量最丰富的氨基酸是精氨酸。对此YU等[18]在凡纳滨对虾 (Lito penaeus vannamei Boone) 生长期间对参与尿素循环的相关物质含量进行检测后认为虾体内的精氨酸等物质通过尿素循环最终形成SEM。
为了进一步研究甲壳类水产品中内源性SEM的生成机理,本研究以罗氏沼虾为研究对象,采用高效液相色谱质谱联用,研究温度对罗氏沼虾SEM检出的影响。根据罗氏沼虾蛋白质及水解氨基酸等相关因素的分布规律,验证精氨酸对罗氏沼虾内源SEM生成的相关性,这对今后研究甲壳类水产品中内源SEM的生成机理具有重要研究意义。
1 材料与方法
1.1 材料与试剂
罗氏沼虾成虾采自广东肇庆养殖基地,在整个养殖期间未曾添加NFZ药物,采集一定数量后用便携冰箱运回实验室-80 ℃超低温冷冻保存。样品分析前自然解冻,将去除头部组织(包括头胸甲)的罗氏沼虾虾壳和虾肉分离,分别准确称取虾壳和虾肉样品2.00 g(精确到0.01 g)冻干处理48 h;分别准确称取虾壳和虾肉样品2.00 g(精确到0.01 g)于50、70、100、130、200 ℃下恒温48 h烘干处理,每次处理做3个平行,再用微型粉碎机粉碎(虾肉60 s;虾壳120 s)。
氨基脲标准品(SEM)、氨基脲内标(SEM-15N2-13C),上海安谱璀世标准技术服务有限公司;甲醇、乙腈、正己烷和乙酸乙酯(质谱纯),广州化学试剂厂;2-硝基苯甲醛、二甲基亚砜、磷酸氢二钾、氢氧化钠和盐酸(分析纯),广州化学试剂厂;实验用水为MiliQ超纯水。
1.2 仪器与设备
TQ-S-MICEO高效液相色谱质谱联用,美国Waters公司;BS 224S电子天平,德国赛多利斯公司;DZF6050真空干燥箱,上海精宏仪器有限公司;TDZ5-WS台式低速离心机,长沙湘仪仪器有限公司;Alpha1-4冷冻干燥机,德国Christ公司;3K30台式高速冷冻离心机,德国Sigma公司;THZ-82水浴恒温振荡器,金坛市精达仪器制造厂;N-EVAP24氮吹仪,美国Organomation公司。
1.3 实验方法
1.3.1 罗氏沼虾SEM的测定[19]
1.3.1.1 样品前处理
将粉碎后的样品小心完整的移至50 mL离心管中,分别加入100 ng/mL内标工作液0.1 mL,0.05 mol/L 2-硝基苯甲醛溶液0.2 mL,虾肉样品中加入0.2 mol/L盐酸溶液5 mL,虾壳样品中加入0.2 mol/L盐酸溶液10 mL,涡旋15 min,在37 ℃、转速200 r/min的恒温水浴振荡器,避光衍生16 h。
衍生后的样品冷却至室温,加2~3 mL磷酸氢二钾溶液,调pH至中性,加6 mL乙酸乙酯,涡旋15 min,4 200 r/min离心15 min,取上清液于10 mL离心管,重复提取操作1次,合并上清液,水浴40 ℃氮气吹干。加0.1%甲酸水-乙腈1.5 mL复溶,正己烷1.5 mL除脂,涡旋10 min,10 000 r/min离心15 min,取下清液过0.22 μm滤膜,待测。
1.3.1.2 仪器工作条件[20]
a)色谱条件
色谱柱:ACQUITY UPLC®BEH C18(50 mm×2.1 mm×1.7 μm)反相色谱柱;流动相:A为0.1%甲酸水+5 mmol/L甲酸铵溶液(质谱纯),B为乙腈(质谱纯);进样量:5.0 μL;柱温:35 ℃;流速:0.35 mL/min;梯度洗脱程序见表1。
表1 液相色谱梯度洗脱条件
Table 1 Program of gradient elution
时间/min流速/(mL/min)A/%B/%0.00.39552.00.39557.00.360409.00.360409.60.395511.00.3955
b)质谱条件
离子源:电喷雾电离正离子 (electrospray ionization positive ion, ESI+) 模式扫描;扫描方式:多反应监测 (multiple-reaction monitoring, MRM) 模式;喷雾电压:3 500 V;毛细管电压:1 000 V;离子源温度:120 ℃;去溶剂温度:600 ℃;去溶剂气流:氮气,流速1 000 L/h;锥孔气流:氮气,流速为50 L/h。母离子、子离子、锥孔电压、碰撞能量见表2。SEM衍生物总离子流图及质谱图见图1。
A-总离子流图;B-质谱图
图1 SEM衍生物总离子流图及质谱图
Fig.1 SEM derivative total ion current and mass spectra
表2 呋喃西林代谢物及其内标的质谱条件
Table 2 NFZ metabolites and their internal target mass spectrometry conditions

被测物母离子(m/z)子离子(m/z)DP/VCE/VSEM209.1166.1∗249192.12410SEM-15N2-13C212.1168.1249
注:*表示定量离子。
1.3.2 罗氏沼虾蛋白质的测定
为研究不同处理方式下罗氏沼虾蛋白质分解对SEM的检出影响,采用考马斯亮蓝法 (Bradford法) 对罗氏沼虾虾壳和虾肉进行蛋白质检测[16,21]。
1.3.3 罗氏沼虾SEM生成相关性验证实验
本实验于室内养殖缸进行,在整个实验期间,水位和溶解氧保持恒定。罗氏沼虾虾苗从广州当地养殖场获得,在前期生长过程中未曾添加NFZ药物,须足完整,活泼好动,育龄1月左右。实验前于养殖缸内暂养1周左右以适应环境。正式实验开始前,对水体和饲料均进行SEM的检测。
选择平均个体质量为(10.0±2.0) g,体长(5±1) cm的罗氏沼虾放入养殖缸中,随机分组,养殖密度约为30尾/m3。饲料中精氨酸添加量分别为0、10、30、50 g/kg。按每天喂养100 mg/kg的剂量早晚各投喂1次。分别于第0、10、20、30、40天取罗氏沼虾虾壳和虾肉部位,按1.3.1节检测罗氏沼虾虾壳和虾肉中的SEM含量。
2 结果与分析
2.1 不同处理方式对罗氏沼虾SEM检出量的影响
按1.1节方法制备样品,按1.3.1节方法确认样品中的SEM检出量。检出情况见表3和图3。实验结果 (表3和图3) 显示,未处理的罗氏沼虾原虾与不同处理方式下的虾壳和虾肉中恒有SEM检出,虾壳中的SEM检出量明显高于虾肉中的SEM检出量(P<0.05),且检出量均大于1.0 μg/kg。在保证相同质量和相同实验操作条件下,冻干处理的虾壳和虾肉中的SEM检出与未处理原虾虾壳和虾肉中的SEM检出量无明显差异(P>0.05),这说明温度对罗氏沼虾SEM检出量的影响并非是因为水分浓缩而引起的。与未经处理的原虾对比,随着烘干温度的升高,虾壳和虾肉中的SEM检出量均不断上升,其中虾壳70 ℃和100 ℃,100 ℃和130 ℃烘干条件下的SEM检出量存在显著性差异(P<0.05),而50 ℃与70 ℃差异不显著(P>0.05),虾肉50 ℃与70 ℃, 70 ℃和100 ℃,100 ℃和130 ℃烘干条件下的SEM检出量存在显著性差异(P<0.05),而原虾与50 ℃差异不显著(P>0.05),这与CAO等[22]结论相似,因此在对水产品进行SEM检测时应尽可能地将温度控制在50 ℃以下,以免对实验结果造成误差。
表3 不同处理方式下样品中SEM的检出量 单位:μg/kg
Table 3 The detected amount of SEM in samples under different treatment methods

样品不同处理方式冻干原虾50 ℃70 ℃100 ℃130 ℃200 ℃虾壳11.07±0.52a11.45±0.84a27.81±2.19b29.03±3.16b49.15±3.25c54.55±2.78dND虾肉1.68±0.22a1.54±0.09a2.01±0.27a2.58±0.38b11.28±0.79c13.47±0.89dND
注:同一行上标字母不同者表示差异显著(P<0.05);ND表示未检出(下同)。
研究发现,SEM是离子型化合物,在高温状态下有一定的热分解性,热分解过程是连续进行的,总共包括1个吸热过程和3个放热过程。SEM在166~178 ℃开始第一步热分解,因此随着加热温度达到200 ℃,SEM的分子结构已经不完整[23],在液质检测过程中未呈现相应峰形,如图2所示。由图3可以看

图2 200 ℃处理下SEM及其内标总离子流图
Fig.2 SEM and internal standard total ion current diagram under 200 ℃ treatment

图3 不同处理方式下SEM的检出量
Fig.3 The detected amount of SEM in samples under different treatment methods
注:不同不写字母表示差异显著(P<0.05)(下同)。
出,烘干温度的高低对罗氏沼虾虾壳和虾肉中的SEM检出量有显著影响,总体表现为随着烘干温度的升高,虾壳和虾肉中的SEM检出量逐渐上升,相比于虾肉,虾壳中的SEM检出量基数更大,因此虾壳SEM检出量受温度影响更大。
2.2 不同处理方式对罗氏沼虾蛋白质含量的影响
采用Bradford 法对罗氏沼虾虾壳和虾肉中所含蛋白进行定量检测分析,用系列浓度蛋白绘制蛋白质标准曲线,得到的回归曲线方程为y=0.053 1x+0.016, R2=0.992 9 (图4)。研究发现不同处理方式对罗氏沼虾虾壳和虾肉的蛋白质含量影响不同,在保证相同质量和相同实验操作条件下,冻干处理的虾壳和虾肉中的蛋白质含量与未处理原虾虾壳和虾肉中的SEM检出量无明显差异 (P>0.05),与未经处理的原虾对比,随着加工温度的升高,虾壳和虾肉中的蛋白含量逐渐下降,不同加工温度下的蛋白含量存在显著性差异 (P<0.05),具体结果见表4和图5。将同一处理方式的罗氏沼虾不同部位中蛋白质含量与其SEM检出量比较,发现蛋白质含量最高的虾壳和虾肉中SEM检出量最低,而蛋白质含量相对较低的虾壳和虾肉中SEM检出量却相对较高。以SEM检出量和蛋白质含量绘制曲线,如图5所示,曲线相关系数为负值(P<0.05),说明蛋白质含量与SEM检出浓度呈相反趋势,这表明罗氏沼虾虾壳和虾肉中SEM的生成与其蛋白质的含量也可能相关,样品中蛋白质含量越高,其SEM检出量越低。
图4 蛋白质标准曲线
Fig.4 Protein standard curve
A-罗氏沼虾虾壳,B-罗氏沼虾虾肉
图5 罗氏沼虾不同组织中SEM检出量与蛋白质
含量相关性分析
Fig.5 Correlation analysis of semicarbazide concentration and protein content in different tissues of M.rosenbergii
表4不同处理方式下样品中蛋白含量
Table 4 Protein content in samples under different treatments

不同处理方式虾壳蛋白含量/%虾肉蛋白含量/%冻干1.147±0.069a18.286±0.034a原虾1.276±0.031a19.741±0.028a50 ℃0.195±0.016a18.461±0.049a70 ℃0.151±0.024b15.741±0.208a100 ℃0.127±0.056c10.572±0.421b130 ℃0.097±0.016c0.207±0.125c200 ℃NDND
2.3 精氨酸对罗氏沼虾中SEM检出量的影响
通过上述实验证明,罗氏沼虾SEM的检出与温度变化显著相关,结合相关研究,温度的改变引起的蛋白质变化是影响SEM检出变化的主要因素。氨基酸是蛋白质的基本构成单位,蛋白质通过各种酶的联合作用分解成氨基酸。另有研究证明,SEM的生成与氨基酸组成有关,SEM是由含氮物质 (如精氨酸、组氨酸、瓜氨酸和肌酐) 与酰胺或尿素反应形成[24-25]。对上述研究与结论,本实验精氨酸对罗氏沼虾内源SEM生成的影响见图6。如图6所示,随着养殖时间的延长,罗氏沼虾虾壳内的SEM检出量呈现先上升后下降的趋势,而虾肉中的SEM检出量无明显变化趋势。这可能是由于罗氏沼虾初期摄入优质蛋白饲料后迅速进入成长期,虾壳中的SEM检出量随着虾体的生长也随之升高,随着虾体的生长进入频繁的蜕壳期,虾体不断蜕壳致使虾壳中的SEM难以完整富集,SEM检出量随之下降。罗氏沼虾虾肉在整个养殖期间恒有SEM检出,并且随着养殖时间的延长,虾肉中的SEM检出量无显著差异 (P>0.05)。由图6可以看出,随着饲料中摄入精氨酸的含量增加,罗氏沼虾虾壳和虾肉中SEM的检出量也随之增加,不同含量精氨酸饲料喂养的罗氏沼虾虾壳和虾肉中SEM检出量存在显著性差异 (P<0.05)。将不同生长时期的罗氏沼虾不同组织的SEM检出量与摄入的精氨酸含量做相关性分析,以SEM检出量和精氨酸含量绘制曲线,结果见图7。由图7可以看出,精氨酸含量与SEM检出量呈正相关,这表明罗氏沼虾虾壳和虾肉中SEM的生成与其摄入的精氨酸含量相关,精氨酸能促进罗氏沼虾体内SEM的生成,样品中精氨酸含量越高,其SEM检出量越高。

图6 精氨酸对罗氏沼虾内源SEM检出量的影响
Fig.6 Effect of arginine on endogenous SEM detection of Macrobrachium rosenbergii
注:大写不同字母表示不同含量的精氨酸对罗氏沼虾内源SEM检出差异显著(P<0.05);小写不同字母表示养殖时间对罗氏沼虾内源SEM检出差异显著(P<0.05)。
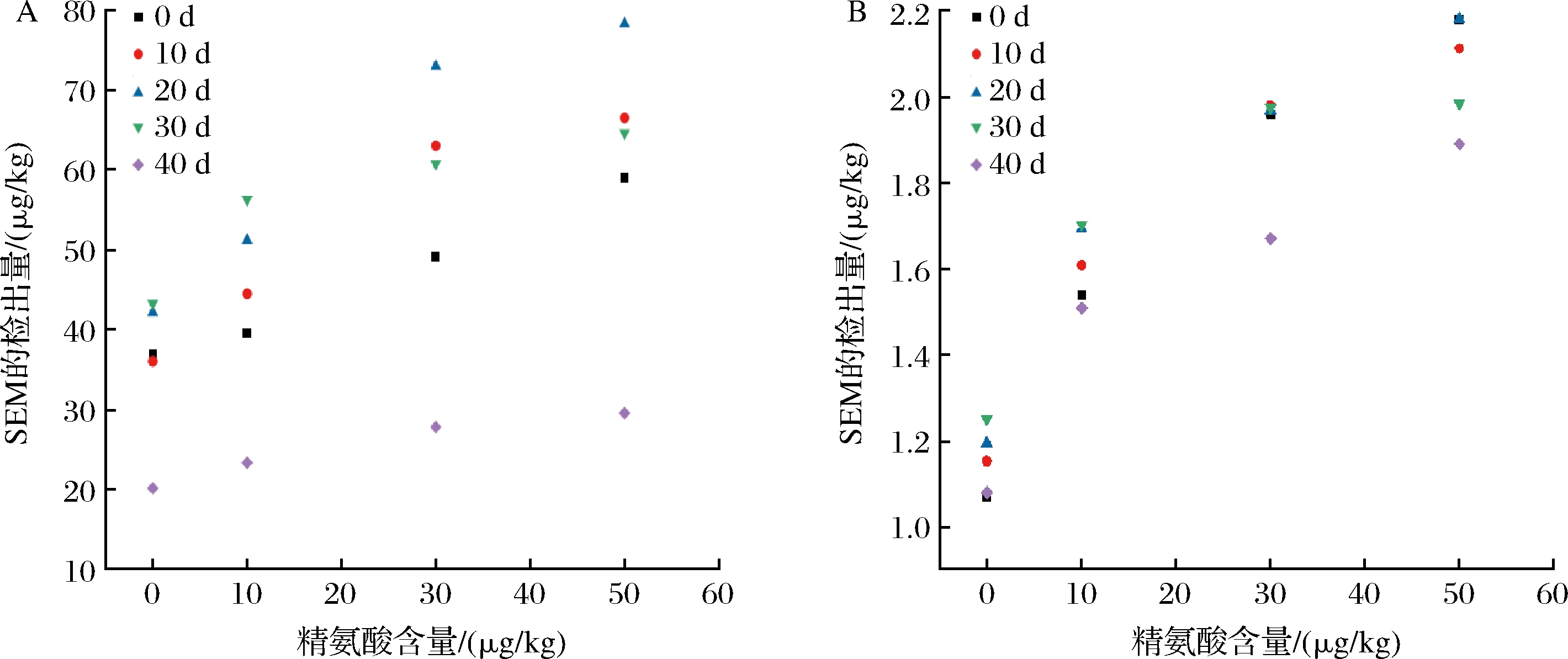
A-罗氏沼虾虾壳,B-罗氏沼虾虾肉
图7 不同生长期罗氏沼虾不同组织中SEM检出量与精氨酸含量的相关性分析
Fig.7 Correlation analysis between SEM detection amount and arginine content in different tissues of M.rosenbergii in different growth stages
3 结论与讨论
本实验通过对不同处理方式下的罗氏沼虾的虾壳和虾肉中的SEM进行检测,得出随着烘干温度的升高,罗氏沼虾虾壳和虾肉中的蛋白质含量逐渐降低,而虾壳和虾肉中的SEM检出量却随之升高,这说明烘干温度对罗氏沼虾内源性SEM的生成有促进作用,在对罗氏沼虾等甲壳类水产品进行NFZ的检测时,应尽可能避免虾壳等甲壳物质混入其中,同时避免检测温度高于50 ℃。通过对罗氏沼虾虾壳和虾肉中氨基酸的分析,本实验通过室内人工喂养精氨酸混合饲料的方式探索罗氏沼虾内源性SEM生成的可能影响因素。实验结果发现,随着养殖时间的延长,罗氏沼虾虾壳内的SEM呈现先升高后降低的趋势,虾肉中的SEM检出量无明显变化趋势。摄入不同含量精氨酸的罗氏沼虾,虾壳和虾肉SEM检出量分别存在显著性差异 (P<0.05),这说明精氨酸能够促进罗氏沼虾内源性SEM的生成。
[1] PEREIRA A S, PAMPANA L C, DONATO J L, et al.Analysis of nitrofuran metabolic residues in salt by liquid chromatography-tandem mass spectrometry[J].Analytica Chimica Acta, 2004, 514(1):9-13.
[2] FERNANDO R, MUNASINGHE D M S, GUNASENA A R C, et al.Determination of nitrofuran metabolites in shrimp muscle by liquid chromatography-photo diode array detection[J].Food Control, 2017, 72:300-305.
[3] STADLER R H, VERZEGNASSI L, SEEFELDER W, et al.Why semicarbazide (SEM) is not an appropriate marker for the usage of nitrofurazone on agricultural animals[J].Food Additives and Contaminants:Part A, 2015, 32(11):1842-1850.
[4] ABERNETHY G A.Generation of semicarbazide from natural azine development in foods, followed by reaction with urea compounds[J].Food Additives &Contaminants:Part A, 2015, 32(9):1416-1430.
[5] 丁春燕. 青虾中硝基呋喃代谢物残留的检测研究[D].杭州:浙江工业大学, 2019.
DING C Y.Study on the detection of nitrofuran metabolite residues in green shrimps[D].Hangzhou:Zhejiang University of Technology, 2019.
[6] 丁军伟, 邓建朝, 杨贤庆, 等.4种硝基呋喃类代谢物在青石斑鱼肌肉中的富集与消除规律[J].南方水产科学, 2018, 14(1):60-67.
DING J W, DENG J C, YANG X Q, et al.Accumulation and elimination of four nitrofuran metabolites in muscle of grouper(Epinephelus awoara)[J].South China Fisheries Science, 2018, 14(1):60-67.
[7] 张晓燕, 张睿, 陈雷, 等.甲壳类水产品中氨基脲的来源分析[J].食品研究与开发, 2013, 34(13):125-127.
ZHANG X Y, ZHANG R, CHEN L, et al.Analysis to the occurrence of semicarbazide in shellfish[J].Food Research and Development, 2013, 34(13):125-127.
[8] 李春风, 康海宁, 岳振峰, 等.食品中氨基脲来源的研究进展[J].中国兽医杂志, 2010, 46(2):88-89.
LI C F, KANG H N, YUE Z F, et al.Research progress on the source of semicarbazide in food[J].Chinese Journal of Veterinary Medicine, 2010, 46(2):88-89.
[9] SAARI L, PELTONEN K.Novel source of semicarbazide:Levels of semicarbazide in cooked crayfish samples determined by LC/MS/MS[J].Food Additives and Contaminants, 2004, 21(9):825-832.
[10] MCCRACKEN R, HANNA B, ENNIS D, et al.The occurrence of semicarbazide in the meat and shell of Bangladeshi fresh-water shrimp[J].Food Chemistry, 2013, 136(3-4):1562-1567.
[11] VAN POUCKE C, DETAVERNIER C, WILLE M, et al.Investigation into the possible natural occurence of semicarbazide in Macrobrachium rosenbergii prawns[J].Journal of Agricultural and Food Chemistry, 2011, 59(5):2107-2112.
[12] 王鼎南, 周凡, 李诗言, 等.甲壳类水产品中呋喃西林代谢物氨基脲的本底调查及来源分析[J].中国渔业质量与标准, 2016, 6(6):6-11.
WANG D N, ZHOU F, LI S Y, et al.Background value survey and source analysis of semicarbazide in shellfish[J]. Chinese Fishery Quality and Standards, 2016, 6(6):6-11.
[13] 倪永付, 朱莉萍, 王勇, 等.微山湖小青虾各部分呋喃西林代谢物含量测定[J].食品与发酵科技, 2012, 48(1):86-88.
NI Y F, ZHU L P, WANG Y, et al.Determination of nitrofurazone metabolite in every part of Weishan Lake shrimp[J].Food and Fermentation Technology, 2012, 48(1):86-88
[14] 彭婕, 吕磊, 喻亚丽, 等.中华绒螯蟹中内源性氨基脲的产生途径研究[J].淡水渔业, 2019, 49(3):108-112.
PENG J, LYU L, YU Y L, et al.Study on the formation approach of endogenous semicarbazide in Eriocheir sinensis[J].Freshwater Fisheries, 2019, 49(3):108-112.
[15] 彭婕, 甘金华, 陈建武, 等.中华绒螯蟹中氨基脲的分布及产生机理分析[J].淡水渔业, 2015, 45(4):108-112.
PENG J, GAN J H, CHEN J W, et al.Distribution and formation mechanism of semicarbazide in Ericocheir sinensis[J].Freshwater Fisheries, 2015, 45(4):108-112.
[16] 曹爱玲, 陈怡琳, 蔡路昀, 等.不同烘干温度对甲壳类水产品中氨基脲检出量的影响[J].中国动物检疫, 2020, 37(1):94-99.
CAO A L, CHEN Y L, CAI L Y, et al.The Effects of different drying temperatures on the detectable amount of semicarbazide in crustacean aquatic products[J].China Animal Health Inspection, 2020, 37(1):94-99.
[17] NOONAN G O, BEGLEY T H, DIACHENKO G W.Semicarbazide formation in flour and bread[J].Journal of Agricultural and Food Chemistry, 2008, 56(6):2064-2067.
[18] YU W L, LIU W H, TIAN W R, et al.Semicarbazide universality study and its speculated formation pathway[J].Journal of Food Safety, 2019, 39(1):e12591.
[19] 范清涛, 邓建朝, 张宾, 等.养殖虾类中呋喃西林代谢物检测方法的优化[J].食品与发酵工业, 2021, 47(16):233-238.
FAN Q T, DENG J C, ZHANG B, et al.Optimization of the detection method of furacillin metabolite residue in farmed shrimp[J].Food and Fermentation Industries, 2021, 47(16):233-238.
[20] 范清涛. 养殖虾类中氨基脲的检测方法与来源研究[D].舟山:浙江海洋大学, 2021.
FAN Q T.Study on detection method and source of semicarbazide in cultured shrimp[D].Zhoushan:Zhejiang Ocean University, 2021.
[21] 张品, 余顺波, 朱文秀, 等.紫苏饼粕分离蛋白中蛋白质含量测定方法比较[J].粮食与油脂, 2021, 34(11):150-154.
ZHANG P, YU S B, ZHU W X, et al.Comparison of methods for determining protein content in perilla meal protein isolate[J].Cereals &Oils, 2021, 34(11):150-154.
[22] CAO A L, CHEN Y L, NI Z, et al.Production mechanism of semicarbazide from protein in chinese softshell turtles at different drying temperatures based on TMT-tagged quantitative proteomics[J].Journal of Food Composition and Analysis, 2021, 99: 103872.
[23] 马桂霞, 张同来, 张建国, 等.盐酸氨基脲的分子结构及热分解特性[J].火炸药学报, 2003, 26(2):58-61.
MA G X, ZHANG T L, ZHANG J G, et al.Molecular structure and thermal decomposition mechanism of semicarbazide hydrochloride[J].Chinese Journal of Explosives &Propellants, 2003, 26(2):58-61.
[24] HOENICKE K, GATERMANN R, HARTIG L, et al.Formation of semicarbazide (SEM) in food by hypochlorite treatment: Is SEM a specific marker for nitrofurazone abuse?[J].Food Additives and Contaminants, 2004, 21(6):526-537.
[25] 谢冬冬, 万志刚, 沈金灿, 等.不同鸡组织经次氯酸钠处理后氨基脲生成量差异研究[J].食品安全质量检测学报, 2014, 5(11):3394-3399.
XIE D D, WAN Z G, SHEN J C, et al.Study on semicarbazide content difference from different organizations chicken generated by sodium hypochlorite[J].Journal of Food Safety &Quality, 2014, 5(11):3394-3399.