有机磷农药是指磷酸酯或是硫代磷酸脂化合物,依照结构可分为磷酸酯、亚膦酸酯和磷酰胺及其相应的硫代衍生物[1]。有机磷农药可与乙酰胆碱酯酶(acetylcholinesterase, AChE)结合,生成磷酰化胆碱酯酶而无法水解乙酰胆碱,使得体内乙酰胆碱蓄积,导致胆碱能神经和部分中枢神经的过度兴奋,从而产生中毒症状[2]。有机磷农药的持续使用导致了环境和食品的污染,严重影响了人类健康。目前,用于食品中有机磷农药残留的检测方法包括毛细管电泳法、胶体金法、酶联免疫吸附法、色谱法、分光光度法和比色法[3]等,然而这些方法都存在一定的局限性,如操作步骤复杂、成本高、难以实现快速检测、酶试剂易失活、结果不稳定以及重复性较差等缺点。针对上述问题,一些检测食品中有机磷农药残留的新方法被开发,其中电化学传感器由于其检测速度快、成本低、灵敏度高而备受关注。

图1 电化学传感器检测有机磷农药
Fig.1 Electrochemical sensors detect organophosphorus pesticides
可将电化学传感器分为2个部分,分别是识别元件和信号转换元件,利用电化学分析,一般以电极作为信号转换器,以电势或者电流为表现信号对目标物质进行检测。检测有机磷农药常用的识别元件包括以下三类:1)以生物材料作为识别元件,例如AChE、有机磷水解酶(organophosphorus hydrolase, OPH)、核酸适配体、微生物、抗体等;2)以有机物为识别元件,如分子印迹聚合物(molecularly imprinted polymers, MIP)和肟类化合物等;3)以无机物为识别元件,如CuO、ZrO2、TiO2等。
1 电化学生物传感器
1.1 电化学酶传感器
电化学酶传感器是以酶为识别元件的电化学传感器,根据酶的不同作用,又可将电化学酶传感器抑制型和催化型。
电化学抑制酶传感器的识别元件大多采用 AChE或丁酰胆碱酯酶(butyrylcholinesterase,BChE),底物为乙酰胆碱(acetylcholine,ACh),AChE或BChE可以催化ACh,加入有机磷农药后,有机磷农药与AChE或BChE结合,从而抑制ACh的催化反应。检测原理如下:将AChE或BChE固定在玻碳电极上,AChE或BChE可以将ACh催化生成电活性物质,产生电信号,加入有机磷农药后,有机磷农药的磷酸基团会和AChE或BChE发生共价结合,使AChE或BChE的催化能力降低,导致催化ACh生成的电活性物质减少,电信号会随之变化,如图2-a所示。

a-AChE为识别元件;b-OPH或产OPH微生物为识别元件;c-抗体为识别元件
图2 电化学生物传感器检测有机磷农药的原理
Fig.2 Principles of electrochemical biosensors to detect organophosphorus pesticides
GONG等[4]在修饰了Au-PPy交错的网络状纳米材料上负载了AChE用于甲基对硫磷的检测,该传感器具有良好的再现性,且检出限为2 ng/mL。VIGNESH等[5]在AChE为识别元件的基础上加以改善放大电信号的材料,修饰碳纳米管并采用戊二醛交联AChE包裹的牛血清蛋白纳米复合材料对甲基对硫磷进行检测,得到更低的检出限:3.75×10-11 mol/ L(0.099 ng/mL)。
此外,以AChE为识别元件的传感器还可用来检测久效磷、毒死蜱、甲基对硫磷、倍硫磷等有机磷农药,均呈现较低的检出限及较高的准确性[6-9]。以AChE作为识别元件制备的电化学传感器材料易得,成本较低,但特异性较差,研究发现, AChE的活性也受氨基甲酸酯类农药的影响,因此电化学AChE传感器用于食品中时,会导致检测有机磷农药残留的结果偏大。
电化学催化酶传感器以OPH为识别元件,对食品中有机磷农药残留进行检测。OPH能识别有机磷农药中的结构,包括P—O、P—S、P—F、P—CN [10],使有机磷农药水解成硝基苯酚,硝基苯酚的电化学活性可以表现出电信号的变化,如图2-b所示。基于以上原理进行了大量研究,如PEDROSA等[11]成功制备以OPH为识别元件的电化学传感器对含有P—O的对氧磷进行检测。除此之外,DEO等[12]以碳纳米管修饰电极并负载OPH,对对氧磷和含有P—S的甲基对硫磷进行检测。
对氧磷和甲基对硫磷是分别含有P—O和P—S的有机磷农药,OPH可催化这2种有机磷农药水解,生成电活性物质,从而使电信号发生变化。电化学OPH传感器只针对上述的结构有机磷农药,具有良好的特异性,但OPH来自特定的微生物,目前还不能扩大生产。
电化学复合酶传感器的识别元件是采用2种及2种以上的酶。除了上述的AChE和OPH单独作为识别元件,也可以采用复合酶作为识别元件,SAHIN等[13]研究出一种以OPH和辣根过氧化物酶作为识别元件的电化学传感器, OPH能够水解有机磷农药生成酚类物质,酚类物质的水解产物可作为电子转移的介质,在辣根过氧化物酶电极上得到电信号,将该传感器用于二氯倍硫磷的检测,检测效果良好。目前,电化学复合酶传感器开发较少,对比单一酶作为识别元件的电化学传感器,2种或2种以上复合酶传感器的检出限并未大幅度降低,针对电化学复合酶传感器还需要进一步研究。以酶作为识别元件的电化学传感器存在一些问题,如酶不易保存,在贮藏过程易出现酶活下降的现象,且放大电信号的材料需进一步筛选,重金属材料会导致酶变失活等,对电化学酶传感器的进一步研究还需解决上述问题。
1.2 电化学免疫传感器
以抗原/抗体为识别元件的电化学传感器称为电化学免疫传感器。将抗原/抗体修饰到电极上,分别用于检测抗体/抗原,利用抗原抗体的特殊反应,以电信号的形式表现,实现对目标物的检测,如图2-c所示。因为抗原抗体的免疫免疫反应具有特异性,电化学免疫传感器只需利用不同的抗原或抗体,就可以实现对不同有机磷农药的检测,并得到较好的检测专一性。如LIU等[14]以对氧磷半抗原为识别元件,采用竞争法对对氧磷进行检测,将该电化学免疫传感器用于湖水、农田水、自来水和纯净水中对氧磷残留的检测,都得到较好的回收率。同时MEHTA等[15]采用抗对硫磷抗体为识别元件,实现对对硫磷的特异性检测。
但抗原/抗体大多为蛋白质,易受温度、pH值、介质环境等因素影响而导致其生物活性降低,需要特别考虑其储藏稳定性。有研究表明通过改善贮藏条件及采用交联剂处理,可以延长抗原/抗体识别元件的电化学稳定性,如MEHTA等[16]将所制备的电化学传感器放置于4 ℃的冰箱中,50 d后传感器的输出信号减少小于5%;YIN等[17]采用交联剂保护抗体的生物活性,使传感器在9周后仍保留原来信号的85%。电化学免疫传感器特异性好、灵敏度,但其核心识别元件抗原抗体的获取困难,因此将电化学免疫传感器扩大生产,还需解决抗原抗体的获取问题。
1.3 电化学核酸适配体传感器
核酸适配体是10~50个单链脱氧核糖核酸或核糖核酸通过指数富集(SELEX),由配体的系统进化产生,它们能够以高亲和力特异性结合各种分析物,进而特异性折叠成三维结构,核酸适配体可以形成广泛的结构基序,包括发夹、茎、凸起、G-四链体和假结,通过疏水和范德瓦尔斯相互作用、氢键、芳香堆积等多种相互作用与目标物识别[18]。电化学核酸适配体传感器是利用核酸适配体与目标物质进行特异性结合实现对目标物的检测,如图2-c所示。
核酸适配体针对目标物质进行设计,因此具有极强特异性,此外核酸适配体还具有可重复利用性。如KAUR[19]等制备核酸适配体成功应用于生菜样品中马拉硫磷的检测,该传感器表现出优异的选择性。GUO等[20]以核酸适配体为识别元件制备电化学传感器用于苹果和大白菜中毒死蜱残留的检测,检测效果准确且回收率高。该传感器不仅具有良好的选择性和重复性,并且可以通过尿素再生,实现重复使用。核酸适配体目前被认为是基于酶和抗体的潜在替代品,相比酶和抗体,核酸适配体稳定性较好,可形成与目标物相匹配的结构,特异性好,存在可重复性,但特定核酸适配体较高的成本及复杂的筛选都限制了电化学核酸适配体传感器的进一步发展。
1.4 电化学微生物传感器
电化学微生物传感器以微生物的细胞或细胞表面的活性物质作为电化学传感器的识别元件,如从环境筛选出能够产生有OPH的微生物,OPH与有机磷农药结合后会使其分解产生硝基苯酚等物质,硝基苯酚等物质具有电化学活性,基于此原理检测有机磷农药[21],如图2-b所示。
MULCHANDANI等[22]研制出了一种由溶解氧电极组成的电化学微生物传感器,以微生物为识别元件,该微生物能在细胞表面表达OPH,降解有机磷农药并消耗氧气,该传感器对于对氧磷的检出限为0.1 mmol/L。电化学微生物传感器具有创新性,但与
电化学催化酶传感器相比存在缺陷,微生物难以固定,且不同微生物的运动方式不同,导致固定方式的复杂性;电化学微生物传感器由于其识别元件的特殊性,导致其稳定性相对于其他传感器较差;微生物传代较快,难以在检测过程中确定微生物是否存活,导致检测结果存在误差。
2 电化学有机物传感器
以生物材料为识别元件的电化学传感器在应用方面受到一定的限制,如酶和抗体等物质会出现活力降低的现象,需要放置在4 ℃的条件下进行保存;核酸适配体成本高昂等。学者们开发出了一些有机物替代生物材料用于有机磷农药的检测,如分子印迹聚合物、肟类化合物等。
2.1 电化学分子印迹传感器
分子印迹聚合物molecular imprinted polymers,MIPs)是一类聚合材料,目标分子表现为模板,交联的单体围绕着目标分子进行排列聚合,形成特定的结合腔,结合腔的形状和官能团可以与目标分子特异性结合,实现对目标分子的检测[23]。电化学分子印迹传感器是利用MIPs与目标物质的特异性结合,将该反应转换为电信号,实现对目标物的检测,如图3所示。
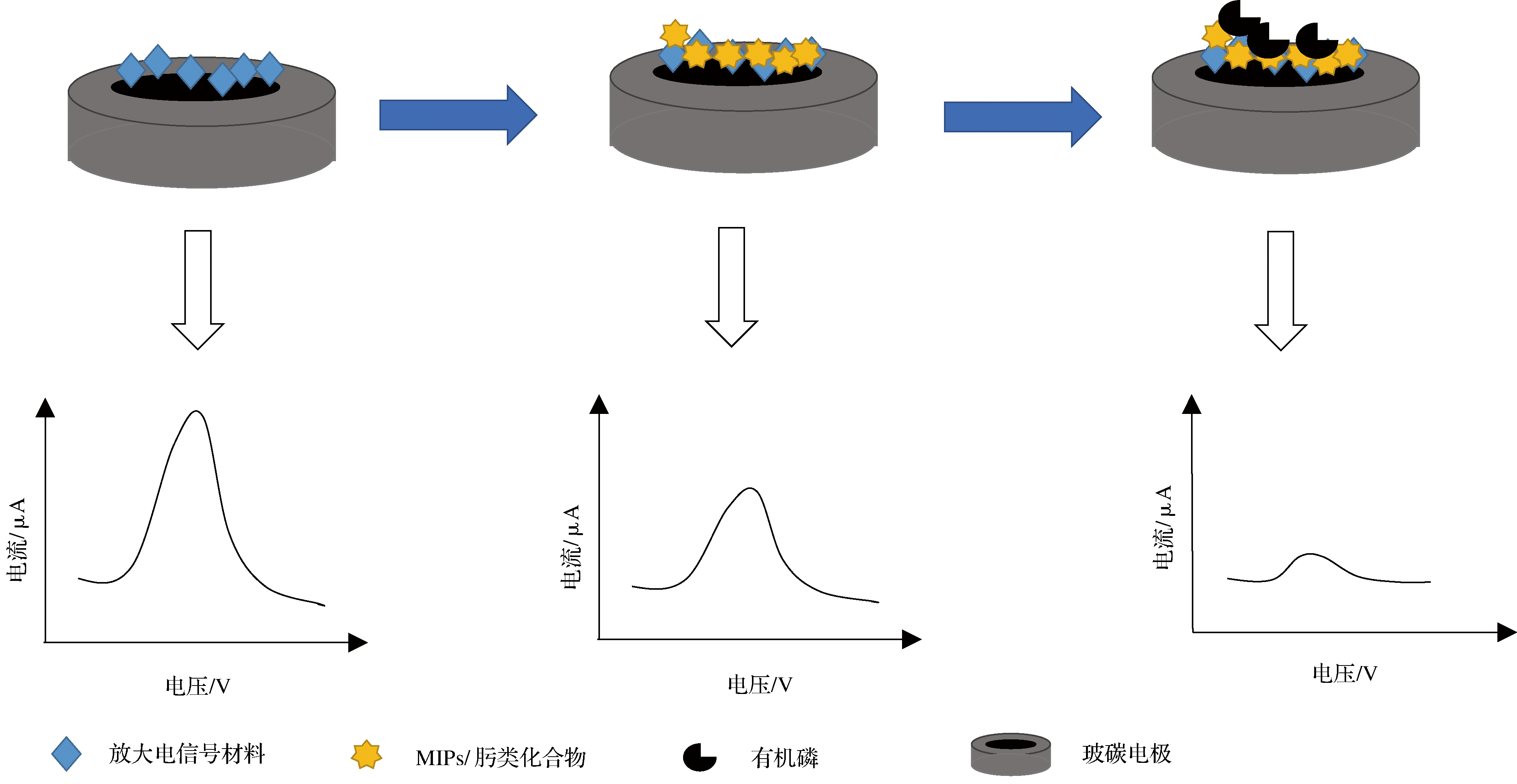
图3 电化学分子印迹聚合物/肟类化合物传感器检测有机磷农药的原理
Fig.3 Principles of electrochemical molecularly imprinted polymer/oxime compound sensors for detecting organophosphorus pesticides
研究者利用此原理通过改善修饰材料和制备MIPs的原材料从而改善电化学MIPs传感器的检测性能,如ZOUAOUI等[24]基于壳聚糖电沉积印迹草甘膦的MIPs,成功用于草甘膦的检测,检测时间为30 min。而DING等[25]通过在聚吡咯纳米管的壁上和表面上印迹草甘膦位点制备得到针对于草甘膦的电化学分子印迹传感器,将其用于检测橙汁和大米饮料中的草甘膦残留,回收率分别为97.45%~101.69%和94.54%~102.79%。且制备的传感器检测时间更短。
电化学MIPs传感器的识别元件通过印迹不同的有机磷农药可以实现对其他有机磷农药的检测,大量研究表明,能将分子印迹聚合物用于多种有机磷农药的检测[26-27]。分子印迹聚合物是针对特定的目标物进行设计,具有良好特异性和重复使用性,但其制备过程复杂,且模板分子需采用纯度较高的单体,制备成本较高,限制了该方法在食品中有机磷农药残留快速检测领域的应用。
2.2 电化学肟传感器
肟类化合物能与有机磷农药结合发生反应,使其磷酰化,利用此原理制备电化学肟传感器对有机磷农药进行检测,如图3所示。WU等[28]制备识别元件4-氨基苯乙酮肟对二乙基氰基膦酸酯进行检测,该传感器具有较广的检测范围,并能用于检测其他有机磷农药,如乐果、杀螟硫磷等有机磷农药。以肟类化合物为识别元件的电化学传感器对有机磷农药的检测具有良好特异性,检出限低等优势,但肟类化合物合成步骤繁杂且合成原料具有毒性,限制了电化学肟传感器的大规模应用。
以有机物为识别元件的电化学传感器虽然稳定性好,但其制备流程复杂、制备所用有机物大多存在毒性、污染较大,为了避免出现上述问题,以无机物为识别元件的电化学传感器也被广泛研究。
3 电化学无机物传感器
3.1 电化学CuO传感器
电化学无机物传感器利用无机物与有机磷农药进行结合,得到电信号变化,从而实现对有机磷农药的检测,识别元件可以为CuO、TiO2、ZrO2等无机化合物。据研究发现,铜或含铜化合物与硫代化合物具有良好的亲和力[29],可以与含硫的有机磷农药进行结合形成配合物,引起电信号的变化,如图4所示。

图4 电化学CuO传感器检测有机磷农药的原理
Fig.4 Principles of electrochemical CuO sensors to detect organophosphorus pesticides
由于马拉硫磷和甲基对硫磷都属于含硫的有机磷农药,因此电化学Cu/CuO传感器可对这类农药进行检测。如HUO等[30]在玻碳电极上修饰了单壁碳纳米管和氧化铜纳米线对马拉硫磷进行检测,该电化学传感器对马拉硫磷的检测显示出良好选择性、灵敏度和较宽的线性范围,将大蒜中加入马拉硫磷,检测得到回收率良好。李琼[31]通过简单混合的方式得到铜纳米线和石墨烯/壳聚糖复合纳米材料并将其成功用于甲基对硫磷的检测。
电化学铜传感器操作简便,环境污染小,可以实现马拉硫磷和甲基对硫磷等含硫有机磷农药的检测,但铜也能和EDTA[32]和柠檬酸[33]等物质进行配位结合,导致该检测方法易受干扰、检测结果准确度不高。
3.2 其他氧化物电化学传感器
除了CuO,其他纳米金属、纳米金属氧化物及其复合物也对有机磷农药表现出特殊催化活性和吸附性,如ZrO2等,ZrO2对磷酸基团有很强的亲和力[34],GAO等[35]在玻碳电极上合成了Au、ZrO2和石墨烯复合材料对大白菜中的甲基对硫磷进行检测,得到96.2%~102.1%的回收率。以无机物为识别元件的电化学传感器无毒,但其与有机磷农药配位结合力特异性不强,易受其他物质的干扰。
4 不同种类电化学传感的比较
不同的电化学传感器在应用于实际检测食品中有机磷农药残留时各有优缺点(表1)。电化学AChE传感器成本较低,在食品中有机磷农药残留检测领域的应用已经较为成熟,但该方法特异性差的问题仍未解决。电化学OPH传感器具有良好特异性,由于目前OPH来自特定微生物,将其应用于有机磷农药残留的检测需要解决其生产问题。电化学免疫传感器特异性好,灵敏度高,但抗原/抗体获取仍存在困难;电化学核酸适配体传感器是近几年研究较多的电化学传感器,针对不同的物质可以筛选出不同的结构,特异性好,但每种有机磷农药需要筛选与其特异性结合的适配体,特定的二级结构形成机制复杂,且核酸适配体的成本问题仍没有得到解决。电化学微生物传感器具有创新性,但由于微生物的特殊性,导致该电化学传感器稳定性较差。电化学分子印迹聚合物传感器稳定性好,易保存,可重复使用,但分子印迹聚合物的功能单体价格较为昂贵,制备时间长且多数有机物存在毒性。电化学肟传感器针对有机磷农药有很强特异性且来源较广,但肟类化合物易氧化及部分肟类化合物存在毒性。电化学无机物传感器虽然无毒,但特异性差,如铜可以和多种化合物进行配合。综上,电化学传感器仍需进一步优化方法,以实现在食品中有机磷农药残留检测的广泛应用。
表1 不同种类电化学传感器用于检测食品中有机磷农药的优缺点
Table 1 Advantages and disadvantages of different types of electrochemical sensors in detecting organophosphorus pesticides in food

识别元件传感界面目标物及检出限/(ng/mL)检测基质检测时间/min贮藏稳定性/d(电信号保持率/%)优缺点文献AChEAChE/CNTs-NH2/Ag NPs-N-F-MoS2/GCE久效磷:5×10-5;毒死蜱:10-3新鲜水果157(98.5%),30(93.3%)能检测多种有机磷农药;但特异性不足[36]OPHCNT/OPH/GCE甲基对硫磷:210大蒜—30(90%)特异性好,稳定性好,能检测多种农药;但OPH从微生物中提取,获取困难,现未得到广泛得生产[37]核酸适配体Apt/GO-CuNPs/GCE丙溴磷:1.12×10-3;甲拌磷:0.12;水胺硫磷:0.01;氧化乐果:0.12 油菜、菠菜407 (95.27%)具有良好的选择性;但筛选合适的适配体所需时间长,制备成本高[38]抗体Ab/ AuNPs /FTO毒死蜱:3.5×10-3苹果—21(—)选择性好,检出限低,但抗体贮存需要温和的条件[39]微生物OPH-bacteria/OMCs/QCM对氧磷:24.77对硫磷:29.1甲基对硫磷:39.45水—30 (70%)特异性较好;但稳定性较差且不同的微生物需要不同的固定方式[40]分子印迹聚合物MIP/ Au-SPE马拉硫磷:0.06 橄榄油、水果3030 (83%),高特异性、可重复使用;但需要用大量有机试剂,带有毒性且成本较高[41]肟类化合物MNO/Au/Ag/NG/GCE乐果:0.072水、西红柿、橙子3 min 20 s30(92%)高特异性、稳定性好,可同时检测几种有机磷农药;但需要用大量有机试剂,合成步骤繁杂、原料及制得的识别元件具有一定的毒性[42]CuO/CuCuO/MWCNTS-IL/HF-graphite electrode草甘膦:0.22水10—操作简单、成本低;但可以与许多物质进行络合,特异性较差[43]ZrO2Au-ZrO2-GN/GCE甲基对硫磷:1水1230(93%)ZrO2对磷酸基团具有亲和能力,检测灵敏度高,稳定性好;但特异性不足[44]
注:“—”表示文献中未提及。
5 结论与展望
电化学传感器是食品中快速检测有机磷农药残留的研究热点,但应用于食品中的有机磷农药残留的检测仍存在如下问题:(1)电化学传感器的识别元件存在缺陷。易受介质环境其他物质的干扰;部分识别元件制备成本高,制备过程环境污染大,难以应用于实际食品中有机磷农药残留快速检测。(2)放大电信号材料有待进一步研究,食品中残留的有机磷农药含量少,因此在制备电化学传感器时需要修饰提高电化学性能的材料,但在使用提高电化学性能材料的同时会带来额外的一些问题,如多孔材料吸附非检测目标物质而带来干扰;金属纳米材料易发生团聚现象导致检测灵敏性降低等;(3)电化学传感器需进一步研究其系统化和功能化。目前大多研究电化学传感器仍配置的电化学工作站进行研究;有机磷农药降解速度快,因此很难实现对食品中有机磷农药残留的快速、实时现场检测;目前大多前处理方法仍采用国标方法的前处理方法,缺少针对于电化学传感器的前处理方法。
电化学传感器快速检测食品中有机磷农药残留具有仪器简单、响应速度快、检测灵敏度低等优点,具有较高的应用潜力,尤其以下发展方向值得关注:(1)开发具有选择特异性好、毒性低且环境友好、制备成本低的识别元件;制备灵敏性、选择性、可重复性和稳定性俱佳的有机磷农药残留检测的电化学传感器,如研究可替代MIPs的廉价材料、改良核酸适配体筛选方法以降低识别元件成本等研究;改善电化学免疫传感器的储藏环境及制备条件,以保持识别元件的生物活性,增强其贮藏稳定性、延长保质期,进一步提高其在食品中有机磷农药残留检测的应用潜力。(2)筛选、研究新的可提高电化学性能的材料或方法,以避免或降低由材料带来的对电化学传感器检测的不利影响;(3)电化学传感器检测方法的系统化、功能化研究,开发适宜的样品前处理方法配合电化学传感器对实时、在线、现场快速检测的需求,并配合仪器制造,将高选择性、高灵敏度的电化学传感器转变为自动化、多功能化的自动检测电化学分析仪器。
[1] 贺红武. 有机磷农药产业的现状与发展趋势[J]. 世界农药, 2008, 30(6):29-33;6.
HE H W. Present situation and development trend of organophosphorus pesticide industry[J]. World Pesticides, 2008, 30(6):29-33;6.
[2] WANG R R, WANG Y H, QU H, et al. An acetylcholinesterase-functionalized biosensor for sensitive detection of organophosphorus pesticides based on solution-gated graphene transistors[J]. ACS Agricultural Science &Technology, 2021, 1(4):372-378.
[3] ZHAO G Z, ZHOU B H, WANG X W, et al. Detection of organophosphorus pesticides by nanogold/mercaptomethamidophos multi-residue electrochemical biosensor[J]. Food Chemistry, 2021, 354:129511.
[4] GONG J M, WANG L Y, ZHANG L Z. Electrochemical biosensing of methyl parathion pesticide based on acetylcholinesterase immobilized onto Au-polypyrrole interlaced network-like nanocomposite[J]. Biosensors and Bioelectronics, 2009, 24(7):2285-2288.
[5] VIGNESH KUMAR T H, SUNDRAMOORTHY A K. Electrochemical biosensor for methyl parathion based on single-walled carbon nanotube/glutaraldehyde crosslinked acetylcholinesterase-wrapped bovine serum albumin nanocomposites[J]. Analytica Chimica Acta, 2019, 1074:131-141.
[6] LIU Y J, WANG G C, LI C P, et al. A novel acetylcholinesterase biosensor based on carboxylic graphene coated with silver nanoparticles for pesticide detection[J]. Materials Science and Engineering: C, 2014, 35:253-258.
[7] SONG D D, WANG Y Z, LU X, et al. Ag nanoparticles-decorated nitrogen-fluorine co-doped monolayer MoS2 nanosheet for highly sensitive electrochemical sensing of organophosphorus pesticides[J]. Sensors and Actuators B: Chemical, 2018, 267:5-13.
[8] MA L, ZHOU L Y, HE Y, et al. Hierarchical nanocomposites with an N-doped carbon shell and bimetal core: Novel enzyme nanocarriers for electrochemical pesticide detection[J]. Biosensors and Bioelectronics, 2018, 121:166-173.
[9] LU X, TAO L, LI Y S, et al. A highly sensitive electrochemical platform based on the bimetallic Pd@Au nanowires network for organophosphorus pesticides detection[J]. Sensors and Actuators B: Chemical, 2019, 284:103-109.
[10] JAIN M, YADAV P, JOSHI B, et al. Recombinant organophosphorus hydrolase (OPH) expression in E.coli for the effective detection of organophosphate pesticides[J]. Protein Expression and Purification, 2021, 186:105929.
[11] PEDROSA V A, PALIWAL S, BALASUBRAMANIAN S, et al. Enhanced stability of enzyme organophosphate hydrolase interfaced on the carbon nanotubes[J]. Colloids and Surfaces B: Biointerfaces, 2010, 77(1):69-74.
[12] DEO R P, WANG J, BLOCK I, et al. Determination of organophosphate pesticides at a carbon nanotube/organophosphorus hydrolase electrochemical biosensor[J]. Analytica Chimica Acta, 2005, 530(2):185-189.
[13] SAHIN A, DOOLEY K, CROPEK D M, et al. A dual enzyme electrochemical assay for the detection of organophosphorus compounds using organophosphorus hydrolase and horseradish peroxidase[J]. Sensors and Actuators B: Chemical, 2011, 158(1):353-360.
[14] LIU G Z, SONG D D, CHEN F J. Towards the fabrication of a label-free amperometric immunosensor using SWNTs for direct detection of paraoxon[J]. Talanta, 2013, 104:103-108.
[15] MEHTA J, VINAYAK P, TUTEJA S K, et al. Graphene modified screen printed immunosensor for highly sensitive detection of parathion[J]. Biosensors and Bioelectronics, 2016, 83:339-346.
[16] MEHTA J, BHARDWAJ N, BHARDWAJ S K, et al. Graphene quantum dot modified screen printed immunosensor for the determination of parathion[J]. Analytical Biochemistry, 2017, 523:1-9.
[17] YIN W J, ZHANG J X, WANG H, et al. A highly sensitive electrochemical immunosensor based on electrospun nanocomposite for the detection of parathion[J]. Food Chemistry, 2023, 404:134371.
[18] MAJDINASAB M, DANESHI M, LOUIS MARTY J. Recent developments in non-enzymatic (bio)sensors for detection of pesticide residues: Focusing on antibody, aptamer and molecularly imprinted polymer[J]. Talanta, 2021, 232:122397.
[19] KAUR N, THAKUR H, PRABHAKAR N. Multi walled carbon nanotubes embedded conducting polymer based electrochemical aptasensor for estimation of malathion[J]. Microchemical Journal, 2019, 147:393-402.
[20] XU G L, HUO D Q, HOU C J, et al. A regenerative and selective electrochemical aptasensor based on copper oxide nanoflowers-single walled carbon nanotubes nanocomposite for chlorpyrifos detection[J]. Talanta, 2018, 178:1046-1052.
[21] MULCHANDANI A, MULCHANDANI P, CHAUHAN S, et al. A potentiometric microbial biosensor for direct determination of organophosphate nerve agents[J]. Electroanalysis, 1998, 10(11):733-737.
[22] MULCHANDANI P, CHEN W, MULCHANDANI A. Microbial biosensor for direct determination of nitrophenyl-substituted organophosphate nerve agents using genetically engineered Moraxella sp[J]. Analytica Chimica Acta, 2006, 568(1-2):217-221.
[23] MAZZOTTA E, DI GIULIO T, MALITESTA C. Electrochemical sensing of macromolecules based on molecularly imprinted polymers: Challenges, successful strategies, and opportunities[J]. Analytical and Bioanalytical Chemistry, 2022, 414(18):5165-5200.
[24] ZOUAOUI F, BOUROUINA-BACHA S, BOUROUINA M, et al. Electrochemical impedance spectroscopy determination of glyphosate using a molecularly imprinted chitosan[J]. Sensors and Actuators B: Chemical, 2020, 309:127753.
[25] DING S C, LYU Z Y, LI S Q, et al. Molecularly imprinted polypyrrole nanotubes based electrochemical sensor for glyphosate detection[J]. Biosensors and Bioelectronics, 2021, 191:113434.
[26] HASSAN A H A, MOURA S L, ALI F H M, et al. Electrochemical sensing of methyl parathion on magnetic molecularly imprinted polymer[J]. Biosensors and Bioelectronics, 2018, 118:181-187.
[27] KHALIFA M E, ABDALLAH A B. Molecular imprinted polymer based sensor for recognition and determination of profenofos organophosphorous insecticide[J]. Biosensors and Bioelectronics: X, 2019, 2:100027.
[28] WU H X, HUO D Q, ZHAO Y N, et al. A non-enzymatic electro-chemical sensor for organophosphorus nerve agents mimics and pesticides detection[J]. Sensors and Actuators B: Chemical, 2017, 252:1118-1124.
[29] SGOBBI L F, MACHADO S A S. Functionalized polyacrylamide as an acetylcholinesterase-inspired biomimetic device for electrochemical sensing of organophosphorus pesticides[J]. Biosensors and Bioelectronics, 2018, 100:290-297.
[30] HUO D Q, LI Q, ZHANG Y C, et al. A highly efficient organophosphorus pesticides sensor based on CuO nanowires-SWCNTs hybrid nanocomposite[J]. Sensors and Actuators B: Chemical, 2014, 199:410-417.
[31] 李琼. 基于铜纳米材料的非酶有机磷农残电化学传感检测研究[D]. 重庆: 重庆大学, 2014.
LI Q. A non-enzymatic organophosphorus pesticides sensor based on copper nanomaterials[D]. Chongqing: Chongqing University, 2014.
[32] CAO Y, QIAN X C, ZHANG Y X, et al. De complexation of EDTA-chelated copper and removal of copper ions by non-thermal plasma oxidation/alkaline precipitation[J]. Chemical Engineering Journal, 2019, 362:487-496.
[33] MART NEZ A, VARGAS R, GALANO A. Citric acid: A promising copper scavenger[J]. Computational and Theoretical Chemistry, 2018, 1133:47-50.
NEZ A, VARGAS R, GALANO A. Citric acid: A promising copper scavenger[J]. Computational and Theoretical Chemistry, 2018, 1133:47-50.
[34] TAO T, ZHOU Y, MA M Y, et al. Novel graphene electrochemical transistor with ZrO2/rGO nanocomposites functionalized gate electrode for ultrasensitive recognition of methyl parathion[J]. Sensors and Actuators B: Chemical, 2021, 328:128936.
[35] GAO N, HE C H, MA M Y, et al. Electrochemical co-deposition synthesis of Au-ZrO2-graphene nanocomposite for a nonenzymatic methyl parathion sensor[J]. Analytica Chimica Acta, 2019, 1072:25-34.
[36] SONG D D, WANG Y Z, LU X, et al. Ag nanoparticles-decorated nitrogen-fluorine co-doped monolayer MoS2 nanosheet for highly sensitive electrochemical sensing of organophosphorus pesticides[J]. Sensors and Actuators B: Chemical, 2018, 267:5-13.
[37] DU D, CHEN W J, ZHANG W Y, et al. Covalent coupling of organophosphorus hydrolase loaded quantum dots to carbon nanotube/Au nanocomposite for enhanced detection of methyl parathion[J]. Biosensors and Bioelectronics, 2010, 25(6):1370-1375.
[38] FU J Y, AN X S, YAO Y, et al. Electrochemical aptasensor based on one step co-electrodeposition of aptamer and GO-CuNPs nanocomposite for organophosphorus pesticide detection[J]. Sensors and Actuators B: Chemical, 2019, 287:503-509.
[39] TALAN A, MISHRA A, EREMIN S A, et al. Ultrasensitive electrochemical immuno-sensing platform based on gold nanoparticles triggering chlorpyrifos detection in fruits and vegetables[J]. Biosensors and Bioelectronics, 2018, 105:14-21.
[40] TANG X J, ZHANG T T, LIANG B, et al. Sensitive electrochemical microbial biosensor for p-nitrophenylorganophosphates based on electrode modified with cell surface-displayed organophosphorus hydrolase and ordered mesopore carbons[J]. Biosensors and Bioelectronics, 2014, 60:137-142.
[41] AMATATONGCHAI M, SROYSEE W, SODKRATHOK P, et al. Novel three-dimensional molecularly imprinted polymer-coated carbon nanotubes (3D-CNTs@MIP) for selective detection of profenofos in food[J]. Analytica Chimica Acta, 2019, 1076:64-72.
[42] 张亚. 基于肟修饰石墨烯基纳米复合材料的电化学传感器对有机农药残留的检测研究[D]. 重庆: 重庆大学, 2017.
ZHANG Y. Electrochemical sensor based on oxime group-functionalized nitrogen-doped graphene composites for determination organophosphorus pesticides[D]. Chongqing: Chongqing University, 2017.
[43] GHOLIVAND M B, AKBARI A, NOROUZI L. Development of a novel hollow fiber-pencil graphite modified electrochemical sensor for the ultra-trace analysis of glyphosate[J]. Sensors and Actuators B: Chemical, 2018, 272:415-424.
[44] GANNAVARAPU K P, GANESH V, THAKKAR M, et al. Nanostructured Diatom-ZrO2 composite as a selective and highly sensitive enzyme free electrochemical sensor for detection of methyl parathion[J]. Sensors and Actuators B: Chemical, 2019, 288:611-617.