猴头菌(Hericium erinaceus),又称猴头菇、狮子鬃毛,是常见的珍稀食药用菌之一,属于齿菌科担子菌、猴头菇属真菌的一种。目前,已从猴头菌子实体、菌丝体及发酵液中分离出多糖、蛋白质、萜类、甾醇、酚类等多种营养及功能活性物质。前期研究发现,猴头菌具有增强人体免疫[1]、抗肿瘤[2]、抗疲劳[3]、抑菌[4]、保护胃损伤和治疗慢性萎缩性胃炎[5]、调节肠道菌群[6]、保护神经细胞[7-8]等诸多功效。除此之外,最新的研究表明猴头菌还具有改善学习记忆能力[9]、防治阿尔茨海默症[10]、改善骨关节炎症[11]以及改善衰老过程中运动能力[12]的潜力。
野生猴头菌资源有限,常用人工栽培方式培育子实体。但因人工栽培周期长,且受到环境因素制约,易受农药、重金属和塑化剂等残留影响,不适合现代化工厂发展。液态发酵法能在短时间内获得大量菌丝体及发酵液,且工艺设备较简单,生产过程产品品质便于控制,已成为一种重要的食药用菌生产途径。在过去几十年中,已经有几十种食药用菌采用液态发酵技术生产成功,其中大多数属于担子菌门及子囊菌门[13]。早期液态发酵研究中,提高发酵效率的主要方式是优化培养工艺。随着诱变育种技术的发展,已有多种诱变育种技术应用于猴头菌的菌株变异与筛选,显著提高了菌株活性与代谢产物生产能力。最近十几年来,诱导调控技术成为了液态发酵中新的研究热点,诱导调控是采用低剂量诱导剂以促进目标代谢物快速生物合成的一种发酵策略,具有经济效益高,特异性强,工艺流程简单,不易对环境造成污染等优点[14]。
众多研究结果表明猴头菌液态发酵菌丝体及其发酵液具有很高的食药用价值。此前关于猴头菌液态发酵领域的综述性文章多针对于发酵培养条件优化以及发酵产品应用等方面,近十年来缺乏针对猴头菌活性物质发酵方面的综述。本文对猴头菌液态发酵产活性物质的最新进展进行综述,归纳猴头菌液态发酵相关生产工艺和技术,为进一步研究和利用猴头菌液态发酵生产活性物质提供参考。
1 猴头菌菌株诱变育种
选取生长力旺盛、代谢合成能力强的菌株是实行猴头菌液态发酵的第一步,也是最关键的一步。目前,优良菌株的选育一般是通过从野生猴头菌中分离并筛选出生长力强的菌株进行纯化、传代。另一种途径是通过诱变育种的方式,猴头菌的诱变育种主要通过外源物理干扰,诱导猴头菌菌株产生突变或调控基因表达,通过稳定传代筛选出生长旺盛,分泌代谢产物能力强的变异菌株。常用的方法有紫外线诱变、射线辐照诱变、超声波诱变、离子束诱变等。如表1所示,研究人员利用筛选后的诱变菌株进行液态发酵,与原始菌株相比,诱变菌株在液态发酵过程中的生长速率以及代谢产物产量均明显提高。
表1 不同诱变育种技术对猴头菌液态发酵影响
Table 1 Effects of different mutagenesis breeding techniques on liquid fermentation of Hericium erinaceus

菌种诱变技术效果机理参考文献猴头菌911紫外线诱变育种菌丝体生物量提高0.86倍,总多糖含量提高0.36倍DNA分子吸收紫外光后,形成嘧啶二聚体,引发双链结构扭曲,造成碱基转换、颠换、移码突变或缺失从而造成突变[15]猴头菌HT1紫外线诱变育种菌丝体生物量提高率由13.03 g/L提高至21.61 g/LDNA分子吸收紫外光后,形成嘧啶二聚体,引发双链结构扭曲,造成碱基转换、颠换、移码突变或缺失从而造成突变[16]猴头菌(肇庆学院)超声波诱变略微提高粗多糖含量;多糖结构改变,增强抑菌性超声波的空化、机械和热效应影响与生物体代谢合成途径相关的基因的表达[17]猴头菌0605常温室压等离子体(atmospheric room temperature plasma,ARTP)诱导育种诱变菌株较出发菌株菌丝体生物量提高14%~17%;多糖产率最高可提高达97.86%引起基因组多样性损伤,产生大规模的突变[18]猴头菌(沈阳农业大学)60Co-γ射线辐照诱变生物量和原始菌株相比提高14.2%,菌丝多糖产量提高200%菌株DNA发生断裂、损伤和碱基缺失等生物学效应[19]猴头菌(新疆乌鲁木齐食用菌研究所)N+离子注入诱变经稳定传代后,较好的变异菌株生长速度提高44.1%,多糖含量提高224.42%,总氨基酸含量提高12.12%离子深入到生物体遗传物质,引起一系列生物学效应,影响基因表达、修复等[20]猴头菌920N+离子注入诱变液态发酵生物量和多糖含量分别提高了30.37%和47.45%离子深入到生物体遗传物质,引起一系列生物学效应,影响基因表达、修复等[21]
1.1 紫外线诱变
紫外线诱变育种成本低、易操作且突变效果好,可在短时间内大量获得突变体。菌株吸收紫外光后,DNA分子会形成嘧啶二聚体,引发DNA空间构象的改变,阻碍碱基间正常配对,从而引起诱变[22]。李艳红等[16]利用紫外线对猴头菌株HT1进行诱变育种,变异菌株HT65,菌丝体生物量提高率由13.03 g/L提高至21.61 g/L。此外,吴清山[15]通过紫外线诱导猴头菌株,筛选出的变异菌株经液态发酵后菌丝体生物量提高86.5%,达到12.03 g/L,总多糖含量提高35.9%,达到3.27 g/L。
1.2 γ射线辐照诱变
射线辐射诱变主要使细胞发生DNA发生断裂、损伤和碱基缺失等多种生物学效应而促使其产生大的突变[23]。王楠等[19]利用60Co-γ射线辐照诱变猴头菌株,在辐照剂量为800 Gy和剂量率为27.84 Gy/min的条件下选育出的猴头菌变异株HE-09,液体培养其生物量和原始菌株相比提高14.2%,菌丝多糖产量提高200%。经过氧化物同工酶电泳分析,诱变菌株HE-09与原始菌株均有相同的谱带,但出现了不同谱带和部分相同谱带浓度不一致的现象,说明诱变菌株与出发菌株同源但不同株。GONG等[24]在对ATRP诱变的猴头菌进行多组学分析中发现,变异菌株与原始菌株相比,显著下调的蛋白质中,过氧化物酶为其中之一。诱变菌株产生的变异可能与过氧化物酶的改变有关。
1.3 超声波诱变
超声波的空化、机械和热效应刺激猴头菌细胞产生对应激环境的防御反应,影响与生物体代谢合成途径相关的基因的表达。此外,利用超声波空化效应及其次生效应,即高压高频瞬变机械效应,可以剪切基因,改变蛋白质表达水平,实现诱变育种[25]。张帅等[17]采用超声波诱变猴头菌菌株,经筛选后的猴头菌变异株H-2,经液态发酵培养后,菌丝体粗多糖含量提高1.2%。经抑菌性测试,从猴头菌变异株H-2提取出的子实体多糖对金黄色葡萄球菌有强抑制效果,原菌株提取多糖则对金黄色葡萄球菌无明显抑制效果。超声诱导可能影响了多糖结构。
1.4 离子束诱变
ARTP诱变育种技术具有放电均匀且稳定、诱变时间短、安全性高、基因突变体的稳定性高等特点,主要作用对象为细胞,造成细胞内DNA损伤,从而引发突变[26]。杨珊等[27]采用ARTP技术对猴头菌原生质体进行诱变,经重复培养、稳定遗传后,筛选出的变异株猴头菌321液态发酵生物量和多糖含量分别提高了30.37%和47.45%。宋甜甜等[18]在前者的基础上,对诱变的3株菌株提取的菌丝体多糖进行研究并与原始菌株比较,发现变异菌株菌丝体多糖结构发生改变,诱变菌株236的20%醇沉多糖H2P40表现出较好的免疫活性,明显高于原始菌株。进一步分析显示,ARTP诱变改变了菌丝体多糖分子量质分布与单糖组成。其中变异菌株大分子多糖比例增加;H4P20与原始菌株菌丝体多糖相比,单糖组成中葡萄糖与甘露糖比例有明显提高。GONG等[24]进一步对ARTP诱变的猴头菌株通过多组学分析,发现编码UDP-葡萄糖4-差向异构酶的A6180基因片段在猴头菇突变株中显著上调,这与突变菌株中多糖的产量较高有关。此外,诱变株Ras-cAMP-PKA途径的蛋白表达谱显著降低,而多糖含量显著增加47.45%。S期阻滞实验进一步证实Ras-cAMP-PKA途径的功能障碍可能促进突变株产生高水平的多糖和β-葡聚糖。
低能离子束诱导也是菌株诱变常用方法之一,低能离子束注入会刻蚀细胞,增加细胞通透性,在细胞表面形成孔洞,细胞表面及内部的孔洞和空腔连接成特定通道,使后续离子深入到遗传物质,进而产生其他生物学效应[28]。低能离子束诱导具有损伤轻,诱变率高等特点。谭一罗等[21]采用N+离子注入技术诱变猴头菌孢子,在12×1016 ions/cm2,注入能量为15 keV的离子束下成功选育出一株猴头菌诱变株H1215,生长速率及液体发酵生物量分别提高了25.30%和30.67%。严涛等[20]则采用N+离子注入技术对猴头菌菌株进行诱变,并进行了高温耐热试验,成功选育出一株能在高温下生长较快的突变菌株,突变株较原始菌株生长速度提高了44.41%,多糖含量提高了224.42%,总氨基酸含量提高了12.12%。
2 猴头菌生物活性物质液态发酵工艺
培养基的组成与配比直接影响着猴头菌液态发酵菌丝体的形态与生物活性物质的合成,选择合适的培养基,是提高液态发酵中猴头菌生物活性物质产量最直观有效的方法。表2列举了多种针对猴头菌特定活性物质所筛选的优化培养基,发现在不同品系的猴头菌之间,营养需求也可能并不相同。面对不同的生物活性产物的需求,所选用的最佳培养基组分也有所区别,因此,针对不同品系的猴头菌以及目标活性物质进行液态发酵工艺研究很有必要。
表2 猴头菌在不同培养条件中生物量及代谢物产量
Table 2 Biomass and metabolite production of Hericium Erinaceus under different culture conditions
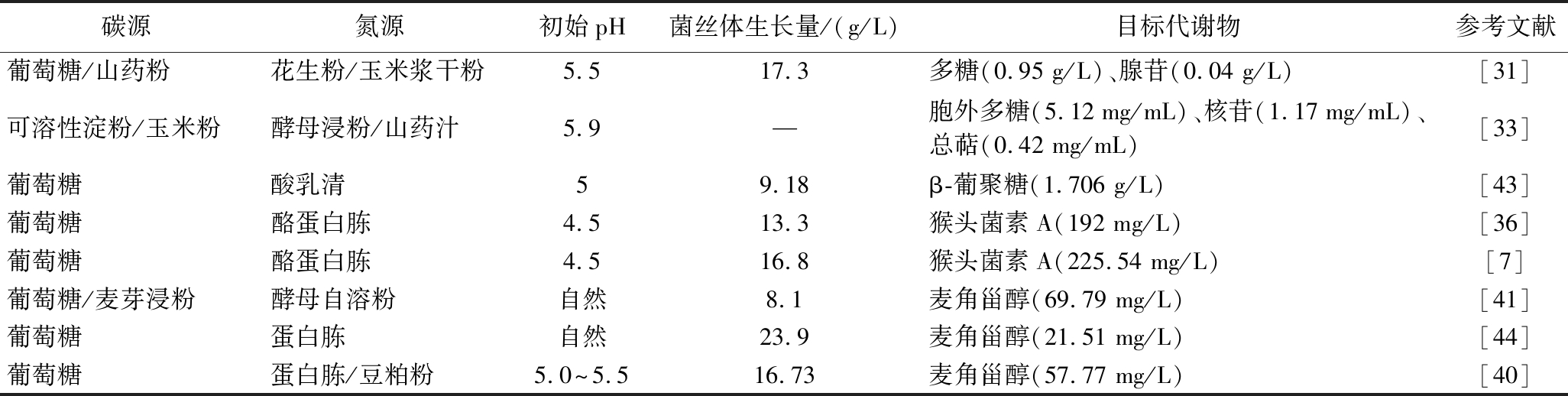
碳源氮源初始pH菌丝体生长量/(g/L)目标代谢物参考文献葡萄糖/山药粉花生粉/玉米浆干粉5.517.3多糖(0.95 g/L)、腺苷(0.04 g/L)[31]可溶性淀粉/玉米粉酵母浸粉/山药汁5.9—胞外多糖(5.12 mg/mL)、核苷(1.17 mg/mL)、总萜(0.42 mg/mL)[33]葡萄糖酸乳清59.18β-葡聚糖(1.706 g/L)[43]葡萄糖酪蛋白胨4.513.3猴头菌素A(192 mg/L)[36]葡萄糖酪蛋白胨4.516.8猴头菌素A(225.54 mg/L)[7]葡萄糖/麦芽浸粉酵母自溶粉自然8.1麦角甾醇(69.79 mg/L)[41]葡萄糖蛋白胨自然23.9麦角甾醇(21.51 mg/L)[44]葡萄糖蛋白胨/豆粕粉5.0~5.516.73麦角甾醇(57.77 mg/L)[40]
注:“—”表示未提及。
2.1 多糖
多糖作为猴头菌最主要的活性成分之一,利用液态发酵技术生产猴头菌多糖是主要的研究方向。已有众多研究人员优化液态发酵工艺生产猴头菌多糖,并研究其生物活性及营养功能。利用液态发酵生产的猴头菌多糖具有生产周期短,产品质量稳定等优势。菌丝体多糖和胞外多糖是不同代谢途径的产物,因此适合它们生产的最佳营养素有所不同[29]。
为了提高菌丝体多糖含量,所选用培养基必须同时促进菌丝体发育和代谢产物合成。菌丝体多糖含量和组成受碳源种类的影响比较显著。汪敬健等[30]在进行猴头菌液体培养基优化发现,以葡萄糖和可溶性淀粉为碳源时,均可以获得较高的菌丝体生物量,而发酵培养基以可溶性淀粉为碳源时,菌丝体多糖含量最高。速效碳源(葡萄糖、麦芽糖等)搭配复合碳源(玉米粉、山药粉等)是一种更有效的培养基,不仅兼顾前期菌丝体发育,也解决了后期代谢产物合成后劲不足的问题。例如,信文娟等[31]优化猴头菌液体发酵培养基,相比其他碳源,发现葡萄糖与山药粉组成的复合碳源培养的菌丝体量和多糖产量最高,可达0.95 g/L,多糖含量为52.5 mg/g。张筱梅等[32]选用2%葡萄糖、0.5%酵母膏、2%麦麸、2%玉米粒、1%(均为质量分数)豆粉作为培养基碳氮源,在26 ℃、pH 5.0条件下对猴头菌进行罐批发酵,菌丝体多糖含量可达130 mg/g,产量最高可达1.38 g/L。
除菌丝体多糖外,猴头菌胞外多糖的分泌受碳源和氮源影响都显著,这可能与胞外多糖复杂的转化过程有关。MALINOWSKA等[29]在碳源筛选过程中,发现蔗糖有利于提高胞外多糖产量,但影响了菌丝体生长量,这一结果同样与汪敬健等[30]的研究相似;此外,研究还发现麦芽提取物能同时促进菌丝体生长和胞外多糖分泌。在氮源方面,无机氮源促进了胞外多糖的合成,却抑制了菌丝体生长,因为它无法提供菌丝体生长所需要的必需氨基酸。最近,万宁威等[33]研究对比多种营养素,发现复杂的碳氮源更利于猴头菌发酵,提高猴头菌发酵液营养成分的最佳碳源为可溶性淀粉和玉米粉,氮源为酵母浸粉和山药汁,胞外多糖产量达到5.12 g/L。在单因素试验筛选碳氮源过程中,复合组碳氮源均比单一组分的碳氮源(如葡萄糖、蛋白胨、酵母粉等)更适合促进猴头菌胞外多糖的分泌。值得注意的是,猴头菌在这些含淀粉的培养基中生长速率和活性物质产量都有所提高,适合在工厂化生产中获得富含多糖的高质量猴头菌菌粉及发酵液等粗产物,作为药用材料或食品辅料。但若其中的淀粉未被完全利用,则会对猴头菌胞外活性多糖后续的分离纯化增加一定难度。
2.2 猴头菌素
猴头菌素(erinacine)主要是一类Cyathane型二萜化合物,液态发酵过程中主要在菌丝体中富集,也有少量在猴头菌发酵液中被发现(猴头菌素E和Q)。目前发现的20种猴头菌素化学结构如图1所示。猴头菌素具有刺激神经生长因子合成的生物活性,可用于治疗神经退行性疾病和周围神经病。到目前为止,已分离鉴定出20种左右的猴头菌素(猴头菌素A~K、P~V和Z1、Z2)(图1),进一步研究表明其具有不同的神经保护活性,例如促进神经生长因子释放(猴头菌素A~I)、减少β淀粉样蛋白沉积、增加胰岛素降解酶的表达(猴头菌素A和S)或止痛(猴头菌素E)[34]。猴头菌素A已被证实具有抗肿瘤活性,研究人员发现猴头菌素A可以在体外抑制DLD-1细胞的增殖,并在体内抑制DLD-1细胞的生长[35]。猴头菌素虽然能通过化学合成,但是其步骤繁琐,易产生副产物[34],液态发酵是猴头菌素增产的重要途径。因此,优化液态发酵生产猴头菌素工艺非常必要。

图1 二十种猴头菌素化学结构
Fig.1 Chemical structures of 20 erinacines
目前,主要针对与猴头菌素A与猴头菌素C液体发酵及优化的研究比较多,这可能与它们在菌丝体中含量较高有关。KRZYCZKOWSKI等[36]发现pH 4~5的环境可能是促进猴头菌素A合成的有利因素,最适的碳氮源分别为葡萄糖和酪蛋白胨,并采用中心复合旋转设计法优化了培养基,采用最适培养基组成(g/L):葡萄糖69.87,酪蛋白胨11.17,氯化钠1.45,硫酸锌0.055,磷酸二氢钾1.0,pH 4.5;25 ℃下,在10 L生物反应器中可获得192.73 mg/L的猴头菌素A。CHANG等[7]在前者研究基础上,额外添加了亚铁、铜、锰、镍金属离子,猴头菌素A产量提高到225.54 mg/L。在大型发酵罐生产实例中,LI等[37]用20 t发酵罐生产猴头菌素,优化培养基由0.25% 酵母膏、4.5%葡萄糖、0.5%黄豆粉、0.25%蛋白胨和0.05%(均为质量分数)硫酸镁组成,pH 4.5,温度为25 ℃。在发酵12 d后,观察到猴头菌素A的积累产量最高为5 mg/g干菌丝体。
在优化猴头菌素C发酵培养基研究中,WOLTERS等[8]发现,燕麦片和Edamin@K(一种水解乳清蛋白)是增加猴头菌素C产量的关键。其采用最适培养基组成为燕麦片5 g/L,碳酸钙1.5 g/L,EDamin@K 0.5 g/L,pH 7.5,培养6 d后猴头菌素C质量浓度可达2.73 g/L。但是在其方法中,是将一级种子液离心浓缩去除预培养基组分,菌丝体再以体积比5∶10的接种量接种至主发酵培养基中。但该方法只适用于实验室小规模研究培养,不适用于工厂化大规模发酵生产,因为高浓度液体种子难以适应大型生物反应器的无菌操作[34]。WOLTERS等[38]进一步研究还发现,采用酸化处理后的啤酒糟和小麦麸皮可作为产猴头菌素C的培养基原料,猴头菌经酸化啤酒糟基质和酸化小麦麸皮基质预培养后,采用上述方法接种至主发酵培养基,其中采用酸化啤酒糟预培养的猴头菌素C含量为174.8 mg/g菌丝体干重,采用小麦麸皮预培养的猴头菌素C含量为99.3 mg/g菌丝体干重,这对利用加工废弃副产物利用有重要意义。
2.3 甾醇
猴头菌中甾醇类物质主要为麦角甾醇及其衍生物,麦角甾醇具有抗炎作用,在体内还可以通过代谢转换成骨化二醇的活性形式,起到调节机体代谢作用。LI等[39]从猴头菌菌丝体的甲醇提取物中分离得到11种麦角烷型脂肪酸酯,其中Erinarol A~I为新发现的化合物。Erinarol A、B以剂量依赖的方式显著激活过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)的转录活性,目前,PPAR是设计和开发治疗2型糖尿病和代谢综合征激动剂的治疗靶点。
研究发现,可以通过优化培养基提高猴头菌中甾醇类物质的产量。杜娇[40]采用优化培养基:3.3%葡萄糖、0.3%蛋白胨、0.15%硫酸镁、3.2%(均为质量分数)豆粕粉,在pH 5.0~5.5,温度25 ℃条件下,猴头菌麦角甾醇产量最高为57.77 mg/L。与前者不同的是,张忠等[41]研究了猴头菇高产麦角甾醇液态发酵工艺,采用0.74%葡萄糖、0.66%(质量分数)麦芽浸粉作为复合碳源,1.8%(质量分数)酵母自溶粉为氮源,配备液态发酵培养基,在26 ℃,pH自然的条件下,麦角甾醇含量可达到69.79 mg/L。在对诱变后菌株的发酵工艺优化方面,蔡佳佳等[42]通过紫外线诱变育种,筛选出一株高产麦角甾醇的猴头菌菌株,在优化培养基:葡萄糖2%、酵母膏0.5%、磷酸二氢钾0.15%、硫酸镁0.075%、蛋白胨1%(均为质量分数)、起始pH值5.0,温度23 ℃条件下,发酵获得菌丝体粉麦角甾醇含量高达18.44 mg/g,总产量可达到114.79 mg/L。上述研究均发现,适合猴头菌液态发酵生产麦角甾醇的最佳碳源为葡萄糖,最佳氮源为酵母膏和蛋白胨,额外添加麦芽浸粉、豆粨粉等复杂碳氮源均有助于提高麦角甾醇产量。除此之外,诱变育种技术对提升猴头菌麦角甾醇的产量有显著作用。
2.4 其他活性物质
猴头菌液态发酵还可以生产糖苷酶类,杜娇等[45]研究猴头菌液态发酵产α-半乳糖苷酶的培养条件,以3%豆粕粉、2.3%葡萄糖、1.9%蛋白胨、0.3%(均为质量分数)氯化镁为优化培养基,在pH 5.0~6.0,温度25 ℃条件下,培养发酵液中α-半乳糖苷酶活性可达1.178 U/mL,较未优化前提高48.9%。
在猴头菌菌丝体中,还分离鉴定出如酚类、吡喃酮类、生物碱类等化合物。KOBAYASHI等[46]发现酚类物质Hericene A~C具有一定的生物活性作用,Hericene A对Hela细胞以及α-葡萄糖苷酶均具有抑制活性,Hericenes B和C对毒胡萝卜素诱导的内质网应激依赖性细胞凋亡具有一定的保护作用。汪楷等[47]针对猴头菌属次级代谢产物(hericenes、erinapyrones和erinacerins等)已有较多阐述,但针对这些活性物质的优化发酵还尚未见报道,这可能与其在猴头菌发酵产物中含量过低有关。
3 发酵诱导技术
为了高效生产目标次生代谢产物,需要刺激细胞的生物合成,最常用的方法是选择各种合适的诱导子[48]。诱变育种技术与发酵工艺优化均能显著提升液态发酵中生物活性物质的产量,但诱变育种技术存在一定不确定性,发酵工艺优化方法也有一定局限性,诱导发酵技术成为了新的突破方向,并能与前两种技术发挥协同作用。诱导子是一类特殊触发因子,它能触发真菌细胞对胁迫做出一系列的防御反应,调控代谢过程中酶的活性,从而增加植物次生代谢产物的合成[14]。根据来源不同,诱导子可分为两种类型,即生物诱导子与非生物诱导子,非生物诱导子又分为物理诱导子和化学诱导子。关于利用诱导子在猴头菌发酵领域中还仅有少量研究,如表3所示,本文在此将介绍猴头菌及其他几种食用菌的研究作为参考,以期在未来借鉴采用更多诱导方式应用于猴头菌液态发酵研究。
表3 猴头菌及其他食药用菌的液态发酵诱导影响
Table 3 Effect of liquid fermentation induction on Hericium Erinaceus and other edible and medicinal mushrooms

菌种技术/刺激物效果机理参考文献猴头菌磁场菌丝体干重生长率达到140.1%,菌体胞外多糖质量浓度的增加率达到271.7%影响细胞的微观结构;菌丝体对磁场处理产生了胁迫反应;菌丝体结构变疏松[50]猴头菌吐温80菌丝体含量提高118%,β-葡聚糖含量提高87%增加了细胞膜的通透性[54]猴头菌茉莉酸甲酯麦角甾醇含量提高25.8%调节基因表达,影响酶活性[53]猴头菌多菌种共发酵蒽醌产率从0.97%(单菌种最高)提高至2.11%不同菌之间的相互作用[57]中华美味蘑菇蓝光胞外多糖产率提高42%菌体内部代谢途径产生自适应调节,提高次生代谢产物合成[49]灰树花法尼醇胞外多糖产量提高150%法尼醇作为信号分子,影响菌丝体的形态、生物膜的形成、氧化应激和调节代谢产物外排[56]牛樟芝橘子皮提取物总多酚的产量在第28天分别56.73 mg/L增加到224.39 mg/L。三萜类化合物的产量从99.93 mg/L增加到1 028.02 mg/L提取物中精油成分影响了菌丝体生长和新陈代谢[58]
3.1 物理诱导
物理诱导因素通常有光照、干旱、高低温胁迫等。LU等[49]研究不同光源诱导中华美味蘑菇产生胞外多糖,通过比较6种光源发现,蓝光是最适合中华美味蘑菇在液态发酵中促进胞外多糖生产的诱导光源。蓝光照射诱导显著提高了胞外多糖的产量,与黑暗环境下相比胞外多糖产率提高了42%。
近年来,弱磁场应用于微生物培养展现出良好的应用前景。磁场处理会影响细胞的微观结构;它会导致细胞膜脂质流动性的加速,从而使细胞能够对外部应激刺激做出反应,从而保护细胞内部。细胞膜通透性的增加,也让细胞能吸收更多营养物质,增加分泌代谢产物能力[25]。研究表明,磁场能促进猴头菌的生长和胞外多糖的分泌。高梦祥等[50]在猴头菌液态发酵过程中,利用低交变磁场诱导,与对照组相比,发现菌丝体干重增长率达140.1%,菌体胞外多糖质量浓度增长率达271.7%。磁场作用影响了细胞的微观结构,经过放大观察,菌丝体在磁场影响下,结构变疏松,这种结构更利于菌丝体与外界物质的交换[51]。
3.2 化学诱导
常用的化学诱导子有植物生长调节剂、重金属离子、油脂类物质、信号分子刺激物等。化学诱导子具有快速、稳定、专一性强等优势,可以选择性诱导食用菌特定基因的表达,从而实现代谢产物的积累[52]。DAI等[53]利用水杨酸和茉莉酸甲酯调控猴头菌生产麦角甾醇,在培养基中添加适宜浓度的茉莉酸甲酯,猴头菌菌丝体中麦角甾醇含量提高了25.8%。除添加刺激物外,添加表面活性剂也是重要手段之一。OKUMURA等[54]采用吐温80诱导猴头菌菌丝体发酵,可以显著增加细胞膜的通透性,有利于营养物质的吸收、胞外多糖的生物合成和胞外多糖分泌。经吐温80诱导,收获的干菌丝体量相较对照组提高了118%,β-葡聚糖产量相较对照组提高了87%。
信号分子诱导也是化学诱导的重要途径,如法尼醇作为真菌中的群体感应分子,可以通过促进多糖的生物合成和调节菌丝形态而显著提高胞外多糖(exopoly saccharides,EPS)产量。法尼醇使杂色木霉菌丝发育成蓬松、疏松的多菌丝形态,有利于胞内多糖向培养基内排泄[55]。WANG等[56]通过外源添加群体感应分子法尼醇来提高灰树花液体发酵EPS的产量、抗氧化活性和抗肿瘤活性,经法尼醇诱导,EPS产量为1.25 g/L,比对照提高150%,通过分级醇沉出4种多糖组分,EPS-F-0.2M具有最高的抗氧化和抗肿瘤活性,说明法尼醇可能通过影响结构和性质来调节EPS的生物活性。这可为法尼醇在诱导猴头菌液态发酵提供参考。
3.3 生物诱导
生物诱导子是指来源于动植物细胞或微生物中的物质,包括细菌、真菌、酵母提取物、细胞壁成分、代谢产物、蛋白质和脂类等。例如,YANG等[57]通过人工神经网络优化猴头菌、双孢菇和鸡腿菇菌丝体共发酵产蒽醌,相比单种食用菌组合发酵,产率要明显提高。蒽醌产率从0.55%~0.97%大大提高至2.11%。此外,MA等[58]发现,在牛樟芝液态发酵第7天,添加橘子皮提取物,可显著促进多酚和三萜类化合物产生,这可能与橘子皮中的柑橘精油含大量萜烯类物质有关。并且,牛樟树皮提取物也被证实能有效促进牛樟芝菌丝体生长和生物活性物质的产量[59]。目前,利用生物诱导子促进猴头菌液态发酵产次生代谢产物的研究还很少,生物诱导调控在液态发酵中效率高、符合绿色生产原则,还能实现资源的可再生利用。猴头菌中次生代谢产物种类丰富,可利用的活性价值高,利用诱导策略促进猴头菌高价值的次生代谢产物发酵生产是猴头菌液态发酵研究的一大趋势。
4 总结与展望
猴头菌自古以来就以其味道鲜美、生物活性高而广受关注。为了满足猴头菌产量日益增长的需求,液态发酵为猴头菌及其活性物质提供了一种高效的生产途径,具有广阔的工业应用前景和极高的经济价值。本文从菌株选育、发酵工艺以及诱导调控3个方面对猴头菌液态发酵生产活性物质的方法进行了总结和归纳。目前,大多数研究都侧重于猴头菌液态发酵培养基优化的研究,而在诱导调控猴头菌液态发酵,促进代谢产物生成方面的研究还较缺乏。近年来,已有研究通过代谢组学分析,确定了猴头菌中多糖与萜类等物质合成的上游通路和关键酶[24,60],这为探索寻找猴头菌液态发酵诱导调控中新的诱导子提供了新的思路。猴头菌中活性物质的提取、分离、鉴定和功能方面的研究已较有较多阐述,而在开发和利用高效、绿色、经济的新诱导技术来提高目标活性产物的发酵效率,是猴头菌液态发酵领域的发展趋势。
[1] WU F F, HUANG H H. Surface morphology and protective effect of Hericium erinaceus polysaccharide on cyclophosphamide-induced immunosuppression in mice[J]. Carbohydrate Polymers, 2021, 251:116930.
[2] YANG Y, YE H Q, ZHAO C H, et al. Value added immunoregulatory polysaccharides of Hericium erinaceus and their effect on the gut microbiota[J]. Carbohydrate Polymers, 2021, 262:117668.
[3] 杨雪, 张海悦, 张鑫, 等. 猴头菇多糖对小鼠抗疲劳作用研究[J]. 食品工业科技, 2015, 36(13):368-370;375.
YANG X, ZHANG H Y, ZHANG X, et al. Anti-fatigue effects of polysaccharides from Hericium erinaceus in mice[J]. Science and Technology of Food Industry, 2015, 36(13):368-370;375.
[4] 罗青, 杨玉珍, 王国霞. 灵芝与猴头菇发酵液的抑菌性测定[J]. 现代牧业, 2017, 1(3):34-36.
LUO Q, YANG Y Z, WANG G X. Determination of antimicrobial activity of Ganoderma lucidum and Hericium erinaceus[J]. Modern Animal Husbandry, 2017, 1(3):34-36.
[5] WANG M X, GAO Y, XU D D, et al. A polysaccharide from cultured mycelium of Hericium erinaceus and its anti-chronic atrophic gastritis activity[J]. International Journal of Biological Macromolecules, 2015, 81:656-661.
[6] TIAN B M, GENG Y, XU T, et al. Digestive characteristics of Hericium erinaceus polysaccharides and their positive effects on fecal microbiota of male and female volunteers during in vitro fermentation[J]. Frontiers in Nutrition, 2022, 9: 858585.
[7] CHANG C H, CHEN Y, YEW X X, et al. Improvement of erinacine A productivity in Hericium erinaceus mycelia and its neuroprotective bioactivity against the glutamate-insulted apoptosis[J]. LWT-Food Science and Technology, 2016, 65:1100-1108.
[8] WOLTERS N, SCHEMBECKER G, MERZ J. Erinacine C: A novel approach to produce the secondary metabolite by submerged cultivation of Hericium erinaceus[J]. Fungal Biology, 2015, 119(12):1334-1344.
[9] ZHU X X, ZHANG Z L, YANG X, et al. RETRACTED: Improvement of extraction from Hericium erinaceus on the gut-brain axis in AD-like mice[J]. Brain Research, 2022, 1793:148038.
[10] YANSHREE, YU W S, FUNG M L, et al. The monkey head mushroom and memory enhancement in Alzheimer’s disease[J]. Cells, 2022, 11(15):2284.
[11] YANG S Y, FANG C J, CHEN Y W, et al. Hericium erinaceus Mycelium ameliorates in vivo progression of osteoarthritis[J]. Nutrients, 2022, 14(13):2605.
[12] RODA E, RATTO D, DE DE LUCA F, et al. Searching for a longevity food, we bump into Hericium erinaceus primordium rich in ergothioneine: The “longevity vitamin” improves locomotor performances during aging[J]. Nutrients, 2022, 14(6):1177.
[13] BAKRATSAS G, POLYDERA A, KATAPODIS P, et al. Recent trends in submerged cultivation of mushrooms and their application as a source of nutraceuticals and food additives[J]. Future Foods, 2021, 4:100086.
[14] 俞嘉卿, 邱涵, 程新, 等. 诱导子对植物次生代谢产物积累的影响研究进展[J]. 生物灾害科学, 2022, 45(3): 255-265.
YU J Q, QIU H, CHENG X, et al. Research progress in effects of elicitors on the accumulation of secondary metabolites in plants[J]. Biological Disaster Science, 2022, 45(3): 255-265.
[15] 吴清山. 猴头菇菌丝体诱变提高多糖产量的培养基优化试验[J]. 北方园艺, 2015(21):146-149.
WU Q S. Medium optimization test of improving polysaccharide yield by Hericium mycelium mutation[J]. Northern Horticulture, 2015(21):146-149.
[16] 李艳红, 李莉. 原生质体紫外诱变选育猴头菌新菌株的研究[J]. 食用菌, 2006, 28(5):18-19.
LI Y H, LI L. Study on breeding new Hericium erinaceus strain by protoplast ultraviolet mutation[J]. Edible Fungi, 2006, 28(5):18-19.
[17] 张帅, 程昊, 邱彩霞, 等. 超声波诱变对猴头菇粗多糖的影响[J]. 食品与发酵工业, 2020, 46(2):126-130.
ZHANG S, CHENG H, QIU C X, et al. Effect of ultrasonic mutation on crude polysaccharide of Hericium erinaceus[J]. Food and Fermentation Industries, 2020, 46(2):126-130.
[18] 宋甜甜, 吴迪, 张赫男, 等. ARTP诱变猴头菌株的发酵菌丝体多糖理化性质及体外免疫活性[J]. 菌物学报, 2018, 37(6):794-804.
SONG T T, WU D, ZHANG H N, et al. Physicochemical properties and immunological activities in vitro of mycelial polysaccharides from Hericium erinaceus mutants induced by atmospheric and room temperature plasma[J]. Mycosystema, 2018, 37(6):794-804.
[19] 王楠, 任大明, 龚涛, 等. 60Co-γ射线辐照诱变尖端菌丝选育猴头菌多糖高产菌株[J]. 中国食用菌, 2005,24(6):37-39.
WANG N, REN D M, GONG T, et al. Screening of high polysaccharide yield strain of Hericium erinaceus by 60Co-gamma irradiation[J]. Edible Fungi of China, 2005,24(6):37-39.
[20] 严涛, 李冠, 曾宪贤. N+离子注入技术选育猴头菌优良菌株[J]. 食品工业科技, 2007, 28(3):109-110; 113.
YAN T, LI G, ZENG X X. N+离子注入技术选育猴头菌优良菌株[J]. Science and Technology of Food Industry, 2007, 28(3):109-110; 113.
[21] 谭一罗, 苏文英, 任立凯, 等. N+注入技术选育猴头菇菌株[J]. 浙江农业科学, 2022, 63(1):83-85;93.
TAN Y L, SU W Y, REN L K, et al. Breeding of Hericium erinaceus strain by N+ implantation technology[J]. Journal of Zhejiang Agricultural Sciences, 2022, 63(1):83-85;93.
[22] MAO P, WYRICK J J, ROBERTS S A, et al. UV-induced DNA damage and mutagenesis in chromatin[J]. Photochemistry and Photobiology, 2017, 93(1):216-228.
[23] 杨兆民, 张璐. 辐射诱变技术在农业育种中的应用与探析[J]. 基因组学与应用生物学, 2011, 30(1):87-91.
YANG Z M, ZHANG L. Radiation mutation breeding in agriculture technology application and analysis[J]. Genomics and Applied Biology, 2011, 30(1):87-91.
[24] GONG M, ZHANG H N, WU D, et al. Key metabolism pathways and regulatory mechanisms of high polysaccharide yielding in Hericium erinaceus[J]. BMC Genomics, 2021, 22(1): 160.
[25] LI W, MA H L, HE R H, et al. Prospects and application of ultrasound and magnetic fields in the fermentation of rare edible fungi[J]. Ultrasonics Sonochemistry, 2021, 76:105613.
[26] 杨小冲, 陈忠军. 新型物理诱变技术在微生物育种中的应用进展[J]. 食品工业, 2017, 38(3):242-245.
YANG X C, CHEN Z J. Application progress of new microorganism physical mutation breeding technology[J]. The Food Industry, 2017, 38(3):242-245.
[27] 杨珊, 杨焱, 李巧珍, 等. 常压室温等离子体诱变筛选高产多糖猴头菌株的研究[J]. 上海农业学报, 2019, 35(5):6-11.
YANG S, YANG Y, LI Q Z, et al. Screening of high-yield polysaccharide Hericium erinareus by atmospheric and room temperature plasma mutagenesis[J]. Acta Agriculturae Shanghai, 2019, 35(5):6-11.
[28] 李欢琴, 王文磊, 王昭凯, 等. 低能离子束生物技术的应用[J]. 氨基酸和生物资源, 2016, 38(2):1-6.
LI H Q, WANG W L, WANG Z K, et al. Application of low energy ion beam biotechnology[J]. Amino Acids &Biotic Resources, 2016, 38(2):1-6.
[29] MALINOWSKA E, KRZYCZKOWSKI W,  APIENIS G, et al. Improved simultaneous production of mycelial biomass and polysaccharides by submerged culture of Hericium erinaceum: Optimization using a central composite rotatable design (CCRD)[J]. Journal of Industrial Microbiology &Biotechnology, 2009, 36(12):1513-1527.
APIENIS G, et al. Improved simultaneous production of mycelial biomass and polysaccharides by submerged culture of Hericium erinaceum: Optimization using a central composite rotatable design (CCRD)[J]. Journal of Industrial Microbiology &Biotechnology, 2009, 36(12):1513-1527.
[30] 汪敬健, 温鲁, 翁梁, 等. 不同碳、氮源对猴头菌菌丝体多糖含量的影响[J]. 食品科学, 2010, 31(1):149-151.
WANG J J, WEN L, WENG L, et al. Effects of different carbon and nitrogen sources on content of polysaccharide in liquid submerged-fermented mycelia and broth of Hericium erinaceus[J]. Food Science, 2010, 31(1):149-151.
[31] 信文娟, 肖毓, 董调亚, 等. 猴头菌深层发酵培养基筛选[J]. 食品与发酵科技, 2019, 55(3):64-67; 110.
XIN W J, XIAO Y, DONG D Y, et al. Selecting culture medium of Hericium erinaceusin in deep fermentation[J]. Food and Fermentation Sciences &Technology, 2019, 55(3):64-67; 110.
[32] 张筱梅, 朱维红, 苗晓燕. 猴头菌多糖罐批发酵种子培养及发酵条件优化[J]. 中国食用菌, 2012, 31(2):22-25.
ZHANG X M, ZHU W H, MIAO X Y. Cultivation of seeds and optimization of conditions for batch fermentation of Hericium erinaceus polysaccharide[J]. Edible Fungi of China, 2012, 31(2):22-25.
[33] 万宁威, 雷帮星, 何劲, 等. 猴头菌液体发酵产多糖、核苷、萜类工艺优化及其抗氧化活性[J]. 食品工业科技, 2022, 43(2):233-240.
WAN N W, LEI B X, HE J, et al. Optimization of polysaccharides, nucleosides and terpenes production from Hericium erinaceus by liquid fermentation and its antioxidant activity[J]. Science and Technology of Food Industry, 2022, 43(2):233-240.
[34] LI I C, LEE L Y, TZENG T T, et al. Neurohealth properties of Hericium erinaceus mycelia enriched with erinacines[J]. Behavioural Neurology, 2018, 2018:5802634.
[35] LU C C, HUANG W S, LEE K F, et al. Inhibitory effect of Erinacines A on the growth of DLD-1 colorectal cancer cells is induced by generation of reactive oxygen species and activation of p70S6K and p21[J]. Journal of Functional Foods, 2016, 21:474-484.
[36] KRZYCZKOWSKI W, MALINOWSKA E, HEROLD F. Erinacine A biosynthesis in submerged cultivation of Hericium erinaceum: Quantification and improved cultivation[J]. Engineering in Life Sciences, 2010, 10(5):446-457.
[37] LI I C, CHEN Y L, LEE L Y, et al. Evaluation of the toxicological safety of erinacine A-enriched Hericium erinaceus in a 28-day oral feeding study in Sprague-Dawley rats[J]. Food and Chemical Toxicology, 2014, 70:61-67.
[38] WOLTERS N, SCHABRONATH C, SCHEMBECKER G, et al. Efficient conversion of pretreated brewer’s spent grain and wheat bran by submerged cultivation of Hericium erinaceus[J]. Bioresource Technology, 2016, 222:123-129.
[39] LI W, ZHOU W, SONG S B, et al. Sterol fatty acid esters from the mushroom Hericium erinaceum and their PPAR transactivational effects[J]. Journal of Natural Products, 2014, 77(12):2611-2618.
[40] 杜娇. 猴头菌麦角甾醇高产发酵条件及提取工艺的研究[D]. 太谷: 山西农业大学, 2020.
DU J. Study on high-yield fermentation conditions and extraction technology of ergosterol from Hericium erinaceus[D].Taigu: Shanxi Agricultural University, 2020.
[41] 张忠, 吴迪, 王雨阳, 等. 猴头菌高产麦角甾醇液体发酵工艺优化[J]. 菌物学报, 2021, 40(8):2159-2170.
ZHANG Z, WU D, WANG Y Y, et al. Optimization of liquid fermentation process of ergosterol produced by Hericium erinaceus[J]. Mycosystema, 2021, 40(8):2159-2170.
[42] 蔡佳佳, 张岩, 邢春玉, 等. 猴头菌麦角甾醇高产菌株选育及深层培养条件的优化[J]. 食品安全导刊, 2016(21):119-123.
CAI J J, ZHANG Y, XING C Y, et al. Breeding of Hericium erinaceus ergosterol-producing strain and optimization of submerged culture conditions[J]. China Food Safety Magazine, 2016(21):119-123.
[43] ASADA C, OKUMURA R, SASAKI C, et al. Acceleration of Hericium erinaceum mycelial growth in submerged culture using yogurt whey as an alternative nitrogen source[J]. Advances in Bioscience and Biotechnology, 2012, 3(7):828-832.
[44] 戴肖东, 张介驰, 韩增华, 等. 十株野生猴头菌菌株的栽培性状及麦角甾醇含量[J]. 食用菌学报, 2014, 21(3):45-49.
DAI X D, ZHANG J C, HAN Z H, et al. Growth parameters and ergosterol content of mycelia and fruit bodies of ten Hericium erinaceus strains collected from the wild in Heilongjiang Province, China[J]. Acta Edulis Fungi, 2014, 21(3):45-49.
[45] 杜娇, 叶枫, 耿雪冉, 等. 猴头菌液体发酵产α-半乳糖苷酶工艺优化及其酶学性质[J]. 食用菌学报, 2019, 26(4):107-115.
DU J, YE F, GENG X R, et al. Process optimization for α-galactosidase produced by liquid fermentation of Hericium erinaceus and its enzymatic properties[J]. Acta Edulis Fungi, 2019, 26(4):107-115.
[46] KOBAYASHI S, HAMADA Y, YASUMOTO T, et al. Total syntheses and endoplasmic reticulum stress suppressive activities of hericenes A-C and their derivatives[J]. Tetrahedron Letters, 2018, 59(18):1733-1736.
[47] 汪锴, 陈保送, 宝丽, 等. 猴头菌属药用真菌活性次级代谢产物研究概况[J]. 菌物学报, 2015, 34(4):553-568.
WANG K, CHEN B S, BAO L, et al. A review of research on the active secondary metabolites of Hericium species[J]. Mycosystema, 2015, 34(4):553-568.
[48] ALSOUFI A S M, ![]() C, D
C, D UGOSZ M, et al. Influence of selected abiotic factors on triterpenoid biosynthesis and saponin secretion in marigold (Calendula officinalis L.) in vitro hairy root cultures[J]. Molecules, 2019, 24(16):2907.
UGOSZ M, et al. Influence of selected abiotic factors on triterpenoid biosynthesis and saponin secretion in marigold (Calendula officinalis L.) in vitro hairy root cultures[J]. Molecules, 2019, 24(16):2907.
[49] LU H Y, LIU S Y, ZHANG S L, et al. Light irradiation coupled with exogenous metal ions to enhance exopolysaccharide synthesis from Agaricus sinodeliciosus ZJU-TP-08 in liquid fermentation[J]. Journal of Fungi, 2021, 7(11):992.
[50] 高梦祥, 夏帆, 朱朋涛. 交变磁场对猴头菌生长及胞外多糖的影响[J]. 农业机械学报, 2009, 40(2):139-141; 90.
GAO M X, XIA F, ZHU P T. Influence of alternating magnetic field on growth and polysaccharide outside the cell of lions mane hericium[J]. Transactions of the Chinese Society for Agricultural Machinery, 2009, 40(2):139-141; 90.
[51] 朱莉萍, 马海乐, 陆敏, 等. 低频交变磁场对樟芝液态发酵的影响[J]. 现代食品科技, 2019, 35(8):153-159; 54.
ZHU L P, MA H L, LU M, et al. Effects of low-intensity alternating magnetic field on liquid fermentation of Antrodia camphorata[J]. Modern Food Science and Technology, 2019, 35(8):153-159; 54.
[52] 韦朝阳, 贺亮, 邵双双, 等. 外源添加物对食药用菌液体发酵影响的研究进展[J]. 食品科学, 2015, 36(7):245-250.
WEI C Y, HE L, SHAO S S, et al. A review on the effects of exogenous additives on submerged fermentation of edible and medicinal fungi[J]. Food Science, 2015, 36(7):245-250.
[53] DAI X D, ZHAN Y G, ZHANG J C, et al. Regulatory effect of salicylic acid and methyl jasmonate supplementation on ergosterol production in Hericium erinaceus mycelia[J]. Journal of Forestry Research, 2015, 26(1):71-77.
[54] OKUMURA R, NAKAMURA Y, SASAKI C, et al. Effects of Tween series and agar additives on mycelia biomass and β-glucan production by Hericium erinaceus in submerged culture[J]. Biomass Conversion and Biorefinery, 2023, 13(4):3135-3141.
[55] WANG K F, SUI K Y, GUO C, et al. Quorum sensing molecule-farnesol increased the production and biological activities of extracellular polysaccharide from Trametes versicolor[J]. International Journal of Biological Macromolecules, 2017, 104:377-383.
[56] WANG X L, ZHANG L L, CHEN N, et al. The effects of quorum sensing molecule farnesol on the yield and activity of extracellular polysaccharide from Grifola frondosa in liquid fermentation[J]. International Journal of Biological Macromolecules, 2021, 191:377-384.
[57] YANG J, HUANG Y, XU H Y, et al. Optimization of fungi co-fermentation for improving anthraquinone contents and antioxidant activity using artificial neural networks[J]. Food Chemistry, 2020, 313:126138.
[58] MA T W, LAI Y T, YANG F C. Enhanced production of triterpenoid in submerged cultures of Antrodia cinnamomea with the addition of citrus peel extract[J]. Bioprocess and Biosystems Engineering, 2014, 37(11):2251-2261.
[59] ZHANG B B, GUAN Y Y, HU P F, et al. Production of bioactive metabolites by submerged fermentation of the medicinal mushroom Antrodia cinnamomea: Recent advances and future development[J]. Critical Reviews in Biotechnology, 2019, 39(4):541-554.
[60] CHEN J, ZENG X, YANG Y L, et al. Genomic and transcriptomic analyses reveal differential regulation of diverse terpenoid and polyketides secondary metabolites in Hericium erinaceus[J]. Scientific Reports, 2017, 7:10151.