紫苏[Perilla frutescens(L.)Britt.],又名桂荏、赤苏、白苏、红苏等,为唇形科紫苏属下唯一种,一年生直立草本植物,具有药用和营养价值[1]。我国的紫苏资源丰富,广泛分布于河北、江苏、湖北、安徽等地。紫苏的种子可以加工成食用油或其他食物,其叶子常被用作中草药、蔬菜和香料[2]。紫苏叶性味辛温,具有发表、理气、散寒、和营的功效,临床主要用于风寒感冒、妊娠呕吐、咳嗽等症状,长期以来一直被用作天然中草药来治疗抑郁症、肿瘤、细菌感染、过敏和肠道疾病等各种疾病[3]。数千年来,紫苏叶在许多国家被广泛用于各种用途。在我国南方,常用紫苏叶来搭配各种海鲜菜肴以减轻对肠胃的刺激,夏季饮用苏叶水还可以解暑、增加食欲[4]。在日本和韩国,新鲜紫苏叶可直接食用,或制作各种菜肴,深受人们的喜爱。研究表明紫苏叶中不仅富含蛋白质、氨基酸、脂肪酸、矿物质、维生素等营养成分[5],还含有大量的次级代谢产物,包括萜类、黄酮类、苯丙素类等物质[6-7],这些活性成分具有抗菌、抗炎、抗氧化和抗肿瘤等多种药理作用[8]。同时,紫苏叶也是一种重要的天然香料,在食品和化妆品工业中发挥重要的作用。
紫苏叶作为多种活性化合物的潜在来源,已成为人们广泛关注的研究热点。因此,对紫苏叶的植物化学成分、生物活性进行全面系统的综述将有助于紫苏叶资源在食品、医药、化妆品等领域的开发应用。目前,国内外学者对紫苏叶化学成分和药理作用进行了大量的研究,但是对紫苏叶中化学成分的结构和生物活性作用机理进行系统总结的综述还较少,因此本工作全面系统地评价了紫苏叶中的活性成分、生物活性及其作用机制。此外,本文还介绍了在紫苏叶研究方面存在的不足以及今后的研究方向和发展趋势。
1 紫苏叶的生物活性成分
1.1 萜类
萜类化合物(terpenoids)是天然产物中数量最多的一类化合物,分布广泛、骨架庞杂,具有丰富的生物活性和药理作用。其分子结构以异戊二烯单元为基本骨架,除了以萜烃的形式存在外,还以各种含氧衍生物的形式存在,包括萜醇、萜醛、萜酮、萜羧酸及萜酯等[9]。相较于紫苏的其他部位,紫苏叶中萜类化合物的含量更高,目前从紫苏叶中分离得到70多种萜类化合物,主要有紫苏醛、紫苏酮、柠檬烯等(表1和图1)。萜类化合物是食品和化妆品行业重要的原料,目前从紫苏叶中分离得到多种结构独特的萜类化合物,但是这些化合物的应用大多缺乏深入的研究。

图1 紫苏叶中萜类化合物结构
Fig.1 Structure of terpenoids in Perilla leaves
表1 紫苏叶中萜类化合物
Table 1 Terpenoids in Perilla leaves
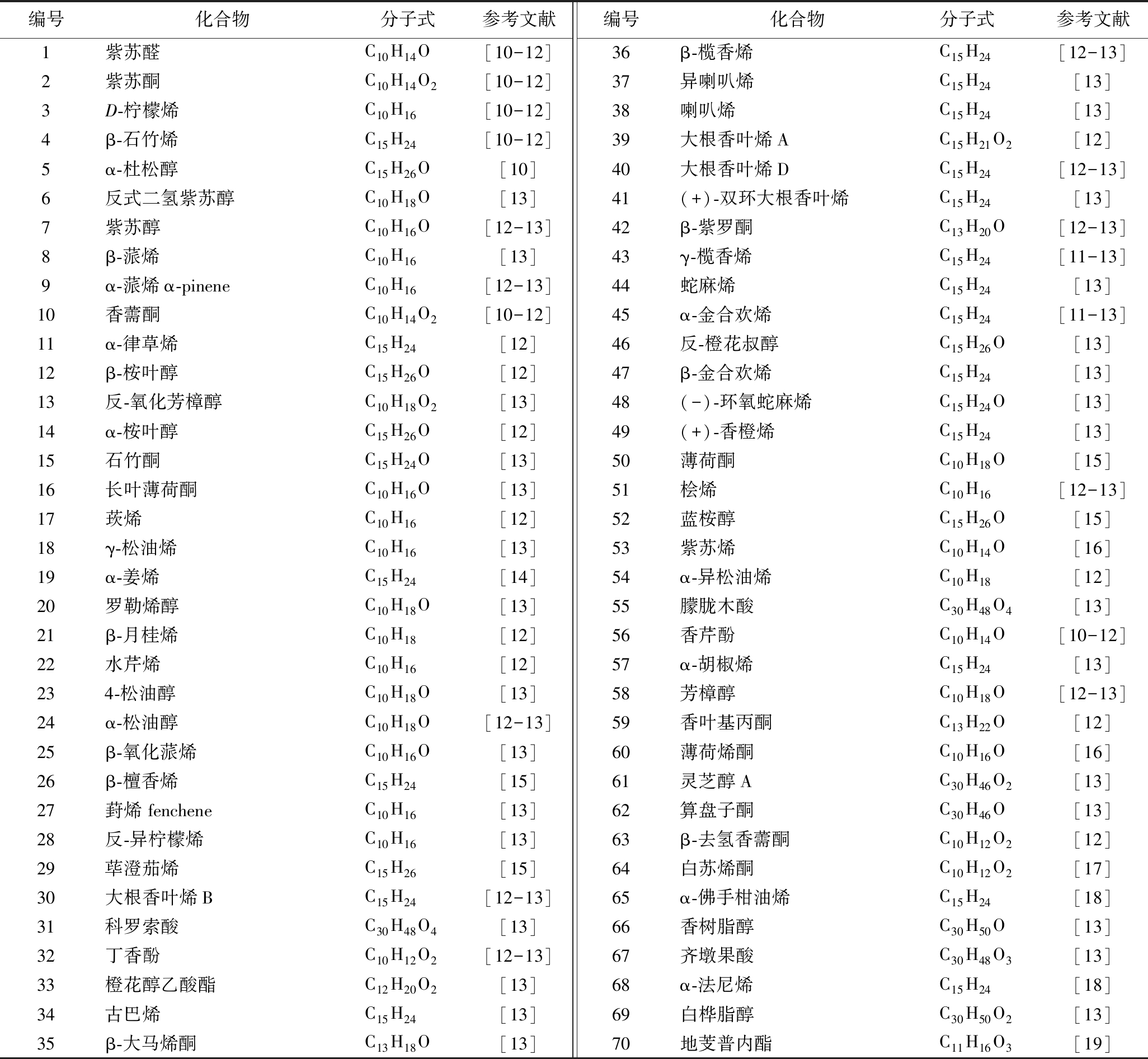
编号化合物分子式参考文献编号化合物分子式参考文献1紫苏醛C10H14O[10-12]36β-榄香烯C15H24[12-13]2紫苏酮C10H14O2[10-12]37异喇叭烯C15H24[13]3D-柠檬烯C10H16[10-12]38喇叭烯C15H24[13]4β-石竹烯C15H24[10-12]39大根香叶烯AC15H21O2[12]5α-杜松醇C15H26O [10]40大根香叶烯DC15H24[12-13]6反式二氢紫苏醇C10H18O[13]41(+)-双环大根香叶烯C15H24[13]7紫苏醇 C10H16O[12-13]42β-紫罗酮C13H20O[12-13]8β-蒎烯C10H16[13]43γ-榄香烯 C15H24[11-13]9α-蒎烯α-pineneC10H16[12-13]44蛇麻烯C15H24[13]10香薷酮C10H14O2[10-12]45α-金合欢烯 C15H24[11-13]11α-律草烯C15H24[12]46反-橙花叔醇C15H26O[13]12β-桉叶醇C15H26O[12]47β-金合欢烯C15H24[13]13反-氧化芳樟醇C10H18O2[13]48(-)-环氧蛇麻烯C15H24O[13]14α-桉叶醇C15H26O [12]49(+)-香橙烯C15H24[13]15石竹酮C15H24O[13]50薄荷酮C10H18O[15]16长叶薄荷酮C10H16O[13]51桧烯C10H16[12-13]17莰烯 C10H16[12]52蓝桉醇C15H26O[15]18γ-松油烯C10H16[13]53紫苏烯C10H14O[16]19α-姜烯C15H24[14]54α-异松油烯C10H18[12]20罗勒烯醇C10H18O[13]55朦胧木酸C30H48O4[13]21β-月桂烯C10H18[12] 56香芹酚 C10H14O[10-12]22水芹烯C10H16[12]57α-胡椒烯C15H24[13]234-松油醇C10H18O[13]58芳樟醇C10H18O[12-13]24α-松油醇C10H18O[12-13]59香叶基丙酮C13H22O [12]25β-氧化蒎烯C10H16O[13]60薄荷烯酮C10H16O[16]26β-檀香烯C15H24[15]61灵芝醇AC30H46O2[13]27葑烯 fencheneC10H16[13]62算盘子酮C30H46O[13]28反-异柠檬烯C10H16[13]63β-去氢香薷酮C10H12O2[12]29荜澄茄烯C15H26[15]64白苏烯酮C10H12O2[17]30大根香叶烯BC15H24[12-13]65α-佛手柑油烯C15H24[18]31科罗索酸C30H48O4[13]66香树脂醇C30H50O[13]32丁香酚C10H12O2[12-13]67齐墩果酸C30H48O3[13]33橙花醇乙酸酯C12H20O2[13]68α-法尼烯C15H24[18]34古巴烯C15H24[13]69白桦脂醇C30H50O2[13]35β-大马烯酮 C13H18O[13]70地芰普内酯C11H16O3[19]
1.2 黄酮类
黄酮类化合物属于低分子酚类化合物,是由2个苯环通过中央三碳原子(C6-C3-C6)相互连接而形成,作为一类重要的天然有机化合物广泛存在于自然界植物中[20]。在植物体内,黄酮类化合物大部分以碳糖基或糖苷类的形式存在,有一些则以游离形式存在。紫苏叶中含有大量的黄酮类化合物,从成熟的紫苏叶中已分离出20种黄酮类化合物(表2和图2)。黄酮类化合物具有多种生物学活性,包括保肝、抗炎、抗菌、抗氧化等作用,故被广泛应用于食品、医药、化妆品行业中[25]。

图2 紫苏叶中黄酮类化合物结构
Fig.2 Structure of flavonoid compounds in Perilla leaves
表2 紫苏叶中黄酮类成分
Table 2 Flavonoid in Perilla leaves

编号化合物分子式参考文献1芹菜素C15H10O5[21]2芹菜素-7-O-葡萄糖酸苷 C21H18O11[21]3芹菜素-7-O-双葡萄糖酸苷C27H26O17[21]4芹菜素-7-咖啡酰葡萄糖苷C30H17O14[21]5木犀草素C15H10O6[21]6木犀草素-7-葡萄糖酸苷 C21H18O12[21]7木犀草素-7-O-双葡萄糖酸苷C27H26O18[21]8木犀草素-7-咖啡酰葡萄糖苷C30H19O11[21]9金圣草黄素C16H12O2[15]10氯化花青苷C27H31ClO16[21]11高黄芩C15H10O6[22]12野黄芩苷C21H18O12[22]13高黄芩素-7-O-双葡萄糖酸苷C27H26O18[22]14蒙花苷C28H32O14[13]15槲皮素C15H10O7[22]168-羟基-6,7-二甲氧基黄烷酮C17H16O5[22]175-羟基-6,7-二甲氧基黄烷酮C17H16O5[22]18黄芩素-7-甲醚C16H12O5[23]19芦丁C27H30O16[24]205,8-二羟基-7-甲氧基黄烷酮C17H16O5[24]
1.3 苯丙素类
苯丙素类化合物是由苯环与3个直链碳连在一起为结构单元(C6-C3)的化合物,包括苯丙稀及其氧化程度不同的衍生物等[20],在药用植物成分中普遍存在。苯丙素类化合物在治疗或预防人类疾病方面发挥着重要的作用,包括癌症、肥胖、糖尿病、感染、心血管疾病等。LEE等[26]利用核磁共振波谱和液相色谱-质谱联用的方法从紫苏叶中检测出咖啡酸和迷迭香酸及其衍生物。除此以外,紫苏叶中还含有少量香豆素类、木脂素类化合物,但这些化学成分在紫苏叶的研究中鲜有报道,仍需相关学者进一步研究。具体见表3和图3。

图3 紫苏叶中苯丙素类化合物结构
Fig.3 Structure of phenylpropanoids in Perilla leaves
表3 紫苏叶中苯丙素类成分
Table 3 Phenylpropanoids in Perilla leaves

编号化合物分子式参考文献1迷迭香酸C18H16O8[27-28]2迷迭香酸甲酯C19H18O8[27-28]3迷迭香酸乙酯C20H20O8[27]4迷迭香酸-3-O-葡萄糖苷C24H26O13[27-28]5三甲氧基肉桂酸 C12H14O5[27-28]6苯丙酸C9H10O2[27]7阿魏酸C10H10O4[27-28]8阿魏酸甲酯C11H12O4[27-28]9咖啡酸C9H8O4[28]10咖啡酸甲酯C10H10O4[28]11咖啡酸乙酯C11H12O4[28]123-咖啡酰奎宁酸C16H18O9[28]13丹参素C9H10O5[28]14反式对羟基桂皮酸C9H8O3[28]156,7-二羟基香豆素C9H6O4[29]
1.4 其他
紫苏叶中活性成分复杂多样,还含有甾体化合物、芳香族化合物、多糖等多种活性成分。目前,已经从紫苏叶中分离出来β-谷甾醇、20-异戊基-孕甾-3β,14α-二醇、胡萝卜苷及豆甾醇等甾体化合物[30],且此类化合物具有一定的抗氧化活性和镇静作用[24]。此外,KWON等[31]采用热水提取和乙醇沉淀等步骤从紫苏叶中提取分离得到粗多糖。紫苏叶多糖的分析是研究紫苏叶中活性成分的一个重要环节,对于紫苏叶多糖的结构解析还有待进一步研究。
由于紫苏叶中存在大量结构新颖、活性独特的化合物,从紫苏叶中寻找具有药用价值的天然化学成分成为越来越多研究者关注的热点。但目前的研究还存在很多不足,紫苏叶中只有部分化合物的结构被分离和鉴定,仍有大量的化学成分(多糖、醌类化合物)需要被表征。
2 紫苏叶中活性成分的生物活性
2.1 抗氧化活性
黄酮类和酚酸类成分被认为是植物中的基本抗氧化物质,可以显著抑制上皮细胞诱导的低密度脂蛋白或偶氮自由基氧化,增加上皮细胞中抗氧化酶和蛋白表达水平[32]。研究表明,从紫苏叶中提取的黄酮类物质对羟自由基和DPPH自由基均有较好的清除能力,半数抑制浓度(inhibitory concentration of a substance,IC50)分别为0.130、0.032 mg/mL[33]。ZHOU等[34]实验发现紫苏叶中迷迭香酸的质量浓度为10 μg/mL时,DPPH自由基的清除率达到88.3%。王月等[35]采用超声辅助法从紫苏叶中提取花色苷,发现紫苏叶花色苷对ABTS阳离子自由基、羟自由基和DPPH自由基的清除率分别为47.85%、51.27%和84.42%。此外,从紫苏叶中分离得到以β-糖苷键为主的多糖,测得其对DPPH自由基的IC50值为27.07 μg/mL,表明紫苏叶多糖具有良好的抗氧化活性[36]。然而,紫苏叶中有效成分的抗氧化活性作用机制仍尚待发现,需进一步研究。
2.2 抑菌活性
紫苏叶中黄酮类物质能够抑制细菌、真菌的生长,具有一定的抗菌作用。张蕾蕾[37]通过乙醇、白醋分别提取紫苏叶中的黄酮类化合物,并比较了它们对寿司携带菌的抑菌作用,结果发现2种溶剂提取的黄酮对大肠杆菌的最低抑菌浓度(minimum inhibitory concentration,MIC)分别为65 μg/mL和50 μg/mL,对匍枝根霉的MIC分别是55 μg/mL和45 μg/mL,而且以白醋作为溶剂提取得到的黄酮类物质抑菌率最高可达到81.7%。郭群群等[38]也发现,从紫苏叶中分离的木犀草素(1 mg/mL)具有良好的抗菌作用,对金黄色葡萄球菌、大肠杆菌的抑菌圈直径分别为24、16 mm。此外,研究发现紫苏叶挥发油对化脓性链球菌、假结核棒状杆菌具有持续的抑菌效果,其主要成分紫苏醛与多糖联用时具有广谱抑菌性[30]。刘小琴等[39]的研究表明,紫苏叶的水提取物和乙醇提取物对念珠菌具有较好的抑制作用。因此,对紫苏叶提取物中的抑菌活性成分进一步采取活性成分跟踪和分离分析相结合的方法,将可能发现高效的天然活性抑菌物质,为植物中抗菌物质的研究开发提供新资源。
2.3 抗炎活性
紫苏叶中萜类、黄酮类和苯丙素类化合物是主要的抗炎活性物质。研究结果表明,用不同浓度乙醇和甲醇提取的紫苏叶中活性成分对特异性皮炎、结肠炎和肾炎均具有广泛的抑制作用[40]。LIM等[41]研究发现紫苏叶中的肉豆蔻醚和榄香素能够浓度依赖性地抑制肺泡上皮细胞A549产生白细胞介素(interleukin,IL)-6,说明紫苏叶醇提物对肺炎促炎因子的形成具有抑制作用。XU等[42]评估了紫苏醛对大鼠脑缺血再灌注损伤的影响,发现灌胃给药后大鼠的一氧化氮(NO)水平、诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)活性、炎症细胞因子的表达均显著下降,揭示了紫苏醛是通过调节炎症反应来减轻大鼠大脑皮层的脑缺血再灌注损伤的。此外,王宇宁等[19]对紫苏叶乙醇提取物进行分离纯化得到的各单体化合物进行体外抗炎活性实验,结果显示化合物2在浓度为80 μmol/L时可以显著抑制iNOS的蛋白表达,表现出一定的抗炎活性。综合目前的研究报道,紫苏醛和肉豆蔻醚可能是紫苏叶中发挥抗炎作用的主要成分,然而活性化合物的潜在靶标和作用机制仍需进一步的探索研究。具体见表4。
表4 抗炎机制
Table 4 Anti-inflammatory mechanism

细胞/动物模型作用机制参考文献RAW264.7细胞紫苏叶中的萜类化合物显著抑制 iNOS 蛋白和环氧合酶-2(cyclooxygenase-2,COX-2)蛋白的表达[19]大鼠大脑中动脉阻塞模型紫苏醛通过调节大鼠大脑皮层Akt/JNK信号通路抑制缺血再灌注脑损伤细胞凋亡[42]肝癌细胞HepG2紫苏水提物下调IL-6诱导的HepG2细胞中Stat3的磷酸化水平,阻断IL-6/IL-6R结合,抑制IL-6生物活性[43]RBL-2H3细胞紫苏叶提取物通过靶向酪氨酸蛋白激酶Syk及其下游炎症途径减轻过敏性炎症症状[44]硫酸葡聚糖诱导小鼠结肠炎模型紫苏醛抑制硫酸菌聚糖诱导的促炎细胞因子和结肠中基质金属蛋白酶9的表达,调节改善结肠炎[45]人角膜上皮细胞紫苏醛降低了人角膜上皮细胞中IL-1β、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、IL-6、β葡聚糖受体抗体(Dectin-1)和髓过氧化酶(myeloperoxidase, MPO)水平[46]
2.4 抗肿瘤活性
近年来,国内外学者发现紫苏叶中的化合物具有抗肿瘤活性,其中紫苏叶挥发油中的活性成分与乳腺癌、肺癌、肝癌等多种肿瘤发病率的降低密切相关[47]。WANG等[48]研究发现紫苏叶中的异白苏烯酮降低了肝癌细胞(Huh-7)的活性和肿瘤的体积及质量,并推测抗癌作用是通过阻断PI3K/Akt信号通路发挥的。袁芃等[49]从紫苏叶中分离出的萜类化合物能够明显抑制肺癌细胞(LTEP-α-2)的增长,其活性物的最佳抑制浓度为20~30 mg/mL。体外细胞实验[50]发现紫苏叶中的萜类成分紫苏醇可以诱导癌细胞凋亡,且紫苏醇的浓度越高抑制癌细胞生长的能力越强。综上所述,紫苏叶中多种生物活性成分对不同肿瘤细胞均具有抑制作用,其中紫苏醇作为紫苏叶挥发油的主要成分,表现尤为突出。近年来癌症发病态势持续走高,寻找天然高效的药物具有较大研究价值,随着对紫苏叶中活性成分的抗癌活性及其作用机制的不断深入研究,有望开发出应用于治疗多种恶性肿瘤的新型药物。具体见表5。
表5 抗肿瘤机制
Table 5 Anti-tumor mechanism

细胞/动物模型作用机制参考文献人肺癌细胞LTEP-α-2紫苏叶挥发油抑制小分子G蛋白的异戊二烯化,提高转化生长因子-β(transforming growth factor-β,TGF-β)的活性使LTEP-α-2细胞凋亡[49]人乳腺癌细胞系MDA-MB 435紫苏醇抑制小G蛋白RhoA的异戊二烯化[50]Hras128大鼠模型D-柠檬烯抑制小G蛋白p21 ras的异戊二烯化[51]雌性ICR小鼠皮肤模型三萜酸通过抑制蛋白激酶C(protein kinase C,PKC)信号通路,减少乳头状瘤的数量[52]人前列腺癌细胞系LNCaP紫苏醇通过抑制LNCaP细胞中雄激素受体蛋白的表达,对癌细胞进行干预 [53]
2.5 其他
紫苏叶除具上述活性作用外,还具有抗抑郁、降血糖、免疫调节等作用。紫苏醛可以抑制和调节NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3),减轻慢性不可预测的轻度应激诱导的抑郁行为[54]。此外,研究表明益生菌发酵紫苏叶可以增强α-葡萄糖苷酶的抑制能力,α-葡萄糖苷酶得到抑制可延迟碳水化合物消化和葡萄糖吸收,从而降低餐后血糖水平,达到缓解糖尿病及其并发症的目的[55]。PHROMNOI等[56]研究发现富含木犀草素和黄芩素的紫苏叶正己烷组分(Perilla leaf hexane fraction,PLH)具有抑制破骨细胞分化和促进成骨细胞增殖的功能,表明PLH可能是一种潜在的骨质疏松症预防和治疗药物,但需要更广泛的生理病理学研究以确认PLH在治疗骨病方面的疗效。
3 结论和展望
紫苏作为一种传统的药用和食用植物,越来越受到研究者的重视。除了富含必需营养素外,它还含有多种生物活性化合物,如萜类、黄酮类、苯丙素类、甾体和植物多糖。这些生物活性化合物具有良好的抗炎、抑菌、抗氧化、抗肿瘤等活性。此外,紫苏叶还可以用作色素、香料、防腐剂等,有巨大的开发价值。本文综述了紫苏叶中的生物活性物质,并对分离出的化学物质结构进行了总结。实验和临床研究已经证实,紫苏叶中的活性成分具有治疗潜力,副作用较小。然而,仍有一些问题需要进一步研究。a)紫苏叶中的活性成分结构复杂,种类繁多,对其分离纯化较难,在天然植物活性成分研究和应用方面给人们带来许多挑战。b)紫苏叶中植物化学成分的生物活性和作用机制尚未完全清楚,且大多停留在实验室基础研究阶段,缺乏关于活性物质应用评价的研究报道。c)综合以往研究发现,紫苏叶中化学成分有待国内外学者进一步探索,尤其是紫苏叶中多糖的化学结构。因此,进一步分析紫苏叶中的活性成分结构具有重要的研究意义。
[1] 钱锦秀, 孟武威, 刘晖晖, 等. 经典名方中紫苏类药材的本草考证[J]. 中国实验方剂学杂志, 2022, 28(10):55-67.
QIAN J X, MENG W W, LIU H H, et al. Textual research on perillae in famous classical formulas[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(10):55-67.
[2] JIANG T, GUO K Y, LIU L D, et al. Integrated transcriptomic and metabolomic data reveal the flavonoid biosynthesis metabolic pathway in Perilla frutescens (L.) leaves[J]. Scientific Reports, 2020, 10:16207.
[3] JEON I, KIM H, KANG H, et al. Anti-inflammatory and antipruritic effects of luteolin from Perilla (P. frutescens L.) leaves[J]. Molecules, 2014, 19(6):6941-6951.
[4] ROUPHAEL Y, KYRIACOU M C, CARILLO P, et al. Chemical eustress elicits tailored responses and enhances the functional quality of novel food Perilla frutescens[J]. Molecules, 2019, 24(1):185.
[5] 王仙萍, 商志伟, 沈奇, 等. 两种紫苏叶主要营养及药用成分评价[J]. 植物生理学报, 2021, 57(7):1419-1426.
WANG X P, SHANG Z W, SHEN Q, et al. The nutritional and medicinal component evaluation of two Perilla (Perilla frutescens) leaves[J]. Plant Physiology Journal, 2021, 57(7):1419-1426.
[6] 张欣蕊, 冯启鑫, 安绮沄, 等. 基于Web of Science紫苏研究进展与态势分析[J]. 中国农学通报, 2022, 38(4):144-152.
ZHANG X R, FENG Q X, AN Q Y, et al. Research progress and status of Perilla frutescens based on web of science[J]. Chinese Agricultural Science Bulletin, 2022, 38(4):144-152.
[7] FUJIWARA Y, KONO M, ITO A, et al. Anthocyanins in perilla plants and dried leaves[J]. Phytochemistry, 2018, 147:158-166.
[8] ERHUNMWUNSEE F, PAN C, YANG K L, et al. Recent development in biological activities and safety concerns of perillaldehyde from perilla plants: A review[J]. Critical Reviews in Food Science and Nutrition, 2022, 62(23):6328-6340.
[9] 钟萍, 汪镇朝, 刘英孟, 等. 紫苏叶挥发油化学成分及其药理作用研究进展[J]. 中国实验方剂学杂志, 2021, 27(13):215-225.
ZHONG P, WANG Z C, LIU Y M, et al. Advances on chemical constituents of essential oils from perillae folium and their pharmacological effect: A review[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(13):215-225.
[10] 亢倩丽, 李壮壮, 范珊珊, 等. 基于UPLC-Q-Exactive-Orbitrap-MS的紫苏叶与紫苏梗化学成分分析[J]. 中国实验方剂学杂志, 2020, 26(13):156-162.
KANG Q L, LI Z Z, FAN S S, et al. Qualitative analysis on Perilla frutescens leaves and stalks by UPLC-Q-exactive-orbitrap-MS[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(13):156-162.
[11] 张辰露, 梁宗锁, 吴三桥, 等. 不同方法提取紫苏叶挥发油成分GC-MS分析[J]. 中药材, 2016, 39(2):337-341.
ZHANG C L, LIANG Z S, WU S Q, et al. GC-MS analysis of volatile oil from perilla leaves extracted by different methods[J]. Journal of Chinese Medicinal Materials, 2016, 39(2):337-341.
[12] 魏长玲, 张琛武, 郭宝林, 等. 紫苏叶挥发油组分和化学型影响因素探究Ⅱ-叶片不同成熟度[J]. 中国现代中药, 2017, 19(8):1170-1175;1186.
WEI C L, ZHANG C W, GUO B L, et al. Research on influencing factors of chemotype and components of Perilla frutescens leaf volatile oil Ⅱ: Different leaf maturity[J]. Modern Chinese Medicine, 2017, 19(8):1170-1175;1186.
[13] 向福, 江安娜, 项俊, 等. 四种紫苏叶挥发油化学成分GC-MS分析[J]. 食品研究与开发, 2015, 36(13):90-94.
XIANG F, JIANG A N, XIANG J, et al. Study on chemical compositions of volatile oils from four kinds of perilla leaves by GC-MS[J]. Food Research and Development, 2015, 36(13):90-94.
[14] RAD CSI P, S
CSI P, S ROSI S, SZOMOR L
ROSI S, SZOMOR L  , et al. Comparison of the production and chemical constituents of five Perilla frutescens (L.) britt. accessions[J]. Acta Biologica Hungarica, 2017, 68(4):453-465.
, et al. Comparison of the production and chemical constituents of five Perilla frutescens (L.) britt. accessions[J]. Acta Biologica Hungarica, 2017, 68(4):453-465.
[15] 雷殷. 中药紫苏叶挥发油的提取与气相色谱分析[D]. 长春: 吉林大学, 2006.
LEI Y. Extraction and gas chromatography analysis of volatile oil from perilla leaves[D].Changchun: Jilin University, 2006.
[16] 古建兰, 任久强, 韦雪娇, 等. 紫苏不同器官活性成分分布及功能性分析研究进展[J]. 北方农业学报, 2021, 49(5):118-126.
GU J L, REN J Q, WEI X J, et al. Research progress on the distribution and functional analysis of active components in Perilla frutescens(L.)Britt organs[J]. Journal of Northern Agriculture, 2021, 49(5):118-126.
[17] KANG R, HELMS R, STOUT M J, et al. Antimicrobial activity of the volatile constituents of Perilla frutescens and its synergistic effects with polygodial[J]. Journal of Agricultural and Food Chemistry, 1992, 40(11):2328-2330.
[18] 李珊珊, 郑开斌, 杨敏, 等. 漳州地区产紫苏叶挥发油成分GC-MS分析[J]. 中药材, 2018, 41(7):1633-1636.
LI S S, ZHENG K B, YANG M, et al. GC-MS analysis of essential oil from Perilla frutescens leaves in Zhangzhou area[J]. Journal of Chinese Medicinal Materials, 2018, 41(7):1633-1636.
[19] 王宇宁, 樊晖, 梁克利. 紫苏叶化学成分及其体外抗炎活性[J]. 中成药, 2021, 43(6):1500-1503.
WANG Y N, FAN H, LIANG K L. Chemical constituents from the leaves of Perilla frutescens and their anti-inflammatory activities in vitro[J]. Chinese Traditional Patent Medicine, 2021, 43(6):1500-1503.
[20] 裴月湖, 娄红祥. 天然药物化学[M]. 7版. 北京: 人民卫生出版社, 2016.
[21] 张运晖, 赵瑛, 欧巧明. 紫苏叶化学成分及生物活性研究进展[J]. 甘肃农业科技, 2020(12):69-76.
ZHANG Y H, ZHAO Y, OU Q M. Research progress on chemical constituents and biological activities of Folium Perillae[J]. Gansu Agricultural Science and Technology, 2020(12):69-76.
[22] 霍立娜, 王威, 刘洋, 等. 紫苏叶化学成分研究[J]. 中草药, 2016, 47(1):26-31.
HUO L N, WANG W, LIU Y, et al. Chemical constituents from leaves of Perilla frutescens[J]. Chinese Traditional and Herbal Drugs, 2016, 47(1):26-31.
[23] AHMED H M, TAVASZI-SAROSI S. Identification and quantification of essential oil content and composition, total polyphenols and antioxidant capacity of Perilla frutescens (L.) Britt[J]. Food Chemistry, 2019, 275:730-738.
[24] 黄亮辉. 紫苏化学成分药材质量分析研究[D]. 西安: 西北大学, 2011.
HUANG L H. Study on quality analysis of chemical constituents of Perilla frutescens[D].Xi'an: Northwest University, 2011.
[25] 张蕾蕾, 常雅宁, 夏鹏竣, 等. 微波法提取紫苏黄酮类物质及其成分分析[J]. 食品科学, 2012, 33(22):53-57.
ZHANG L L, CHANG Y N, XIA P J, et al. Microwave-assisted extraction and composition analysis of flavonoids from Perilla frutescens leaves[J]. Food Science, 2012, 33(22):53-57.
[26] LEE J H, CHO Y. Assessment of phenolic profiles from various organs in different species of Perilla plant (Perilla frutescens (L.) Britt.) and their antioxidant and enzyme inhibitory potential[J]. Industrial Crops and Products, 2021, 171:113914.
[27] 闫钰. 紫苏叶的质量标准研究[D]. 北京: 中国中医科学院, 2021.
YAN Y. Study on quality standard of perillae foilum[D].Beijing: China Academy of Chinese Medical Sciences, 2021.
[28] 陈永康, 赵志刚, 孙丽娟. 液相色谱-飞行时间质谱法快速鉴定紫苏叶中的化学成分[J]. 医药导报, 2013, 32(3):371-374.
CHEN Y K, ZHAO Z G, SUN L J. Rapid identification of chemical constituents in perilla leaves by liquid chromatography-time-of-flight mass spectrometry[J]. Herald of Medicine, 2013, 32(3):371-374.
[29] 周勤梅, 朱德伟, 罗孟兰, 等. 紫苏属植物的化学成分及其生物活性研究进展[J]. 中华中医药学刊, 2019, 37(8):1826-1831.
ZHOU Q M, ZHU D W, LUO M L, et al. Advances in studies on chemical constituents in plants from perilla and their bioactivities[J]. Chinese Archives of Traditional Chinese Medicine, 2019, 37(8):1826-1831.
[30] 孙也评.紫苏叶提取物及其有效成分的抗菌活性研究[C]. 延边朝鲜族自治州:延边大学,2014.
SUN Y P. Study on the antibacterial activity of extracts of Perilla frutescens and its active ingredients[C]. Yanbian University, 2014.
[31] KWON K H, KIM K I, JUN W J, et al. In vitro and in vivo effects of macrophage-stimulatory polysaccharide from leaves of Perilla frutescens var. crispa[J]. Biological and Pharmaceutical Bulletin, 2002, 25(3):367-371.
[32] 何育佩, 郝二伟, 谢金玲, 等. 紫苏药理作用及其化学物质基础研究进展[J]. 中草药, 2018, 49(16):3957-3968.
HE Y P, HAO E W, XIE J L, et al. Research process on pharmacological effect and substance basis of Perilla frutescens[J]. Chinese Traditional and Herbal Drugs, 2018, 49(16):3957-3968.
[33] 刘宁, 仇农学, 田玉霞. 超声辅助提取紫苏叶黄酮及其清除自由基作用研究[J]. 西北林学院学报, 2008, 23(1):158-161.
LIU N, QIU N X, TIAN Y X. Ultrasonic-aided extraction of flavonoids from Perilla frutescens(L.) britt leaves and evaluation for free-radical scavenging[J]. Journal of Northwest Forestry University, 2008, 23(1):158-161.
[34] ZHOU X J, YAN L L, YIN P P, et al. Structural characterisation and antioxidant activity evaluation of phenolic compounds from cold-pressed Perilla frutescens var. arguta seed flour[J]. Food Chemistry, 2014, 164:150-157.
[35] 王月, 赵彦巧, 李建颖. 超声辅助提取紫苏叶花色苷及其抗氧化活性研究[J]. 食品研究与开发, 2022, 43(4):128-135.
WANG Y, ZHAO Y Q, LI J Y. Ultrasonic-assisted extraction of anthocyanins from perilla leaves and antioxidant activity analysis[J]. Food Research and Development, 2022, 43(4):128-135.
[36] 张红娇. 紫苏多糖的分离纯化、结构表征及应用研究[D]. 太原: 中北大学, 2022.
ZHANG H J. Isolation, purification, structural characterization and application of perilla polysaccharide[D].Taiyuan: North University of China, 2022.
[37] 张蕾蕾. 紫苏黄酮的提取分离及其应用研究[D]. 上海: 华东理工大学, 2012.
ZHANG L L. Extraction, separation and application of flavonoids from Perilla frutescens[D].Shanghai: East China University of Science and Technology, 2012.[知网]
[38] 郭群群, 杜桂彩, 李荣贵, 等. 紫苏抗菌活性成分的研究[J]. 高等学校化学学报, 2006, 27(7):1292-1294.
GUO Q Q, DU G C, LI R G, et al. Studies on antibacterial constituents of Perilla frutescens[J]. Chemical Journal of Chinese Universities, 2006, 27(7):1292-1294.
[39] 刘小琴, 万福珠, 郑世玲. 紫苏、白苏的抑菌实验[J]. 天然产物研究与开发, 2000, 12(1):42-45.
LIU X Q, Wan F Z, ZHENG S L. Effects of anti-bacteria and fungus of Perilla frutescens(l.) britton in vitro[J]. Natural Product Research and Development, 2000, 12(1):42-45.
[40] 杨慧, 马培, 林明宝, 等. 紫苏叶化学成分、抗炎作用及其作用机制研究进展[J]. 中国药理学与毒理学杂志, 2017, 31(3):279-286.
YANG H, MA P, LIN M B, et al. Research progress in chemical constituents, anti-inflammatory effect and mechanism of Folium Perillae[J]. Chinese Journal of Pharmacology and Toxicology, 2017, 31(3):279-286.
[41] LIM H J, WOO K W, LEE K R, et al. Inhibition of proinflammatory cytokine generation in lung inflammation by the leaves of Perilla frutescens and its constituents[J]. Biomolecules &Therapeutics, 2014, 22(1):62-67.
[42] XU L X, LI Y B, FU Q, et al. Perillaldehyde attenuates cerebral ischemia-reperfusion injury-triggered overexpression of inflammatory cytokines via modulating Akt/JNK pathway in the rat brain cortex[J]. Biochemical and Biophysical Research Communications, 2014, 454(1):65-70.
[43] 史继静, 刘朝奇, 高明星, 等. 紫苏水提物对白细胞介素6与其受体结合的拮抗作用(英文)[J]. 中国新药与临床杂志, 2009, 28(9):703-708.
SHI J J,LIU C Q,GAO M X, et al. Inhibition of aqueous extract of Perilla frutescens leaves on interleukin-6/interleukin-6 receptor binding[J]. Chinese Journal of New Drugs and Clinical Remedies, 2009, 28(9):703-708.
[44] YANG H, SUN W, MA P, et al. Multiple components rapidly screened from perilla leaves attenuate asthma airway inflammation by synergistic targeting on syk[J]. Journal of Inflammation Research, 2020, 13:897-911.
[45] UEMURA T, YASHIRO T, ODA R, et al. Intestinal anti-inflammatory activity of perilla ldehyde[J]. Journal of Agricultural and Food Chemistry, 2018, 66(13):3443-3448.
[46] FAN Y Q, LI C, PENG X D, et al. Perillaldehyde ameliorates Aspergillus fumigatus keratitis by activating the Nrf2/HO-1 signaling pathway and inhibiting dectin-1-mediated inflammation[J]. Investigative Opthalmology &Visual Science, 2020, 61(6):51.
[47] HA J Y, YI G, BAE H H, et al. Isolation, identification, and apoptosis activity of the photosensitizer methyl pheophorbide A from Perilla frutescens leaves[J]. Applied Biological Chemistry, 2022, 65(1):1-9.
[48] WANG Y, HUANG X X, HAN J M, et al. Extract of Perilla frutescens inhibits tumor proliferation of HCC via PI3K/AKT signal pathway[J]. African Journal of Traditional, Complementary, and Alternative Medicines: AJTCAM, 2012, 10(2):251-257.
[49] 袁芃, 牛晓涛, 宋梦薇, 等. 紫苏挥发油对人肺癌细胞的体外抑制作用研究[J]. 食品科技, 2017, 42(2):235-238.
YUAN P, NIU X T, SONG M W, et al. The inhibitory effect of the essential oil from Folium Perillae on human lung cancer cells in vitro[J]. Food Science and Technology, 2017, 42(2):235-238.
[50] WAGNER J E, HUFF J L, RUST W L, et al. Perillyl alcohol inhibits breast cell migration without affecting cell adhesion[J]. Journal of Biomedicine &Biotechnology, 2002, 2(3):136-140.
[51] ASAMOTO M, OTA T, TORIYAMA-BABA H, et al. Mammary carcinomas induced in human c-ha-ras proto-oncogene transgenic rats are estrogen-independent, but responsive to d-limonene treatment[J]. Japanese Journal of Cancer Research, 2002, 93(1):32-35.
[52] BANNO N, AKIHISA T, TOKUDA H, et al. Triterpene acids from the leaves of Perilla frutescens and their anti-inflammatory and antitumor-promoting effects[J]. Bioscience, Biotechnology, and Biochemistry, 2004, 68(1):85-90.
[53] CHUNG B H, LEE H Y, LEE J S, et al. Perillyl alcohol inhibits the expression and function of the androgen receptor in human prostate cancer cells[J]. Cancer Letters, 2006, 236(2):222-228.
[54] SONG Y C, SUN R X, JI Z Y, et al. Perilla aldehyde attenuates CUMS-induced depressive-like behaviors via regulating TXNIP/TRX/NLRP3 pathway in rats[J]. Life Sciences, 2018, 206:117-124.
[55] WANG Z X, JIN X M, ZHANG X C, et al. From function to metabolome: Metabolomic analysis reveals the effect of probiotic fermentation on the chemical compositions and biological activities of Perilla frutescens leaves[J]. Frontiers in Nutrition, 2022, 9: 933193.
[56] PHROMNOI K, YODKEEREE S, PINTHA K, et al. Anti-osteoporosis effect of Perilla frutescens leaf hexane fraction through regulating osteoclast and osteoblast differentiation[J]. Molecules, 2022, 27(3):824.