麦角甾醇又称麦角固醇,是真菌细胞膜的关键功能成分,对膜结构的完整性、膜的通透性、膜结合酶的活性、细胞活力以及物质运输等起着重要作用[1-2]。研究表明麦角甾醇具有多种药理功能,包括预防心血管疾病、抗氧化、抗肿瘤、降血脂、抗炎、利尿等功效[3-4];麦角甾醇是重要的医药化工原料,用于生产可的松、芸苔素内酯、激素黄体酮等类固醇药物[5];麦角甾醇也是脂溶性维生素D2的前体,经紫外线照射后转化为维生素D2[6],可当作饲料添加剂增加畜禽的产蛋率和孵化率。目前,通过微生物发酵技术制备麦角甾醇的研究已有报道[7],但发酵产物中麦角甾醇含量低限制了其在相关领域的应用。而采用大型真菌在中草药液体环境中发酵的方法作为一种新型蕈菌发酵技术,已在该领域得到越来越多学者的关注。
羊肚菌(Morchella esculenta)是一种药食两用的珍稀真菌,富含多糖、多酚、甾醇、脂肪酸、氨基酸、维生素等成分,具有抗氧化、抗肿瘤、降血脂、免疫调节、保肝护肾等功效[8-9],具备进行活性物质开发的潜质。近年来我国羊肚菌产业化发展迅猛,已研制出饮品、食品以及保健品等相关精深加工产品[10],但其产品的开发还有很大的空间。由于羊肚菌栽培条件复杂,技术不稳定,尚难以真正实现产业化生产,目前,液体发酵成为该菌的重要开发途径[11]。液体发酵能提供必需营养物质供其生长代谢,且培养条件易控,生产周期短,产量稳定,发酵液和菌丝体营养物质含量丰富,从中提取各类营养成分和活性物质,制成高附加值的食品、药品等,能有效缓解子实体资源短缺的问题,且节约成本,提升生产效率[12-13]。目前,有关羊肚菌液体发酵产麦角甾醇的研究鲜有报道。
为此,本试验拟以6种甘肃道地中草药为试材,探究其对羊肚菌液体发酵麦角甾醇的影响,试图通过其协同作用,筛选出对羊肚菌生长和麦角甾醇产量有促进作用的中草药种类及适宜添加量,并通过发酵工艺优化,建立羊肚菌在中草药液体环境中的发酵体系,以期提高羊肚菌液体发酵产麦角甾醇的技术水平,为麦角甾醇在功能性食品和药品的开发提供优质资源。
1 材料与方法
1.1 材料与仪器
菌株:羊肚菌CICC14033,中国工业微生物菌种保藏管理中心。
中草药:党参、红芪、甘草、当归、柴胡、板蓝根,兰州复兴厚药材有限责任公司。
试剂:麦角甾醇标准品,上海源叶生物科技有限公司。
仪器:Agilent 1260高效液相色谱仪,美国安捷伦公司。
1.2 中草药提取液的制备[14]
分别称取200 g中草药,加水600 mL浸泡30 min,然后用文火熬煮30 min,4层纱布过滤,再将药渣加水400 mL熬煮一遍过滤,将两遍滤液混合定容到1 L,即制得质量浓度为200 g/L的中草药提取液。可逐级稀释得到试验添加浓度的提取液[提取液中还原糖含量用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定,多糖含量用苯酚-硫酸法测定[15]]。
1.3 培养基
PDA培养基(g/L):马铃薯200,葡萄糖20,琼脂20。
PDB培养基(g/L):马铃薯200,葡萄糖20。
基础发酵培养基:葡萄糖20 g、蛋白胨5 g、KH2PO41 g、MgSO4·7H2O 0.5 g、维生素B110 mg、蒸馏水1 L。
中草药发酵培养基:在基础发酵培养基中,根据试验设计情况添加各中草药提取液的量(中草药发酵培养基葡萄糖加入量=基础发酵培养基中葡萄糖量-中草药提取液还原糖的量)。
1.4 中草药深层发酵培养
1.4.1 种子液制备
在无菌条件下,将活化好的菌株挑取3块(0.5 cm×0.5 cm)接种于PDB培养基中(250 mL三角瓶装液量100 mL),置于25 ℃、160 r/min振荡培养4 d,即得种子液。
1.4.2 深层发酵培养
在无菌条件下,将培养好的种子液以8%(体积分数)的接种量接入上述各发酵培养基中(250 mL三角瓶装液量100 mL),置于25 ℃,160 r/min振荡培养10 d。
1.5 中草药及添加剂量筛选
参考武忠伟等[16]的方法,将6种供试中草药提取液分别添加到基础发酵培养基中,分别制成50、100、150、200 g/L质量浓度梯度的中草药发酵培养基,进行羊肚菌深层发酵,并以不添加中草药提取液作为对照组,考察不同中草药及添加剂量对菌丝体生长和麦角甾醇产量的影响。
1.6 液体发酵单因素条件筛选
发酵温度筛选:在1.5节最佳中草药及添加剂量的基础上,发酵温度分别设为20、22、24、26、28、30 ℃。
发酵时间筛选:在上述试验优化的基础上,发酵时间分别设为4、6、8、10、12、14 d。
摇床转速筛选:在上述试验优化的基础上,转速分别设为120、140、160、180、200 r/min。
分别考察发酵温度、发酵时间、转速对菌丝体生长和麦角甾醇产量的影响。
1.7 Box-Behnken的中心组合试验设计
在上述单因素试验的基础上,根据Box-Behnken的中心组合试验设计原理,选取红芪剂量、发酵温度、发酵时间为因素,以麦角甾醇产量为响应值,设计3因素3水平响应面试验,其因素水平设计见表1。
表1 Box-Behnken试验设计
Table 1 Design of the Box-Behnken experiment

水平因素红芪剂量(A)/(g/L)发酵温度(B)/℃发酵时间(C)/d-1502480100261011502812
1.8 菌丝体生物量和麦角甾醇产量的测定
1.8.1 生物量测定
将发酵液在4 ℃、8 000 ×g离心15 min,收集菌丝体,并用蒸馏水洗涤3次,真空冷冻干燥后称重,生物量计算如公式(1)所示:
(1)
式中:Y为菌丝体生物量,g/L;m为菌丝体干重,g;V为发酵液体积,L。
1.8.2 麦角甾醇提取[17]
称取1.0 g菌丝体干粉末,加入30 mL碱-醇溶液(25 g KOH,40 mL蒸馏水,甲醇定容100 mL),超声浸提1 h(功率400 W,频率40 kHz),8 000×g离心15 min,上清液用正己烷萃取2次,收集上层液体置于分液漏斗中,加入蒸馏水混匀,待静置分层后,用pH计测定下层液体pH,直至中性结束水洗。用真空浓缩仪蒸干正己烷,加无水甲醇定容到25 mL。
1.8.3 麦角甾醇产量测定
采用HPLC测定。取上述麦角甾醇提取液1 mL,用0.22 μm的有机相微孔滤膜过滤后上样测定。HPLC条件:色谱柱Symmetry® C18(4.6 mm×250 mm,5 μm),流动相为甲醇,等度洗脱,流速1.0 mL/min,检测波长282 nm,柱温30 ℃,进样量5.0 μL。以峰面积外标法对菌丝体中麦角甾醇进行定量分析(本试验绘制的麦角甾醇标准曲线为y=8.030 9x-7.776 9,R2=0.999 3)。
(2)
式中:Ye为麦角甾醇产量,mg/L;Ce为菌丝体中麦角甾醇含量,mg/g;m为菌丝体干重,g;V为发酵液体积,L。
1.9 数据处理
采用SPSS 26统计软件进行单因素方差分析,用Design Expert 12软件进行响应面试验设计及数据处理与分析,并运用Origin 2021进行图形绘制。
2 结果与分析
2.1 中草药中还原糖与多糖含量
由图1可以看出,中草药中还原糖与多糖含量各不相同,在试验设计中,保持了各发酵培养基中能被羊肚菌速效利用的还原糖含量一致。

图1 各中草药还原糖与多糖含量
Fig.1 Content of reducing sugar and polysaccharide in various Chinese herbal medicines
注:不同小写字母表示各中草药还原糖含量差异显著;不同大写字母表示多糖含量差异显著(P<0.05)。
2.2 不同中草药提取物对羊肚菌发酵的影响
2.2.1 不同中草药提取物中羊肚菌发酵的外观性状
在添加了中草药提取物的液体发酵体系中,羊肚菌菌丝体生长状况和发酵液外观性状存在明显差异,试验结果见附图1(https://doi.org/10.13995/j.cnki.11-1802/ts.034406),其具体差异性详见表2。
表2 羊肚菌在不同中草药提取物添加下菌丝体特征和发酵液性状
Table 2 Characteristics of mycelia and fermentation broth of M.esculenta in different Chinese herbal extracts

中草药添加剂量/(g/L)菌丝体长势菌丝体颜色菌丝体形态发酵液性状CK0+淡黄色球状、块状颗粒混合淡黄色,清澈透亮50++棕黄色大小不一的小圆球棕黄色,清澈透亮党参100++棕黄色大小不一的小圆球黄褐色,清澈透亮150+++棕黄色大小不一的小圆球棕褐色,清澈透亮200++棕褐色大小不一的小圆球深褐色,浑浊50++淡黄色大小均匀黄豆状圆球棕黄色,清澈透亮红芪100+++棕黄色大小均匀黄豆状圆球棕黄色,清澈透亮150++棕黄色大小均匀黄豆状圆球棕黄色,清澈透亮200++黄褐色大小均匀黄豆状圆球棕褐色,清澈透亮50++棕黄色大小均匀小米状颗粒棕黄色,清澈透亮甘草100+黄褐色大小均匀小米状颗粒深褐色,浑浊150菌丝未见萌发— — —200菌丝未见萌发— — —50+棕黄色大小不一的小圆球棕褐色,清澈透亮当归100菌丝未见萌发— — —150菌丝未见萌发— — —200菌丝未见萌发— — —50++棕黄色大小均匀小米状颗粒棕褐色,清澈透亮柴胡100++黄褐色大小均匀小米状颗粒棕褐色,清澈透亮150+++黄褐色大小均匀小米状颗粒棕褐色,浑浊200++棕褐色大小均匀小米状颗粒深褐色,浑浊50++棕黄色无规则絮状小颗粒棕黄色,浑浊板蓝根100菌丝未见萌发— — —150菌丝未见萌发— — —200菌丝未见萌发— — —
注:+表示菌丝体稀疏;++表示菌丝体较浓密;+++表示菌丝体浓密;—表示未观察到试验结果。

附图1 羊肚菌在不同中草药提取物液体发酵体系中的外观特征
Fig.S1 Appearance characteristics of M. esculenta in liquid fermentation system of different Chinese herbal extracts
2.2.2 中草药及添加剂量筛选结果
由图2-A和图2-E可知,在0~150 g/L的中草药提取物浓度范围内,党参、柴胡对羊肚菌菌丝体生长和麦角甾醇产量的促进作用成剂量关系,且在150 g/L 时达到峰值,菌丝体生物量分别为10.37 g/L、10.42 g/L,与对照组相比分别是对照组的2.77倍、2.79倍,麦角甾醇产量分别为39.48 mg/L和44.63 mg/L,分别是对照组的2.07倍和2.34倍,当添加剂量超过150 g/L时,生物量和麦角甾醇产量均出现下降趋势,因此确定党参、柴胡的适宜添加剂量为150 g/L。图2-B显示,红芪提取物的适宜添加剂量为100 g/L,此时羊肚菌菌丝体生物量和麦角甾醇产量最大,分别为10.57 g/L、47.69 mg/L,分别是对照组的2.83倍、2.50倍。由图2-C~图2-F可知,甘草、当归、板蓝根提取物在50 g/L的添加剂量下,对菌丝体生长和麦角甾醇产量有一定的促进作用,生物量增幅在42.44%~123.44%,麦角甾醇产量增幅在73.87%~81.51%;当归和板蓝根添加剂量超过50 g/L 时,羊肚菌生长处于完全被抑制状态,而甘草在100 g/L添加剂量下抑制了羊肚菌生长,当超过100 g/L时完全抑制其生长。
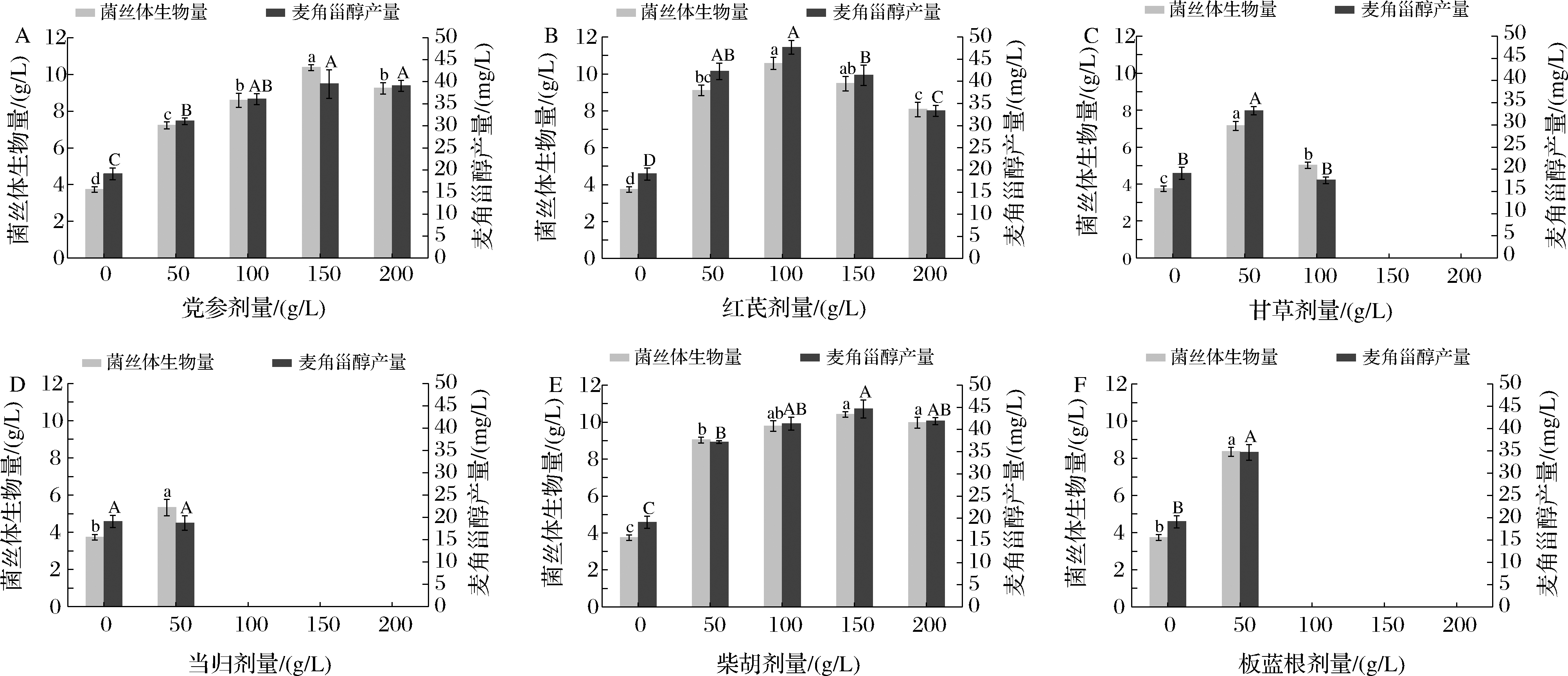
A-党参;B-红芪;C-甘草;D-当归;E-柴胡;F-板蓝根
图2 不同中草药提取物对羊肚菌菌丝体生物量和麦角甾醇产量的影响
Fig.2 Effects of different Chinese herbal extracts on mycelial biomass and ergosterol yield of M.esculenta
注:不同小写字母表示同一处理组不同剂量间菌丝体生物量差异显著;不同大写字母表示麦角甾醇产量差异显著(P<0.05)(下同)。
综上试验结果,在供试的6种中药材中,添加100 g/L红芪提取物对羊肚菌发酵麦角甾醇产量的促进作用最为显著,故选取红芪提取物作为液体发酵培养基,开展后续羊肚菌深层发酵工艺响应面优化试验。
2.3 单因素试验结果
2.3.1 发酵温度对羊肚菌发酵红芪提取物的影响
由图3-A可知,在20~30 ℃,羊肚菌在100 g/L红芪提取液中发酵所得到的菌丝体生物量,随着发酵温度的升高呈现先上升后下降的趋势,当温度为26 ℃时,菌丝体生物量和麦角甾醇产量均达到峰值,分别为10.33 g/L和47.96 mg/L。因此,其适宜发酵温度为26 ℃。

A-发酵温度;B-发酵时间;C-转速
图3 不同发酵温度、时间、转速对羊肚菌菌丝体生物量和麦角甾醇产量的影响
Fig.3 Effects of different fermentation temperature, time, and shaking speed on mycelial biomass and ergosterol yield of M.esculenta
2.3.2 发酵时间对羊肚菌发酵红芪提取物的影响
由图3-B可知,羊肚菌在100 g/L红芪提取液中,发酵初期菌丝体生长速度较缓,从第6天起菌丝体快速生长,在第10天时,菌丝体生物量和麦角甾醇产量均达到峰值,分别为10.63 g/L和48.37 mg/L,此后随着发酵时间的延长,菌丝体生物量和麦角甾醇产量均保持相对稳定。因此,其适宜发酵时间为10 d。
2.3.3 摇床转速对羊肚菌发酵红芪提取物的影响
由图3-C可知,在120~160 r/min的摇床转速下,菌丝体生物量和麦角甾醇产量呈现上升趋势,在160~200 r/min的转速下,菌丝体生物量和麦角甾醇产量均比较高,各处理组间差异不显著(P>0.05),在180 r/min时,麦角甾醇产量最大为48.51 mg/L。因此,其适宜转速选择为180 r/min。
2.4 响应面试验分析
2.4.1 响应面回归模型的建立与检验
按照Box-Behnken中心组合试验方案开展试验,各组麦角甾醇产量见表3。经多元回归拟合模型对试验数据进行分析处理,得到回归方程为:麦角甾醇产量=56.88-2.07A-0.979 3B+2.88C+0.339 8AB+3.64AC-0.182 6BC-7.44A2-6.26B2-3.57C2。
表3 Box-Behnken试验设计及其结果
Table 3 Design and results of the Box-Behnken tests
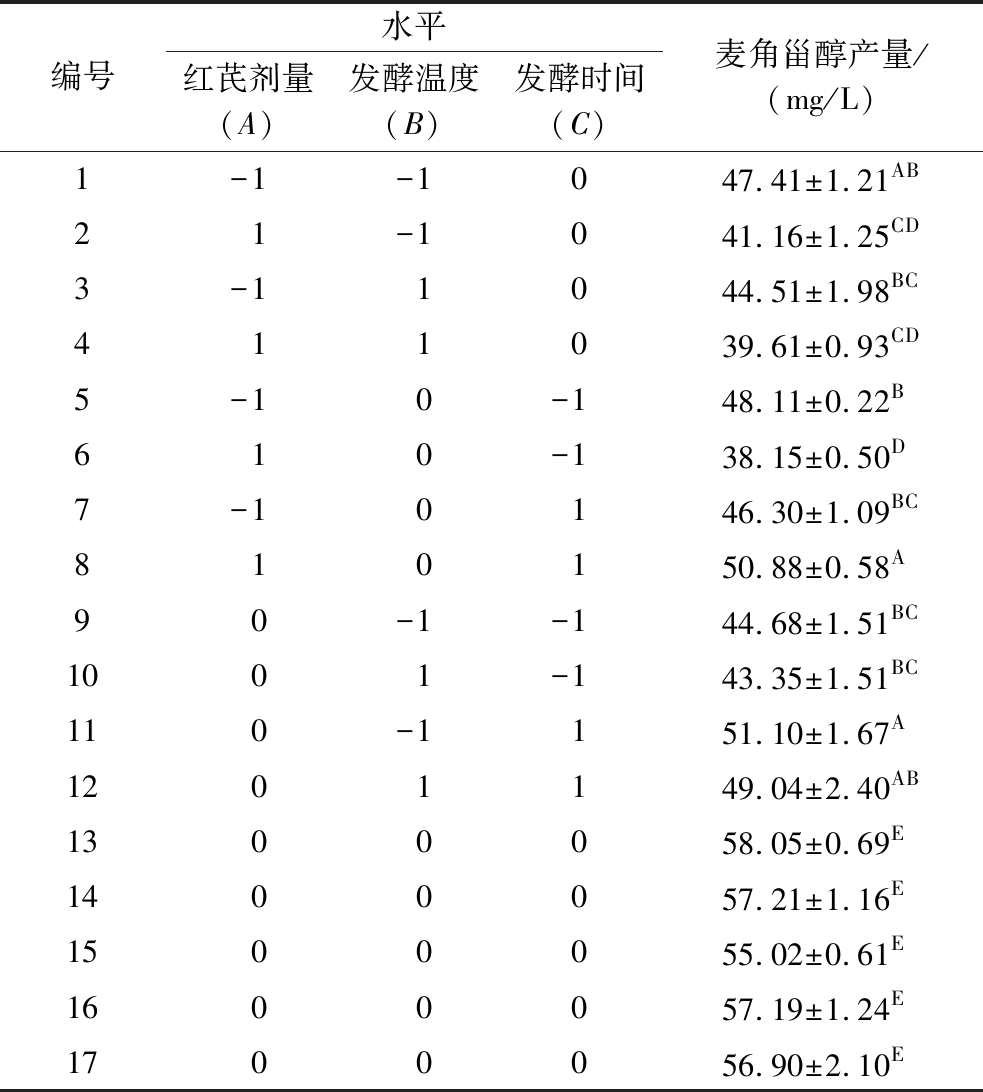
编号水平红芪剂量(A)发酵温度(B)发酵时间(C)麦角甾醇产量/(mg/L)1-1-1047.41±1.21AB21-1041.16±1.25CD3-11044.51±1.98BC411039.61±0.93CD5-10-148.11±0.22B610-138.15±0.50D7-10146.30±1.09BC810150.88±0.58A90-1-144.68±1.51BC1001-143.35±1.51BC110-1151.10±1.67A1201149.04±2.40AB1300058.05±0.69E1400057.21±1.16E1500055.02±0.61E1600057.19±1.24E1700056.90±2.10E
注:表中数值为平均值±SD,不同上标字母表示麦角甾醇产量差异显著(P<0.05)。
方差分析见表4,本回归模型有明显的差异显著性(P<0.01),失拟项无显著差异(P=0.420 4),其中R2=0.985 8,RAdj2=0.967 6,说明该模型有较好的拟合度。回归方程中一次项A、B、C和二次项A2、B2、C2差异显著(P<0.05),表明羊肚菌在深层发酵产麦角甾醇的过程中,红芪剂量、发酵温度和发酵时间对麦角甾醇产量具有显著影响,其影响顺序为C>A>B,即发酵时间>红芪剂量>发酵温度;交互项AC的P值为0.000 4,表明麦角甾醇产量受到红芪剂量和发酵时间交互作用的显著影响,交互项AB、BC的P值大于0.05,表明麦角甾醇产量不受红芪剂量和发酵温度、发酵温度和发酵时间交互作用的显著影响。
表4 回归模型方差分析
Table 4 Variance analysis of the regression model
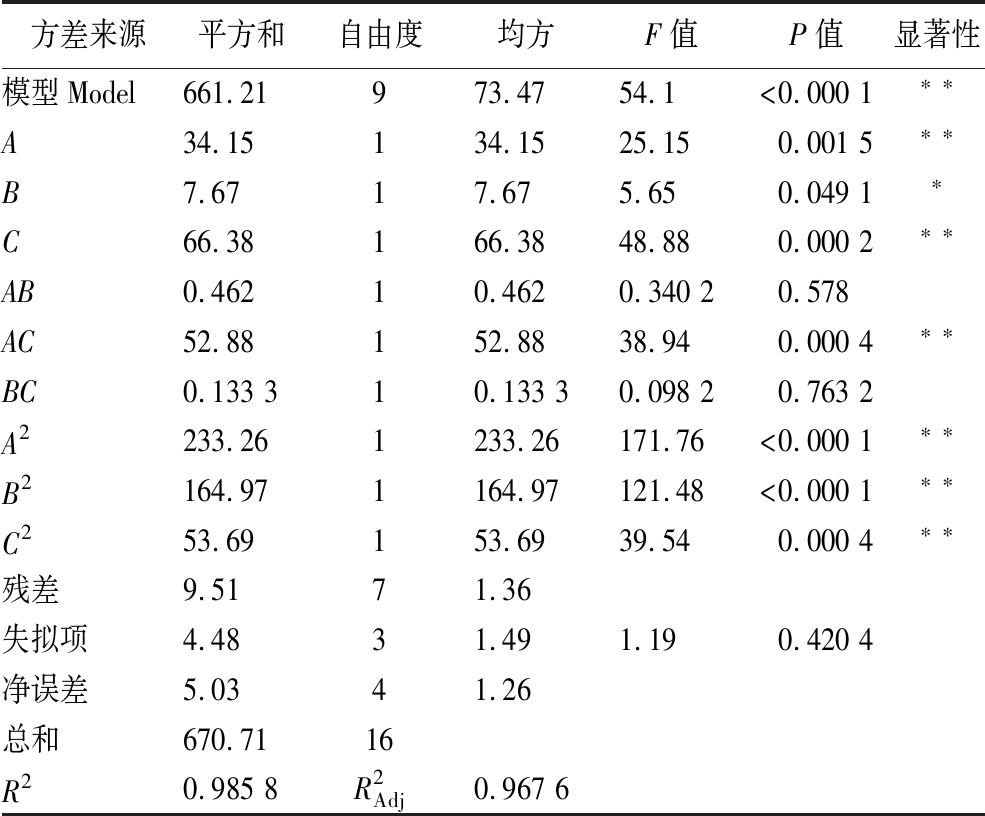
方差来源平方和自由度均方F值P值显著性模型Model661.21973.4754.1<0.000 1∗∗A34.15134.1525.150.001 5∗∗B7.6717.675.650.049 1∗C66.38166.3848.880.000 2∗∗AB0.46210.4620.340 20.578AC52.88152.8838.940.000 4∗∗BC0.133 310.133 30.098 20.763 2A2233.261233.26171.76<0.000 1∗∗B2164.971164.97121.48<0.000 1∗∗C253.69153.6939.540.000 4∗∗残差9.5171.36失拟项4.4831.491.190.420 4净误差5.0341.26总和670.7116R20.985 8R2Adj0.967 6
注:*表示P< 0.05;**表示P< 0.01。
由图4可知,AB、BC交互作用图坡度较缓且等高线为圆形,表明红芪剂量和发酵温度、发酵温度和发酵时间的交互作用对麦角甾醇产量影响不显著;AC交互作用等高线为椭圆形且响应面坡度较陡,表明红芪剂量和发酵时间的交互作用对麦角甾醇产量影响显著。这一结果与方差分析结果完全一致。
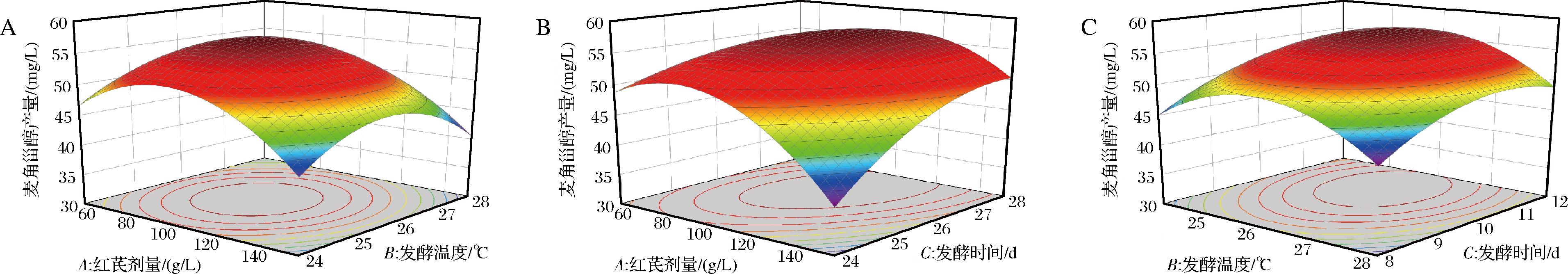
A-AB交互作用;B-AC交互作用;C-BC交互作用
图4 发酵条件交互作用图
Fig.4 Interaction diagram of fermentation conditions
2.4.2 最佳发酵工艺参数的确定及回归模型的验证
通过软件分析得到羊肚菌发酵红芪提取物产麦角甾醇的最佳工艺为红芪剂量97.60 g/L,发酵温度25.83 ℃,发酵时间10.76 d,接种量8%,转速180 r/min,麦角甾醇最大预测产量为57.52 mg/L。结合实际操作的可行性,调整发酵温度为26 ℃,发酵时间为11 d,在此条件下进行5组平行试验,得到麦角甾醇实际产量均值为59.16 mg/L,与预测值相对误差小于5%,表明预测值和实际值之间拟合性良好。
3 讨论
发酵是利用微生物的生长代谢或生物催化反应体系,获得菌体本身或其代谢产物的过程,通过一定的技术手段选择菌种和控制发酵工艺,可以实现目标产物的工业化大规模生产[18]。微生物发酵技术因其反应特异性强、反应条件温和、副产物少、安全性高、清洁高效等优点[19],在传统食品发酵、抗生素医药和功能性食品行业中都占据了重要地位,在生物活性药物生产领域的应用也越来越广泛[20]。
在添加中药材的微生物发酵体系中,由于中草药含有多种活性成分(生物碱、皂苷、黄酮、多糖等),其中某些成分可能对微生物的生长代谢及活性物质的产生有促进或抑制作用,微生物在中草药特殊环境中可能改变自身的代谢途径,从而产生新的活性物质或改变各活性物质间比例[21]。羊肚菌代谢产物可能与中草药中某些有效成分发生协同增效作用,使羊肚菌在中草药提取物的环境中加速生成麦角甾醇的产量,并增加其生物活性,从而具有更强的预防、保健或治疗功效[22]。
麦角甾醇是真菌细胞膜上的主要固醇分子,其生物合成途径是多种酶参与的复杂代谢过程,至少涉及到15种酶的参与、23步反应以及25个结构基因,相关酶活性的高低以及相关基因的表达量都影响着麦角甾醇的合成代谢[23]。本研究结果表明,在党参、红芪、柴胡3种中草药的协同作用下,其能够显著促进菌丝体生长和麦角甾醇产量积累,证实这3种中草药提取物中有效成分对羊肚菌麦角甾醇合成代谢产生了增效作用,可能与麦角甾醇合成途径的相关酶活性提高有关,或作为前体物质促进了麦角甾醇生物合成。工艺优化后的验证试验表明,羊肚菌在红芪提取物中发酵麦角甾醇的产量为59.16 mg/L,这一结果与杜娇[24]对猴头菌发酵麦角甾醇产量57.77 mg/L的结果接近;但与戴肖东等[25]筛选到一株野生猴头菇菌株液体发酵麦角甾醇产量21.51 mg/L相比,产量提高了175.03%,与罗立津等[26]利用蝉拟青霉液体发酵制备麦角甾醇产量47.57 mg/L相比,产量提高了24.36%。可见,红芪提取物可以作为羊肚菌生长促进因子,应用于液体发酵麦角甾醇具有一定的可行性。当然,有关中草药促进羊肚菌生长及麦角甾醇合成的代谢机理,以及此类中草药的添加是否对其他生物活性物质也存在促进作用等问题,尚有待进一步研究。
4 结论
本研究以6种甘肃道地中草药为试材,筛选适合羊肚菌液体发酵的中草药种类,并采用单因素试验结合响应面法,优化了发酵红芪提取物的工艺条件。结果表明,党参、红芪、柴胡3种中草药可显著促进羊肚菌菌丝体生长和麦角甾醇产量,其中红芪的效果最佳,在100 g/L的添加剂量下,菌丝体生物量达到10.57 g/L,麦角甾醇产量达到47.69 mg/L。优化的工艺条件为红芪剂量97.60 g/L,发酵温度26 ℃,发酵时间11 d,接种量8%,转速180 r/min,该条件下麦角甾醇产量可达到59.16 mg/L,与工艺优化前麦角甾醇产量48.51 mg/L相比,其产量提高了21.95%。因此,该发酵技术可为羊肚菌麦角甾醇等生物活性物质的规模化生产提供一定的参考。
[1] 曹龙辉, 李晓珺, 赵文红, 等.麦角甾醇的研究进展[J].中国酿造, 2014, 33(4):9-12.
CAO L H, LI X J, ZHAO W H, et al.Research progress on ergosterol[J].China Brewing, 2014, 33(4):9-12.
[2] LIU J, CHAI X Y, GUO T, et al.Disruption of the ergosterol biosynthetic pathway results in increased membrane permeability, causing overproduction and secretion of extracellular Monascus pigments in submerged fermentation[J].Journal of Agricultural and Food Chemistry, 2019, 67(49):13673-13683.
[3] ZHAO Y Y, XIE R M, CHAO X, et al.Bioactivity-directed isolation, identification of diuretic compounds from Polyporus umbellatus[J].Journal of Ethnopharmacology, 2009, 126(1):184-187.
[4] 崔丹丹. 香菇麦角甾醇的降脂功效研究[D].镇江:江苏大学, 2019.
CUI D D.Study on the lipid-lowering effect of ergosterol from Lentinus edodes[D].Zhenjiang:Jiangsu University, 2019.
[5] LIU J F, XIA J J, NIE K L, et al.Outline of the biosynthesis and regulation of ergosterol in yeast[J].World Journal of Microbiology and Biotechnology, 2019,35(7):98.
[6] 程洋洋, 惠靖茹, 郝竞霄, 等.食用菌中麦角甾醇的研究进展[J].食品工业科技, 2021, 42(10):349-354.
CHENG Y Y, HUI J R, HAO J X, et al.Research progress of ergosterol in edible fungi[J].Science and Technology of Food Industry, 2021, 42(10):349-354.
[7] GAO H, GU W Y.Optimization of polysaccharide and ergosterol production from Agaricus brasiliensis by fermentation process[J].Biochemical Engineering Journal, 2007, 33(3):202-210.
[8] 孙巧弟, 张江萍, 谢洋洋, 等.羊肚菌营养素、功能成分和保健功能研究进展[J].食品科学, 2019,40(5):323-328.
SUN Q D, ZHANG J P, XIE Y Y, et al.Recent progress in research on nutrients, functional components and health benefits of Morchella esculenta[J].Food Science, 2019, 40(5):323-328.
[9] TANG Y, CHEN J L, LI F H, et al.Antioxidant and antiproliferative activities of modified polysaccharides originally isolated from Morchella angusticepes peck[J].Journal of Food Science, 2019, 84(3):448-456.
[10] 么越, 荣丹, 唐梦瑜, 等.羊肚菌药用价值及产品开发现状[J].中国食用菌, 2022, 41(7):13-17;21.
YAO Y, RONG D, TANG M Y, et al.Medical value and product development status of Morchella spp.[J].Edible Fungi of China, 2022, 41(7):13-17;21.
[11] 支彩艳, 乔俊, 赵建国, 等.羊肚菌人工栽培技术研究进展[J].北方园艺, 2021(15):143-150.
ZHI C Y, QIAO J, ZHAO J G, et al.Research progress in artificial cultivation of Morchella[J].Northern Horticulture, 2021(15):143-150.
[12] 赵瑞华, 贺晓龙, 田茜.羊肚菌菌丝体液体发酵及其应用的研究进展[J].食品研究与开发, 2020, 41(12):190-195.
ZHAO R H, HE X L, TIAN X.Research advancement on liquid fermentation and the application of Morchella Mycelia[J].Food Research and Development, 2020, 41(12):190-195.
[13] LI J L, WU H S, LIU Y T, et al.The chemical structure and immunomodulatory activity of an exopolysaccharide produced by Morchella esculenta under submerged fermentation[J].Food &Function, 2021, 12(19):9327-9338.
[14] 李赟. 五种中草药提取液对白灵菇深层发酵多糖的影响[D].兰州:甘肃农业大学, 2009.
LI Y.Effect of five kinds of Chinese herbal medicines extraction on polysaccharide from Pleurotus nebrodensis by submerged fermentation[D].Lanzhou:Gansu Agricultural University, 2009.
[15] 曾志恒, 曾辉, 程翊, 等.双孢蘑菇发酵液还原糖和总糖的含量测定[J].中国食用菌, 2018, 37(6):40-43;49.
ZENG Z H, ZENG H, CHENG Y, et al.Determination of reducing sugar and total sugar content in fermentation liquid of Agaricus bisporus[J].Edible Fungi of China, 2018, 37(6):40-43;49.
[16] 武忠伟, 郭爱莲, 殷红, 等.中草药提取液对冬虫夏草深层培养的影响[J].食品科学, 2005, 26(6):116-119.
WU Z W, GUO A L, YIN H, et al.Effects of extracts of Chinese medicines on Cordyceps sinensis in submerged culture[J].Food Science, 2005, 26(6):116-119.
[17] 高虹, 程薇, 周明, 等.高效液相法测定香菇菇柄麦角甾醇的含量[J].菌物研究, 2013, 11(2):78-81.
GAO H, CHENG W, ZHOU M, et al.Determination of ergosterol in Lentinus edodes stem by high-performance liquid chromatoraphy[J].Journal of Fungal Research, 2013, 11(2):78-81.
[18] 刘雨, 姜明星, 张轲.发酵技术在化妆品中的应用进展[J].发酵科技通讯, 2022, 51(2):121-124.
LIU Y, JIANG M X, ZHANG K.Progress in the application of fermentation technology in cosmetics[J].Bulletin of Fermentation Science and Technology, 2022, 51(2):121-124.
[19] HOFF B, PLASSMEIER J, BLANKSCHIEN M, et al.Unlocking nature’s biosynthetic power—Metabolic engineering for the fermentative production of chemicals[J].Angewandte Chemie, 2021, 133(5):2288-2308.
[20] GADHOUMI H, AKREM HAYOUNI E L, MARTINEZ-ROJAS E, et al.Biochemical composition, antimicrobial and antifungal activities assessment of the fermented medicinal plants extract using lactic acid bacteria[J].Archives of Microbiology, 2022, 204:374.
[21] 赵雯玮, 陈祥贵, 李鑫.微生物发酵在中药研究中的应用[J].生命科学仪器, 2008, 6(10):3-5.
ZHAO W W, CHEN X G, LI X.Application of microbial fermentation in the research of traditional Chinese medicine[J].Life Science Instruments, 2008, 6(10):3-5.
[22] 杨海龙, 唐华.中药对药用真菌深层发酵的影响[J].食品与发酵工业, 2009, 35(4):128-131.
YANG H L, TANG H.Effects of Chinese medicines on submerged culture of medicinal fungi[J].Food and Fermentation Industries, 2009, 35(4):128-131.
[23] 魏娟. 柠檬醛和肉桂醛抑制接骨木镰刀菌生长和产毒的机理[D].兰州:甘肃农业大学, 2020.
WEI J.The antifungal and anti-mycotoxin mechanisms of citral and cinnamaldehyde against Fusarium sambucinum[D].Lanzhou:Gansu Agricultural University, 2020.
[24] 杜娇. 猴头菌麦角甾醇高产发酵条件及提取工艺的研究[D].太谷:山西农业大学, 2020.
DU J.Study on high-yield fermentation conditions and extraction technology of ergosterol from Hericium erinaceus[D].Taigu:Shanxi Agricultural University, 2020.
[25] 戴肖东, 张介驰, 韩增华, 等.十株野生猴头菌菌株的栽培性状及麦角甾醇含量[J].食用菌学报, 2014,21(3):45-49.
DAI X D, ZHANG J C, HAN Z H, et al.Growth parameters and ergosterol content of mycelia and fruit bodies of ten Hericium erinaceus strains collected from the wild in Heilongjiang Province, China[J].Acta Edulis Fungi, 2014,21(3):45-49.
[26] 罗立津, 乐占线, 贾纬, 等.蝉拟青霉发酵培养基、蝉拟青霉发酵制备麦角甾醇的方法:中国, CN109749941A[P].2019-05-14.
LUO L J, LE Z X, JIA W, et al.Preparation of ergosterol by Paecilomyces cicadae fermentation medium and Paecilomyces cicadae fermentation:China, CN109749941A[P].2019-05-14.