花生,一年生豆科草本植物[1],世界上第二大重要的豆类作物和第四大食用油料作物,是油脂和蛋白质的主要来源。花生红衣含有多种多酚化合物(酚酸、类黄酮和二苯乙烯),如各种花青素和原花青素等,具有降血糖、清除自由基、促进血小板生成、降血脂等多种生理功能[2],同时还具有强化毛细血管、促进血液循环的功效,有助于提高视力、改善关节的灵活性、增强心脏活力,预防大脑病变等作用[3-4]。研究表明其中的多酚化合物有可能成为未来膳食补充剂和功能性成分的可持续来源[5],应用在各种食品和制药领域[6]。尽管花生红衣有这些有益的特性,但它仍然是一种未得到充分利用的自然资源,更多地只是将这种副产品作为动物饲料来使用。为了提高花生多酚在增强化学稳定性和感官特性以及延长加工食品保质期方面的潜力,需要进行更多的研究来开发有效的提取工艺。
许多研究发现采用固-液提取技术(浸渍、超声、索氏提取和热回流)和不同的有机溶剂对花生红衣的提取率较高,主要是因为氢键作用可以提高酚类物质的提取效率[7]。超声波法具有提取率高、提取时间短,操作简便、成本低、产物易纯化、设备要求低等优点[8-9],被广泛应用于天然产物及生物活性物质提取等领域[10-11]。响应面法(response surface method,RSM)是一种评估多个因素及其相互作用对一个或多个响应变量的影响的有效方法,该方法用于工艺优化,可获得最优的工艺因素条件[12]。虽然花生红衣的一些化合物已经被鉴定出来,但许多仍是未知的,这是因为不同提取方法、提取剂、工艺都会影响其化合物的产率及种类,花生红衣酚类提取物的活性强弱受其酚类物质含量的影响[13]。此外,对于花生红衣提取物对各类细菌的抑菌抗菌性能以及抗氧化性能的研究并不深入。
本试验采用RSM法探究了花生红衣多酚的最佳提取条件,优化了料液比、溶剂浓度、温度和时间等工艺参数;并通过液质联用仪鉴定了花生红衣中主要的物质成分,最后测定了花生红衣提取物的总酚含量、抗氧化特性,并对4种革兰氏阳(阴)细菌的抑菌抗菌性能进行了研究。
1 材料与方法
1.1 材料与试剂
花生红衣,安徽省昊州某供应商;磷酸缓冲液(pH=6.8)、乙醇(分析纯)、甲醇(HPLC级)、福林酚(分析纯)、没食子酸(分析纯)、DPPH(分析纯)与ABTS(分析纯)等试剂,上海麦克林公司;Mueller-Hinton(MH)琼脂培养基、LB培养基、金黄色葡萄球菌(ATCC25923)、大肠埃希氏菌(ATCC25922)、鼠伤寒沙门氏菌(ATCC14028)与单增李斯特菌(ATCC191115),广东环凯微生物科技有限公司。
1.2 仪器与设备
040S超声波清洗仪,深圳利兴隆有限公司;96孔板,南通试验器材有限公司;LBI-375-N细菌培养箱,上海龙跃仪器设备有限公司;JIDI-20D高速离心机,广州吉迪仪器有限公司;RE52CS旋转蒸发仪,上海亚荣仪器有限公司;UV-2450紫外分光光度计仪,日本岛津公司;AGILENT 6460液质联用仪,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 花生红衣提取物(peanut scarlet extractive,PSE)的制备
将花生红衣磨碎后,过120目筛网,称取5 g花生红衣粉末浸泡于80%乙醇溶液6 h(料液比值为0.05 g/mL);采用超声清洗仪辅助提取40 min(超声温度60 ℃);采用高速离心机离心10 min(6 000 r/min),使用0.22 μm的水系滤膜除去杂质,利用旋转蒸发仪回收提取液中的乙醇溶液,冷冻干燥后,获得PSE,置于4 ℃冰箱中保存备用。
1.3.2 PSE的提取工艺优化
1.3.2.1 超声时间对总多酚提取率的影响
超声提取时间分别为20、40、60、80、100 min;超声温度为30 ℃,料液比值固定为0.07 g/mL。采用紫外分光光度计测定PSE中总多酚含量。
1.3.2.2 超声温度对总多酚提取率的影响
设置超声清洗仪的温度分别为30、40、50、60、70 ℃;超声时间固定为30 min,料液比值固定为0.05 g/mL,乙醇体积分数为80%。采用紫外分光光度计测定PSE中总多酚含量。
1.3.2.3 料液比值对总多酚提取率的影响
设置花生红衣粉末质量与70%乙醇溶液的料液比值分别为0.01、0.03、0.05、0.07、0.09 g/mL;超声温度固定为40 ℃,超声时间固定为40 min,乙醇体积分数为90%。采用紫外分光光度计测定PSE中总多酚含量。
1.3.2.4 乙醇体积分数对总酚提取率的影响
设置提取液中乙醇体积分数为50%、60%、70%、80%、90%;超声时间温度分别固定为50 min与50 ℃;料液比值固定为0.03 g/mL。采用紫外分光光度计测定PSE中总多酚含量。
1.3.3 PSE提取工艺的优化
基于单因素试验的优化结果,总酚含量为效应值,利用RSM对超声时间、超声温度、料液比值以及乙醇体积分数等4个因素进行3水平响应面优化试验分析,每组试验重复3次,实验设计如表1所示,通过Design-Expert 13软件的Box Behnken设计设定RSM试验因子水平值,确定花生红衣提取物最佳工艺条件。
表1 RSM的影响因素及水平
Table 1 Factors and levels of RSM
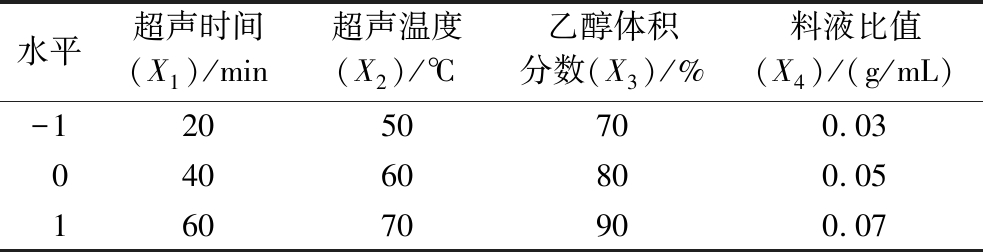
水平超声时间(X1)/min超声温度(X2)/℃乙醇体积分数(X3)/%料液比值(X4)/(g/mL)-12050700.0304060800.0516070900.07
1.3.4 PSE粗提率的测定
PSE中的总多酚含量(total polyphenols content, TPC)参照MUNOZ等[14]方法并稍作修改,将PSE超声溶解于无水乙醇溶液中,将该溶液、福林酚试剂和20% Na2CO3溶液以不同比例混合在10 mL容量瓶中,常温避光反应40 min后,用紫外分光光度计(波长为760 nm)测定PSE的TPC,PSE中的TPC以没食子酸当量表示(mg/g)[15]。PSE的粗提率(E,%)计算如公式(1)所示:
(1)
式中:m1为提取前花生红衣的质量,mg;m2为提取后花生红衣的质量,mg。
1.3.5 PSE中生物活性成分的测定
参照JAEGER等[16]的方法稍作修改,将所得PSE超声溶解于甲醇溶液(1 mg/L)中,采用液质联用仪(柱温30 ℃,流速0.3 mL/min),对PSE的化学组成进行定性分析。其中流动相A为乙腈溶液,流动相B为甲醇溶液;按梯度洗脱,进样量15 μL,运行时间10 min。
1.3.6 PSE自由基清除性的计算
PSE溶解于无水乙醇中,配制质量浓度分别为500、250、125、62.5、31.25 μg/mL的PSE提取溶液,取其上清液0.5 mL与5 mL的DPPH溶液混合(DPPH配制成0.1 mmol/L的乙醇溶液),避光反应1 h,采用紫外分光光度计测定样品在517 nm处的吸光度,复合膜的DPPH清除活性的计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
式中:Acontrol为空白对照组的吸光度;Asample为试验组的吸光度。
为了测定PSE的ABTS阳离子自由基清除效果,取0.737 mL ABTS的甲醇溶液(7.4 mmol)和1.43 mL过硫酸钾水溶液(2.6 mmol)的混合物避光反应12 h,将原液用蒸馏水稀释一定倍数后,使混合物在734 nm处的吸光度保持在0.7不变;然后将5 mL混合溶液与0.5 mL PSE乙醇溶液混合,避光反应10 min,使用紫外分光光度计测定734 nm处的吸光度,复合膜ABTS清除活性的计算如公式(3)所示。
ABTS阳离子自由基清除率![]()
(3)
式中:Acontrol为空白对照组的吸光度;Asample为试验组的吸光度。
1.3.7 PSE的抑菌测定
1.3.7.1 细菌培养
选取革兰氏阳性细菌:金黄色葡萄球菌(S.aureus)和单增李斯特细菌(L.monocytgenes),革兰氏阴性菌:大肠杆菌(E.coli)和鼠伤寒杆沙门氏菌(S.typhimurium)作为试验菌株。将上述4种细菌冻干粉溶解后加入至LB肉汤中,在37 ℃的恒温振荡器中培养24 h,转移到固体培养基(MH培养基)中进行复苏。在后续接种步骤中,再次使用灭菌后的接种环将培养基中细菌接种到LB肉汤(50 mL)中,将培养液振荡24 h(37 ℃,110 r/min)使其生长。
1.3.7.2 最小抑菌浓度测定
选取S.aureus、E.coli、S.typhimurium、L.monocytogenes作为试验菌株,称取冷冻干燥后的PSE溶解于蒸馏水中。采用二倍稀释法[17]将PSE溶液质量浓度分别稀释为9.6、4.8、2.4、1.2、0.6、0.3、0.15 mg/mL;吸取上述500 μL的PSE溶液、25 μL细菌悬液(菌浓度为105 CFU/mL)以及500 μL的LB培养基至96孔板中,以磷酸缓冲液(PBS,pH值为7.4)为阳性对照,不含细菌悬液和PSE溶液的孔板为阴性对照,每组试验平行3次,最后将上述孔板放入恒温振荡器中(37 ℃,110 r/min)振荡培养24 h,记录溶液中细菌生长情况。将孔内溶液浑浊的样品编号记为“+”,表明溶液中有细菌繁殖;将孔内溶液澄清的样品记为“-”,表明溶液无细菌繁殖,并将该样品浓度记为最小抑菌浓度(minimal inhibitory concentration,MIC)[18]。
1.3.7.3 抗菌活性(琼脂扩散)测定
采用琼脂扩散法测定PSE的抗菌活性,利用PBS(pH值为7.4)溶液将细菌浓度稀释至107CFU/mL,用玻璃涂布棒将菌悬液(100 μL)均匀涂布于培养基上,采用镊子夹取灭菌后的牛津杯平稳放置于培养基上,每个牛津杯注入不同浓度的PSE溶液,最后将培养基置于培养箱(37 ℃)培养24 h后,测量其抑菌圈的直径。
2 结果与分析
2.1 PSE提取参数优化(单因素试验)
2.1.1 超声时间对PSE中总多酚提取率的影响
没食子酸标准曲线在0.001~0.006 μg/mL的吸光度具有良好的线性关系(y=47.94x-0.011,R2=0.997);PSE中的TPC以没食子酸当量表示(mg/g)。超声时间对多酚提取率的影响如图1-A 所示,当超声时间为40 min时,TPC与粗提率值最大,分别为114.25 mg/g,35.86%;随着超声时间延长,TPC逐渐降低,这是因为花生红衣在恒定功率条件下,长时间受热造成提取物中多酚物质结构破坏,分解失活[19],降低了提取物的TPC含量。因此,最佳超声时间为40 min。

A-超声时间;B-超声温度;C-料液比;D-乙醇体积分数
图1 单因素试验对多酚提取率的影响
Fig.1 Effect of single factor experiment on the extraction rate of polyphenols
2.1.2 超声温度对PSE中总多酚提取率的影响
如图1-B所示,当温度<60 ℃时,花生红衣多酚提取率随着温度升高而增加,当温度>60 ℃时,PSE中的TPC为126.82 mg/g,粗提率为34.93%;随着温度逐渐增大,其TPC逐渐降低,这是因为提取溶剂在高温时易挥发,PSE中的多酚物质易分解造成的[20]。因此最佳超声温度为60 ℃。
2.1.3 料液比、乙醇体积分数对PSE中总多酚提取率的影响
如图1-C、图1-D所示,当料液比值为0.05 g/mL时,PSE中的TPC含量最大为122.50 mg/g,粗提率为35.75%;当乙醇体积分数为80%时,PSE中的多酚提取率最大。因此,选择料液比值为0.05 g/mL、乙醇体积分数为80%作为最佳提取工艺参数。
2.2 PSE的提取工艺响应面法优化
基于单因素优化条件,通过Design-expert 13软件对试验结果(TPC)进行分析(表2),优化了PSE提取工艺条件,构建了PSE多酚提取的模型[21],并对结果进行多元回归拟合,所得二次回归函数的模型方程为y=134.35+2.27A-0.498B-0.336 7C-0.117 0D+7AB+4.58AC+3.73AD-5.28BC+10.68BD+7.36CD-42.88A2-19.30B2-13.38C2-25.85D2;经计算可得,模型的P值≤0.000 1,说明该回归方程显著,失拟项为0.052 1(不显著),回归系数R2=0.973 3,表明方程与响应值吻合度达到了95.43%,结果还表明该函数方程可对试验结果进行良好的评估和预测,适合花生红衣多酚的提取工艺参数优化,其影响因素由大到小依次为乙醇体积分数>超声温度>超声时间>料液比,结果值预测有效。进一步优化分析可得,花生红衣提取最佳工艺参数分别为超声时间40 min,超声温度60 ℃,料液比值为0.05 g/mL,乙醇体积分数为80%,预测提取得到的TPC最大为148.17 mg/g,最小为120.53 mg/g;而实际测量值为137 mg/g,与预测的平均提取多酚得率偏差1.97%,该结果表明优化后的工艺参数对于花生红衣中多酚的提取具有指导性意义。
表2 制备PSE的Box-Behnken设计因子及响应值
Table 2 The Box-Behnken design factors and response values of PSE

试验序号超声时间(A)/min超声温度(B)/℃料液比值(C)/(g/mL)乙醇体积分数(D)/%TPC/(mg/mL)140500.0570112.68260600.057075.28340600.0580139.23460500.058074.72520600.038076.25640700.057082.8720500.058083.65840600.0770101.65940700.078096.911040600.079088.241120600.057079.411260600.059067.311360700.058076.21420600.078065.111560600.038072.341640500.059064.651740500.0780116.31840700.0380105.621940600.0580134.52040500.0380103.92140700.059077.52240600.039075.42340600.0580132.472440600.0370118.242540600.0580135.72640600.0580129.852760600.078079.52820700.058057.152920600.059056.52
2.3 PSE主要化学组成
采用LC-MS研究了PSE的主要化学成分,如图2 所示。采用Compoud Discoverer 2.1软件进行总峰面积比数据(样品/对照)对PSE进行化学组成分析。PSE中主要多酚活性化学成分为百里香酚[质量/电荷比(m/e)7 962.537,保留时间为10.501 min]和儿茶素(m/e 2 607.77,保留时间为4.714 min);同时在提取物中还存在对苯二甲酸(m/e 10.416,保留时间为0.327 min)、龙胆酸(m/e 36.168,保留时间为0.429 min)、紫苏酸(m/e 100.312,保留时间为11.039 min)、槲皮素(m/e 2.341,保留时间为8.667 min)、4-仲丁酚(m/e 43.464,保留时间为0.429 min)与根匍柄菌素(m/e 11.237,保留时间为16.969 min),以及其他含量较多的糖类脂肪类物质。前人报道发现红色花生品种中主要多酚成分为原花青素、儿茶素、没食子酸等多酚物质[22],而对黑色花生外皮而言,主要为花青素、阿魏酸和槲皮素等多酚物质[23]。这主要是因为除了溶剂种类、浓度、提取方式的影响外,花生种类也是造成化学组成差异的原因[24]。
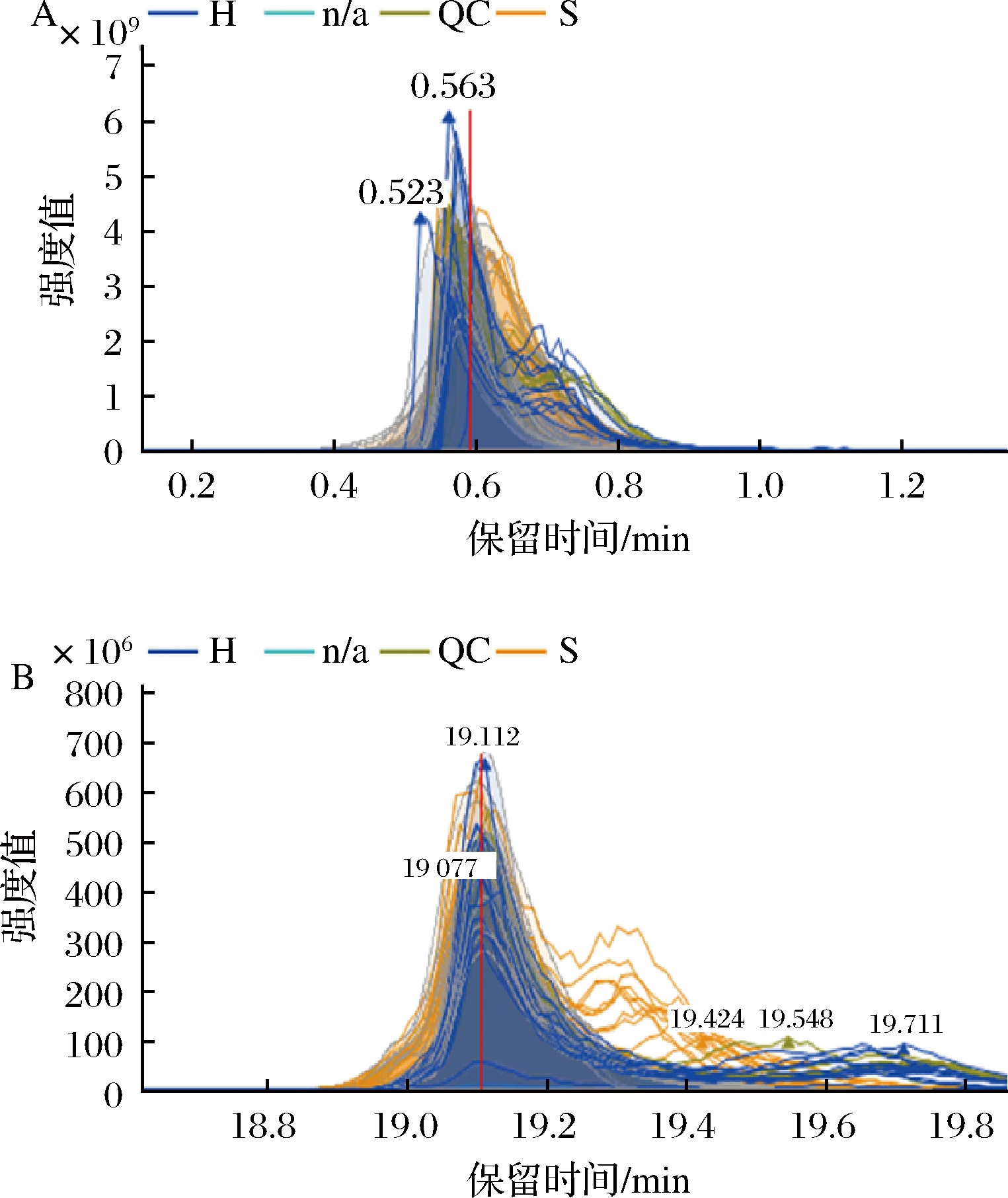
A-正离子色谱图;B-负离子色谱图
图2 PSE的色谱图
Fig.2 Chromatogram of PSE
2.4 PSE抗氧化性能
PSE的抗氧化性如图3所示,随着PSE浓度增加,对DPPH自由基的清除率升高,而在相同的测定浓度范围内,高浓度PSE对ABTS阳离子自由基的清除率并未有显著的差异。当PSE质量浓度为500 μg/mL 时,PSE对2种自由基的最大清除率分别为93.93%(DPPH)与99.62%(ABTS),该结果还表明PSE对ABTS清除效果优于DPPH。这是因为PSE中多酚化合物的苯环上含有大量羟基,可通过氢原子从活性基团上转移到自由基上来清除自由基;CAO等[25]发现花生红衣中的二苯乙烯类化合物反式白藜芦醇的供氢(或原子脱氢)反应是其具有优异自由基清除能力的原因。酚羟基在对位羟基上供氢(或原子脱氢)的反应,以及苯氧基4位上未配对的电子与二苯乙烯骨架的π电子之间发生π共轭效应,所生成稳定半醌自由基,导致了提取物具有较强的自由基清除能力[26]。
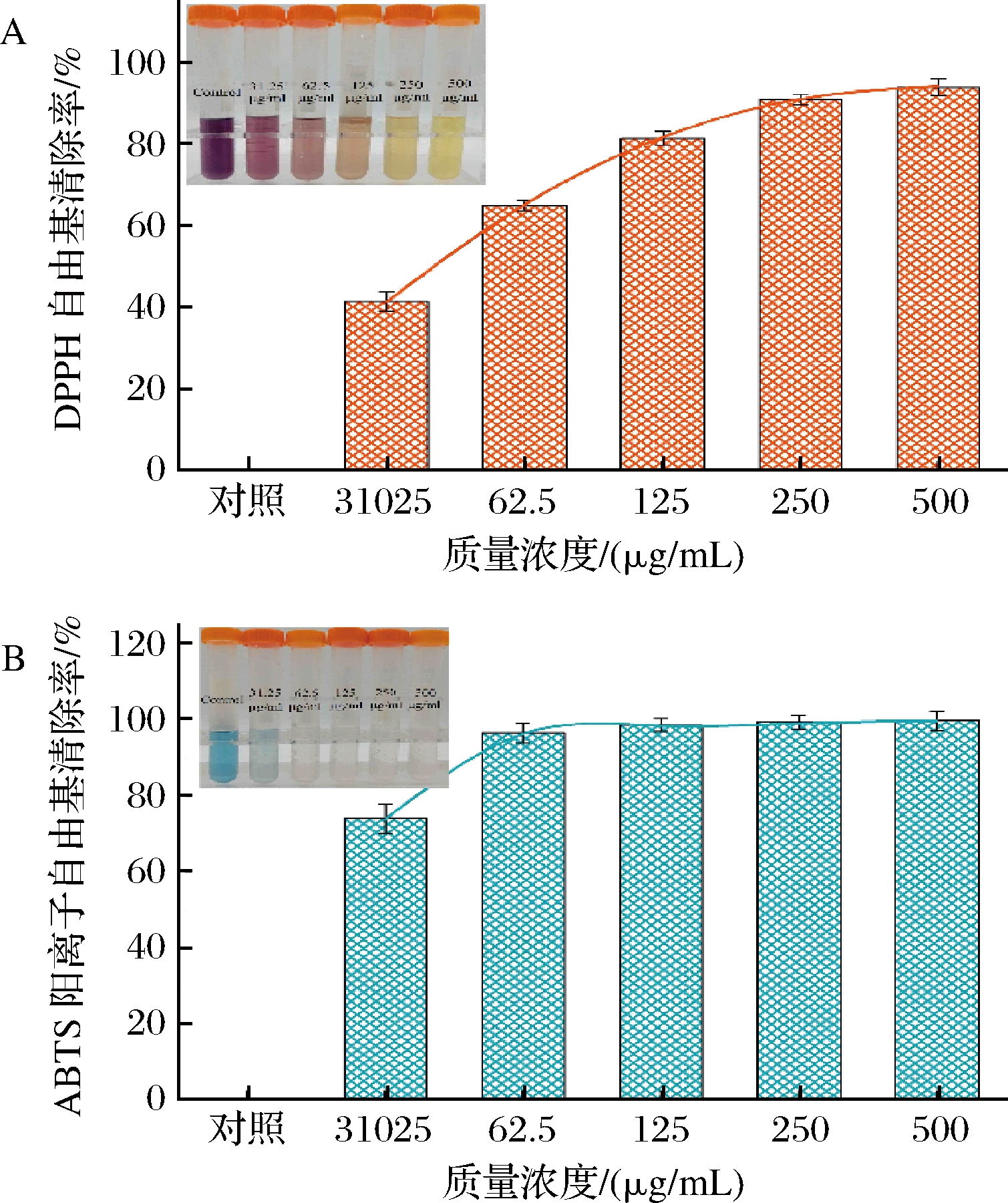
A-DPPH自由基清除率;B-ABTS阳离子自由基清除率
图3 PSE的DPPH自由基、ABTS阳离子自由基清除率
Fig.3 The DPPH and ABTS radical scavenging activity of PSE
2.5 PSE最小抑菌浓度与抗菌效果
不同浓度PSE提取物对4种革兰氏阳(阴)细菌的最小抑菌浓度如表3所示。
表3 PSE对4种细菌的MIC
Table 3 MIC of PSE to 4 kinds of bacteria

细菌种类阳性对照PSE质量浓度/(mg/mL)11.25.62.81.40.70.350.175阴性对照+---++++-S.aureus+----+++-+----+++-+---++++-E.coli+--+++++-+---++++-+----+++-S.typhimurium+----+++-+----+++-+---++++-L.monocytogenes+---++++-+--+++++-
注:“+”表示溶液中有细菌繁殖生长,“-”表示溶液中无细菌繁殖生长。
PSE对S.aureus与S.typhimurium的最小抑菌浓度为1.4 mg/mL;对E.coli与L.monocytogenes的最小抑菌浓度为2.8 mg/mL。研究表明花生红衣与花生壳的提取物对革兰氏阴性细菌的抗菌活性大于革兰氏阳性细菌[27],但也有研究报道花生及其副营养物(花生壳、花生红衣)提取物对革兰氏阴性细菌有更好的抑菌效果[28]。为了进一步探究PSE对细菌的抑菌效果,采用琼脂扩散法测定了不同浓度PSE的抑菌效果,抑菌直径如图4所示,当PSE浓度小于MIC时,对细菌并未产生任何抑菌效果,随着PSE的浓度增大,对细菌的抑制效果越为明显,这与MIC结果一致。抑菌直径的结果表明PSE对4种细菌的抑菌效果为S.typhimurium>S.aureus>E.coli>L.monocytogenes。

培养皿上的数字1~6分别代表PSE的质量浓度为
0.175、0.35、0.7、1.4、2.8、5.6 mg/mL
A-S.aureus;B-E.coli;C-S. typhimurium;D-L. monocytogene
图4 不同浓度的PSE对菌株的抑菌效果
Fig.4 The bacteriostatic effects of PSE with different concentrations on strains
3 结论
花生红衣多酚提取工艺参数影响因素由大到小依次为乙醇体积分数、超声温度、超声时间、料液比,结果值预测有效;最优工艺参数分别为超声时间40 min,超声温度60 ℃,料液比值为0.05 g/mL,乙醇体积分数80%,最终提取的TPC为137 mg/g。LC-MS 结果表明,PSE中多酚活性化学成分主要为百里酚(m/e 7 962.537)和儿茶素(m/e 2 607.77)等;PSE对DPPH与ABTS均具有优异的抗氧化能力,当PSE质量浓度为500 μg/mL时,PSE对2种自由基的最大清除率分别为93.93%(DPPH)与99.62%(ABTS)。PSE对S.aureus与S.typhimurium的MIC为1.4 mg/mL,对E.coli与L.monocytogenes的MIC为2.8 mg/mL;琼脂扩散试验结果表明PSE对4种细菌的抑菌效果依次为S.typhimurium>S.aureus>E.coli>L.monocytogenes。
[1] SALES J M, RESURRECCION A V A.Maximising resveratrol and piceid contents in UV and ultrasound treated peanuts[J].Food Chemistry, 2009, 117(4):674-680.
[2] 高锦鸿, 芦鑫, 孙强, 等.不同品种花生红衣中八种酚类物质成分分析[J].食品与发酵工业, 2022, 48(14):218-225.
GAO J H, LU X, SUN Q, et al.Analysis of eight phenolic contents in peanuts skin from different cultivars[J].Food and Fermentation Industries, 2022, 48 (14):218-225.
[3] MARTEL J, OJCIUS D M, KO Y F, et al.Hormetic effects of phytochemicals on health and longevity[J].Trends in Endocrinology &Metabolism, 2019, 30(6):335-346.
[4] SARKAR P, THIRUMURUGAN K.Modulatory functions of bioactive fruits, vegetables and spices in adipogenesis and angiogenesis[J].Journal of Functional Foods, 2019, 53:318-336.
[5] RAUF A, IMRAN M, ABU-IZNEID T, et al.Proanthocyanidins:A comprehensive review[J].Biomedicine and Pharmacotherapy, 2019, 116:108999.
[6] YU J M, AHMEDNA M, GOKTEPE I, et al.Peanut skin procyanidins:Composition and antioxidant activities as affected by processing[J].Journal of Food Composition and Analysis, 2006, 19(4):364-371.
[7] LIAO J Q, GUO Z R, YU G C.Process intensification and kinetic studies of ultrasound-assisted extraction of flavonoids from peanut shells[J].Ultrasonics Sonochemistry, 2021, 76:105661.
[8] 邢敏, 费鹏, 史恩聪, 等.响应面法优化杜仲雄花多酚提取工艺及其抗氧化活性[J].食品科技, 2021, 46(7):201-207;214.
XING M, FEI P, SHI E C, et al.Optimization of extraction and antioxidant activity of polyphenols from Eucommia ulmoides male flower by response surface methodology[J].Food Science and Technology, 2021,46(7):201-207;214.
[9] 沈伟, 张一文.乌药叶多酚提取工艺优化及其对金黄色葡萄球菌的抑菌作用[J].食品安全质量检测学报, 2022, 13(4):1256-1263.
SHEN W, ZHANG Y W.Optimization of extraction technology of polyphenols from leaves of Lindera aggregata and its antibacterial effect against Staphylococcus aureus[J].Journal of Food Safety and Quality, 2022, 13(4):1256-1263.
[10] 李萍, 舒展, 胡矗垚, 等.姜辣素的超声波法提取及其抑菌活性研究[J].中国调味品, 2017, 42(10):160-164;175.
LI P, SHU Z, HU C Y, et al.Ultrasonic extraction of gingerol and its antibacterial activity[J].China Condiment, 2017, 42(10):160-164;175.
[11] 冯戏雨, 李萍, 朱婧婧, 等.超声波法提取蒲公英中绿原酸的工艺优化研究[J].保鲜与加工, 2019, 19(6):112-116.
FENG X Y, LI P, ZHU J J, et al.Optimization of ultrasonic extraction technology of chlorogenic acid from dandelion[J].Storage and Process, 2019, 19(6):112-116.
[12] ALAM P, NOMAN O M, HERQASH R N, et al.Response surface methodology (RSM)-based optimization of ultrasound-assisted extraction of sennoside A, sennoside B, Aloe-emodin, emodin, and chrysophanol from Senna alexandrina (aerial parts):HPLC-UV and antioxidant analysis[J].Molecules, 2022, 27(1):298.
[13] 宋昱, 方策, 马飞, 等.不同品种花生衣原花青素含量及抗氧化活性研究[J].山东农业科学, 2020, 52(6):108-114.
SONG Y, FANG C, MA F, et al.Study on proanthocyanidin contents and antioxidant activities of seed coats of different peanut varieties[J].Shandong Agricultural Sciences, 2020, 52(6):108-114.
[14] MUNOZ E, VELASQUEZ P, RODRIGUEZ K, et al.Influence of Brassica campestris and Galega officinalis on antioxidant activity of bee pollen[J].Revista Brasileira de Farmacognosia, 2020, 30(3):444-449.
[15] MAHINDRAKAR K V, RATHOD V K.Ultrasonic assisted aqueous extraction of catechin and gallic acid from Syzygium cumini seed kernel and evaluation of total phenolic, flavonoid contents and antioxidant activity[J].Chemical Engineering and Processing-Process Intensification, 2020, 149:107841.
[16] JAEGER D, SIMPSON B S, NDI C P, et al.Biological activity and LC-MS/MS profiling of extracts from the Australian medicinal plant Acacia ligulata (Fabaceae)[J].Natural Product Research, 2018, 32(5):576-581.
[17] LI K, MA C Y, JIAN T C, et al.Making good use of the byproducts of cultivation:Green synthesis and antibacterial effects of silver nanoparticles using the leaf extract of blueberry[J].Journal of Food Science and Technology-Mysore, 2017, 54(11):3569-3576.
[18] AMENDOLA V, BAKR O M, STELLACCI F.A study of the surface plasmon resonance of silver nanoparticles by the discrete dipole approximation method:Effect of shape, size, structure, and assembly[J].Plasmonics, 2010, 5(1):85-97.
[19] 李宪钞, 谭姣, 刘梦海, 等.超声辅助提取玉米苞叶中类胡萝卜素及其稳定性研究[J].分子植物育种, 2019, 17(17):5783-5791.
LI X C, TAN J, LIU M H, et al.Ultrasound-assisted extraction and stability of total carotenoids from corn bract[J].Molecular Plant Breeding, 2019, 17(17):5783-5791.
[20] 吴青莹, 宋莹莹, 邢思熙, 等.香蕉皮类胡萝卜素提取工艺条件的研究[J].中国食物与营养, 2016, 22(4):32-34.
WU Q Y, SONG Y Y, XING S X, et al.Research on carotenoids extraction process from banana peel[J].Food and Nutrition in China, 2016, 22(4):32-34.
[21] REUNGOAT V, GAUDIN M, FLOURAT A L, et al.Optimization of an ethanol/water-based sinapine extraction from mustard bran using response surface methodology[J].Food and Bioproducts Processing, 2020, 122:322-331.
[22] CHANG M, SUN X T, GUO X, et al.Composition and antioxidant study of procyanidins from peanut skins[J].Journal of Food Measurement and Characterization, 2020, 14(5):2781-2789.
[23] KIM M Y, KIM H J, LEE Y Y, et al.Antioxidant and anti-inflammatory effects of peanut (Arachishypogaea L.) skin extracts of various cultivars in oxidative-damaged HepG2 cells and LPS-induced raw 264.7 macrophages[J].Food Science &Nutrition, 2020, 9(2):973-984.
[24] AMEER K, SHAHBAZ H M, KWON J H.Green extraction methods for polyphenols from plant matrices and their byproducts:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2017, 16(2):295-315.
[25] CAO H, PAN X L, LI C, et al.Density functional theory calculations for resveratrol[J].Bioorganic &Medicinal Chemistry Letters, 2003, 13(11):1869-1871.
[26] PAPUC C, GORAN G V, PREDESCU C N, et al.Plant polyphenols as antioxidant and antibacterial agents for shelf-life extension of meat and meat products:Classification, structures, sources, and action mechanisms[J].Comprehensive Reviews in Food Science and Food Safety, 2017, 16(6):1243-1268.
[27] ZHONG T C, LIANG Y, JIANG S, et al.Physical, antioxidant and antimicrobial properties of modified peanut protein isolate based films incorporating thymol[J].RSC Advances, 2017, 7(66):41610-41618.
[28] DO VALLE CALOMENI A, DE SOUZA V B, TULINI F L, et al.Characterization of antioxidant and antimicrobial properties of spray-dried extracts from peanut skins[J].Food and Bioproducts Processing, 2017, 105:215-223.