20世纪七十年代初FROMMER等从犹他游动放线菌的培养液中分离得到一种C7 N-氨基环醇类假性四糖物质即阿卡波糖(acarbose)[1-2],它的结构组成包括不饱和氨基环醇、脱氧己糖和麦芽糖3个部分[3]。阿卡波糖是一种竞争性的α-葡萄糖苷酶抑制剂,由于它能够通过抑制小肠壁细胞的α-葡糖苷酶活性,以减缓肠道中寡糖、双糖或多糖的消化吸收,从而降低餐后血糖水平[4]。因此自1990年以来,一直被用作Ⅱ型糖尿病的常用药物[5]。常压室温等离子体(atmospheric pressure room temperature plasma,ARTP)作为一种新型的高效诱变技术,具有突变效率高、突变谱图广、操作简单、且安全无污染等特点,是现代发酵工业中选育优势突变菌株和构建高附加值微生物细胞工厂的有效方法之一[6-7]。但是,由于突变的方向具有不确定性,如何快速、高效的从数以万计的突变子文库中筛选得到阳性菌株至关重要,因此建立阿卡波糖高通量筛选方法是十分必要的。
目前针对于放线菌突变菌株的筛选方法,常用的是基于理化性质的筛选方法,比如利用抑菌圈或抗性进行初筛,然后再进行摇瓶发酵[8],并利用HPLC对其进行定量分析,比较费时费力,且无法实现对大量突变株文库进行分离筛选[9]。由于阿卡波糖不具有抑菌能力,单纯依靠抗性初筛并不能达到较高筛选效果,而对所有突变菌均进行HPLC检测工作量大效率低。而以微孔板作为载体的高通量筛选技术,目前在放线菌生物活性物质的筛选、菌种筛选以及新药的研发[10-13]等方面得到广泛应用。近些年,α-淀粉酶抑制剂筛选的碘-淀粉比色法[14]、3,5-二硝基水杨酸(3, 5-dinitrosalicylic acid,DNS)[15]、电泳法[16],以及微量板筛选方法[17]在产阿卡波糖菌株的筛选中相继得到运用[18-20]。与其他方法相比较,微量孔板筛选一次可以实现对大批量样品同时检测,高效便捷,大大节约了菌株选育的时间成本以及经济成本。当前,多孔板培养技术已经在微生物学领域得到了成功的应用,相对于传统摇瓶培养,该技术具有高平行度,高效率,低工作量,低消耗等优势[21-22]。将多孔板培养与微量板筛选技术相结合,可以从培养检测双方面来节省人力和时间,大大提高工作效率。
本研究采用新型ARTP育种方法[23-25]诱变阿卡波糖产生菌游动放线菌,建立多孔板发酵结合酶标仪检测的高通量筛选模型,并在孔板中对种子培养基和摇瓶发酵培养基进行组合式优化,以提高孔板发酵效率,为后续利用孔板发酵快速筛选阿卡波糖高产菌提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种
游动放线菌(Actinoplanes sp.SE50)实验室保藏菌种。
1.1.2 培养基
分离、斜面培养基(g/L):蔗糖30、蛋白胨5、L-酪氨酸1、KCl 0.5、MgSO4·7H2O 0.5、K2HPO4·3H2O 1、琼脂18,pH 7.0~7.3。
种子培养基(g/L):黄豆饼粉40、丙三醇20、玉米淀粉10、碳酸钙2,pH 6.4~7.0。
摇瓶发酵培养基(g/L):葡萄糖23、麦芽糖96、黄豆饼粉10、CaCl2 3.5、谷氨酸钠5、K2HPO4·3H2O 1、丙三醇5、碳酸钙3、FeCl3·6H2O 0.5,pH 6.4~6.7。
24孔板发酵培养基(g/L):黄豆饼粉30、丙三醇15、碳酸钙4、玉米淀粉10、葡萄糖23、麦芽糖96、CaCl2 3.5、谷氨酸钠5、K2HPO4·3H2O 1、FeCl3·6H2O 0.5,pH 6.4~6.7。
1.2 阿卡波糖快速检测方法的建立
1.2.1 阿卡波糖测定原理
2-氯-4-硝基苯-α-半乳糖-麦芽糖苷(2-chloro-4-nitrophenyl-α-galactopyranosylmaltoside,Gal-G2-α-CNP)作为测定淀粉酶活力的常用试剂,可以被α-淀粉酶水解为两部分且无副产物生成,其中水解产物2-氯-4-硝基苯酚(2-chloro-4-nitrophenol,CNP)在特定波长具有特征吸收峰,该过程不需要任何的辅助因子参与[17]。
阿卡波糖能够与淀粉酶产生竞争性结合作用,从而阻碍淀粉酶与底物的正常结合,抑制产物生成。利用这一原理,建立了底物-酶-抑制剂筛选模型。
1.2.2 CNP检测波长的选择
取适量0.10 mmol/L的CNP标准溶液,全波长扫描测定最大吸收峰波长。
对该酶催化反应的产物以及不添加淀粉酶添加检测样品阿卡波糖的体系进行全波长扫描,以pH 6.5的磷酸氢二钠-柠檬酸缓冲液作为参比,确定产物的最佳检测波长,以排除反应体系中其他物质的干扰。
1.2.3 不同pH下CNP标准曲线
由于CNP的摩尔消光系数(ε)随溶液pH变化很大,为确定酶促反应产物的最佳检测pH范围,测定了pH 2.2、3.0、4.8、5.5、6.0、6.5、7.0、7.5、8.0条件下不同浓度CNP的显色情况。
1.2.4 最适反应条件的优化
由于温度、pH、反应时间等是酶催化反应的重要影响因素,为了保证α-淀粉酶活力发挥到最大,分别对这3个因素进行了考察。
基于CNP在不同pH条件下吸光度稳定性,所选反应体系磷酸氢二钠-柠檬酸缓冲液pH区间为5.0~7.5。按照200 μL反应体系,在96孔板内依次加入pH分别为5.0、5.5、6.0、6.5、7.0、7.5的磷酸氢二钠-柠檬酸缓冲液130 μL,5 mmol/L Gal-G2-α-CNP溶液40 μL,10 U/mL α-淀粉酶溶液30 μL,反应每隔10 min用酶标仪检测一次,直至反应趋于稳定,以确定最佳反应pH及时间。在最佳pH和时间下分别在26、28、30、32、34、36 ℃反应,以确定酶促反应最佳温度。
1.3 阿卡波糖快速检测方法的优化
1.3.1 酶催化反应比例的优化
取5 mmol/L的Gal-G2-α-CNP溶液10、20、30、40、50 μL,分别加入10 U/mL α-淀粉酶溶液10、20、30、40、50、60、70、80 μL,pH 6.5的磷酸氢二钠-柠檬酸缓冲液稀释到200 μL,摇匀。以缓冲液为空白参比,30 ℃反应50 min后,在最佳检测波长处检测吸光度,构建标准曲线以确定中Gal-G2-α-CNP溶液添加量。
1.3.2 检测样品阿卡波糖添加量的确定
在200 μL反应体系中,通过调节缓冲溶液体积,分别加入0.1 g/L的阿卡波糖标准溶液10、20、30、40、50、60 μL,30 ℃反应50 min后酶标仪检测,确定反应体系中抑制剂的最优添加量。
1.3.3 抑制曲线的建立
在最适反应体系要求下按序加入缓冲液、底物Gal-G2-α-CNP、不同浓度的抑制剂阿卡波糖标准溶液及α-淀粉酶溶液,在最优情况下反应完成后,酶标仪测定其OD值。以未添加阿卡波糖溶剂为对照,计算各浓度阿卡波糖下抑制率。抑制率计算如公式(1)所示:
抑制率![]()
(1)
式中:A0为未添加阿卡波糖时反应体系的OD值;A1为添加阿卡波糖后反应体系的OD值。
以阿卡波糖浓度为横坐标,抑制率为纵坐标构建抑制曲线。
1.3.4 加标回收试验
取已知浓度的抑制剂阿卡波糖溶液,按优化后方法进行反应,酶标仪测定吸光值,计算回收率。
1.3.5 酶标仪与HPLC方法检测阿卡波糖的拟合验证
分别采用酶标仪及HPLC法检测ARTP诱变所得突变株经孔板发酵的阿卡波糖效价,并采用Origin软件分析两种方法检测结果拟合曲线。
1.4 孔板发酵
1.4.1 孔板类型选择及优化
随机足量不同菌株进行24、48孔板与摇瓶发酵产量相关性比对,筛选出较适宜高通量筛选的孔板结构类型。并对所选孔板发酵培养基中黄豆饼粉、丙三醇(甘油)、碳酸钙含量进行正交优化。
1.4.2 孔板孔间差异考察
采用同一菌株的孔板发酵检测产量,考察孔板孔间差异大小。
1.4.3 孔板发酵培养基优化
为减少种子培养过程,节约筛选时间及工作量,采用平板菌落直接发酵的方法,对种子培养基和发酵培养基差异成分进行整合分析和正交优化,得出最佳孔板发酵条件,并对孔板发酵过程进行考察。
2 结果与分析
2.1 阿卡波糖快速检测方法的建立
2.1.1 CNP检测波长及pH测定范围的选择
为了确定生成产物CNP的最适吸收波长,如图1-a所示,对CNP标准液进行全波长检测,发现CNP最大吸收波长为398 nm。同时,对该酶催化反应体系进行全波长扫描结果显示(图1-b),其在398 nm处也表现出特征吸收峰,可见该酶促反应特异性生成CNP。底物Gal-G2-α-CNP与待检测样品混合物(不加α-淀粉酶溶液)扫描结果显示(图1-b),其在398 nm处无吸收,因此可排除其检测干扰。

a-CNP (0.10 mmol/L)全波长扫描;b-酶促反应体系扫描曲线及底物Gal-G2-α-CNP与待检测样品混合物(不加α-淀粉酶溶液)扫描曲线;c-不同pH条件下CNP的标准曲线
图1 CNP全波长扫描及pH对吸光度影响
Fig.1 CNP full-wavelength scanning and the effect of pH on absorbance
pH对CNP的摩尔吸光系数ε影响显著[17]。本研究测定了pH 2.2~8.0的不同浓度CNP的显色情况,并绘制出标准曲线。当pH值低于3.0时,与对照缓冲液相比,无明显吸收。当pH值为4.8~8.0时,结果如图1-c所示。当pH值处于6.0以下,pH增大,CNP在398 nm处吸光度也明显增加;当pH值达到6.0以上,CNP的吸光度基本稳定,且与浓度之间有良好的相关性。
2.1.2 CNP检测波长及pH测定范围的选择
pH以及温度会影响酶促反应,通过优化反应的pH以及温度表明(图2),在pH值为6.5、温度为30 ℃时,反应效果最好。且由图2-a可知,反应在50 min 后吸光度基本稳定。因此在后续实验中以pH 6.5、30 ℃反应50 min为最佳条件。
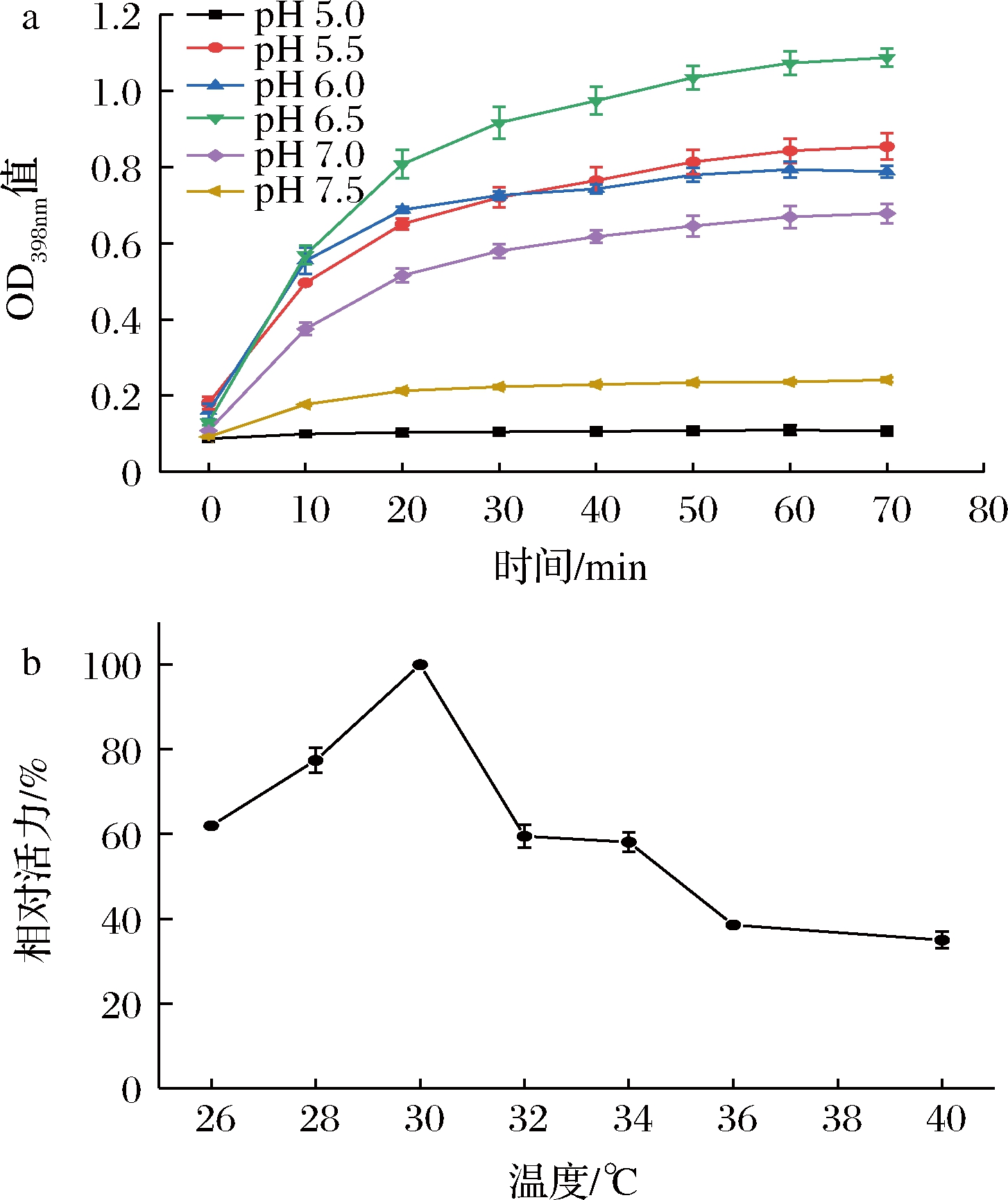
a-不同pH条件下反应体系进程曲线;b-不同反应温度对吸光度的影响
图2 pH、温度及反应时间对反应的影响
Fig.2 Effects of pH, temperature and reaction time on enzyme-catalyzed reaction
2.2 阿卡波糖快速检测方法的优化
2.2.1 底物Gal-G2-α-CNP溶液添加量及阿卡波糖溶液添加量的优化
通过优化底物Gal-G2-α-CNP溶液添加量发现(图3-a),在200 μL体系中,当α-淀粉酶浓度在0.5~4.0 U/mL,底物Gal-G2-α-CNP溶液添加量低于30 μL时,吸光度变化明显;底物Gal-G2-α-CNP溶液添加量高于30 μL时,吸光度相当稳定,且在底物添加量为40 μL时,线性关系最好,线性方程为y=0.671 14x+0.125 68(R2=0.999 93)。分析原因可能是由于α-淀粉酶的量不足以完全催化Gal-G2-α-CNP反应形成CNP,所以底物必须过饱和。故每200 μL体系中,选择5 mmol/L Gal-G2-α-CNP 40 μL、10 U/mL α-淀粉酶溶液30 μL为最佳反应比例。
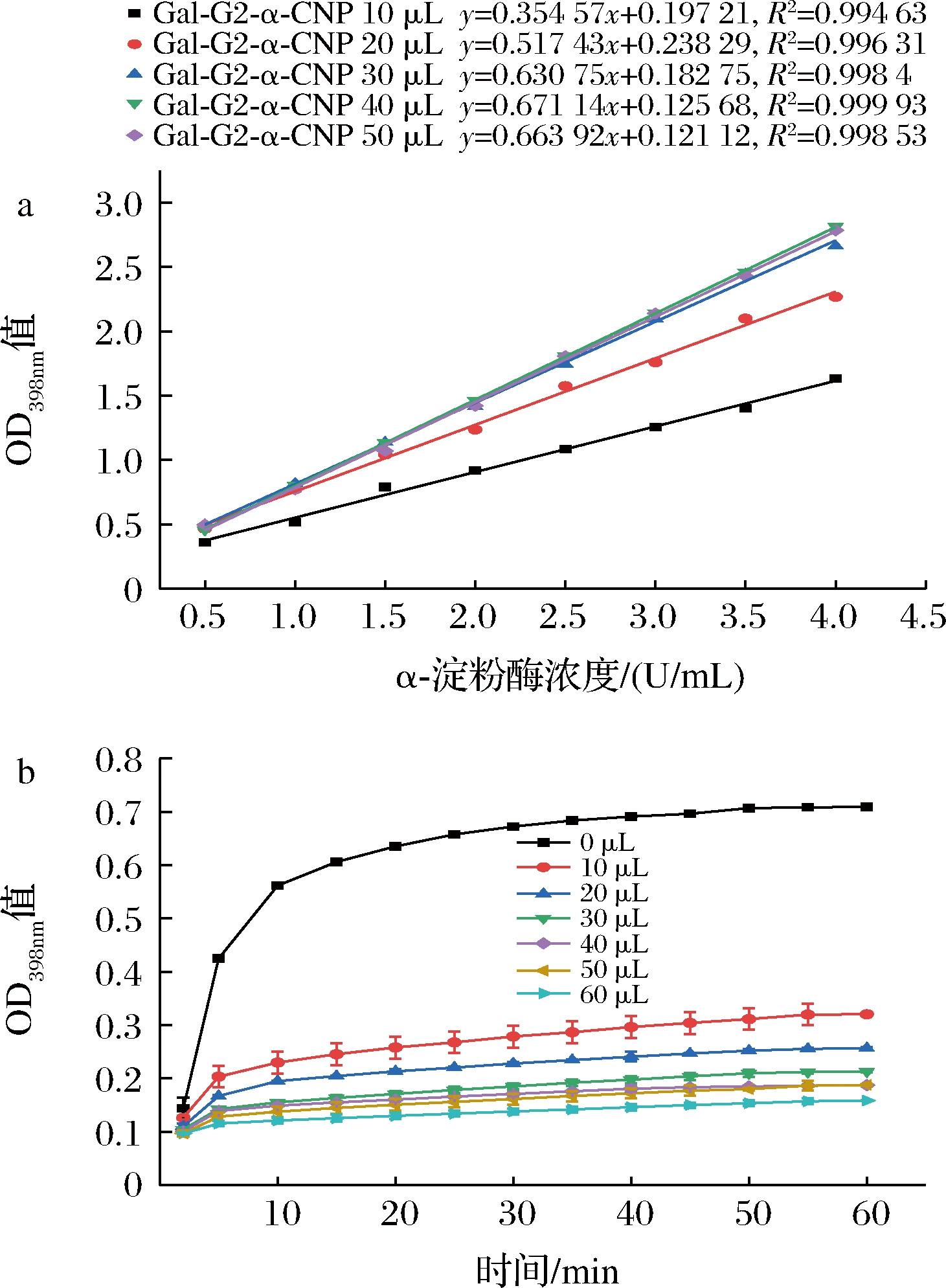
a-Gal-G2-α-CNP添加量对吸光度的影响;b-不同阿卡波糖添加体积下进程曲线
图3 Gal-G2-α-CNP及阿卡波糖添加量对反应的影响
Fig.3 Effect of Gal-G2-α-CNP and acarbose addition on the reaction
通过分析阿卡波糖检测阈值发现,向200 μL体系分别添加10、20、30、40、50、60 μL阿卡波糖标准溶液的结果如图3-b所示。当阿卡波糖添加量在10~30 μL时,反应后体系的吸光度值波动较大;当阿卡波糖添加量大于30 μL时,吸光度波动相对较小,且添加40 μL 阿卡波糖时,反应后期吸光度更稳定。故检测样品阿卡波糖添加量为40 μL。
综上,阿卡波糖快速检测方法反应体系为40 μL 5 mmol/L Gal-G2-α-CNP溶液、30 μL 10 U/mL α-淀粉酶溶液、40 μL检测样品及90 μL pH 6.5的磷酸氢二钠-柠檬酸缓冲液,30 ℃反应50 min于398 nm波长处检测。
2.2.2 抑制率曲线的建立及拟合验证
根据上述优化的反应体系及抑制率计算公式,经多次实验测定,对结果进行非线性拟合,得到如图4-a所示标准曲线:y=106.491 12+13.747 75 ln(x-0.004 85),R2=0.999 31。
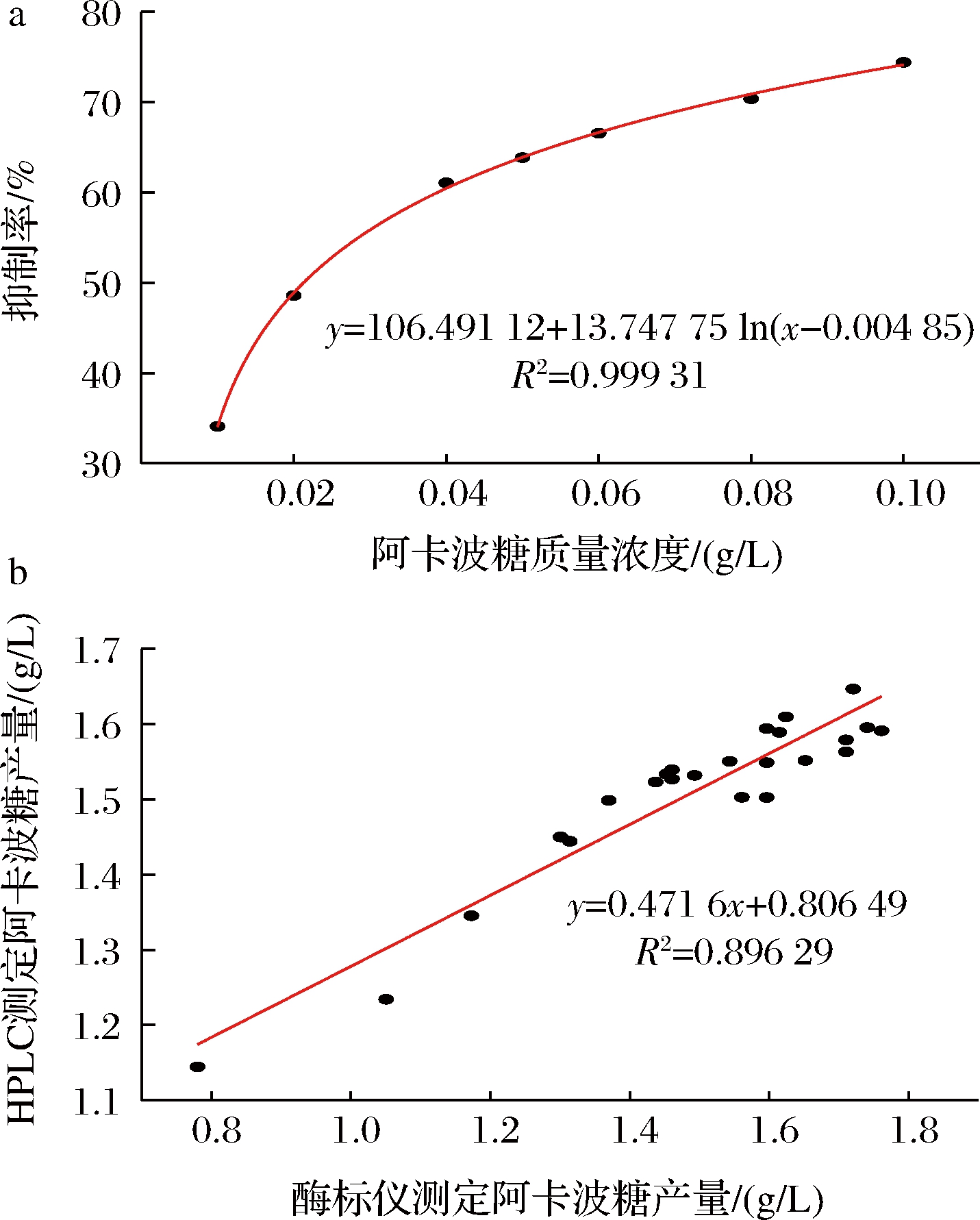
a-不同浓度阿卡波糖对该反应的抑制率;b-酶标仪与HPLC测定阿卡波糖产量之间的相关性
图4 抑制率标准曲线及拟合验证
Fig.4 Standard curve of inhibition rate and its fitting verification
为验证试样前处理过程对结果测定是否有影响,以及在测定过程中有无基体构成干扰,需做加标回收实验。由表1可知,回收率在98%~102%,平均回收率为100.126 277%,相对标准偏差(relative standard deviation,RSD)为1.446 613%。由实验结果中显示的酶标仪测定阿卡波糖加样回收率,可得出实验过程中几乎可忽略前处理过程及水溶液基体对样品测定的影响。
表1 加标回收率
Table 1 Recovery rate of standard addition
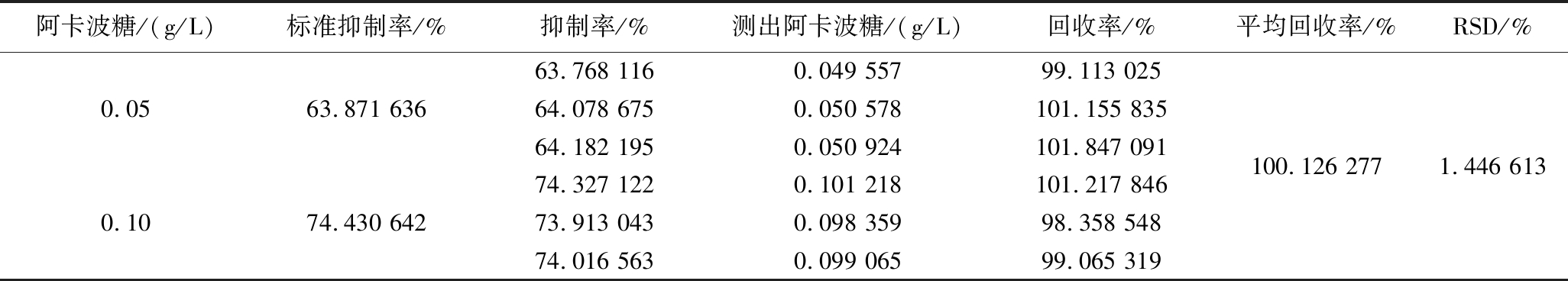
阿卡波糖/(g/L)标准抑制率/%抑制率/%测出阿卡波糖/(g/L)回收率/%平均回收率/%RSD/%63.768 116 0.049 55799.113 0250.0563.871 63664.078 6750.050 578101.155 83564.182 195 0.050 924101.847 091100.126 2771.446 61374.327 1220.101 218101.217 8460.1074.430 64273.913 0430.098 35998.358 54874.016 5630.099 06599.065 319
该方法的合理性可以通过与HPLC测定数据的相关性分析得到证实。相关系数分析的正绝对值和正负分别代表着相关强度与方向。在文献中,统计学家给出了一个确定相关强度大小的指标,R2=0.7为一个相对较高的相关系数[26]。由图4-b可知,拟合曲线的相关值R2=0.896 29,这表明酶标仪与HPLC法测定发酵液中阿卡波糖产量具有很好的相关性,在具有较多发酵样品时,可以采用酶标仪来快速、高效测定。
2.3 孔板发酵条件优化
2.3.1 孔板类型的选择
为了能更省时省力地进行大批量的菌株选育,本研究随机挑选了30株不同性状的游动放线菌,在24孔和48孔板中进行发酵,并与摇瓶培养产量之间进行相关性分析对比,选择出更合适的板型进行高通量筛选,结果见图5。

a-突变株24孔板与摇瓶发酵产量之间的相关性;b-突变株48孔板与摇瓶发酵产量之间的相关性
图5 24、48孔板与摇瓶发酵产量之间的相关性拟合
Fig.5 Correlation fitting between 24,48-microwell plates and fermentation yield in shaking flask
由图5可知,24孔板与摇瓶发酵产量的相关性系数(R2)高于48孔板(0.881 61>0.833 74),因此24孔板发酵产量与摇瓶发酵产量更接近,原因可能与溶氧量有关。因此选择24孔板发酵来达到快速筛选要求。
2.3.2 孔间差异对于阿卡波糖发酵的影响
根据文献报道,部分菌种进行孔板发酵结果存在孔间差异[27]。为避免存在孔间差异对后续筛选结果造成干扰,本实验采用同一菌株对24孔板发酵孔间差异特性进行了检验。结果如图6-b所示,阿卡波糖产量中间孔1区<长边缘孔2区<短边缘孔3区(图6-a),这种边缘效应可能与溶氧量或孔间水分蒸发分布不均有关。参考文献[27],后续考虑通过在边缘孔位置填充2 mL培养基或无菌水来有效减少边缘效应产生的影响。对此进行实验验证,结果如表2所示,在P=0.05显著水平下,此种方法下中间孔孔间差异不显著。
表2 中间孔孔间差t检验
Table 2 t-test of the difference between intermediate holes
样本(N)平均值标准差变异系数标准误t统计值自由度概率>|t|241.703 020.076 064.466 180.015 53-0.119 53230.905 9

a-24孔板位置示意图;b-24孔板不同区域阿卡波糖产量
图6 孔板不同区域阿卡波糖产量
Fig.6 Acarbose yield in different regions of orifice plate
注:不同小写字母表示不同类型孔间存在显著性差异(P<0.05)。
2.3.3 孔板发酵培养基优化
为减少筛选过程工作量及时间,本实验将种子液培养和发酵培养过程进行了整合,采取直接挑菌进行孔板发酵的方式。为保证孔板发酵培养保留有种子培养基的扩培作用和发酵培养基对产物合成作用,综合对比分析了种子培养基和发酵培养基成分差异。本实验采用L9(34)正交试验设计方法对黄豆饼粉、丙三醇(甘油)、碳酸钙3种因素进行考察(表3)。
表3 因素水平表
Table 3 Factor level table

水平黄豆饼粉(A)/%甘油(B)/%碳酸钙(C)/%110.50.3231.50.4352.50.5
24孔板发酵结果分析如表4、表5所示,由实验结果极差分析可知,黄豆饼粉对游动放线菌产阿卡波糖发酵水平的影响大于甘油大于碳酸钙(A>B>C),且A(黄豆饼粉)影响显著。通过正交试验得出的最优组为试验4,而直观分析得出的最优组为A2B2C2,按照试验组4、A2B2C2条件进行发酵,以原始培养基发酵为对照,对3组实验结果进行对比,得出阿卡波糖发酵产量A2B2C2>试验组4>对照组,试验组A2B2C2条件下,阿卡波糖产量为(2 183.66±6.60) μg/mL,比对照组(1 744.13±72.13) μg/mL提高了25.2%。因此最后得出24孔板发酵培养基最优结果为黄豆饼粉3%,甘油1.5%,碳酸钙0.4%。
表4 孔板发酵优化结果与分析
Table 4 Optimization results and analysis of pore plate fermentation
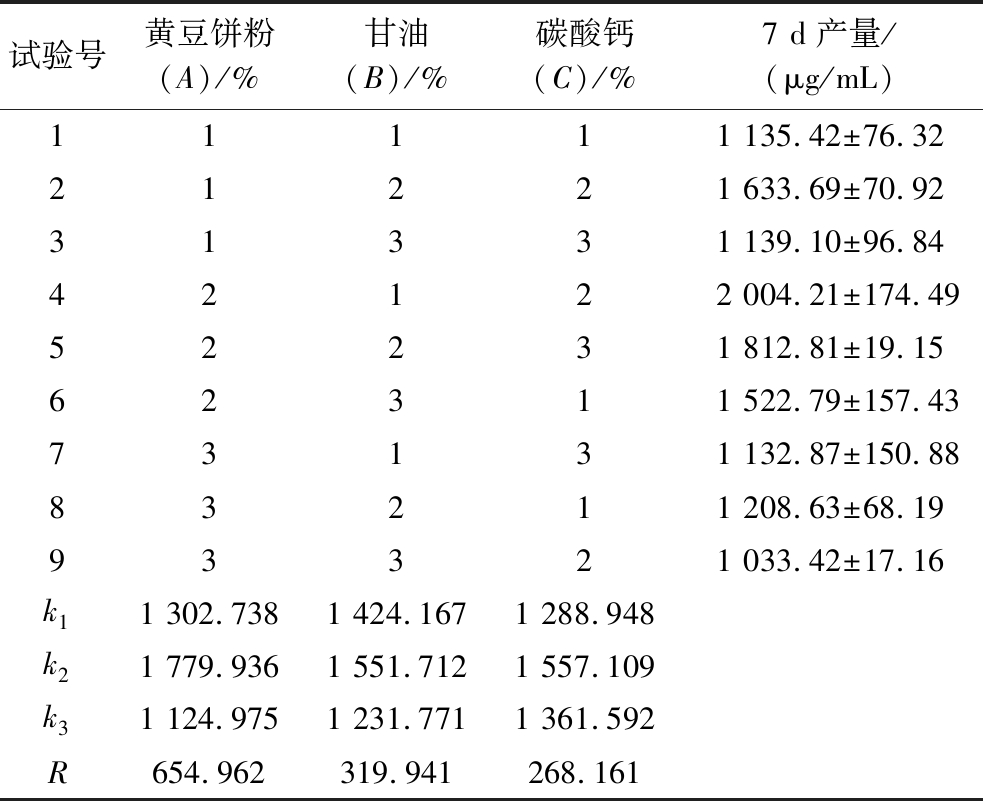
试验号黄豆饼粉(A)/%甘油(B)/%碳酸钙(C)/%7 d产量/(μg/mL)11111 135.42±76.3221221 633.69±70.9231331 139.10±96.8442122 004.21±174.4952231 812.81±19.1562311 522.79±157.4373131 132.87±150.8883211 208.63±68.1993321 033.42±17.16k11 302.7381 424.1671 288.948k21 779.9361 551.7121 557.109k31 124.9751 231.7711 361.592R654.962319.941268.161
表5 孔板发酵优化结果方差分析
Table 5 Analysis of variance of optimization results of pore plate fermentation
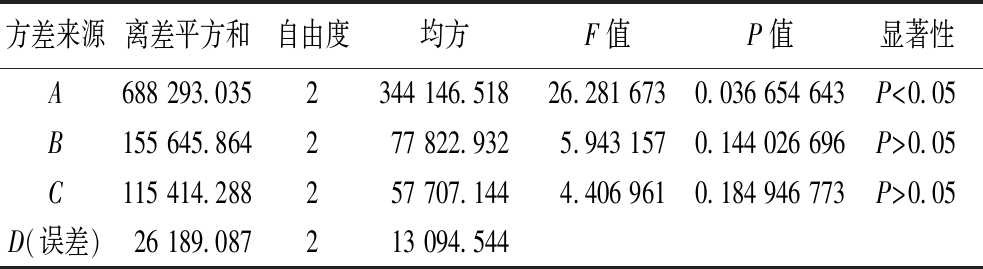
方差来源离差平方和自由度均方F值P值显著性A688 293.035 2344 146.51826.281 6730.036 654 643P<0.05B155 645.864277 822.932 5.943 1570.144 026 696P>0.05C115 414.288257 707.144 4.406 9610.184 946 773P>0.05D(误差)26 189.087213 094.544
通过每隔12 h取样分析得到平板菌落直接接种24孔板发酵过程菌体生长体积分数及阿卡波糖合成的代谢变化曲线如图7所示,从曲线可以看出,36 h以后菌体进入快速生长阶段,48 h以后,伴随着菌体的生长,阿卡波糖的生成迅速增加,168 h时,产量达到最高,延长发酵时间,产量会有所下降,因此选择168 h为最佳发酵时间。
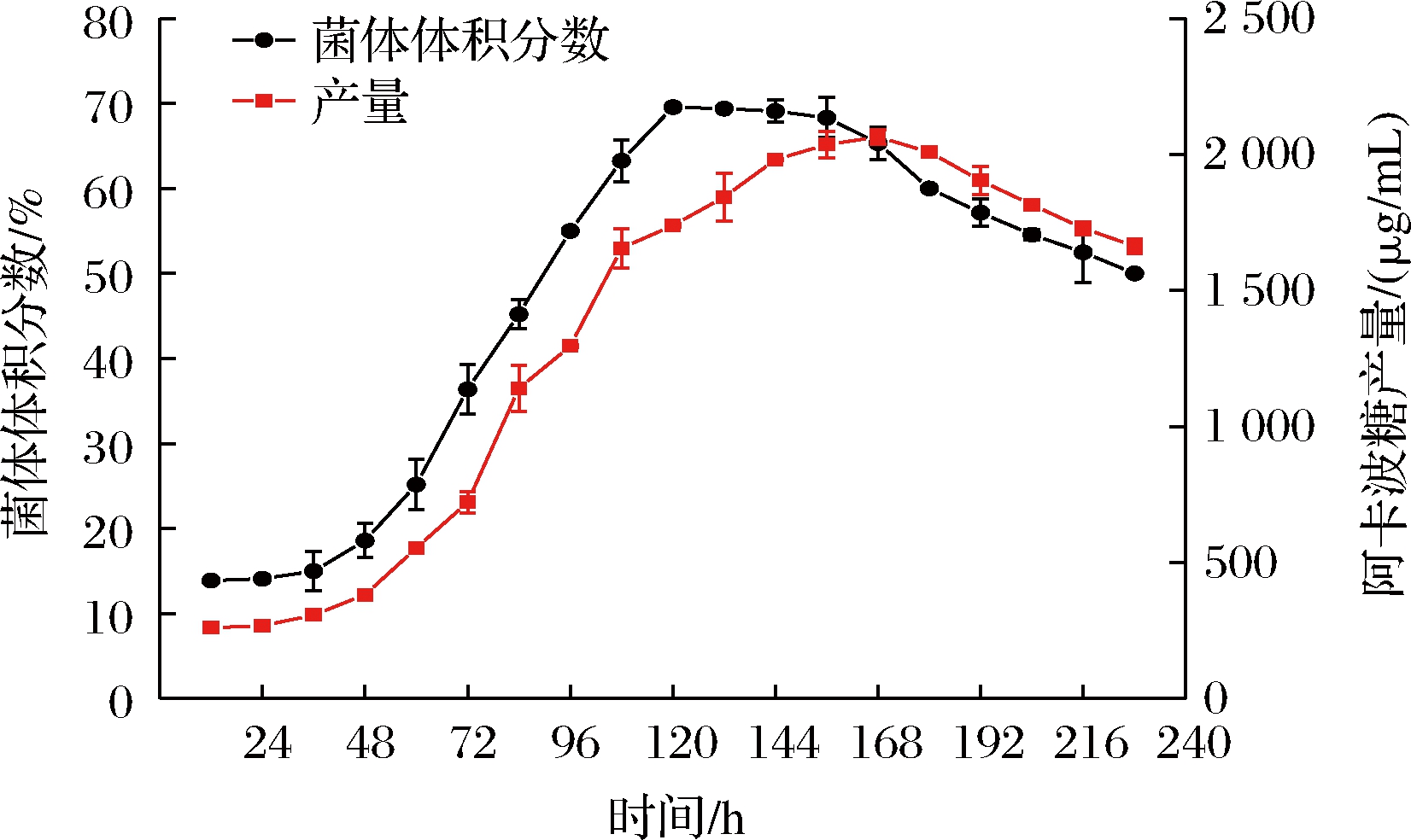
图7 孔板发酵过程菌体生长体积分数及阿卡波糖产量变化
Fig.7 Changes of bacterial growth volume fraction and acarbose yield during orifice plate fermentation
3 结论与讨论
高产突变株的筛选是菌株选育的关键步骤,高效、准确筛选方法的选择尤为重要。近些年来高通量筛选方法研究广泛涉及各个方面,JOHN等[28]研究发现谷氨酸棒杆菌在微孔板、摇瓶及发酵罐培养的生长参数具有良好的一致性;栾书慧等[29]通过ARTP诱变技术结合24深孔板发酵及以线黑粉酵母为指示菌的高通量生物测定筛选技术,筛选得到两株安丝菌素P-3产量稳定提高15%的高产突变株;YU等[23]采用孔板发酵/酶标仪(台盼蓝分光光度法)高通量复筛的策略筛选得到一株新霉素产量提高40%的高产突变株。由于孔板装液量少,在大批量筛选菌株时,不仅可以节约工作量,还可以有效较少大量筛选所耗费的试剂成本。目前文献报道的阿卡波糖高产菌株选育[9,30]基本采用的都是通过摇瓶发酵液相检测,工作量大且时耗较长,本研究将酶标仪检测与孔板发酵相结合,可以很好的解决这个问题。
本文基于酶标仪检测方法,建立了结合孔板发酵的高通量选育模型。通过比较分析选择24孔板发酵代替传统的摇瓶发酵,并对孔板发酵条件进行了优化,确定平板菌落直接24孔板发酵法采用的培养基中黄豆饼粉、甘油、碳酸钙3种成分的添加量需在原始发酵培养基上分别改为3%、1.5%和0.4%,并对此发酵过程进行了考察,发酵在168 h时,阿卡波糖产量达到最高,故以168 h作为最佳发酵时长。
[1] CLISSOLD S P, EDWARDS C.Acarbose.A preliminary review of its pharmacodynamic and pharmacokinetic properties, and therapeutic potential[J].Drugs, 1988, 35(3):214-243.
[2] MAHMUD T.The C7 N aminocyclitol family of natural products[J].Natural Product Reports, 2003, 20(1):137-166.
[3] TSUNODA T, SAMADI A, BURADE S, et al.Complete biosynthetic pathway to the antidiabetic drug acarbose[J].Nature Communications, 2022, 13(1):3455.
[4] 杨晓晖, 邓媛瑗, 董慧, 等.阿卡波糖不良反应国外最新研究进展[J].中国药物警戒, 2009, 6(1):36-40.
YANG X H, DENG Y Y, DONG H, et al.Latest study of adverse drug reaction of acarbose in the foreign countries[J].Chinese Journal of Pharmacovigilance, 2009, 6(1):36-40.
[5] HANEFELD M, SCHAPER F, KOEHLER C.Effect of acarbose on vascular disease in patients with abnormal glucose tolerance[J].Cardiovascular Drugs and Therapy, 2008, 22(3):225-231.
[6] ZHANG X, ZHANG C, ZHOU Q Q, et al.Quantitative evaluation of DNA damage and mutation rate by atmospheric and room-temperature plasma (ARTP) and conventional mutagenesis[J].Applied Microbiology and Biotechnology, 2015, 99(13):5639-5646.
[7] ZHANG X, ZHANG X F, LI H P, et al.Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool[J].Applied Microbiology and Biotechnology, 2014, 98(12):5387-5396.
[8] LI Z X, YANG S B, ZHANG Z Y, et al.Enhancement of acarbose production by genetic engineering and fed-batch fermentation strategy in Actinoplanes sp. SIPI12-34[J].Microbial Cell Factories, 2022, 21(1):240.
[9] REN F, CHEN L, TONG Q Y.Highly improved acarbose production of Actinomyces through the combination of ARTP and penicillin susceptible mutant screening[J].World Journal of Microbiology and Biotechnology, 2017, 33(1):16.
[10] BLACK G W, BROWN N L, PERRY J J B, et al.A high-throughput screening method for determining the substrate scope of nitrilases[J].Chemical Communications, 2015, 51(13):2660-2662.
[11] WILLIES S C, WHITE J L, TURNER N J.Development of a high-throughput screening method for racemase activity and its application to the identification of alanine racemase variants with activity towards L-arginine[J].Tetrahedron, 2012, 68(37):7564-7567.
[12] MEZNA M, WONG A C, AINGER M, et al.Development of a high-throughput screening method for LIM kinase 1 using a luciferase-based assay of ATP consumption[J].SLAS Discovery, 2012, 17(4):460-468.
[13] SPAINK H P, CUI C, WIWEGER M I, et al.Robotic injection of zebrafish embryos for high-throughput screening in disease models[J].Methods, 2013, 62(3):246-254.
[14] BATES F L, FRENCH D, RUNDLE R E.Amylose and amylopectin content of starches determined by their iodine complex formation[J].Journal of the American Chemical Society, 1943, 65(2):142-148.
[15] MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry, 1959, 31(3):426-428.
[16] HAMDAN I I, AFIFI F U.Capillary electrophoresis as a screening tool for alpha amylase inhibitors in plant extracts[J].Saudi Pharmaceutical Journal, 2010, 18(2):91-95.
[17] FENG Z H, WANG Y S, ZHENG Y G.A new microtiter plate-based screening method for microorganisms producing alpha-amylase inhibitors[J].Biotechnology and Bioprocess Engineering, 2011, 16(5):894-900.
[18] 冯志华. 阿卡波糖产生菌的诱变育种及发酵条件优化[D].杭州:浙江工业大学,2011.
FENG Z H. Mutation breeding of acarbose-producing strain and optimization of fermentation conditions[D].Hangzhou: Zhejiang University of Technology, 2011.
[19] 马妮. 阿卡波糖产生菌育种新方法的研究与应用[D].沈阳:沈阳药科大学, 2006.
MA N. Study and application of a new breeding method for acarbose-producing bacteria[D].Shenyang: Shenyang Pharmaceutical University, 2006.
[20] 任飞. 产阿卡波糖放线菌的选育、发酵条件优化及代谢调控研究[D].无锡:江南大学, 2017.
REN F. Breeding, optimization of fermentation conditions and metabolic regulation of acarbose-producing actinomycetes[D].Wuxi: Jiangnan University, 2017.
[21] 余飞, 孙俊峰, 刘鹏飞, 等.弗氏链霉菌产硫酸新霉素高通量选育模型的建立及优化[J].食品与发酵工业, 2019, 45(8):162-167;177.
YU F, SUN J F, LIU P F, et al.A high-throughput screening method for selecting Streptomyces fradiae mutants with improved neomycin yield and its optimization[J].Food and Fermentation Industries, 2019, 45(8):162-167;177.
[22] 周扬, 薛正莲, 夏俊, 等.常压室温等离子体(ARTP)诱变及高通量筛选那西肽高产菌株[J].工业微生物, 2015,45(2):7-12.
ZHOU Y, XUE Z L, XIA J, et al.Mutation by using atmospheric and room temperature plasmas and high-throughput screening method for improving production of nosiheptide of Streptomyces actuosu[J].Industrial Microbiology, 2015,45(2):7-12.
[23] YU F, ZHANG M, SUN J F, et al.Improved neomycin sulfate potency in Streptomyces fradiae using atmospheric and room temperature plasma (ARTP) mutagenesis and fermentation medium optimization[J].Microorganisms, 2022, 10(1):94.
[24] YE L T, YE R F, HU F X, et al.Combination of atmospheric and room temperature plasma (ARTP) mutagenesis, genome shuffling and dimethyl sulfoxide (DMSO) feeding to improve FK506 production in Streptomyces tsukubaensis[J].Biotechnology Letters, 2021, 43(9):1809-1820.
[25] HUANG Y T, WANG L Y, ZHANG X, et al.Quantitative evaluation of DNA damage caused by atmospheric and room-temperature plasma (ARTP) and other mutagenesis methods using a rapid umu-microplate test protocol for microbial mutation breeding[J].Chinese Journal of Chemical Engineering, 2021, 39(11):205-210.
[26] 叶子弘, 陈春.生物统计学[M].北京:化学工业出版社2012.
YE Z H, CHEN C.Biostatistics[M].Beijing:Chemical Industry Press, 2012.
[27] 杨心萍, 宋词, 张伟豪, 等.常压室温等离子体与5-溴尿嘧啶复合诱变及快速选育腺苷高产菌株[J].食品与发酵工业, 2020, 46(9):73-77.
YANG X P, SONG C, ZHANG W H, et al.Combined mutagenesis of ARTP and 5-BU for improving production of adenosine in Bacillus subtilis[J].Food and Fermentation Industries, 2020, 46(9):73-77.
[28] JOHN G T, KLIMANT I, WITTMANN C, et al.Integrated optical sensing of dissolved oxygen in microtiter plates:A novel tool for microbial cultivation[J].Biotechnology and Bioengineering, 2003, 81(7):829-836.
[29] 栾书慧, 成筱钰, 康前进, 等.基于ARTP诱变的安丝菌素P-3高产菌株高通量筛选[J].基因组学与应用生物学, 2021, 40(S3):3079-3087.
LUAN S H, CHENG X Y, KANG Q J, et al.High-throughput screening of ansamitocin P-3 high-yield strains based on ARTP mutagenesis[J].Genomics and Applied Biology, 2021, 40(S3):3079-3087.
[30] 王远山, 牛鑫淼, 郑裕国.游动放线菌原生质体诱变选育阿卡波糖高产菌株[J].食品与发酵工业, 2013, 39(5):37-43.
WANG Y S, NIU X M, ZHENG Y G.Protoplast mutagenesis for improving acarbose production of Actinoplanes[J].Food and Fermentation Industries, 2013, 39(5):37-43.