在中国白酒中,乳酸是代表白酒特征的一种有机酸类,在酒中起到调和酒味的缓冲作用,乳酸乙酯在酒体的呈味和呈香中发挥重要作用,其在中国白酒中较高的含量是区别于国外蒸馏酒的显著特征[1]。酱香型白酒具有二次投料、多轮次循环发酵的工艺特点,上一轮次的发酵产物,尤其乳酸等不易挥发物质的不断积累,必然影响到下一轮次的微生物结构以及产酒品质[2]。适量的乳酸能调节发酵进程,但乳酸含量过高,则会破坏微生物细胞内外质子平衡,破坏细胞膜,从而损伤细胞[3]。因此有必要对发酵过程中影响乳酸积累的因素进行研究。
乳酸菌是酱香型白酒发酵过程中普遍存在的一类微生物[4],它能够产生乳酸、乙酸等代谢物质[5],随着发酵的进行,窖内pH逐步降低,乳酸菌的含量不断增加,到出窖时则会成为绝对优势细菌[6]。而不同香型白酒的优势乳酸菌种类和含量均有所不同[7]:刑敏钰等[8]通过高通量测序发现Weissella paramesenteroides和Lactobacillus sp.分别是芝麻香型白酒酿造中后期优势微生物;罗青春等[9]从浓香型白酒酒醅中分离出2株产乳酸能力很强的Lactobacillus buchneri和Lactobacillus acetotolerans;赵欣怡等[10]从清香型白酒酒醅中筛选得到Lactobacillus coryniformis和Pediococcus acidilactici 2株具有较强产酸、耐酸能力的乳酸菌。“二次投料,多轮次循环发酵”是酱香型白酒不同于其他香型白酒的工艺特点,复杂的工艺特征导致其每个轮次的乳酸菌群结构必然有所差异,杨帆[11]结合酱香型白酒乳酸显著积累的造沙轮次中不同乳酸菌的产酸能力及其在微生物群落中所占比例,判定Lactobacillus panis为造沙轮次窖内发酵过程中优势产乳酸微生物。张艳等[12]从四轮次酒醅中筛选出2株Lactobacillus homohiochii和Lactobacillus buchneri,对维持酿造微生物区系平衡有重要意义。然而目前对酱香型白酒一轮次主要乳酸代谢菌群的研究尚不明确。
针对以上问题,本研究采用高通量扩增子测序技术解析了发酵过程中乳酸代谢菌群的演替规律及大曲、环境中的微生物群落结构;通过微生物溯源手段分析了堆积酒醅中乳酸菌的来源;将酱香型白酒一轮次发酵过程中关键理化因素同乳酸菌丰度和乳酸生成量联系起来,最后通过实验室模拟发酵验证了关键理化因素对乳酸代谢的影响。本研究对分析酱香型白酒一轮次中乳酸的来源、演替及代谢规律具有重要的意义,同时对实现生产过程中乳酸的动态调控提供了具体的指导方向。
1 材料与方法
1.1 试剂与仪器
红缨子高粱,产自贵州;MRS培养基,Oxoid公司;氯化钠、麦芽浸粉、乳酸(分析纯)、乙酸(分析纯)、乙醇(分析纯),国药集团化学试剂有限公司;糖化酶、高温α-淀粉酶,江苏锐阳生物科技有限公司;ChamQ Universal SYBR qPCR Master Mix,南京诺唯赞生物科技有限公司;DNA提取液,Omega Bio-tek公司。
Avanti J-E冷冻离心机,Beckman Coulter公司;Beadbeater细胞破碎仪,Biospec公司;凝胶成像仪、PCR仪、电泳仪,Bio-Rad公司;Milli-Q超纯水系统,Millipore公司;固相萃取头,Supelco公司;Agilent 1200高效液相色谱仪,Agilent公司;MGC厌氧罐、厌氧袋,三菱公司;多管旋涡混匀仪,上海沪析实业有限公司。
1.2 样品采集、核酸提取、测序及生物信息学分析
所用酒醅、大曲样品均来自贵州省某酱香型酒厂;酒醅总DNA的提取参考SONG等[13]的方法;通过QIIME软件分析处理样品中细菌群落的扩增子基因序列,将相似度>97%的序列聚类为1个操作分类单元(operational taxonomic unit, OTU)。利用NCBI BLAST软件将OTU序列同数据库中的序列进行比较,得到物种信息。
1.3 理化指标测定
酒醅的水分、酸度、还原糖、pH、乳酸、乙酸、乙醇均依据T/CBJ 004—2018《固态发酵酒醅通用分析方法》测定。
1.4 酒醅浸提液富集培养
取酒醅10 g置于100 mL生理盐水(0.9%氯化钠)中,振荡1 h,加入100 mL MRS培养基,置于厌氧箱中富集培养7 d。
1.5 不同理化参数对浸提液富集培养的影响
将富集培养液加入固态发酵高粱培养基中(制备方法具体参考WEI等[14]的方法),固态发酵,控制不同理化参数(乳酸、乙酸、乙醇、含水量、麦芽提取物和氧气),培养7、14 d。
试验操作过程:称取蒸好的固态高粱30 g于50 mL离心管中,加入5%大曲及5%富集培养液,搅拌均匀,置于37 ℃培养箱箱静置培养,以该培养组为对照组(含水量为50%,糖化酶添加量为300 μL/L),改变培养条件包括添加乙醇(30、15 g/L)、添加乙酸(30、15 g/L)、添加糖化酶(600 μL/L、900 μg/L)、添加麦芽提取物(200、100 g/L),调整含水量(45%、40%,含水量调整参考张溪桐等[15]的方法)以及控制氧气含量(置于200 r/min摇床和厌氧箱培养),共13组不同的培养组别,发酵7、14 d,分别取样检测相应指标,一式三份。
1.6 固态发酵乳酸产量的分析
将发酵谷物(5 g)添加到20 mL无菌盐水(0.85%氯化钠)中,超声处理30 min(0 ℃),然后以8 000×g离心5 min得到上层清液(4 ℃),发酵液中乳酸浓度的检测参考DENG等[16]和宋哲炜[17]的方法,标准曲线为y=29 968x-15 471,R2=1。
1.7 统计学分析及绘图
使用Microsoft Office Excel 2016(Microsoft,Redmond,WA)、OriginPro 2022b(OriginLab,Northampton,MA)进行统计学分析和数据绘图。主成分分析(principal component analysis, PCA)通过CANOCO5进行。Source Tracker(0.9.8)[18]用于预测堆积酒醅中微生物群落的来源。采用Origin 2022进行图表绘制。
2 结果与分析
2.1 酱香型白酒不同轮次乳酸变化规律
酱香型白酒造沙至第五轮次出窖酒醅的乳酸含量如图1-a所示,可见从造沙至五轮次,乳酸含量逐轮次上升,由造沙轮次出窖3.43 g/kg酒醅上升至五轮次的29.47 g/kg酒醅。各轮次不同发酵阶段的乳酸含量如图1-b所示,可见各轮次堆积阶段的乳酸含量变化不大,进入窖内发酵7 d后,由于窖内厌氧环境以及酸度的上升,乳酸菌大量繁殖,导致乳酸产量显著上升,其中一轮次出窖时的乳酸含量为堆积起始时的1.91倍,而二、三、四轮次出窖酒醅乳酸含量分别为堆积起始的1.30、1.32、1.16倍,一轮次酒为酱香型白酒经过两次投粮两次发酵后取得的第一次酒,其乳酸含量的变化和微生物群落结构构成对后续轮次微生物的演替及代谢的影响至关重要,因此通过解析一轮次微生物群落结构及与生产过程中关键理化参数的内在联系,探究影响乳酸含量变化的因素。

a-造沙到第五轮次出窖酒醅乳酸含量;b-造沙到第五轮次发酵过程酒醅乳酸含量
图1 造沙到第五轮次乳酸积累规律
Fig.1 Lactic acid accumulation from ZaoSha to the 5th round
2.2 一轮次酒醅微生物群落演替规律
本研究采用高通量测序对酱香型白酒一轮次3个平行班组(C1班、C2班、C3班)的酒醅样品进行分析,同细菌数据库进行比对后得到发酵酒醅中原核微生物群落的OTU分类信息。在属水平上,共检测到224个属,具体细菌群落变化如图2-a所示。其中,乳杆菌属(Lactobacillus)、慢生芽孢杆菌属(Lentibacillus)、克罗彭斯特菌(Kroppenstedtia)、大洋芽孢杆菌属(Oceanobacillus)、芽孢杆菌属(Bacillus)以及嗜热细菌属(Thermoactinomyces)在酒醅中的平均丰度>1%。乳杆菌为窖内发酵的优势微生物,其窖内平均相对丰度超过80%。乳酸菌是各类型白酒发酵过程中最主要的功能细菌种群[19],它们产生乳酸的同时,还会产生挥发性的醇、酮、氨基酸、有机酸、长链脂肪酸等其他风味代谢产物。
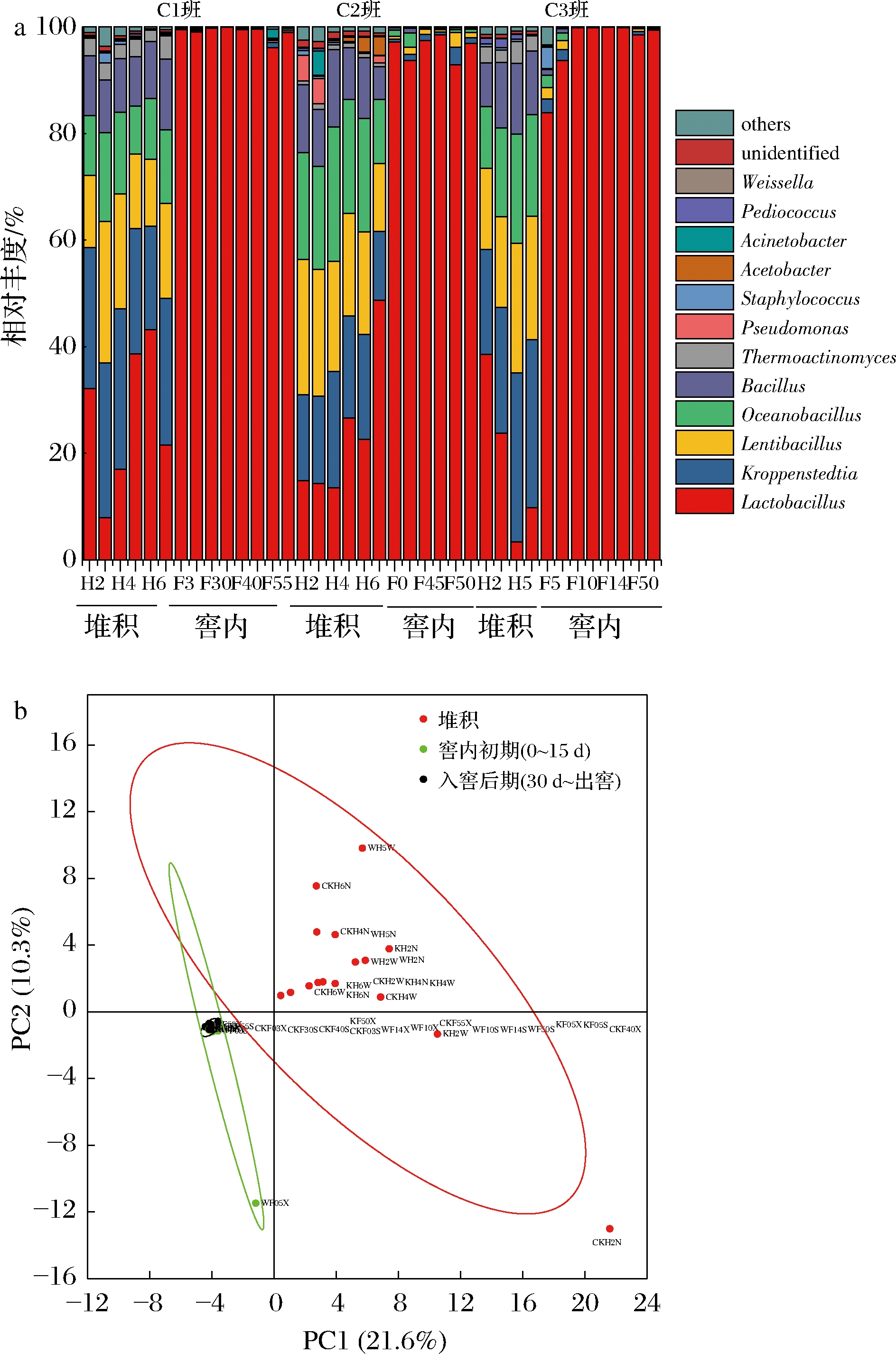
a-一轮次酒醅细菌属水平群落结构;b-基于weighted UniFrac距离的主成分分析
图2 一轮次酒醅细菌属水平群落结构
Fig.2 Genus level of bacterial community compositions of the first round
乳酸代谢相关菌群(包括乳杆菌属、魏斯氏菌属和片球菌属)种水平高通量测序数据表明(图3-a),发酵过程中主要的乳酸菌种为金山乳杆菌(Lactobacillus jinshan)、耐酸乳杆菌(L.acetotolerans)、面包乳杆菌(Lactobacillus panis)、食果糖乳杆菌(Lactobacillus fructosus)、乳酸片球菌(P.acidilactici)等。其中L.jinshan在任意发酵时间点的相对丰度都占据优势地位,窖内发酵后期超过99%,L.jinshan属于乳杆菌属,是一株广泛存在于中国传统酿造体系中的重要酿造微生物[20],张艳[21]对酱香型白酒四、七轮次的乳酸菌群落结构研究发现Lactobacillus sp.1作为优势乳酸菌种存在于整个发酵过程中,经NCBI数据库比对其为L.jinshan。L.jinshan在中国白酒尤其是酱香型白酒各个轮次中均占据优势地位,DU等[22]根据其分布广含量高的特点,将其作为内标,用特异性引物实时荧光定量PCR定量测定了其在各类白酒酒醅中的绝对量,用内标物归一法对各类白酒中关键乳酸菌进行定量分析,发现该菌在发酵过程可分为生长期和稳定期2个阶段,并推测该菌在发酵0~15 d代谢较为旺盛,在发酵15 d之后可能开始积累次级代谢产物[20],然而目前在白酒酒醅中尚未分离得到其纯培养物;2019年首次从镇江香醋醋醅中分离得到一株具有较强乙酸耐受特性与异型乳酸发酵特征的革兰氏阳性兼性厌氧菌株,并命名为Lactobacillus jinshan HSLZ-75T[23],孙佳[24]通过比较其与其他酿醋细菌基因组差异发现,其基因组中有关能量代谢、氨基酸转运相关基因数量较多,且其和耐酸特性相关的基因数占比最多,表明醋醅中L.jinshan高丰度的原因可能和耐酸特性有关。由于白酒酿造过程与酿醋过程原料、工艺等存在较大差异,因此酒醅/醋醅的理化性质(乳酸、乙酸、乙醇、溶氧等)和微生物生态位有所不同,可能导致不同酿造环境下的L.jinshan拥有不同的营养需求或生长特性,从而增加了分离筛选的难度。

a-一轮次酒醅细菌种水平群落结构;b-一轮次酒醅细菌种水平群落结构
图3 一轮次酒醅细菌种水平群落结构
Fig.3 Species level of bacterial community compositions of the first round
PCA结果表明(图2-b、图3-b),堆积阶段和入窖阶段的酒醅细菌组成存在较大差异,主要是由乳酸菌在不同发酵阶段的相对丰度变化引起。
2.3 微生物溯源分析
高通量测序显示在所有样品(大曲、环境、堆积酒醅)中,细菌属水平共检测出223个属,其中过道中检测出182个,工具中153个,堆积地面139个,大曲52个,堆积酒醅83个。有11个属仅在大曲中检测到,有112个属仅从生产环境中能检测到;有25个属仅能从堆积酒醅中检测出,可能来源于发酵原料或是空气中的微生物富集。生产环境、大曲以及堆积酒醅中的细菌微生物属水平群落结构如图4所示,主要归属于15个属,其中在过道中检测到的,相对丰度较高的有考克氏菌属(Kocuria,16.4%),乳杆菌属其次(10.76%);而在生产工具、车间地面、大曲以及堆积酒醅中,慢生芽孢杆菌属、芽孢杆菌属、克罗彭斯特菌以及海洋芽孢杆菌属(Ocean Bacillus)为最主要的细菌属,四者总共占据80%的相对丰度,不同属的细菌在各个样品中所占的比例不同。

图4 环境、大曲属水平细菌群落结构
Fig.4 Genus level of bacterial community compositions of the environment and Daqu

a-堆积酒醅细菌不同来源分析;b-堆积酒醅微生物属水平溯源分析
图5 堆积酒醅微生物溯源分析
Fig.5 Source tracking analysis of fermented grains microorganisms
本研究使用贝叶斯概率工具SourceTracker[18],以大曲和生产环境的微生物为来源端,以堆积发酵酒醅的微生物为接受端,来预测堆积酒醅中的微生物来源,结果表明,生产环境为堆积酒醅提供了大多数细菌(93.8%),其中生产工具57.3%,地面26.5%,过道10%。大曲仅为1.8%。SourceTracker还预测了堆积发酵酒醅各种优势细菌微生物的来源。Lactobacillus最主要的来源为过道和生产工具。以上分析结果表明,堆积酒醅中的乳酸菌主要来源于生产环境,而大曲中乳杆菌的含量较少。
2.4 生产理化指标&微生物相关性分析
为了分析发酵过程中各类理化指标对乳酸积累的影响,基于Spearman等级相关性(|ρ|>0.2,P<0.05记为“*”,P<0.01记为“**”)绘制一轮次7类理化指标之间的相关性热图(图6-a),对乳酸含量积累影响较大的主要有酸度、pH、还原糖、乙醇和水分。其中pH和还原糖对乳酸含量的影响是负面的,而还原糖由于测定的是剩余值而非消耗值因此显示为负值,因此有必要进一步研究乙醇和水分对乳酸生成量的影响。

a-理化指标间正负相互性关系;b-理化指标和微生物的正负相关性关系
图6 生产理化指标&微生物相关性分析
Fig.6 Correlation analysis of production physicochemical index µorganism
注:*表示P<0.05,**表示P<0.01。
为了探究酒醅中优势乳酸菌富集的原因,我们基于Spearman等级相关性(|ρ|>0.2,P<0.05记为“*”,P<0.01记为“**”),将酒醅主要的7种理化指标(乙醇、水分、酸度、乳酸、乙酸、pH、还原糖)同主要的微生物属进行相关性分析(图6-b),根据相关性分析结果,发现同理化指标间相关性一样,乙醇、水分、酸度、乳酸同乳酸杆菌属呈显著的正相关,pH和还原糖含量呈显著负相关。因此我们将综合理化指标,设立不同的参数,探究影响乳酸菌富集及产酸的原因。
2.5 不同培养条件对乳酸产量的影响
如图7-a所示,好氧培养14 d乳酸含量为18.89 g/L,厌氧培养乳酸含量则为49.90 /L,显著高于静置时28.32 g/L的乳酸产量,因此氧气是影响乳酸菌产酸的重要影响因素。通过将固态高粱培养基放入烘箱中控制其含水量在50%、45%、40%培养14 d(图7-b),乳酸产量分别为28.32、20.71、17.39 g/L,可见培养基中水分的多少对乳酸菌属产乳酸的影响较大,这和之前相关性分析结果一致,水分是窖内发酵的重要指标之一,水参与酱香型白酒发酵所有生化反应,是大多数微生物生长不可缺少的重要物质,微生物的生长和代谢与其存在的微环境的物质循环、能量流动和信息传递的“三流运转”离不开水的直接或间接参与[11]。水分与发酵过程中其他指标相互影响,有研究表明水分与氧气含量呈显著负相关关系[25],因此,通过控制含水量导致的乳酸产量减少,可能和其引起的氧气含量变化有关,即氧气的增加抑制了偏好厌氧生长的乳酸菌的生长,从而导致乳酸产量降低。如图7-c所示,通过往固态高粱培养基中添加100、200 g/L麦芽提取物,乳酸含量分别为43.87、51.89 g/L,麦芽提取物是一类含有丰富碳氮源的植物性营养物质,其可以显著提升部分优势乳酸菌的生长富集速度以及产乳酸能力[26];添加600、900 μg/L的糖化酶,乳酸含量分别为19.26、29.26 g/L,可见添加更多的糖化酶,并不会明显提升乳酸的生成(图7-d);添加了30 g/L的乙酸(图7-e),乳酸含量为17.08 g/L,可见高浓度的乙酸会抑制乳酸的产生,但是乳酸菌具有较强的酸耐受能力及抗胁迫能力,因此仍能代谢生成一定量的乳酸。先前的相关性分析发现,乙醇和乳酸菌呈显著的正相关性,然而添加了30 g/L的乙醇(图7-f),乳酸含量仅为15.67 g/L,可见直接添加乙醇不会促进乳酸菌的生长反而抑制了乳酸的产生,白酒发酵过程主要就是以酵母为主的微生物厌氧呼吸不断积累乙醇的过程,部分异型乳酸发酵的乳酸菌同样会代谢生成乙醇[27],因此随着发酵的进行,乙醇、乳酸等代谢产物的不断积累对乳酸菌的选择驯化,导致其在群体中占据优势,呈现出高相关性,有研究表明乙醇对乳酸菌的抑制作用主要是通过破坏细胞膜功能[28],而在模拟发酵实验中直接添加高浓度的乙醇,不可避免的对乳酸菌细胞膜的结构和功能产生了干扰,从而影响乳酸菌的生长代谢。
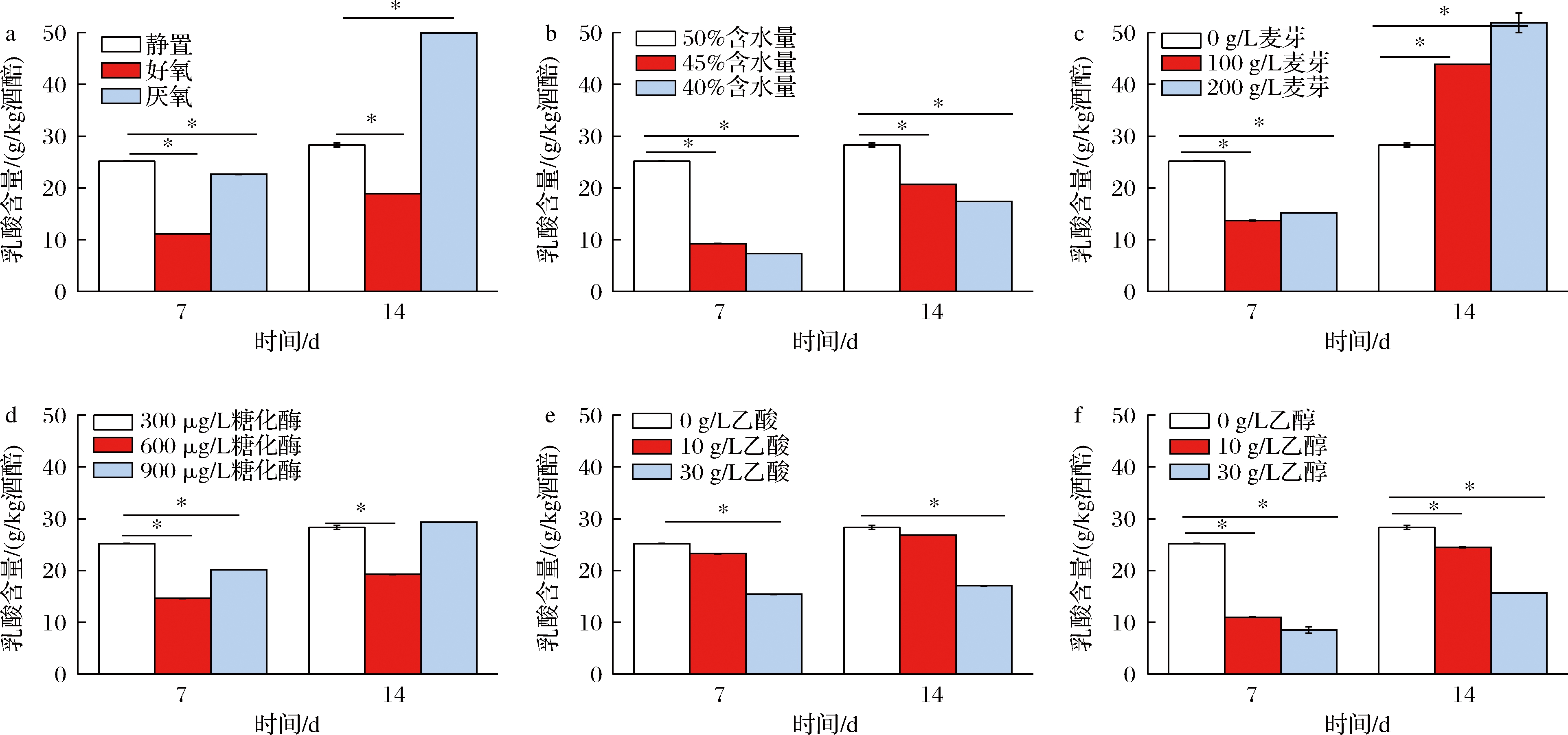
a-氧气;b-含水量;c-麦芽提取物;d-糖化酶;e-乙酸;f-乙醇
图7 不同培养条件富集液的乳酸生成情况
Fig.7 Lactic acid production in enriched solution under different culture conditions
注:*表示P≤0.05。
3 结论
乳酸是酱香型白酒中最重要的一类有机酸,乳酸菌属也是酱香型白酒酒醅中丰度最高的细菌。本研究通过研究乳酸含量增长速率最快的一轮次酒醅微生物群落构成,发现堆积阶段和入窖阶段的酒醅细菌组成存在较大差异,这主要是由乳酸菌在不同发酵阶段的相对丰度变化引起。金山乳杆菌(L.jinshan)、耐酸乳杆菌(L.acetotolerans)、面包乳杆菌(L.panis)、食果糖乳杆菌(L.fructosus)、乳酸片球菌(P.acidilactici)等为一轮次酒醅中相对丰度最高的乳酸菌属;对一轮次酒醅微生物的溯源分析发现,生产环境为堆积酒醅提供了大多数细菌(93.8%),乳酸菌主要来源于生产环境(包括车间过道及生产工具),而大曲中乳酸菌的含量较少。影响乳酸菌生长&乳酸积累的理化因素相关性分析和模拟固态发酵实验表明,厌氧环境、高含水量以及丰富的底物会显著促进乳酸菌的生长及产酸,高浓度乙醇和乙酸的添加会抑制乳酸的产生,然而乳酸菌对乙醇和乙酸仍具有较高的耐受性。后续的研究我们将会分离筛选出酱香型白酒中优势的乳酸菌种,通过比较基因组学结合可培养实验,对其生长性状包括营养底物利用、产酸、风味代谢的种间差异性进行具体分析研究,结合生产实际探究优势乳酸菌种在酱香型白酒发酵体系中快速富集的原因以及研究其与白酒发酵过程中其他关键微生物的相互作用,进一步解析酱香型白酒中乳酸积累的相关机制,实现对乳酸代谢的动态调控。
[1] 李维青. 浓香型白酒与乳酸菌、乳酸、乳酸乙酯[J].酿酒, 2010,37(3):90-93.
LI W Q.Relationship between Luzhou flavor liquor, lactic acid bacteria, lactic acid and ethyl lactate[J].Liquor Making, 2010,37(3):90-93.
[2] 于勇. 酱香型酒中的乳酸及乳酸乙酯[J].酿酒, 2004, 31(4):21-22.
YU Y.Lactic acid and ethyl lactate in Maotai-flavored liquor[J].Liquor Making, 2004, 31(4):21-22.
[3] 郝小明, 陈博, 安泰.工业微生物酸胁迫的耐受机制及改造途径[J].生物工程学报, 2015, 31(8):1151-1161.
HAO X M, CHEN B, AN T.Pathway modification of industrial microorganisms to improve acid-stress tolerance[J].Chinese Journal of Biotechnology, 2015, 31(8):1151-1161.
[4] LIU S N, HAN Y, ZHOU Z J.Lactic acid bacteria in traditional fermented Chinese foods[J].Food Research International, 2011, 44(3):643-651.
[5] WU Z F, ZHUANG B W, WENG P F, et al.Fermentation quality characteristics and flavor formation changes during the process of pickled wax gourd in Eastern Zhejiang[J].International Journal of Food Properties, 2016, 19(2):409-419.
[6] 邵明凯, 王海燕, 徐岩, 等.酱香型白酒发酵中酵母群落结构及其对风味组分的影响[J].微生物学通报, 2014, 41(12):2466-2473.
SHAO M K, WANG H Y, XU Y, et al.Yeast community structure and its impact on flavor components during the fermentation process of Chinese Maotai-flavor liquor[J].Microbiology China, 2014, 41(12):2466-2473.
[7] 吴莉莉, 王海燕, 徐岩, 等.酱香型与清香型白酒发酵过程中乳酸菌菌群的差异性分析[J].微生物学通报, 2013, 40(12):2182-2188.
WU L L, WANG H Y, XU Y, et al.Differences of lactic acid bacteria community between soy sauce aroma style and light aroma style liquor fermentation[J].Microbiology China, 2013, 40(12):2182-2188.
[8] 邢敏钰, 杜海, 徐岩.芝麻香型白酒发酵过程中乳酸菌多样性及其演替规律[J].微生物学通报, 2018, 45(1):19-28.
XING M Y, DU H, XU Y.Diversity and succession of lactic acid bacteria during sesame-flavor liquor fermentation[J].Microbiology China, 2018, 45(1):19-28.
[9] 罗青春, 郑佳, 赵东, 等.浓香型白酒中优势乳酸菌和酵母菌间的相互关系[J].应用与环境生物学报, 2019, 25(5):1192-1199.
LUO Q C, ZHENG J, ZHAO D, et al.Interaction between dominant lactic acid bacteria and yeasts strains in strong aroma Baijiu[J].Chinese Journal of Applied and Environmental Biology, 2019, 25(5):1192-1199.
[10] 赵欣怡, 甄攀, 赵鑫锐, 等.清香型白酒立醅期酒醅中主体酸和细菌菌群结构动态解析[J].食品与发酵工业, 2022, 48(9):26-33.
ZHAO X Y, ZHEN P, ZHAO X R, et al.Dynamic analysis of main acids and bacterial flora structure in the Fen-flavor fermented grains during LiPeiQi[J].Food and Fermentation Industries,2022, 48(9):26-33.
[11] 杨帆. 酱香型白酒中乳酸代谢机理及调控策略的研究[D].无锡:江南大学, 2020.
YANG F.Lactic acid metabolic mechanism investigation and control strategy development during chinese Jiang-flavor liquor making[D].Wuxi:Jiangnan University, 2020.
[12] 张艳, 杜海, 吴群, 等.酱香型白酒发酵中两株主要乳酸菌对酿造微生物群体的影响[J].微生物学通报, 2015, 42(11):2087-2097.
ZHANG Y, DU H, WU Q, et al.Impacts of two main lactic acid bacteria on microbial communities during Chinese Maotai-flavor liquor fermentation[J].Microbiology China, 2015, 42(11):2087-2097.
[13] SONG Z W, DU H, ZHANG M H, et al.Schizosaccharomyces pombe can reduce acetic acid produced by Baijiu spontaneous fermentation microbiota[J].Microorganisms, 2019, 7(12):606.
[14] WEI J L, DU H, ZHANG H X, et al.Mannitol and erythritol reduce the ethanol yield during Chinese Baijiu production[J].International Journal of Food Microbiology, 2021, 337:108933.
[15] 张溪桐, 徐岩, 杜海.低含水量条件下大曲中抑制土味素的功能微生物解析[J].食品与发酵工业, 2022, 48(13):55-62.
ZHANG X T, XU Y, DU H.Analysis of the geosmin-in hibiting microorganisms in Daqu under low water content[J].Food and Fermentation Industries, 2022, 48(13):55-62.
[16] DENG N, DU H, XU Y.Cooperative response of Pichia kudriavzevii and Saccharomyces cerevisiae to lactic acid stress in Baijiu fermentation[J].Journal of Agricultural and Food Chemistry, 2020, 68(17):4903-4911.
[17] 宋哲玮. 酱香型白酒核心酿造菌群及群体代谢机制的研究[D].无锡:江南大学, 2020.
SONG Z W.Revealing the core brewing microbes and theirmetabolic mechanisms in Chinese Maotai-flavor Baijiu[D].Wuxi:Jiangnan University, 2020.
[18] KNIGHTS D, KUCZYNSKI J, CHARLSON E S, et al.Bayesian community-wide culture-independent microbial source tracking[J].Nature Methods, 2011, 8(9):761-763.
[19] DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].International Journal of Food Microbiology, 2019, 297:32-40
[20] 杜如冰, 吴群, 徐岩.基于三步荧光定量PCR技术揭示不同产区白酒酿造系统中Lactobacillus sp.的分布特征[J].微生物学通报, 2020, 47(1):1-12.
DU R B, WU Q, XU Y.Distribution of Lactobacillus sp.in Chinese liquor fermentation system from different producing location by three-step fluorescent quantitative PCR[J].Microbiology China, 2020, 47(1):1-12.
[21] 张艳. 酱香型白酒发酵中乳酸菌群结构及功能研究[D].无锡:江南大学, 2015.
ZHANG Y.Community structure and function of lactic acidbacteria during Maotai-flavor liquor fermentation[D].Wuxi:Jiangnan University, 2020.
[22] DU R B, WU Q, XU Y.Chinese liquor fermentation:Identification of key flavor-producing Lactobacillus spp.by quantitative profiling with indigenous internal standards[J].Applied and Environmental Microbiology, 2020, 86(12):e00456-20.
[23] YU Y, LI X, ZHANG J, et al.Lactobacillus jinshani sp.nov., isolated from solid-state vinegar culture of Zhenjiang aromatic vinegar[J].Antonie van Leeuwenhoek, 2020, 113:43-54.
[24] 孙佳. 金山醋酸乳杆菌比较基因组分析与酿醋功能评价[D].无锡:江南大学, 2021.
SUN J.Comparative genome analysis of Acetilactobacillus jinshanensis and its function in vinegar fermentation[D].Wuxi:Jiangnan University, 2020.
[25] 张静, 刘娟, 陈浩, 等.干湿交替条件下稻田土壤氧气和水分变化规律研究[J].中国生态农业学报, 2014, 22(4):408-413.
ZHANG J, LIU J, CHEN H, et al.Change in soil oxygen and water contents under alternate wetting and drying in paddy fields[J].Chinese Journal of Eco-Agriculture, 2014, 22(4):408-413.
[26] HUANG T, LU Z M, PENG M Y, et al.Constructing a defined starter for multispecies vinegar fermentation via evaluation of the vitality and dominance of functional microbes in an autochthonous starter[J].Applied and Environmental Microbiology, 2022, 88(3):e02175-21.
[27] 罗寒, 曾祥炼, 陈良强, 等.微生物干预降低酱香型白酒酿造中的乳酸[J].食品与发酵工业,2023,49(15):63-68.
LUO H, ZENG X L, CHEN L Q, et al.Microbial intervention to reduce lactic acid in Maotai-flavor liquor brewing[J].Food and Fermentation Industries,2023,49(15):63-68.
[28] YANG K, LIU M M, WANG J, et al.Surface characteristics and proteomic analysis insights on the response of Oenococcus oeni SD-2a to freeze-drying stress[J].Food Chemistry, 2018, 264:377-385.